Clínica Universitária de Cirurgia II
Caso Clínico: Pancreatite Autoimune
Teresa Carolina V. Gouveia
maio/2017
Clínica Universitária de Cirurgia II
Caso Clínico: Pancreatite Autoimune
Teresa Carolina V. Gouveia
Orientado por:
Doutor João Coutinho
maio/2017
maio
’17
3
Resumo:
A pancreatite autoimune (AIP) é uma patologia rara, recentemente descrita na literatura, de etiologia autoimune, cujo diagnóstico diferencial com a neoplasia do pâncreas é complexo.
No enquadramento deste tema, considera-se relevante a abordagem do seguinte caso clínico: Homem de 71 anos de idade, com antecedentes de hipertensão arterial, diabetes mellitus tipo 2 e status-pós resseção transuretral vesical por pólipo vesical benigno, desenvolve um quadro de icterícia, colúria e acolia com uma semana de evolução. Concomitantemente regista-se um emagrecimento de 8 Kg em 6 meses. Pela avaliação analítica compatível com um quadro de colestase hepática e achados imagiológicos sugestivos de colangiocarcinoma multicêntrico, o doente foi submetido a uma duodeno-pancreatectomia cefálica e hepatectomia esquerda alargada ao segmento I. Através do exame anatomopatológico foi possível diagnosticar uma AIP e colangite esclerosante associada às Imunoglobulinas G4 (IgG4) que mimetizava um colangiocarcinoma.
Neste caso clínico é discutida a apresentação clínica e dificuldade no diagnóstico da AIP. No âmbito deste tema segue-se uma breve revisão sobre o mesmo.
Palavras-chave: Pancreatite autoimune; Imunoglobulinas G4; Colangite esclerosante associada às IgG4; Colangiocarcinoma;
“O Trabalho final exprime a opinião do autor e não da Faculdade de Medicina da Universidade de Lisboa”
maio
’17
4
Abstract:
Autoimmune pancreatitis (AIP) is a rare disease, with an autoimmune etiology, recently described in the literature, whose differential diagnosis with pancreatic neoplasia is difficult.
In this context, the approach of the following clinical case is considered relevant. A 71-year-old man, with a history of arterial hypertension, type 2 diabetes mellitus and post-transurethral bladder resection due to a benign bladder polyp, develops jaundice,
choluria andacholia with a week of evolution. At the same time, there is a weight loss of 8 kg in 6 months. Given that the analytical evaluation is compatible with a case of hepatic cholestasis and that the imaging findings are suggestive of multicentric cholangiocarcinoma, the patient underwent cephalic duodenum-pancreatectomy and left hepatectomy extended to segment I. Through the anatomopathological examination, it was possible to diagnosis the existence of an AIP and sclerosing cholangitis associated with Immunoglobulins G4 (IgG4), which mimicked a cholangiocarcinoma.
In this case report we discuss the clinical presentation and the difficulty in the diagnosis of AIP. We include a brief presentation review in the scope of this theme after discussing the clinical case.
Key words: Autoimmune pancreatitis; Immunoglobulins G4; Sclerosing cholangitis associated with IgG4; Cholangiocarcinoma;
“The final work expresses the opinion of the author and not of the Faculdade de Medicina da Universidade de Lisboa”
maio
’17
5
Lista de abreviaturas*
ACF- formações quísticas AIP- pancreatite autoimune ALT- alanina aminotransferase AST- aspartato animotransferase CP – pancreatite crónica
CT- tomografia computorizada
ERCP- colangiopancreatografia retrógrada endoscópica
ERP- pancreatografia endoscópica retrógrada
EUS- ultrassonografia endoscópica
EUS- FNA- punção aspirativa com agulha fina guiada por EUS
F18-FDG-PET – tomografia por emissão de positrões com 18F-fluordesoxiglicose GGT- gama glutamiltransferase
HLA- antigénios leucocitários humanos
h.p.f.- campo de alta potência IBD- doença inflamatória intestinal
ICDC- The International Consensus Diagnostic Criteria
IDUS – ultrassonografia intraductal
IgG- Imunoglobulinas G IgG4- Imunoglobulinas G4
IgG4-RD – doenças relacionadas com as Imunoglobulinas G4 IgG4-SC – colangite esclerosante associada a IgG4
MR – ressonância magnética
MRCP- colangiopancreatografia por ressonância magnética
NBI – imagem de banda estreita
POC- colangioscopia per oral
PSC- colangite esclerosante primária
PVI- envolvimento vascular peripancreático RPF- fibrose retroperitoneal
SUC- serviço de urgência central
maio
’17
6 VBIH- vias biliares intra-hepáticas
VBP- via biliar principal
maio
’17
7
Índice
Introdução ... 8 Caso Clínico ... 9 Conceito ... 17 Epidemiologia ... 18 Patogénese ... 19 Manifestações clínicas ... 20 Achados Laboratoriais ... 21 Achados Radiológicos ... 22Achados histopatológicos e imunohistoquímicos ... 26
Critérios de Diagnóstico ... 28
Diagnóstico Diferencial ... 30
Tratamento e Prognóstico ... 34
Subtipos clínicos ... 36
AIP associada a formações quísticas ... 36
Doença esclerosante associada às IgG4 ... 39
Colangite esclerosante ... 41 Conclusão ... 47 Agradecimentos ... 48 Bibliografia ... 49 Anexos ... 51
maio
’17
8
Introdução
A pancreatite crónica (CP) é uma doença inflamatória caracterizada pela alteração morfológica irreversível do pâncreas, acompanhada de dor e perda permanente da função endócrina/exócrina (18). Apesar de anos de estudo, a patogénese da CP continua por esclarecer.
A AIP foi descrita pela primeira vez em 1961 por Sarles et al. como uma esclerose inflamatória crónica do pâncreas (10). Em 1992, Toki et al. reportou 4 casos de uma pancreatite crónica rara, caracterizada por uma estenose difusa e irregular do ducto pancreático principal (2). Yoshida et al. apresentou em 1995 o envolvimento do mecanismo autoimune na patogénese da pancreatite crónica e propôs o conceito de AIP (3,8).
Durante os últimos 10 anos, muitos aspectos da AIP foram clarificados, tornando-se uma patologia reconhecida mundialmente (9).
Após análise dos resultados histológicos e imunohistoquímicos das lesões extrapancreáticas de doentes com AIP, foi sugerida a existência de uma nova patologia clínica, a “doença esclerosante sistémica associada às IgG4 ”, sugerindo que a AIP não é apenas uma doença isolada, mas antes uma lesão pancreática que reflete uma doença sistémica (1, 4).
Este trabalho relata o caso clínico de uma AIP que mimetiza um colangiocarcinoma e uma breve revisão focada nas características clínicas, serológicas, imagiológicas e histopatológicas da AIP, fazendo referência à doença esclerosante sistémica associada às IgG4.
maio
’17
9
Caso Clínico
M.O.G., sexo masculino, 71 anos, leucodérmico, mecânico, independente nas atividades de vida diária, dirige-se ao serviço de urgência central (SUC) do Hospital Santa Maria no dia 29 de Agosto de 2015 por um quadro de icterícia, colúria e acolia com uma semana de evolução. Concomitantemente refere um emagrecimento de 8 Kg em 6 meses que o doente associou à diabetes mellitus. Negava febre, náuseas, vómitos ou dor abdominal.
Como antecedente pessoais destaca-se: hipertensão arterial, diabetes mellitus tipo 2 e status-pós resseção vesical transuretral por pólipo vesical benigno. O doente referia hábitos alcoólicos esporádicos e negava hábitos toxicofílicos ou tabágicos. Encontrava-se medicado com vildagliptina e cloridrato de metformina, enalapril, hidroclorotiazida e esomeprazol. Sem alergias medicamentosas conhecidas.
À observação no SUC, o doente encontrava-se vígil e orientado no tempo e espaço. Pele e mucosas coradas, hidratadas e ictéricas. Escleróticas ictéricas. Hemodinamicamente estável (normocárdico e normotenso). Eupneico em repouso, acianótico, sem sinais de dificuldade respiratória. Auscultação cardíaca e pulmonar sem alterações. Abdómen livre. Membros inferiores sem edema nem sinais de trombose venosa profunda.
Laboratorialmente apresentava uma anemia normocítica normocrómica, com hiperbilirrubinémia (9,9 mg/dL), elevação da gama glutamiltansferase (GGT) (1330 U/L), aspartato aminotransferase (AST) (122 U/L) e alanina aminotransferase (ALT) (116 U/L). Analiticamente o doente não apresentava outras alterações significativas.
Tabela 1. Resultados laboratoriais no SUC a 29 de Agosto de 2015
29/08/2015
Hemoglobina 11,8 (Normocrómica Normocítica)
Proteína C Reativa 0,9 ( mg/dL)
Bilirrubina Total 9,9 mg/dL
AST 122 U/L
ALT 116 U/L
GGT 1330 U/L
Amilase Pancreática 3 U/L
O electrocardiograma da admissão apresentava ritmo sinusal, sem alterações a destacar. A radiografia do tórax postero-anterior não apresentava alterações.
maio
’17
10
Imagem 1. Radiografia torácica realizada a 29 de Agosto 2015
Pediu-se uma ultrassonografia (US) abdominal que revelou uma dilatação das vias biliares intra-hepáticas (VBIH) e do segmento proximal da via biliar principal (VBP), visualizando-se uma área de espessamento parietal no segmento distal da VBP. Demonstrou ainda atrofia do parênquima pancreático com ligeira ectasia do Wirsung.
Imagem 2. US abdominal realizada a 29 de Agosto 2015
O doente foi internado no serviço de gastrenterologia a 29 de Agosto de 2015, sendo transferido para o serviço de cirurgia geral a 31 de Agosto de 2015. Para esclarecimento do quadro clínico e analítico sugestivo de colestase e lesão hepática, foi realizada tomografia computorizada (CT) tóraco-abdomino-pélvica da qual se destacavam numerosas formações ganglionares nas cadeias mediastino-hilares; micro nódulo calcificado no segmento apical do lobo inferior direito (cerca de 3 mm); VBP
maio
’17
11 com franco espessamento distal e obliteração do lúmen associando a moderada dilatação das VBIH e da VBP a montante da lesão (calibre de 19mm) salientando-se o aparecimento de “novo” das alterações descritas comparativamente ao exame de referência; vesícula biliar praticamente colapsada com conteúdo denso no seu interior; pâncreas com parênquima atrófico difuso e milimétricos focos cálcicos na região da cauda; ligeira ectasia do canal de Wirsung (calibre de 4-5mm); glândula suprarrenal esquerda observaram duas imagens sólidas de dimensões relativamente sobreponíveis e traduzindo prováveis adenomas.
Imagem 3. CT tóraco-abdomino-pélvica realizada a 04 de Setembro 2015
Realizou ainda colangiopancreatografia por ressonância magnética (MRCP) que
revelou um lobo esquerdo hepático atrófico com alteração de sinal comparativamente ao lado direito; dilatação bilateral das VBIH com ausência de sinal nos ramos intra-hepáticos do lado esquerdo, com dilatação distal mais marcada; VBP com dilatação no terço proximal; ausência de sinal no terço médio, com espessamento circunferencial da parede; canal pancreático irregular (processo inflamatório crónico); vias biliares com lesão primitiva.
maio
’17
12 Imagem 4. MRCP realizada a 10 de Setembro 2015
Com a hipótese de diagnóstico de Colangiocarcinoma Multicêntrico, o doente foi proposto para cirurgia.
A 16 de Setembro 2015 realizou-se uma duodeno-pancreatectomia cefálica e hepatectomia esquerda alargada ao segmento I, com exame extemporâneo (Wirsung e margem pâncreas, VBP) negativo. O doente foi transferido no 3º dia pós-operatório do SMI para o serviço de cirurgia. Encontrava-se clinicamente e analiticamente estável, com tolerância da dieta oral e transito intestinal mantido. Como intercorrências durante o internamento registou-se um derrame pleural, para o qual realizou toracocentese evacuadora, e uma fístula pancreática com coleção drenada por via per cutânea.
O relatório anatomopatológico da peça revelou uma colangite esclerosante associada às IgG4.
O doente teve alta a 2 de Outubro 2015 ficando referenciado para a consulta externa de cirurgia geral.
A 19 de Outubro 2015 o caso foi discutido na reunião multidisciplinar (Cirurgia, Medicina Interna e Patologia Autoimune) onde ficou decidido a realização de estudos complementares laboratoriais e imagiológicos.
Analiticamente os resultados mantiveram-se compatíveis com quadro de colestase hepática. Foi realizada a pesquisa de auto-anticorpos que resultou negativa.
maio
’17
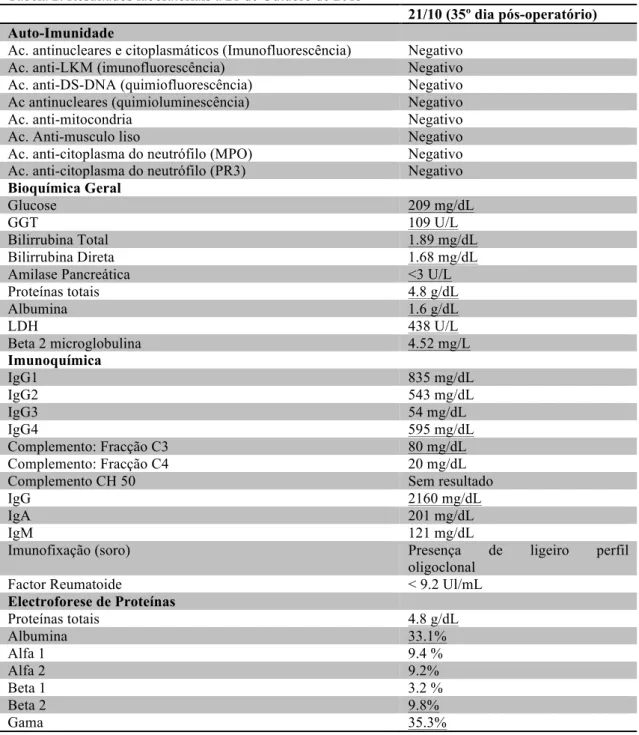
13 Da electroforese de proteínas destacava-se uma hipergamaglobulinémia (35.3 g/dL), com perfil oligoclonal; imunoquímica revelou elevação marcada das IgG e IgG4 (2160 g/dL); verificou-se ainda consumo da fracção C3 do complemento (80 mg/dL) e beta 2 microglobulina aumentada (4.52 mg/dL).
Tabela 2. Resultados laboratoriais a 21 de Outubro de 2015
21/10 (35º dia pós-operatório) Auto-Imunidade
Ac. antinucleares e citoplasmáticos (Imunofluorescência) Negativo Ac. anti-LKM (imunofluorescência) Negativo Ac. anti-DS-DNA (quimiofluorescência) Negativo Ac antinucleares (quimioluminescência) Negativo
Ac. anti-mitocondria Negativo
Ac. Anti-musculo liso Negativo
Ac. anti-citoplasma do neutrófilo (MPO) Negativo Ac. anti-citoplasma do neutrófilo (PR3) Negativo
Bioquímica Geral
Glucose 209 mg/dL
GGT 109 U/L
Bilirrubina Total 1.89 mg/dL
Bilirrubina Direta 1.68 mg/dL
Amilase Pancreática <3 U/L
Proteínas totais 4.8 g/dL Albumina 1.6 g/dL LDH 438 U/L Beta 2 microglobulina 4.52 mg/L Imunoquímica IgG1 835 mg/dL IgG2 543 mg/dL IgG3 54 mg/dL IgG4 595 mg/dL Complemento: Fracção C3 80 mg/dL Complemento: Fracção C4 20 mg/dL
Complemento CH 50 Sem resultado
IgG 2160 mg/dL
IgA 201 mg/dL
IgM 121 mg/dL
Imunofixação (soro) Presença de ligeiro perfil
oligoclonal
Factor Reumatoide < 9.2 Ul/mL
Electroforese de Proteínas Proteínas totais 4.8 g/dL Albumina 33.1% Alfa 1 9.4 % Alfa 2 9.2% Beta 1 3.2 % Beta 2 9.8% Gama 35.3%
maio
’17
14 Imagem 5. Resultado da electroforese de proteínas realizada a 21 de Outubro 2015
A 25/10/2015 o doente realizou CT pescoço, tórax e abdómen para exclusão de coleções intra-abdominais e do envolvimento de outros sistemas orgânicos pela doença autoimune associada às IgG4 antes do início da corticoterapia.
A CT revelou múltiplas pequenas adenopatias nas cadeias mediastínicas, pré-vasculares e no mediastino médio (paratraqueais inferiores direitas e esquerdas e janela aortopulmonar); pequena adenopatia na cadeia mamária interna esquerda; espessamento irregular difuso da pleura à esquerda, especialmente na metade superior, com densificação nodular na pleura mediastínica anterior e superior heterogénea com área hipodensa no seu interior; moderado derrame pleural à esquerda, predominantemente inferior e subpulmonar com áreas de loculação; pequeno derrame pleural à direita, aparentemente livre com envolvimento ligeiro da asa superior da grande cisura do mesmo lado. Entre o fígado e a anastomose pancreatoentérica uma coleção septada de contornos anfractuosos, com gás no seu interior que inferiormente comunicava com um trajeto que aparentava fistulizar à pele na região do hipocôndrio direito; irregularidade do contorno hepático esquerdo, bem como heterogeneidade do parênquima com pequenas áreas hipodensas no segmento VIa.
maio
’17
15 Imagem 6. CT pescoço e tórax realizada a 25 de Outubro 2015
Após discussão da CT com a radiologia, concluiu-se que a imagem nodular pulmonar era de etiologia inflamatória/infecciosa, sem indicação para biopsia. As coleções intrabdominais foram drenadas com exsudado bacteriológico negativo.
Assim, na consulta de doenças autoimunes a 24/11/2015 e ainda com supuração da ferida operatória, o início da corticoterapia ficou adiado até resolução do quadro.
Apesar da evolução positiva, a 01/11/2015 o doente apresentou-se na consulta com edema bilateral dos membros inferiores com sinais inflamatórios na perna esquerda, pelo que foi enviado à urgência de dermatologia.
Com isolamento de Staphylococcus aureus sensível à meticilina no exsudado do membro inferior a 01/03/2016, prescreveu-se flucloxacilina com boa resposta clínica e laboratorial, iniciando a 11/03/2016 prednisolona (lepicortinolo) 40 mg/dia.
Verificou-se uma ligeira melhoria das provas hepáticas após 7 semanas de corticoterapia, sendo a terapia com prednisolona (lepicortinolo) reduzida para 20 mg/dia.
Tabela 3. Resultados laboratoriais 26 de Abril 2016
26/04 Fibrinogénio 157 mg/dL AST 43 U/L ALT 76 U/L GGT 467 U/L FA 625 U/L Bilirrubina Total 1.37 mg/dL
Amilase Pancreática <3 U/L
Proteínas totais 4.7 g/dL
Albumina 2.6 g/dL
maio
’17
16 Foi requisitada uma MRCP às 8 semanas após inicio de corticoterapia que o doente não realizou, tendo este decido ser acompanhado na consulta de Medicina Interna do Hospital Fernando-Fonseca.
maio
’17
17
Conceito
A AIP é um tipo de pancreatite associada a mecanismos autoimunes. É uma patologia rica em achados clínicos, radiológicos, serológicos e histopatológicos, caracterizada por:
1- Idoso sexo masculino;
2- Sintomas iniciais de icterícia obstrutiva sem dor;
3- Ocasional disfunção endócrina ou exócrina pancreática 4- Eventual associação com lesões extrapancreáticas; 5- Resposta à terapia com esteroides;
6- Estenose irregular do ducto pancreático principal e aumento do pâncreas; 7- Elevação dos níveis séricos das IgG ou IgG4, por vezes com auto-anticorpos
presentes;
8- Densa infiltração linfoplasmocítica com fibrose e flebite obliterante no pâncreas;
A típica AIP caracteriza-se por alterações difusas do pâncreas, enquanto que nos casos severos de AIP as alterações são segmentares.
maio
’17
18
Epidemiologia
Uma vez que a AIP é uma patologia que tem vindo a ser descrita na última década (1) a sua epidemiologia ainda não é clara. Os casos de AIP reportados têm vindo a aumentar com a consciencialização desta realidade.
AIP é uma doença rara com uma taxa de prevalência global de 2.2/100 000 habitantes e uma taxa de incidência anual de 0.9/100 00 habitantes no Japão (25).
A AIP tipo 1 é o subtipo mais prevalente, representando mais de 80% dos casos nos Estados Unidos da América. Já na Europa, apesar da AIP tipo 1 ser a mais prevalente, a AIP tipo 2 é mais comum. Um estudo internacional verificou que doentes com AIP tipo 1 são aproximadamente 16 anos mais velhos que os doentes do tipo 2. Um estudo nacional Japonês apresentou uma idade média de 63 anos para os doentes com AIP (25).
Enquanto que a AIP tipo 1 é mais frequente no sexo masculino, a frequência da AIP tipo 2 é igual em ambos os sexos. Estes dados estão de acordo com os achados de estudos Japoneses que reportam um rácio Homem/Mulher de 3.7:1 para a AIP tipo 1 (25).
maio
’17
19
Patogénese
As IgG4 séricas encontram-se frequentemente elevadas na AIP (5). Nos doentes com AIP verificam-se densas infiltrações de plasmócitos IgG4 positivos no pâncreas e noutros órgãos afectados. Assim, acredita-se que as IgG4 desempenham um papel fundamental na patogénese da AIP (1, 23).
O número de células T CD4+ e CD8+ estão aumentadas no sangue periférico e no pâncreas de doentes com AIP. Foi ainda reportada uma associação com haplotipo antigénios leucocitários humanos (HLA) DRB1 (1).
São vários os factos que sugerem o envolvimento de um mecanismo autoimune na AIP, nomeadamente: a coexistência da pancreatite e doenças autoimunes extrapancreáticas; presença de auto-anticorpos não específicos de órgão com títulos elevados; anticorpos para a anidrase carbónica tipo I e tipo II no soro; expressão de moléculas HLA-DR pelas células dos ductos pancreáticos; infiltrado inflamatório rico em linfócitos, plasmócitos, granulócitos e agregados epiteliais dispersos no pâncreas e a resposta à corticoterapia (18).
maio
’17
20
Manifestações clínicas
Na AIP as manifestações típicas das pancreatites são raras. A principal manifestação clínica é a icterícia obstrutiva indolor, por vezes intermitente, devido à colangite esclerosante que ocorre em 76% dos doentes, acompanhada de perda ponderal que ocorre em 35% dos doentes (1, 9). Num estudo realizado por Robison SL Lindsay et al. (9) em 23 doentes com AIP, 17% apresentavam apenas dor abdominal.
A diabetes mellitus do tipo 2 é frequente. Em muitos casos, o diagnóstico de diabetes mellitus e de AIP é feito em simultâneo (1).
A insuficiência pancreática marcada é rara, apesar da função exócrina estar geralmente afectada (1).
Existem ainda doentes que apresentam outras manifestações, tais como tumefacção das glândulas salivares devido à sialadenite esclerosante, hidronefrose devido à fibrose retroperitoneal (RFP) e linfoadenopatias.
maio
’17
21
Achados Laboratoriais
Na AIP a elevação sérica das enzimas pancreáticas é pouco frequente. Nos casos em que existem lesões biliares, verifica-se o aumento dos níveis de bilirrubina e das enzimas hepatobiliares (1).
Alguns doentes apresentam eosinofilia periférica ou elevação dos níveis séricos das imunoglobulinas E. É frequente uma banda policlonal na migração rápida da fração gama das globulinas, com uma hipergamaglobulinémia (>2.0g/dL) e elevação da níveis séricos das IgG (>1800mg/dL) (1, 23).
Desde 2001, foram descritos nos doentes com AIP níveis séricos elevados de IgG4, iguais ou superiores a 135 mg/dL (14), sendo considerado um dado útil para distinguir a AIP de outras doenças pancreáticas (16). De acordo com os estudos de Hamano et al. (30), um cutoff de 135mg/dl traduz uma precisão de 97%, sensibilidade 95% e especificidade de 97%, o que permitiria diferenciar a AIP do carcinoma pancreático. No entanto, outros estudos demonstraram que a elevação dos níveis séricos de IgG4 não é específica das doenças esclerosantes associadas as IgG4, uma vez que também se registam noutras patologias, tais como dermatite atópica, asma, doenças malignas do pâncreas e vias biliares, entre outras (13).
Num estudo realizado por Robison SL Lindsay et al. (9) 35% (8/23) dos doentes apresentavam elevação dos níveis de IgG e 57% (13/23) elevação sérica das IgG4. Ou seja, alguns doentes com AIP apresentam níveis séricos elevados de IgG4 apesar dos níveis normais de IgG.
Em alguns casos verifica-se ainda a presença de anticorpos antinucleares, factor reumatoide, anticorpos anti-lactoferrina e anti-anidrase carbónica II (1).
Note-se que os achados serológicos durante o curso da doença, podem espontaneamente sofrer alterações.
maio
’17
22
Achados Radiológicos
A tomografia computorizada (CT), a ultrassonografia (US) e a ressonância magnética (MR) mostram nos casos típicos de AIP um aumento difuso do pâncreas, tipicamente designado de aparência sausage-like (1).
Na CT verifica-se um aumento focal ou difuso do pâncreas, com sinal “halo” positivo,
capsule-like periféricahipodensa em 12-40 % dos doentes com AIP (9).
Imagem 7. CT mostrando o aumento difuso do pâncreas, com capsule-like periférica hipodensa e veia esplénica deformada na AIP (8)
Na CT e na MR dinâmicas há um atraso do reforço do parênquima pancreático (1). Na MR com ponderação em T1 as lesões pancreáticas são hipointensa, ao passo que em T2 são mais hiperintensas quando comparadas com o sinal hepático (1). O tecido adiposo peripancreático surge como uma área hipodensa na CT e hipointensa na RM em T2, devido aos processos inflamatórios e fibróticos que envolvem o pâncreas (1, 19). A MR em T2 revela ainda uma borda periférica hipointensa (10).
maio
’17
23 Imagem 8. MR com ponderação em T1 onde se observa um pâncreas com sinal hipointenso (19)
Por vezes, deteta-se na CT linfadenopatias cervicais, hilares e abdominais. Em alguns casos observa-se invasão das estruturas vasculares, sendo a veia mesentérica superior a mais comummente afectada. Também se observar por vezes a invasão da artéria mesentérica superior, celíaca, veia porta, hepática comum e hepática própria (9).
Imagem 9. CT axial com contraste revela deformidade do contorno da veia mesentérica superior (seta branca) por uma massa heterogénea adjacente sugestivo de invasão vascular (9)
Na colangiopancreatografia retrógrada endoscópica (ERCP), nos casos típicos de AIP, verifica-se uma estenose difusa irregular do ducto pancreático principal com grau variável (1). Em casos raros, a estenose do ducto pancreático principal pode ser segmentar. A dilatação a montante do ducto pancreático na AIP é pouco frequente (1).
Os resultados da US revelam um pâncreas hipoecogénico com manchas hiperecogénicas (1).
maio
’17
24 A ultrassonografia endoscópica (EUS) é o melhor método para a visualização do parênquima ou ductos pancreáticos. Vários estudos indicaram a sua utilidade no diagnóstico de estadios precoces de CP que não poderiam ser detectados através da US ou CT. No entanto a variabilidade dos resultados encontrados em diferentes estudos, provavelmente devido aos diferentes estadios da AIP, refletem-se numa menor utilização deste método em detrimento de outros exames de imagem.
Num estudo realizado por Okabe Y. et al. (8) todos os doentes apresentavam focos hiperecogénicos, 80% apresentavam bandas hiperecogénicas, 50% lobularidade e 60% margens externas lobulares. Doentes nos quais não foram identificadas bandas hiperecogénicas, também não se identificava lobularidade. Neste doentes, o parênquima pancreático era muito hipoecogénico com uma forte probabilidade de hipertrofia, oclusão da veia esplénica e/ou portal. Estes resultados inconsistentes podem justificar-se com base nas diferenças do estado histopatológico das estruturas lobulares do pâncreas acinar, isto é, se as estruturas lobulares estão relativamente bem conservadas ou quase ausentes, sendo o tecido substituído por fibrose.
A lobularidade é característica da AIP no estadio inicial, o que se correlaciona, sob o ponto de vista histológico, com as estruturas lobulares do pâncreas acinar relativamente bem conservadas, enquanto que nos estágios mais avançados de AIP, esses resultados são menos comuns (8).
maio
’17
25
A colangiopancreatografia por ressonância magnética (MRCP) devido à baixa resolução não é o exame mais indicado para observar a estenose do ducto pancreático principal na AIP, mas permite observar a estenose do ducto biliar com a dilatação do a montante do ducto biliar (1, 11).
Imagem 11. MRCP onde se observa (a) estenoses biliares da região proximal do ducto hepático comum (seta) e da raiz do ducto biliar posterior direito (cabeça da seta) (19)
Em relação à angiografia, é frequente o revestimento das artérias peripancreáticas e a estenose da veia porta (1).
A tomografia por emissão de positrões com 18F- fluordesoxiglicose (F18-FDG-PET)
revela ocasionalmente uma captação intensa de FDG no pâncreas dos doentes com AIP na fase ativa e a diminuição da captação de FDG nos estadios precoces daterapia esteroide (após 1 semana de terapia) (1, 8).
maio
’17
26
Achados histopatológicos e imunohistoquímicos
Sob o ponto de vista microscópico as principais características são a infiltração de células inflamatórias e a fibrose.
A infiltração é linfoplasmocítica, predominantemente subepitelial e o epitélio ductal geralmente encontra-se preservado, apresentado uma escassa infiltração. Verifica-se a formação ocasional de folículos linfoides e infiltração perineural (1, 9). As
linfoadenopatias regionais têm um aumento de diâmetro até 2,0 centímetros e apresentam hiperplasia folicular e densa infiltração plasmocítica nas regiões paracortical e medular (1).
A fibrose apresenta uma distribuição periductal e interlobular, geralmente é difusa e densa, em alguns casos, com edema estromal.
As células acinares são substituídas por células inflamatórias e fibrose, com a consequente alteração da arquitetura lobular do pâncreas (1, 11).
Imagem 12. Lâmina de microscópio mostrando a estrutura lobular do pâncreas acinar relativamente bem conservada, com a perda quase completa da estrutura lobular (8).
Outros achados histológicos característicos são a flebite obliterante das veias pancreáticas e o envolvimento da veia portal com infiltrado linfoplasmocítico e a proliferação de fibroblastos (1).
A aspiração por agulha fina guiada por EUS (EUS-FNA) permite confirmar a presença de células benignas ou atípicas, sem malignidade (1).
maio
’17
27
linfócitos T CD4 ou CD8 positivos e plasmócitos IgG4 positivos. Verificou-se que em quase metade dos casos de AIP existem mais de 20 plasmócitos IgG4 positivos por campo de alta potência (h.p.f) (12). Atualmente, consideram-se positivos os resultados um valor superior a 10 células h.p.f. (12).
Imagem 13. Densa infiltração de plasmócitos IgG4 positivos detectados na espécime pancreática (imunocoloração IgG4, ampliação original 9100) (8)
maio
’17
28
Critérios de Diagnóstico
Os achados histológicos observados durante a fase ativa da doença, poderiam por si só constituir o gold standard para o diagnóstico da AIP. No entanto, o diagnóstico da AIP com base numa biopsia ou numa punção EUS-FNA é por vezes infrutífero devido à ínfima dimensão da amostra. Assim, atualmente, para se estabelecer o diagnóstico de AIP, os dados clínicos, laboratoriais, imagiológicos e histológicos
devem ser tidos em consideração (1).
Em 2002, The Japan Pancreas Society propôs os "Critérios de Diagnóstico para Pancreatite Autoimune", que incluem três parâmetros (24):
1. Imagem radiológica: aumento difuso do pâncreas com estenose irregular e difusa do ducto pancreático principal (mais de um terço do comprimento do pâncreas);
2. Avaliação laboratorial: hipergamaglobulinemia (> 2 g/dL) ou IgG > 1800 mg/dL;
3. Exame histológico: infiltração linfoplasmocítica e fibrose.
Considera-se que estamos perante uma AIP quando todos os critérios estão presentes ou na presença do critério 1 com critério 2 ou critério 3 (24).
Em 2006, a clínica de Mayo apresentou os critérios HISORt e propôs pela primeira vez a elevação dos níveis séricos das IgG4:
1. Histologia do pâncreas (infiltrado linfoplasmocítico);
2. Imagem típica (aumento glandular difuso do pâncreas ou aumento glandular focal, ducto pancreático difusamente irregular);
3. Serologia (níveis séricos elevados de IgG4);
4. Doença pancreática inexplicável com serologia positiva e/ou manifestações extra-pancreáticas (isto é, estenose biliar, fibrose retroperitoneal entre outros) com Resposta à terapia esteroide;
O diagnóstico de AIP usando os critérios HISORt requer primeiro a suspeita clínica de AIP (massa focal pancreática ou aumento difuso do pâncreas, icterícia obstrutiva, ou pancreatite) com um ou mais dos critérios HISORt. Para o diagnóstico de AIP é
maio
’17
29
necessário: (1) apenas o resultado da histologia do pâncreas, (2) imagem e serologia, ou (3) a serologia e/ou manifestações extrapancreáticas que respondem à terapia esteroide (9).
O diagnóstico com base nos critérios Korean (2007) requer: imagiologia (CT/ MR demonstrando o aumento do pâncreas e ERCP/MRCP com estenose do ducto pancreático frequentemente associada a estenose do ducto biliar) com um ou mais dos seguintes critérios: serologia, histopatologia do pâncreas ou lesões extrapancreáticos, e / ou resposta aos esteroide.
Em 2011, Shimosegawa et al. propôs The International Consensus Diagnostc Criteria (ICDC) para a AIP, considerado o critério de diagnóstico major para a AIP. ICDC 2011 propõem duas formas de AIP: tipo 1 que está associada ao padrão histológico de pancreatite esclerosante linfoplasmocítica, acompanhada de elevação das IgG4 sérica, enquanto que o tipo 2 é caracterizada por uma pancreatite idiopática ducto-central, com lesões epiteliais com granulócitos e IgG4 negativa (24).
maio
’17
30
Diagnóstico Diferencial
A clínica da AIP caracterizada por icterícia obstrutiva e perda de peso, com os achados radiológicos de uma massa focal pancreática ou estenose do ducto pancreático, mimetiza muitas vezes um carcinoma do pâncreas (1, 9, 11). Deste modo, e devido à dificuldade no diagnóstico desta patologia clínica, o diagnóstico é frequentemente estabelecido após ressecção cirúrgica da massa (10).
Assim, o principal diagnóstico diferencial da AIP é a neoplasia pancreática. Clinicamente, doentes com AIP e carcinoma do pâncreas apresentam (1,9):
1. Idade avançada;
2. Icterícia obstrutiva indolor;
3. Diagnóstico recente de diabetes mellitus;
4. Elevação dos marcadores tumorais;
5. Radiologicamente, aumento difuso do pâncreas ou uma massa focal no pâncreas (o que representa uma obstrução dos ductos pancreáticos e biliares) e linfadenopatias regionais e/ou invasão vascular;
Radiologia
Existem achados radiológicos mais comuns na AIP do que na neoplasia pancreática, tais como a capsule-like periférica hipodensa na CT. Contudo, o aumento glandular difuso ou focal do pâncreas comummente observados em doentes com AIP torna difícil o diagnóstico diferencial com a neoplasia pancreática (9).
Imagem 14. CT (a) e MR (b) observa-se que a cabeça do pâncreas tem um aumento heterogéneo (setas) (10)
maio
’17
31
Kajiwara M. et. al (11) sugeriu que na presença de massas pancreáticas duplas, a possibilidade de se tratar de uma mass-forming pancreatitis deveria ser considerada como diagnóstico principal ao invés do diagnóstico de carcinoma pancreático duplo, na medida em que raramente casos destes surgem na clínica.
Num estudo realizado por Robison SL Lindsay et al. (9), com 23 doentes com AIP, cuja suspeita inicial era de neoplasia do pâncreas, verificaram que 83% dos doentes apresentaram icterícia obstrutiva e/ou perda ponderal e 83% tinham evidência radiológica de um aumento glandular difuso pancreático ou um aumento focal da cabeça e/ou do processo uncinado (22%) ou uma massa focal (61%).
Assim, a suspeita de cancro pancreático surge quando o aumento glandular é focal, localizado na cabeça do pâncreas ou no processo uncinado, sobretudo se associado a icterícia.
As lesões extrapancreáticas são sugestivas de AIP (9), sendo a árvore biliar o local afectado com maior frequência, com espessamento e estenose do ducto biliar.
Na maioria dos doentes com AIP, apesar das estenoses longas e irregulares do ducto pancreático, a dilatação ductal a montante é mínima. A estenose na neoplasia da cabeça do pâncreas é geralmente longa e irregular com obstrução do ducto pancreático principal e dilatação marcada a montante (9, 10, 11).
Imagem 15. ERCP mostra a localização da estenose irregular do ducto pancreático (setas) num doente com AIP(10)
maio
’17
32
Ultrassonografia endoscópica
O papel dos resultados da EUS no diagnóstico diferencial da AIP com o cancro pancreático é controverso (8).
Nos casos em que não se observam bandas hiperecogénicas e lobularidade, o pâncreas geralmente é hipertrófico e hipoecogénico, o que influencia os vasos sanguíneos circundantes tornando difícil distinguir a AIP do cancro pancreático apenas pela morfologia da EUS. A presença de lobularidade excluiu o diagnóstico de cancro pancreático(8).
A EUS-FNA permite confirmar o diagnóstico de AIP, excluindo assim o diagnóstico de neoplasia do pâncreas, se não existirem bandas hiperecogénicas e lobularidade no local de punção (8,9).
Imagem 16. US abdominal (a) e EUS (b) detectam uma massa de 30 mm hipoecogénica na cabeça do pâncreas (setas) (10)
Serologia
Hipergamaglobulinémia, níveis elevados de IgG4 e outros auto-anticorpos têm sido descritos como marcadores da AIP.
A elevação dos níveis séricos de IgG4 (iguais ou superiores a 135 mg/dL) podem ser importantes para o diagnóstico diferencial entre a AIP e a neoplasia do pâncreas.
Apesar de vários autores demostrarem que os níveis séricos das IgG4 podem contribuir para distinguir a AIP do cancro pancreático e de outras condições que envolvem o pâncreas e a árvore biliar com elevada sensibilidade e especificidade, outros estudos realizados recentemente não apresentam resultados tão promissores (9,
maio
’17
33 11, 23). Doentes com AIP podem apresentar níveis normais de IgG4, do mesmo modo que 10% dos doentes com outras patologias pancreáticas, nomeadamente a neoplasia do pâncreas, ou biliares, apresentam uma elevação ligeira das IgG4 (9).
Ensaios esteroides
Apesar da utilidade dos ensaios com os esteroides para o diagnóstico diferencial, na medida em que estes promovem a melhoria do quadro clínico dos doentes com AIP, a administração de esteroides empírica não está preconizada (1).
Em suma, a combinação dos achados imagiológicos característicos, serológicos, as lesões extra-pancreáticas e a resposta a ensaios esteroides, que pode muitas vezes diferenciar os dois diagnósticos, minimizando o erro (9).
Uma vez que a AIP responde dramaticamente à terapia com esteroides, o diagnóstico diferencial pré-operatório entre AIP e o cancro pancreático é importante a fim de evitar a cirurgia (10). Cerca de 2,5-11% dos doentes submetidos a resseção cirúrgica com diagnóstico de neoplasia do pâncreas, na verdade apresentavam uma doença inflamatória benigna do pâncreas, incluindo os casos de AIP (1). Urge assim considerar a presença da AIP nos doentes idosos com icterícia obstrutiva e uma massa pancreática.
maio
’17
34
Tratamento e Prognóstico
Vários casos clínicos demonstraram melhoria da sintomatologia e qualidade de vida nos doentes com AIP submetidos a pancreatoduodenectomias (10). A cirurgia pareceu ser eficaz para a melhoria dos sinais e sintomas clínicos, sendo proposta como um possível tratamento no contexto da AIP. Não obstante, doentes com AIP após a resseção cirúrgica têm reincidênciada doença (10).
Atualmente, o tratamento de primeira linha para a AIP é a terapia esteroide, sendo clinicamente, morfologicamente e serologicamente eficaz nos doentes com AIP.
Alguns doentes também podem melhorar espontaneamente (9, 10).
Imagem 17. Imagens do pâncreas obtidas com MR com ponderação T1 e T2 antes e após 4 meses de terapia esteroide. Em Outubro, a MR mostrava que o pâncreas remanescente estava aumentado com sinal de baixa intensidade em T1 (a) e borda periférica com baixa intensidade em T2 (b). Em Janeiro, os achados da MR demostram uma melhoria do aumento pancreático na ponderação T1 (c) e o desaparecimento da borda periférica na ponderação T2(d) (10)
A dose inicial recomenda de prednisolona é de 0,6 mg/Kg/dia administrada durante 2 a 4 semanas, sendo reduzida 5mg a cada uma ou duas semanas até a dose de manutenção (2,5-5 mg/dia), que deverá ser mantida três anos (24).
Antes do início do tratamento, doentes com icterícia obstrutiva devem realizar a drenagem per cutânea transhepática ou endoscópica e doentes com diabetes mellitus é necessário o controlo da glicemia (1).
maio
’17
35 Normalmente após duas semanas o tamanho do pâncreas normaliza. A drenagem biliar não é necessária após um a dois meses. Regra geral, a estenose implica mais tempo de recuperação (1, 9, 10, 17). Em relação à função pancreática, metade dos doentes tratados com esteroides apresentam uma diminuição da função exócrina e melhoria da função endócrina (1).
Imagem 18. CT após terapia esteroide onde se pode observar redução do aumento do pâncreas (8)
Doentes nos quais está documentada radiologicamente uma regressão completa, podem interromper a medicação. Os restantes fazem terapia esteroide de manutenção continua (1) durante pelo menos seis meses (17). Os doentes com recaída durante o tratamento de manutenção ou após interromperem a medicação, não deverão ser novamente submetidos a altas doses de esteroides.
Nos casos em que se verificam resistências à terapia esteroide ou efeitos secundários marcados, a terapia imunossupressora é uma alternativa (14).
Imagem 19. EUS após terapia esteroide verificando-se a redução do aumento do parênquima pancreático e da deformidade da veia esplénica (8)
maio
’17
36
Subtipos clínicos
A AIP é uma doença heterogénea. Apesar de ser uma doença característica dos idosos, pode manifestar-se em indivíduos jovens. Nestes, a dor abdominal e a elevação da amilase pancreática sérica são mais comuns assim como a infiltração de neutrófilos no epitélio do ducto pancreático, a doença inflamatória intestinal e a associação com sialadenite (1).
Histologicamente, existem dois tipos de AIP:
• Tipo 1: pancreatite esclerosante linfoplasmocítica; uma doença sistémica caracterizada por uma infiltração abundante de plasmócitos IgG4 positivos dos órgãos afectados;
• Tipo 2: pancreatite idiopática ducto-central, caracterizada por lesões epiteliais com granulócitos no pâncreas sem envolvimento sistémico;
AIP associada a formações quísticas
Em alguns casos, a AIP tipo 1 revela formações quísticas (ACF), tais como pseudo-quistos, walled-off necrosis e quistos de retenção. É um subtipo raro com escassos casos descritos na literatura (17).
Imagem 20. Tomografia computorizada mostrando pâncreas com quisto de retenção com 6 cm de diâmetro de um doente com AIP (17)
As ACF podem corresponder a um fenómeno tardio da pancreatite crónica acompanhadas pelo envolvimento vascular peripancreático (PVI) ou formação de
maio
’17
37 varizes. Perante este cenário, o pâncreas torna-se atrófico e perde a função, sem dor abdominal associada. No entanto, os estudos revelam o aumento do pâncreas em doentes com AIP, sem atrofia, com dor abdominal e elevação das enzimas pancreáticas, a maioria dos quais revertiam com os esteroides. Assim, constata-se que a maioria dos doentes com AIP e ACF podem não estar necessariamente num estadio avançado da doença, tal como sucede com as formações quísticas na pancreatite crônica.
Uma minoria dos doentes com AIP, devido à atrofia pancreática associada ao desenvolvimento de pancreatolitíase e formações quísticas, apresentam um curso crónico, com o desenvolvimento a longo prazo de insuficiência endo/exócrina. Portanto, casos refratários à terapia esteroide.
Num estudo realizado por Kubota K. et al. (17) em doentes com e sem ACF, o único factor preditivo independente para a ACF em doentes com AIP tipo 1 foi a presença da formação de varizes na fase inicialda doença. No entanto, os dados demonstraram também que a dor abdominal, a elevação das enzimas pancreáticas, o PVI e a formação de varizes ocorrem com uma incidência relativamente alta nas ACF quando comparadas com os doentes sem formações quísticas.
Uma vez que a formação de quistos é rara na AIP, não existem guidelines no que se refere à estratégia terapêutica.
No estudo acima mencionado (17), a terapia esteroide foi eficaz no grupo com quistos com diâmetro inferior a 55mm enquanto que o grupo com quistos com diâmetro igual ou superior a 55 mm era refratário à terapia esteroide.
A elevação das enzimas pancreáticas mesmo nos casos com formação quística sugere que a terapia esteroide é eficaz na ausência de pancreatolitíase ou formação de varizes, na presença de quistos com diâmetro inferior a 55 mm.
Apesar da PVI não ser um factor de risco para a ACF, doentes com AIP tipo1 com PVI potencialmente desenvolvem ACF. Deste modo, considera-se que doentes com AIP do tipo 1 com PVI, independentemente de apresentarem ou não quistos no estadio inicial, devem fazer terapia esteroide para prevenir o curso refratário.
maio
’17
38
Para lesões quísticas refratárias a esteroides, lesões com diâmetro superior a 55 mm, os tratamentos de segunda linha consistem na drenagem endoscópica ou cirurgia.
Imagem 21. CT mostrando o envolvimento da veia e artéria esplénica com formação quística na AIP associada a formação quística (17)
Imagem 22. Estratégia terapêutica para AIP com formações quísticas (17)
Em suma, AIP é reversível com terapia esteroide. Contudo, em alguns doentes evoluiu para pancreatite crónica, irreversível com terapia esteroide, devido à trombose da veia porta, formação de varizes, formação de quistos e pancreatolitíase (17).
maio
’17
39
Doença esclerosante associada às IgG4
Em 2003, Kamisawa et al. (19) propôs o conceito de “doença sistémica associada às IgG4”, sendo o pâncreas e a árvore biliar respectivamente os órgãos mais afectados.
A doença esclerosante sistémica associada às IgG4, também designada de doença relacionada com as IgG4 (IgG4-RD), surgiu no contexto da AIP, quando se verificou a presença de lesões extrapancreáticas, de origem autoimune com alterações histopatológicas semelhantes às descritas no pâncreas e a elevação dos níveis de IgG4 no plasma (11,12, 16).
A IgG4-RD engloba a pancreatite esclerosante, colangite e colecistite esclerosante, sialadenite, fibrose retroperitoneal, linfoadenopatias, pneumonia intersticial, pseudotumor inflamatório pulmonar e hepático, nefrite intersticial, pseudotumor da hipófise, púrpura trombocitopénica imune, surdez autoimune neurossensorial, hipotiroidismo, anosmia, perda do paladar, entre outras. A maioria das doenças esclerosantes relacionadas com IgG4 estão associadas à AIP, no entanto, existem casos de doenças esclerosantes relacionadas com IgG4 sem envolvimento pancreático (1, 14).
A IgG4-RD ocorre predominantemente nos homens idosos (1). A extensão da doença pode ser definida como localizada ou sistémica, caso haja o envolvimento de mais de dois órgãos (14). Segundo os dados, 40% dos casos de IgG4-RD apresentam envolvimento das glândulas lacrimais e 29% das salivares. Este tropismo da IgG4-RD permanece por esclarecer (14). As principais manifestações clínicas devem-se ao envolvimento do pâncreas, ducto biliar, glândulas salivares e lacrimais e retroperitoneu (1).
Sob o ponto de vista histopatológico, caracteriza-se por uma extensa infiltração de plasmócitos IgG4 positivos e de linfócitos T CD4 e CD8 positivos e fibrose nos vários órgãos afectados (1).
Em 2012, um consenso internacional determinou os atuais critérios de diagnóstico IgG4 -RD com base nas características patológicas, considerando a elevação sérica de IgG4 um achado complementar (14).
maio
’17
40
(Consultar tabela 9 em anexo)
O maior estudo multicêntrico sobre a IgG4-RD publicado em 2014 é de origem japonesa e incluiu 122 doentes, apesar dos critérios atuais só terem sido aplicados a 76 doentes (14). Fora do Japão, um dos estudos com maior relevância foi guiado por Fernández-Codina A. et al. (14) com 55 doentes espanhóis e foi realizado segundo os critérios de diagnóstico da IgG4-RD atuais. Neste estudo, à data da apresentação,
47,3% dos doentes tinham o envolvimento de pelo menos dois órgãos, sendo o retroperitoneu o mais afectado. O envolvimento do seio maxilar estava mais associado à forma sistémica. Os autores verificaram que nos doentes com IgG4-RD sistémica, a probabilidade de recorrer à imunoterapia era maior do que aqueles com doença localizada. Dos 32,7% dos doentes sujeitos a terapia imunossupressora, 16,36% utilizaram rituximab com resultados positivos. Nenhuma morte esteve diretamente relacionada com a IgG4-RD e a taxa de malignidade foi baixa (9%). Concluíram ainda que a IgG4-RD tem tropismo para os órgãos da cabeça, retroperitoneu e pâncreas.
Apesar da boa resposta ao tratamento, a IgG4-RD sistémica é difícil de tratar com muitas recaídas.
Uma vez que tanto as lesões pancreáticas como extrapancreáticas respondem à terapia esteroide, esta é considerada o tratamento de primeira linha. Outras opções terapêuticas incluem os agentes imunossupressores (14). A introdução do Rituximab pode representar uma nova era do tratamento da IgG4-RD. Associado ou não a esteroides, foi descrito como um tratamento altamente eficaz na IgG4-RD. Apesar de ainda não existirem muitos estudos acerca do assunto, a depleção de células B parece ser um dos pontos a considerar nas futuras estratégias terapêuticas.
Recentemente, foram introduzidos os fármacos antirreumáticos modificadores da doença, eficazes em alguns doentes com IgG4-RD (14). No entanto aguardam-se estudos mais dirigidos.
Na verdade, os tratamentos disponíveis oferecem limitações no que se refere à “eliminação” de todos os vestígios da doença, especialmente em doentes com um longo período de evolução e mais fibrose (14).
maio
’17
41 A relação entre IgG4-RD e neoplasia ainda é controversa. No estudo realizado por Fernández-Codina A. et al. (14) apenas 7,2% dos doentes desenvolveram neoplasia (sólida ou hematológica) ou uma condição pré-maligna após diagnóstico de IgG4-RD, todos eles com baixo nível de agressividade.
Colangite esclerosante
A colangite esclerosante é uma das doenças que mais frequentemente surge associada à AIP. Pode ser secundária a coledocolitíase, tumor biliar ou a infecção ou ser uma colangite esclerosante benigna de origem desconhecida, a maioria dos casos uma colangite esclerosante primária (PSC) (1).
A PSC envolve os ductos biliares intra e extra-hepáticos, é progressiva e culmina com cirrose e insuficiência hepática. Ocorre em doentes entre os 30 e 40 anos e está muitas vezes associada à doença inflamatória intestinal (IBD). Na maioria dos doentes, o pancreatograma é normal. O efeito da terapia esteroide é questionável, sendo atualmente o transplante hepático a única possibilidade de cura (1). O problema major após transplante hepático é a recorrência da doença (20).
À exceção dos casos desencadeados por estimulação mecânica, muitas estenoses biliares benignas estão, de alguma forma, associadas ao sistema imune (12).
A colangite esclerosante associada à IgG4 (IgG4-SC) foi recentemente foi apontada como uma das causas de colangite esclerosante benigna associada à AIP (12,16). Inclusive, é particularmente difícil o diagnóstico de IgG4-SC em casos não associados à AIP (13). Estão descritos na literatura poucos casos de IgG4-SC sem envolvimento do pâncreas (19).
A colangiografia permite classificar a IgG4-SC em 4 tipos com base na localização da estenose (13, 16):
• Tipo 1: estenose localizada apenas na região distal do ducto biliar comum; • Tipo 2: estenose distribuída difusamente ao longo dos ductos biliares intra e
extra hepáticos;
maio
’17
42 do ducto biliar comum;
• Tipo 4: estenoses do ducto biliar são detectadas apenas na região hepática hilar;
Assim, o principal diagnóstico diferencial para a IgG4-SC tipo 1 é o carcinoma pancreático; para a IgG4-SC tipo 2 a PSC; e para os tipos 3 e 4 o colangiocarcinoma (16).
Perante um colangiograma do tipo 1, a EUS-FNA deve ser realizada para exclusão de cancro do pâncreas. No colangiograma do tipo 2, o diagnóstico diferencial entre PSC e a IgG4-SC deve ser realizado com base nos achados colangiográficos. Por último, perante os tipos 3 e 4 o colangiocarcinoma deve excluído através da US, que incluem a EUS ou IDUS (16).
Imagem 23. Classificação colangiográfica da Colangite esclerosante associada IgG4 e diagnóstico diferencial (13)
Os achados característicos da colangiografia da PSC são: a estenose band-like, beaded appearance, a aparência em pruned-tree e diverticulum-like outpouching, não
observados na IgG4-SC (13). Por outro lado, a estenose segmentar, estenoses longas com dilatação pré-estenose e estenoses distais do ducto biliar comum são significativamente mais comuns na IgG4-SC (16). Estas características refletem os processos patológicos subjacentes. Na PSC a fibrose obliterativa é a principal causa de estenose biliar, o que resulta em estenoses curtas. Por outro lado, na IgG4-SC, a infiltração abundante linfoplasmocítica ao longo das paredes dos ductos biliares é a principal causa de estenose biliar, pelo que as estenoses são longas.
maio
’17
43
Imagem 24. Esquema ilustrando a comparação dos achados colangiográficos da PSC versus IgG4-SC (16)
A CT abdominal mostra o envolvimento dos ductos biliares, nomeadamente o aumento da espessura da parede do ducto biliar, com margens livres e hiperatenuação homogénea durante a fase tardia arterial. É possível observar em alguns doentes uma protusão a partir da parede do ducto biliar correspondente a um pseudotumor inflamatório hepático, que pode mimetizar um colangiocarcinoma (13, 16). Os achados da CT não são suficientemente específicos para permitirem distinguir a IgG4-SC de outras doenças biliares (16).
Imagem 25. CT (a) e EUS (b) onde se observa o espessamento da parede do ducto biliar comum e vesícula biliar (16)
Na IgG4-SC, através da ultrassonografia intraductal (IDUS), observa-se um espessamento distal da parede do ducto biliar comum circular e simétrico, margens musculares internas e externas e área estenótica homogénea (16). Estes achados são reconhecidos não só nas áreas estenosadas ou ocasionalmente na vesicular biliar, mas
também nas áreas sem estenose que aparentemente são normais no colangiograma (1,
maio
’17
44
13). O achado mais característico da IDUS é o espessamento da parede superior a 0,8 mm em áreas sem estenoses que aparentemente eram normais no colangiograma (16).
Imagem 26. Achados característicos da Ultrasonografia Intraductal (16)
Imagem 27. IDUS através da qual se verifica o espessamento do ducto biliar em áreas de estenose (a) e áreas sem estenose (b) (16)
A colangioscopia per oral (POC) é uma técnica de diagnóstico alternativa para diferenciar as estenoses benignas de estenoses malignas. As estenoses malignas podem ser identificadas pelo easy oozing e mucosa com superfície irregular com vasos irregularmente dilatados e tortuosos. A imagem de banda estreita(NBI)ajuda a caracterizar a estrutura e vasos da mucosa (15).
maio
’17
45 Imagem 28. POC de doente com 69 anos com IgG4-SC: edema da mucosa e proliferação da dilatação e tortuosidade das veias no local da estenose. a) Imagem convencional white-light b) NBI
Histologicamente, comparando com a PSC, na IgG4-SC a infiltração de plasmócitos IgG4 positivos é mais densa, a fibrose estoriforme transmural é menos densa e a aparência em casca de cebola raramente é observada (1). Note-se ainda que na IgG4-SC esta inflamação é observada apenas na submucosa da parede do ducto biliar, permanecendo o epitélio intacto, o que não se verifica na PSC (13).Verifica-se ainda a presença de infiltração linfoplasmocítica e fibrose na região portal e periportal do fígado e flebite obliterante (15, 16).
(Consultar tabela 5 nos anexos)
Em relação aos níveis séricos de IgG4, a elevação dos níveis séricos IgG4 (iguais ou superiores a135 mg/dl) é frequente na IgG4-SC (16). No caso da PSC, nem sempre se observam níveis elevados de IgG4 (1).
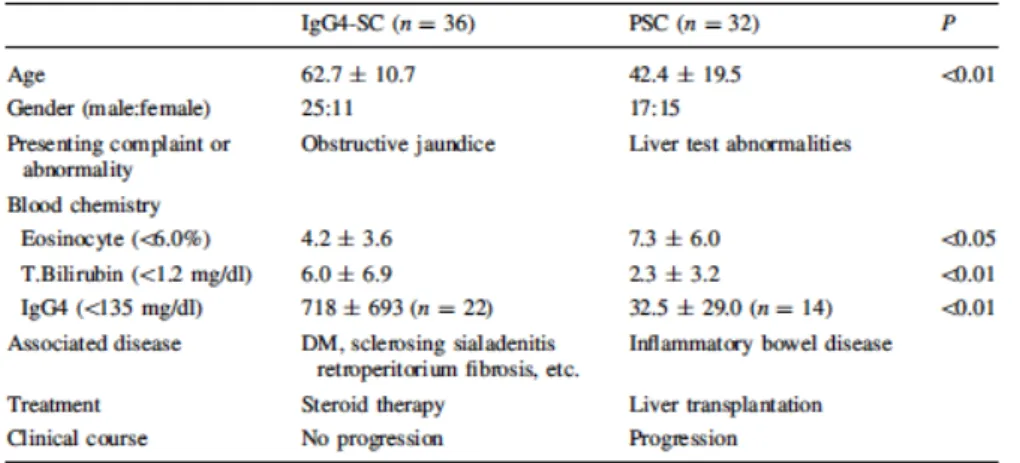
Clinicamente, a IgG4-SC afecta mais homens que mulheres, enquanto que na PSC não se verificam diferenças em relação ao sexo. A idade de início da doença é significativamente mais avançada nos doentes com IgG4-SC (62.7 ± 10.7 anos), contrariamente aos doentes com PSC (42.4 ± 19.5 anos). A icterícia obstrutiva é mais frequente na IgG4-SC, refletindo a marcada estenose concêntrica do grande ducto biliar (16). A associação com a IBD é característica da PSC, estando presente em apenas 0 a 6% dos doentes com IgG4-SC (16). No entanto, apesar da IBD não ser uma doença caracteristicamente associada à AIP tipo 1, é comum a associação com a AIP tipo 2 (16) e com a AIP em doentes jovens (1).
maio
’17
46
Por último, a colangite esclerosante associada à AIP responde à terapia esteroide e à drenagem biliar (1, 16), apesar de estadios avançados por vezes não responderem à terapia esteroide (17). A PSC culmina com cirrose hepática, exigindo transplante hepático. No colangiocarcinoma a resseção cirúrgica é necessária (16).
(Consultar tabela 6 em anexo)
Se não for possível obter um diagnóstico utilizando os procedimentos acima referidos, os ensaios com esteroides podem ser úteis. A duração, a dose e o método ainda carecem de esclarecimentos. Contudo, apesar de ser um critério de diagnóstico clínico opcional dos critérios da IgG4-SC 2012, devem ser feitos esforços no sentido de evita-los sempre que possível (12). Isto porque algumas lesões malignas podem melhorar após a terapia esteroide, falseando deste modo o diagnóstico. Além disso,
perante um colangiograma do tipo 1, 3 ou 4, tendo em conta os respectivos diagnósticos diferenciais, o cancro pancreático e o colangiocarcinoma respectivamente, é importante não adiar a cirurgia em detrimento da realização de ensaios esteroides prolongados (16).
Segundo alguns estudos (12), a incidência da estenose biliar benigna varia entre os 8 e 17,3% nos casos cirurgicamente ressecados com diagnóstico pré-operatório de colangiocarcinoma. Dentro destes casos, a incidência da colangite esclerosante associada a IgG4 varia entre os 4,8 e 9,1%.
(Consultar tabela 7 em anexo)
O diagnóstico da IgG4-SC é baseado nos 4 critérios: 1. Achados imagiológicos das características biliares; 2. Elevação da concentração séricas IgG4;
3. Coexistência de doenças relacionadas com as Imunoglobulinas G4 (IgG4-RD) excepto as relacionadas com o trato biliar (ex.: sialoadenite associada a IgG4 ou fibrose retroperitoneal IgG4 associada);
4. Achados histopatológicos característicos;
maio
’17
47
Conclusão
AIP é uma patologia recentemente descrita, com muitas características clínicas, serológicas, morfológicas e histopatológicas a considerar, cujo diagnóstico é baseado de um modo geral na combinação dos seguintes achados: estenose irregular do ducto pancreático principal e aumento difuso do pâncreas; elevação dos níveis séricos das IgG ou IgG4; prevalência nos homens idosos, icterícia obstrutiva intermitente; densa infiltração de plasmócitos IgG4-positivos e linfócitos T, com fibrose e flebite obliterante; lesões extrapancreáticas ocasionais e resposta aos esteroides.
A terapia esteroide é atualmente o tratamento de primeira linha para a AIP, sendo clinicamente, morfologicamente e serologicamente eficaz nos doentes com AIP, pelo que um diagnóstico precoce é necessário a fim de evitar intervenções cirúrgicas desnecessárias. Vários são os casos retratados na literatura de variantes da AIP com
achados clínicos e radiológicos semelhantes aos da neoplasia pancreática e colangiocarcinoma.
Atualmente é considerada a existência de uma nova entidade clínico-patológica, a doença esclerosante associada às IgG4, cujas principais manifestações clínicas se refletem no principalmente no pâncreas, ducto biliar, retroperitoneu e glândulas
salivares. Assim, AIP assume-se como uma lesão pancreática que reflete uma doença sistémica.
Em suma, a compreensão do especto completo da doença sistémica relacionada com IgG4 exige ainda muita investigação a nível internacional.
maio
’17
48
Agradecimentos
Ao Doutor João Coutinho, professor, médico e orientador, pelos conselhos, disponibilidade e esclarecimentos prestados.
À minha família, pelo apoio e incentivo ao longo do meu percurso académico.
Ao Doutor Manuel Ribeiro, pela disponibilidade e ajuda prestada na obtenção de informação para realização deste trabalho.
À Faculdade de Medicina da Universidade de Lisboa e a todo o corpo docente pela formação académica. A todos aqueles que, direta ou indiretamente, contribuíram para a realização desta dissertação.
maio
’17
49
Bibliografia
1. Kamisawa T., Okamoto A. (2006) Autoimmune pancreatitis: proposal of IgG4-related sclerosing disease. J Gastroenterol 41:613-625
2. Toki F., Kozu T., Oi I. (1992) An usual type of chronic pancreatitis showing diffuse irregular narrowing of the entire main pancreatic duct on ERCP. A report of four cases. Endoscopy 24:640
3. Yoshida K., Toki F., Takeuchi T., Watanabe S., Shiratori K., Hayashi N. (1995) Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci 40:1561–8
4. Lang D., Zwerina J., Pieringer H. (2016) IgG4-related disease: current challenges and future prospects. Therapeutics and Clinical Risk Management 12:189-99
5. Hirano K., Komatsu Y., Yamamoto N., Nakai Y., Sasahira N., Toda N., Isayama H., Tada M., Kawabe T., Omata M. (2004) Pancreatic mass lesions associated with raised concentration of IgG4. Am J Gastroenterol 99:2038-2040
6. Kim K.P., Kim M.H., Song M.H., Lee SS, Seo D.W., Lee S.K. (2004) Autoimmune chronic pancreatitis. Am J Gastroenterol 99:1605-1616
7. Takayama M., Hamano H., Ochi Y., Saegusa H., Komatsu K., Muraki T., Arakura N., Imai Y., Hasebe O., Kawa S. (2004) Recurrent attacks of autoimmune pancreatitis result in pancreatic stone formation. Am J Gastroenterol 99:932-937
8. Okabe Y., Ishida Y., Kaji R., Sugiyama G., Yasumoto M., Naito Y., Toyonaga A., Tsuruta O., Sata M. (2012) Endoscopic ultrasonographic study of autoimmune pancreatitis and the effect of steroid therapy. J Hepatobiliary Pancreat Sci 19:266-273
9. Robison S.L., Canon L.C., Varadarajulu S., Eloubeidi A.M., Vickers S., Wilcox C.M. (2011) Autoimmune pancreatitis mimicking pancreatic cancer. J Hepatobiliary Pancreat Sci 18:162-169
10. Watanabe M., Yamaguchi K., Kobayashi K., Konomi H., Nakamura M., Mizumoto K., Tsuneyoshi M., Tanaka M. (2007) Autoimmune pancreatitis diagnosed after pancreatoduodenectomy and successfully treated with low-dose steroid. J Hepatobiliary Pancreat Surg 14:397-400
11. Kajiwara M., Kojima M., Konishi M., Nakagohri T., Takahashi S., Gotohda N., Hasebe T., Ochiai A., Kinoshita T. (2008) Autoimmune pancreatitis with multifocal lesions. J Hepatobiliary Pancreat Surg 15:449-452
12. Fujita T., Kojima M., Gotohda N., Takahashi S., Nakagohri T., Konishi M., Ochiai A., Kinoshita T. (2010) Incidence, clinical presentation and pathological features of benign sclerosing cholangitis of unknown origin masquerading as biliary carcinoma. J Hepatobiliary Pancreat Sci 17:139-146