3
A impressão desta dissertação foi aprovada pelo Conselho Científico da Faculdade de Medicina de Lisboa em reunião realizada a 22 de Fevereiro de 2011.
4
RESUMO
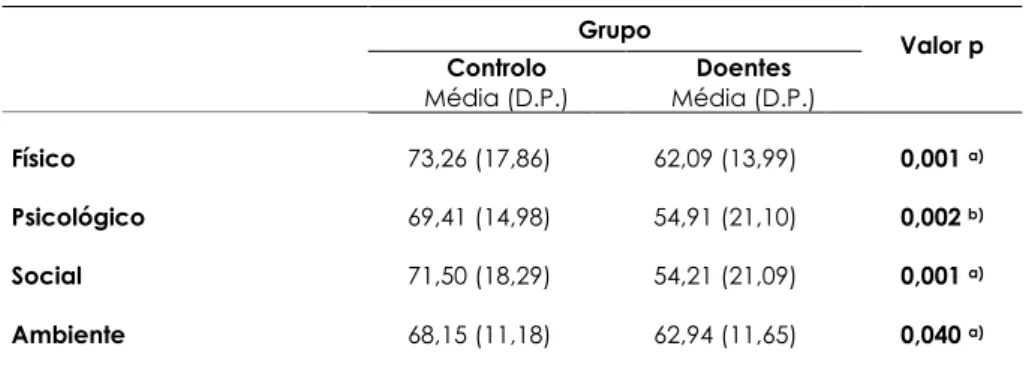
As alterações do sono são frequentemente observadas na esquizofrenia. No presente trabalho pretendeu-se caracterizar o ciclo sono-vigília na esquizofrenia. Para o efeito, seleccionaram-se duas amostras: a primeira constituída por 34 indivíduos saudáveis (15 sexo feminino e 19 sexo masculino) que integraram o grupo de controlo e a segunda constituída por 34 doentes (12 sexo feminino e 22 do sexo masculino), estabilizados clinicamente há pelo menos um mês e seguidos em ambulatório, com o diagnóstico de Esquizofrenia, segundo o instrumento de classificação DSM IV TR. Foram usados os seguintes instrumentos de avaliação: a escala PANNS para avaliar a psicopatologia, a escala Pittsburgh (PSQI) para avaliar a qualidade do sono, a escala WHOQOL-BREF para avaliar a qualidade de vida, a escala Morningness-Eveningness Questionnaire para avaliar os hábitos do ciclo sono-vigília, a actigrafia (consecutiva por sete dias) para avaliar os ciclos sono-vigília e o doseamento nocturno de melatonina na saliva como marcador do relógio biológico interno. As 4 recolhas de saliva para doseamento da melatonina foram efectuadas com intervalo de 60 minutos, em baixas condições de luminosidade(<50 lux), entre as 20h00 e as 23h00 . Neste trabalho foram identificados 6 casos de alteração do padrão ciclo sono-vigília: 3 casos de síndrome de avanço na fase de sono e 3 casos de padrão irregular do ciclo sono-vigília. Apesar de se ter identificado 3 casos de síndrome de atraso de fase no grupo de controlo as diferenças entres os grupos, neste capítulo, não foram estatisticamente significativas. Apesar disso, verificaram-se alterações estatisticamente significativas entre os dois grupos em várias variáveis do sono estudadas. Os doentes, face ao grupo de controlo, apresentaram valores superiores da latência do sono, período total do sono, tempo total do sono despertares nocturnos. Por outro lado, registaram-se valores significativamente inferiores na eficiência do sono. Os doentes deitavam-se mais cedo e levantavam-se mais tarde comparativamente ao grupo de controlo. A qualidade do sono dos doentes revelou-se significativamente inferior à do grupo de controlo. Da análise dos dados apresentados, podemos ainda concluir que a subescala PANNS sintomas positivos, está correlacionada negativamente com a qualidade do sono (rs=-0,484; p=0,004). Observamos que um funcionamento mais enérgico durante o dia está correlacionado positivamente com a qualidade do sono (rs=0,371; p=0,031) e com a qualidade de vida no domínio físico (rs=0,518; p=0,002), psicológico (rs=0,529; p=0,001), social (rs=0,472; p=0,005) e ambiental (rs=0,546; p=0,001). A actividade motora durante o dia (activity level) mostrou-se correlacionada negativamente com
5
o tempo total de sono, (rs=-0,447; p=0,008). Por sua vez, a actividade motora expressa pelo parâmetro uninterrupted activity encontra-se correlacionada negativamente com a subescala PANSS sintomas negativos (rs=-0,367; p=0,033), enquanto o parâmetro uninterrupted immobility mostrou-se correlacionada positivamente com a subescala PANSS psicopatologia (r=0,356; p=0,039). Não se observaram diferenças significativas nos doseamentos de melatonina na saliva entre os dois grupos. Contudo, contrariamente ao que se observou no grupo de doentes em que não existiu qualquer correlação entre os níveis de melatonina e as varáveis do sono, no grupo dos indivíduos saudáveis encontraram-se as seguinte correlações: a latência do sono (r = − 0, 488, p = 0,003) e o período total do sono (r = − 0, 384, p = 0,025) correlacionaram-se negativamente com os valores de melatonina. A eficiência do sono correlacionou-se positivamente com a melatonina (r= 0, 520, p = 0,002). Através da análise de regressão linear múltiplas, para o grupo de controlo, valores mais elevados da latência do sono estão associados a menores valores de melatonina (R2=28,9%; p=0,037). Ou seja, no grupo de doentes a melatonina, mostrou ter o seu efeito fisiológico promotor do sono comprometido. Este aspecto poderá contribuir para explicar o aumento significativo das perturbações do sono observados nos doentes com esquizofrenia.
Palavras-chave: Esquizofrenia, Actigrafia, Ciclos Sono-Vigília, Qualidade de Vida, Melatonina, Sono.
6
ABSTRACT
Sleep disturbances are very common in schizophrenia. The aim of this study was to describe the sleep-wake cycle in schizophrenia. Thirty-four schizophrenia patients (according to DSM IV TR), 12 women and 22 men, clinically stable for at least one month, and thirty-four healthy subjects, 15 women and 19 men, participated in this study. Wrist-actigraphy recordings and a sleep diary during seven consecutive days were used for sleep-wake cycle assessment. The quality and patterns of sleep were measured with the Pittsburgh Sleep Quality Index, (PSQI) the sleep-awake habits were evaluated with Morningness Eveningness Questionnaire and the Positive and Negative Syndrome Scale (PANSS) was used for psychopathology assessment. Nocturnal melatonin was used as a marker of internal biological clock. To quantify and assess nocturnal melatonin profiles, saliva samples werecollected for one night under dim light conditions (<50 lux) hourly from 20h00 to 23h00. In patients group, we identified three cases of advance sleep phase syndrome and three cases of irregular sleep phase syndrome. Despite having identified three cases of delayed sleep phase syndrome in the control group, no significant differences, in this chapter, were found between the groups. Nevertheless, there were statistically significant differences between the two groups on several sleep variables studied. Scores on PSQI were significantly higher in schizophrenia patients as compared to healthy controls, indicating a worse quality of sleep. Patients went to bed early and wake up later, sleep more at night, but have poorer sleep efficiency, than healthy controls. Sleep latency and nighttime awakenings were significant higher in schizophrenia patients. The PANSS positive subscale is negatively correlated with sleep quality (rs =- 0.484, p = 0.004). Finally, we note that a more energetic during the working day is positively correlated with sleep quality (rs = 0.371, p = 0.031) and quality of life in the physical (rs = 0.518, p = 0.002), psychological (rs = 0.529, p = 0.001), social (rs = 0.472, p = 0.005) and environmental domains (rs = 0.546, p = 0.001). The motor activity during the day (activity level) was negatively correlated with total sleep time (rs =- 0.447, p = 0.008). The motor activity expressed by the parameter uninterrupted activity is negatively correlated with PANSS negative subscale (rs =- 0.367, p = 0.033), while the parameter uninterrupted immobility was correlated positively with the PANSS psychopathology subscale (r = 0.356, p = 0.039). No statistical differences were found in melatonin concentration, in all four measuring points, between schizophrenia patients and healthy controls (p 0.1). Despite that, the melatonin levels were negatively correlated with SL (r = − 0, 488, p = 0,003), total sleep time (r = − 0, 384, p = 0,025) and
7
positively correlated sleep efficiency (r= 0, 520, p = 0,002) in HS but not in SP. Through multiple linear regression analysis for the control group, higher values of sleep latency were associated with lower levels of melatonin (R2 = 28.9%, p = 0.037). The results of the present study indicate that endogenous melatonin sleep-promoting action is compromised in schizophrenia. These findings can explain some of the sleep disturbances observed in schizophrenia patients.
Key Words: Schizophrenia, Actigraphy, Sleep-Wake Cycles, Quality of Life, Sleep, Melatonin.
8
ÍNDICE
RESUMO 4 ABSTRACT 6 PREFÁCIO 11 AGRADECIMENTOS 13 LISTA DE TABELAS 14 LISTA DE FIGURAS 15 LISTA DE ABREVIATURAS 16 1. INTRODUÇÂO 18 1.1 O sono normal 201.2 As alterações do sono na esquizofrenia 22
1.2.1 Aspectos subjectivos 23
1.2.2 Aspecos objectivos 24
1.2.3 Alterações do ritmo circadiano do sono 27
1.2.4 Efeitos da terapêutica no sono 28
1.3 A melatonina e o sono 32
1.3.1 Síntese e regulaçãoo 32
1.3.2 Catabolismo e excreção 34
1.3.3 Locais de actuação 35
1.3.4 Efeitos cronobióticos e cronohipnóticos 35
1.3.5 Outros efeitos fisiológicos 36
1.4 O ciclo sono-vigília 37
1.4.1 Regulação molecular do relógio biológico 40
1.4.2 Vias de sincronização do relógio biológico 41
1.5 Alterações dos padrões do ciclo sono-vigília 43
1.5.1 Trabalho por turnos 45
1.5.2 Síndrome de mudança rápida de fusos horários (Jet Lag) 46
1.5.3 Síndrome de atraso na fase de sono 46
1.5.4 Síndrome de avanço na fase do sono 48
1.5.5 Síndrome de ciclo sono-vigília diferente das 24 horas 48
1.5.6 Padrão irregular do ciclo sono-vigília 50
2. OBJECTIVOS 52
2.1 Hipóteses a testar 53
3. MATERIAL E MÉTODOS 54
3.1 Material 54
9
3.1.2 Critérios de exclusão da amostra 54
3.1.3 Caracterização da amostra 55 3.2 Métodos 55 3.2.1 Instrumentos de avaliação 55 3.2.1.1 Questionário 55 3.2.1.2 Diário do sono 55 3.2.1.3 Escala WHOQOL-BREF 56 3.2.1.4 Escala PANNS 57 3.2.1.5 Escala Pittsburgh 58 3.2.1.6 Escala Morningngness-Eveningness 58 3.2.1.7 Actigrafia 58 3.2.1.8 Doseamentos de melatonina 60 3.2.2 Métodos estatísticos 60 4. RESULTADOS 62 4.1 Caracterização sociodemográfica 62
4.2 Caracterização dos antecedentes psiquiátricos 64
4.3 Escala PANNS 67 4.4 Escala PSQI 68 4.5 Escala WHOQOL-BREF 70 4.6 Escala Morningngness-Eveningness 71 4.7 Diário do sono 72 4.8 Actigrafia 75 4.9 Doseamentos de melatonina 84
4.10 Correlações significativas de variáveis 86
4.10.1 Grupo de Controlo 86
4.10.2 Grupo de Doentes 88
4.11 Análises de regressão linear múltiplas 93
5. DISCUSSÃO 99 5.1 Dados sociodemográficos 99 5.2 Antecedentes psiquiátricos 99 5.3 Escala PANNS 100 5.4 Escala PSQI 100 5.5 Escala WHOQOL-BREF 101 5.6 Escala Morningness-Eveningness 102 5.7 Diário do sono 103 5.8 Actigrafia 104
10
5.9 Doseamentos de melatonina 111
6. CONCLUSÕES 113
7. REFERÊNCIAS BIBLIOGRÁFICAS 117
8. ANEXOS 144
Anexo I – Termo de consentimento informado 145
Anexo II - Diário do sono 147
Anexo III - Resultados estatísticos 150
Anexo IV - Artigos publicados 163
Anexo V – Artigos submetidos para publicaçãoo 171
11
PREFÁCIO
Este trabalho de investigação que serve de tese de dissertação para doutoramemto em psiquiatria e saúde mental, acaba por ser um desenvolvimento do projecto de investigação iniciado através do curso de Mestrado em Ciências do Sono (II edição) 2006-2008. Os resultados dessa pesquisa apontavam para a existência de alterações do ritmo circadiano do ciclo sono-vigília na esquizofrenia.
Do trabalho anteriormente realizado ficaram duas importantes limitações que, com o presente projecto de investigação, se procuraram ultrapassar: o reduzido tamanho da amostra e a ausência de um marcador biológico do relógio interno que pudesse apontar algumas pistas sobre a origem das eventuais alterações do padrão do sono na esquizofrenia.
Confesso que, após obter os resultados da investigação, a primeira impressão foi de uma profunda desilusão. Na verdade, e baseando-me noutros trabalhos publicados, levantei a hipótese de na origem das alterações do ritmo circadino sono-vigília dos doentes com esquizofrenia poder estar uma diminuição da síntese da melatonina. Esta substância tem um ritmo circadiano muito estável, desempenhando um papel importante na regulação do ciclo sono-vigília, e a sua síntese, predominatemente nocturna, é promotora do sono. Porém, os resultados eram inequívocos: não havia diferenças significativas na síntese nocturna de melatonina entre os doentes com esquizofrenia e os indivíduos saudáveis.
Curiosamente, e depois de uma melhor reflexão sobre os resultados, verifiquei que, apesar de não existir uma diminuição da síntese da melatonina nos doentes com esquizofrenia estudados comparativamente aos elementos saudáveis do grupo de controlo, as anáilses de correlação e as análises de regressão linear múltiplas apontaram para um resultado supreendente que se irá expôr mais à frente.
Ao fim ao cabo esta pequena experiência agora partilhada deve acontecer inúmeras vezes com outros investigadores. No meu caso serviu para perceber que só está ao nosso alcance formular a pergunta. Uma vez que a resposta a essa pergunta poderá ser completamente surpreendente e nem sempre se enquadra, por mais que seja fértil a nossa imaginação e inspirado o nosso raciocínio, na hipótese inicial. Este é, sem sombra de dúvida, o lado fascinante
12
da investigação: a possibilidade de sermos surpreendidos pelo desvendar de uma pequena parcela da realidade.
Não obstante o entusiasmo obtido pelos resultados deste trabalho de investigação, predominantemente clínico, ficam obviamente muitas respostas por dar. Sabemos, porém, que a investigação em medicina apesar de iniciada pela inquietação da pergunta, dá lugar muitas vezes a novas dúvidas e questões. Também sabemos que só nos cabe fazer uma parte desse trabalho e que outros farão o resto do caminho.
Considerando a complexidade da medicina, a nossa contribuição na investigação é sempre parcelar, limitando-se muitas vezes a apontar novas pistas de investigação. Julgo que com este trabalho que agora apresento esse objectivo foi alcançado.
13
AGRADECIMENTOS
À Professora Doutora Maria Luísa Figueira, não apenas pela orientação desta Tese, mas também pelo apoio incansável que generosamente me tem concedido ao longo dos anos.
À Professora Doutora Teresa Paiva pela sua co-orientação nesta Tese e pelo entusiasmo e conhecimentos transmitidos na área do sono, que se revelaram imprescindíveis para a realização deste trabalho.
À Dra. Maria João Carnot, directora de serviço do Centro Hospitalar Psiquiátrico de Lisboa, pelo seu apoio dado desde o início a este projecto.
À Dra. Vânia Nunes, Dra. Sofia Brissos e Dr. Tiago de Sousa pelo auxílio no recrutamento de doentes.
Ao Dr. Alberto Leal do Centro Hospitalar Psiquiátrico de Lisboa pela colaboração ao nível da actigrafia.
À Professora Doutora Maria Rosário Ramos pelo apoio no trabalho estatístico.
À minha mulher e filhos pelo tempo que os privei para a realização deste trabalho.
Aos meus pais.
14
LISTA DE TABELAS
Tabela 1 Distribuição do sono normal ao longo da noite 21
Tabela 2 Caracterização sociodemográfica da amostra 62
Tabela 3 Caracterização dos sub-diagnósticos 64
Tabela 4 Resultados da escala PANNS 67
Tabela 5 Resultados da escala PSQI 68
Tabela 6 Resultados da escala WHOQOL-BREF 70
Tabela 7 Resultados da escala Morningness-eveningness 71
Tabela 8 Diário do sono: como se sentiu ao acordar 73
Tabela 9 Consumo de café 74
Tabela 10 Resultados da actigrafia (noite) 76
Tabela 11 Resultados da actigrafia (sestas) 78
Tabela 12 Actigrafia – Actividade motora regista (dia) 79
Tabela 13 Actigrafia – Actividade motora regista (noite) 79
Tabela 14 Uninterrupted immobility (dia) versus ocupaçãoo 80
Tabela 15 Doseamento de melatonina 85
Tabela 16 Correlações entre os paramentos da actigrafia (dia) 91
Tabela 17 Correlações entre os parâmetos da actigrafia (noite) 91
15
LISTA DE FIGURAS
Figura 1 Hipnograma normal de um jovem adulto 22
Figura 2 Processo S e C e regulação do ritmo circadiano 38
Figura 3 O efeito da luz no ciclo sono-vigília 39
Figura 4 Regulação molecular do relógio biológico 40
Figura 5 Vias de sincronização do relógio biológico 42
Figura 6 Organização do relógio biológico 43
Figura 7 Alterações primárias do ciclo sono-vigília segundo o sexo 45
Figura 8 Distribuição de sexo pelos grupos 63
Figura 9 Caracterização da actividade profissional 64
Figura 10 Subtipos de diagnóstico 65
Figura 11 Número de internamentos psiquiátricos 65
Figura 12 Terapêutica: antipsicóticos 66
Figura 13 Terapêutica : outros medicamentos 67
Figura 14 Dimensões da escala PSQI, por grupo 69
Figura 15 Resultados da escala PSQI –pontuação total 70
Figura 16 Resultados da escala WHOQOL-BREF 71
Figura 17 Resultados da escala Morningness-eveningness por grupo 72
Figura 18 Consumo de café 74
Figura 19 Funcionamento durante o dia, por grupo 75
Figura 20 Tempo total de sono e período total de sono 76
Figura 21 Depertares nocturnos 77
Figura 22 Tipo de ciclo sono-vigília 81
Figura 23 Actograma de 7 dias – ciclo sono-vigília normal 82
Figura 24 Actograma de 7 dias – ciclo sono-vigília tipo irregular 82
Figura 25 Actograma de 7 dias – ciclo sono-vigília tipo avanço de fase 83
Figura 26 Actograma de 7 dias – ciclo sono-vigília tipo atraso de fase 84
16
LISTA DE ABREVIATURAS
AANAT – Aril-alquil-N-acetiltransferase
AFMK – N1-acetil-N2-formil-5-metoxiqinuramina
AL – Activity level
BDNF – Brain-derived neurotrophic factor
BPRS – Brief Psychiatry Rating Scale
CSVD24H – Ciclo sono-vigília diferente das 24 horas
DA – Receptores dopaminérgicos
DSM IV – Diagnostic and Statistical Manual of Mental Disorders. 4th ed.
EEG – Electroencefalograma
EMG – electromiograma
EOG – Electro-oculograma
ES – Eficiência do sono
GABA – Ácido gama-aminobitírico
HIOMT – Hidroxindol-O-metiltransferase
IGL – Folheto intergeniculado
LCR – Líquido cefalorraquideano
LREM – Latência do sono paradoxal
LS – Latência do sono
M.I.N.I. – Mini-International Neuropsychiatric Interview
MAP – Mean duration (sec) of uninterrupted activity
17
MIP – Mean duration (sec) of uninterrupted immobility
NAS – N-acetil serotonina
NMDA – N-metil-D-aspartato
NREM – Sono lento
PACAP – Péptideo activador da adenilciclase
PANSS – Positive and Negative Syndrome Scale
PICSV – Padrão irregular do ciclo sono-vigília
PSQI – Pittsburgh Sleep Quality Index
REM – Sono paradoxal
SLP – Sono lento profundo
SNC –Sistema nervoso central
TTS – Tempo total de sono
VRH – Via retinohipotalâmica
18
1.
INTRODUÇÃO
Segundo o ilustre psiquiatra português Sobral Cid (1934), na esquizofrenia, o sonho subsistiu a acção e o sonhado tem o valor de vivido. Curiosamente, também Bleuler, no início do século XX, referiu claramente nos seus trabalhos que nesta doença o sono se encontra perturbado, defendendo que algumas ideias delirantes se constituem durante o sonho e que o pensamento onírico e o pensamento autístico esquizofrénico são idênticos no essencial. Segundo este autor: “Os doentes com esquizofrenia tratam as suas alucinações oníricas como se fossem reais, constituem as suas ideias delirantes no decurso do sonho e agarram-se-lhes no estado de vigília”.
Após a descrição do sono REM por Aserinsky e Kleitman em 1953, levantou-se a possibilidade de alguns aspectos clínicos da esquizofrenia, nomeadamente as alucinações, poderem corresponder a uma intrusão anómala desta fase do sono no estado de vigília. Esta associação entre o sono, o sonho e a esquizofrenia só foi devidamente esclarecida cerca de dois anos mais tarde por Dement (1955). A avaliação objectiva do sono alcançada pelo aparecimento da polissonografia mostrou que a quantidade, a qualidade e a distribuição da fase de sono REM não apresentava diferenças significativas entre doentes com esquizofrenia não medicados – mesmo com os critérios de diagnósticos à época – e indivíduos saudáveis. Ou seja, embora inicialmente se supusesse de que as alucinações e os delírios dos doentes com esquizofrenia pudessem corresponder a uma forma, evidentemente patológica, de sonhar acordado, a verdade é que esta interessante hipótese não se veio a confirmar como válida.
Não obstante ter sido abandonada esta teoria, observamos que, na prática clínica, são raros os doentes com esquizofrenia que não se queixam de alterações do sono. Aliás, a insónia é muitas vezes uma queixa que antecede a eclosão do episódio psicótico agudo, intensificando-se durante o surto psicótico, podendo inclusive manter-se na fase de remissão. Este sintoma clínico tem importância na qualidade de vida dos doentes, na abordagem terapêutica, e no prognóstico da doença. Portanto, se é verdade que na esquizofrenia os sintomas psiquiátricos são agravados e amplificados pelas perturbações do sono, também é verdade que a doença também parece contribuir para uma pior qualidade do sono.
Apesar de terem surgido nos últimos anos vários trabalhos publicados na área do sono na esquizofrenia, verificamos que os mecanismos fisiopatológicos
19
responsáveis pelas alterações do sono, observadas com tanta frequência nesta doença, continuam por desvendar. Sabemos ainda que, para além do contributo da própria doença para as perturbações do sono, os tratamentos usados na esquizofrenia, mais concretamente os antipsicóticos, interferem na arquitectura do sono, justificando assim, por parte do psiquiatra, um melhor aprofundamento desta temática.
Considerando que o sono é uma necessidade fisiológica essencial à vida, ao bem-estar, e a uma série de funções fisiológicas importantes, o objectivo de alcançar um sono equilibrado e reparador revela-se uma prioridade na esquizofrenia. Neste contexto, sabendo de antemão que alguns destes doentes apresentam défices cognitivos decorrentes do processo fisiopatológico da esquizofrenia, e que o sono é um processo fisiológico fundamental para a manutenção de um bom rendimento cognitivo, a intervenção terapêutica nesta área reveste-se de uma importância acrescida. Mas para que tal aconteça, torna-se necessário compreender quais são efectivamente as alterações do sono na esquizofrenia.
Atendendo ao facto de a literatura ser realmente escassa no que concerne à caracterização do ciclo sono-vigília na esquizofrenia, e sabendo ainda que para proporcionar um maior sucesso no projecto de reabilitação destes doentes é importante ter um ritmo ciclo sono-vigília ajustado às necessidades sociais e profissionais, decidimos dar o nosso contributo científico para esta área da psiquiatria. É o que iremos fazer com o nosso trabalho que será apresentado de seguida.
20
1.1 O sono normal
Sabemos que no sono encontram-se envolvido vários processos fisiológicos importantes: a consolidação da memória (Stickgold e Walker, 2007; Hornung et al., 2007) a conservação de energia (Zepelin e Rechtschaffen, 1974; Siegel, 2005), os processos anabólicos − por exemplo, através da produção da hormona do crescimento − (Takahashi et al., 1968; Nakanishi, 1997), a plasticidade cerebral (Krueger et al., 1995; Cirelli et al., 2004), o restauro metabólico do cérebro (Hartmann, 1973; Adam e Oswald, 1977; Maquet, 1995), etc.
Embora com algumas variações individuais, dormimos uma média de 8 horas diárias, o que significa que ao longo da nossa vida passamos sensivelmente um terço do tempo a dormir. Durante o sono existe uma alteração do estado de consciência reversível, uma redução da actividade e uma diminuição da sensibilidade aos estímulos externos. Contudo, o sono não é simplesmente o resultado da diminuição do funcionamento dos sistemas de vigília, mas um processo activo que requer a interação de vários sistemas do tronco encefálico e do cérebro (Rechtschaffen e Bergamann, 2002).
No adulto, o sono segue um determinado padrão que geralmente se desenrola ao longo da noite. A polissonografia é o método habitualmente utilizado para o estudo do sono. Esta técnica recorre a três variáveis para caracterizar as diferentes fases do sono: o electroencefalograma (EEG) para registo das ondas eléctricas cerebrais, o electro-oculograma (EOG) para detectar os movimentos oculares e o electromiograma (EMG) destinado a avaliar o tónus muscular. A classificação das várias fases do sono é efectuada através da combinação destes três parâmetros.
Recorrendo à polissonografia, podemos dividir o sono em dois grandes estados que vão alternando entre si ao longo da noite: o sono lento (NREM) e o sono paradoxal (REM). O sono NREM é caracterizado no EEG pela presença de ondas sincronizadas e de grande amplitude (ondas delta). É subdividido em quatro estádios, sendo o último aquele que corresponde o sono mais profundo. O sono REM ao nível do EEG é caracterizado por ondas dessincronizadas e de baixa amplitude.
Após o início do sono a frequência do EEG reduz, a amplitude aumenta e o tónus muscular vai diminuindo gradualmente. Os quatro estádios do sono NREM distinguem-se por um aumento progressivo de ondas de baixa frequência e de grande amplitude, designadas por ondas delta. No sono NREM observa-se um
21
predomínio do sistema nervoso parassimpático com redução da frequência cardíaca, pressão arterial, temperatura corporal e do consumo de oxigénio.
O sono REM segue-se a um período de sono NREM – alternando com este ao longo da noite – e caracteriza-se por altas frequências mistas no EEG, atonia muscular, movimentos oculares rápidos, respiração e batimentos cardíacos irregulares. Contrariamente ao estado de sono anterior, durante o sono REM verifica-se um predomínio do sistema nervoso simpático com uma grande variabilidade da frequência cardíaca e respiratória, além de uma intensa actividade onírica; ou seja, é o período do sono em que sonhamos com maior intensidade e onde os sonhos têm maior riqueza de conteúdo.
O sono NREM e o sono REM alternam entre si, três a seis vezes ao longo da noite, com um intervalo de aproximadamente 90 minutos, com um sono de duração em torno das oito horas. Apesar da alternância entre estas duas fases do sono, na realidade o tempo passado em cada uma delas não é igual (ver tabela 1).
Tabela 1 – Distribuição do sono normal ao longo da noite (adaptado de Carskadon
e Dement, 2005)1
A macroestrutura do sono
O sono inicia-se em fase NREM
O ciclo NREM/REM ocorre 3 a 6 vezes durante a noite com intervalos de 90 a 120 minutos.
A distribuição do sono pelas várias fases ocorre da seguinte forma:
Fase NREM (75-80%) Estádio 1 (2-5%) Estádio 2 (45-55%) Estádio 3 (3-8%) Estádio 4 (10-15%) Fase REM (20-25%) Vigília (<5%)
A maior parte do sono ocorre em fase NREM (cerca de 75-85%), enquanto o restante tempo ocorre em fase REM (cerca de 20-25%) e em fase de vigília (cerca de 5%), embora, na maior parte das vezes, não haja memória para este período.
1Em 2007, a American Academy of Sleep Medicine (AASM) publicou “The AASM Manual for the Scoring of Sleep and
Associated Events” (Iber et al. 2007, http://www.aasmnet.org/), tendo em vista substituir o antigo sistema de classificação do sono de Rechtschaffen e Kales (1968). Neste caso, foi proposto o desaparecimento da fase 4 no sono NREM, procedendo-se à combinação das fases 3 e 4 numa única fase.
No caso do sono lento (NR
longo da noite (designadamente os estádios 3 e 4), ao passo que a duração do ciclo do sono REM vai aumentado ao longo da noite. O primeiro terço da noite é passado quase todo em período de sono lento,
maioritariamente em sono REM.
O hipnograma (fig. 1) é uma representação gráfica das várias fases do sono. Esta é uma forma rápida de visualizar a arquitectura do sono ao longo da noite.
Figura 1 –– Hipnograma normal de um jovem adulto (extraído de Kales
1.2 As alterações do sono na esquizofrenia
Na prática clínica verificamos que, na esquizofrenia, a insónia é uma queixa frequentemente reportada pelos doentes e familiares. A dificul
manter, ou alcançar um sono reparador encontra
da psicopatologia e tem sido referenciada como um sintoma prodrómico da agudização da doença (Tandon
com frequência uma dificuldade em manter um ritmo circa
e adaptado às necessidades socioprofissionais. Este factor compromete o processo reabilitativo uma vez que dificulta o cumprimento dos horários laborais e o ajustamento às actividades sociais. Neste âmbito, para além da doença, devem ser considerados os eventuais efeitos secundários dos antipsicóticos
quando se utilizam doses mais elevadas este desasjustamento, causando, por ex
Corrigir as alterações do sono observadas na esquizofrenia, deve ser considerada uma prioridade terapêutica dado que
22
No caso do sono lento (NREM), a duração de cada ciclo vai-se reduzindo ao longo da noite (designadamente os estádios 3 e 4), ao passo que a duração do ciclo do sono REM vai aumentado ao longo da noite. O primeiro terço da noite é passado quase todo em período de sono lento, enquanto o terço final é passado maioritariamente em sono REM.
O hipnograma (fig. 1) é uma representação gráfica das várias fases do sono. Esta é uma forma rápida de visualizar a arquitectura do sono ao longo da noite.
Hipnograma normal de um jovem adulto (extraído de Kales Kales, 1974)
As alterações do sono na esquizofrenia
Na prática clínica verificamos que, na esquizofrenia, a insónia é uma queixa frequentemente reportada pelos doentes e familiares. A dificuldade em iniciar, manter, ou alcançar um sono reparador encontra-se relacionada com a gravidade da psicopatologia e tem sido referenciada como um sintoma prodrómico da agudização da doença (Tandon et al., 1992, Benson, 2006). Também se observa
frequência uma dificuldade em manter um ritmo circadiano sono
e adaptado às necessidades socioprofissionais. Este factor compromete o processo reabilitativo uma vez que dificulta o cumprimento dos horários laborais e o dades sociais. Neste âmbito, para além da doença, devem ser considerados os eventuais efeitos secundários dos antipsicóticos
quando se utilizam doses mais elevadas
que também poderão contribuir para este desasjustamento, causando, por exemplo, uma excessiva sedação diurna.Corrigir as alterações do sono observadas na esquizofrenia, deve ser considerada uma prioridade terapêutica dado que um sono reparador
se reduzindo ao longo da noite (designadamente os estádios 3 e 4), ao passo que a duração do ciclo do sono REM vai aumentado ao longo da noite. O primeiro terço da noite é o terço final é passado
O hipnograma (fig. 1) é uma representação gráfica das várias fases do sono. Esta é uma forma rápida de visualizar a arquitectura do sono ao longo da noite.
Hipnograma normal de um jovem adulto (extraído de Kales e
Na prática clínica verificamos que, na esquizofrenia, a insónia é uma queixa dade em iniciar, se relacionada com a gravidade da psicopatologia e tem sido referenciada como um sintoma prodrómico da , 1992, Benson, 2006). Também se observa no sono-vigília regular e adaptado às necessidades socioprofissionais. Este factor compromete o processo reabilitativo uma vez que dificulta o cumprimento dos horários laborais e o dades sociais. Neste âmbito, para além da doença, devem ser principalmente que também poderão contribuir para emplo, uma excessiva sedação diurna.
Corrigir as alterações do sono observadas na esquizofrenia, deve ser sono reparador e um
23
adequado ajustamento do ritmo sono-vigília poderá facilitar a integração sócio-profissional e consequentemente proporcionar um maior sucesso no projecto de reabilitação.
As alterações do sono na esquizofrenia podem surgir na fase aguda da doença e persistir, em muitos casos, na fase crónica. Portanto, em doentes que se encontram medicados e estabilizados clinicamente, o que faz supor que possam existir mecanismos fisiopatológicos da própria doença que comprometem o normal desempenho desta importante necessidade fisiológica.
1.2.1 Aspectos subjectivos
As alterações do sono são frequentemente reportadas pelos indivíduos com perturbação psiquiátrica (Krystal, 2006), sendo parte integrante dos critérios de diagnóstico de algumas doenças psiquiátricas graves, incluindo as Perturbações Depressiva Major, Bipolar, Ansiedade Generalizada e Stress Pós-Traumático (APA, 2004).
Tal como acontece com outras perturbações psiquiátricas, a insónia na esquizofrenia tem efeitos negativos importantes no curso da doença, no funcionamento e qualidade de vida dos doentes (McCall et al., 2000; Morin, 2003; Ritsner et al., 2004, Hofstetter et al., 2005, Afonso P, 2008). Neste caso, existe uma dificuldade em iniciar e manter um sono reparador, uma vez que este é prejudicado por múltiplos despertares nocturnos, o que resulta numa diminuição do tempo total de sono (TTS) (Benca et al., 1992; Chouinard et al., 2004). Além disso, o sono é geralmente inquieto e agitado, e os pesadelos são comuns (Benson et al., 2006). A manutenção da insónia poderá favorecer uma inversão do ritmo circadiano nos indivíduos com esquizofrenia, reflectindo-se numa grande sonolência diurna, com tendência para dormir durante o dia e permanecer acordado durante a noite (Krystal et al., 2008). Este aspecto poderá contribuir para uma deterioração no funcionamento social e profissional.
Tem sido sugerida uma associação entre a insónia e a gravidade da psicopatologia apresentada pelos doentes (Neylan et al., 1992; Tandon et al., 1992; Benson et al., 1993; Poulin et al., 2003). Neste contexto, é importante referir que alterações moderadas do sono podem ser consideradas um pródromo de agudização da doença, podendo revelar-se como um prelúdio de um surto psicótico (Dencker, 1986; Tandon et al., 1992; Neylan et al., 1992; Chemerinsky 2002; Poulin et al., 2003; Chouinard et al., 2004; Norwood et al., 2005), o que reforça a
24
necessidade de se valorizar justamente as queixas de insónia reportadas pelos doentes com esquizofrenia.
1.2.2. Aspectos Objectivos
Após se terem levantado várias teorias sobre as perturbações do sono na esquizofrenia e a sua possível influência na psicopatologia, foi através da polisssonografia que se conseguiu estudar finalmente de uma forma objectiva e mais rigorosa as alterações do sono na esquizofrenia. Assim, vários aspectos da arquitectura do sono têm sido estudados, tendo havido um particular interesse na avaliação dos seguintes parâmetros polissonográficos: latência do sono (LS); manutenção do sono, neste caso avaliada através do TTS e da eficiência do sono (ES); sono NREM (estádios 1-4); latência do sono REM (LREM).
a) Sono total, continuidade e manutenção do sono
As queixas subjectivas de insónia têm sido confirmadas pelos estudos objectivos de polissonografia (Benca, 1992; Benson, 2005; Chouinard, 2004). Na fase aguda da doença, foi observada uma diminuição da ES (Tandon et al., 1992; Lauer
et al., 1997), do TTS (Tandon et al., 1992; Keshavan et al., 1996), além de insónia
inicial, média e tardia (Benson, 2006). De facto, quando comparados com o grupo de controlo, os doentes com esquizofrenia apresentam alterações significativas da continuidade do sono, com maior número de despertares nocturnos, permanecendo acordados por um maior período de tempo (Yang et al., 2006).
O aumento da LS, parece ser a alteração mais consistentemente reportada. Enquanto que em indivíduos saudáveis a LS raramente excede os 30 minutos, nos doentes com esquizofrenia observamos com frequência LS superiores a 60 minutos (Benson, 2008; Kathleen et al., 2005). A insónia é reportada durante os períodos de agudização da esquizofrenia podendo inclusivamente preceder o aparecimento dos sintomas da doença (Van Kammen, 1986). Quando a insónia se associa ao agravamento da psicopatologia, nomeadamente dos sintomas positivos e afectivos, acaba por ter uma influência negativa na consolidação da memória, demonstrada através de testes de memória declarativa (Goder, 2004).
Curiosamente, foi referenciada uma correlação positiva entre os níveis de hipocretina – peptídeo que produz um efeito excitatório nos neurónios dopaminérgicos do mesencéfalo – no líquido cefalorraquideano (LCR) e um aumento da LS (Nishino et al., 2002), podendo abrir uma hipótese explicativa do
25
aumento da LS, tendo em conta a importância a neurotransmissão da hipocretina na regulação do sono, mais precisamente como promotor do estado de vigília.
Será ainda de referir que a LS e o número de despertares nocturnos foram relacionadas positivamente com alterações morfológicas cerebrais subjacentes à doença, como o aumento do volume do sistema ventricular e atrofia cortical pré-frontal (Lauer et al., 1997; Keshavan et al., 1991; Van Kammen DP, 1988). Contudo, estes resultados apresentam a limitação de terem sido obtidos através de estudos transversais, devendo-se aguardar por avaliações longitudinais de modo a permitir uma melhor avaliação da correlação destas alterações anatómicas com o início e a manutenção do sono.
b) Fase de NREM
O sono NREM encontra-se frequentemente alterado na esquizofrenia, verificando-se uma diminuição da sua quantidade, mais concretamente do estádio 4 da fase de sono NREM (Lauer, 1997; Keshavan, 1998; Poulin, 2003); facto que foi inclusivamente observado fora do período agudo da doença (Traub, 1972) e em doentes que nunca foram submetidos a terapêutica antipsicótica (Feinberg, 1969). Porém, este achado está longe de ser consistente nos vários estudos publicados (Chouinard et al., 2004). A heterogeneidade das amostras, as diferenças metodologias e a existência de um período prévio de tratamento antipsicótico poderão ajudar a compreender algumas diferenças encontradas.
O sistema serotoninérgico poderá estar implicado na diminuição do sono NREM observada na esquizofrenia. A concentração do metabolito da serotonina, ácido 5-hidroxindolacético no líquido cefalorraquídeo foi correlacionada positivamente com a quantidade do estádio 4 da fase de sono NREM, sugerindo que a serotonina pode ter um efeito modulador desta fase do sono (Bensol et al., 1991).
Observou-se também uma correlação negativa entre o volume ventricular cerebral dos doentes com esquizofrenia e a quantidade de sono NREM, mostrando que a etiologia da redução do sono NREM poderá estar relacionada directa ou indirectamente com a alteração da morfologia cerebral subjacente à doença (Benson et al., 1996). Feinberg (1982) acabou por propor uma teoria explicativa deste achado na polissonografia, estabelecendo uma relação com o modelo de neurodesenvolvimento da esquizofrenia, já que durante a adolescência se verifica uma diminuição acentuada do tempo passado no estádio 4 do sono NREM. No caso da esquizofrenia, os doentes poderiam ter uma disfunção no processo normal
26
de maturação neuronal com um excesso de eliminação sináptica, o que condicionaria uma maior diminuição da actividade de ondas lentas no EEG e uma consequente redução acentuada do estádio 4.
Sabemos que a privação de sono está associada a um aumento significativo do SLP na noite seguinte. Esta resposta homeostática tem um papel de recuperação e restauração do sistema nervoso central (SNC). Contrariamente ao que ocorre em indivíduos saudáveis, os doentes com esquizofrenia não apresentam um aumento da quantidade de SLP (Luby e Caldwell, 1967) o que poderá comprometer algumas funções cognitivas, nomeadamente a consolidação da memória (Gais, 2004).
c) Fase de sono REM
Tal como já foi mencionado anteriormente, e contrariamente ao que se julgava, o sono REM dos doentes com esquizofrenia não se revelou diferente dos indivíduos saudáveis. Também não se verificaram diferenças no sono REM entre doentes com esquizofrenia com e sem actividade alucinatória, o que acabou por desmistificar a ideia de que a esquizofrenia seria uma forma de sonhar acordado (Koresko, 1963).
Apesar disso, a LREM, definida como o período que compreende o início do sono e o aparecimento do primeiro sono REM, encontra-se habitualmente diminuída na esquizofrenia (Taylor et al., 1991; Zarcone et al., 1987; Poulin et al., 2003; Caldwell
et al., 1967), embora tenham surgido vários estudos que não replicaram esta
característica polissonográfica (Chouinard et al., 2004). A divergência dos resultados poderá ser explicada pela falta de controlo de algumas variáveis, nomeadamente o sexo, uma vez que se observaram diferenças entre homens e mulheres no que diz respeito LREM e o prognóstico da doença (Goldman et al., 1996), e a medicação antipsicótica (Tandon et al,. 1992). Neste último caso, a LREM e a percentagem de sono REM estão substancialmente aumentadas durante as primeiras 2-4 semanas em doentes que suspenderam a terapêutica, havendo, porém, uma atenuação desse efeito a partir das 4 semanas. No entanto, Hiatt et al. (1985), verificaram que em doentes não medicados, recentemente hospitalizados, a LREM apresentava-se significativamente diminuída. Porém, decorrido um ano de tratamento, observa-se um aumento da LREM e duração de REM (Keshavan et al., 1996), demonstrando que os antipsicóticos modificam estes parâmetros polissonográficos.
A hipersensibilidade colinérgica foi sugerida como mecanismo neuroquímico subjacente à redução da LREM (Riemann, 1994, Jones et al., 1985). Na esquizofrenia foi demonstrado um aumento da estimulação colinérgica (Tandon e Greden, 1989)
27
o que poderá explicar, pelo menos em parte, este achado polissonográfico. A imagiologia cerebral também deu um contributo para se compreender as alterações da LREM. Através de estudos imagiológicos observou-se uma correlação positiva entre a LREM e os volumes do terceiro ventrículo, do núcleo caudado e do corno anterior (Keshavan et al., 1991). Finalmente, a diminuição da LREM tem sido associada ao aumento da actividade delirante, alucinatória, à desorganização do pensamento e do comportamento (Feinberg et al., 1969; Tandon et al., 1992; Poulin
et al., 2003), relacionando-se com um pior prognóstico da doença (Benson, 2006).
1.2.3. Alterações do Ritmo Circadiano do Sono
Subsistem evidências que suportam o papel do ciclo sono-vigília e o sistema endógeno circadiano na patogénese de várias doenças psiquiátricas, nomeadamente a esquizofrenia (Boivin, 2000). Apesar de não existirem muitos estudos do ciclo sono-vigília na esquizofrenia, recorrendo à actigrafia, dispomos de vários dados que apontam para a existência de alterações do ritmo circadiano do sono, nomeadamente do tipo de avanço de fase e tipo irregular (Afonso, 2008; Wulff
et al., 2006; Martin et al., 2005).
No avanço de fase o indivíduo adormece mais cedo e acorda mais cedo, face à maioria da população. Os indivíduos queixam-se de uma incapacidade para se manterem acordados no início da noite, apresentando ainda uma insónia no final da noite, despertando mais cedo do que o desejado (AASM, 2005). Por sua vez, o padrão irregular do ciclo sono-vigília consiste em episódios variáveis e temporários de padrões de sono e despertar desorganizados. O indivíduo não tem uma hora regular para adormecer e acordar; ou seja, não existe uma distinção clara em termo de ritmo sono-vigília uma vez que o sono é fragmentado por períodos irregulares, podendo haver períodos de vigília durante a noite e períodos de sono durante o dia (AASM, 2005). As alterações ao ciclo sono-vigília originam, entre outros sintomas, insónia ou sonolência excessiva.
O facto de uma grande parte destes doentes não terem uma ocupação leva a que as pistas sociais e profissionais, sincronizadoras do relógio biológico, desapareçam. Este factor comportamental é um elemento que poderá contribuir para a dessincronização do ritmo circadiano do sono.
A melatonina é um importante marcapasso do relógio biológico interno. Uma outra hipótese explicativa deste achado relaciona-se com o facto de os níveis de melatonina encontram-se reduzidos em doentes com esquizofrenia em comparação com indivíduos saudáveis (Ferrier et al., 1982; Faget et al., 1989), Além
28
disso, a hipófise de doentes com esquizofrenia apresenta uma marcada esclerose e gliose(Nieto, 1987)o quepoderá comprometer a síntese de melatonina.
A estabilidade do ritmo circadiano do sono revela-se essencial para um funcionamento social e profissional adequado. A existência de dados que apontam para alterações do ritmo circadiano sono-vigília na esquizofrenia revela que para vários destes doentes torna-se problemático cumprir horários (profissionais, escolares e sociais) dificultando a sua reintegração socioprofissional.
1.2.4. Efeitos da terapêutica no sono
Na generalidade dos casos, os antipsicóticos têm um efeito positivo na melhoria dos padrões de continuidade do sono (Godbout, 2006). O impacto dos antipsicóticos no sono poderá ser, pelo menos parcialmente, explicado pelos seus efeitos nos sistemas dopaminérgico, serotoninérgico, adrenérgico, colinérgico e histaminérgico, diferenciando-se pela sua maior ou menor afinidade para determinado receptor (Bymaster et al., 1996). O bloqueio dos receptores histaminérgicos tem um efeito sedativo e indutor do sono (olanzapina e clozapina). Por sua vez, o antagonismo dos receptores serotoninérgicos, além do efeito sedativo, promove um aumento do SLP (clozapina, olanzapina e risperidona) (Sekine
et al., 1999).
Os efeitos anticolinérgicos associam-se a uma diminuição de REM e a um aumento da LREM (olanzapina e clozapina) (Leonard, 1996; Wilson et al., 2005). A inibição -1 adrenérgica parece ter um efeito indutor do sono e uma tendência para aumentar o sono REM (olanzapina, risperidona e clozapina) (Krystal et al., 2008).
A afinidade para os receptores D2, intermédia (clozapina) ou elevada (haloperidol, olanzapina, risperidona) pode explicar, em parte, o efeito benéfico destes fármacos na qualidade de sono dos doentes com esquizofrenia, embora também estejam envolvidos outros receptores (Monti et al., 2004).
Os efeitos terapêuticos descritos anteriormente poderão ser benéficos nos casos de insónia e/ou alterações na arquitectura do sono. De referir ainda que a descontinuação dos antipsicóticos tem sido associada a uma deterioração progressiva da qualidade de sono (Norwood et al., 2005; Cohrs, 2008). Apesar disso, existem alguns dados contraditórios, já que a terapêutica antipsicótica utilizada no tratamento da esquizofrenia pode ser responsável por efeitos potencialmente adversos no ciclo de sono, nomeadamente a sedação diurna, as alterações no ritmo circadiano e o aumento de peso (Krystal et al., 2008) que, como se irá referir
29
mais à frente, poderá levar a um risco acrescido para a síndrome de apneia do sono.
a) Antipsicóticos Clássicos
Os antipsicóticos de primeira geração, nomeadamente o haloperidol, o tiotixeno e o flupentixol, melhoram algumas medidas de manutenção do sono, induzindo um aumento do TTS, da ES, da LREM e uma diminuição dos despertares nocturnos e da LS. Contudo, não foi observada nenhuma influência significativa no sono lento profundo (Monti e Monti, 2004; Taylor, 1991; Maixner 1998; Nofzinger,1993; Wetter, 1996; Benson, 2006). A DREM, não se encontra habitualmente alterada com a administração de antipsicóticos clássicos (Gaillard et al., 1977; Kaplan et al., 1974; Brannen et al., 1969; Risberg et al., 1975; Feinberg, 1969; Lester et al.; 1971), excepto em doentes com esquizofrenia medicados a longo prazo com doses altas de cloropromazina (Kaplan et al., 1974), tendo-se, neste caso, observado um aumento deste parâmetro polissonográfico juntamente com um aumento do SL. A suspensão súbita do antipsicótico típico haloperidol, após um período prolongado de utilização, origina uma redução no TTS, no estádio 4 do SL, sono REM e DREM, sendo ainda associado nalguns casos a um aumento do estádio 2 do SL e uma diminuição da ES (Nofzinger, 1993; Thaker, 1989).
O princípio fundamental do mecanismo de acção dos antipsicóticos clássicos é a sua afinidade pelos receptores dopaminérgicos (DA) D2. Este bloqueio ao nível da via dopaminérgica nigroestriada pode levar ao aparecimento de efeitos extra-piramidais indesejáveis como a acatísia, distonia, discinésia tardia e parkinsonismo. Portanto, este antagonismo dopaminérgico pode conduzir ao aparecimento da acatísia e da síndrome das pernas irrequietas, o que poderá interferir com a LS e a continuidade do sono (Farde, 1992; Hornyak et al., 2006).
A acatísia manifesta-se pela incapacidade de permanecer quieto e pela necessidade de movimento constante, originando menor disrupção do sono quando comparada com a síndrome das pernas inquietas (Walters et al., 1991). Neste caso, a síndrome de pernas inquietas causa muitas vezes insónia inicial ou disrupção do sono distinguindo-se da acatísia pela presença de desconforto e inquietude motora dos membros inferiores e pela variabilidade circadiana dos sintomas, que tendem a agravar-se durante o sono e/ou em repouso (Norwood et
al., 2005). Importa referir que estes efeitos secundários, com impacto no sono, não são exclusivos dos antipsicóticos clássicos uma vez que também já foram descritos nos antipsicóticos atípicos (Kraus, 1999; Wetter, 2002). Os dados disponíveis sobre a
30
prevalência do síndrome das pernas inquietas e movimentos periódicos do sono na esquizofrenia são contraditórios e não permitem associar aumento de risco para patologias (Cohrs, 2008).
Por último, a sedação é outro efeito secundário frequentemente associado aos antipsicóticos típicos, responsável pelo aparecimento de sonolência diurna significativa (Lieberman et al., 2005) que nesta população de doentes varia entre 24% a 31% (Benson, 2008).
b) Antipsicóticos Atípicos
Actualmente, os antipsicóticos atípicos são os fármacos de primeira linha para o tratamento da esquizofrenia, apresentando menos efeitos secundários extrapiramidais, face aos antipsicóticos clássicos. Existem evidências que associam esta nova geração de antipsicóticos a uma maior eficácia no tratamento dos sintomas negativos e défices cognitivos quando comparados aos antipsicóticos clássicos (APA, 2004).
Em termos gerais o antipsicóticos atípicos aumentam o TTS e a ES (Benson, 2006; Krystal et al., 2007; Cohrs, 2008). Com base no perfil farmacológico 5-HT2, a risperidona, olanzapina, ziprazidona e clozapina também têm efeitos sedativos importantes, salientando-se que a sedação diurna constitui o efeito adverso mais comum da clozapina (Krystal et al., 2008).
A quetiapina e a ziprazidona têm maior capacidade para induzir o sono sem causar sedação diurna. Estas diferenças reflectem, entre outros factores, o tempo de semi-vida curta de ambos os fármacos, 6 h e 4-10 h respectivamente (Markowitz
et al., 1999). A clozapina aumenta o TTS, a ES, o estádio 2, tendo diminuído o SLP,
principalmente devido à redução do estadio 4, a LS, e os despertares nocturnos (Benson, 2008; Krystal et al., 2008; Monti et al., 2004). Enquanto que a olanzapina provoca um aumento TTS, ES, no estádio 2, SLP, LREM e uma diminuição no estádio 1 (Salin-Pascual et al., 1999; Monti et al., 2004; Krystal et al., 2007). Por sua vez, a risperidona origina um aumento significativo do SLP (Monti et al., 2004). Já o efeito da paliperidona no padrão de sono relacionou-se com o aumento da ES, TTS, estádio 2 e TREM, e uma diminuição da LS, estádio 1 e dos despertares nocturnos (Luthringer et al., 2007). Relativamente à quetiapina, ficou demonstrada a sua capacidade em melhorar o TTS, ES e LS (Cohrs et al., 2004). A ziprazidona relacionou-se com um aumento do TTS, ES, TS, LREM, SLP além de um aumento da qualidade de sono (Cohrs et al., 2005). Foi relatada também uma diminuição do sono REM e dos despertares nocturnos (Demartinis, 2007).
31
A substituição de um antipsicótico clássico por um atípico parece relacionar-se com uma melhor qualidade subjectiva do sono e com a melhoria dos sintomas negativos (Cohrs, 2008; Monti et al., 2005). Apesar de estarem associados a menos efeitos extra-piramidais, estes novos antipsicóticos com frequência dão origem a alterações no metabolismo glucídico, lipídico, e consequentemente a um aumento de peso (Newcomer, 2005). A obesidade provocada pelo aumento do peso varia com o antipsicótico instituído, sendo a clozapina e a olanzapina aqueles que mais se associam a este efeito secundário (Conley, 2007). Este é um aspecto importante que deve ser considerado na escolha do antipsicótico dado que o risco de aumento de peso que esta classe de medicamentos apresenta pode aumentar a prevalência da síndrome de apneia do sono, uma vez que esta foi relacionada com o aumento do índice de massa corporal, sexo masculino e a utilização a longo prazo de antipsicóticos (Winkelman, 2001).
c) Melatonina
A melatonina é uma hormona secretada pela hipófise e que tem sido utilizada no tratamento de insónias associadas a alterações da sua secreção. Em indivíduos saudáveis, a melatonina é responsável pela regulação do ritmo circadiano (efeito cronobiótico). A sua síntese é inibida pela luz, observando-se concentrações séricas muito baixas durante o dia, mas que vão aumentado progressivamente durante a noite. Ocorre habitualmente um pico em torno das 04.00 h, diminuindo progressivamente na segunda parte da noite, tornando-se praticamente indetectável no início da madrugada. A melatonina encontra-se também envolvida na neurogénese, imunomodelação, metabolismo lipídico e eliminação de radicais livres (Maldonado et al., 2009).
Vários estudos têm demonstrado que o aumento nocturno desta hormona, não ocorre da mesma forma em doentes com esquizofrenia (Monteleone et al., 1992; Vigano et al., 2001) podendo estar comprometida a sua síntese (Afonso et al., 2010), o que poderá ajudar a explicar as alterações do ritmo circadiano observadas na esquizofrenia. Em face destes dados, a melatonina administrada por via oral poderá apresentar-se como uma estratégia possível na abordagem das alterações do ritmo circadiano em doentes com esquizofrenia (Shamir et al., 2000), tendo-se mostrado eficaz no aumento da ES e TTS (Benson, 2008). O papel da melatonina na regulação do ciclo sono-vigília será desenvolvido mais à frente.
32 d) Benzodiazepinas
As benzodiazepinas têm um efeito hipnótico, reduzem a LS, o número de despertares nocturnos e aumentam o TTS. Os dados da polissonografia mostram ainda que este medicamento diminuiu habitualmente o estádio 3 e 4 do sono NREM e o sono REM (Parrino et al., 1996). Apesar de ter sido documentada uma melhoria no ciclo sono-vígilia, na maioria dos doentes tratados com antipsicóticos, alguns relataram insónia residual (Lieberman, 2005). Nestes casos, as benzodiazepinas poderão ser utilizados durante um período limitado de tempo, dado o risco de dependência, embora com alguma precaução particularmente no caso de existirem co-morbilidades (ex: apneia obstrutiva do sono, consumo de álcool e/ou de substâncias ilícitas, etc). Simultaneamente ao uso de benzodiazepinas devem ser reforçadas as medias de higiene do sono, evitando-se, deste modo, o abuso e a dependência destas substâncias.
As diferenças dos resultados encontrados nos estudos, recorrendo à polissonografia, e a dificuldade que por vezes existe em encontrarem-se resultados consistentes, devem-se a múltiplos factores que passam, por exemplo, pela heterogeneidade da esquizofrenia, com os seus vários sub-tipos, o tempo de evolução da doença, a idade dos portadores, o número reduzido de algumas amostras, a fase da doença em que é realizada a observação (aguda ou crónica) e os diversos tipos de antipsicóticos utilizados.
1.3 A Melatonina e o Sono
1.3.1 Síntese e regulação
A melatonina (N-acetil-5-metoxitriptamina), isolada pela primeira vez por Aaron Lerner (1958), é uma hormona sintetizada principalmente pela hipófise a partir do aminoácido triptofano. Após os pinealócitos captarem o triptofano circulante, este é transformado em hidroxitriptofano (5HTP) pela enzima triptofano 5-hidroxilase. Depois uma descarboxilase de aminoácidos aromáticos inespecífica transforma o 5HTP em serotonina (5-hidroxitriptamina). Seguidamente a serotonina é N-acetilada pela aril-alquil-N-acetiltransferase (AANAT) produzindo N-acetil serotonina (NAS). A AANAT é a enzima passo-limitante da síntese de melatonina (Klein e Moore, 1979). O passo final da síntese da melatonina ocorre quando a enzima hidroxindol-O-metiltransferase (HIOMT) transforma a NAS em melatonina.
33
Contrariamente ao que é habitual com outros órgãos endócrinos, a melatonina não é armazenada para ser libertada posteriormente, sendo rapidamente libertada dos pinealócitos para a corrente sanguínea (Arendt, 2000) e para o líquido cefalorraquídeo, através do terceiro ventrículo (Tricoire et al., 2002), sendo rapidamente distribuída pelos vários tecidos do nosso organismo. Neste caso, o perfil plasmático da melatonina reflete o nível da sua síntese na hipófise (Reiter, 1991).
A síntese de melatonina tem um ritmo circadiano bem definido, sendo praticamente indetectável durante o dia, aumentando progressivamente durante a noite, com um pico de secreção em torno das 03.00-04.00h. A sua concentração sérica nocturna atinge valores entre 10-80 µg (Geoffriau et al., 1999).
A quantidade de melatonina produzida é determinada geneticamente. Assim, indivíduos com a mesma idade poderão apresentar variações significativas da concentração desta hormona durante a noite, altura em que existe um aumento da sua produção. Enquanto uns apresentam uma subida significativa das concentrações séricas de melatonina nocturnas, outros mantêm valores muito baixos (melatonin low producers). As explicações para este achado são ainda desconhecidas (Reiter, 2002).
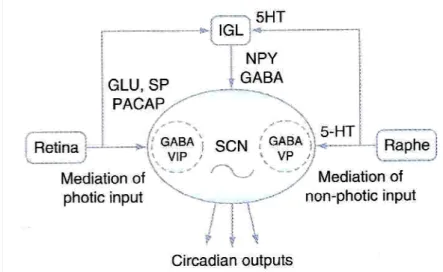
O núcleo supraquiasmático, localizado na região anterior do hipotálamo, é o marcapasso circadiano da secreção de melatonina para a corrente sanguínea (Klein e Moore, 1979). O ciclo luz/escuridão é o principal Zeitgeber (dador de tempo) para o ritmo circadiano de libertação desta substância. As tradicionais células fotoreceptoras (cones e bastonetes) não se encontram directamente envolvidas na percepção da luz que modula a produção de melatonina na hipófise. Neste caso, existem neurónios especializados com um fotopigmento específico na retina que responde à luz (Brainard et al., 2001; Foster e Hankins, 2002).
A luz inibe a síntese de melatonina. Intensidades luminosas de 2000-2500 lux aplicadas durante 2h (02:00-04:00h) suprimem por completo a secreção de melatonina, enquanto a iluminação doméstica (50-300 lux) tem apenas um modesto efeito inibitório (Bojkowski et al., 1987).
A acção inibitória da luz sobre a hipófise é mediada da seguinte forma: após o estímulo luminoso, essa informação é transferida para o hipotálamo anterior, através dos axónios das células ganglionares da retina do nervo óptico, constituindo uma parte do tracto retino-hipotalâmico, que irão ligar-se ao núcleo supraquiasmático (Cassone e Nateson, 1997). Por sua vez, do núcleo
34
supraquiasmático partem projecções inibitórias para o núcleo paraventricular, onde conexões da porção subparaventricular se ligam ao núcleo dorsomedial do hipotálamo. Também do núcleo paraventricular partem fibras eferentes criando sinapases com neurónios ganglionares simpáticos da medula espinal. Estes conectam-se com os neurónios pós-ganglionares simpáticos do gânglio cervical superior que envia fibras noradrenérgicas à hipófise. A estimulação noradrenérgica ocorre durante a noite, aumentando os níveis de AMP cíclico nos pinealócitos que por sua vez induz a expressão de N-acetiltransferase, resultando na síntese de melatonina (Moller et al., 2002).
Além deste mecanismo, existem outras moléculas envolvidas no controlo da síntese da melatonina: acetilcolina, polipeptídio intestinal vasoativo (VIP), neuropeptídeo Y (NPY) e o polipetídeo activador da adenil ciclase (PACAP), embora os processos de regulação ainda sejam pouco conhecidos (Simmonneaux e Ribelayga, 2003).
Os fármacos também podem interferir com a síntese de melatonina. Os bloqueadores beta1 adrenérgicos, alfa 2 adrenérgicos, (por exemplo, a clonidina), e o ácido valpróico através da activação dos receptores do ácido gama-aminobitírico (receptores GABA), suprimem a síntese nocturna de melatonina. Existem ainda fármacos com efeito contrário, reforçando neste caso a sua síntese, através do aumento da disponibilidade sináptica de catecolaminas, como é o caso dos inibidores da monoaminooxidase e dos antidepressivos triciclicos (Claustrat et
al., 2005; Monteleone et al., 1997).
Em suma, o controlo da síntese é efectuado através da via gabaérgica inibitória, da estimulação glutamatérgica do núcleo paraventricular e da estimulação noradrenérgica da hipófise (Perrreau-Lenz Sa et al., 2003; Perrreau-Lenz Sb et al., 2004; Reppert et al., 1981; Klein et al., 1979).
1.3.2 Catabolismo e excreção
A melatonina circula na corrente sanguínea maioritariamente e as suas características de hidrossolubilidade e lipossolubilidade facilitam a sua passagem através das membranas celulares (Pardridge e Mietus, 1980). A semi-vida da melatonina quando administrada por via oral é cerca de 20 minutos (Claustrat et
al., 2005). A sua metabolização é maioritariamente hepática, sendo hidroxilada, convertida em 6-hidroximelatonina, conjugada com sulfatos ou com glucoronídeos e excretada na urina (Skene et al., 2001). A quantificação da forma sulfatada, 6-sulfatoxi-melatonina, excretada na urina, é um excelente marcador da secreção de