UNIVERSIDADE FEDERAL DE VIÇOSA
CENTRO DE CIÊNCIAS EXATAS E TECNOLÓGICAS
DEPARTAMENTO DE QUÍMICA
MÁRCIA GONÇALVES MONTEIRO
DESENVOLVIMENTO DE MATERIAIS INSTRUCIONAIS
VOLTADOS AO ENSINO DE ELETROQUÍMICA
UNIVERSIDADE FEDERAL DE VIÇOSA
CENTRO DE CIÊNCIAS EXATAS E TECNOLÓGICAS
DEPARTAMENTO DE QUÍMICA
MÁRCIA GONÇALVES MONTEIRO
DESENVOLVIMENTO DE MATERIAIS INSTRUCIONAIS
VOLTADOS AO ENSINO DE ELETROQUÍMICA
Monografia apresentada ao Departamento de
Química da Universidade Federal de Viçosa,
como parte das exigências para a conclusão do
Curso de Licenciatura em Química.
Orientador: Prof. Efraim Lázaro Reis
i
UNIVERSIDADE FEDERAL DE VIÇOSA
CENTRO DE CIÊNCIAS EXATAS E TECNOLÓGICAS
DEPARTAMENTO DE QUÍMICA
MÁRCIA GONÇALVES MONTEIRO
DESENVOLVIMENTO DE MATERIAIS INSTRUCIONAIS
VOLTADOS AO ENSINO DE ELETROQUÍMICA
Monografia aprovada em 28 de junho de 2018.
Profª. Odilaine Inácio de Carvalho Damasceno
Colégio de Aplicação – Cap – Coluni (Membro da banca avaliadora)
Profº. César Reis
Departamento de Química - UFV (Membro da banca avaliadora)
Profª. Efraim Lázaro Reis Departamento de Química – UFV
(Orientador)
Profº. Vinícius Catão Assis Souza Departamento de Química – UFV
ii
AGRADECIMENTOS
Agradeço, primeiramente, a Deus, por ter me dado forças para chegar até aqui. Por me fazer acreditar que sou capaz. Por ter me dado paciência e sabedoria para enfrentar os obstáculos que surgiam pelo caminho.
Agradeço imensamente à minha mãe, Efigênia, e ao meu irmão, Marcio, por todo apoio e incentivo. Por não desistirem de mim. Por acreditarem em mim. Só eles sabem quão difícil foi essa luta e quanto eu sofri e enfrentei para chegar até aqui. Mas hoje eu vejo e digo: tudo só foi possível com vocês ao meu lado. Sem vocês, eu não conseguiria! Obrigada, meus amores. E ao meu pai, que também não desistiu de mim, e que de alguma forma tem orgulho de mim.
Agradeço à minha tia Aparecida, às minhas primas Juliana e Jaqueline e, ao meu primo Giovani, por também não desistirem de mim. Ao meu tio João Bosco, que mesmo não estando mais entre nós, mas que eu tenho certeza, onde ele estiver, estará orgulhoso de mim. Agradeço a vocês por sempre estarem ao meu lado. Por toda força que me deram. Que continuemos sempre unidos. Na tristeza e na alegria. Obrigada por serem a minha família.
Agradeço também aos amigos que a UFV me deu. Vocês foram essenciais na minha vida acadêmica. Faço um agradecimento em especial à Claudinéia. Você está sempre me ajudando. Sem você eu estaria perdida. Obrigada por tudo.
Ao Professor Efraim Lázaro Reis por me orientar neste trabalho, por me socorrer todas as vezes em que precisei, por estar sempre pronto a ajudar. Obrigada por tudo.
Ao Professor Vinícius Catão Assis Souza pelos ensinamentos e contribuições oferecidos durante a graduação.
iii
RESUMO
Este trabalho consiste em desenvolver atividades experimentais com materiais didáticos alternativos de baixo custo que colaborem para o Ensino de Eletroquímica, a fim de favorecer a compreensão dos conceitos discutidos em sala de aula, bem como analisar o desempenho e interesse dos alunos nas atividades e, desse modo, contribuir com o processo de ensino e aprendizagem. As propostas de atividades experimentais foram desenvolvidas para uma abordagem contextualizada e investigativa através da elaboração de uma Sequência Didática para o Ensino de Eletroquímica, contendo levantamento das concepções prévias dos alunos através de questionários, textos para leitura e discussão, aplicação de vídeos e um questionário final para verificar o ensino e aprendizagem. A montagem da Célula Galvânica baseia-se em uma proveta central contendo uma solução salina e outros baseia-seis tubos de ensaio periféricos presos ao seu redor, cada tubo com o eletrodo e a solução dos respectivos íons. A elaboração dos eletrodos para as Células Galvânicas foi realizada utilizando materiais alternativos simples e facilmente disponíveis no cotidiano. As Pontes Salinas (tubos em “U”) que, são os contatos entre as soluções dos metais e a solução da proveta, foram feitas a partir de tubos de vidro cortados. Para as medidas das diferenças de potencial das celas galvânicas será utilizado um pHmetro, na escala de milivolts. A montagem da Célula Eletrolítica foi feita a partir de dois eletrodos de grafite, retirados do interior de pilhas descarregadas, tubo de caneta esferográfica, uma solução salina e um indicador ácido-base apropriado para visualização do processo. A fonte de energia, utilizada na Célula Eletrolítica e na Condutância, foi obtida a partir de um carregador de celular, já inutilizado, o qual teve o conector do aparelho retirado. No Medidor de Condutância foi utilizada uma lâmpada de LED como sendo o indicador de corrente elétrica e tubos de canetas esferográficas que servirão como suporte para os dois eletrodos de grafite retirados de pilhas descarregadas. Os materiais desenvolvidos podem colaborar para o ensino e aprendizagem, bem como contribuir para o interesse dos alunos pela Ciência/Química, bem como ser aplicados em turmas do 2º ano do Ensino Médio, tanto em escolas públicas quanto em escolas privadas, uma vez que foram utilizados materiais de baixo custo e que os mesmos podem ser facilmente transportados. A Sequência Didática desenvolvida para essa pesquisa apresenta-se como uma alternativa metodológica para o ensino do conteúdo de Eletroquímica podendo ser adaptada e trabalhada em qualquer espaço físico. Com isso, espera-se que os alunos sejam motivados a aprenderem o conteúdo de Eletroquímica e que o mesmo possa ser facilitado, tornando a aprendizagem mais efetiva através da abordagem do conhecimento e da experimentação.
iv
ABSTRACT
This work is to develop experimental activities with alternative teaching materials inexpensive to collaborate for Electrochemical education in order to promote understanding of the concepts discussed in class, as well as analyze performance and students' interest in activities, and that contribute to the teaching and learning process. Proposals for experimental activities have been developed for a contextualized and investigative approach by developing a Didactic Sequence for Electrochemistry Teaching containing survey of preconceptions of students through questionnaires, texts for reading and discussion, application videos and a final questionnaire to verify teaching and learning. The Galvanic Cell assembly is based on a central cylinder containing a saline solution and six other peripheral test tubes attached to it, each tube with the electrode and the solution of the respective ions. The elaboration of the electrodes for the Galvanic Cells was carried out using alternative materials simple and easily available in daily life. The Saline Bridges ("U" tubes), which are the contacts between the solutions of the metals and the solution of the test tube, were made from cut glass tubes. For the measurements of the potential differences of the galvanic cells, a pH meter will be used, in the millivolt scale. The assembly of the electrolytic cell was made from two graphite electrodes, taken from inside battery unloaded, one ballpoint pen tube, salt solution and acid-base indicator suitable for process visualization. The energy source, used in the Electrolytic Cell and the Conductance cell, was obtained from a cellphone charger, which had already been used, which had the connector of the device removed. In the Conductance Meter an LED lamp was used as the indicator of electric current and tubes of ballpoint pens that will serve as support for the two graphite electrodes removed from discharged batteries. The materials developed can contribute to the teaching and learning as well as contribute to the students' interest in Science/Chemistry, as well as be applied to groups of the 2nd year of high school, both in public schools and in private schools, since they are materials that they can be easily transported. The Didactic Sequence developed for this research presents itself as a methodological alternative for teaching the content of Electrochemistry and can be adapted and worked in any physical space. With this, students are expected to be motivated to learn the content of Electrochemistry and that it can be facilitated, making learning more effective through the approach of knowledge and experimentation.
v
SUMÁRIO
1 INTRODUÇÃO ... 1
1.1 Justificativa ... 2
2 OBJETIVOS ... 3
2.1 Objetivo Geral ... 3
2.2 Objetivos Específicos ... 3
3 REFERENCIAL TEÓRICO ... 3
3.1 Experimentação no Ensino de Química ... 3
3.2 O Ensino de Eletroquímica ... 4
4 METODOLOGIA ... 5
4.1 Elaboração dos Eletrodos das Células Galvânicas ... 5
4.2 Preparo das Soluções ... 6
4.3 Elaboração da Ponte Salina ... 6
4.4 Elaboração das Células Galvânicas ... 7
4.5 Elaboração Das Células Eletrolíticas ... 8
4.6 Elaboração Do Medidor De Condutância ... 8
4.7 Sequência Didática ... 9
5RESULTADOS E DISCUSSÕES ... 10
5.1 Células Galvânicas Múltiplas ... 10
5.2 Eletrólise no Tubo em “U” ... 13
5.3 Medidor de Condutância ... 14
6 CONSIDERAÇÕES FINAIS ... 15
7 REFERÊNCIAS BIBLIOGRÁFICAS ... 16
ANEXOS ... 20
Anexo A.1 – Parte 1: Plano de Aula (Células Galvânicas) ... 20
Anexo A.2 – Questionário 1 ... 22
Anexo A.3 – Texto: Como é feita a reciclagem de pilhas e baterias? ... 23
Anexo A.4 – Roteiro Aula Prática ... 25
vi
Anexo B.1 - Questionário 2 ... 29
Anexo B.2 – Texto: Etanol e hidrogênio: uma parceria de futuro para o Brasil ... 30
Anexo B.3 – Roteiro Aula Prática ... 32
Anexo C – Parte 3: Plano de Aula – Condutância ... 33
Anexo C.1 – Questionário 3 ... 35
Anexo C.2 – Texto: Efeitos da Corrente Elétrica no Corpo Humano ... 36
Anexo C.3 – Roteiro Aula Prática... 37
1
1 INTRODUÇÃO
A disciplina de Química faz parte do programa curricular do Ensino Fundamental e Médio e o seu aprendizado deve envolver a compreensão tanto dos processos químicos em si quanto da construção do conhecimento científico, relacionando-os com suas aplicações tecnológicas, bem como suas implicações ambientais, sociais, políticas e econômicas. Esse aprendizado deve ser promovido de maneira ampla e adaptada, por meio da interdisciplinaridade, bem como da contextualização e da investigação, para que os alunos sejam capazes de tomar decisões enquanto indivíduos e cidadãos, desde que seja possível relacionar os conhecimentos socialmente pertinentes, que façam sentido e que dialoguem com o cotidiano (PCNEM, 1999).
Entretanto, Bueno et al. (2007) ressaltam que se não houver uma conexão entre teoria e prática, os conteúdos não terão muito sentido ou pouco contribuirão para o desenvolvimento cognitivo dos alunos. Porém, os autores afirmam que o Ensino de Química não oferece condições para favorecer a compreensão dos conceitos e nem a sua aplicação no dia-a-dia dos estudantes.
Com a realização de experimentos, “os alunos podem ir além da observação direta e da manipulação dos aparatos do laboratório, desde que a eles sejam
oferecidas condições para que possam levantar hipóteses e testar suas ideias sobre
os fenômenos científicos ali presentes” (BUENO; KOVALICZN, 2008, p.2). Em função disso, Bizzo (2002) argumenta que:
(...) a experimentação é um elemento essencial nas aulas de Ciências, mas que ela, por si só, não garante um bom aprendizado. Pois a simples realização de um experimento não é suficiente para modificar a forma de pensar dos alunos. Isso significa que a realização de experimentos é uma tarefa importante, mas não dispensa o acompanhamento do professor, que deve pesquisar quais são as explicações apresentadas pelos alunos para os resultados encontrados. (BIZZO, 2002, p. 75)
2 (2009), nas quais abordam a experimentação no ensino de Ciências/Química propõem alternativas para realização de experimentos simples, bem como para a utilização de materiais de fácil aquisição, aparatos simples e de fácil manuseio.
1.1 JUSTIFICATIVA
O presente trabalho foi baseado no conteúdo de Eletroquímica devido “a sua relevância no mundo físico e, por estabelecer estreitas relações com o dia – a – dia do
aluno, com suas experiências diárias e com seus conhecimentos prévios. Além disso,
a mesma é vista, pelos alunos, como um conteúdo de difícil compreensão, tendo sido
apontadas dificuldades conceituais” (SANJUAN et al., 2009, p.190). Desse modo, faz -se necessária a busca por uma metodologia de ensino que auxilie na aprendizagem desse assunto e que faça com que os alunos tenham a atenção voltada para o tema abordado.
Por outro lado, é possível aproximar o conteúdo de Eletroquímica, segundo Barreto (2016), do cotidiano do aluno por meio de suas aplicações e explicitar os fenômenos numa abordagem investigativa, a fim de mostrar, por exemplo, como ocorre o processo de Eletrodeposição (ou Galvanoplastia). Visto que muitos utensílios domésticos, bijuterias, peças de automóveis, ferramentas, dentre outros, são revestidos por uma camada de metal tal como ouro, prata, zinco, estanho ou cromo, protegendo-os contra a corrosão.
Nessa perspectiva, este trabalho mostrará como a construção de materiais alternativos, de baixo custo, podem contribuir para a compreensão do conteúdo de pilhas e reações de oxirredução, bem como Eletrólise e Condutância. Para verificar a compreensão dos alunos, foi elaborada uma Sequência Didática com questionários investigativos com questões sobre o dia-a-dia dos alunos, textos para leitura e discussão e, aplicação de vídeos para melhor entendimento dos temas abordados em sala de aula.
3
2 OBJETIVOS
2.1 OBJETIVO GERAL
O objetivo da presente pesquisa é desenvolver atividades experimentais com materiais didáticos alternativos de baixo custo que colaborem para o Ensino de Química abordando, principalmente, o conteúdo de Eletroquímica, a fim de favorecer a compreensão dos conceitos discutidos em sala de aula, bem como analisar o desempenho e interesse dos alunos nas atividades e, desse modo, contribuir com o processo de ensino e aprendizagem.
2.2 OBJETIVOS ESPECÍFICOS
• Elaborar materiais alternativos de baixo custo e fácil acesso;
• Elaborar uma Sequência Didática voltada ao Ensino de Eletroquímica; • Despertar o interesse e motivação dos alunos;
• Contribuir na melhoria do processo ensino e aprendizagem;
• Avaliar o desempenho dos alunos através de um questionário final com questões envolvendo o conteúdo de Eletroquímica.
3 REFERENCIAL TEÓRICO
3.1 EXPERIMENTAÇÃO NO ENSINO DE QUÍMICA
A ementa de Eletroquímica é extensa e conteudista, favorecendo a memorização de conceitos, símbolos, fórmulas, regras e cálculos intermináveis. Estudos revelam que os alunos têm dificuldades em acompanhar a transição de níveis de representações macroscópica, submicroscópica e simbólica (RAUPP et al., 2009). No entanto, é importante ressaltar que
essa realidade vem em forma de testes, provas e exercícios, na qual só se vê uma mera repetição gerando uma repulsa e falta de interesse pela disciplina. Há uma explícita desconexão entre os conteúdos científicos e o mundo real, os quais são apresentados em formato “finalizado”, sem nenhuma discussão sobre os processos de construção do conhecimento. Em tais aulas não ocorre a contextualização fazendo com que o aluno tenha um menor engajamento em seu aprendizado. (FOUREZ, 2003 apud VIEIRA, 2011)
Em função disso, vale ressaltar que é importante “utilizar formas alternativas de ensino sempre tentando despertar o interesse, o raciocínio e o entendimento dos
4 facilita a visualização e compreensão de fenômenos, motiva os alunos a aprender os conteúdos estudados em sala de aula e, desse modo, eles são conduzidos a pensar de forma a construírem o conhecimento a partir de situações que os façam refletir sobre o mundo que os cercam, além de despertar o interesse por disciplinas de exatas.
Diante disso, pode-se afirmar que “estas visões de ensino experimental ampliam as possibilidades de interação professor-aluno e aluno-objeto, na perspectiva
de se obter eficiência no processo ensino e aprendizagem” (BARBOSA et al., 1999, p.107). Com isso, é possível proporcionar aos alunos do Ensino Médio experimentos que empregam materiais existentes em seu cotidiano, sem prejudicar os objetivos e metas da aprendizagem, por meio da construção de equipamentos alternativos de baixo custo e fácil aquisição.
3.2 O ENSINO DE ELETROQUÍMICA
Uma das ramificações da Química enquanto Ciência, de extrema importância para a formação do indivíduo, é a Eletroquímica. A mesma é capaz de interagir e contribuir para o desenvolvimento da sociedade devido a sua vasta aplicabilidade no cotidiano. As pilhas e baterias são cada vez mais utilizadas em nossas vidas e esses dispositivos estão presentes em laptops, brinquedos, lanternas, celulares, filmadoras, barbeadores, câmeras fotográficas, relógios, calculadoras, instrumentos de medição e aferição, equipamentos médicos, dentre outros.
Ao abordar o conteúdo de Eletroquímica no Ensino Médio, “pode-se realizar uma relação das pilhas e o meio ambiente e assim destacar que pilhas comuns,
muitas vezes, são eliminadas inadequadamente”, uma vez que os resíduos existentes nas pilhas são tóxicos à saúde e ao meio ambiente (SILVA et al., 2016, p.238). Alguns desses conteúdos também “são considerados difíceis e complexos para professores e, eles mesmos revelam que deixam o tópico de Eletroquímica para o último semestre,
pois já sabem que não terão tempo de executá-lo e que, desse modo, ficam livres dessa parte da matéria” (SANJUAN et al., 2009, p.191).
5 Uma das principais características relacionadas ao ensino de Ciências/Química é a “falta de interesse decorrente, principalmente, da metodologia de ensino tradicional empregado que muitas vezes se resume a cálculos matemáticos, memorização de fórmulas e regras de nomenclatura, sem valorizar os aspectos conceituais” (LIMA et al., 2000, p.26), visando apenas o preparo para concursos e vestibulares. Como consequência, tem-se um ensino que se coloca afastado da realidade do aluno, o que leva a questionamentos por parte do mesmo a respeito do estudo de Química.
Ao longo dos anos o Ensino de Ciências tem sido considerado desestimulante e sem sentido pela maioria dos alunos do Ensino Médio. Assim, entende-se que “para que o pensamento científico faça parte do aluno como uma prática cotidiana é
necessário que a Ciência esteja ao seu alcance, que o conhecimento tenha sentido,
ou seja, que possa ser utilizado na compreensão da realidade” (BUENO; KOVALICZN, 2008, p.5). A partir dessa reflexão, pode-se dizer que a realização de experimentos é uma excelente ferramenta utilizada para que os alunos possam compreender o conteúdo e estabelecer uma relação entre teoria e prática.
4 METODOLOGIA
Todo o desenvolvimento dos materiais foi feito em conjunto com alunos do Programa Institucional de Bolsas de Iniciação Científica Júnior (Pibic Jr), o qual tem como objetivo despertar interesse pela pesquisa científica nos estudantes do Ensino Médio da Rede Pública. No entanto, as atividades desenvolvidas devem ser orientadas por um pesquisador especializado, em instituições de Ensino Superior ou Institutos de Pesquisas.
O material desenvolvido foi elaborado para ser aplicado em Escolas Estaduais/Federais/Privadas de Viçosa – Minas Gerais, podendo ser apresentado às turmas do 2º ano do Ensino Médio, nas quais será utilizada como uma estratégia de ensino mais diversificada, uma Sequência Didática voltada aos conteúdos de Eletroquímica.
4.1 ELABORAÇÃO DOS ELETRODOS DAS CÉLULAS GALVÂNICAS
6 uma tesoura. Já o fio de cobre e o bastão de ferro foram cortados com auxílio de um alicate em pedaços de aproximadamente 12 cm.
Figura 1. Eletrodos metálicos utilizados nas Células Galvânicas Múltiplas.
4.2 PREPARO DAS SOLUÇÕES
As soluções dos respectivos íons metálicos dos eletrodos mencionados acima foram preparadas a partir de nitratos e sulfatos: Mg(NO3)2.6H2O (98%, Merck), Pb(NO3)2.6H2O (99%, Sigma Aldrich), Zn(NO3)2.6H2O (98%, Vetec), AgNO3 (99%, Impex), CuSO4.5H2O (98%, Sigma Aldrich), FeSO4.7H2O (99%, Sigma Aldrich) resultando numa concentração 0,1 mol/L dos metais em estudo.Para a Ponte Salina e para a Condutância, foi preparada uma solução de KNO3 (99%, Sigma Aldrich) 0,1 mol/L. Já para as Células Eletrolíticas, foi preparada uma solução de Na2SO4 (99%, Sigma Aldrich) 0,5 mol/L.
4.3 ELABORAÇÃO DA PONTE SALINA
7
Figura 2. Tubos em “U” utilizados como Ponte Salina.
4.4 ELABORAÇÃO DAS CÉLULAS GALVÂNICAS
Para a montagem da Célula Galvânica Múltipla (Figura 3), foi utilizada como suporte uma proveta central, na qual foram fixados seis tubos de ensaio com auxílio de gomas de elástico. Na proveta central foi adicionada uma solução de KNO3 0,1 mol/L e em cada um dos tubos periféricos foi adicionada uma solução contendo os íons do respectivo eletrodo metálico.
Desta forma, foram obtidas 15 pilhas diferentes por meio de uma Combinação Matemática de seis elementos tomados dois a dois, resultando num total de 15 combinações diferentes. Para medir a diferença de potencial das pilhas foi utilizado um potenciômetro, o qual foi conectado, por meio de garras do tipo “jacaré”, aos eletrodos que foram testados, na escala de milivolts. Na ausência do mesmo, pode-se utilizar um multímetro digital simples.
(a) (b)
8
4.5 ELABORAÇÃO DAS CÉLULAS ELETROLÍTICAS
Para a montagem da Célula Eletrolítica foram utilizados dois eletrodos de grafite (Figura 4a), retirados do interior de pilhas alcalinas descarregadas, fios metálicos, dois tubos de canetas esferográficas e uma solução de sulfato de sódio 0,5 mol/L. Esta foi adicionada ao tubo em “U”, o qual foi fixado por uma garra, sendo apoiado por um suporte (Figura 4b) e, posteriormente, os eletrodos foram colocados em contato com a solução, na qual foi adicionado o indicador de azul de bromotimol para que os alunos pudessem visualizar o processo.
Já a fonte de energia (Figura 4c), foi obtida a partir de um carregador de celular, já inutilizado, o qual teve o conector do aparelho retirado. Os fios da extremidade do carregador foram, então, separados e acoplados a conectores metálicos com o auxílio de uma solda. Porém, esse procedimento deve ser realizado pelo professor por medidas de segurança.
(a) (b) (c)
Figura 4. Célula Eletrolítica. (a) Montagem do eletrodo de grafite, (b) Montagem com o tubo em “U” e (c) Fonte de energia elaborada com carregador de celular.
4.6 ELABORAÇÃO DO MEDIDOR DE CONDUTÂNCIA
Os eletrodos inertes de grafite utilizados na Condutância foram construídos da mesma maneira que nas Células Eletrolíticas, também foram utilizados dois tubos de canetas esferográficas, fios metálicos e uma fonte de energia. Além desses materiais, foi utilizada uma lâmpada de LED para finalizar a elaboração do Medidor de Condutância (Figura 5).
9 As outras extremidades dos fios, nos dois casos mencionados acima, foram soldadas a outros conectores metálicos, os quais foram encaixados na parte superior dos respectivos tubos de caneta e, assim, os dois novos eletrodos foram obtidos. Estes foram, então, acoplados lado a lado com o auxílio de uma cola e, assim, obteve-se o Medidor de Condutância.
Figura 5. Fonte de energia elétrica e o Medidor de Condutância.
4.7 SEQUÊNCIA DIDÁTICA
Como método de ensino, foi elaborada uma Sequência Didática (Anexo A) baseada em uma abordagem contextualizada, investigativa e interdisciplinar para o Ensino de Eletroquímica. As atividades propostas nesta pesquisa foram desenvolvidas através da experimentação com materiais alternativos e de baixo custo a fim de promover o ensino e aprendizagem visando relacionar o conteúdo apresentado em sala de aula com os acontecimentos no mundo real ou no cotidiano dos alunos. Planejou-se uma Sequência Didática para o Ensino de Eletroquímica, sendo dividida em três partes, da seguinte forma:
Parte 1 – Plano de Aula - Células Galvânicas (Anexo A.1)
1º Momento: Levantamento das Concepções Prévias: Pré-questionário investigativo. (Anexo A.2). Investigação sobre descarte de pilhas e baterias relacionando o tema com uma abordagem contextualizada de modo a verificar os conhecimentos prévios dos alunos.
2º Momento: Exposição do vídeo: “Descarte consciente de pilhas e baterias - UNASP/EC” para conscientização dos danos ao meio ambiente causado pelo descarte incorreto de pilhas e baterias e, leitura e discussão do texto: “Como é feita a reciclagem de pilhas e baterias?” (Anexo A.3).
10 Parte 2 – Plano de Aula - Células Eletrolíticas (Anexo B)
1º Momento: Levantamento das Concepções Prévias: Pré-questionário investigativo (Anexo B.1). Investigação sobre Eletrólise relacionando o tema com uma abordagem contextualizada de modo a verificar os conhecimentos prévios dos alunos.
2º Momento: Leitura e discussão do texto: “Etanol e hidrogênio: uma parceria de futuro para o Brasil” (Anexo B.2).
3º Momento: Organização e aplicação do conhecimento: Desenvolvimento dos conceitos fundamentais sobre Eletrólise através de atividades experimentais (Anexo B.3).
Parte 3 – Plano de Aula - Condutância (Anexo C)
1º Momento: Levantamento das Concepções Prévias: Pré-questionário investigativo (Anexo C.1) Investigação sobre corrente elétrica de maneira interdisciplinar para testar os conhecimentos prévios dos alunos.
2º Momento: Leitura e discussão do texto (Anexo C.2): “Efeitos da Corrente Elétrica no Corpo Humano”
3º Momento: Organização e aplicação do conhecimento: Desenvolvimento dos conceitos fundamentais sobre Condutância através de atividades experimentais (Anexo C.3).
Parte 4 – Questionário Final (Anexo D)
Esta parte consiste da aplicação de um questionário final (Questionário 4) com questões relacionadas ao conteúdo abordado durante as aulas para verificação do ensino e aprendizagem.
5RESULTADOS E DISCUSSÕES
5.1 CÉLULAS GALVÂNICAS MÚLTIPLAS
Nas Células Galvânicas ocorrem a transformação de energia química em energia elétrica, essa conversão de energia é devida às reações de oxirredução, nas quais há transferência de elétrons de uma espécie para a outra. Nos dois compartimentos da pilha, chamados meia-células, ocorre as semi-reações, as quais podem ser descritas por equações de redução. Assim, as semi-reações envolvidas na montagem das pilhas integradas podem ser representadas da seguinte forma:
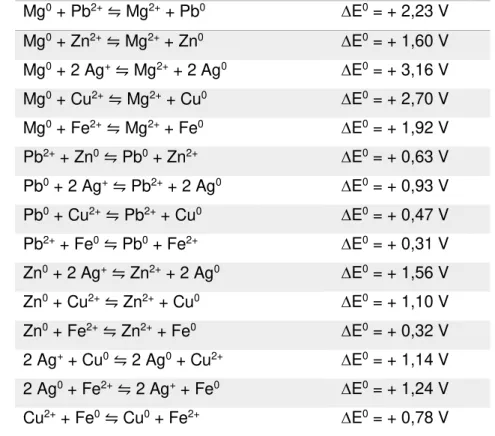
11 Tendo isso em vista, e com base na literatura, as possíveis reações globais para as 15 pilhas diferentes resultantes da Combinação Matemática de seis elementos tomados dois a dois e seus respectivos potenciais de redução encontram-se listados na Tabela 1 abaixo.
Tabela 1. Equações globais das 15 pilhas e seus respectivos potenciais globais. Mg0 + Pb2+⇋ Mg2+ + Pb0 ∆E0 = + 2,23 V
Mg0 + Zn2+⇋ Mg2+ + Zn0 ∆E0= + 1,60 V Mg0 + 2 Ag+⇋ Mg2+ + 2 Ag0 ∆E0 = + 3,16 V Mg0 + Cu2+⇋ Mg2+ + Cu0 ∆E0 = + 2,70 V Mg0 + Fe2+⇋ Mg2+ + Fe0 ∆E0 = + 1,92 V Pb2+ + Zn0⇋ Pb0 + Zn2+ ∆E0 = + 0,63 V Pb0 + 2 Ag+⇋ Pb2+ + 2 Ag0 ∆E0 = + 0,93 V Pb0 + Cu2+⇋ Pb2+ + Cu0 ∆E0 = + 0,47 V Pb2+ + Fe0⇋ Pb0 + Fe2+ ∆E0 = + 0,31 V Zn0 + 2 Ag+⇋ Zn2+ + 2 Ag0 ∆E0 = + 1,56 V Zn0 + Cu2+⇋ Zn2+ + Cu0 ∆E0 = + 1,10 V Zn0 + Fe2+⇋ Zn2+ + Fe0 ∆E0 = + 0,32 V 2 Ag+ + Cu0⇋ 2 Ag0 + Cu2+ ∆E0 = + 1,14 V 2 Ag0 + Fe2+⇋ 2 Ag+ + Fe0 ∆E0 = + 1,24 V Cu2+ + Fe0⇋ Cu0 + Fe2+ ∆E0 = + 0,78 V
12
Tabela 2. Valores das diferenças de potencial, em milivolts, entre as pilhas com concentrações 0,1 mol/L
As diferenças de potencial encontradas apresentaram valores bem diferentes dos valores teóricos, de acordo com a equação de Nernst dada abaixo, possivelmente pela resistência oferecida pela ponte salina e/ou calibração do aparelho.
E = Eº - 0,0592 log Q n
Sendo,
E = Potencial da Célula Galvânica; Eº = Potencial Padrão da Célula;
n = número de elétrons envolvidos no processo de oxirredução; Q = razão entre as concentrações das espécies reduzidas e oxidadas.
Os valores medidos contra o eletrodo de chumbo apresentaram os maiores desvios do calculado de acordo com a equação de Nernst. Este fato pode ser justificado pela formação de uma camada de óxido de chumbo (PbO2), que altera a natureza do eletrodo, além dos íons chumbo (Pb2+) presentes em solução serem consumidos no processo de formação do óxido desse metal.
A reatividade química de um metal está relacionada com sua eletropositividade, portanto, quanto mais eletropositivo for o elemento, mais reativo será o metal. Assim, os metais mais reativos são aqueles que possuem grande tendência de perder elétrons, logo, formam íons positivos com mais facilidade. Dessa forma, pode-se verificar que, os metais utilizados nas Células Galvânicas apresentam uma ordem crescente de reatividade baseada na fila de reatividade representada na Figura 6, na qual a prata é o metal é menos reativo e, o magnésio é o metal mais reativo.
Polo Positivo do Potenciômetro
Mg Pb Zn Ag Cu Fe
P olo N eg at ivo do P otenc iôme tro
Mg X 795 440 1146 1258 1055
Pb X 426 825 344 40
Zn X 1018 720 466
Ag X 440 629
Cu X 345
13
Figura 6. Fila de reatividade dos metais.
A ordem de reatividade dos metais também pode ser estabelecida tendo como referência os potenciais padrão de redução, mencionados anteriormente, ou seja, quanto maior e mais positivo o E0red, maior a tendência de ocorrência da redução.
Apesar dos desvios citados anteriormente, a montagem integrada de Células Galvânicas Múltiplas pode ser utilizada em uma abordagem didática no estudo de potenciais de redução, uma vez que possibilita aos alunos a construção de uma tabela de potenciais e com auxílio desta é possível verificar a ordem de reatividade dos metais através de uma montagem simples e compacta.
5.2 ELETRÓLISE NO TUBO EM “U”
Na Eletrólise da água utiliza-se uma fonte externa que fornece corrente elétrica a Célula Eletrolítica, a qual atravessa dois elétrodos mergulhados em uma solução aquosa contendo íons, denominada solução eletrolítica, permitindo a dissociação da água em oxigênio (O2) e hidrogênio (H2).
Quando a Eletrólise ocorre em meio aquoso, a água fornece íons H+ e íons OH -e, dessa forma, o processo de auto-ionização da água pode ser representado pela seguinte equação:
2 H2O (l) ⇋ 2 H+ (aq) + 2 OH- (aq)
Quando um sal é dissolvido em água, ele sofre dissociação ou liberação de íons, assim, uma solução aquosa de sulfato de sódio (Na2SO4) 0,5 mol/L quando dissociada em água libera os seguintes íons:
Na2SO4 (aq) ⟶ 2 Na+ (aq) + SO42- (aq)
14 A semi-reação que ocorre no ânodo, polo positivo da meia-célula, é chamada de reação de oxidação e é representada da seguinte forma:
H2O (l) ⟶ ½ O2 (g) + 2 H+ (aq) + 2 e
-A semi-reação que ocorre no catodo, polo negativo da meia-célula, é denominada reação de redução e é dada por:
2 H2O (l) + 2 e- ⟶ H2 (g) + 2 OH- (aq)
Esse processo constitui uma reação de oxirredução e a soma das duas semi-reações nos eletrodos é a reação global na Célula Eletrolítica, sendo indicada por:
H2O (l) ⟶ H2 (g) + ½ O2 (g)
Ao adicionar o indicador azul de bromotimol, de coloração esverdeada, na solução de sulfato de sódio, com pH neutro, obtêm-se no ânodo uma solução amarelada, à medida que o meio se torna ácido e, ao mesmo tempo, obtêm-se no catodo uma solução azulada, à medida que o meio vai se tornando básico como mostra a Figura 7. A adição do indicador permite a visualização do processo de Eletrólise de acordo com as respectivas semi-reações nos dois eletrodos.
Portanto, conclui-se que o material alternativo desenvolvido para a Eletrólise pode ser utilizado no Ensino Médio de modo a contribuir no ensino e aprendizagem e, é facilmente executado em sala de aula ou em laboratório.
Figura 7. Processo de Eletrólise utilizando o indicador de azul de bromotimol.
5.3 MEDIDOR DE CONDUTÂNCIA
A Condutometria baseia-se nas medidas de condutividade elétrica de uma solução eletrolítica. A condutância é a medida resultante da aplicação de uma força eletromotriz (fem) entre dois eletrodos e ocorre devido à migração de íons positivos e negativos.
15 íons NO3- na solução. Por outro lado, quando o mesmo é imerso em, por exemplo, água destilada, a lâmpada não se acende, Figura 8b, pois a água destilada apresenta baixa condutibilidade por não haver íons suficientes para que a condução de eletricidade ocorra.
Portanto, conclui-se que o dispositivo desenvolvido com materiais de baixo custo pode ser utilizado tanto em sala de aula quanto em laboratório devido à sua praticidade. Este aparelho pode ser reproduzido pelos próprios alunos, tendo em vista a acessibilidade dos materiais utilizados e a facilidade de sua montagem. Espera-se que o experimento possa estimular a curiosidade e despertar o interesse pela Ciência.
(a) (b)
Figura 8. Medidor de Condutância: (a) Eletrodo imerso na solução contendo uma solução de nitrato de potássio 0,1 mol/L. (b) Eletrodo imerso no béquer contendo água destilada.
6 CONSIDERAÇÕES FINAIS
Após a elaboração dos dispositivos e realização dos testes foi possível verificar que o desenvolvimento dos mesmos com materiais simples, de fácil acesso e de baixo custo podem colaborar para o ensino e aprendizagem, bem como contribuir para o interesse dos alunos pela Ciência/Química.
16 A Sequência Didática desenvolvida para essa pesquisa apresenta-se como uma alternativa metodológica para o ensino do conteúdo de Eletroquímica, podendo ser adaptada e trabalhada em qualquer espaço físico, uma vez que foram utilizados materiais de baixo custo e que os mesmos podem ser facilmente transportados. Espera-se que a proposta favoreça o desenvolvimento da formação do conhecimento científico de uma forma mais incentivadora.
Como as metodologias utilizadas nos livros não têm se mostrado muito eficazes para que o aluno alcance uma aprendizagem significativa, espera-se que a Sequência Didática aqui apresentada possa ajudar na reformulação do Ensino de Química do 2º ano do Ensino Médio e servir como auxílio para professores.
Infelizmente, devido a alguns contratempos não foi possível aplicar a Sequência Didática e nem verificar sua eficiência como uma estratégia de ensino voltada para o desenvolvimento do senso crítico dos alunos. No entanto, espera-se aplicá-la futuramente para assim poder constatar sua eficácia.
7 REFERÊNCIAS BIBLIOGRÁFICAS
ARAÚJO, Sayonara Maria Ferreira; SILVA, Jamylles Soares; LORENZO, Jorge Gonçalo Fernandez; SANTOS, Sérgio Ricardo Bezerra; SANTOS, Márcia de Lourdes Bezerra; MONTEIRO, Hilton Costa. Confecção de celas galvânicas com materiais de baixo custo para otimização de aulas sobre reações de oxirredução e eletroquímica no ensino médio. VII Connepi Congresso Norte Nordeste de Pesquisa e Inovação. Palmas – TO, 2012.
ASSUMPÇÃO, Mônica Helena; FREITAS, Kellen Heloizy; SOUZA, Fernanda; FILHO, Orlando Fatibello. Construção e Adaptação de Materiais Alternativos em Titulação Ácido-base. Eclética Química, São Paulo,vol. 35,n.4, p.133-138, 2010.
ATKINS, Peter; JONES, Loretta. Princípios de Química. 3. ed. Porto Alegre: Bookman, 2006.
BAIO, José Augusto Fragale; RAMOS, Luiz Antônio; CAVALHEIRO, Éder Tadeu Gomes. Construção de Eletrodo de Grafite Retirado de Pilha Comum: Aplicações Didáticas. Química Nova, Vol. 37, N. 6, p. 1078-1084, 2014.
BARRETO, Bárbara; BATISTA, Carlos Henrique; CRUZ, Maria Clara. Células Eletroquímicas, Cotidiano e Concepções dos Educandos. Química Nova na Escola, São Paulo, vol.39, n.1, p. 52-58, fev. 2017.
17 BOCCHI, Nerilso; FERRACIN, Luiz Carlos; BIAGGIO, Sonia Regina. Pilhas e Baterias: Funcionamento e Impacto Ambiental. Química Nova na Escola, n. 11, p. 3-9, maio 2000.
BUENO, Lígia; MOREIA, Kátia de Cássia; SOARES, Marília; DANTAS, Denise; WIEZZEL, Andréia Cristiane Silva; TEIXEIRA, Marcos. O ensino de química por meio de atividades experimentais: a realidade do ensino nas escolas. In: Silvania Lanfredi Nobre; José Milton de Lima. (Org.). Livro Eletrônico do Segundo Encontro do Núcleo de Ensino de Presidente Prudente São Paulo: Unesp, 2007.
BUENO, Regina de Souza Marques; KOVALICZN, Rosilda Aparecida. O Ensino de Ciências e as Dificuldades das Atividades. Curitiba: SEED- PR/ PDE, 2008 (Portal diaadiaeducacao.pr.gov.br).
BRASIL. Ministério da Educação, Secretaria de Educação Média e Tecnológica.
Parâmetros Curriculares Nacionais: Ensino Médio. Brasília: 1999.
FINAZZIA, Guilherme Antônio; MARTINS, Carlos Ney; CAPELATO, Milton Duffles; FERREIRA, Luiz Henrique. Desenvolvimento de Experimento Didático de Eletrogravimetria de Baixo Custo Utilizando Princípios da Química Verde. Química Nova, v. 39, n. 1, p. 112-117, 2016.
GIORDAN, Marcelo. O Papel da Experimentação no Ensino de Ciências. Química Nova na Escola, n.10, p.43-49, nov. 1999.
GONÇALVES, Fábio Peres. O texto de experimentação na educação em química: discursos pedagógicos e epistemológicos. Tese de Doutorado. Universidade Federal de Santa Catarina, Centro de Ciências da Educação. Programa de Pós-Graduação em Educação Científica e Tecnológica, 2005.
GUIMARÃES, Cleidson Carneiro. Experimentação no Ensino de Química: Caminhos e Descaminhos Rumo à Aprendizagem Significativa. Química Nova na Escola, vol.31, n.3 p.198-202, ago. 2009.
HIOKA, Noboru; FILHO, Ourides Santin; MENEZES, Aparecido Junior; YONEHARA, Fernando Seiji, BERGAMASKI, Kleber; PEREIRA, Robson Valentim. Pilhas de Cu/Mg Construídas com Materiais de Fácil Obtenção. Química Nova na Escola, n. 11, p.40-44, maio 2000.
18 MARQUES, André; ALVES, Aline; SILVA, Ana Flávia; MORAIS, Lorraine; GUIMARÃES, Pâmella; LIMA, Jocasta; RIBEIRO, Fernanda; SANTOS, Leidimar; MEDEIROS, Eliziane; FRANCO, Vânia. A Importância De Aulas Práticas No Ensino De Química Para Melhor Compreensão E Abstração De Conceitos Químicos. XIV Encontro Nacional de Ensino de Química (XIV ENEQ) UFPR 2008.
MARTINS, Ana Laura da Silva. Uma Proposta de Sequência Didática para o Ensino de Eletrólise na Educação Básica. 2017. Dissertação (Mestre em Ensino de Ciências Naturais) – Universidade Federal de Mato Grosso, Mato Grosso.
MASTERTON, W.L.; SLOWINSKI, E.J. e STANITSKI, C.L. Princípios de química. 6. ed. Rio de Janeiro: LTC, 1990.
MATSUBARA, Elaine Yoshiko; NERI, Cláudio Roberto; Rosolen, José Maurício. Pilhas Alcalinas: Um Dispositivo Útil para o Ensino de Química. Química Nova, v. 30, n. 4, p.1020-1025, mar 2007.
MESSIAS, Adriano Sousa; FERREIRA, Wendel Menezes. Eletroquímica e a construção de pilhas e baterias com material de fácil aquisição. IV Colóquio Internacional Educação e Contemporaneidade. Campo do Brito – SE.
PALMA, Maria Helena Cunha; TIERA, Vera Aparecida de Oliveira. Oxidação de Metais. Química Nova na Escola, n.18, p.52-54, nov. 2003.
RAUPP, Daniele; SERRANO, Agostinho; MOREIRA, Marco Antônio. Desenvolvendo Habilidades Visuoespaciais: Uso De Software De Construção De Modelos Moleculares No Ensino De Isomeria Geométrica Em Química. Experiências em Estudo de Ciências, v.4 (1), p.65-78, 2009.
SANJUAN, Maria Eugênia Cavalcante; SANTOS, Cláudia Viana; MAIA, Juliana de Oliveira; SILVA, Aparecida de Fátima Andrade; WARTHA, Edson José. Maresia: Uma Proposta para o Ensino de Eletroquímica. Química Nova na Escola, v.31, n. 3, p.190-197, ago. 2009.
SARTORI, Elen; SANTOS, Vagner Bezerra; TRENCH, Aline; FATIBELLO-FILHO, Orlando. Construção de Uma Célula para o Ensino de Eletrólise a Partir de Materiais de Baixo Custo. Química Nova na Escola, v.35, n.2, p.107-111, maio 2013.
19 TOLENTINO, Mario; ROCHA-FILHO, Romeu Cardozo. O Bicentenário da Invenção da Pilha Elétrica. Química Nova na Escola, n.11, p.35-39, maio 2000.
20
ANEXOS
Anexo A.1 – Parte 1: Plano de Aula (Células Galvânicas)
PLANO DE AULA – CÉLULAS GALVÂNICAS
PLANO DE AULA
TEMA: Células Galvânicas (Pilhas)
OBJETIVOS
GERAL: Desenvolver atividades experimentais com materiais didáticos alternativos de baixo custo que colaborem para o Ensino de Química abordando, principalmente, o conteúdo de Eletroquímica, a fim de favorecer a compreensão dos conceitos discutidos em sala de aula, bem como analisar o desempenho e interesse dos alunos nas atividades e, desse modo, contribuir com o processo de ensino e aprendizagem.
ESPECÍFICOS: Saber como se constrói uma Célula Galvânica e seu funcionamento. Compreender os Potenciais de Redução. Compreender as reações de oxirredução.
CONTEÚDO
- Reações de oxidação-redução; - Célula Galvânica (Pilha);
- Potencial Padrão de Hidrogênio; - Potenciais padrão de redução; - Força Eletromotriz (fem); - Equação de Nernst.
METODOLOGIA
No início a aula, o professor deverá aplicar um questionário relacionado ao tema abordado, o qual permitirá conhecer os saberes prévios dos alunos. Será entregue aos alunos uma folha com as questões propostas, a qual deverá ser respondida com clareza e sem rasuras. Também será apresentado um vídeo sobre algumas curiosidades sobre as pilhas e leitura e discussão do texto: “Como é feita a reciclagem de pilhas e baterias?” para estabelecer um diálogo sobre os temas envolvidos. Para a parte experimental, será solicitado aos alunos que formem grupos e a esses grupos será entregue um kit de Eletroquímica. O aluno deverá registrar as informações observadas na atividade experimental e criar uma tabela com os potenciais de redução.
RECURSOS DIDÁTICOS
- Problematização inicial;
21 - Quadro, giz e data-show;
- Espaço físico (sala de aula ou laboratório) para o desenvolvimento da atividade experimental;
- Kit de Eletroquímica; - Roteiro da aula; - Questionário.
AVALIAÇÃO
Será aplicado um questionário com a problematização inicial com questões investigativas para verificar os conhecimentos prévios dos alunos. Para verificar se o material didático desenvolvido contribuiu para o processo de ensino e aprendizagem e, se os alunos compreenderam os conceitos discutidos, será aplicado outro questionário ao final da Sequência Didática direcionado aos conceitos relacionados aos temas abordados.
REFERÊNCIAS
• Básica
ATKINS, Peter; JONES, Loretta. Princípios de Química. 3. ed. Porto Alegre: Bookman, 2006.
MASTERTON, W.L.; SLOWINSKI, E.J. e STANITSKI, C.L. Princípios de Química. 6. ed. Rio de Janeiro: LTC, 1990.
• Complementar
KOTZ, J.C.; TREICHEL Jr., P. Química e reações Químicas. Vol. 1 e 2. Rio de Janeiro: LTC, 2005.
22 Anexo A.2 – Questionário 1
QUESTIONÁRIO 1 - DESENVOLVIMENTO DE MATERIAIS INSTRUCIONAIS VOLTADOS AO
ENSINO DE ELETROQUÍMICA
Prezado (a) estudante,
O presente questionário tem como objetivo relacionar o conteúdo de Eletroquímica de forma contextualizada, de modo a verificar os conhecimentos prévios dos alunos. Solicita-se que responda as questões propostas com o máximo de atenção possível, de modo que as suas respostas possam ajudar a avaliar se o experimento contribui para um melhor entendimento dos conceitos de Química.
Por fim, agradeço a sua disponibilidade em responder ao questionário. Márcia Gonçalves Monteiro – Monografia em Química
QUESTÃO 01: Observe a tirinha abaixo e responda.
Mafalda está em dúvida quanto ao descarte da pilha velha. Proponha uma maneira de ajudá-la nesta tarefa indicando ações ou um local para o descarte.
_____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
Questão 02. O que você entende por conscientização ambiental?
23
QUESTÃO 03. Quais são riscos relacionados ao descarte inadequado de pilhas e baterias no Meio Ambiente?
_____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
QUESTÃO 04. Na sua opinião, quem é responsável do descarte correto de pilhas e baterias? Comente.
_____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
QUESTÂO 05. Você sabe como as pilhas e baterias são recicladas? Comente. _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
Anexo A.3 – Texto: Como é feita a reciclagem de pilhas e baterias?
Como é feita a reciclagem de pilhas e baterias?
Processo de reciclagem demora até dois meses
24
Descarregando as baterias
1. Pilhas e baterias são separadas por composição. Baterias de carro vão para um lado e de celulares para outro. As pilhas domésticas são abertas para separar a cobertura plástica do miolo metálico. O plástico que envolve as pilhas vai para reciclagem especializada.
2. O metal passa por uma máquina de trituração. As partículas resultantes seguem para um reator químico, onde são dissolvidas e neutralizadas, ou seja, deixam de reagir e serem tóxicas para o meio ambiente.
3. A pasta segue para um filtro prensa, que separa a parte líquida – esta segue para uma estação de tratamento – da sólida. O material passa, então, por um teste químico, que revela o metal mais abundante na composição – esse processo define a cor do produto final.
4. A mistura vai a um forno, aquecido a mais de 1.300 Cº. O resultado é um óxido metálicoem pó, neutralizado e inofensivo, vendido como corante para a fabricação de cerâmicas, vidros, pisos e azulejos.
25 Anexo A.4 – Roteiro Aula Prática
ATIVIDADE PRÁTICA 1 – CÉLULAS GALVÂNICAS (PILHAS)
Objetivos: Verificar o funcionamento de uma pilha. Verificar a ordem de reatividade dos metais. Obter uma tabela de potenciais de redução.
Materiais e Reagentes:
• 6 eletrodos: magnésio (Mg), chumbo (Pb), zinco (Zn), prata (Ag), cobre (Cu) e ferro (Fe);
• 1 Proveta;
• 2 Gomas de elástico; • 6 Tubos de ensaio; • 6 Tubos em “U”;
• 1 Potenciômetro ou Multímetro Digital com garras tipo “jacaré”; • Solução KNO3 0,1 mol/L;
• Soluções de Mg(NO3)2.6H2O 0,1 mol/L; Pb(NO3)2.6H2O 0,1 mol/L; Zn(NO3)2.6H2O 0,1 mol/L; AgNO3 0,1 mol/L; CuSO4.5H2O 0,1 mol/L; FeSO4.7H2O 0,1 mol/L.
Procedimentos:
1. Preparar as soluções de Mg(NO3)2.6H2O 0,1 mol/L; Pb(NO3)2.6H2O 0,1 mol/L; Zn(NO3)2.6H2O 0,1 mol/L; AgNO3 0,1 mol/L; CuSO4.5H2O 0,1 mol/L; FeSO4.7H2O 0,1 mol/L e KNO3 0,1 mol/L;
2. Monte a Célula Galvânica: Pegue a proveta, os tubos de ensaio e prenda-os com as gomas de elástico. Coloque enrole uma goma na parte de cima e enrole a outra goma na parte de baixo, de modo que os tubos fiquem bem amarrados a proveta central.
3. Adicione, cuidadosamente, a cada um dos tubos de ensaio a respectiva solução dos íons metálicos. Enumere de 1 a 6 os tubos de ensaio e anote os íons que estão em cada um deles.
4. Pegue os tubos em “U” e adicione, cuidadosamente, a solução de KNO3 0,1 mol/L em cada um deles.
5. Com muito cuidado, porém com uma certa rapidez para evitar que a solução saia do tubo, conecte os tubos em “U” com a proveta e os tubos de ensaio.
6. Coloque um eletrodo em cada tubo de ensaio.
7. Conecte uma das garras do tipo “jacaré” num eletrodo mergulhado em um dos tubos de ensaio, tubo 1, e a outra garra em um eletrodo diferente, tubo 2.
8. Ligue o potenciômetro na tomada e faça os ajustes necessários.
26
10. Faça o mesmo procedimento do item 6, porém, agora para o tubo 1 e tubo 3. Repita o mesmo procedimento mantendo o tubo 1 e variando os demais tubos até que todas as medições possíveis sejam feitas. Depois, faça o mesmo procedimento mantendo o tubo 2 e variando os outros tubos e assim por diante até obter um total de 15 pilhas diferentes. Anotando sempre os valores dos potenciais de cada medida indicado no potenciômetro.
27 Anexo B – Parte 2: Plano de Aula (Célula Eletrolítica)
PLANO DE AULA – CÉLULAS ELETROLÍTICAS
PLANO DE AULA
TEMA: Eletrólise da água
OBJETIVOS
GERAL: Desenvolver atividades experimentais com materiais didáticos alternativos de baixo custo que colaborem para o Ensino de Química abordando, principalmente, o conteúdo de Eletrólise da água, a fim de favorecer a compreensão dos conceitos discutidos em sala de aula, bem como analisar o desempenho e interesse dos alunos nas atividades e, desse modo, contribuir com o processo de ensino e aprendizagem.
ESPECÍFICOS: Saber como se constrói uma Célula Eletrolítica e seu funcionamento. Compreender as reações de oxirredução.
CONTEÚDO
- Eletrólise em solução aquosa com eletrodos inertes; - Comparar o funcionamento das pilhas com a Eletrólise; - Aplicações da Eletrólise.
METODOLOGIA
No início a aula, o professor deverá aplicar um questionário relacionado ao tema abordado, o qual permitirá conhecer os saberes prévios dos alunos. Será entregue aos alunos uma folha com as questões propostas, a qual deverá ser respondida com clareza e sem rasuras. Também será apresentado um texto para leitura e discussão: “Etanol e hidrogênio: uma parceria de futuro para o Brasil” para estabelecer um diálogo sobre os temas envolvidos relacionando questões econômicas. Para a parte experimental, será solicitado aos alunos que formem grupos e a esses grupos será entregue um kit de Eletroquímica. O aluno deverá registrar as informações observadas na atividade experimental para eventuais discussões.
RECURSOS DIDÁTICOS
- Problematização inicial;
- Texto: “Etanol e hidrogênio: uma parceria de futuro para o Brasil”; - Quadro, giz e data-show;
- Espaço físico (sala de aula ou laboratório) para o desenvolvimento da atividade experimental;
- Kit de Eletroquímica; - Roteiro da aula; -Questionário.
28 Será apresentada uma problematização inicial com questões investigativas para verificar os conhecimentos prévios dos alunos. Para verificar se o material didático desenvolvido contribuiu para o processo de ensino e aprendizagem e, se os alunos compreenderam os conceitos discutidos, será aplicado outro questionário ao final da Sequência Didática direcionado aos conceitos relacionados aos temas abordados.
REFERÊNCIAS
• Básica
ATKINS, Peter; JONES, Loretta. Princípios de Química. 3. ed. Porto Alegre: Bookman, 2006.
MASTERTON, W.L.; SLOWINSKI, E.J. e STANITSKI, C.L. Princípios de Química. 6. ed. Rio de Janeiro: LTC, 1990.
• Complementar
KOTZ, J.C.; TREICHEL Jr., P. Química e reações Químicas. Vol. 1 e 2. Rio de Janeiro: LTC, 2005.
MARTINS, Ana Laura da Silva; SOARES, Elane Chaveiro. Uma Proposta de Sequência Didática para o Ensino de Eletrólise na Educação Básica. Mato Grosso, p.5-39.
SILVA, Ennio Peres. Etanol e hidrogênio: uma parceria de futuro para o Brasil.
Ambiente e Sociedade, São Paulo, p.51. Disponível em:
29 Anexo B.1 - Questionário 2
QUESTIONÁRIO 2 - DESENVOLVIMENTO DE MATERIAIS INSTRUCIONAIS VOLTADOS AO
ENSINO DE ELETROQUÍMICA
Prezado (a) estudante,
O presente questionário tem como objetivo relacionar o conteúdo de Eletroquímica de forma contextualizada, de modo a verificar os conhecimentos prévios dos alunos. Solicita-se que responda as questões propostas com o máximo de atenção possível, de modo que as suas respostas possam ajudar a avaliar se o experimento contribui para um melhor entendimento dos conceitos de Química.
Por fim, agradeço a sua disponibilidade em responder ao questionário. Márcia Gonçalves Monteiro – Monografia em Química
QUESTÃO 01: Você acha que existe uma relação entre as palavras eletricidade e eletrólise? Explique.
_____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
QUESTÃO 02: Você acredita que seja possível produzir gás hidrogênio utilizando eletricidade e água? Explique.
_____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ _____________________________________________________________________
QUESTÃO 03: Você acredita que é possível utilizar gás hidrogênio como combustível para automóveis? Explique.
30
QUESTÃO 04. A célula à combustível é uma tecnologia que utiliza o hidrogênio e o oxigênio para gerar eletricidade com alta eficiência e essa energia elétrica produzida pode ser empregada em veículos automotores. Em sua opinião, é possível produzir esse gás através de outra substância? Explique.
_______________________________________________________________________ _______________________________________________________________________ _______________________________________________________________________ _______________________________________________________________________ _______________________________________________________________________ _______________________________________________________________________
Anexo B.2 – Texto: Etanol e hidrogênio: uma parceria de futuro para o Brasil
Etanol e hidrogênio: uma parceria de futuro para o Brasil
A crescente busca mundial pela redução dos impactos ambientais globais tem conduzido os países à diminuição das emissões e ao aumento da participação das fontes renováveis de energia em suas respectivas matrizes energéticas. No caso específico da redução das emissões de gás carbônico, além de um uso mais eficiente dos combustíveis fósseis procuram-se maneiras de evitar a emissão desse gás (por ex. através do sequestro do carbono) e a substituição desses combustíveis por outros de origem renovável, como o etanol e o biodiesel. Neste cenário a combinação do etanol e do hidrogênio resulta em um dos mais interessantes sistemas energéticos disponíveis.
Por não ser encontrado livre na natureza, o hidrogênio deve ser produzido a partir de um insumo químico que possua esse elemento, como a água ou os hidrocarbonetos, e uma fonte de energia térmica e/ou elétrica, que pode ou não ser renovável. Sua obtenção a partir de fontes fósseis, como o carvão, derivados de petróleo e gás natural, representa uma forma menos impactante desses energéticos, enquanto que a partir de fontes renováveis, como a hidroeletricidade e a biomassa, representa uma das formas menos agressivas ao meio ambiente disponíveis.
31 quando empregado em células a combustível, além de emissões quase desprezíveis esse combustível pode ser empregado com até 50% de eficiência.
A obtenção do hidrogênio a partir do etanol pode ser realizada através de diversos processos, entre eles o de reforma-vapor, no qual este composto reage quimicamente com a água, produzindo uma mistura gasosa cujo componente principal é o hidrogênio. A eficiência desse processo situa-se na casa dos 80%. Uma vez disponível, esse hidrogênio pode ser utilizado energeticamente em motores de combustão interna, turbinas a gás e células a combustível. Este último dispositivo é um reator eletroquímico que converte o hidrogênio e o oxigênio do ar em eletricidade, calor e água, com elevada eficiência de conversão (em torno de 50%).
A energia elétrica produzida nas células a combustível pode ser empregada para uso veicular, caracterizando-se como uma forma alternativa do uso do etanol em veículos de passeio. Pode ser empregada também em aplicações aonde o etanol não vem sendo utilizado diretamente, como veículos pesados (ônibus e de carga) e geração distribuída de eletricidade (sistemas isolados e rurais, sistemas complementares à rede elétrica, de segurança, etc). Como se pode perceber, a eficiência global da combinação etanol, hidrogênio e veículos com células a combustível está por volta de 40%, quase o dobro daquela verificada nos veículos com motores de combustão interna a álcool (cerca de 25%), sendo que em todo seu ciclo de produção e utilização não há praticamente nenhuma emissão de poluentes.
Portanto a associação do etanol e do hidrogênio representa a forma mais eficiente e menos impactante de utilização desse biocombustível, praticamente dobrando sua disponibilidade para substituição de combustíveis não renováveis em todo mundo, o que poderá significar para o Brasil, além da posição de maior produtor, também a de maior exportador de energia renovável do mundo.
32 Anexo B.3 – Roteiro Aula Prática
AULA PRÁTICA 2 – CÉLULA ELETROLÍTICA (ELETRÓLISE)
Objetivos: Realizar o processo de Eletrólise de uma solução aquosa de sulfato de sódio;
Materiais e Reagentes:
• 2 eletrodos de grafite • 1 Tubo em “U”
• Suporte com garra
• Solução Na2SO4 0,5 mol/L • Indicador azul de bromotimol
• Fonte de energia (carregador de celular)
Procedimentos:
1. Preparar a solução de Na2SO4 0,5 mol/L.
2. Prenda o tubo em “U” no suporte com garra.
3. Coloque a solução Na2SO4 0,5 mol/L no tubo.
4. Adicione 2 gotas de indicador azul de bromotimol.
33 Anexo C – Parte 3: Plano de Aula – Condutância
PLANO DE AULA – CONDUTÂNCIA
PLANO DE AULA TEMA: Condutância
OBJETIVOS
GERAL: Desenvolver atividades experimentais com materiais didáticos alternativos de baixo custo que colaborem para o Ensino de Química abordando, principalmente, o conteúdo de Condutância, a fim de favorecer a compreensão dos conceitos discutidos em sala de aula, bem como analisar o desempenho e interesse dos alunos nas atividades e, desse modo, contribuir com o processo de ensino e aprendizagem.
ESPECÍFICOS: Saber como se constrói uma Célula Eletrolítica e seu funcionamento. Compreender as reações de oxirredução.
CONTEÚDO
- Corrente Elétrica; - Corpo Humano;
-Condutividade elétrica dos compostos.
METODOLOGIA
No início a aula, o professor deverá aplicar um questionário relacionado ao tema abordado, o qual permitirá conhecer os saberes prévios dos alunos. Será entregue aos alunos uma folha com as questões propostas, a qual deverá ser respondida com clareza e sem rasuras. Também será aplicado um vídeo para complementar a aula, bem como um texto para leitura e discussão: “Efeitos da Corrente Elétrica no Corpo Humano” para estabelecer um diálogo sobre os temas envolvidos por meio da interdisciplinaridade. Para a parte experimental, será solicitado aos alunos que formem grupos e a esses grupos será entregue um kit de Eletroquímica. O aluno deverá registrar as informações observadas na atividade experimental para eventuais discussões.
RECURSOS DIDÁTICOS
- Problematização inicial;
- Texto: “Efeitos da Corrente Elétrica no Corpo Humano”;
- Vídeo: “Choque elétrico (Parte 1) - O MELHOR vídeo - Curso NR10 Engehall”; - Quadro, giz e data-show;
- Espaço físico (sala de aula ou laboratório) para o desenvolvimento da atividade experimental;
34 -Questionário.
AVALIAÇÃO
Será aplicado um questionário com a problematização inicial com questões investigativas para verificar os conhecimentos prévios dos alunos. Para verificar se o material didático desenvolvido contribuiu para o processo de ensino e aprendizagem e, se os alunos compreenderam os conceitos discutidos, será aplicado outro questionário ao final da Sequência Didática direcionado aos conceitos relacionados aos temas abordados.
REFERÊNCIAS
• Básica
ATKINS, Peter; JONES, Loretta. Princípios de Química. 3. ed. Porto Alegre: Bookman, 2006.
MASTERTON, W.L.; SLOWINSKI, E.J. e STANITSKI, C.L. Princípios de Química. 6. ed. Rio de Janeiro: LTC, 1990.
• Complementar
KOTZ, J.C.; TREICHEL Jr., P. Química e reações Químicas. Vol. 1 e 2. Rio de Janeiro: LTC, 2005.
MARTINS, Ana Laura da Silva; SOARES, Elane Chaveiro. Uma Proposta de Sequência Didática para o Ensino de Eletrólise na Educação Básica. Mato Grosso, p.5-39.
https://www.youtube.com/watch?v=usLEVgJwyss
JÚNIOR, Joab Silas da Silva. Disponível em:
35 Anexo C.1 – Questionário 3
QUESTIONÁRIO 3 - DESENVOLVIMENTO DE MATERIAIS INSTRUCIONAIS VOLTADOS AO
ENSINO DE ELETROQUÍMICA
Prezado (a) estudante,
O presente questionário tem como objetivo relacionar o conteúdo de Eletroquímica utilizando uma abordagem interdisciplinar. Solicita-se que responda as questões propostas com o máximo de atenção possível, de modo que as suas respostas possam ajudar a avaliar se a Sequência Didática contribui para um melhor entendimento dos conceitos de Química.
Por fim, agradeço a sua disponibilidade em responder ao questionário. Márcia Gonçalves Monteiro – Monografia em Química
QUESTÃO 01: O que acontece quando tomamos um choque elétrico? Comente.
__________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________
QUESTÃO 02. Como você acha que a corrente elétrica percorre nosso corpo? Comente. __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________
QUESTÃO 03. Por que os pássaros não tomam choques quando pousam nos fios da rede elétrica?