Stricto Sensu
em Educação Física
O EFEITO AGUDO DO EXERCÍCIO AQUÁTICO MODERADO EM
FATORES DA COAGULAÇÃO DE PESSOAS COM HEMOFILIA
Brasília - DF
2013
LUIS GUSTAVO NORMANTON BELTRAME
O EFEITO AGUDO DO EXERCÍCIO AQUÁTICO
MODERADO EM FATORES DA COAGULAÇÃO DE
PESSOAS COM HEMOFILIA
Dissertação apresentada ao Programa de Pós-Graduação Stricto Sensu em Educação Física
da Universidade Católica de Brasília, como requisito para obtenção do título de Mestre em Educação Física.
Orientador: Prof. Dr. Daniel Alexandre Boullosa Álvarez.
12,5 cm
7,5 cm 7,5cm
Ficha elaborada pela Biblioteca Pós-Graduação da UCB 07/06/2013
B453e Beltrame, Luis Gustavo Normanton
O efeito agudo do exercício aquático moderado em fatores da coagulação de pessoas com hemofilia. / Luis Gustavo Normanton Beltrame – 2013.
122f. ; il.: 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2013 Orientação: Prof. Dr. Daniel Alexandre Boullosa Álvarez.
1. Exercícios aquáticos. 2. Hemofilia. 3. Pessoas. I. Álvarez, Daniel Alexandre Boullosa, orient. II. Título.
Agradeço a Deus e a Nossa Senhora Aparecida que me acompanham e iluminam em todos os caminhos trilhados nesta vida e contribuíram para mais este passo.
Aos meus pais, José Carlos Beltrame e Maria da Graça Normanton Beltrame, que sempre estiveram presentes na minha formação e nunca deixaram de dar oportunidades para exercitarmos o nosso respeito, humildade, honestidade e perseverança diante dos desafios que a vida nos proporciona.
A minha esposa e companheira, Flavia Simões Ferreira Rodrigues que sempre esteve ao meu lado, dividindo todos os momentos do dia-a-dia e que me deu o bem mais precioso da minha vida, a nossa filha Alice.
Aos meus irmãos, André Luis Normanton Beltrame e Marília Normanton Beltrame e todos os familiares, que me deram o apoio necessário durante os momentos que mais precisei.
Ao meu professor e orientador Dr. Daniel Alexandre Boullosa Álvarez, sempre dedicado, presente, ético, profissional e acima de tudo, companheiro e amigo. Com este professor, levo a certeza de que a ciência nos ensina que ainda há muito para aprendermos e que sem trabalho árduo e bem direcionado não há sucesso.
Um agradecimento especial a todos os professores do Programa de Pós-Graduação em Educação Física da Universidade Católica de Brasília, que despertaram em mim novos horizontes a luz da ciência: Dr. Luiz Otávio Teles Assunção, Dra. Tânia Mara Vieira Sampaio, Dr. Herbet Simões, Dra Carmem Campbell, Dr. Flavio Pires, Dra Gislaine Ferreira de Melo, Dr. Jonato Prestes, Dr. Claudio Córdova e aos colegas de Mestrado, que sempre contribuíram para o meu desenvolvimento acadêmico.
Meus agradecimentos a todos os funcionários e responsáveis pelos laboratórios que passamos horas e horas durante este período intenso e estimulante de pesquisa e aprendizado. Especialmente, ao Vinícius do laboratório de gerontologia e Vicente da piscina, muito obrigado.
Aos voluntários e familiares, que participaram direta e indiretamente do projeto de pesquisa e sempre acreditaram no meu trabalho, meus sinceros agradecimentos, pois sem vocês não poderíamos realizar tal projeto.
Ao programa de bolsas PROSUP/CAPES, pelos recursos disponibilizados durante um período do curso de Pós-graduação Stricto Sensu em Educação Física da Universidade
Católica de Brasília, esperando poder reverter tais recursos em prol uma sociedade melhor.
Um especial agradecimento aos professores Claudio Córdova e Ricardo Jacó pelas correções e apontamentos que contribuíram para melhora do texto e do conteúdo sob perspectivas acadêmico-científicas.
A Universidade Católica de Brasília por fornecer todo equipamento e estrutura física necessária para o desenvolvimento do projeto. Muito Obrigado a todos!
Este trabalho é dedicado aos profissionais de saúde, aos pais, familiares dos pacientes, e principalmente ás pessoas com hemofilia, que lutam pela melhora da qualidade de vida e promoção da saúde por meio da atividade física. Em especial, dedico este trabalho a médica hematologista Jussara Almeida, pessoa que se entrega integralmente a Hemofilia por mais de 30 anos, com ações baseadas em fundamentação científica e experiência profissional, as quais tem resultado na inserção do profissional de educação física como parte integrante do corpo clínico e ao tratamento de “Profilaxia” instalado pelo Ministério da Saúde atualmente. Dedico também, ao Sr. Geremias Cavalcante (in memoriam), paciente, amigo e adepto
BELTRAME, Luis Gustavo Normanton. O efeito agudo do exercício aquático moderado em fatores da coagulação de pessoas com hemofilia. 2013. 123f. Dissertação (Mestrado) – Programa de Pós-Graduação em Educação Física, Universidade Católica de Brasília - UCB, Brasília, 2013.
A hemofilia é um distúrbio da coagulação caracterizado por sangramento prolongado. O efeito do exercício físico sobre a hemostasia em hemofílicos ainda tem sido pouco estudado. Este estudo tem como objetivo analisar o efeito agudo de uma sessão de exercício moderado em meio aquático na hemostasia de pessoas com hemofilia. Os parâmetros hemostáticos analisados foram: fator VIII (FVIII), tempo de protrombina (TP), tempo de tromboplastina parcialmente ativado (TTPA), e fibrinogênio. A amostra foi composta de 10 hemofílicos adultos (22,3 ± 7,3 anos; IMC 21,7 ± 3,27) familiarizados com o treinamento aquático. Durante toda a sessão a frequência cardíaca foi monitorada. Observou-se um possível efeito benéfico no período do exercício no TP (-11,4%; intervalos de confiança -26,1 a 3,3%) e TTPA (-5,2%; -14,8 a 4,4); efeito incerto do FVIII (+42%; 90% -35 a 120%), sem mudanças nos níveis de fibrinogênio; e uma associação significativa entre FC durante o exercício e o TP após exercício (r=0,770; p=0,009). As maiores mudanças foram encontradas em hemofílicos moderados. Uma sessão de exercícios moderados na água pode influenciar positivamente alguns fatores de coagulação em pessoas com hemofilia. Este é um aspecto importante na melhora do quadro clínico. Entretanto, maiores estudos são necessários para verificar a influencia de diferentes intensidades e o exercício crônico sobre o processo hemostático desta população.
Hemophilia is a bleeding disorder characterized by prolonged bleeding episodes. The effect of the exercise on the coagulation cascade in hemophiliacs has been poorly studied. The goal of this study was to analyze the acute effect of a single session of moderate aquatic exercise on haemostasis in hemophiliacs. The haemostatic parameters selected were: factor VIII (FVIII) levels, protrombine time (PT), activated partial tromboplastine time (APTT), and fibrinogen.
The sample was composed by 10 hemophiliac adults (22.3 ± 7.3 yrs; BMI 21.7 ± 3.27) familiarized with aquatic training. Exercise intensity was monitored by means of heart rate (HR). There were possibly beneficial effects of the exercise bout on PT (–11.4%; confidence intervals –26.1 to 3.3%) and APTT (–5.2%;–14.8 to 4.4), an unclear effect of FVIII (+42%; 90%:–35 to 120%), with a trivial change on fibrinogen levels; and a significant association between the mean rise in HR during session and PT after exercise (r=0.770; p=0.009). The greater changes were observed in the participants with the moderate level of hemophilia. A short bout of moderate intensity of aquatic exercise may have a positive influence on some coagulatory factors in adults with haemophilia. This may be an important issue in a clinical setting. Further studies are warranted for testing the influence of different exercise intensities and regular exercise on haemostasis.
Figura 1 –Estágios de desenvolvimento da capacidade reprodutora de pessoas com hemofilia e portadoras. Gerações - Sec. XIX - 10%; 1960 - 40%; 2007 - 80%). Fonte: Kasper e Buzin (2007)…...18
Figura 2 – Cascata de Coagulação - Cininogênio de alto peso molecular (CAPM), pré- calicreína (PK), Inibidor do Fator Tissular (IVFT). Conversão e ativação de fatores (seta preta), ação de inibidores (seta vermelha), reações catalisadas por fatores ativados (seta azul), funções da trombina (seta cinza). Fonte: http://pt.wikipedia.org/wiki/coagulação_sanguínea. ... 30
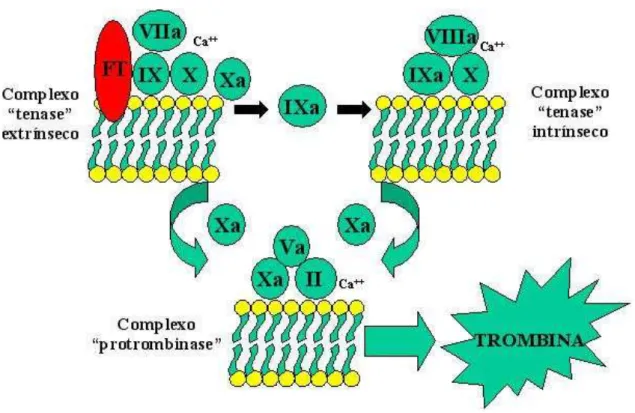
Figura 3 – Representação esquemática dos complexos pró-coagulantes. O início da coagulação se faz mediante ligação do fator VIIa ao fator tecidual (FT), com subsequente ativação dos fatores IX e X. O complexo fator IXa/fator VIIIa ativa o fator X com eficiência ainda maior, e o fator Xa forma o complexo protombinase com o fator Va, convertendo o fator II (protrombina) em fator IIa (trombina). A superfície de membrana celular em que as reações ocorrem também se encontra representada. Fonte: Franco (2001) ... 31
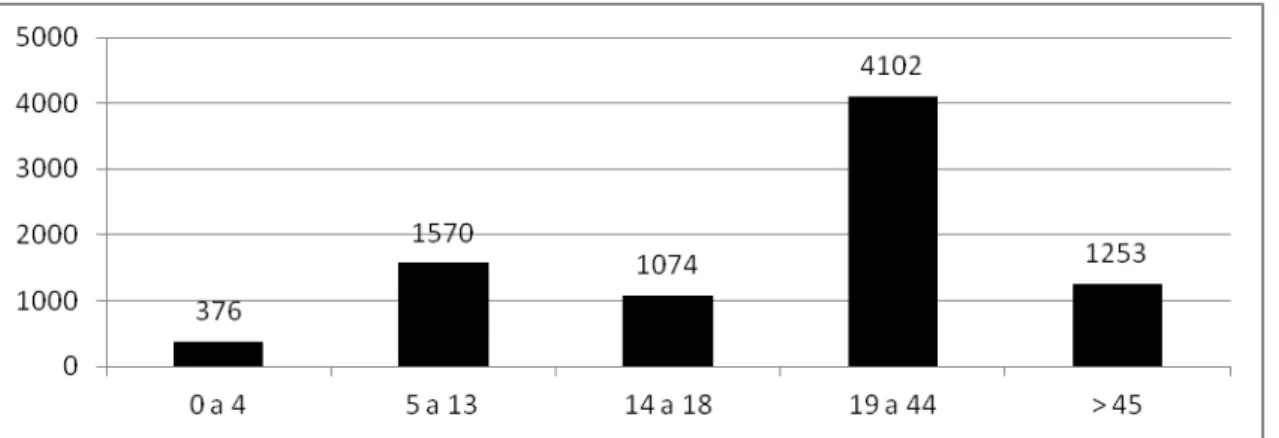
Gráfico 1 – Gráfico baseado nos dados da Federação Mundial de Hemofilia, 2011 (World Federation of Hemophilia. Report on the Annual Global Survey 2010, publicado em
A - Área de superfície projetada a - Ativado (ex. fator VIIa) bpm - Batimentos por minuto Ca2+ - Íons de cálcio
Cd - Coeficiente de arrasto DMO - Densidade Mineral Óssea Fator II - Protrombina
FC - Frequência Cardíaca FT - Fator Tecidual
FVIII - Fator oito da coagulação FvW - Fator de von Willebrand HCV - Vírus da Hepatite C HIC - Hemorragias Intracranianas
HIV/SIDA- Vírus da Imunodeficiência Humana CAPM - Cininogênio de Alto Peso Molecular IIa - Trombina
IMC - Índice de Massa Corporal ON - Óxido Nítrico
p - Densidade do fluido
PCH - Pessoa(s) com hemofilia PK - Pré-calicreina
R - Resistência de avanço
IVFT - Inibidores da Via de Fator Tecidual TP - Tempo de Protrombina
1. INTRODUÇÃO ... 14
1.1 JUSTIFICATIVA ... 16
1.2 OBJETIVOS ... 17
1.2.1 Objetivo Geral ... 17
1.2.2 Objetivos Específicos ... 17
2. REVISÃO DE LITERATURA ... 18
2.1 CONSIDERAÇÕES ESPECÍFICAS SOBRE HEMOFILIA ... 18
2.1.1 Prevalência ... 18
2.1.2 Manifestação e sítios de sangramento ... 19
2.1.3. Tratamento da hemofilia ... 21
2.2 ATIVIDADES FÍSICAS PARA PESSOAS COM HEMOFILIA (PCH) ... 24
2.3 EFEITOS DO EXERCÍCIO SOBRE A HEMOSTASIA ... 29
2.3.1 Mecanismo de ativação da cascata de coagulação ... 29
2.3.2 O efeito do exercício sobre o sistema hemostático. ... 32
2.3.3 Efeitos do treinamento aquático ... 35
3. MATERIAIS E MÉTODOS ... 39
3.1 PROCEDIMENTOS METODOLÓGICOS ... 39
3.1.1 Participantes ... 39
3.1.2 Procedimentos ... 39
3.1.3 Análise estatística ... 40
4. RESULTADOS ... 42
5. DISCUSSÃO ... 43
6. CONCLUSÃO ... 46
7. PERSPECTIVAS FUTURAS ... 47
7.1. OUTRAS PROPOSTAS DE ATIVIDADES AQUÁTICAS PARA PCH ... 47
7.2. TREINAMENTO AQUÁTICO: DOSE RESPOSTA VS EFEITO TERAPÊUTICO NÃO FARMACOLÓGICO ... 48
7.3. ESTUDO DO EFEITO CRÔNICO DO TREINAMENTO AQUÁTICO ... 48
7.4. APLICAÇÃO PRÁTICA ... 49
QUEROL F, PÉREZ-ALENDA S, GALLACH JE, et al. Hemofilia: ejercicio y deporte.
Apunts Medicina de l'Esport 2011; 46(169): 29- 39. ... 59
APÊNDICE ... 62
APÊNDICE A – Artigo aceito para publicação na Revista Brasileira de Cienantropometria e Desempenho Humano ... 62
APÊNDICE B – Termo de Consentimento Livre e Esclarecido ... 77
APENDICE C - Resumo expandido premiado no 2º ConCREF7 ... 78
APÊNDICE D- Resumo publicado - International Journal of Exercise Science ... 87
APÊNDICE E – Comunicações em congresso ... 88
APÊNCICE F – Artigo aceito para publicação – Journal of Strength and Conditioning Research (JSCR). ... 92
ANEXOS ... 120
ANEXO A – Questionário Internacional de Atividade Física (IPAQ) - Versão Curta. ... 120
1. INTRODUÇÃO
As hemofilias são as coagulopatias mais preocupantes e podem ser dividida em três tipos: Hemofilia A, Hemofilia B e Hemofilia C. A Hemofilia C ou Síndrome de Rosenthal é uma doença caracterizada pela deficiência do fator XI, podendo acometer homens e mulheres devido a sua característica autossômica recessiva não ligada ao cromossomo X e com manifestações clínicas de sangramentos que diferem das demais hemofilias (MÓDOLO et al., 2010). Já as hemofilias A e B são doenças hereditárias, podendo ocorrer casos de mutação genética sem histórico familiar. Atingem, em sua maioria, pessoas do sexo masculino enquanto as mães são portadoras da doença e não manifestam os sintomas. Tal enfermidade está associada à deficiência de proteína de coagulação sanguínea (fator). A hemofilia A (deficiência de fator VIII) e hemofilia B (deficiência de fator IX) são caracterizadas por episódios de sangramento prolongado em diversos locais do corpo, principalmente nas articulações (ANDERSON et al., 2000). Ambas apresentam manifestações clínicas semelhantes e serão discutidas com mais ênfase ao longo desta dissertação, pois este é o foco principal do estudo que norteia este trabalho.
As Hemartroses (sangramento articular), sinovites (inflamação da sinóvia) e manchas roxas são alguns dos problemas mais frequentes em pacientes com hemofilia A e B. Estas complicações são geralmente acompanhadas de atrofia muscular em volta das articulações, possivelmente pelo menor uso da musculatura (TIKTINSKY et. al., 2002). Este quadro clínico envolve um processo degenerativo da articulação, conhecido como “artropatia hemofílica”. As hemorragias intra-articulares representam em torno de 65% a 80% dos episódios de sangramento (FERNÁNDEZ e BATISTELLA, 1992). O círculo vicioso ocasionado pelo aumento do aporte sanguíneo, inflamação da sinóvia, neovascularização e danos na cápsula articular tem sido a causa do aumento da dor, instabilidade articular e deficiência física em pessoas com hemofilia (PCH). Estes fatores refletem-se em baixos níveis de atividade física reportados nesta população associados a um alto índice de lesões e sangramentos (GONZALEZ et al.,2007; QUEROL et al., 2004; STEPHENSEN et al., 2004;
BEETON et al., 1998), e dificuldades para a realização de atividades comuns na vida diária (VAN GENDEREN et al., 2002; MILLER et al., 1997).
fatores de coagulação. As coagulopatias mais graves são as hemofilias A e B, as quais são caracterizadas por uma desordem hemorrágica associada ao mau funcionamento do sistema hemostático. Estas enfermidades são hereditárias, recessivas e estão relacionadas à mutação genética no braço longo do cromossomo X (KASPER e BUZIN, 2007; MANO, 2005). De acordo com Pio et al., (2009), o gene que codifica o FVIII esta localizado no braço longo do cromossomo X, na porção Xq28 e compreende 186.000 pares de base distribuídos entre 26 éxons e 25 íntrons que variam de 69 a 3.160 pares de base e de 0,2 a 32,4 kilobases, respectivamente. Além disso, este gene apresenta um baixo índice de polimorfismo e são reportadas também, mutações genéticas associadas ao FVIII com participação de outros genes, podendo resultar em deficiências combinadas dos fatores da coagulação. Segundo o mesmo autor, alguns trabalhos demonstram ainda a relação entre a variação quanto ao padrão de manifestações hemorrágicas, podendo estar relacionado a variabilidade fenotípica associada a farmacocinética do medicamento, e as mutações: no gene da protrombina, no gene da metilenotetrahidrofolato redutase, deficiência da proteína C e proteína S ou co-herança de polimorfismo que afetam o sistema de coagulação.
Estima-se atualmente que o número de pessoas diagnosticadas com hemofilia no mundo é aproximadamente 400.000 (SRIVASTAVA et al., 2012; EVATT, 2005). Levando-se em consideração os dois tipos de hemofilia e todos os graus de Levando-severidade da enfermidade, há uma ocorrência de um para cada 5.000 nascimentos do sexo masculino (KASPER e BUZIN, 2007). A ação de atenção a pacientes portadores de coagulopatias representa 73% da programação orçamentária para o quadriênio previsto pelo Tribunal de Contas da União; dos quais, 85% dos recursos empregados para o tratamento são destinados para o compra de medicamentos (SANTOS et al., 2007). O tratamento de PCH é realizado por meio de terapia de reposição de fator de forma intravenosa, levando-se em consideração o nível sérico de fator presente no sangue e as manifestações de sangramento.
al., 2006; CALEFI et al., 2006), bem como na melhora das condições músculo esqueléticas (SRIVASTAVA et al., 2012; TIKTINSKY et al., 2009; WEIGEL e CARLSON, 1975) e capacidade cardiorrespiratória associado a melhor desempenho motor (VALLEJO et al., 2010).
Além de benefícios músculo esqueléticos, alguns estudos reportam a possibilidade da ativação da cascata de coagulação associada ao aumento da intensidade do exercício (LIPPI e MAFFULLI, 2009; RIBEIRO e OLIVEIRA, 2005; EL-SAYED et al., 2000). Entretanto, são poucos estudos que verificaram tais efeitos em PCH (DEN UIJL et al., 2011; KOCH et al., 1984), sugerindo desta forma o preenchimento de uma lacuna ainda pouco estudada no tratamento de PCH que consiste na determinação da dose resposta do exercício físico associada a melhoras no processo de coagulação.
1.1 JUSTIFICATIVA
Estudos diversos relacionam o exercício físico com alterações significativas na hemostasia tais como alterações na cascata proteolítica (DUFAUX et al., 1991), níveis aumentados de coaguloabilidade (SMITH, 2003; LIPPI e MAFFULLI, 2009) e a alteração de fatores complementares da coagulação em situações de “estresse orgânico”, como o exercício físico (ISRAEL e ISRAEL, 2002).
Há indicações que os efeitos de exercícios vigorosos podem proporcionar mecanismos fisiológicos suficientes para ativação destes componentes sanguíneos (SMITH, 2003). A aplicação de protocolos diferentes tem demonstrado aumentos significativos no mecanismo de ativação da coagulação induzido pelo exercício, inclusive em pessoas sedentárias (EL-SAYED et al., 2000; VAN DEN BURG. et al., 2000). Algumas alterações podem estar relacionadas com a melhora transitória do processo de coagulação em hemofílicos. Entretanto, esta hipótese ainda tem sido pouco estudada (KOCH et al., 1984; DEN UIJL et al., 2011).
1.2 OBJETIVOS 1.2.1Objetivo Geral
Analisar o efeito agudo do treinamento aquático sobre a hemostasia de pessoas com hemofilia (PCH).
1.2.2Objetivos Específicos
Verificar o efeito agudo do exercício físico na água no processo de coagulação em pessoas com hemofilia por meio de mensuração dos seguintes parâmetros: FVIII, TTPA, TP e Fibrinogênio.
2. REVISÃO DE LITERATURA
2.1 CONSIDERAÇÕES ESPECÍFICAS SOBRE HEMOFILIA
2.1.1Prevalência
As hemofilias A e B atingem um a cada 5.000 nascimentos do sexo masculino, considerando todos os graus de severidade da doença (KASPER e BUZIN, 2007). O número de hemofílicos A (deficiência do fator VIII) é quatro vezes maior que o de hemofílicos B (deficiência do fator IX). De acordo com o nível sérico de fator de coagulação 35% dos pacientes são severos (< 0,01 UI mL-1), 15% dos pacientes são moderados (0,01- 0,05 UI mL
-1) e 50% são hemofílicos leves (0,05 – 0,40 UI mL-1), conforme reportado por Berntorp e
Shapiro (2012). A hemofilia é uma enfermidade hereditária, recessiva e ligada ao sexo. Geralmente afeta os indivíduos do sexo masculino devido a alteração genética encontrada no braço longo do cromossomo X (porção Xq28), estimando-se cerca de um terço de mutações genéticas sem histórico familiar antecedente (SRIVASTAVA et al., 2012). Entretanto, estima-se um crescimento significativo de PCH para as gerações futuras, pois já pode estima-ser obestima-servada uma crescente capacidade de reprodutividade nesta população, com um aumento de 10% no século XIX para 80% em 2007 (KASPER e BUZIN, 2007). Tal fato, aponta para um maior número de portadoras e possível perpetuação do gene mutante que predispõe a hemofilia (ver Figura 1).
Figura 1. Estágios de desenvolvimento da capacidade reprodutora de pessoas com hemofilia e portadoras. Gerações - Sec. XIX - 10%; 1960 - 40%; 2007 - 80%. Fonte: Kasper e Buzin, (2007).
região centro-oeste, estima-se 530 hemofílicos: 201 no Distrito Federal, região onde foi realizado o presente estudo; e 220 no estado de Goiás (BARCA et al., 2010). Este é um dos fatores que justifica o número reduzido de voluntários na presente pesquisa. Apesar do número não tão expressivo de pessoas acometidas por hemofilia, esta doença é considerada uma das coagulopatias mais graves devido à manifestação de aspectos clínicos diversos associados aos sangramentos prolongados tais como: hematomas musculares; hemartroses, sangramentos que ocorrem nas articulações e podem ocasionar deterioração óssea da cápsula articular; hematúria, presença de sangue na urina; sangramentos gastrointestinais; sangramentos intracranianos entre outros.
Gráfico 1. Gráfico baseado nos dados da Federação Mundial de Hemofilia, 2011 (World Federation of
Hemophilia. Report on the Annual Global Survey 2010, publicado em 2011).
2.1.2Manifestação e sítios de sangramento
Esta enfermidade é caracterizada de acordo com o grau de severidade. Hemofílicos leves apresentam 5-40 UI dL-1 (0,05 – 0,40 UI mL-1) da proteína fator VIII ou IX na corrente sanguínea, sangramentos em situações de trauma severo, quadro cirúrgico e raramente sangramentos espontâneos. Hemofílicos moderados apresentam de 1-5 UI dL-1 (0,01- 0,05 UI mL-1), sangramentos espontâneos ocasionais e sangramentos decorrentes de traumas menores ou cirurgias. Hemofílicos severos ou graves apresentam uma quantidade menor que 1 UI dL-1 (<0,01 UI mL-1) e apresentam uma predisposição a sangramentos espontâneos, predominantemente nas articulações e músculos (SRIVASTAVA et al., 2012).
nervoso central, gastrointestinal, no pescoço, na garganta e trauma severo) (SRIVASTAVA et al., 2012). Os sangramentos articulares (hemartroses) são os tipos de sangramento de maior incidência. Os sítios de sangramento mais acometidos são os joelhos, cotovelos e tornozelos, com uma prevalência de 45%, 30% e 15% respectivamente (WFH, 2005).
Há uma frequência de 70-80% de hemartroses, 10-20% de sangramentos musculares, 5-10% de outros sangramentos e menor que 5% de sangramentos no sistema nervoso central (SRIVASTAVA et al., 2012). Estes sangramentos podem levar a diversas complicações crônicas tais como: a) complicações músculo esqueléticas - sinovites, hemartroses, artropatia hemofílica crônica, contraturas, formação de pseudotumor e fraturas; b) inibidores de fator VIII e IX - anticorpos produzidos para inibir o efeito desejado do medicamento; c) reações alérgicas e infecções relacionadas à transfusão - Vírus da Imunodeficiência Humana Adquirida (HIV/SIDA), Hepatite B, Hepatite C, Hepatite A, Parvovirus B19, outros (SRIVASTAVA et al., 2012).
Os sangramentos mais comumente encontrados em PCH são as hemartroses, acometendo grande parte dos hemofílicos severos e levando a quadros de degeneração óssea crônica conhecida como a artropatia hemofílica ((RODRIGUEZ-MERCHAN, 2010; MULVANY, et al., 2010). Os primeiros sangramentos ocorrem na primeira infância, nos 12 ou 24 primeiros meses de vida (MULVANY, et al., 2010). Os sintomas mais comuns de um sangramento são: dor, inchaço, limitação articular (MARVIN, 1997), calor local e hematoma (RODRIGUEZ-MERCHAN, 2012).
Além dos sangramentos articulares, há sangramentos que podem ocorrer diretamente nos músculos. Os sangramentos musculares mais comuns são sangramentos de iliopsoas, quadríceps, gastrocnêmico/solear e flexores do braço, podendo levar a quadros de “síndrome compartimental”, comprometimento neurovascular, contraturas, fibroses, hematomas e pseudotumores (MULVANY et al., 2010). Dentre as maiores preocupações para tais sangramentos estão: sangramento no músculo iliopsoas - risco de paralisia do nervo femoral; sangramento do músculo gastrocnêmico - risco de deformidade (exemplo: “pé equino” ou contratura equina) ocasionada por lesão do nervo tibial posterior e contratura do músculo; e sangramento dos flexores do braço - risco de contratura isquêmica de Volkmann
(SRIVASTAVA et al., 2012).
A análise de frequência de sangramentos em diferentes tipos de tratamento em hemofílicos com idade entre um e cinco anos demonstrou uma menor incidência de sangramentos articulares do que sangramentos em outros sítios (MANCO JOHNSON et al., 2007). Entre o sangramento de maior severidade, com altas taxas de mortalidade e disfunções neurológicas estão às hemorragias intracranianas (HIC) (ZANON et al., 2012). Lesões pós-traumáticas na cabeça e/ou fortes dores de cabeça são sintomas comuns de uma HIC que devem ser tratadas antes de serem avaliadas, pois representam eminente risco de morte (SRIVASTAVA et al., 2012). Assim, os resultados de sangramentos de repetição para PCH nas fases da infância e adolescência sem o adequado tratamento podem repercutir em alterações musculoesqueléticas, dor e limitação articular, encontradas comumente na fase adulta.
2.1.3.Tratamento da hemofilia
2007) que consiste na aplicação do medicamento de forma preventiva, antevendo possíveis episódios hemorrágicos.
Embora existam divergências de protocolos em relação a quando começar a profilaxia, Berntorp e Shapiro (2012) relatam que em estudo comparativo realizado com dois modelos de tratamento, o sueco e o holandês, que iniciam a profilaxia aos dois e cinco anos de idade respectivamente, verificou-se menor número de hemartroses por ano no modelo sueco, o qual inicia o tratamento mais precocemente que o holandês. Estes achados, reforçam ainda mais a importância de se iniciar o tratamento profilático na primeira infância como fator primordial para saúde e qualidade de vida de PCH.
De acordo com Berntorp e Shapiro (2012), o mecanismo causador da hemofilia foi reconhecido na década de 1950, entretanto até a década de 1960, onde o plasma e o crioprecipitado eram os únicos produtos disponíveis para o tratamento da hemofilia A (MANNUCI, 2012), a reposição de concentrados de fator de coagulação ainda não estava disponível a população em geral. Na década de 1970 os concentrados não estavam suficientemente prontos e refinados para a autoaplicação. Já na década de 1980, houveram registros elevados de contaminações virais como a hepatite e HIV/SIDA (MANNUCCI, 2011), aumentando os níveis de morbidade nesta população. Visto a necessidade e efetividade do tratamento e autoadministração do medicamento, também conhecido como tratamento domiciliar, às duas últimas décadas foram marcadas por um crescente desenvolvimento dos fármacos e meios de tratamento mais eficazes. Atualmente estima-se que a expectativa de vida de uma PCH, que tem acesso ao medicamento e que façam o tratamento adequado, esteja próximo ao da população em geral.
JOHNSON et al., 2007), há evidências que 80-85% da população mundial de hemofílicos ainda recebem o tratamento por demanda, conforme descrito acima, ou não recebem tratamento algum (RODRIGUEZ-MERCHAN, 2010).
Levando-se em consideração todas as fases do tratamento, Srivastava et al., (2012), em nova versão do protocolo mundial de tratamento da PCH, definem os seguintes protocolos: tratamento por demanda, profilaxia primária, profilaxia secundária, profilaxia terciária e profilaxia intermitente.
a) Tratamento por demanda - Tratamento dado no momento em que ocorre uma evidência clínica de sangramento comprovada;
b) Profilaxia primária - Reposição regular e contínua (mínimo de 45 semanas ao ano) do fator de coagulação. Iniciado na ausência de lesão osteocondral observada por meio de exames físicos e/ou estudos de imagem, antes da segunda evidência clínica de sangramento em grandes articulações (joelho, tornozelo, cotovelo, quadril e ombro) e antes de completar três anos de idade;
c) Profilaxia secundária - Reposição regular e contínua (mínimo de 45 semanas ao ano) do fator de coagulação. Inicia-se depois de dois ou mais sangramentos articulares e antes de iniciar um dano articular documentado por exames físicos e/ou de imagem; d) Profilaxia terciária - O tratamento de reposição de fator começa no início de um
quadro patológico de dano articular documentado em exames físicos e radiográficos da articulação afetada;
e) Profilaxia intermitente - Tratamento dado para prevenir sangramentos por períodos que não excedem 45 semanas durante um ano.
Assim, de maneira geral, o tratamento de uma PCH pode ser dividido em: tratamento sob demanda, cuja aplicação do fator de coagulação ocorre após um episódio de sangramento; e o tratamento de profilaxia, cuja aplicação ocorre de forma preventiva de 2 a 3 vezes por semana.
al., 2010; NAZZARO et al., 2006). Além de tais comportamentos observados entre pessoas com hemofilia e seus familiares, hemofílicos tratados sob regime de demanda reportam um quadro de incapacidade funcional e dor associados a um comportamento sedentário (ROYAL et al., 2002) observados desde a infância, demonstrando assim maior efetividade do tratamento profilático sobre o tratamento em demanda (MANCO JOHNSON et al., 2007).
Não se sabe ao certo os efeitos da atividade física sobre o tratamento profilático de pessoas com hemofilia. Apesar de reportados efeitos benéficos sobre melhora das condições musculoesqueléticas associadas e diminuição de sangramentos (VON MACKENSEN et al., 2012; CZEPA D et al. 2012; TIKTINSKY et.al., 2002), há uma lacuna nos estudos associando modelos de treinamento com os mecanismos farmacocinéticos dos concentrados de fatores de coagulação para tratamento individualizado (COLLINS, 2012). Estudo recente (DEN UIJL et al., 2011) demonstra a ativação do FVIII em hemofílicos leves e moderados frente a atividade de esforço extenuante, mas poucos estudos tem mencionado a dose resposta do exercício sobre os marcadores de coagulação e discutido novos modelos de treinamento para esta população tal como sugerido por Souza et al., (2012).
2.2 ATIVIDADES FÍSICAS PARA PESSOAS COM HEMOFILIA (PCH)
Os primeiros estudos sobre qualidade de vida em PCH surgiram em 1990 com a utilização de questionários genéricos, tais como SF 36 e EQ-5D (VON MACKENSEN, 2007). Em 2007 já podemos encontrar trabalhos científicos com questionários mais específicos para verificar a qualidade de vida de PCH (Haemo-QoL). A atividade física sempre foi um quesito importante abordado nestes instrumentos. Desta forma, estudo recente (CZEPA et al., 2012) procura a validação de tal instrumento (HEP-Test-Q) associado a testes de campo, tais como caminhada de 12 minutos, para identificação da aptidão física em hemofílicos e correlação com questionários específicos, visto que o tratamento atual e o acesso ao tratamento estão levando as PCH a um aumento significativo na expectativa de vida.
concentrado de fator, evidências científicas destacam a atividade física como recurso terapêutico na melhora de aspectos fisiológicos e psicológicos das PCH. Desde então, a atividade física tem sido vista como componente necessário no tratamento e manutenção da capacidade funcional por meio de exercícios físicos e inclusão social (DE LA CORTE-RODRIGUEZ e CORTE-RODRIGUEZ-MERCHAN, 2012; VALLEJO et al., 2010; WEIGEL e CARLSON, 1975).
Há evidências científicas que reportam a diminuição de sangramentos devido à melhora da condição musculoesquelética em praticantes de atividade física regular (CZEPA et al., 2012; TIKTINSKY et al., 2002). Esta prerrogativa se mostra de grande importância no desenvolvimento de novas concepções para a aplicabilidade de novos modelos de treinamento para esta população. Sugere-se ainda a possibilidade do tratamento ajustar-se ao padrão de sangramento, condição musculoesquelética e ao tipo de atividade física a ser praticado por cada indivíduo, com possibilidades de aumento da eficácia do medicamento por meio de mensuração farmacocinética da atividade do fator de coagulação nestas condições (COLLINS, 2012).
Em primeiro momento, evidências científicas têm demonstrado que o papel da atividade física para as PCH está voltado para a prevenção de lesões e diminuição da deterioração da cápsula articular, levando esta população à diminuição de morbidade e mortalidade (DE LA CORTE-RODRIGUEZ e RODRIGUEZ-MERCHAN, 2012). Tal fato tem levado a maiores recomendações para a prática de atividades físicas regulares entres as PCH. Entretanto, evidências científicas também tem demonstrado grande preocupação com fatores de risco associados ao sedentarismo e ao envelhecimento como: obesidade e sobrepeso; (MONAHAN et al., 2011) osteoporose (GHOSH e SHETTY, 2012; FALK et al., 2005) e qualidade de vida das PCH (CZEPA et al., 2012; VON MACKENSEN, 2007).
Observa-se frequentemente a relação do exercício físico e o esporte como modelos de atividades físicas bem aceitas na reabilitação e tratamento das PCH. Apesar de diversos estudos terem demonstrado uma forte associação entre a atividade física de uma forma geral e benefícios relacionados à qualidade de vida tais como, inclusão social (WEIGEL e CARLSON, 1975, BUZZARD et al., 2007), melhora da autoestima (VON MACKENSEN, 2007), redução de comorbidades (GHOSH e SHETTY, 2012; SOUZA et al., 2012; DE MOERLOOSE et al., 2012), não são encontrados registros que abordem propriamente a importância da dose resposta do exercício no tratamento das PCH.
A relação tratamento e atividade física é frequentemente associada à reposição de concentrado de fatores de coagulação no sangue de forma preventiva e precoce (tratamento profilático), principalmente em hemofílicos graves (BUZZARD et al., 2007), além de orientações para diminuição de lesão durante a prática de esportes (PETRINI et al., 2009). Embora pesquisadores mais recentes reportem que em condições hemostáticas adequadas as PCH podem manter uma boa condição física, com impactos relevantes na diminuição de comorbidades e mortalidade (DE LA CORTE-RODRIGUEZ et al., 2012), são poucos os estudos que sugerem alguma alteração no mecanismo de coagulação de acordo com a intensidade do exercício (DEN UIJL et al.,2011; KOCH et al., 1984).
Entre os fatores de maior preocupação nos estudos que abordam a qualidade de vida relacionada à atividade física para as PCH, a saúde articular parece representar uma variável preocupante, a qual determina de forma clara os menores níveis de aptidão física entre indivíduos hemofílicos (CZEPA et al., 2012; LUTEREK et al., 2009; DOUMA-VAN RIET et al., 2009; GERSTNER et al., 2009; KHAWAJI et al., 2009; VAN DER NET et al., 2006). Desta forma, a manutenção de condições hemostáticas ideais (profilaxia primária) ainda é o fator decisivo para a prática de atividades físicas entre as PCH (DE LA CORTE-RODRIGUEZ et al., 2012; KHAWAJI et al., 2010).
(MULDER et al., 2004). Além do tratamento farmacológico adequado há outros fatores que envolvem a prática de esportes.
A atividade física desempenha um importante papel na aquisição de melhor condicionamento físico, força, resistência aeróbia, coordenação motora e aduz ainda aspectos favoráveis a inclusão social, melhora da autoestima, entre outros aspectos psicossociais (DOUMA-VAN RIET et al., 2009; VAN DER NET et al., 2006; MULDER et al., 2004; VON MACKENSEN, 2007). Apesar de alguns estudos reportarem a efetiva resposta da prática de esportes entre PCH como aspectos relevantes na melhora das condições musculoesqueléticas (GOMIS et al., 2009), bem como melhora da mobilidade articular, força, resistência e coordenação motora (CZEPA et al., 2012), há uma grande preocupação em relação ao aumento da proporção de sangramentos em hemofílicos submetidos a exercícios vigorosos (TIKTINSKY et al., 2009). Todavia, não há nenhuma associação linear entre a força e perfil de sangramento (TIKTINSKY et al., 2009). Desta forma, entre crianças e adolescentes com hemofilia é possível observar a maior tendência à participação de atividades esportivas com um maior nível de preocupação relacionado ao possível aumento de lesões ocasionadas principalmente por trauma, apontando como esporte mais recomendado a natação (TIKTINSKY et al., 2009; WEIGEL e CARLSON, 1975). Apesar de termos a natação como um dos esportes mais recomendados para as PCH, principalmente adultos com limitações articulares, há que se aproveitar o ambiente aquático para outras atividades tais como o treinamento aquático.
como sugestão para diminuição da dor, melhora da mobilidade articular e função motora (LUTEREK et al., 2009).
Outra preocupação observada em hemofílicos adultos é a diminuição da massa óssea, que está associada aos longos períodos de imobilização que podem acarretar em osteopenia e osteoporose. As variáveis associadas a este quadro em PCH são: menores níveis de vitamina D, baixo IMC, menores níveis de atividade física; amplitude articular reduzida; histórico de inibidor, HIV/SIDA, vírus da hepatite C (HCV), e idade (GERSTNER et al., 2009). Tal fato reforça mais uma vez a importância da profilaxia precoce em hemofílicos para aperfeiçoar a realização de uma capacidade de tensão mecânica favorável ao desenvolvimento da massa óssea já na infância e adolescência (KHAWAJI et al., 2010). Nos casos de artropatia hemofílica ou limitação articular as atividades aquáticas têm sido frequentemente recomendadas, entretanto pouco estudadas, mas demonstram melhoras expressivas dos parâmetros cardiorrespiratórios e desempenho motor quando comparados antes e após 27 sessões com duração de 1h e frequência semanal de três vezes (VALLEJO et al., 2010).
Desta forma, a maior parte dos estudos analisados tem reportado os efeitos da atividade física sobre a melhora da qualidade de vida em PCH levando-se em consideração benefícios em relação à capacidade aeróbia, aumento de força, equilíbrio, flexibilidade e coordenação motora. Tais benefícios têm sido mais comumente reportados de acordo com os avanços do tratamento, principalmente em hemofílicos severos, os quais comumente apresentam um número maior de possibilidades de sangramentos espontâneos. Entre os sangramentos de maior preocupação estão os sangramentos articulares, os quais têm se apresentado como a maior causa de incapacidade física e funcional, diminuindo os níveis de atividade física e qualidade de vida desta população.
As crianças com hemofilia severa, tratadas com concentrados de fator de forma profilática, têm sido encorajadas na prática de esportes e a literatura apresenta preocupações em relação ao aumento de possibilidades de lesões por trauma visto a maior liberdade de participação em tais atividades.
importância da atividade física como recurso terapêutico em suas diversas modalidades para o tratamento de PCH.
2.3 EFEITOS DO EXERCÍCIO SOBRE A HEMOSTASIA
2.3.1 Mecanismo de ativação da cascata de coagulação
A hemostasia representa uma complexa interação entre coagulação, sistema fibrinolítico, plaquetas, células circulantes e alterações da parede vascular (EL-SAYED et al., 2004). Em resposta a uma lesão vascular as plaquetas circulantes agregam-se e aderem à superfície celular para o início do processo de coagulação sanguínea. A manutenção da integridade vascular é representada pelo coágulo de fibrina (FRANCO, 2001). A coagulação e a fibrinólise constituem dois importantes oponentes no processo hemostático e formação do trombo. A ativação do sistema de coagulação induz a formação de fibrina, enquanto a ativação do mecanismo fibrinolítico resulta em degradação do coágulo de fibrina, os quais são regulados pelo equilíbrio entre ativadores e inibidores deste processo (VAN DEN BURG et al., 1997). O mecanismo regulador deste processo se contrapõe a perda excessiva de sangue e a formação de trombos intravasculares provenientes da formação excessiva da fibrina (FRANCO, 2001).
A coagulação sanguínea é um importante mecanismo do sistema hemostático associado a uma série de mecanismos fisiológicos que envolvem proteases, enzimas, e cofatores de coagulação para a geração de trombina e formação da rede de fibrina que sela o tampão hemostático. Este mecanismo de coagulação sanguínea pode ser subdividido em três vias: a) via intrínseca ou via de contato - caracterizada pela ativação do fator de Hageman
Figura 2. Cascata de Coagulação. Cininogênio de Alto Peso Molecular (CAPM), Pré-calicreina (PK), Inibidor da Via do Fator Tissular (IVFT). Conversão e ativação de fatores (seta preta), ação de inibidores (seta vermelha), reações catalisadas por fatores ativados (seta azul), funções da trombina (seta cinza). Fonte: http://pt.wikipedia.org/wiki/coagulação_sanguínea.
Figura 3. Representação esquemática dos complexos pró-coagulantes. O início da coagulação se faz mediante ligação do fator VIIa ao fator tecidual (FT), com subseqüente ativação dos fatores IX e X. O complexo fator IXa/fator VIIIa ativa o fator X com eficiência ainda maior, e o fator Xa forma o complexo protombinase com o fator Va, convertendo o fator II (protrombina) em fator IIa (trombina). A superfície de membrana celular em que as reações ocorrem também se encontra representada. Fonte: Franco (2001).
As plaquetas também desempenham um importante papel no processo de coagulação, particularmente na via intrínseca da cascata de coagulação e têm a função de agregação e adesão na formação do tampão hemostático. Outro importante papel das plaquetas é o transporte de fibrinogênio e outros componentes liberados durante a agregação plaquetária (e.g. β tromboglobulina, fator plaquetário IV) (EL-SAYED et al., 2004). Os reguladores fisiológicos do mecanismo de coagulação são os inibidores da via de fator tecidual (IVFT), antitrombina, proteína C e proteína S, tal como mostra a Figura 2.
A cascata de coagulação é composta por diversos fatores de coagulação que desempenham função específica em todo processo de coagulação. Quando há uma deficiência em algum destes fatores de coagulação denomina-se de coagulopatia. Dentre as principais coagulopatias temos a hemofilia (A e B), detectada por meio de exames laboratoriais específicos. Os principais testes laboratoriais para detecção de distúrbios hemorrágicos são: tempo de protrombina (TP), o qual detecta alteração na via extrínseca de coagulação; e o tempo de tromboplastina parcialmente ativado (TTPA), que avalia alterações hemostáticas na via intrínseca. Os testes de dosagem de FVIII e dosagem de FIX são mais específicos para controle da condição hemostática de pessoas com hemofilia A e B respectivamente e os testes de fibrinogênio verificam a formação da rede de fibrina como fase final da formação do trombo hemostático. Abaixo os principais testes utilizados para diagnóstico e avaliação da cascata de coagulação de PCH.
a) O Tempo de Protrombina (TP) - Avaliação da via extrínseca da coagulação, medindo o tempo da formação do coágulo plasmático em presença de um excesso de fosfolipídios (tromboplastina), sendo dependente do complexo protrombinico (Fatores V, VII e X), da protrombina (Fator II) e fibrinogênio.
b) O Tempo de Tromboplastina Parcialmente Ativado (TTPA) - Recalcificação do plasma na presença de grande quantidade de fosfolipídios é um ativador do sistema de contato. O TTPA é considerado um teste triagem. É uma prova não específica da via intrínseca que juntamente com o TP normal constitui um teste de investigação útil para detectar deficiência dos fatores VIII, IX, XII e XIII.
c) A dosagem do Fator VIII - Detecta a quantidade de fator VIII plasmático responsável por alterar o tempo de coagulação que é inversamente proporcional à concentração plasmática do fator na amostra.
d) A dosagem do Fator IX - Detecta a quantidade de fator IX plasmático responsável por alterar o tempo de coagulação que é inversamente proporcional à concentração plasmática do fator na amostra.
2.3.2O efeito do exercício sobre o sistema hemostático.
Ribeiro e Oliveira (2005), a elevação da noradrenalina circulante durante o exercício causa hiperatividade plaquetária e aumento da coagulação medida nas plaquetas. Já o estímulo responsável pelos aumentos induzidos pelo exercício nos níveis de FVIII pode ser mediado por receptores beta-adrenérgicos(RIBEIRO e OLIVEIRA, 2005), enquanto que o aumento do fator Von Willebrand e FVIII: C (fator VIII coagulante) no plasma é causado por um mecanismo dependente do óxido nítrico (ON) (JILMA et al., 1997) cuja ativação está relacionada ao estresse de cisalhamento da parede endotelial provocado pela atividade física.
Em relação aos mecanismos fisiológicos do processo de coagulação associados ao exercício físico, estudos realizados por Ribeiro e Oliveira (2005) associam o exercício físico com o aumento de componentes da cascata proteolítica, tais como: o FVIII e fator de Von Willebrand (FvW); diminuição do tempo de tromboplastina parcialmente ativada (TTPA) e aumento do número de plaquetas. Porém, ainda há dúvidas se a melhor resposta para ativação destes mecanismos no sistema hemostático estaria na aplicação de um treinamento com a prevalência de vias metabólicas aeróbias ou anaeróbias. A ativação de alguns mecanismos da coagulação não são completamente compreendidos pela literatura, como a elevação do FVIII (EL-SAYED et al., 2000) e o aumento do fibrinogênio plasmático (EL-SAYED e DAVIES, 1995) induzidos pelo exercício, havendo assim resultados conflitantes.
Alguns estudos reportam aumento do fibrinogênio em resposta ao exercício agudo (ARAI et al., 1990; JOOTAR et al., 1992; SUZUKI et al., 1992) e outros demonstram diminuição do mesmo componente (EL-SAYED et al., 2000). Esta inconsistência de resultados pode estar relacionada com os diferentes protocolos de exercícios, condicionamento físico, condições de saúde dos indivíduos e métodos de análise do plasma (EL-SAYED et al., 2000).
De acordo com Andrew et al., (1986), que aplicaram três métodos de exercício para verificar alterações agudas no FVIII e atividade fibrinolítica: exercícios gradativos até a exaustão; exercícios em estado estável; e exercício máximo em curta duração. Os resultados encontrados demonstraram que nos exercícios gradativos não houve alteração do FVIII até que fosse alcançado 80% da capacidade máxima; nos exercícios em estado estável e de curta duração foram verificadas mudanças relativas no complexo de FVIII e sistema fibrinolítico, entretanto não tão expressivas quanto o encontrado em exercícios gradativos até a exaustão.
Weiss et al., (1991) relacionam a intensidade do exercício com o aumento na formação de plasminogênio, cuja função é regular a fibrinólise e marcadores da coagulação. Ademais, o aumento significativo na atividade fibrinolítica (75-250%) não se mostra aparente até atingir 50% frequência cardíaca máxima (FC max) (ANDREW et al., 1986), com maior aumento observado a 70%-90% da carga máxima aeróbia (ANDREW et al., 1986; DAVIS et, al., 1976). Todavia, Lippi e Maffulli, (2009) reportam que valores de FVIII, TTPA e VW são aumentados quando medidos logo após exercícios exaustivos mensurados em crianças sedentárias. O mesmo autor relata ainda que somente o FVIII se mantém elevado 24h após o exercício, concluindo que tanto o sistema hemostático quanto o sistema fibrinolítico são altamente influenciados pelo exercício físico, e que o exercício vigoroso está associado a um estado de hipercoagulação transitório, especialmente em sedentários ou indivíduos destreinados.
Os efeitos agudos se mostram bem evidentes em relação à alteração dos mecanismos fisiológicos da hemostasia, enquanto que os efeitos crônicos ainda se apresentam conflitantes. Lippi e Maffulli, (2009) sugeriram que os principais efeitos crônicos do exercício na hemostasia são: a diminuição da agregação plaquetária, fatores de coagulação normais ou reduzidos e marcadores fibrinolíticos normais ou baixos. Entretanto, ainda são poucas as evidências até o momento.
2.3.3 Efeitos do treinamento aquático
Há uma grande demanda do treinamento aquático voltado para melhora da capacidade aeróbia (TAKESHIMA et al., 2002) e redução de impacto sobre os membros inferiores
(MIYOSHI et al., 2004). Tal fato justifica a ampla recomendação para a prática de atividades em meio aquático para as PCH (SRIVASTAVA et al., 2012). O treinamento aquático em adultos com hemofilia tem reportado melhora da amplitude articular, melhora da capacidade cardiorrespiratória (VALLEJO L. et al., 2010), equilíbrio e força (FRANCO et al., 2006). Entretanto, não há estudos que reportem os efeitos da dose resposta do treinamento aquático em adultos com hemofilia sobre os parâmetros hemostáticos da coagulação sanguínea.
Os efeitos fisiológicos do treinamento aquático sobre a frequência cardíaca máxima (FCmax) e o consumo de oxigênio (VO2) demonstram diferentes resultados quando
comparados aos exercícios em terra (ALBERTON et al., 2010). Estes resultados estão associados a aspectos biomecânicos e as propriedades física da água (ALBERTON et al., 2010). Dentre estas propriedades podemos destacar a resistência de avanço (R), a densidade do fluido (p), a área de superfície projetada (A), a velocidade de movimento (v) e o coeficiente de arrasto (Cd) expresso por R = 0,5 * p *A * v2 *Cd (PÖYHÖNEN et al., 2000).
As respostas cardiorrespiratórias podem ser maiores de acordo com o aumento da área projetada e o aumento da resistência de avanço imposta pela intensidade do exercício (PINTO et al., 2008). Alguns estudos demonstram mudanças relacionadas ao tipo de exercício. O deslocamento vertical, como exercícios de resistência e exercícios estacionários, parece diminuir o gasto metabólico (ALBERTON, et al., 2009; HEITHOLD e GLASS, 2002; KRUEL, 2000) e a atividade neuromuscular (KELLY et al., 2000; MÜLLER et al., 2005). Os exercícios com deslocamento horizontal, como a caminhada demonstram um aumento do VO2
(MASUMOTO et al., 2008; SHONO et al., 2007) em ambiente aquático na mesma velocidade comparada com os exercícios em terra. Tal fato pode estar relacionado à diminuição aparente do peso, encontrada em profundidades maiores de imersão, facilitado pela flutuabilidade, encontrada em intensidades submáximas (HARRISSON et al., 1992).
Em relação à frequência cardíaca dentro e fora da água, de acordo com Graef e Kruel (2006), podem-se observar mudanças representativas da frequência cardíaca (FC) a partir da imersão do corpo na água, demonstrando diferenças significativas na diminuição da FC a partir da profundidade de imersão: até o quadril (8-9 bpm), até a cicatriz umbilical (11-13 bpm), até o apêndice xifoide (13-16 bpm), ombro (13-25bpm) e pescoço (13-17 bpm). Tais resultados demonstrados no estudo supracitado apresentam variações expressivas entre os parâmetros mensurados. Outro fator relevante na variação da FC é a temperatura da água. Quanto menor a temperatura maior a diminuição da FC (GRAEF e KRUEL, 2006).
As respostas cardiorrespiratórias observadas em repouso dentro e fora da água apresentam valores maiores de consumo de oxigênio (VO2) fora da água do que dentro
(ALBERTON et al., 2010). Entretanto, durante o protocolo de exercício realizado nestes dois ambientes, o VO2 apresenta comportamento similar dentro e fora da água, com valores
maiores alcançados fora da água, demonstrando uma diferença significativa entre os dois ambientes. Dependendo das propriedades físicas da água, da resistência de avanço do exercício e da flutuabilidade, é possível obter frequência cardíaca (FC), VO2 e sinais
eletromiográficos (EMG) maiores ou similares aos obtidos em exercícios em terra (ALBERTON et al., 2005; CASSADY e NIELSEN, 1992; KELLY et al., 2000; MIYOSHI et al., 2004).
Para Graef et al., (2006), alguns dos efeitos da água sobre a diminuição da FC podem ser explicados pela pressão hidrostática sobre os indivíduos imersos verticalmente, havendo um maior volume de sangue que retorna ao coração e maior volume ejetado por sístole, permitindo uma menor frequência de bombeamento.
bpm) é possível observar o aumento dos sinais EMG, que indicam uma maior atividade neuromuscular, na corrida fora da água. Já em velocidade máxima é possível observar um comportamento similar dentro e fora da água. Os resultados encontrados da corrida dentro da água podem ser explicados pelo aumento da resistência de avanço (ALEXANDER, 1977).
O aumento da cadência e consequentemente da velocidade angular do quadril na corrida estacionária repercutem em aumento do VO2 tanto em terra como em água
(ALBERTON et al., 2010), reportando maiores respostas cardiorrespiratórias de acordo com o aumento do ritmo de execução (CASSADY e NIELSEN, 1992; MASUMOTO et al., 2009).
Em quadros patológicos tais como as hemartroses, encontradas comumente em hemofílicos adultos, há uma grande dificuldade em aumentar o ritmo dos exercícios fora da água devido a limitação articular e dor relatada por voluntários. Tal fato, nos leva a entender a água como um ambiente de maior liberdade de movimento e com maiores possibilidades de ativação metabólica entre as PCH. Apesar das atividades em água serem bem recomendadas entre hemofílicos (TIKTINSKY et al., 2009; WEIGEL e CARLSON, 1975), os efeitos do treinamento aquático sobre esta população ainda são pouco estudados (VALLEJO et al., 2010). Entretanto, há evidências de melhora da condição articular (CALEFI et al., 2006; FRANCO et al., 2006; ERBAN et al., 2002; HARRIS e BOGGIO, 2006) e associação entre a melhora da condição articular e parâmetros ventilatórios (VALLEJO et al., 2010). No entanto, os efeitos do treinamento aquático sobre controle hemostático de adultos com hemofilia ainda é uma lacuna a ser estudada.
Os efeitos do exercício sobre parâmetros da coagulação reportados anteriormente, em pessoas sem hemofilia, apontam uma ativação do mecanismo de coagulação induzido pelo exercício em níveis de intensidade maiores, associando os níveis de VO2 e FC ao aumento de
3. MATERIAIS E MÉTODOS
3.1 PROCEDIMENTOS METODOLÓGICOS
3.1.1Participantes
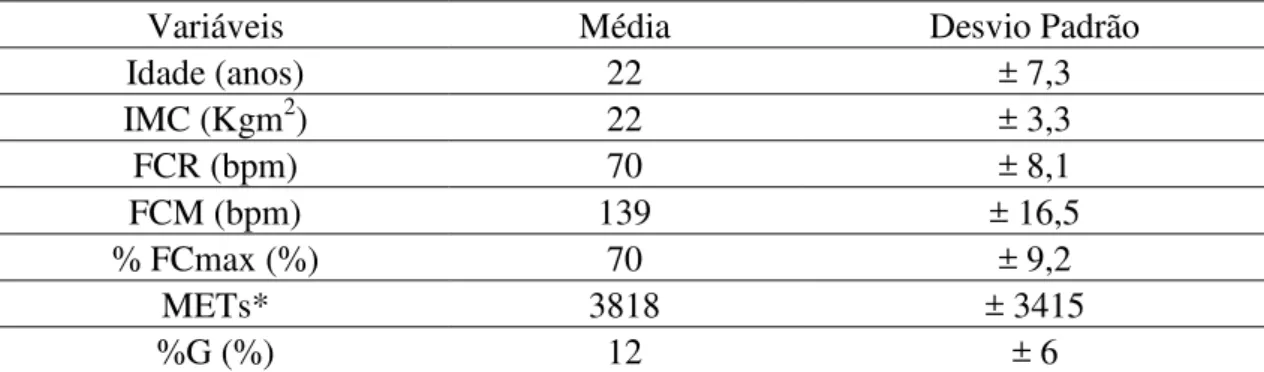
Na região Centro-Oeste estima-se 530 hemofílicos de todas as faixas etárias, dos quais 201 estão no Distrito Federal. Participaram voluntariamente deste estudo 10 hemofílicos do sexo masculino (8 do tipo A, 2 do tipo B) com idade media de 22 (± 7,3) anos e IMC 22 (±3,3) Kg/m2. Metade dos sujeitos foram diagnosticados com hemofilia severa (4 do tipo A e 1 do tipo B), e os demais com hemofilia moderada (4 do tipo A e 1 do tipo B). Os participantes foram recrutados de forma aleatória. Como critérios de inclusão foram estabelecidos pacientes que estavam participando de forma regular do programa de atividades físicas do IHTC – Brasil, devidamente acompanhados por médico hematologista e equipe multidisciplinar e liberados para a prática de atividade física.
Para verificar o nível de atividade física foi aplicado o Questionário Internacional de Atividade Física (IPAQ - versão curta), com resultados expressos em equivalentes metabólicos (METs). Para verificar o percentual de gordura (%G) foi adotado o protocolo de Jackson e Pollock (JACKSON e POLLOCK, 1978). Os dados para estimativa da intensidade do exercício foram frequência cardíaca de repouso (FCR), média da frequência cardíaca durante o exercício (FCM) e percentual da frequência cardíaca máxima estimada (% FCmax), mesurados por meio de monitor de freqüência cardíaca. Os voluntários foram informados para não realizar qualquer atividade física intensa e para evitar a ingestão de álcool 24 h antes da coleta de dados. Não foi permitido qualquer medicamento que influenciasse na hemostasia 72 h antes da coleta de dados. Todos os participantes preencheram um termo de consentimento livre e esclarecido. O estudo foi aprovado pelo comitê de ética do Hospital das Forças Armadas de Brasília (protocolo 016/2010/CEP/HFA).
3.1.2Procedimentos
(Moderados VS Severo). Antes do dia da coleta os participantes foram familiarizados com os procedimentos aplicados durante 10-12 sessões realizadas em quatro semanas (ex. 2-3 dias por semana). As sessões foram realizadas em piscina aberta de 12 x 6 m em profundidade de 1,60 m. Todas as sessões foram realizadas no mesmo período do dia (ex. 10-12 a.m.), sob condições termoneurais, com temperatura ambiente entre 28ºC e 30ºC e umidade relativa do ar de ~ 30%.
As sessões de exercício consistiram de 5 minutos de aquecimento e alongamento seguidos de 20 minutos de exercícios variados em meio líquido. Os exercícios foram realizados em períodos de 5 minutos, em velocidade moderada, em posição vertical e decúbito dorsal (Figura 1 - Apêndice A). Os exercícios realizados foram: pernada de costas com flexão plantar, pernada de costas com extensão plantar, abdução com flexão plantar e corrida na água em diversas direções. Após a sessão de exercícios os participantes realizaram um relaxamento e alongamento por 5 min. A intensidade da sessão de 20 minutos de exercício foi controlada por monitor de frequência cardíaca (FS1, Polar Electro Oy, Finland). A frequência cardíaca máxima (FCmax) foi calculada a partir da formula 220 - idade. A intensidade estimada da sessão de exercícios foi entre 56%-88% da FCmax e o % da FC durante o exercício foi calculado pela média atingida após a sessão. Foi calculada a elevação da média (%) da FC pela diferença entre FC em repouso antes do exercício e a média durante o exercício (Figura 2 - Apêndice A).
Antes e imediatamente após a sessão de exercício foram realizadas quatro coletas de sangue em sistema fechado (5 mL c/u) de cada participante. Subsequentemente, as amostras foram estocadas em tubos de citrato, armazenadas e encaminhadas para o Laboratório de Análises Clínicas do Hospital das Forças Armadas (HFA). As amostras de sangue foram centrifugadas a 3500 r.p.m. por 15 minutos em temperatura ambiente para a obtensão do plasma pobre em plaquetas (PPP). Os parâmetros hemostáticos foram avaliados em coagulômetro (ACL 9000, Instrumentation Laboratory, USA). As variáveis mesuradas foram: tempo de protrombina (TP); tempo de tromboplastina parcialmente ativada (TTPA); fator VIII (FVIII); fibrinogênio de Claus (F). Todos os procedimentos laboratoriais seguiram as recomendações do Centro Internacional de Treinamento em Hemofilia (IHTC) de Brasília.
3.1.3Análise estatística
Para o tratamento estatístico foi utilizado o programa “Statistical package for the
média ± DP. Para verificar a distribuição normal das variáveis utilizou-se o teste de Kolmogorov-Smirnov. As diferenças entre os parâmetros hemostáticos medidos antes e após a sessão de exercícios foram verificadas com o teste T de Student pareado. Para verificar a magnitude das mudanças foi calculado o tamanho do efeito (ES) a partir da fórmula: [/(Mpré - Mapós)/DP agrupado/], sendo que "Mpré" representa o valor médio da variável antes da sessão; "Mapós" é o valor médio após a sessão; e "DP agrupado" representa a média dos desvios padrão em ambos momentos. Os limiares para o ES foram: 0,2 (pequeno); 0,6 (moderado); 1,2 (grande); e 2,0 (muito grande) (HOPKINS et al., 2009). O grau de incerteza da estimativa da mudança percentual média foi expresso em intervalo de confiança a 90% (90% IC). Foram realizadas inferências baseadas em magnitudes a partir das probabilidades das mudanças serem benéficas, insignificantes e prejudiciais. Para isso, foi assumido um mínimo efeito prático ou mínima mudança importante nas variáveis hemostáticas de 0,2 multiplicadas pelo desvio padrão entre sujeitos, expresso como coeficiente de variação (CV%). Os limiares para atribuição de termos qualitativos às chances dos efeitos serem substanciais foram: < 0,5%, quase certamente não; 0,5-5%, muito improvável; 5-25%, improvável; 25-75%, possível; 75-95%, provável; 95-99,5%, muito provável; > 99,5% quase certamente sim(HOPKINS et al., 2009). Os efeitos foram julgados clinicamente incertos se a chance de serem benéficos fosse >25% e a chance de ser prejudicial fosse > 0,5%.
Para inferências mecanicistas, os efeitos foram considerados incertos se o intervalo de confiança sobrepusesse os limiares para valores substancialmente positivos ou negativos. Diferenças entre grupos e intragrupos através das condições de severidade da doença foram analisadas pelo teste de Wilcoxon (para distribuição normal dos valores) ou com o teste de Mann-Whitney (quando as diferenças entre as variáveis não são normais), conforme o mais apropriado. As relações entre os parâmetros foram avaliadas utilizando o coeficiente de correlação de Pearson (r). O nível de significância estatística admitiu o valor de p<0,05.
4. RESULTADOS
A intensidade média da sessão de exercício foi de 56 a 88% da FCmax, com um valor médio de 70% FCmax. A média de elevação da FC durante o exercício resultou 69±18 bpm (101±33%).
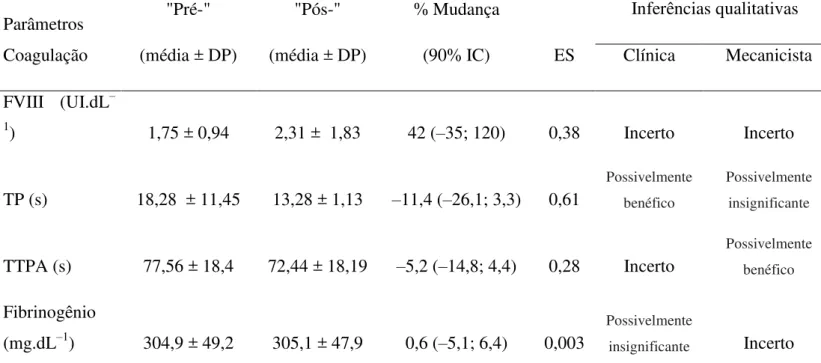
Não houve mudanças significativas nas variáveis do estudo (ver Tabela 2 - Apêndice A), com uma alta variabilidade observada entre sujeitos. Entretanto, quando realizada uma aproximação estatística inferencial baseada em magnitudes e no significado clínico, os resultados qualitativos revelaram que o TTPA exibiu efeito possivelmente benéfico, com um tamanho de efeito de 0,28. O TP foi a variável com maior mudança (ES=0,61). Foi encontrada uma correlação significante nos níveis de TP após a sessão de exercício e elevação da FC (Figura 2 - Apêndice A).
5. DISCUSSÃO
Este é o primeiro estudo para analisar o efeito agudo do exercício aquático sobre as respostas hemostáticas em um grupo de adultos hemofílicos. Não foram encontradas diferenças significativas nos marcadores de coagulação medidos após uma sessão de exercícios. Entretanto, foi observada uma alta variabilidade nas respostas individuais; no incremento de FVIII; na redução do TP e TTPA, com um maior efeito benéfico observado em hemofílicos moderados. Além disso, foi verificada uma correlação significativa entre a elevação da FC durante o exercício e os níveis de TP pós-exercício. Em conjunto, estes achados sugerem que este tipo de intervenção pode proporcionar um impacto positivo na resposta hemostática em adultos hemofílicos.
De acordo com esta afirmação, a intensidade do exercício no presente estudo com média de 70% FCmax, com uma variação de 56 a 88% da FCmax, sugere que a média de intensidade da sessão e portanto a descarga adrenal (RIBEIRO e OLIVEIRA, 2005) podem ser menores com relação ao estudo prévio com crianças hemofílicas que se exercitaram até exaustão (KOCH et al., 1984; DEN UIJL et al., 2011). Entretanto, é difícil comparar tais respostas dadas a partir dos diferentes perfis (triangular VS. retangular) ou modelos (aquático VS. cicloergometro) dos exercícios empregados. Não obstante, também tem sido reportado que mudanças na atividade fibrinolítica não são evidentes em intensidades menores que 50% da FCmax (ANDREW et al., 1986; EL-SAYED et al., 2000) com um grande incremento observado entre 70 e 90% da carga máxima de trabalho (ANDREW et al., 1986; DAVIS et, al., 1976) com estas alterações mantidas entre 45 min. e 24 h após a sessão de exercício (EL-SAYED et al., 2000; FERGUSON et al., 1987; PRISCO et al., 1998). Desta forma, considerando todos os resultados em conjunto, estima-se que pessoas com hemofilia A moderada poderiam se beneficiar de um incremento do FVIII ao passo que aumentem a intensidade do exercício, tal como tem sido apresentado em estudo prévio mais recente, realizado com hemofílicos (DEN UIJL et al., 2011), sugerindo que as doses aumentadas de norepinefrina também possam interferir no processo hemostático e geração de trombina (MENZEL K, HILBERG T. 2011).
Em virtude de poucos estudos desta natureza realizados com hemofílicos severos, estima-se mais apropriado o tratamento profilático frente a atividades de alta intensidade para manutenção dos níveis necessários de fator (FVIII) no sangue. Entretanto, como os exercícios aquáticos tem sido mais recomendados do que os exercícios de pedalar para hemofílicos (VALLEJO et al., 2010), mais estudos comparando alta intensidade deste modelo de exercício são justificáveis. Ainda não está claro se os efeitos dos exercícios de alta intensidade em pessoas com hemofilia severa podem de fato representar um risco para as condições hemostáticas desta população, já que a literatura tem apontado os traumas ocasionados durante a prática de atividades físicas e não a intensidade do exercício como as principais causas de sangramento (TIKTINSKY et al., 2009).
estudo prévio em crianças com hemofilia (KOCH et al., 1984), considerando não haver consenso sobre o efeito agudo do exercício em relação a estes parâmetros (EL-SAYED et al., 1996 (EL-SAYED et al., 2000; FERGUSON et al., 1987; PRISCO et al., 1998; HERREN et al., 1992).As mudanças no TP e TTPA pós-exercício poderia ir de 1 h a 24 h (ARAI M et al.,1990), com a observação de uma grande redução em pessoas fisicamente ativas quando comparado a pessoas sedentárias (EL-SAYED et al., 2000; KORSAN-BENGTSEN et al., 1973). As correlações exibidas dos níveis de TP após uma sessão de exercício e a elevação da FC durante o exercício (Figura 2), reforçam outra vez a possibilidade do papel da intensidade do exercício na resposta hemostática. Assim, enquanto maiores estudos poderiam avaliar o tempo da cinética de ativação da resposta aguda e a relação com a intensidade do exercício, todos os achados demonstram a importância do exercício físico regular para hemofílicos assim como, as suas respostas hemostáticas após uma sessão de exercício poderiam melhorar quando se encontram fisicamente ativos.
Outro resultado interessante refere-se a melhor resposta observada em hemofílicos moderados (Tabela 3 - Apêndice A), levando-se em conta o número limitado de participantes. Este resultado está de acordo com o estudo realizado anteriormente (KOCH et al., 1984). Nestas condições e apesar de não ser muito claro o efeito do exercício em alguns parâmetros da coagulação, a melhora de um fator de coagulação poderia ser clinicamente importante para estes pacientes independentemente da severidade ou até mesmo do tipo de hemofilia. A partir do efeito positivo do exercício sobre alguns fatores com ausência da resposta de outros, sugere-se que aquelas limitações geneticamente determinadas poderiam ser parcialmente contra-arrestadas pela resposta de outros fatores de coagulação influenciados pelo exercício. Além disso, maiores estudos justificam a importância de uma análise mais ampla da cascata de coagulação, incluindo outros fatores e marcadores, tais como plasminogênio uroquinase (uPA) (EL-SAYED et al., 2000) e o plasminogênio tecidual (tPA) (EL-SAYED et al.,1996).
6. CONCLUSÃO