UNIVERSIDADE FEDERAL DO CEARÁ
Ana Paula Dantas de Lima
SÍNTESE E CARACTERIZAÇÃO DE HIDROGÉIS
COMPÓSITOS SUPERABSORVENTES A BASE
DE POLIACRILAMIDA E VERMICULITA
Dissertação de Mestrado
Fortaleza - Ceará
UNIVERSIDADE FEDERAL DO CEARÁ
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
Ana Paula Dantas de Lima
SÍNTESE E CARACTERIZAÇÃO DE HIDROGÉIS
COMPÓSITOS SUPERABSORVENTES A BASE
DE POLIACRILAMIDA E VERMICULITA
Orientadora: Profa. Dra. Nágila Maria Pontes Silva Ricardo
Fortaleza
–
Ceará
Julho - 2008
A Deus,
AGRADECIMENTO ESPECIAL
AGRADECIMENTOS
Aos meus irmãos, Silvia, Franco, Edson, Cristina e Argeu que se alegram com cada uma das minhas conquistas.
A Profa. Dra. Judith Pessoa de Andrade Feitosa, por sua co-orientação e contribuição nas discussões desse trabalho.
A Profa. Dra. Sandra Aguiar, pela qual tenho grande admiração.
Ao Laboratório de Raios-X pelas análises.
Ao Bruno Amoni pelo apoio e contribuição nos resultados.
Aos colegas de curso e amigos que fiz neste período, cada um deles sempre uma boa lembrança.
A secretaria do curso, Orlando e Célia, que sempre se mostraram muito atenciosos e prestativos.
A todos os amigos do Laboratório de Polímeros pela boa convivência diária.
“Descobri como é bom chegar quando se tem paciência.
E para se chegar, onde quer que seja, aprendi que não é preciso dominar a força, mas a razão. É preciso, antes de mais nada, querer.”
ÍNDICE
RESUMO ... i
ABSTRACT ... ii
Lista de figuras ... iii
Lista de tabelas ... v
Lista de abreviaturas... vi
1. INTRODUÇÃO ... 1
2. OBJETIVOS ... 3
2.1 Objetivos específicos ... 3
3. REVISÃO BIBLIOGRÁFICA ... 4
3.1 Compósitos de matriz polimérica ... 4
3.2 Silicatos Lamelares ... 7
3.3 Vermiculita ... 10
3.4 Argila organofílica ... 13
3.5 Poliacrilamida ... 15
3.6 Hidrogéis ... 18
3.6.1 Hidrogel superabsorvente ... 20
4. PROCEDIMENTO EXPERIMENTAL ... 24
4.1 Materiais ... 24
4.2 Determinação da troca catiônica da vermiculita ... 25
4.3 Preparação da organo-vermiculita... 25
4.4 Síntese do gel de poliacrilamida (PAM) ... 26
4.5 Síntese do compósito poliacrilamida/vermiculita (VPG) ... 26
4.6 Hidrólise dos hidrogéis ... 26
4. 7 Difração de Raios-X... 27
4.8 Fluorescência de Raios-X ... 27
4.9 Microscopia eletrônica de varredura (MEV) ... 27
4.10 Espectroscopia de infravermelho ... 27
4.12 Análise elementar ... 28
4.13 Análise termogravimétrica ... 28
4.14 Reologia dinâmica ... 28
4.15 Medidas de intumescimento ... 29
4.15.1 Efeito da presença de sais na absorção de água ... 29
4.15.2 Efeito do pH na absorção de água... 30
4.15.3 Efeito do processo de secagem e intumescimento ... 30
4.15.4 Efeito da temperatura no intumescimento ... 30
4.15.5 Efeito do grau de reticulação ... 30
5. RESULTADOS E DISCUSSÃO ... 31
5.1 Fluorecência de Raios-X ... 31
5.2 Cálculo da CTC ... 32
5.3 Adsorção de N2 (BET) ... 32
5.4 Difração de Raios-X... 33
5.5 Análise termogravimétrica ... 37
5.6 Infravermelho ... 40
5. 7 Hidrólise dos géis... 44
5.8 Microscopia Eletrônica de Varredura (MEV) ... 45
5.9 Cinéticas de intumescimento ... 48
5.9.1 Efeito do grau de reticulação ... 53
5.9.2 Efeito da quantidade de vermiulita nos géis ... 53
5.9.3 Efeito da presença de íons ... 54
5.9.4 Efeito do pH ... 57
5.9.5 Efeito do processo de secagem e intumescimento ... 58
5.9.6 Efeito da temperatura ... 59
5.9.7 Análise de sorção dos hidrogéis ... 61
5.10 Medidas reológicas ... 62
6. SUMÁRIO DE RESULTADOS ... 67
7. CONCLUSÃO ... 68
i
Resumo
ii
Abstract
iii Lista de figuras
Figura 1. Morfologia dos géis ... 6
Figura 2. Unidades estruturais das argilas ... 9
Figura 3. Ilustração do empilhamento de camadas de uma argila 2:1 ... 10
Figura 4. Representação da estrutura da vermiculita ... 11
Figura 5. Imagens (MEV) da vermiculita crua (a) e expandida (b). ... 12
Figura 6. Estrutura do Cetremide ... 14
Figura 7. Estrutura da poliacrilamida ... 15
Figura 8. a) MBA; b) monômero acrilamida; c) TEMED... 17
Figura 9. Hidrogel de PAM reticulado com MBA. ... 17
Figura 10. Formação da rede tridimensional do hidrogel ... 19
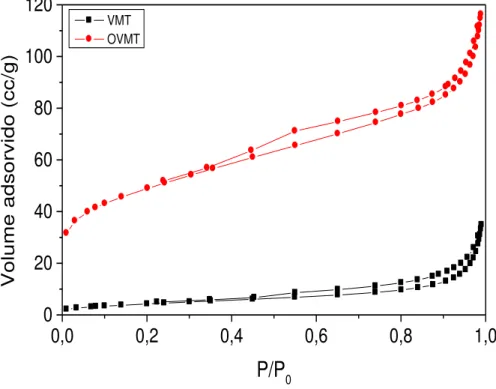
Figura 11. Isotermas de adsorção da VMT e OVMT ... 33
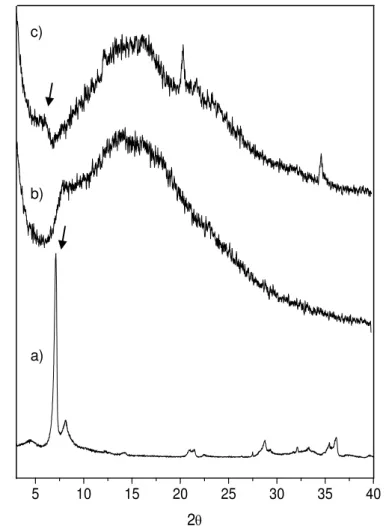
Figura 12. Difratogramas Raios-X: a) VMT natural, b) PAMH e c) VPGH ... 35
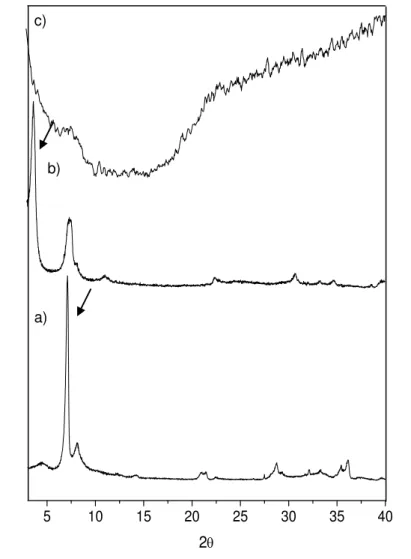
Figura 13. Difratogramas Raios-X: a) VMT natural, b) OVMT e c) OVPGH .... 37
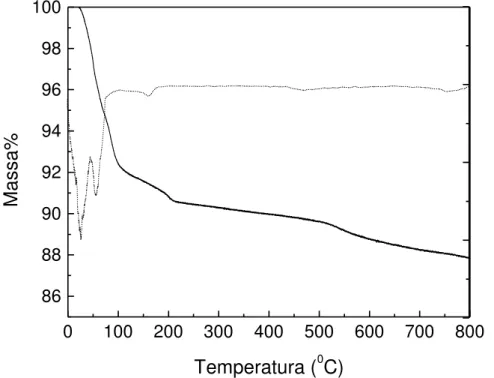
Figura 14. Curva termogravimétrica em atmosfera de N2 da VMT ... 38
Figura 15. Curva termogravimétrica para PAMH em atmosfera de N2 ... 39
Figura 16. Curva termogravimétrica para VPGH em atmosfera de N2 ... 39
Figura 17. Espectros de IR ... 41
Figura 18. Curva de calibração de AR versus percentual de acrilato ... 42
Figura 19. Espectros de IR ... 43
Figura 20. Reação de hidrólise da PAM ... 44
Figura 21. Micrografias dos géis de PAM (a) e PAMH (b) ... 46
Figura 22. Micrografias dos géis de VPG (a) e VPGH (b) ... 47
Figura 23. Cinética de intumescimento para os géis PAM e VPG ... 50
Figura 24. Curva da taxa de intumescimento para os géis PAM e VPG ... 50
Figura 25. Cinética de intumescimento para os géis hidrolisados ... 51
Figura 26. Curva da taxa de intumescimento para os géis hidrolisados ... 51
Figura 27. Cinética de absorção em água para o hidrogel VPGH. ... 52
Figura 28. Cinética de absorção em água para o hidrogel PAMH ... 52
Figura 29. Efeito da quantidade de argila no processo de intumescimento... 54
iv Figura 31. Intumescimento para o gel de PAMH em soluções aquosas de NaCl, CaCl2 e FeCl3 com diferentes concentrações ... 56 Figura 32. Efeito do pH no intumescimento dos hidrogéis... 58 Figura 33. Efeito da secagem e intumescimento na capacidade de absorção de água ... 59 Figura 34. Efeito da temperatura no intumescimento dos hidrogéis. ... 60 Figura 35. Cinética de intumescimento em água dos géis PAM, VPG e OVPG
em forma cilíndrica ... 61 Figura 36. Influência da tensão no G’ e G” a 1Hz de frequência para o gel de
VPG com 2% de reticulante ... 63 Figura 37. Influência da tensão no G’ e G” a 1Hz de frequência para o gel de
PAM com 2% de reticulante ... 64 Figura 38. Influência da frequência no G’ e G” a 1Hz de frequência para o géis
PAM e VPG com 2% de reticulante ... 65 Figura 39. Influência da temperatura no G’ e G” a 1Hz de frequência para o
v Lista de tabelas
Tabela 1. Hidrogéis e suas aplicações... 23
Tabela 2. Espécies químicas na vermiculita ... 31
Tabela 3. Análise de adsorção-dessorção de N2 ... 33
Tabela 4. Perda de massa para os hidrogéis PAMH e VPGH ... 40
Tabela 5. Freqüências e atribuições para os hidrogéis estudados. ... 42
Tabela 6. Freqüências e atribuições para os géis com argila modificada ... 44
Tabela 7. Análise elementar e razão entre acrilamida/acrilato dos géis. ... 45
Tabela 8. Parâmetros obtidos na cinética de intumescimento ... 49
Tabela 9. Intumescimento em função da concentração de reticulante ... 53
Tabela 10. W (gH2O/g) em função da quantidade de argila para hidrogéis ... 54
Tabela 11. W (gH2O/g) em função da força iônica para hidrogéis ... 57
Tabela 12. Efeito do pH no intumescimento dos hidrogéis ... 57
Tabela 13. Valores de Weq para os hidrogéis após ciclos de secagem ... 59
Figura 14. Parâmetros n e k determinados pela equação 9 ... 62
vi Lista de abreviaturas e siglas
AM Acrilamida
AA Ácido acrílico
MBA Metilenobisacrilamida
CTC Capacidade de troca catiônica
CETREMIDE Brometo de hexadeciltrimetilamônio
TEMED N,N,N’,N’tetrametil etilenodiamina
VMT Vermiculita
MMT Montomirilonita
OVMT Vermiculita organicamente modificada
ATP Atapulgita
PAM Poliacrilamida
KPS Persulfato de potássio
PAMH Poliacrilamida hidrolisada
VPG Compósito poliacrilamida/vermiculita
VPGH Compósito poliacrilamida/vermiculita hidrolisado
Weq Intumescimento no equilíbrio
PAMCOM Poliacrilamida comercial
PAANa Poliacrilato de sódio
PPC Polipropileno carbonato
CMC Carboximetilcelulose
PVA Polivinilalcool
PAMPS Ácido poli (2-acrilamida-2-metil-propano-sulfônico)
PAC Àcido poliacrílico
SH Humato de sódio
GA Goma arábica
GC Goma do cajueiro
RVL Região de viscoelasticidade linear
TG Análise termogravimétrica
DRX Difração de raios-x
MRV Microscopia eletrônica de varredura
FTIR Espectroscopia de infravermelho
BET Cálculo da área superficial pela adsorção de N2
TOT Camadas tetraédrica-octaédria-tetraédrica
1 Introdução
1. INTRODUÇÃO
A adição de cargas sólidas em materiais de matriz polimérica é uma prática muito utilizada na indústria para melhorar suas propriedades mecânicas, térmicas e elétricas ou, simplesmente para reduzir o custo, pela adição de cargas volumosas e mais baratas do que o polímero puro. Estas partículas têm dimensões da ordem de alguns micrômetros e pertencem à categoria dos chamados microcompósitos ou compósitos convencionais.
Uma nova classe de materiais compósitos em que pelo menos uma de suas fases tenha dimensão na ordem de nanômetros é chamada de nanocompósitos. Tal como acontece nos compósitos tradicionais, um dos componentes serve de matriz, na qual as partículas do segundo material se encontram dispersas.
Nanopartículas podem ser definidas como partículas que apresentam pelo menos uma de suas dimensões menor do que 100 nm (HOLISTER e col., 2007). A partir dessa definição, pode-se classificá-las de acordo com o número de dimensões nanométricas em (DUBOIS E ALEXANDRE, 2000):
Lamelares: apresentam uma dimensão nanométrica. Ex: argila e grafita.
Fibrilares e tubulares: apresentam duas dimensões nanométrica. Ex: nanofibras, nanotubos de carbono.
Isodimensionais: apresentam três dimensões nanométricas. Ex: nanopartículas metálicas.2 Introdução
Incrementos consideráveis em termo de resistência ao calor e um decréscimo da permeabilidade de gases e líquidos.
Nos últimos anos, a preparação de nanocompósitos superabsorventes a partir do uso de argilas como aditivos, atraiu grande atenção devido ao baixo custo de fabricação, seu alto ponto de absorção de água e de uma escala considerável de aplicações.
Hidrogéis superabsorventes são polímeros hidrofílicos reticulados que podem absorver, intumescer e reter soluções aquosas com massa centenas de vezes maiores que o seu. Eles vêm sendo estudados nas mais diversas áreas como produtos de higiene, horticultura, medicina e liberação de fármacos. Dos materiais inorgânicos que vêm sendo também estudados para a preparação desses superabsorventes são argilas tais como: caolinita (WU, WEI E LIN, 2003; LI e col., 2007), montmorilonita (KHOKHLOV e col., 2002; LEE E YANG, 2004), atapulgita (LI, WANG E CHEN, 2004; LI E WANG, 2005; LI, LIU E WANG, 2005)) e mica (LIN e col., 2001; LEE E CHEN, 2005). A adição desses materiais aumenta a estabilidade térmica, a absorção e a velocidade de absorção de água.
Uma fase inorgânica que está sendo bastante estudada na preparação de compósitos de matriz polimérica é a argila vermiculita pertencente ao grupo dos filossilicatos 2:1, composta principalmente de alumínio, ferro e magnésio. (MENG e col., 2003, XU e col., 2005, XU e col., 2003, DU, LIU E MENG, 2005, PAUL e col, 2006, TANG e col., 2007, ZHANG E WANG, 2007, WANG, ZHENG E ZHANG, 2007).
3 Objetivos
2. OBJETIVOS
O objetivo deste trabalho é a síntese e a caracterização de géis de poliacrilamida e compósitos poliacrilamida/vermiculita e estudar o uso desses sistemas como condicionadores de solo.
2.1 Objetivos específicos
Caracterizar a argila vermiculita por Fluorescência de raios-x, capacidade de troca catiônica (CTC), análise termogravimétrica e Espectroscopia de infravermelho.
Sintetizar hidrogéis por polimerização em solução a partir da acrilamida e vermiculita reticulados com N, N’- metilenobisacrilamida (MBA).
Estudar o efeito de um sal quaternário de amônio (brometo de cetil trimetil amônio) na organofilização da vermiculita.
Sintetizar hidrogéis a partir da argila modificada e não modificada.
Caracterização estrutural dos géis a partir das técnicas de Espectroscopia de Infravermelho (IR), Difração de Raios-X (DRX) e Microscopia Eletrônica de Varredura (MRV), Análise termogravimétrica (TG) e adsorção de N2 (BET).
Estudar a cinética de intumescimento, verificando o efeito de variáveis na capacidade de absorção de água.
4 Revisão Bibliográfica
3. REVISÂO BIBLIOGRÁFICA
3.1 Compósitos de Matriz Polimérica
Os compósitos constituem uma classe de materiais formados pela combinação de pelo menos duas fases em proporções pré-determinadas, sendo uma fase contínua e outra dispersa.
Compósitos poliméricos reforçados com materiais inorgânicos especiais são de grande interesse devido as suas aplicações em indústrias automobilísticas, indústrias dos setores elétricos e eletrônicos. Compósitos reforçados com materiais inorgânicos não apenas podem oferecer uma alternativa para melhorar as propriedades físicas dos materiais, as propriedades mecânicas, resistência térmica e resistência a agentes químicos, mas também podem fornecer materiais de alto desempenho a um custo viável (BOTELHO, 2006; QUTUBUDDIN E MENEGHETTI, 2006).
O interesse e desenvolvimento da nanotecnologia nas últimas décadas levaram a um crescimento e grande interesse pela área de nanocompósitos devido às propriedades especiais apresentadas por estes materiais, não apenas por estes possibilitarem a obtenção das propriedades equivalentes à dos compósitos tradicionais, mas também por exibirem algumas propriedades únicas (SOUSA E PESSAN, 2006; SARAVANAN, RAJU E ALAM, 2007).
5 Revisão Bibliográfica
Os nanocompósitos de polímeros e silicatos têm se tornado uma área importante de pesquisa de compósitos poliméricos. Um dos mais promissores sistemas de compósitos são os nanocompósitos baseados na inserção de nanopartículas, na forma de argilominerais (RAY E OKAMOTO, 2003; GIANNELIS, SHAH E SCHIMIDT, 2002).
As lâminas de argilas têm uma área de superfície elevada e funcionam como reforços estruturais, que aderem fortemente ao polímero. Quando dispersas na matriz polimérica promovem alterações nas propriedades da matriz, relacionadas com a interação química específica entre as cargas e o polímero. Este tipo de interações pode influenciar a dinâmica molecular do polímero resultando em alterações significativas nas suas propriedades físicas, como por exemplo, no comportamento térmico e/ou mecânico. Durante o processamento dos nanocompósitos, há a inserção de cadeias poliméricas entre a estrutura lamelar dos argilominerais (XU E COL., 2005; COELHO, SANTOS E H. SANTOS, 2007).
6 Revisão Bibliográfica
(DU, LIU, MENG, 2006; TRINDADE, ESTEVES E TIMMONS, 2004; OKAMOTO, 2007). Uma das grandes vantagens destes materiais é que a melhoria nas propriedades é obtida para pequenas concentrações de argila, em geral, menores que 15% em peso (PINNAVAIA e col., 1995). Para se obterem propriedades semelhantes em compósitos convencionais é necessário adicionar de 30 a 40% de carga (SOUSA E PESSAN, 2006). Como a concentração de carga em nanocompósitos é baixa, o peso específico do material é próximo ao do polímero sem carga, o que é um atrativo em algumas áreas, pois a redução de peso significa uma redução de custos. Além disso, a adição de cargas sólidas aumenta a resistência mecânica e a rigidez de polímeros pela redução da mobilidade das cadeias poliméricas.
Dentre as propriedades desses materiais podem-se citar:
Melhoria das propriedades mecânicas;
Propriedades de barreira, tais como: a permeabilidade e resistência a solventes e aumento da estabilidade térmica e retardância de chama.
7 Revisão Bibliográfica
3.2 Silicatos lamelares
O sucesso dos nanocompósitos se deve em parte ao fato de que as propriedades mencionadas acima são obtidas através da adição de argila, que são materiais facilmente encontrados na natureza, de custo relativamente baixo. O interesse de estudo com argilas vem crescendo muito, principalmente no que diz respeito a sua composição, estrutura e propriedades fundamentais dos seus constituintes das argilas e dos solos. As formas de ocorrência e a relação das argilas com suas propriedades tecnológicas têm sido também bastante estudadas. Devido ao seu baixíssimo custo elas podem ser utilizadas como cargas nas indústrias de plásticos, tintas e inseticidas, produtos farmacêuticos e veterinários, com a finalidade de aumentar o volume e modificar as propriedades desses materiais.
O termo “silicatos lamelares” refere-se a argilas naturais. Define-se como argila uma rocha finamente dividida, constituída essencialmente por minerais argilosos cristalinos, mas podendo conter também minerais que não são considerados minerais argilosos (calcita, dolomita, quartzo e outros), matéria orgânica e impureza (SANTOS, 1975). Normalmente, o termo argila é usado para materiais que se tornam plásticos quando misturados com pequenas quantidades de água. (BHATTACHARYYA E GUPTA, 2008).
Dentre as classes de silicatos, a dos filossilicatos e a que tem maior destaque em numero de pesquisa. Dentro desta classe encontram-se os argilominerais, que são extensivamente estudados, por apresentarem propriedades químicas e físicas interessantes. Desta forma, argilominerais são silicatos de Al, Fe e Mg hidratados, com estruturas cristalinas em camadas (filossilicatos). Todos os minerais de argila têm estrutura foliada e se caracterizam por apresentar aspecto laminar ou achatado, exibindo estruturas internas na forma de folhas (filossilicatos: do grego phyllon = folha).
8 Revisão Bibliográfica
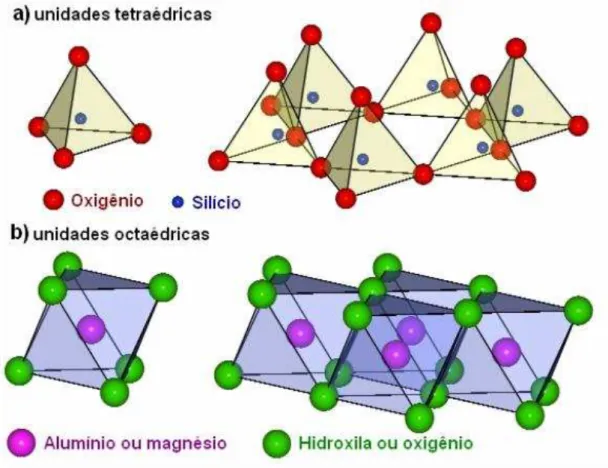
cada átomo de silício esta rodeado por quatro átomos de oxigênio, sendo que as formas tetraédricas são ligadas covalentemente uma a outra através do compartilhamento de oxigênios. Estes oxigênios compartilhados formam um plano basal, e os oxigênios axiais restantes são compartilhados com outros cátions lamelares. As unidades tetraédricas estão arranjadas em uma rede hexagonal ao longo do plano basal. Na camada octaédrica (Fig. 2b) os cátions (geralmente Al ou Mg) estão coordenados com seis átomos de oxigênio ou hidroxilas, e estas unidades são ligadas covalentemente, formando uma camada.
As lâminas tetraédricas e octaédricas podem se encaixar para formar camadas (compostas por duas ou mais lâminas) de várias maneiras, dando origem às estruturas dos argilominerais. Os silicatos de estrutura lamelar podem ser divididos em grupos ou famílias: a) camadas 1:1; b) camadas 2:1; c) camadas 2:2 e d) camadas 2:1:1. (AIROLDI E FONSECA, 2003; FONSECA E COL., 2006).
9 Revisão Bibliográfica
Esses tipos de ocorrências são chamados de substituições isomórficas (quando átomos com cargas diferentes das do alumínio e/ou silício substituem alguns desses átomos na estrutura) geram um desbalanceamento elétrico na superfície das camadas, tornando-as negativa.
Figura 2. Unidades estruturais das argilas: a) tetraedros de sílica e b) ocataedros de hidróxidos de alumínio (CARASTAN, 2007).
10 Revisão Bibliográfica
Esses cátions podem ser trocados por sais orgânicos, como, por exemplo, sais quaternários de amônio, que tornam organofílica a superfície das camadas, permitindo a intercalação de moléculas de monômeros ou polímeros (DUBOIS E ALEXANDRE, 2000).
Figura 3. Ilustração do empilhamento de camadas de uma argila 2:1. (CARASTAN, 2007).
Os argilominerais mais frequentemente utilizados em nanocompósitos pertencem ao grupo das esmectitas, como, por exemplo, as montmorillonitas (MMT), hectoritas e saponitas, sendo a MMT a mais importante delas.
3.3 Vermiculita
A vermiculita é um mineral constituído de silício, alumínio, magnésio, ferro e água, em proporções variáveis. O nome vermiculita é derivado do latim
11 Revisão Bibliográfica
se expande sob aquecimento e suas partículas tomam formas semelhantes a vermes. Este mineral ocorre em placas constituídas por finíssimas lamínulas superpostas com espessuras em torno de 9,3 Å. O espaçamento entre as lamínulas é variável e, na maioria das vezes, depende da natureza e tipo de moléculas localizadas na região de separação entre elas. No estado natural, os espaços interlamelares ocupados por água são da ordem de 14,2 Å. Essa água interlamelar não está submetida a ligações fortes, podendo ser quase ou totalmente removida através de aquecimento (ALMEIDA, 2008).
A vermiculita possui célula unitária do tipo 2:1, constituída por duas folhas tetraédricas e uma folha octaédrica entre elas. As folhas tetraédricas são compostas por tetraedros de silício (SiO4), onde ocasionalmente o silício pode ser substituído isomorficamente por alumínio (Figura 4). As folhas octaédricas são formadas de átomos de alumínio, oxigênio e hidrogênio, onde o alumínio pode ser substituído por magnésio, ferro e por outros elementos. As camadas TOT (tetraedro-octaedro-tetraedro) são separadas por duas ou mais camadas de moléculas de água arranjadas em uma estrutura hexagonal, onde os cátions trocáveis, principalmente o magnésio, e também o cálcio e o potássio, encontram-se localizados entre as folhas de moléculas de água (FONSECA e col., 2006).
Figura 4. Representação da estrutura da vermiculita.
T
T O
T
T O Mg Mg Mg
T
T O Mg Mg Mg
Al Si
Al
12 Revisão Bibliográfica
A principal característica que a diferencia de outros minerais, é que este mineral se expande rapidamente após aquecimento a temperaturas elevadas produzindo um material leve. A água de hidratação contida entre os seus milhares de lâminas se transforma em vapor, expulsando-a de modo irreversível, formando flocos (ADDISON, 1995).
A expansão ou piro expansão ocorre na direção perpendicular ao plano basal e provoca um aumento de até 30 vezes o volume inicial. Esses flocos, denominados de vermiculita esfoliada ou expandida, podem se apresentar como um material de estrutura escamosa, de coloração que varia do dourado ao esverdeado e densidade de 2,5 a 2,7 g/cm3 quando crua e de 0,05 a 0,3 g/cm3 quando expandida, dependendo da granulometria e do método de expansão (LAGO e col., 2006).
13 Revisão Bibliográfica
Suas propriedades de superfície, somadas aos altos valores de área superficial específica, porosidade e carga superficial (negativa) fazem deste um material adequado para o uso como adsorvente ou como carreador. A expansão concede ao mineral uma grande importância industrial, em decorrência da diversidade de aplicações, seja como isolante térmico e acústico, na purificação de águas residuais ricas em sais dissolvidos e na remoção de camadas poluentes de petróleo na superfície de água oceânicas,
entre muitas outras (MENTASTI e col. 2006; STYLIANOU e col, 2007; RODRÍGUEZ e col, 2005; BALEK e col., 2007; LAGO e col. 2006; FARIAS e
col., 2003).
No Brasil existem depósitos de vermiculita nos estados da Bahia, Minas Gerais, Goiás, São Paulo, Paraná, Piauí e Paraíba.
A vermiculita na forma expandida constitui-se também num ótimo condicionador de solos ácidos e argilosos, por auxiliar na correção do pH, tornando-os mais soltos, porosos e arejados, de forma a proporcionar um melhor desenvolvimento nas raízes das plantas (ADDISON, 1995).
3.4 Argila Organofílica
As argilas naturais geralmente possuem características organofóbicas, ou seja, as argilas ou seus argilominerais constituintes têm fobia ou repelem moléculas orgânicas. As argilas na sua grande maioria são hidrofílicas (que têm afinidade com água). Por isso a base do processo de transformação das argilas inorgânicas em argilas organofílicas, é fazer com que seus cátions naturais inorgânicos sejam trocados em presença de água, por cátions orgânicos. Os cátions orgânicos que substituem os inorgânicos nas galerias dos filossilicatos através de troca catiônica agem como surfactantes e são, geralmente, cátions de sais de amônio quaternário (CONNELL e col., 2002).
14 Revisão Bibliográfica
ligados diretamente a um átomo de nitrogênio onde se situa a parte catiônica da molécula. Ao adicionar esses sais em dispersões aquosas de argila, esses cátions orgânicos substituem os cátions divalentes, que são facilmente trocáveis. Assim, os cátions quaternários de amônio com longas cadeias de hidrocarbonetos livres, se acomodam entre as camadas 2:1 do argilomineral, tornando-o organofílico (OSMAN, 2006; MARTYNKOVÁ e col., 2007; TJONG, MENG E HAY. 2002; PAIVA, MORALES E DIAZ, 2008)).
Figura 6. Estrutura do Cetremide.
A argila organofílica tem energia superficial menor, compatível com líquidos orgânicos ou polímeros, podendo ser agente reforçante na síntese de nanocompósitos argila/polímero (PAIVA, MORALES E GUIMARÃES, 2006; SOUZA E PESSAN, 2006). A intercalação de surfactantes entre as camadas da argila modifica as propriedades da superfície de hidrofílica para hidrofóbica, expandido e aumentando o espaçamento entre as camadas (BARBOSA e col., 2006; DARYN e col., 2002). Nestas dispersões aquosas, as partículas da argila devem se em elevado grau de delaminação, isto é, devem encontrar-se (em maior ou menor grau) umas encontrar-separadas das outras (e não empilhadas), facilitando a introdução dos compostos orgânicos, que irão torná-las organofílicas (BARBOSA e col, 2006; COELHO, SANTOS E SANTOS H., 2007).
15 Revisão Bibliográfica
hidrocarbonetos variando de 14 a 18 átomos de carbono. Ele mostrou que à medida que se aumenta o comprimento da cadeia alquílica há também um aumento no espaçamento basal dessa argila.
XU e col. (2005) sintetizaram nanocompósito intercalado de poli(propileno carbonato) (PPC) com vermiculita modificada com brometo de cetiltrimetil amônio e acompanharam a dispersão da argila na matriz do polímero por difração de raios-X. Foi observado que o espaçamento basal aumentou significantemente (4,37 nm) em relação à argila não modificada (1,2 nm).
Argilas organofílicas são utilizadas nas indústrias de fundição de metais, lubrificantes, tintas, adesivos, cosméticos e como componentes tixotrópicos em fluidos de perfuração de petróleo (SOUZA, 1989).
3.5 Poliacrilamida
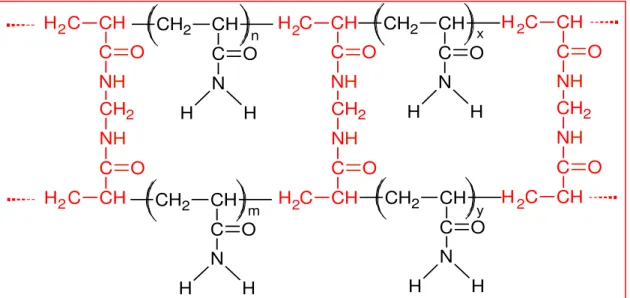
Poliacrilamida (Figura 7), ou poli 2-propenamida, é um polímero orgânico sintético derivado da acrilamida, bastante solúvel em água, de alta massa molar (~106) e amorfo. Pode ser sintetizado como polímero neutro, aniônico ou catiônico onde a quantidade de carga pode ser variada por hidrólise (SEYBOLD, 1994).
Figura 7. Estrutura da poliacrilamida.
CH
2CH
C O
N
H
H
16 Revisão Bibliográfica
A poliacrilamida não é tóxica para o homem, animais, peixes e plantas. Já o monômero acrilamida, utilizado na síntese do polímero, sim. Esse monômero é altamente solúvel e é neurotóxico, provoca irritação a até mesmo pequena quantidade do produto representa risco e deve ser evitada. Testes em animais têm demonstrado que a exposição ao monômero provoca danos ao sistema nervoso central e periférico. No solo a acrilamida é rapidamente biodegradada em CO2, NH4+ e H2O (HOLLIMAN e col., 2005; SMITH e col., 1997). O nível de acrilamida em polímeros comerciais tem sido uma questão importante, especialmente para aplicações onde o contato humano está envolvido. No entanto, há uma longa discussão a respeito da possibilidade da acrilamida residual presente do material polimérico e se a poliacrilamida pode degradar e voltar ao monômero (CAULFIELD e col., 2002).
A acrilamida tem sido classificada pela Agência de Proteção Ambiental Americana (U.S. Enviromental Protection Agency - EPA) como um provável
carcinogênico. A EPA recomenda como dose segura de exposição para a acrilamida 0,3 ppb (CAULFIELD e col., 2002). No Brasil, o Conselho Nacional de Meio Ambiente (CONAMA) estabelece como limite para descarte de acrilamida em águas doces a concentração de 0,5 ppb.
17 Revisão Bibliográfica
O hidrogel de poliacrilamida pode ser facilmente obtido da reação simultânea de polimerização e reticulação da acrilamida, onde o sistema iniciador redox utilizado é composto de TEMED (N,N,N`,N`tetrametil etilenodiamina) e persulfato de potássio (KPS), o agente reticulante é a N’N’ -metilenobisacrilamida (MBA) (SILVA, 2006). A PAM é obtida, geralmente, por polimerização em cadeia através do uso de radicais livres. A obtenção desses radicais pode ser feita por iniciação térmica ou por sistemas de óxido-redução (CAULFIELD e col., 2003).
Figura 8. Estruturas: a) MBA; b) monômero acrilamida; c) TEMED
Figura 9. Hidrogel de PAM reticulado com MBA. C
H2 CH
C O N H H N C H3 C H3 CH2
CH2 N CH3 CH3
a)
b) c)
C
H2 CH
C O NH CH2 NH C O CH C H2 C
H3 CH2 C O NH CH2 NH C O CH2 C H3
CH2 CH
C O N
H H
C
H3 CH2 C O NH CH2 NH C O CH2 C H3
CH2 CH
C O N
H H
C
H3 CH2
C O NH CH2 NH C O CH2 C H3
CH2 CH
C O N
H H
CH2 CH
18 Revisão Bibliográfica
A família de polímeros e copolímeros de poliacrilamida é um grupo altamente versátil, usado em muitas aplicações, tais como retenção de água em solo arenoso, gel para eletroforese, floculante na manufatura de papéis e adesivos e aplicações biomédicas (SEPASKHAH E HOSSEINABADI, 2008; LU, WU E LETEY, 2002). PAM linear de alta massa molar é especialmente utilizada na recuperação de petróleo como agente espessante aumentando a eficiência da extração e no tratamento de água e efluentes como floculante (SEYBOLD, 1994). Uma importante aplicação é como redutor do espalhamento de jato usado em aplicações de herbicidas. O polímero aumenta a viscosidade da solução contendo herbicida, permitindo uma aplicação mais uniforme e também aumentando o tempo de contato com o vegetal (CAULFIELD e col., 2002).
3.6 Hidrogéis
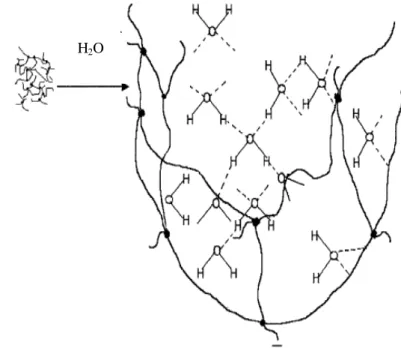
Hidrogéis podem ser definidos como sistemas hidrofílicos formados por dois ou mais componentes unidos por ligações covalentes e/ou eletrostáticas dispostos em uma ou mais redes tridimensionalmente estruturadasenvoltas por moléculas de um determinado solvente, geralmente água (ZOHURIAAN-MEHR E KABIRI, 2008). A quantidade de água adsorvida pelos hidrogéis geralmente está relacionada com a hidrofilicidade das cadeias e a densidade de agente de reticulação utilizada na síntese.
19 Revisão Bibliográfica
rede polimérica é contrabalanceada por uma força elástica retrativa (FLORY E REHNER, 1943). Assim, quando as forças osmóticas e elásticas forem iguais, o hidrogel terá atingido o estado de equilíbrio de intumescimento.
O intumescimento de um hidrogel é governado por fatores físicos e externos. Alguns fatores físicos como presença de forças de coesão, grupos hidrofílicos, baixa densidade de reticulação e flexibilidade da cadeia do polímero são favoráveis ao processo de intumescimento. A presença de grupos hidrofóbicos, maior densidade de reticulação e a presença de íons desfavorecem a absorção do gel (RUDZINSKI e col., 2002). Mudanças de pH, força iônica, temperatura, composição de solvente, aplicação de voltagem são alguns dos fatores externos que interferem no processo de absorção de água pelo gel (BAJPAI E SINGH, 2006; MOLLOY, SMITH E COWLLING, 2000; WEIAN,WEI E YUE, 2005).
O controle dos fatores tais como densidade de cadeias poliméricas, quantidade de agente de reticulação e balanço hidrofílico-hidrofóbico possibilitam a obtenção de matrizes com propriedades mecânicase estruturais ajustadas para um grau de intumescimento adequado para uma determinada aplicação.
Figura 10. Formação da rede tridimensional do hidrogel com o processo de intumescimento (SILVA, 2006).
20 Revisão Bibliográfica
As propriedades físicas exibidas pelos hidrogéis como a capacidade de reter água, resistência mecânica e sensibilidade a condições ambientais são fatores que favorecem a sua utilização.
A característica principal de um hidrogel é sua capacidade de absorver água. Para algumas aplicações é desejável que o hidrogel absorva muita água, enquanto, para outras grandes variações de volume não são desejadas. Quanto a essa propriedade podem-se dividir os hidrogéis em dois grandes grupos: os convencionais e os superabsorventes.
3.6.1 Hidrogel Superabsorvente
Hidrogel superabsorvente é constituído de redes poliméricas tridimensionais altamente flexíveis e podem absorver e reter massa de água centenas de vezes além de sua massa seca (GUILHERME e col., 2005). Estes materiais têm sido aplicados em produtos de higiene pessoal como, por exemplo, absorventes feminino, fraldas descartáveis e na agricultura como condicionadores de solo (ZOHURIAAN-MEHR, KABIRI 2003, BUCHHOLZ E GRAHAMT, 1998).
A conformação tridimensional de um material superabsorvente se aproxima de um novelo de linhas com longos fios distribuídos aleatoriamente. Quando imerso em meio aquoso este tipo de conformação permite que as cadeias poliméricas sejam expandidas consideravelmente, resultando em um alto grau de intumescimento (GUILHERME, 2006). Assim, para ser superabsorvente em água é necessário que o polímero apresente estrutura contendo grupos iônicos, alta flexibilidade e porosidade.
21 Revisão Bibliográfica
principalmente no desenvolvimento de lentes de contato, onde fizeram uma revolução na área da oftomologia (ZOHURIAAN-MEHR, KABIRI, 2008). Nos últimos anos, várias aplicações de polímeros superabsorventes têm-se revelado de particular interesse. Uma parte significativa do atual mercado é relacionada com produtos de cuidados higiênicos, perspectivando-se a utilização numa gama variada de outras aplicações, tais como: agricultura no condicionamento de solo e solo artificial para a hidroponia, agentes para liberação controlada de agroquímicos ou de medicamentos (REHIM, 2005). Na agricultura, estes materiais devem possuir alguns outros requisitos tal como biodegradação e altíssimo intumescimento e baixo custo de produção. O aspecto econômico é um fator importante que deve ser considerado em síntese de hidrogéis superabsorventes com aplicações voltadas para a agricultura.
Materiais poliméricos superabsorventes podem ser obtidos a partir de uma grande diversidade de polímeros, como por exemplo, acrilamida hidrolisada, acrilatos (sais de ácido acrílico), carboximetilcelulose, alginato, poli(álccol vinílico) e polissacarídeos. (OMIDIAN, ROCCA E PARK, 2004, WANG E LI, 2005, BUCHHOLZ E GRAHAMT, 1998).
As principais características desejáveis em hidrogéis superabsorventes são: a elevada capacidade de absorção de água, a alta taxa de absorção e boas propriedades mecânicas. No entanto, é difícil encontrar um material que reuna todas essas características, portanto, várias rotas de sínteses são propostas para a obtenção de materiais superabsorventes.
Hidrogéis superabsorventes à base de argilas têm despertado grande interesse por apresentarem vantagens como o baixo custo e aumento da capacidade de absorção de água.
22 Revisão Bibliográfica
Os compósitos PAM/argila com 10% de argila incorporada mostraram elevadas capacidades de absorção de água, onde o compósito com 10% de vermiculita teve a maior absorção, 1689 g H20/g gel, nesta concentração.
Os polímeros na agricultura são preferencialmente usados para mudas, flores, e cultivo de vegetais visando melhorar condições de disponibilidade de água, como condicionadores de solo. Um condicionar de solo é definido como todo material orgânico ou sintético, natural ou quimicamente modificado que, adicionado ao solo, altera favoravelmente suas propriedades físicas e estruturais (SILVA, 2006).
O uso de hidrogéis na agricultura se deu na década de 50 por uma empresa americana. Nessa época, a capacidade de retenção de água não ultrapassava 20 vezes a sua massa. No entanto, os materiais de alto custo de aplicação limitaram seu uso por algum tempo. O interesse em condicionadores de solo foi renovado nos anos 70, porém o custo ainda não os tornava economicamente viáveis (AZEVEDO e col., 2002).
Poliacrilatos, poliacrilamida, álcool polivinílico e polietileno glicol são alguns exemplos de polímeros utilizados como condicionadores de solo. Outros polímeros como polieletrólitos à base de copolímeros de acrilamida/acrilato têm-se mostrado mais eficientes em melhorar as propriedades físicas e químicas dos solos. A adição de condicionadores no solo melhora suas propriedades estruturais na medida em que aumenta a capacidade de retenção de água e melhora a permeabilidade do solo, além de reduzir a erosão causada pela água e ventos e contribuir para o crescimento de plantas (AZEVEDO e col., 2000). TERRY E NELSON (1986) observaram uma melhora em termos percentuais de 80% na estabilidade do solo após a adição de poliacrilamida aniônica.
23 Revisão Bibliográfica
Tabela 1. Hidrogéis e suas aplicações.
*Ver siglas na lista de abreviaturas
Matriz Aplicação Referencia
PAM/PAANa* Remoção de metais BAJPAI E JOHNSON, 2005
CMC/PVA/PAM Liberação de agroquímicos BAJPAI E GIRI, 2002
CMC/PAM Liberaçao de agroquímicos BAJPAI E GIRI, 2003
PVA/MMT Cicatrização de ferimentos KOKABI e col., 2007
PAM/SH/Laponita Adsorção de corantes ZHEN, ZHANG, 2007
Amido/PAM/Atapulgita Materiais superabsorventes LI, LIU E WANG, 2005 Amido/PAM/argila Materiais superabsorventes WU E COL., 2003
PAM/ PAMPS Materiais superabsorventes CASQUILHO, ROSA E BORDADO,
2002.
Quitosana/PAM/PAC Materiais superabsorventes POURJAVADI E COL., 2004
SH/PAM/Argila Adsorção de corantes YI, ZHANG, 2008
PAM/atapulgita Materiais superabsorventes WANG, ZHANG E CHEN, 2005
PAANa/vermiculita Materiais superabsorventes WANG E COL., 2007
PAM Biosensor PÉREZ E COL., 2006
Quitosana/PAC/APT Materiais superabsorventes ZHANG, WANG, 2006 PAM/PAANa/
vermiculita Materiais superabsorventes TANG E COL., 2007
Quitosana/PAM Biosensor XIA E COL., 2005
PAANa/PAA/caolinita Materiais superabsorventes LI E COL., 2007
GA/AM Hidrogéis de rápida
absorção PATENTE - GUILHERME E COL., 2005
GC/AM Hidrogéis superabsorventes PATENTE - GUILHERME E COL.,
24 Procedimento Experimental
4. PROCEDIMENTO EXPERIMENTAL
4.1 Materiais
Acrilamida (AM), Merck;
N,N,N',N'–tetrametilenodiamino (TEMED), Merck;
Persulfato de potássio (K2S2O8), Merck;
N,N'–metilenobisacrilamida (MBA) da Pharmacia Biotech;
Brometo de cetiltrimetil amônio (CETREMIDE), Vetec.
A vermiculita foi gentilmente fornecida pela UBM (União Brasileira de Mineração, Santa Rita - Paraíba) e previamente seca a 70 ºC e passada em tela de 325 mesh;
Todos os outros reagentes utilizados são de grau analítico.
4.2 Determinação da troca catiônica da vermiculita
Preparação da argila
25 Procedimento Experimental
No destilador de Kjeldahl
O íon amônio, incorporado à argila, é deslocado, na forma de amônio, aquecendo a massa de argila em uma solução de hidróxido de sódio 40 %. A amônia deslocada, carreada pela água do destilador, sendo novamente capturada por uma solução de ácido bórico 4 %. Quando o volume da solução de ácido bórico aumenta em até 20 vezes do seu volume inicial, a destilação é interrompida. Efetua-se a titulação da solução ácida bórico-amônia com ácido clorídrico ou ácido sulfúrico padronizado para determinar o teor de amônia e conseqüentemente o teor de amônio trocado pela argila.
Reações:
1. Troca iônica da argila
Argila–Cátion(s) + NH4+(aq) → Argila–NH4+(s) + Cátion(aq)
2. Destilação
Argila–NH4+(s) + Na+(aq) + OH-(aq) → Argila–Na+(aq) + H2O(l) + NH3(aq) NH3(aq) + H2BO3(aq) → H2BO3–NH3(aq)
3. Titulação
H2BO3–NH3(aq) + HCl(aq) → H2BO3(aq) + NH4Cl(aq)
4.3 Preparação da organo-vermiculita
Os cátions da vermiculita foram primeiramente trocados por íons sódio seguindo o método de Xu e col. (2005): 10 g de vermiculita foram adicionados a 100 mL de solução 1M de NaCl e misturados sob agitação magnética por 48 horas a 60 ºC. O material foi então lavado até a remoção completa de íons Cl-. O material lavado foi adicionado a uma solução contendo 12 g de Cetremide
26 Procedimento Experimental
4.4 Síntese do gel de poliacrilamida (PAM)
A 30 mL de água destilada foram adicionados 2,1 g de acrilamida sob agitação e borbulhamento de gás nitrogênio para diminuir o efeito de inibição do oxigênio na reação de polimerização radicalar. Após 10 minutos foram adicionados 16,2 mg do iniciador persulfato de potássio. Em seguida foram adicionados 4,5 mg do reticulante bisacrilamida e 100 µL do acelerador da reação TEMED 0,57g/L. O sistema foi fechado e mantido sob agitação até o ponto de gel, quando a agitação foi então suspensa. Após 24 horas o material foi triturado, lavado com água até completa remoção do excesso de monômero que não reagiu. Em seguida foi seco em estufa a uma temperatura de 70 ºC.
4.5 Síntese do compósito poliacrilamida/vermiculita (VPG)
A síntese do VPG seguiu a mesma metodologia utilizada para a PAM. A exceção faz-se quanto à adição do monômero, onde este foi previamente dissolvido em uma dispersão de argila10% m/m em relação ao monômero. A dispersão foi mantida sob agitação magnética constante por 24 horas. Esse procedimento também foi utilizado para a síntese do compósito com argila modificada (OVPG).
4.6 Hidrólise dos hidrogéis
27 Procedimento Experimental
4.7 Difração de Raios-X
Os difratogramas de Raios-X foram obtidos através de um difratômetro de pó modelo Rigaku (DMAXB) com radiação Cu-Kα, varredura de 2° < 2θ < 40° e λ = 1,5418 Å.
4.8 Fluorescência de Raios-X
A composição química da vermiculita foi realizada por fluorescência de raios-X em um equipamento modelo Rigaku (ZSX Mini II). A técnica envolve a formação de íons excitados, que, depois de um breve tempo retornam ao estado fundamental através de uma série de transições eletrônicas, envolvendo elétrons de níveis energia mais elevados. O método permite identificar e quantificar os elementos que tem uma raia característica dentro da faixa de operação do espectrofotômetro.
4.9 Microscopia Eletrônica de Varredura (MEV)
Para a análise morfológica dos hidrogéis, os mesmos foram inicialmente equilibrados em água a 25 °C e liofilizados. Nessas condições pode-se assumir que a estrutura do hidrogel é preservada. O estudo morfológico foi realizado em um equipamento da Phillips XL 30, acoplado ao sistema de ligação 3.34 séries 300 com detector Si (Li). As amostras foram preparadas em fita de carbono em suporte de cobre e recobertas com ouro.
4.10 Espectroscopia de Infravermelho
28 Procedimento Experimental
4.11 Adsorção de N2 pelo método do BET
As características dos poros das amostras foram analisadas usando um equipamento Autosorb – Quantachrome NOVA 1200, o qual é composto por um sistema de adsorção física automatizada que fornece dados de equilíbrio de adsorção e dessorção. As amostras foram degaseificadas por 2 horas a 120 ºC, antes de cada ensaio. Os dados de volume adsorvido e dessorvido em várias pressões relativas foram utilizados para gerar informações sobre a área superficial por BET e volume de poros.
4.12 Análise elementar
A análise elementar de carbono, hidrogênio e nitrogênio dos compósitos polímero/argila foi executada utilizando um microanalizador Carlo ERBA EA 1108.
4.13 Análise termogravimétrica
O comportamento térmico das amostras foi analisado em equipamento da Shimadzu TGA-50 com fluxo de nitrogênio de 50 cm3/min. As curvas termogravimétricas foram obtidas em atmosfera de nitrogênio utilizando razão de aquecimento de 10 °C/min e massa de 10 mg e uma faixa de temperatura de 0 a 800 °C.
4.14 Reologia dinâmica
29 Procedimento Experimental
A evaporação do solvente foi evitada com a utilização de “solvent trap”. A região de viscoelasticidade linear foi determinada através de varreduras de tensão a 0,1 e 1 Hz de freqüência e 25 °C., 1 Hz de freqüência e 6,0 Pa de tensão. A dependência do módulo de estocagem com a temperatura foi verificada para o intervalo de 10-50 °C, com taxa de aquecimento de 2 °C/min, 1 Hz de freqüência e 6 Pa de tensão.
4.15 Medidas de intumescimento
Estudou-se o efeito de 5%, 10%, 20% e 30% de vermiculita no gel de PAM na absorção de água. Amostras dos géis foram pesadas (30 mg para
VPG e 10 mg para VPGH) e colocadas em um cadinho filtrante de 30 mL (porosidade nº 0) umedecido previamente e com parede externa seca. Este conjunto foi inserido em água de modo que o gel ficasse totalmente submerso. O conjunto cadinho/gel foi retirado em vários intervalos de tempo, a parede externa do cadinho seca e o sistema pesado. Cada experimento foi realizado em triplicata. A absorção de água foi calculada usando a seguinte equação:
(1)
onde, W é o ganho de massa de água por grama de gel, m é a massa do
material intumescido e m0 é a massa do material seco. A granulometria dos
hidrogéis permaneceu na faixa de 24-35 mesh.
4.15.1 Efeito da presença de sais na absorção de água
Os hidrogéis foram imersos em soluções de NaCl, CaCl2 e FeCl3 de diferentes concentrações e a absorção de água foi determinada de acordo com
0
1
m
W
m
30 Procedimento Experimental
o método descrito no item 4.15.
4.15.2 Efeito do pH na absorção de água
O efeito do pH foi verificado utilizando soluções tampões fosfato de pH 2,5 (H3PO4/KH2PO4); 7,4 (KH2PO4/Na2HPO4) e pH 10,2 (Na2HPO4/Na3PO4).
4.15.3 Efeito do processo de secagem e intumescimento
O processo de secagem e intumescimento foi verificado para o hidrogel em meio aquoso. O hidrogel foi imerso em água e a absorção determinada como previamente descrito. O material foi então seco a 70°C durante 20 h e novamente submetido ao processo de intumescimento. Esse ciclo foi repetido por 5 vezes.
4.15.4. Efeito da temperatura no intumescimento
A influência da temperatura no intumescimento do hidrogel foi estudada da faixa de 25-50 °C
4.15.5 Efeito do grau de reticulação
31 Resultados e Discussão
5. RESULTADOS E DISCUSSÃO
5.1 Fluorescência de Raios-X
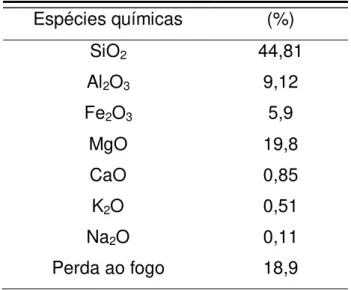
Um aluminossilicato é composto em grande parte por sílica (SiO2), alumina (Al2O3) e óxido de magnésio (MgO) em sua rede inorgânica estrutural. Assim, a análise química da vermiculita oriunda da região de Santa Rita, interior do estado da Paraíba, na forma de percentagens de óxidos é apresentada na Tabela 2.
Tabela 2. Espécies químicas presentes na vermiculita
Espécies químicas (%)
SiO2 44,81
Al2O3 9,12
Fe2O3 5,9
MgO 19,8
CaO 0,85
K2O 0,51
Na2O 0,11
Perda ao fogo 18,9
A perda ao fogo deve-se, principalmente, a água intercalada de coordenação, a decomposição dos grupos hidroxilas dos argilominerais e dos hidróxidos presentes como Al(OH)3, Fe(OH)3. Além destes, compostos como matéria orgânica, sulfetos, carbonatos e sulfatos, se presentes, estão também incluídos nesta determinação.
32 Resultados e Discussão
A ausência de outros metais de transição confirma ser um argilomineral de boa qualidade, uma vez que a presença de outros metais de transição alem de ferro poderia modificar significativamente as propriedades químicas e físicas. As pequenas porcentagens dos constituintes CaO, Na2O e K2O, indicam que os cátions trocáveis são Ca2+, Na+ e K+. Esses resultados corroboram com valores encontrados na literatura (FONSECA e col., 2006). Com base nos resultados obtidos na tabela pôde-se estimar a fórmula química da amostra:
(K)0,30 (Mg)2,46 (Fe)0,25 [(Si)3,46 (Al)0,56 ]O10 (OH)2.2H2O
5.2 Cálculo da CTC
A medida de CTC da vermiculita foi cerca de 120 meq/100g. Os materiais argilosos possuem as propriedades de troca de íons, cátions e ânions, fixados na superfície exterior dos seus cristais. Esses cristais estão localizados nos espaços intercamadas estruturais ou em outros espaços interiores. Sendo que em todos estes espaços são acessíveis à estrutura desde que estejam em soluções aquosas.
A capacidade de troca de cátions é a quantidade de cátions que um mineral argiloso ou uma argila pode adsorver e trocar. É uma propriedade importante dos minerais argilosos que resulta do desequilíbrio das suas cargas elétricas. É um processo estequiométrico segundo o qual cada equivalente de um íon adsorvido pelo mineral argiloso vai provocar a libertação de um equivalente do cátion anteriormente fixado. O poder de troca de um cátion será maior quanto maior for sua valência e menor for a sua hidratação.
5.3 Adsorção de N2 (BET)
33 Resultados e Discussão
Tabela 3. Análise de adsorção-dessorção de N2
As curvas de adsorção da OVMT e VMT são bastante similares. No entanto, as curvas de dessorção são um pouco diferente. As isotermas são do tipo IV, característica de materiais porosos, de acordo com a classificação BDDT (BRUNAUER e col., 1923, apud DAVIDSON e MCMURRY, 2000).
Figura 11. Isotermas de adsorção da VMT e OVMT.
5.4 Difração de Raios-X
Dentre as várias técnicas de caracterização de materiais, a técnica de difração de raios-X é a mais indicada na determinação das fases cristalinas. Isto é possível porque na maior parte dos sólidos (cristais), os átomos se ordenam em planos cristalinos separados entre si por distâncias da mesma
Amostra Área superficial BET (m2/g) Volume poro (cm3/g)
VMT 13.9771 0.045084
OVMT 173.200 0.170121
0,0
0,2
0,4
0,6
0,8
1,0
0
20
40
60
80
100
120
Volu
me
ad
so
rv
id
o
(c
c/
g)
VMT OVMT
34 Resultados e Discussão
ordem de grandeza dos comprimentos de onda dos raios X (ALBERS e col. 2002). Sendo as argilas sólidos cristalinos, estas apresentam padrões de raios-X característicos, os quais podem ser utilizados para determinar sua morfologia e detectar a existência de outras formas cristalinas (qualitativamente) e para determinar o grau de pureza e/ou cristalinidade e os parâmetros de cela unitária (quantitativamente). O valor de d001 representa a distância basal da argila.
Ao incidir um feixe de raios X em um cristal, o mesmo interage com os átomos presentes, originando o fenômeno de difração. A difração de raios-X ocorre segundo a Lei de Bragg (3), a qual estabelece a relação entre o ângulo de difração e a distância entre os planos que a originaram (característicos para cada fase cristalina):
nλ = 2d . sen θ (3)
n: número inteiro
λ: comprimento de onda dos raios X incidentes (λ = 1,5418) d: distância interbasal
θ: ângulo de incidência do laser sobre a amostra
35 Resultados e Discussão
A análise pode ser feita através da observação do pico correspondente ao plano d001 da argila
Observa-se que o gel de PAMH apresenta comportamento amorfo, como esperado. Após a reação de polimerização com 10% de VMT ocorre um deslocamento do pico característico da VMT para ângulos menores o que indica a intercalação do polímero entre as camadas da argila (Figura 12b).
No entanto, picos de cristalinidade (Figura 12c) ainda podem ser observados, indicando que a argila não foi totalmente dispersa na matriz polimérica.
Figura 12. Difratogramas de Raios-X: a) VMT natural, b) PAMH e c) VPGH
b)
a) c)
5 10 15 20 25 30 35 40
2
In
te
nsid
ad
36 Resultados e Discussão
A fim de compreender as características físicas e químicas do processo de intercalação de surfactantes uma simples análise teórica é feita a seguir.
Os espaçamentos basais entre as camadas na VMT são da ordem de ~1nm. Existe uma grande barreira entrópica que dificulta o processo de intercalação do polímero. Uma das maneiras de diminuir essa barreira entrópica é a modificação orgânica dessa argila usando cadeias de surfatantes. O ganho energético resultante da interação polímero-surfactante pode compensar as perdas entrópicas. Sob estas circunstâncias, o polímero pode penetrar nas camadas, separando essas camadas da argila dispersando-as na matriz polimérica.
Para explicar as interações entre polímeros e argilas organicamente modificadas a seguinte equação pode ser usada como modelo. (XU e col. 2005).
ΔF = F(h) – F(h0) = ΔE –TΔS (4) Onde ΔF é a mudança total na energia livre de Helmholtz; E é a mudança da
energia interna associada com o estabelecimento de interações moleculares; h
significa a altura das camadas não intercaladas e h0 à altura da galeria com o
polímero intercalado, respectivamente. ΔF<0 indica que a separação entre as camadas é favorável. ΔF>0 implica que o estado não intercalado inicial é favorável. O principal fator que contribui para a mudança da energia livre pode ser identificado como o estabelecimento de novas interações intermoleculares entre polímero e argila durante o processo de intercalação (XU e col. 2005).
37 Resultados e Discussão
Quando a distância entre as lamelas excede um determinando valor limite (cerca de 8 nm) não é mais possível observar o pico do plano 001 (DARYN e col., 2002). A sua ausência geralmente indica que ocorreu esfoliação. O desaparecimento dos picos de difração para o OVPGH (Figura 13c) sugere que a argila foi completamente esfoliada e dispersa na matriz polimérica.
Figura 13. Difratogramas de Raios-X: a) VMT natural, b) OVMT e c) OVPGH
5.5 Análise termogravimétrica
A Figura 14 mostra a curva termogravimétrica (linha cheia) que indica perda de massa do mineral em 8,13 e 8,33%, na faixa de 20-120 ºC, referente à umidade das amostras. Na faixa de temperatura 120-230 ºC ocorre a perda
5 10 15 20 25 30 35 40
2
c)
b)
a)
In
te
nsid
ad
38 Resultados e Discussão
de água coordenada, podendo ocorrer re-hidratação em condições favoráveis de umidade e acima de 400 ºC ocorrem pequenas perdas referentes ao fenômeno de desidroxilação da vermiculita (BRIGATTI e col., 2005).
Figura 14. Curva termogravimétrica em atmosfera de N2 da VMT
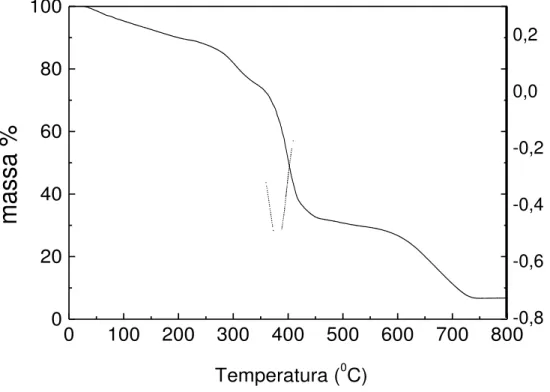
As curvas gravimétricas dos hidrogéis VPGH e PAMH são mostradas nas Figuras 15 e 16, respectivamente. A PAMH apresenta 3 estágios de decomposição. Amônia e água são os principais produtos voláteis abaixo de 340 ºC. A poliacrilamida seca é estável até 285 ºC e se decompõe acima dessa temperatura com liberação de amônia e formação de grupos imida (SILVA, 2006). Para o gel com argila, a decomposição inicia-se a temperatura superior a 300 ºC. O primeiro evento nas curvas termogravimétricas a 62ºC e 54 ºC (VPGH e PAMH, respectivamente) é atribuído à saída de água (correspondendo a 10,4% e 12,2% de perda de massa). Para os três últimos eventos foram observados os valores Tmáx 315, 410 e 612 ºC (correspondendo a 9,97; 48,2 e 26,3% de perda de massa, respectivamente). Para o hidrogel PAMH os eventos ocorrem a 295, 396 e 650 ºC, que correspondem a 11,39; 49,6 e 20,3% de perda de massa (Tabela 4).
0 100 200 300 400 500 600 700 800
86 88 90 92 94 96 98 100
Ma
ss
a%
39 Resultados e Discussão
Figura 15. Curva termogravimétrica para VPGH em atmosfera de N2.
Figura 16. Curva termogravimétrica para PAMH em atmosfera de N2.
0 100 200 300 400 500 600 700 800
0 20 40 60 80 100
M
a
s
s
a
%
-0,8 -0,6 -0,4 -0,2 0,0 0,2
0 100 200 300 400 500 600 700 800
0 20 40 60 80 100
Temperatura (0C)
ma
ss
a %
40 Resultados e Discussão
Tabela 4. Perda de massa para os hidrogéis PAMH e VPGH.
VPGH PAMH
I evento
Tpeak (ºC) 315 295
II evento
Tpeak (ºC) 410 396
III evento
Tpeak (ºC) 612 650
Resíduo 5,13 6,51
5.6 Infravermelho
Os espectros de FTIR para VMT, PAM, PAMH, VPG e VPGH são mostrados na Figura 17. No espectro da vermiculita (Fig. 17a) observa-se uma banda de absorção larga e intensa na região de 3440 cm-1 referente a vibrações de deformação axiais de O-H livres dos grupos silanois (SiOH) da estrutura, alem de moléculas de água que são invariavelmente adsorvidas por ligações de hidrogênio e, também, encontradas na região interlamelar. A banda em 1640 cm-1 é atribuída à deformação angular simétrica da ligação O-H da água, confirmando a presença de água na estrutura. Bandas de estiramento assimétrico Si-O-Si em 1004 cm-1 e de vibração Si-O em 448 cm-1 também são observadas.
41 Resultados e Discussão
razão de acrilamida convertida a acrilato e, a partir dela, pôde-se determinar o percentual de hidrólise e a proporção de sal formado através de uma curva de calibração (Figura 18). Os resultados foram confirmados através de análise elementar, mostrados na Tabela 5.
Figura 17. Espectros de IR da VMT (a), PAM (b), PAMH (c), VPG (d) e VPGH (e).
c)
b)
a)
4000 3500 3000 2500 2000 1500 1000 500
T
ra
ns
m
itâ
ncia
%
Número de onda (cm-1) d)
42
Resultados e Discussão
A Tabela 5 mostra os valores de freqüência e as atribuições das principais bandas encontradas nos espectros dos demais hidrogéis sintetizados.
Tabela 5. Freqüências e atribuições para os hidrogéis estudados.
VMT PAM PAMH VPGH VPG Atribuições
3440 OH
3430 3446 3434 3430 N-H
1640 H2O
2935 2940 2946 2938 sCH2
1683 1683 1672 1677 C=O
1645 1645 1646 1657 NH
1413 1407 s,COO-
1559 1551 a,COO-
1326 1323 1323 1315 CH
1186 1185 1176 1180 NH2
1004 SiOSi
448 SiOFe
676 SiOAl
Figura 18. Curva de calibração de AR versus percentual de acrilato.
A Figura 19 mostra os espectros de FTIR para VMT, OVMT, OVPG e OVPGH. O espectro da argila modificada organicamente apresenta bandas de absorção em 2921 e 2847 cm-1 atribuídas ao estiramento simétrico e assimétrico do grupo CH2, respectivamente, provenientes do sal orgânico.
0,0 0,5 1,0 1,5 2,0 2,5
0 20 40 60 80 100
AREL = A1410 / A2940
m
ol%
N
aA
A
43 Resultados e Discussão
Resultados que evidenciam a intercalação do cátion quaternário de amônio nos espaços interlamelares da argila. Na Tabela 6 podem ser vista as demais freqüências e atribuições.
Figura 19. Espectros de Infravermelho da VMT (a), OVMT(b), OVPG (c) e OVPGH (d).
Número de onda (cm-1)
4000 3500 3000 2500 2000 1500 1000 500
T
ra
ns
m
itâ
ncia
44 Resultados e Discussão
Tabela 6. Freqüências e atribuições para os géis com argila modificada.
VMT OVMT OVPGH OVPG Atribuições
3440 3440 OH
3437 3422 N-H
1640 1645 H2O
2921, 2847 2932 2940 aCH2
1680 1685 C = O
1656 1650 NH
1405 s,COO-
1556 a,COO-
1316 1319 CH
1175 1175 NH2
1004 1004 SiOSi
448 442 SiOFe
676 670 610 SiOAl
5.7 Hidrólise dos géis
Os dados de análise elementar para os géis são mostrados na Tabela 7 onde observamos os percentuais de C, H e N, a razão de acrilamida/acrilato obtida estequiometricamente através dos percentuais de C e N calculada através da razão entre o número de átomos de carbono e nitrogênio nas amostras uma vez que a relação na acrilamina é 3:1 e no acrilato 3:0 e os resultados obtidos através da análise de infravermelho. Observa-se uma diminuição no percentual de N tanto para PAMH quanto para VPGH indicando a substituição dos grupos aminos por grupos acrilatos durante a hidrólise (Figura 20).
CH2 CH C=O
O- Na+
C
H3 CH2 CH
C=O
CH3
NH2 NaOH
C
H3 CH2 CH CH3
O=C
NH2
n n-x
x
45 Resultados e Discussão
A proporção de hidrólise obteve valores próximos a 1 para a VPGH e foi maior que o valor apresentado para a PAMH mostrando uma maior efetividade da reação para o gel que possui argila.
Tabela 7. Valores da análise elementar e razão entre acrilamida/acrilato dos géis.
Amostra % C % H % N Am/Acr* Am/Acr**
PAM 42,01 6,82 15,99 - -
PAMH 30,32 4,11 5,11 0,77 0,72
VPG 40,57 6,43 15,43 - -
VPGH 31,40 5,89 6,43 0,90 0,96
* Análise Elementar ** Infravermelho
Os espectros de infravermelho dos compósitos hidrolisados podem ser vistos nas Figuras 17 e 19. Após a hidrólise, novas bandas em 1410 e 1560 cm-1 atribuídas aos estiramentos simétrico e assimétrico do grupo carboxilato, podem ser observadas.
5.8 Microscopia Eletrônica de Varredura (MEV)
46 Resultados e Discussão
47 Resultados e Discussão