VIRUS RABICO EN RATAS Y RATONES INOCULADOS
INTRAPLANTARMENTE
M. Martell D.l y L. P. Moles y C.2
Se inocularon
ratas y ratones por vía intraolantar
con virus
rábico con el fin de observar el tiempo trakcurrido
inoculación
y la detección
del virus en médula
encéfalo y córnea, antes de la aparición
de signos
entre la
espinal,
clínicos.
Introducción
La rabia es una enfermedad que afecta a
muchos mamíferos, y que produce cuadros
clínicos caracterizados por trastornos del
sistema nervioso, y casi siempre es mortal.
Con toda probabilidad esta es una de las
antropozoonosis que mayor importancia e
interés ha despertado desde que se descubrió.
Primero se pensó que el virus rábico solo
infectaba las glándulas salivales y el sistema
nervioso central, pero estudios posteriores
’ Jefe del Laboratorio Central Nacional de Diagnós-
tico, Red Nacional de Laboratorios de Diagnóstico
(RENALDI), Dirección General de Sanidad Animal,
Secretaría de Agricultura y Ganadería, México D F
2 T)epartamento de Patología, Laboratorio ‘Cekral
Naclonsl de Diagnóstico, Dirección General de Sani-
dad Animal, Secretaría de Agricultura y Ganadería,
México, D.F.
sobre patogenia demostraron que este virus
se puede aislar de glándula lagrimal, humor
acuoso, humor vítreo, pulmón, corazón,
riñón, adrenales, y de otras glándulas de
secreción externa, lo cual ha sido demostrado
en el hombre (10) ; en murciélagos (22,
23) ; en bovinos (4, 14, 21) ; en perros
(1, 5, 9), y en ratones (12, 20).
El uso de colorantes inespecíficos ha
permitido la detección de virus directamente
en epitelio cornea1 (II).
Luego, usando la
técnica de tinción con anticuerpos fluores-
centes, también se ha detectado en la córnea
(20’). En ratones inoculados experimental-
mente, Schneider (20) observó 70% de
casos positivos en córnea y en glándula
salival simultáneamente. Sin embargo, en
Marte11 D. y Moles y C. * VIRUS RABEO 355
casos naturales en perros se observó 70% de positividad en cornea, pero no siempre ‘
coincidió con la presencia de virus en glán- dula salival (12). En ratones inoculados intracerebralmente con una cepa de origen t canino se ha logrado la detección de virus rábico en encéfalo, 96 horas antes de la presentación de signos clínicos; al utilizar una cepa proveniente de vampiro, la detec- ción fue 87 horas antes (15).
En bovinos sacrificados en el rastro se detectó virus rábico en médula espinal. Esto
ocurrió en animales de zonas donde el
derriengue es enzoótico, sin observarse
i
alteraciones clínicas aparentes (13).
Este experimento se realizó con el fin de * observar a cuántas horas después de la ino-
culación intraplantar era posible detectar el virus rábico en médula espinal, encéfalo y . córnea, antes de la aparición de signos clínicos, utilizando, ratas y ratones como animales de experimentación,
Material
Animales. Se emplearon 100 ratones
albinos suizos adultos y 100 ratas blancas adultas.
Virus. Cepa V-319 -de virus rábico con título de 104.6 D.L. 50% (0.03 ml I.C. en ratones de 21 días)- aislada de glándulas salivales de vampiros (Desmodus rotundus) y fijada por pases intracerebrales en ra- tones.”
Znóculo. Suspensión al 10% de cerebros de ratones infectados, utilizando solución salina Hanks como diluyente (8).
Microscopfa. Microscopio de luz U.V.
para fluorescencia, Carl Zeiss, con lámpara HB0 200 Osram, filtro de excitación BG-12 y Kg 1 como barrera.
Métodos
Ratones. Se hizo una dilución de 10-l de inóculo del cual se aplicó 0.08 ml en el .
s Cepa amablemente proporcionada por el Dr. Pierre Sureau, Director del Proyecto sobre Rabia Paralítica Bovina, I.N.I.P. (FAO).
cojinete plantar del miembro posterior
izquierdo de cada animal. Luego se sacrifi- caron grupos de 3 a 5 ratones cada 12 horas, hasta observar la parálisis en el grupo de animales sobrevivientes, lo cual se consi- deró como el primer signo clínico (2, 9, 15 y 19).
Ratas. Estas fueron inoculadas intra-
plantarmente en el miembro posterior
izquierdo, con 0.1 ml de la suspensión 10-l. Se sacrificaron 3 ratas por grupo, el primero a las 18 horas posteriores a la inoculación; el segundo a las 24 horas, y después, cada
12 horas, hasta observar la parálisis.
Titulación del virus. A 6 grupos de 6 ratones cada uno, se les inoculó intracere- bralmente 0.03 ml de diluciones de 10-l a
10-G. Los animales muertos durante las primeras 96 horas fueron desechados, por considerar que murieron por causas ajenas al virus. El título se calculó por el método de Reed y Muench (17).
Diagnóstico. Después de sacrificar con éter a los animales, se procedió a disecar la columna vertebral y el encéfalo. Se hicieron cortes sagitales a la altura de la región lumbar, torácica, cervical, y del cerebelo y cerebro. Con estos tejidos se hicieron im- presiones al igual que de epitelio comeal, procesándose por el método de anticuerpos fluorescentes (6).
Resultados y discusión
Los resultados obtenidos en los ratones se presentan en el cuadro 1; y los de las ratas, en el cuadro 2.
356 BOLETIN DE LA OFICINA SANITARIA PANAMERICANA * Octubre 1973
CUADRO 1-Deteccih de virus rábico antes de la aparición de signos clinicos en médula lumbar, tchcica,
ce~icol, cerebelo y cerebro de ratones inoculados intrap!antormente.
Horas posteriores
a la inoculación Lumbar Torácica
Regiones >.
Cervical Cerebelo Cerebro Córnea
12 015 015 015 015 015 015
24 (1 dia) 015 015 015 015 015 015 4.
36 015 015 015 015 015 015
48 (2 días) 015 015 015 015 015 015
60 015 015 015 015 015 015
72 (3 días) 015 015 015 015 015 015
84 515 515 515 315 315 015
96 (4 días) 5/5 sy3 575 515 515 215
108 515 515 515 5/5 5/5 015
120 (5 días) 515 515 515 515 515 515
132 313 313 313 313 313 373
144 (6 días) 515 5!5 515 515 5/5 315
156 313 313 313 313 313 313 f-
Título-104 0 D.L. 50%.
Período de incubación, 168 horas (7 días).
observó fluorescencia. Sin embargo, a las 96 horas (4 días), 2 de 5 resultaron positi- vos, y 156 horas (6.5 días) después de la inoculación hubo 3 de 3 negativos. Esto puede deberse a una fase ciega en la multi-
plicación vira1 y también muestra cuán
variable puede ser la detección de virus en este tejido. Esta variación coincide con la
observada anteriormente en bovinos por
Hernández (7), quien detectó virus en
epitelio cornea1 en la fase agónica de la enfermedad y no al morir los animales. En médula lumbar se detectó el virus a las 84 horas (3.5 días), o sea 12 horas después de lo observado por Schindler (19) al inocular ratones por vía intramuscular con 126,000
,
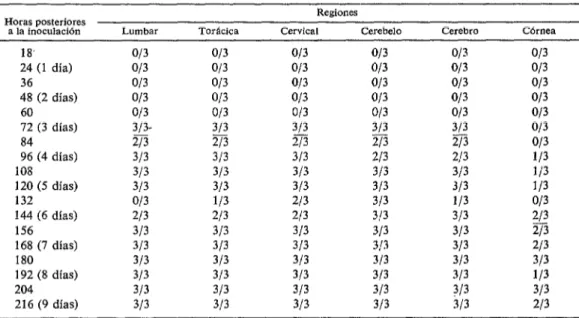
CUADRO 2-Detección de tluorescencia especifica a rabio en médula lumbar, torbcica, cervical, cerebelo y cere- bro de ratas inoculadas intmplantarmente. *
Horas posteriores
a la inoculación Lumbar Torácica
Regiones
Cervical Cerebelo Cerebro Córnea
18, 013 013 013 013 013 013
24 (1 día) 013 013 013 013 013 013
36 0/3 0/3 013 013 013 013
48 (2 días) 0/3 013 013 013 013 013 Y-
60 013 013 0/3 013 013 013
72 (3 días) 84 96 (4 días) 108 120 (5 días) 132 144 (6 días) 156 168 (7 días) 180 192 (8 días) 204 216 (9 días)
313. 313 313
2/3 33 21s
313 313 313 213 2/3
313 313 313 313 313
313 313 313 313 313
013 ll3 213 313 113
213 213 213 3!3 313
313 313 313 313 313
313 313 313 3/3 313 313 313 313 313 313
313 313 313 313 313
313 313 313 313 313
313 313 313 313 313 313
273 313 2/3 013 013
ll3 JI3 113
013 c 213
2/3
213
313
ll3
313
213 Título-1Ol.B D.L. 50%.
Marte11 Ll. y Moles y C. . VIRUS RABICO
(D.L. 50%, 0.03 ml I.C. en ratones de 21 días), lo cual pudo haber inlluido en la temprana aparición del virus en la médula, o tal vez esta diferencia se deba a la vía de
inoculación, ya que en este estudio se
, inocularon 12,000 (D.L. 50%, 0.03 ml I.C. en ratones de 21 días).
Con respecto a las diferencias con traba- jos anteriores, donde se utilizó la inoculación
intracerebral, Salido (18) menciona la
presencia de virus a las 24 horas posteriores a la inoculación. Bagnaroli y colaboradores (3 ) , al utilizar ratones lactantes, observaron fluorescencia en 28 de 30 ratones a las 72 4 horas (3 días) después de la inoculación
intracerebral. Pilo Moron y colaboradores (16) la observaron a las 120 horas (5 días) * con cepas aisladas de glándula salival. En este experimento en ratones, se detectó virus rábico a las 84 horas (3.5 días) en médula lumbar al inocular por vía intraplantar, que equivale a 36 horas (1.5 días) antes que el hallazgo de Pilo Moron y colaboradores
(16) al utilizar la vía intracerebral.
En el lote de ratas se hizo la detección del virus por primera vez a las 72 horas (3 días) en todas las porciones de la médula y 4 encéfalo en 3 de 3 ratas sacrificadas. El hallazgo en córnea fue en 2 de 3 animales a las 144 horas (6 días). Estos resultados indican que la aparición de fluorescencia en médula y encéfalo fue a las 156 horas (6.5 días) antes de presentarse los signos clínicos,
\ los que ocurrieron a las 228 horas (9.5
días).
Baer y colaboradores (2), trabajando con ratas inoculadas por vía intraplantar, ob- servaron el virus por primera vez a las 72 horas, pero únicamente en la porción lumbar 4 de la médula con indicios en el segmento
torácico; a las 96 horas (4 días) había virus en cerebro, pero los animales ya se encon- traban en la fase paralítica.
En los ratones, el virus fue detectado en médula a las 84 horas (3.5 días), o sea 12 & horas después de la detección en médula de las ratas. Además, en estas se realizó la
357
detección de virus en cerebro también a las 72 horas (3 días) y en ratones a las 96 horas (4 días), o sea, 24 horas después. Aparentemente, el virus inoculado en las ratas pasó por el tejido nervioso con mayor rapidez que en los ratones a pesar de ser una cepa fijada en ratones por pases intracere- brales. Quizá a ello se debió que el periodo de incubación fuera más corto en ratones, 168 horas (7 días), mientras que en las ratas fue de 228 horas (9.5 días).
Con respecto al epitelio cornea1 en los ratones, el virus se detectó a las 96 horas (4 días) en 2 de 5 animales, y a las 108 horas (4.5 días) no se detectó, pero volvió a aparecer a las 120 horas (5 días) con detección variable. En ratas sucedió algo semejante lo cual pone de manifiesto la variabilidad de la presencia del virus en este tejido.
El virus fue detectado siempre. Primero en la médula y posteriormente en el encéfalo, lo que sugiere que en este caso pasó al encéfalo por vía centrípeta. Además, según los hallazgos hechos en córnea, que fueron posteriores a los del tejido nervioso, es de suponer que el virus no llegó tampoco por vía sanguínea.
Las diferencias tan marcadas que se
observaron entre los resultados obtenidos por diversos autores pueden deberse al tipo de cepa del virus que se utilizó; a la especie animal o a la cantidad del inóculo usado.
Resumen
J
procesadas por el método de anticuerpos fluorescentes para su diagnóstico.
358
En ratas, el hallazgo de virus en médula
En ratones se detectó virus en médula a las 84 horas (3.5 días), o sea 84 horas
(3.5 días) antes de la aparición de signos clínicos en médula lumbar, a las 96 horas (4 días) antes de la aparición de signos clínicos en médula torácica y cervical, y a las 72 horas (3 días) antes de la presencia de signos clínicos en encéfalo, En córnea la detección se realizó desde las 120 horas
(5 días).
*
BOLETIN DE LA OFICINA SANITARIA PANAMERICANA . Octubre 1973
REFERENCIAS
y encéfalo fue simul%neo, a las 72 horas (3 días), o sea a las 156 horas (6.5 días) ._ antes de la aparición de signos clínicos. En córnea hasta las 144 horas (6 días). Los
resultados obtenidos indican que aparente- (
mente el virus viajó con mayor rapidez en el tejido nervioso de las ratas, que en el de los ratones. 0.
Agradecimiento
Se agradece al Dr. A. Uruchurtu M. su valiosa ayuda en la redacción de este trabajo.
c
(1) Aluja, S. A.; Velázquez, E. A.. y Galindo, R. F. “Identificación del virus rábico en diferentes tejidos celulares mediante la técnica de anticuerpos fluorescentes”. Rev Med Ver Zoof 2(4):143-l%, 1963. (2) Baer, M. G.; Schanthaveerappa, R. T., y
Bourne, H. G. “Studies on the patho- genesis of fixed rabies virus in rats”. Eu//
WHO 33:783-794, 1965.
(3) Bagnaroli, R. A.; Larghi, 0. P., y Mar- chevsky, N. “Susceptibilidad de ratones lactantes y adultos al virus rábico demos- trada por inmunofluorescencia”. Bol Ofic Sanit ianamer 68(5):388-392, 1970. (4) Benignos, J. Estudio de patogenia del virus
rdbico en ganado inoculado experimental- menre. Tesis profesional. Facultad de Medicina VeteLinaria y Zootecnia, Uni- versidad Nacional Autónoma de México, 1970.
(5) Estaiíol, A. C. Confribución al estudio de fa uatoaenia del virus rábico. Tesis pro-
fesiona[ Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autó- noma de México, 197 1.
(6) Goldwasser, R. A. y Kissling, R. E. “Fluorescent antibody staining of Street and fixed rabies virus antigens”. Proc SOC
Exp Biol 98:219-223, 19.58,
(7) Hernández, Y. H. Estudio comparativo entre un caso natural y uno experimental de derriengue en bovinos. Tesis profesio- nal. Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autó- noma de México, 1970.
(8) Hsiung, G. D. Diagnostic virology. Yale University Press, New Haven y Londres, 1964.
(9) Kitselman, C. H. y Mital, A. K. “Terminal dissemination of rabies virus in selected
rat tissues”. Can J Comp Med 32:461-464, 1968.
;.
(10) Leach, C. N. y Johnson, N. H. “Human rabies with special referente to virus dis- tribution and titer”. Amer J Trop Med 1 20:335-340, 1940.
(Il ) Levaditti, C. y Schoen, R. “Les corps de Negri dans le cytoplasm des epitheliums de la cornie”. Ann Inst Pasteur Suppl. Commemorative 55:69-96, 1935. (12) Martell, D. M. y Aldasoro, M. A. “Detec-
ción de virus rábico en glándula salival, lagrimal y epitelio cornea1 de perros afectados en forma natural”. (En prensa) (13) Martell, D. M. y Del Valle, P. Trabajo presentado en el XIX Congreso Mundial de Medicina Veterinaria y Zootecnia, México, D.F., 1971.
(14) Martell, D. M.; Batalla, C. D., y Baer, M. J. “Estudio de inmunofluorescencia de dife- rentes segmentos de encéfalos de bovinos muertos de rabia paralítica o derriengue en forma natural e inoculados experimen- talmente”. Téc Pee Méx 12-13:24-27,
1969.
(15) Martell, L. M.; Batalla, C. D. y López, R. J. “Detección de fluorescencia específica de rabia antes de la aparición de signos en ratones inoculados intracerebralmente con 5 cepas de virus rábico con y sin dime- tilsulfóxido (DMSO)“. Tbc Pee Méx
12-13:28-32, 1969.
(16) Pilo Moron, E. et al. “Diagnostique rapide de la rage par I’inoculation du cerveau et de la glande sous maxilaire aux souriceaux et par l’inmunofluorescence”. Arch Inst Pasteur Afgerie 45:5-10, 1967.
(17) Reed, L. J. y Muench, R. “A simple method of estimating fifty per cent end points”.
Marte11 D. y Moles y C. . VIRUS RABICO 359
-1
(18) Salido y Rengell, F. “Estudio de la cinética
del virus de la rabia en ratones inoculados intracerebralmente”. Rev Invest Sal Púb
Méx 28(3):183-192, 1968.
(19) Schindler, R. “Studies on the pathogenesis of rabies”. Bull WHO 25: 119-126, 1961. .’ (20) Schneider, L. G. “Pathogenesis of rabies in
mice. III. Centrifuga1 and virus spread and generalization in the body”. Zbl Bakt Parasit Kde I, 212:13-41, 1969. :,’ (21) Silva, R. A. y Souza, A. M. “Aislamiento
de virus rábico de pulmón, corazón,
riñón, vejiga y otros diferentes tejidos de
murciélagos hematógafos de las especie
Desmodus rotundus”. En V Congreso
Panamericano de Medicina Veterinaria y Zootecnia, Caracas, Venezuela, 1966. (22) Sulkin, E. S.; Krutz, H. P., y Allen, R. “Role
of brown bat in pathogenesis of rabies in
insectivorous bats (Tadarida b. mexi- cana) “. Proc Soc Expl Biol Med 96(2):
461-464, 1957.
(23) Villa, B. R.; Alvarez, B. L., y Domínguez, E. C. “Presencia y persistencia del virus de la rabia en la glándula interescapular de algunos murciélagos mexicanos”. Cienc Méx 22(5) : 137-140, 1963.
4. Rabies Virus in Rats and Mice Inoculated Intraplantarally (Summary)
The article describes an experiment to deter-
mine how soon rabies virus can be detected by immunofluorescence in the spinal cord, cere- bellum, cerebrum, and cornea before the first clinical signs of disease appear. Mice were inoculated intraplantarally with 0.08 ml and rats with 0.1 ml, and groups of three to five animals were sacrificed every 12 hours. Im- pressions were prepared from the nerve mate- rial and cornea1 epithelium and processed for diagnosis by the fluorescent antibody (FA) technique.
In the mice, virus was detected in the medulla at 84 hours (3.5 days)-an advance
over the appearance of clinical signs of 84 hours (3.5 days) for the lumbosacral cord, 96 hours (4 days) for the thoracic and cervical medulla, and 72 hours (3 days) for the brain. In the cornea detection was possible at 120 hours (5 days) .
In the rats, virus was found simultaneously in the medulla and in the brain at 72 hours (3 days), or 156 hours (6.5 days) sooner than the clinical signs appeared at either of these sites, and in the cornea at 144 hours (6 days).
The results would appear to indicate that the virus traveled more rapidly in the nerve tissue of the rats than in that of the mice.
Vírus rábico inoculado intraplantarmente em ratos e ratazanas (Resumo) .
0 artigo demonstra urna experiencia reali- zada para determinar com quantas horas de antecedencia ao aparecimento dos primeiros sinais clínicos é possível detectar o vírus rábico na medula espinhal, no cerebelo, no cérebro e
na córnea por meio do método de imuno- 4 florescência. Durante a experiência, inocula-
ram-se ratos por via intraplantar com 0,08 ml
e ratazanas com 0,l ml e se sacrificaram gru- pos de três a cinco animais cada 12 horas, fazendo-se impressóes do material nervoco e do epitélio corneal, para cuja diagnóstico foram
processadas pelo método de anticorpos fluores- centes.
r
Detectaram-se vírus na medula de ratazanas
decorridas 84 horas (3,5 dias), ou seja, 84
horas (3,5 dias) antes do aparecimento de ‘sinais clínicos na medula lombar, 96 horas (4 dias) antes do aparecimento de sinais clínicos na medula torácica e cervical, e 72 horas (3 dias) antes da presenta de sinais clínicos no encéfalo. A deteccáo na córnea foi realizada a partir das 120 horas (5 dias).
Em ratos, a deteccáo de vírus na medula e no encéfalo foi simultânea em 72 horas (3 dias), ou seja, 156 horas (6,5) dias antes do
aparecimento de sinais clínicos. Na córnea, a
360
47
BOLETIN DE LA OFICINA SANITARIA PANAMERICANA . Octubre 1973
Virus rabique chez les rats et les souris inoculés par voie intraplantaire (Résumé)
L’étude signale une expérience réalisée dans le but d’établir cambien d’heures avant l’ap- parition des premiers signes cliniques il est possible de déceler le virus rabique dans la moelle épinière, le cervelet, le cerveau et la cornée par la méthode d’immunofluorescence. Pendant l’expérience, on a inoculé par voie
intraplantaire 0,08 ml à des souris et 0,l ml à des rats; toutes les 12 heures on a sacrifié trois à cinq animaux en faisant des impressions du matériel nerveux et de l’épithélium cornéal, lesquelles ont été traitées par la méthode des anticorps fluorescents en vue de leur diagnostic.
Chez les souris, le virus a été décelé dans la moelle dans les 84 heures (3,5 jours), soit 84 heures (3,5 jours) avant l’apparition de signes
cliniques dans la moelle lombaire, 96 heures L (4 jours) avant l’apparition de signes cliniques 1 dans la moelle thoracique et cervicale, et 72 heures (3 jours) avant la présence de signes cliniques dans l’encéphale. Dans la cornée, le + dépistage a été réalisé à partir de 120 heures (5 jours).
Chez les rats, la découverte du virus dans la moelle et I’encéphale a été simultanée, 72 ‘i heures (trois jours) , soit 156 heures (6,5 jours) avant l’apparition de signes cliniques. Dans la cornée jusqu’à 144 heures (6 jours). Il ressort des résultats obtenus que le virus circule apparemment avec une plus grande rapidité dans le tissu nerveux des rats que dans celui
des souris. fi