UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Dissertação de mestrado
"Tratamento de efluentes ricos em sulfato por
adsorção em resinas de troca iônica"
Autora: Damaris Guimarães
Orientador: Prof. DSc. Versiane Albis Leão
UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Damaris Guimarães
"Tratamento de efluentes ricos em sulfato por adsorção em resinas de
troca iônica"
Dissertação de mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para a obtenção do título de Mestre em Engenharia de Materiais.
Área de concentração: Processos de fabricação
Orientador: Prof. DSc.
Versiane Albis Leão
Catalogação: sisbin@sisbin.ufop.br
G963t Guimarães, Damaris.
Tratamento de efluentes ricos em sulfato por adsorção em resinas de troca iônica [manuscrito] / Damaris Guimarães. – 2010.
xxii, 149 f. : il. color., grafs.; tabs.
Orientador: Prof. Dr. Versiane Albis Leão.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de Minas. Rede Temática em Engenharia de Materiais.
Área de concentração: Processos de fabricação.
1. Resíduos industriais - Teses. 2. Efluente - Qualidade - Teses. 3. Sulfatos - Remoção - Teses. 4. Adsorção - Teses. 5. Resinas de troca iônica - Teses. I. Universidade Federal de Ouro Preto. II. Título.
CDU: 628.54
iv
“Seja a mudança que você deseja ver no mundo.”
vi
Agradecimentos
Diante de mais uma etapa concluída, tenho muito a agradecer, pois dificilmente eu teria chegado até aqui se não tivesse contado com o apoio fundamental de pessoas e instituições, as quais colaboraram em diversos sentidos e viabilizaram, assim, a efetivação desta vitória. Primeiramente, eu agradeço a Deus por me permitir chegar até aqui e por jamais me desamparar.
Aos meus pais, Antônio e Maria, pela amizade, pelo carinho e, principalmente, pela força e apoio incondicionais, com os quais sempre pude contar.
Aos meus irmãos, sobrinho e a toda à minha família, que de modo geral, sempre acreditaram em mim.
Ao Paulo Henrique, em especial, por tornar tudo mais fácil com seu apoio, compreensão, carinho e companheirismo.
Ao Prof. DSc. Versiane Albis Leão pela oportunidade, confiança, orientação e, principalmente, pelo aprendizado.
Àquelas pessoas que participaram do dia a dia desta caminhada: os colegas Jardel, Marcela, Fernanda , Priscila e Bruno, pelo companheirismo e empenho durante as longas horas de estudo e nos momentos de descontração, e à toda equipe do laboratório de Bio&Hidrometalurgia, pelo apoio e aprendizagem.
À CAPES, pela concessão da bolsa, à empresa VALE, pelo apoio financeiro, e à REDEMAT/ UFOP/ laboratório de Bio&Hidrometalurgia, por dispor de toda a infraestrutura necessária ao desenvolvimento e à conclusão deste projeto.
vii
Índice
Lista de figuras ... x
Lista de tabelas ... xiv
Lista de notações ... xvii
Resumo ... xx
Abstract ... xxii
1. Introdução ... 1
2. Objetivos ... 4
2.1.Objetivo geral ... 4
2.2.Objetivos específicos ... 4
3. Revisão bibliográfica ... 6
3.1.Efluentes ricos em sulfato ... 6
3.1.1. Problemas relacionados à presença de sulfato em água potável e efluentes industriais ... 6
3.1.2. Drenagem ácida de mina (DAM) ... 7
3.2.Processos para tratar efluentes ricos em sulfato ... 9
3.2.1. Tratamento químico por precipitação ... 10
Formação de gipsita ... 10
Processo SAVMIN® ... 12
Processo CESR® ... 13
Formação de barita... 14
3.2.2. Separação por membranas ... 16
Osmose reversa ... 16
Processo SPARRO® ... 18
Eletrodiálise ... 19
3.2.3 Troca iônica. ... 21
Processo GYP-CIX® ... 21
3.2.4 Redução biológica de sulfato. ... 24
Biorreatores ... 25
Wetlands... 25
Barreiras produtoras de alcalinidade... 26
Barreiras reativas permeáveis ... 27
viii
3.4.O processo de troca iônica ... 30
3.4.1. Resinas de troca iônica ... 32
3.5.Cinética de adsorção ... 37
3.5.1. Modelos cinéticos ... 38
Modelo de pseudoprimeira ordem ... 38
Modelo de pseudossegunda ordem ... 40
Modelo de difusão intrapartícula ... 41
3.6.Equilíbrio de adsorção e tipos de isotermas ... 42
3.6.1. Isoterma de Langmuir ... 44
3.6.2. Isoterma de Freundlich ... 45
3.7.Termodinâmica de adsorção ... 46
3.8.Dessorção e regeneração ... 48
3.9. Adsorção em leito fixo ... 51
3.9.1. Cinética de adsorção em sistemas de leito fixo ... 56
Modelo de Adams-Bohart ... 56
3.10. Resinas de troca aniônica estudadas nos experimentos de adsorção ... 59
3.10.1. Purolite A500 ... 59
3.10.2. Amberlite IRA458 ... 61
3.10.3. Amberlyst A21 ... 62
3.11. Adsorção de sulfato ... 64
4. Materiais e métodos ... 72
4.1.Resinas utilizadas ... 73
4.2.Pré-tratamento das resinas ... 74
4.3.Determinação do tempo de equilíbrio ... 74
4.4.Avaliação das melhores condições operacionais das resinas ... 75
4.5.Estudos cinéticos ... 77
4.6.Isotermas de adsorção ... 78
4.7.Estudos termodinâmicos ... 80
4.8.Ensaios de regeneração e dessorção ... 80
4.9.Experimentos em colunas de leito fixo ... 81
4.10. Avaliação cinética dos dados de adsorção de sulfato em colunas de leito fixo ... 84
4.11. Disposição das resinas carregadas utilizadas nos experimentos. ... 84
5. Resultados e discussões ... 85
ix
5.2.Determinação do tempo de equilíbrio ... 86
5.3.Avaliação das melhores condições operacionais de adsorção ... 90
Influência do pH ... 90
Influência da temperatura ... 95
Influência da relação quantidade inicial de sulfato (mg) para cada mililitro de resina hidratada ... 96
5.4.Estudos cinéticos ... 98
5.5.Isotermas de adsorção ... 103
5.6.Estudos termodinâmicos ... 110
5.7.Ensaios de dessorção e regeneração ... 114
5.8.Adsorção de sulfato em colunas de leito fixo ... 118
Influência da concentração inicial ... 118
Influência da altura do leito ... 123
Influência da vazão ... 127
5.9.Avaliação cinética dos dados de adsorção de sulfato em colunas de leito fixo ... 132
6. Conclusões ... 137
7. Sugestões para trabalhos futuros ... 140
x
Lista de figuras
Figura 3.1: Fluxograma do processo de remoção de sulfato via precipitação de gipsita (Adaptado de INAP, 2003). ... 11 Figura 3.2: Fluxograma simplificado do processo SAVMIN® (Adaptado de INAP, 2003). ... 12 Figura 3.3: Fluxograma do processo de remoção de sulfato via precipitação de Barita (Adaptado de INAP, 2003). ... 15 Figura 3.4: Corte transversal (a) e corte longitudinal (b) de uma membrana tubular e o esquema de um equipamento tubular de osmose reversa (adaptado de Reynolds e Richards, 1995). ... 17 Figura 3.5: Fluxograma do processo SPARRO®... 19 Figura 3.6: Movimento dos íons dentro de uma célula de eletrodiálise (adaptado de INAP, 2003). ... 20 Figura 3.7: Fluxograma simplificado do processo GYP-CIX® (Adaptado de INAP, 2003).... 22 Figura 3.8: Esquema de funcionamento de um sistema de adsorção em colunas de leito fixo (a) e de leito fluidizado (b). ... 29 Figura 3.9: Esquema do mecanismo de troca iônica. B+ e C2+ são os íons a serem separados, X+, Z+ e W+ são os íons contidos nos eluentes (Collins et al., 2006). ... 31
Figura 3.10: Estrutura de resinas do tipo macrorreticulares ou macroporosas, e do tipo gel ou microrreticular (adaptado de Riane, 2008). ... 33 Figura 3.11: Polimerização e sulfonação de matrizes com base de estireno-divinilbenzeno resultando na produção de uma resina fortemente ácida (Collins et al., 2006). ... 35
xi Figura 3.14: Sequência de etapas requeridas para uma completa regeneração de um leito de resina catiônica carregada com íons sódio, onde (a) representa um processo de regeneração no mesmo sentido da alimentação, descendente, e (b) um processo de regeneração em sentido ascendente, contrário ao de alimentação (adaptado de Wheaton e Lefevre, 2000) ... 50 Figura 3.15: Movimento das zonas de sorção ao longo do tempo de saturação de um leito fixo, alimentado por fluxo ascendente, juntamente à respectiva curva de trespasse (Adaptado de Richards e Reynolds, 1995; Woodard, 2001). ... 53 Figura 3.16: Matriz de uma resina de poliestireno, copolimerizada por divinilbenzeno funcionalizada com grupos amônio quaternário estabilizados por íons cloreto, tal como a resina Purolite A500 (Riani apud Buchard, 1979). ... 59
Figura 3.17: Matriz de uma resina acrílica funcionalizada com grupos amônio quaternário estabilizados por íons cloreto, tal como a resina Amberlite IRA458 (Adaptada de Riani apud
Buchard, 1979). ... 61 Figura 3.18: Matriz de uma resina de poliestireno, copolimerizada por divinilbenzeno funcionalizada com grupos amina terciária, tal como a resina Amberlyst A21 (Riani apud
xii Figura 5.4: Curvas de carregamento em função do tempo obtidas para as resinas Purolite A500, Amberlyst A21 e Amberlite IRA458, a 70°C e agitação de 180min-1. ... 88 Figura 5.5: Carregamento de sulfato alcançado pela resina Purolite A500 em função do tempo de contato, a 28±1°C, pH=4, agitação de 200min-1 e solução de sulfato de sódio,
300mg/L. ... 99 Figura 5.6: Carregamento de sulfato alcançado pela resina Amberlyst A21 em função do tempo de contato, a 28±1°C, pH=4, agitação de 200min-1 e solução de sulfato de sódio,
150mg/L. ... 99 Figura 5.7: Isotermas de adsorção ajustadas aos modelos de Freundlich (a) e de Langmuir (b), construídas com os dados obtidos nos experimentos realizados a 34ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 104 Figura 5.8: Isotermas de adsorção ajustadas aos modelos de Freundlich (a) e de Langmuir (b), construídas com os dados obtidos nos experimentos realizados a 40ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 104 Figura 5.9: Isotermas de adsorção ajustadas aos modelos de Freundlich (a) e de Langmuir (b), construídas com os dados obtidos nos experimentos realizados a 50ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 105 Figura 5.10: Isotermas de adsorção ajustadas aos modelos de Freundlich (a) e de Langmuir (b), construídas com os dados obtidos nos experimentos realizados a 70ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 105 Figura 5.11: Gráfico do logaritmo neperiano das constantes de equilíbrio (ln Keq) para a resina
Purolite A500 em função do inverso da temperatura (1/T). Dados obtidos a 34ºC, 40ºC, 50ºC e
70ºC, em pH=4 e agitação de 180min-1. ... 111 Figura 5.12: Gráfico do logaritmo neperiano das constantes de equilíbrio (ln Keq) para a resina
Amberlyst A21 em função do inverso da temperatura (1/T). Dados obtidos a 34ºC, 40ºC e
xiii Figura 5.14: Curvas de trespasse construídas utilizando um leito de resina Amberlyst A21, de 9cm de altura, 0,35 de porosidade, alimentado a uma vazão de 15mL/min com soluções contendo diferentes concentrações de sulfato, em pH=4 e 28±1°C. ... 120 Figura 5.15: Curvas de trespasse construídas utilizando leitos de resina Purolite A500 de diferentes alturas, alimentado a uma vazão de 15mL/min com solução contendo 170mg(SO42-)/L, em pH=4 e 28±1°C. ... 124
Figura 5.16: Curvas de trespasse construídas utilizando leitos de resina Amberlyst A21 de diferentes alturas, alimentado a uma vazão de 15mL/min com solução contendo 80mg(SO42-)/L, em pH=4 e 28±1°C. ... 125
Figura 5.17: Curvas de trespasse construídas utilizando um leito de resina Purolite A500, de 9cm de altura, 0,35 de porosidade, alimentado, sob diferentes vazões, com solução contendo 170mg(SO42-)/L, em pH=4 e 28±1°C. ... 128
Figura 5.18: Curvas de trespasse construídas utilizando um leito de resina Amberlyst A21, de 9cm de altura, 0,35 de porosidade, alimentado, sob diferentes vazões, com solução contendo 80mg(SO42-)/L, em pH=4 e 28±1°C. ... 129
Figura 5.19: Efeito da variação de K nas curvas de trespasse obtidas em condições
experimentais fixas de vazão, concentração, altura do leito e constante No
xiv
Lista de tabelas
Tabela 3.1: Relação entre o fator RL e o tipo de isoterma. ... 45
Tabela 3.2: Dados experimentais obtidos por alguns autores que estudaram a remoção de íons sulfato via adsorção. ... 70 Tabela 4.1: Principais características físicas e químicas das resinas Purolite A500, Amberlite IRA458 e Amberlyst A21. ... 73 Tabela 4.2: Condições operacionais recomendadas pelos respectivos fabricantes para se trabalhar com cada uma das resinas estudadas. ... 73 Tabela 4.3: Condições operacionais testadas ao avaliar o desempenho das resinas estudadas.76 Tabela 4.4: Correspondência entre a relação quantidade inicial de sulfato (mg) para cada mililitro de resina utilizada e a respectiva concentração inicial de sulfatos na soluções utilizadas nos ensaios de avaliação do desempenho das resinas em diferentes condições operacionais. ... 76 Tabela 4.5: Correspondência entre a relação quantidade inicial de sulfato (mg) para cada mililitro de resina utilizada e a respectiva concentração inicial de sulfato nas soluções utilizadas nos ensaios para a construção das isotermas de adsorção. ... 79 Tabela 4.6: Condições experimentais adotadas nos ensaios em que analisou-se a influência da concentração de sulfato na solução de alimentação do sistema. ... 82 Tabela 4.7: Condições experimentais adotadas nos ensaios em que analisou-se a influência da altura do leito adsorvente. ... 82 Tabela 4.8: Condições experimentais adotadas nos ensaios em que analisou-se a influência da vazão. ... 83 Tabela 5.1: Valores de carregamento alcançado pelas resinas estudadas no equilíbrio, qeq
(mg(SO42-)/L), nos experimentos realizados a 34ºC, agitação de 180min-1, pH fixo e utilizando
xv Tabela 5.2: Valores de carregamento alcançado pelas resinas estudadas no equilíbrio, qeq
(mg(SO42-)/L), nos experimentos realizados a 50ºC, agitação de 180min-1, pH fixo e utilizando
solução de sulfato de sódio, cujas concentrações iniciais do ânion foram: (1) 100mg/L, (2) 300mg/L, (3) 700mg/L, (4) 1200mg/L e (5) 1700mg/L. ... 92 Tabela 5.3: Valores de carregamento alcançado pelas resinas estudadas no equilíbrio, qeq
(mg(SO42-)/L), nos experimentos realizados a 70ºC, agitação de 180min-1, pH fixo e utilizando
solução de sulfato de sódio, cujas concentrações iniciais do ânion foram: (1) 100mg/L, (2) 300mg/L, (3) 700mg/L, (4) 1200mg/L e (5) 1700mg/L. ... 93 Tabela 5.4: Constantes dos modelos cinéticos de pseudoprimeira ordem, pseudossegunda ordem e de difusão intrapartícula e ajustes (R2) obtidos para os processos de adsorção de sulfato referentes à resina Purolite A500 e Amberlyst A21, ocorridos a 28±1°C, pH=4, agitação de 200min-1 contendo inicialmente 300 e 150mg(SO42-)/L. ... 101
Tabela 5.5: Parâmetros das isotermas de adsorção, Freundlich e Langmuir, construídas a 34ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 106 Tabela 5.6: Parâmetros das isotermas de adsorção, Freundlich e Langmuir, construídas a 40ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 106 Tabela 5.7: Parâmetros das isotermas de adsorção, Freundlich e Langmuir, construídas a 50ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 107 Tabela 5.8: Parâmetros das isotermas de adsorção, Freundlich e Langmuir, construídas a 70ºC, pH=4 e agitação de 180min-1, com as resinas Purolite A500 e Amberlyst A21. ... 107 Tabela 5.9: Dados para determinação da variação de entalpia envolvida no processo de adsorção de sulfato pela resina Purolite A500, nas temperaturas de 34ºC, 40ºC, 50ºC e 70ºC, em pH=4 e agitação de 180min-1. ... 110 Tabela 5.10: Dados para determinação da variação de entalpia envolvida no processo de adsorção de sulfato pela resina Amberlyst A21, nas temperaturas de 34ºC, 40ºC e 70ºC, em pH=4 e agitação de 180min-1... 110 Tabela 5.11: Variações de entalpia, ΔH°, energia livre de Gibbs, ΔG°, e de entropia, ΔS°,
xvi Tabela 5.12: Resultados de dessorção de obtidos para as resinas Purolite A500 e Amberlyst A21, a 30°C e agitação de 180min-1. ... 116 Tabela 5.13: Dados experimentais obtidos nos ensaios de adsorção realizados em leito fixo de 9cm de altura, 0,35 de porosidade, contendo resina Purolite A500, alimentado com soluções contendo diferentes concentrações de sulfato, a uma vazão de 15mL/min, em pH=4 e 28±1°C... 119 Tabela 5.14: Dados experimentais obtidos nos ensaios de adsorção realizados em leito fixo de 9cm de altura e 0,35 de porosidade, contendo resina Amberlyst A21, alimentado com soluções contendo diferentes concentrações de sulfato, a uma vazão de 15mL/min, em pH=4 e 28±1°C... 120 Tabela 5.15: Dados experimentais obtidos nos ensaios de adsorção realizados em leitos de diferentes alturas de resina Purolite A500, alimentado a uma vazão de 15mL/min com solução contendo 170mg(SO42-)/L em pH=4 e 28±1°C. ... 124
Tabela 5.16: Dados experimentais obtidos nos ensaios de adsorção realizados em leitos de resina Amberlyst A21 de diferentes alturas, alimentados a uma vazão de 15mL/min com soluções contendo 80mg(SO42-)/L, em pH=4 e 28±1°C. ... 125
Tabela 5.17: Dados experimentais obtidos nos ensaios de adsorção realizados em leito fixo de 9cm de altura e 0,35 de porosidade, contendo resina Purolite A500, alimentado com solução contendo 170mg(SO42-)/L, sob diferentes vazões, em pH=4 e 28±1°C. ... 129
Tabela 5.18: Dados experimentais obtidos nos ensaios de adsorção realizados em leito fixo de 9cm de altura e 0,35 de porosidade, contendo resina Amberlyst A21, alimentado com solução contendo 80mg(SO42-)/L, sob diferentes vazões, em pH=4 e 28±1°C. ... 130
Tabela 5.19: Parâmetros do modelo de Adams-Bohart, K e No, e os respectivos ajustes (R2)
correspondentes aos ensaios de adsorção realizados em colunas de leito fixo, a 28±1°C, pH=4
xvii
Lista de notações
ABNT: Associação Brasileira de Normas Técnicas
b: Constante relacionada à afinidade entre o adsorvato e o adsorvente C: Constante associada à espessura da camada limite
Cb: Concentração do adsorvato na solução efluente à coluna no momento em que o leito
adsorvente já se encontra saturado
Ceq: Concentração de equilíbrio do adsorvato na fase fluida
CESR®: “Cost Effective Sulfate Removal”
Cf: Concentração final de adsorvato na solução
Co: Concentração inicial do adsorvato na fase fluida
CONAMA: Conselho Nacional do Meio Ambiente Ct: Concentração de adsorvato no tempo t
DAM: Drenagem Ácida de Mina DAR: Drenagem Ácida de Rocha DBO: Demanda Biológica de Oxigênio DQO: Demanda Química de Oxigênio e: Constante de Euller
eq: Equivalente
FEAM: Fundação Estadual do Meio Ambiente GYP-CIX®:“Gypsum - Cation Exchange Resin”
h: Altura do leito
INAP: “International Network for Acid Prevention”
K: Constante de velocidade de adsorção linear k: Constante de velocidade da reação global
k1: Constante de velocidade da reação direta (adsorção)
k2: Constante de velocidade da reação inversa (dessorção)
kc: Constante de equilíbrio determinada com base em dados cinéticos
KD: Coeficiente de distribuição (ou bipartição)
Keq: Constante de equilíbrio
Kf: Fator de capacidade
kip: Constante de velocidade de difusão intrapartícula
xviii m: Massa de adsorvato acumulada no adsorvente em qualquer tempo t
mE: Quantidade de adsorvente retida no adsorvente quando o mesmo encontra-se saturado
mtotal: Massa total de adsorvato acumulada no adsorvente
n: Parâmetro de intensidade
No: Quantidade máxima de adsorvato adsorvida por volume de leito (Modelo de
Adams-Bohart)
pH: Potencial hidrogeniônico
Q: Vazão de alimentação de um sistema de leito fixo
q: Quantidade de adsorvato transferida da fase fluida para o adsorvente qeq: Quantidade de adsorvato adsorvido por unidade de adsorvente
qmáx: Carregamento máximo do adsorvato alcançado pelo adsorvente
R: Constante universal dos gases R: Coeficiente de correlação RL: Fator de separação
S: Área da seção transversal da coluna SAVMIN®: “Savanah Mining”
SPARRO®: “Slurry Precipitation and Recycle Reverse Osmosis”
STD: Sólidos Totais Dissolvidos T: Temperatura
t: Tempo decorrido TE: Tempo de exaustão
TT: Tempo de trespasse
ttotal: Tempo gasto pelo adsorvente para adsorver mtotal adsorvato
Uo: Velocidade linear do fluxo de alimentação da coluna
USEPA:“United State Environmental Protection Agency” Ut: Parâmetro fracional de equilíbrio
VE: Volume de exaustão
Vres: Volume da resina
Vsol: Volume da solução
VT: Volume de trespasse
Vtotal: Volume de solução contendo mtotal
VZ: Volume da zona de sorção
WHO: “World Health Organization”
xix Zs: Comprimento da zona de sorção
ΔG°: Variação da energia livre de Gibbs
ΔH°: Variação da entalpia
ΔS°: Variação da entropia
xx
Resumo
A presença de íons sulfato em efluentes e águas industriais representa um sério problema para diversos setores industriais, para o meio ambiente e para a saúde humana, os quais são agravados pela sua alta solubilidade em meios aquosos. Visando ao tratamento de efluentes ricos em íons sulfato, em especial de efluentes ácidos de mineração, o presente trabalho descreve estudos de remoção do íon via adsorção em resinas de troca iônica. Foram utilizadas as resinas de troca aniônica: Purolite A500, Amberlite IRA458 e Amberlyst A21, sendo as duas primeiras fortemente básicas e a terceira fracamente básica. Nos ensaios realizados em batelada, observou-se que o processo de adsorção de sulfato pelas resinas estudadas é, principalmente, influenciado pela relação massa de sulfato (na solução)/volume de resina. Especificamente para as resinas Amberlite IRA458 e Amberlyst A21, foi observado que o pH do meio exerce uma influência significativa em seus processos de adsorção, os quais são
favorecidos em pH’s ácidos. Trabalhando nas melhores condições operacionais de adsorção,
foram realizados os estudos cinéticos e termodinâmicos, assim como a construção das isotermas para as resinas Purolite A500 e Amberlyst A21, uma vez que a resina Amberlite IRA458 não é recomendada para adsorção em temperaturas superiores a 35°C. Esses estudos mostraram que os respectivos processos de adsorção são relativamente rápidos, sendo que a resina Purolite A500 e a Amberlyst A21 alcançaram o equilíbrio após decorridos, respectivamente, cerca de 20 minutos e 45 minutos de contato entre a fase sólida a fase líquida. Os dados experimentais ao serem ajustados aos modelos cinéticos de pseudoprimeira ordem, pseudossegunda ordem e de difusão intrapartícula, mostraram que o processo de adsorção de sulfato pela resina Purolite A500 segue a cinética de pseudoprimeira ordem e, pela resina Amberlyst A21, os modelos de pseudoprimeira ordem e ao de pseudossegunda ordem. Observou-se também que a temperatura exerce pouca influência nos processos de adsorção de sulfato pelas resinas Purolite A500 e Amberlyst A21, os quais são de
fisiossorção. Para a resina Purolite A500, o processo é endotérmico (ΔH°=10,81kJ/mol) e a
acessibilidade dos íons sulfato aos sítios de adsorção aumenta com o aumento da temperatura
(ΔS°=0,082kJ/mol.K). Para a resina Amberlyst A21, o processo é exotérmico (ΔH°=-25,06 kJ/mol) e a acessibilidade dos íons sulfato aos sítios diminui com o aumento da temperatura
xxi de sódio (pH = 10 e 12). Os experimentos realizados em colunas de leito fixo foram desenvolvidos avaliando o efeito da concentração inicial de sulfato na alimentação do sistema, da altura do leito e da vazão, onde a resina Purolite A500 alcançou um carregamento máximo de, aproximadamente, 50mg(SO42-)/mL(resina), enquanto que a resina Amberlyst A21
manteve o mesmo desempenho observado em batelada (~10mg(SO42-)/mL(resina)). O modelo
de Adams-Bohart pode ser aplicado para descrever o processo de adsorção de sulfato pela resina Purolite A500, mas não mostrou boa correlação com os dados obtidos pela resina Amberlyst A21.
xxii
Abstract
Sulfate-contaminated effluents and process waters are of special concern from industrial, environmental and health points of view. This is due to its high solubility in aqueous solutions. Aiming to treat sulfate-containing effluents, this work describes sulfate sorption by ion exchange resins with special focus on mining affected waters. The resins Purolite A500 (strong base), Amberlite IRA458 (strong base) and Amberlyst A21 (weak base) were studied. In batch experiments, it was observed that the sulfate adsorption process by studied resins is essentially influenced by the sulfate concentration (in solution) / resin volume ratio. Specifically for Amberlite IRA 458 and Amberlyst A21 resins, the pH solution has an effect on its loading of sulfate ions. Working on best adsorption operational conditions, kinetics and thermodynamics studies and isotherms were developed with Purolite A500 and Amberlyst A21 resins, since Amberlite IRA458 beads are not suited for experiments at temperatures higher than 35°C. These studies showed that the sulfate adsorption onto Purolite A500 and Amberlyst A21 resins is relatively fast and equilibrium is reached respectively in 20 and 45 minutes of contact of liquid and solid phase. The experimental dates showed that Purolite A500 resin follows the first order model while, for Amberlyst A21 resin, both pseudo-first order and pseudo-second order model can be applied to describe its process sorption. In addition, temperature has minor effect on sulfate loading on Purolite A500 e Amberlyst A21 resins, which process present physisorption mechanism. For Purolite A500 resin, sulfate
adsorption is endothermic (ΔH°=10.81kJ mol-1) and the accessibility of sulfate ions to
adsorption site increases with the increase of the temperature (ΔS°=0.082kJ/mol.K). Conversely, the sorption process for Amberlyst A21 resin is exothermic (ΔH°=25.06kJ/mol)
with an associated entropy (ΔS°=0.042kJ/mol.K). The sulfate adsorption process on both
resins can be described by Freundlich and Langmuir models. Batch elution experiments showed good sulfate removal from Purolite A500 and Amberlyst A21 resins (>75%) in presence of, respectively, sodium chloride (1.1 and 2.2g(Cl-)/L-1) or sodium hydroxide (pH 10 e 12). Fixed bed experiments were developed evaluating the effect of initial sulfate concentration, bed height and flow rate. In this case, Purolite A500 resin attained, approximately, 50mg(SO42-)/mL(resin), while the Amberlyst A21 had maintained its
performance observed in batch system (10mg(SO42-)/mL(resin)). Adams-Bohart model could
xxiii Purolite A500 resin always showed the best performance and 50mg(SO42-)/mL-1 (resin) was
attained during fixed bed sorption.
1
1 - Introdução
A associação brasileira de normas técnicas, ABNT, através da norma nº 9800 de 1987, define efluentes líquidos industriais como “despejo líquido proveniente do estabelecimento
industrial, compreendendo emanações de processo industrial, águas de refrigeração poluídas,
águas pluviais poluídas e esgoto doméstico” (ABNT, 1987).
Os efluentes líquidos industriais diferem entre si conforme o tipo de indústria que os origina, sendo sua caracterização feita analisando-se vários parâmetros físicos (temperatura, cor, turbidez, sólidos totais, etc.), químicos (teor de nitrogênio e fósforo, pH, alcalinidade, dureza, teor de oxigênio dissolvido, demanda biológica de oxigênio (DBO), demanda química de oxigênio (DQO), teor de matéria orgânica, concentração de metais, etc.) e biológicos (presença de coliformes) (FEAM, 2000). É com base nesses parâmetros que se determina o risco que esse efluente oferece ao meio ambiente, à saúde humana e, até mesmo, à própria indústria que o originou.
A geração de efluentes líquidos ricos em sulfato é um sério problema associado às indústrias que utilizam ácido sulfúrico em algum de seus processos ou matérias-primas ricas em sulfato, sulfito, tiossulfato, sulfeto e outros compostos contendo enxofre. Como exemplo, podem-se citar as indústrias de fermentação, as unidades de exploração e produção de petróleo, os curtumes, as fundições, as mineradoras, as indústrias têxteis, de celulose, de fertilizantes, dentre outras (Lens et al.,1995; WHO, 2004).
A presença de sulfato dissolvido em águas de processo ou já no efluente final é favorecida pela alta solubilidade do íon em meios aquosos, como é o caso, por exemplo, do sulfato de sódio, do sulfato de potássio e do sulfato de magnésio (WHO, 2004). Os altos teores de sulfato dissolvido nesses meios representam problemas para muitos processos industriais, pois estão relacionados à ocorrência de corrosão de tubulações, estruturas e equipamentos compostos por diferentes materiais. Já o lançamento desses efluentes no meio ambiente pode causar impactos ambientais relacionados ao aumento de acidez de solos e corpos hídricos, como por exemplo, aumento no teor de sais dissolvidos (Bowell, 2000; INAP, 2003; WHO, 2004; Oliveira, 2006).
De acordo com a World Health Organization (WHO, 2004), os seres humanos, ao ingerir
2 gosto amargo a um sabor repugnante. Como o excesso de íons sulfato presente no organismo é eliminado pelas fezes, a ingestão de elevados teores de sulfato pode levar esses indivíduos a apresentarem quadros de diarreia, podendo, por meio desta, levá-los à desidratação.
Dos efluentes contendo elevados teores de sulfato, a drenagem ácida de mina (DAM), um efluente de mineração, receberá atenção especial neste trabalho, pois está diretamente ligada a este importante setor da economia. Isso não significa, porém, que os resultados obtidos não se apliquem aos efluentes ricos em sulfato gerados pelos outros setores industriais ou que esses outros sejam menos importantes.
De acordo com Borma e Soares (2002) e Akcil e Koldas (2006), a DAM pode ser definida como a solução ácida gerada quando minerais sulfetados, presentes em pilhas e depósitos de resíduos de mineração, galerias de minas subterrâneas, pilhas de estoque de minério e cavas de mina a céu aberto, são oxidados em presença de água e oxigênio atmosférico, com ou sem a ajuda de bactérias. Esta solução ácida age como agente lixiviante dos minerais, produzindo um percolado rico em metais dissolvidos e ácido sulfúrico. Caso esse percolado alcance corpos hídricos mais próximos pode contaminar suas águas tornando-as impróprias para o uso por muito tempo, mesmo após cessadas as atividades de mineração.
A denominação drenagem ácida de rochas (DAR) é algumas vezes empregada em lugar de DAM. Isso ocorre particularmente quando se faz referência às drenagens ácidas decorrentes de atividades não relacionadas à mineração como, por exemplo, pode ser observado a partir de materiais sulfetados movimentados na construção civil (Borma e Soares, 2002; Akcil e Koldas, 2006).
A resolução n°357 do Conselho Nacional do Meio Ambiente estabelece que o lançamento de efluentes contendo íons sulfato não pode fazer com que o teor desses íons no corpo hídrico receptor ultrapasse o limite de 250mg/L (CONAMA, 2005). Visando a atender à legislação, o tratamento de efluentes contendo altos teores de sulfato geralmente inclui combinações de etapas de neutralização e precipitação com cal, osmose reversa, eletrodiálise, adsorção, entre outras. Porém, muitas dessas técnicas têm se mostrado economicamente inviáveis ou deficientes, de tal forma que têm sido pouco utilizadas, requerendo para isso atenção especial para que sejam aprimoradas e, então, eficientemente aplicadas (INAP, 2003).
3 que este problema ainda se mostra sem solução aplicável em escala industrial e que são vários os setores industriais que o enfrentam.
Um processo que pode ser aplicado para tratar efluentes ricos em sulfato é o de troca iônica, a qual é capaz de produzir água muito pura a partir de um efluente contaminado (Haghsheno et al., 2009). Este processo consiste na remoção de íons indesejáveis, presentes no efluente, que
são substituídos por uma quantidade equivalente de espécies iônicas que apresentam menor potencial de perigo, previamente adsorvidos em uma matriz sólida insolúvel (Habashi, 1993; Reynolds e Richards, 1995). Ânions como o sulfato podem ser removidos do efluente industrial utilizando uma resina de troca aniônica, forte ou fracamente básica, assim como, é feito pela empresa canadense Bioteq, a qual desenvolveu um processo de remoção desses íons com essa tecnologia.
As resinas de troca iônica são constituídas de uma matriz porosa, natural ou sintética, inerte, insolúvel em água e em solventes orgânicos, apresentando ligações covalentes a grupos trocadores iônicos, que são, principalmente, classificados em catiônicos ou aniônicos. Esses grupos iônicos podem estar ligados a contraíons (Collins et al., 2006), cuja presença no
efluente seja permitida pela legislação em concentrações mais altas, já que serão substituídos pelos íons a serem retirados do efluente.
O processo de troca iônica em resinas, para o sulfato, pode ser representado, de forma geral e simplificada, pela equação (1.1):
2R-A + SO42-→ R2SO4 + 2A- (1.1)
Onde R representa a matriz e grupo trocador iônico da resina e A o contraíon presente na
4
2 - Objetivos
2.1 - Objetivo geral:
Este projeto teve como objetivo geral estudar a aplicabilidade do processo de troca iônica para tratar efluentes com elevados teores de sulfato, utilizando, para isso, resinas de troca aniônica forte e fracamente básicas (Purolite A500, Amberlite IRA458 e Amberlyst A21), sob diversas condições operacionais, em batelada e em colunas de leito fixo.
2.2 - Objetivos específicos:
a) Estimar em diferentes temperaturas o tempo necessário para que o equilíbrio de adsorção/dessorção de sulfato nas resinas fosse atingido;
b) Avaliar, em batelada, as condições operacionais das resinas nas quais um maior carregamento de sulfato, fosse observado, estudando a influência da temperatura, do pH e da concentração inicial de íons sulfato;
c) Nas melhores condições operacionais e em batelada:
i. Construir, na melhor condição de pH observada, em diferentes temperaturas, as respectivas isotermas de equilíbrio e, por meio delas determinar a qual modelo de adsorção, se o de Freundlich ou o de Langmuir, as mesmas melhor se ajustam;
ii. Avaliar os comportamentos cinético e termodinâmico do processo de adsorção de sulfato pelas resinas;
5 d) Avaliar os melhores parâmetros operacionais para se trabalhar com as resinas, em sistemas de coluna de leito fixo, avaliando o efeito da altura do leito, da vazão de entrada e da concentração inicial de sulfato na alimentação do sistema;
6
3 - Revisão bibliográfica
3.1 - Efluentes ricos em sulfato
3.1.1 - Problemas relacionados à presença de sulfato em água potável e efluentes industriais
Os íons sulfato são descarregados no meio aquático via efluentes de mineradoras, fundições, indústrias de papel, têxtil e de curtumes. A presença desses íons em água é favorecida pela alta solubilidade de sulfatos como o de sódio, de potássio e de magnésio e pela não tão alta solubilidade de sulfatos como, por exemplo, o de cálcio (WHO, 2004).
Os íons sulfato, quando presentes em efluentes e demais corpos d’água, são responsáveis por
7 Com base nos efeitos nocivos causados pelo sulfato aos seres humanos e aos animais, a World Health Organization (2006) estabelece um limite para a concentração de sulfato de 500mg/L
em águas de abastecimento e, baseada nesse parâmetro, a United State Environmental Protection Agency (USEPA, 1999) adota um padrão de 250mg/L de íons sulfato em águas
para o mesmo fim. No Brasil, a resolução n°357 do Conselho Nacional do Meio Ambiente (CONAMA) dispõe sobre a classificação dos corpos de água e diretrizes ambientais para o seu enquadramento, bem como estabelece as condições e padrões de lançamento de efluentes. Para o sulfato, esta estabelece que o efluente a ser lançado em algum corpo hídrico, após incorporado no mesmo, não pode fazer com que esse ultrapasse a concentração máxima de sulfato de 250mg/L (CONAMA, 2005).
3.1.2 - Drenagem ácida de mina (DAM)
A drenagem ácida de mina (DAM) é produzida quando minerais sulfetados são expostos à ação da água e do oxigênio, sendo oxidados com ou sem a atuação de micro-organismos (Akcil e Koldas, 2006). A denominação drenagem ácida de rochas (DAR) é algumas vezes empregada em lugar de DAM quando se faz referência às drenagens ácidas geradas a partir de minerais sulfetados contidos em rochas expostas à ação do ar e da água (Lawrence e Marchant, 1991), como por exemplo, na construção civil (Borma e Soares, 2002).
A DAM é caracterizada pelo seu baixo pH e pela alta concentração de metais pesados dissolvidos, tais como zinco (Zn), chumbo (Pb), cobre (Cu) e arsênio (As), que podem contaminar águas superficiais e subterrâneas. Esses metais são liberados em solução por diversos mecanismos, como por exemplo, através da oxidação, direta pelo oxigênio ou pelo íon férrico (Fe3+), de sulfetos metálicos (ZnS, PbS e CuS) ou pelo aumento da solubilidade de minerais não-sulfetados em pH ácido (Yanful et al., 1997).
A origem da DAM está relacionada à oxidação natural de diversos minerais sulfetados, como é o caso, principalmente, da pirita (FeS2) e da pirrotita (Fe1-xS) (Lawrence e Marchant, 1991;
8 2FeS2 (s) + 7O2 (g) + 2H2O → 2Fe2+ + 4SO42-+ 4H+ (3.1)
Em seguida, os íons Fe2+ são oxidados a Fe3+ (equação (3.2)), os quais, entre pH 2,3 e 3,5, podem se precipitar na forma de hidróxido férrico (Fe(OH)3) (equação (3.3)) ou de jarosita. É
possível, ainda, à medida que o pH do meio é reduzido para valores abaixo de 2, que os íons Fe3+ remanescentes na solução oxidem a pirita (equação (3.4)):
4Fe2+ + O2 (g) + 4H+→ 4Fe3+ + 2H2O (3.2)
Fe3+ + 3H2O → Fe(OH)3 (s) + 3H+ (3.3)
FeS2 (s) + 14Fe3+ + 8H2O → 15 Fe2+ + 2SO42- + 16H+ (3.4)
Após iniciado o processo, as equações (3.2), (3.3) e (3.4) ocorrem simultaneamente. De uma forma geral, combinando-se as equações acima obtém-se a equação geral do processo, representada pela equação (3.5):
FeS2 (s) + 15/8O2 + 13/2Fe3+ + 17/4H2O → 15/2 Fe2+ + 2SO42-+ 17/2H+ (3.5)
Inicialmente, o processo de oxidação da pirita ocorre sem a atuação de bactérias, tornando-se mais lento à medida em que o pH decresce. À medida que a equação (3.1) vai ocorrendo e disponibilizando para o meio íons Fe2+, inicia-se a etapa de oxidação do íon Fe2+ a Fe3+ equação (3.2), a qual pode se desenvolver também pela atuação da bactéria Acidithiobacillus ferrooxidans,cuja atividade determina a velocidade do processso. Já a velocidade da reação
representada pela equação (3.3) é dependente da concentração de íons Fe3+ no meio, bem como de sua velocidade de produção (equação (3.2)) (Borma e Soares, 2002).
De acordo com Akcil e Koldas (2006), os principais fatores químicos, físicos e biológicos, do meio, que determinam a velocidade de geração de ácido são:
pH;
Temperatura;
Teor de oxigênio na fase gasosa;
Concentração de oxigênio na fase aquosa;
Grau de saturação da água;
9
Área superficial exposta do sulfeto metálico;
Energia de ativação necessária para iniciar a geração de ácido, e
Atividade bacteriana.
Além dos fatores citados, em se tratando de pilha de resíduos, quanto maior for sua permeabilidade, mais rápido será o processo de geração de ácido, uma vez que a acessibilidade do oxigênio é maior e que o aumento da temperatura por convecção fica favorecido. A influência bacteriana (por exemplo, da bactéria A. ferrooxidans) também é mais
efetiva se o pH da água for menor que 3,2 (Akcil e Koldas, 2006).
A DAM, uma vez iniciada, é considerada um dos problemas ambientais mais preocupantes que deve ser encarado pelas agências fiscalizadoras do meio ambiente, pelas mineradoras e pelos pesquisadores da área, de forma a evitar, remediar ou até mesmo tratar esse tipo de efluente, o qual apresenta uma alta periculosidade, devido, principalmente, à presença de metais pesados dissolvidos (Lapakko et al., 1999; Akcil e Koldas, 2006).
3.2 - Processos para tratar efluentes ricos em sulfato
Poucas pesquisas têm sido realizadas sobre o tratamento de efluentes ricos em sulfato, mas os
membros do “International Network for Acid Prevention – INAP” (2003) fizeram um estudo
de caso dos processos de tratamento de efluentes ácidos de mineração contendo sulfato e dos regulamentos ambientais estabelecidos por agências e órgãos governamentais em todo o mundo. Em seus estudos, os processos de maior eficácia tiveram suas metodologias descritas e seus respectivos custos operacionais levantados, documentando, assim, os estudos de caso das operações de sucesso. Tais operações se dividem em quatro categorias, as quais são descritas a seguir:
i. Tratamento químico por precipitação ii. Separação por membranas
iii. Troca iônica
10 3.2.1 - Tratamento químico por precipitação
De acordo com o INAP (2003), uma das formas de se remover íon sulfato de efluentes ácidos de mineração é através da técnica de precipitação, da qual quatro processos se destacam:
Formação de gipsita (CaSO4.2H2O)
Processo SAVMIN®
Processo CERS®
Formação de sulfato de bário (BaSO4)
Formação de gipsita
O processo de precipitação química envolvendo a formação de gipsita (CaSO4.2H2O),
baseia-se na adição de hidróxido de cálcio (Ca(OH)2) ou carbonato de cálcio (CaCO3), visando,
inicialmente, à neutralização da drenagem ácida de mina, seguida da precipitação dos íons sulfato na forma de gipsita. As reações químicas envolvidas nesse processo são representadas pelas equações (3.6) e (3.7).
Ca(OH)2(s) + H2SO4→ CaSO4. 2H2O(s) (3.6)
CaCO3(s) + H2SO4→ CaSO4.2H2O (s) + CO2 (g) (3.7)
O teor de sulfato que pode ser reduzido por esse processo é controlado pela solubilidade da gipsita, a qual é dependente da composição química inicial do efluente, bem como da força iônica da solução. Devido à alta solubilidade do sulfato de cálcio, o que faz com que uma alta concentração de sulfato remanescente seja observada no efluente após a etapa de precipitação, (entre 1500 e 2000mg/L), o uso de tal processo é melhor indicado como pré-tratamento de efluentes contendo alta concentração do íon.
O processo de precipitação de sulfato na forma de gipsita, utilizando CaCO3, ocorre em três
etapas. Na primeira, CaCO3 é adicionado para elevar o pH até próximo da neutralidade,
11 etapa, Ca(OH)2 é adicionado para elevar o pH para próximo de 12, de forma a precipitar
algum íon de magnésio, eventualmente presente na forma de hidróxido de magnésio (Mg(OH)2), e aumentar a velocidade de precipitação (cristalização) de gipsita. Na terceira e
última etapa, adiciona-se CO2 (recuperado na 1ª etapa) para baixar o pH, ocorrendo
precipitação de CaCO3, o qual é relativamente puro e pode ser reutilizado na primeira etapa
do processo de tratamento. Essas etapas estão representadas na figura 3.1.
Figura 3.1: Fluxograma do processo de remoção de sulfato via precipitação de gipsita (Adaptado de INAP, 2003).
12 Processo SAVMIN®
O processo SAVMIN® (desenvolvido por Savanah Mining), utiliza reações de precipitação
em sucessivos estágios para remover os íons sulfato dissolvidos em efluentes ácidos de mineração. No primeiro estágio, ocorre a adição de hidróxido de cálcio (Ca(OH)2) para
aumentar o pH para aproximadamente 12, precipitando íons metálicos incluindo o magnésio na forma de hidróxidos, o que é representado na equação (3.8).
Me2+ + Ca(OH)2 (s)→ Me(OH)2(s) + Ca2+ (3.8)
Após a remoção dos hidróxidos precipitados, adicionam-se cristais de gipsita para catalisar a cristalização do precipitado de gesso na solução supersaturada. Na sequência, hidróxido de alumínio é adicionado ao sistema, o qual ainda encontra-se supersaturado, promovendo a precipitação de etringita (3CaO.3CaSO4.Al2O3.31H2O), a qual ocorre entre pH 11,6 e 12,0,
conforme representado na equação (3.9).
6Ca2+ + 3SO42- + 2Al(OH)3 (s) + 37H2O → 3CaO.3CaSO4.Al2O3.31H2O (s) + 6H3O+ (3.9)
Separada da etringita, a solução é tratada com injeção de gás carbônico (CO2) para reduzir o
pH e precipitar carbonato de cálcio (CaCO3). Do lodo contendo etringita, pode-se recuperar
hidróxido de alumínio a partir da adição de ácido sulfúrico. Na figura 3.2, está representado um fluxograma simplificado do processo SAVMIN®, o qual apresenta como principal desvantagem o grande volume de lodo gerado (INAP, 2003).
13 De acordo com o INAP (2003), o processo SAVMIN® foi aplicado no tratamento de um efluente de uma mina de ouro, localizada próximo a Vaal Reef, na África do Sul, da qual 30000m3 do mesmo eram bombeados diariamente e descarregados no rio Koekemoerspruit. A concentração de sulfato, nesse efluente, variava entre 600 e 850mg/L, de cálcio entre 130 e 200mg/L e a de magnésio permanecia praticamente constante, em torno de 80mg/L. Após passar pelo tratamento com processo SAVMIN®, foram alcançados cerca de 90% de remoção de íons sulfato e de 40 e 100% dos íons cálcio e magnésio, respectivamente.
Assim como o processo de tratamento de DAM via a precipitação de gipsita, o processo SAVMIN® apresenta como desvantagem a alta produção de lodo, mesmo sendo parte do mesmo reciclado (INAP, 2003).
Processo CESR®
O Processo “Cost Effective Sulphate Removal” (CESR®), também conhecido como processo
“Walhalla”, assim como o SAVMIN®, também ocorre em sucessivas etapas, removendo o
sulfato do efluente através da precipitação de etringita. A única diferença é que o processo CESR® utiliza um reagente derivado o cimento, no lugar do hidróxido de alumínio.
A primeira etapa do processo consiste na adição de hidróxido de cálcio hidratado à corrente de alimentação para precipitar gipsita. Após a filtração da gipsita, segue-se o segundo estágio, o qual consiste em elevar o pH do meio, para próximo de 10,5, visando, então, à precipitação dos hidróxidos metálicos. Esse lodo gerado é filtrado, adicionando-se ao sistema um reagente derivado de cimento para precipitar etringita (3CaO.3CaSO4.Al2O3.31H2O). Por fim, o pH do
meio é ajustado aos padrões de descarte usando gás carbônico (CO2).
14 concentração de magnésio praticamente zerou, enquanto que a concentração de cálcio no mesmo subiu de aproximadamente 260 para 800mg/L. Desta forma, os autores concluíram que, com relação ao íon sulfato, a mesma é melhor indicada para ser aplicada como uma etapa de pré-tratamento, uma vez que apresenta baixa eficiência para sistema altamente concentrados com o íon.
Assim como o processo de tratamento de DAM que ocorre via a precipitação de gipsita e o processo SAVMIN®, o processo CERS® apresenta como desvantagem a alta geração de lodo. Além disso, o agente precipitante não é regenerado ao final do processo, o que o torna relativamente mais caro (INAP, 2003).
Formação de barita
O processo de precipitação química envolvendo a formação de barita (BaSO4), baseia-se na
adição de sulfeto de bário (BaS), hidróxido de bário (Ba(OH)2) ou carbonato de bário
(BaCO3), visando à neutralização da drenagem ácida de mina seguida da precipitação dos íons
sulfato na forma de barita.
A adição de BaS ou de Ba(OH)2 torna o processo mais efetivo, pois ambos são capazes de
atuar em toda a escala de pH, enquanto o BaCO3 é pouco efetivo em condições de pH neutro
ou alcalino.
As reações de formação de sulfato de bário são apresentadas pelas equações (3.10), (3.11) e (3.12).
BaCO3 (s) + H2SO4→ BaSO4 (s) + H2O + CO2 (g) (3.10)
Ba(OH)2(s) + H2SO4→ BaSO4(s) + 2H2O (3.11)
BaS (s) + H2SO4→ BaSO4(s) + H2S (g) (3.12)
Como sais de bário são caros, o sulfato de bário presente no lodo precisa ser recirculado. Isto pode ser feito através da sua conversão a sulfeto de bário, por meio de redução térmica a 1200°C em contato com carvão mineral, de acordo com a equação (3.13):
15 O sulfeto de bário recuperado na redução térmica é reutilizado na etapa de precipitação de sulfato. Ainda visando à redução dos custos do processo, o ácido sulfídrico (H2S(g)) produzido
na etapa de precipitação de sulfato de bário é coletado e oxidado a enxofre elementar, podendo ser, então, comercializado. O processo de remoção de sulfato via formação de barita é representado no fluxograma da figura 3.3.
Figura 3.3: Fluxograma do processo de remoção de sulfato via precipitação de Barita (Adaptado de INAP, 2003).
O estudo de caso, realizado pelo INAP (2003), da técnica de precipitação de sulfato pela formação de barita foi desenvolvido utilizando uma DAM gerada em uma mina de carvão, cujo teor inicial de sulfato era de, aproximadamente, 2000mg/L. Esse efluente foi tratado com BaS e apresentou no final do processo um teor de sulfato de 190mg/L. Além disso, foi observada a elevação do pH de 2,7 para 7,2 e a redução da concentração de magnésio, inicialmente igual a 125mg/L, para apenas 10mg/L.
16 3.2.2 – Separação por membranas
Segundo os estudos do INAP (2003), outra alternativa para remover íons sulfato de efluentes ácidos de mineração é através do uso de membranas. Neste caso, tem-se:
Osmose reversa
Processo SPARRO®
Eletrodiálise
Osmose reversa
17 Figura 3.4: Corte transversal (a) e corte longitudinal (b) de uma membrana tubular e o esquema de um equipamento tubular de osmose reversa (adaptado de Reynolds e Richards, 1995).
O processo de osmose reversa para tratar efluentes ácidos de mineração, descrito pelo INAP (2003), consiste de quatro etapas básicas: (1) pré-tratamento do efluente, (2) bombeamento a alta pressão, (3) contato com as membranas e (4) pós-tratamento.
18 A técnica de osmose reversa foi aplicada para tratar o efluente de uma mina de carvão localizada próximo a Joanesburgo, na África do sul, caracterizado pela alta concentração de sulfato (2200mg/L) e pH=8,4 (INAP, 2003). Foi observado que o efluente após tratado teve as concentrações dos respectivos íons reduzidas consideravelmente em mais de 95%. Especificamente para o caso do sulfato, sua concentração final caiu para, aproximadamente, 14mg/L.
Embora a técnica de osmose reversa apresente uma alta eficiência na remoção dos diversos íons presentes na DAM, esta técnica tem como desvantagem o fato de necessitar de etapas de pré-tratamento do efluente. Sistemas com concentrações muito altas de sais podem promover a formação de incrustações e o consequente entupimento das membranas, reduzindo, assim, sua eficiência e seu tempo de vida útil. Sem um sistema de pré-tratamento, tornam-se necessárias frequentes etapas de lavagem das mesmas, o que implica também em aumento do respectivo custo operacional, o qual já é normalmente elevado (INAP, 2003).
Processo SPARRO®
“Slurry precipitation and recycle reverse osmosis” - SPARRO® é um processo de osmose
19 Figura 3.5: Fluxograma do processo SPARRO®.
O INAP (2003) realizou um estudo de caso com uma usina piloto do processo SPARRO®, na qual um eluente de uma mineradora de ouro foi tratado. Esse efluente apresentava pH igual a 4,97 e concentração de sulfato maior que 6600mg/L. Completadas as etapas de tratamento, o efluente apresentou-se, então, mais neutro (pH=6,23) e a concentração de sulfato caiu para cerca de 15mg/L. Desse estudo, concluiu-se que o processo é capaz de produzir uma água de boa qualidade, porém o mesmo apresenta desvantagens como: (i) baixo tempo de vida útil das membranas, mesmo aplicando uma etapa de pré-tratamento, e (ii) é relativamente caro.
Eletrodiálise
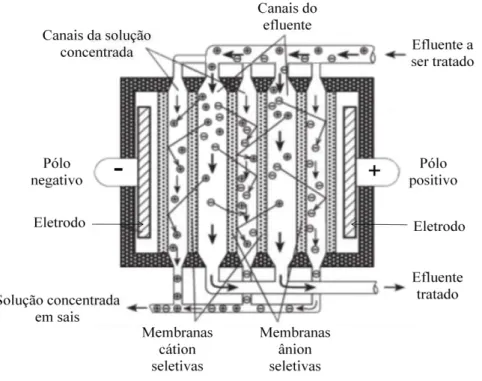
20 outro muito puro. Na figura 3.6, está representado um esquema de funcionamento do processo de eletrodiálise.
.
Figura 3.6: Movimento dos íons dentro de uma célula de eletrodiálise (adaptado de INAP, 2003).
Quando as membranas atingem a saturação, em intervalos de tempos definidos, a polaridade é invertida, fazendo com que os cátions e ânions sejam, então, repelidos dos pólos onde estavam, começando a migrar na direção contrária. A água gerada nesse processo é imediatamente descartada e a qualidade do processo é restabelecida (Reynolds e Richards, 1995; INAP, 2003).
A inversão de polaridade traz para o processo algumas vantagens como a limpeza periódica das células, o que minimiza a deposição nas membranas e a necessidade de um menor número de etapas de pré-tratamento químico, permitindo que soluções mais concentradas sejam dessalinizadas. Uma grande desvantagem, porém, é que esse processo é relativamente caro (INAP, 2003).
21 74mg/L e pH igual a 6,42 e saía com apenas 5mg/L de sulfato e pH igual a 6,14. Desses resultados, concluiu-se que, assim como a técnica de osmose reversa e o processo SPARRO®, a eletrodiálise é capaz de produzir uma água de excelente qualidade, mas que necessita de etapas de pré-tratamento para que os teores de sais dissolvidos sejam reduzidos. Isso se faz necessário para que as membranas sejam preservadas, aumentando, assim, sua vida útil. Outra desvantagem dessa técnica é o fato de ser relativamente cara.
3.2.3 – Troca iônica
Segundo os estudos do INAP (2003), a tecnologia de troca iônica, através de um processo conhecido como GYP-CIX® (gypsum - cation exchange resin), também pode ser utilizada
para remover íons sulfato de efluentes ácidos de mineração.
Processo GYP-CIX®
De acordo com INAP (2003), o processo GYP-CIX® é uma tecnologia de troca iônica particularmente indicada para a remoção de sulfato dissolvido em águas que se encontram próximas à saturação com gipsita.
Esse processo consiste em bombear o efluente, fazendo-o passar por múltiplos estágios de contato fluidizado em colunas contendo resinas catiônicas e aniônicas. Inicialmente, a corrente de alimentação é forçada a passar pela coluna de troca catiônica, contendo resinas fortemente ácidas (R–H), onde cátions como o Ca2+ são removidos. A reação de troca catiônica envolvida no processo é apresentada na equação (3.14).
2R–H + Ca2+→ R2–Ca + 2H+ (3.14)
22 2R–OH + SO42-→ R2–SO4 + 2OH- (3.15)
A água tratada possui pH neutro e baixos teores de cálcio, sulfato e outras substâncias dissolvidas, incluindo metais. O número de estágios, necessários à purificação da água, depende da qualidade da alimentação e da qualidade requerida da água a ser tratada. Convencionalmente, as resinas de troca iônica quando saturadas são regeneradas com hidróxido de sódio (NaOH) (resinas aniônicas) e com ácido clorídrico (HCl) (resinas catiônicas). Porém, no processo GYP-CIX® é utilizado hidróxido de cálcio (Ca(OH)2) e ácido
sulfúrico (H2SO4), produzindo gipsita como resíduo sólido. A regeneração das resinas
catiônicas e aniônicas é representada nas equações (3.16) e (3.17), respectivamente.
R2–Ca + H2SO4→ 2R–H + Ca2+ + SO42- (3.16)
R2–SO4 + Ca(OH)2→ 2R–OH + SO42- + Ca2+ (3.17)
Na figura 3.7, encontra-se um fluxograma simplificado do processo GYP-CIX®.
23 De acordo com o INAP (2003), a técnica GYP-CIX®, apresenta a vantagem de ser muito eficiente, porém, o fato de a eluição dos leitos serem realizados de forma a promover a precipitação de gipsita, representa uma desvantagem, uma vez que gera muito lodo.
A seguir são descrito alguns estudos que foram desenvolvidos envolvendo o processo GYP-CIX®. Sobre esta técnica sua revisão bibliográfica encontra-se mais elaborada, uma vez que a mesma está mais relacionada ao presente trabalho.
Dry (1998) (Feng et al., 2000 apud Dry, 1998); Gussmann e Merve (1997) investigaram a
eluição de íons cálcio e magnésio de resinas de troca catiônica com ácido sulfúrico e a eluição de sulfato de resinas de troca aniônica com hidróxido de cálcio. A solução de ácido sulfúrico, ao passar pela resina de troca catiônica, retira desta o cálcio, precipitando-o na forma de sulfato de cálcio, enquanto a solução de hidróxido de cálcio ao passar pela resina de troca aniônica retira dela o sulfato precipitando-o, também, na forma de sulfato de cálcio. Em efluentes com altas concentrações de magnésio, pôde-se observar a precipitação de hidróxido de magnésio.
O processo GYP-CIX® foi comparado por Schoeman e Steyn (2001) com a eficácia e custo dos processos de osmose reversa e eletrodiálise. Foi observado que, dos três, o processo GYP-CIX® foi o que apresentou maior eficiência de remoção e custo relativo mais baixo. Akcil e Koldas (2006) também citam o processo GYP-CIX® como um dos mais satisfatórios para tratar efluentes ácidos de mineração. Em seu trabalho, porém, é sugerido que em vez de usar hidróxido de cálcio e ácido sulfúrico para regenerar as resinas, que seja usado ácido nítrico ou fosfórico para eluir as resinas catiônicas e amônia ou carbonato de potássio para eluir as resinas aniônicas. Apesar de esses reagentes apresentarem custo relativo mais alto e de existir a possibilidade do ácido nítrico degradar a resina (Wheaton e Lefevre, 2000), tal substituição se justificaria com a possibilidade de se reutilizar o efluente das colunas na fabricação de fertilizantes.
Feng et al. (2000) estudaram um processo semelhante ao GYP-CIX®, porém em vez do
24 que todo ferro e manganês presentes no mesmo se encontrassem com os respectivos números de oxidação iguais respectivamente a 3+ e 4+. Em seguida, adicionaram ao sistema óxido de cálcio (CaO), para elevar o pH a 5,0, visando a evitar o desenvolvimento de ácido sulfídrico (H2S) na etapa seguinte, onde foi adicionado sulfeto de sódio (Na2S). Após a adição de Na2S,
o pH do meio foi ajustado com CaO para 8,0, ocorrendo, então a precipitação de sulfetos metálicos e hidróxidos. O lodo gerado foi removido por separação magnética, devido à adição, à corrente de alimentação, de sementes de magnetita (Fe3O4), e a solução pré-tratada
foi encaminhada para a etapa de tratamento via troca iônica. Assim como no processo GYP-CIX®, na etapa de regeneração da resina carregada, ocorreu a precipitação de gipsita.
3.2.4 - Redução biológica de sulfato
Tratamentos biológicos podem também ser utilizados para tratar efluentes com altos teores de sulfato, pois determinados micro-organismos facilitam a transferência de elétrons de alguns materiais ricos em elétrons (matéria orgânica, H2, CO, etc.) para espécies deficientes em
elétrons (oxigênio ou sulfato) para gerar energia para suas atividades metabólicas. Em tais processos, bactérias redutoras de sulfato (BRS) promovem a redução de sulfato a sulfeto, o qual se precipita na forma de sulfetos metálicos (INAP, 2003).
Segundo o INAP (2003), a utilização de micro-organismos para tratar efluentes ricos em sulfato é um procedimento viável, pois, visando à geração de energia para sua atividade metabólica, estes micro-organismos facilitam a transferência de elétrons de substâncias ricas em elétrons (matéria orgânica, H2, CO, etc.), suas fontes de energia, para espécies
eletrodeficientes (oxidantes como o oxigênio ou o sulfato).
Os processos biológicos, citados pelo INAP (2003), para tratar efluentes ricos em sulfato são:
Biorreatores
Wetlands
Sistemas produtores de alcalinidade
25 Biorreatores
Biorreatores consistem de pilhas anaeróbicas, que são estruturas recheadas com compostos orgânicos pelas quais o efluente deve passar, onde as bactérias presentes irão promover a redução do sulfato a ácido sulfídrico. Esta tecnologia, embora muito eficiente, apresenta algumas limitações tais como a utilização do substrato em presença de outras bactérias anaeróbicas e a toxicidade associada ao H2S e aos metais dissolvidos (INAP, 2003).
Conforme cita o INAP (2003), uma mina de carvão localizada próximo a Witbank, na África do Sul, utilizou biorreatores para promover a redução biológica de sulfato, porém, foi adotada uma etapa de pré-tratamento, na qual se adiciona CaCO3. Nesse caso, o efluente apresentava
inicialmente 8342mg(SO42-)/L e pH=1,8 e, após passar pela etapa de pré-tratamento, sua
concentração de sulfato caiu para aproximadamente 2000mg/L e o pH subiu para cerca de 7. Depois de ser tratado pelos biorreatores, o pH do efluente final praticamente não variou, mas a concentração de sulfato caiu para, aproximadamente, 200mg/L.
Wetlands
Os banhados naturais ou construídos, também conhecidos como wetlands, consistem num
ecossistema complexo, representados pela interação entre sistemas terrestres e aquáticos, que podem ser utilizados para a remoção de íons sulfato através da redução biológica. Em relação aos biorreatores, os wetlands apresentam menores custos operacionais e requerem menos
manutenção. No entanto, além das limitações relacionadas à concentração de metais, acidez, necessidade de fonte de carbono e produção de ácido sulfídrico (H2S), o método requer área
disponível e elevado tempo de residência, causando alguns impactos ambientais a sua volta, como, por exemplo, mudança na umidade atmosférica local e nas propriedades do solo ao longo do perímetro da área alagada (densidade, porosidade, composição química e acúmulo de matéria orgânica). Ainda, nos wetlands a presença de outros aceptores de elétrons,
26 O INAP (2003) realizou um estudo de caso em uma usina piloto, localizada no Colorado, nos Estados Unidos, e concluiu que os wetlands analisados eram muito eficientes na remoção dos
metais presentes na DAM, porém não tanto com relação aos íons sulfato.
Barreiras produtoras de alcalinidade
De acordo com INAP (2003), drenos anóxicos de calcário e sistemas de fluxo vertical, também chamados de sistemas de produção sucessiva de alcalinidade, são principalmente usados para elevar o pH e adicionar alcalinidade à drenagem ácida de mina.
Drenos anóxicos de calcário são células aterradas ou trincheiras de calcário cobertos com uma camada de argila para evitar a exposição atmosférica, criando um ambiente de alta concentração de gás carbônico e pouco oxigênio. Isso aumenta a dissolução de calcário e previne a precipitação de hidróxido de ferro, o que poderia inibir a dissolução de calcário ou entupir o dreno. O efluente dos drenos anóxicos de calcário é frequentemente descarregado em um tanque onde seu pH é aumentado, promovendo a precipitação de metais (INAP, 2003). Uma combinação de drenos anóxicos de calcário e wetlands anaeróbicos foi desenvolvida
sendo denominada sistema de fluxo vertical, que consiste de uma camada de água (1 – 3m) coberta por uma camada de compostos orgânicos (0,2 – 0,3m), que é coberta por uma camada de calcário (0,5 – 1m). Os canais de drenagem abaixo da camada de calcário transportam a água a um tanque onde o pH é aumentado e metais são precipitados. A água se move para a camada inferior, de compostos orgânicos, o que abaixa gradualmente seu teor de oxigênio, resultando na redução do ferro (III) e do sulfato (INAP, 2003).
Os processos de dreno anóxico de calcário e o de fluxo vertical juntamente com wetlands
27 Barreiras reativas permeáveis
De acordo com o INAP (2003) outra forma de tratamento biológico é a criação de barreiras reativas permeáveis, as quais consistem de uma zona reativa, composta de materiais capazes de reagir com os contaminantes do efluente, imobilizando-os ou degradando-os. Esses materiais reativos podem ser ferro elementar, calcário ou materiais orgânicos. As barreiras são dispostas perpendicularmente à trajetória de passagem da água e são projetadas e construídas de forma a permitir que a água contaminada passe através delas com tempo suficiente para que ocorra o contato dos contaminantes com os materiais reativos da barreira.
Barreiras reativas permeáveis foram empregadas para tratar o efluente de uma mina de níquel, próxima a Sudbury, no Canadá, o qual continha cerca de 840mg(SO42-)/L. Nesse caso, foi
observado que após decorridos 38 meses da construção da barreira, a velocidade de redução de sulfato caiu de 15,3 para 10,5mg/L.dia. Desses estudos, chegou-se à conclusão que a maior vantagem dessa técnica é sua facilidade de operação e de manutenção, porém faz-se necessários, ainda, estudos que permitam prever com mais precisão o tempo máximo de operação de uma barreira reativa permeável, de forma que possa ser estimado se ou quando a mesma precisa ser reposta. Outra importante observação é que o sucesso dessas barreiras na remoção de sulfato requer um planejamento para que os metais dissolvidos reajam com o sulfeto presente de forma a evitar sua reoxidação nas etapas posteriores (INAP, 2003).