Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761
Correlação e predição de dados experimentais das misturas binárias:
n-octano + etanol e 1-butanol + 1-hexanol
Correlation and prediction of experimental data of binary mixtures:
n-octane + ethanol and 1-butanol + 1-hexano
DOI:10.34117/bjdv5n10-322
Recebimento dos originais: 10/09/2019 Aceitação para publicação: 25/10/2019
Ronaldo dos Santos Falcão Filho
Doutorando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: ronaldo.falcao@ifrn.edu.br
José Cosme Cunha Gomes
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: cosme1412@gmail.com
Marcelo da Silva Pedro
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: marcelopedrocz@hotmail.com
Elton da Nóbrega Silva
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: eltonobrega@hotmail.com
Jonas Medeiros de Paiva
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: jonasmedeiroseq@gmail.com
RESUMO
No presente trabalho, foram coletados os dados de equilíbrio líquido-vapor para dois sistemas diferentes (n-octano + etanol e 1-butanol + 1-hexanol). Além disso, testes de consistência foram utilizados para validar os dados experimentais. Esses dados experimentais foram usados para encontrar os parâmetros de interação do UNIQUAC. A equação de estado de
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Robinson foi usada para comparar os dados experimentais e os resultados do modelo UNIQUAC.
Palavras-chave: ELV, mistura binária, UNIQUAC. ABSTRACT
In the present work the vapor-liquid equilibrium data for two different systems (n-octane + ethanol and 1-butanol + 1-hexanol) were collected. Furthermore, consistency tests were used in order to validate the experimental data. This experimental data was used to find the UNIQUAC’s interaction parameters. Peng-Robinson’s equation of state was used in order to compare the experimental data and the UNIQUAC’s model results.
Key-words: VLE, binary mixture, UNIQUAC.
1 INTRODUÇÃO
O n-octano é um hidrocarboneto alifático de cadeia aberta não ramificada, presente no petróleo presente na faixa de destilação dos leves e médios (nafta, querosene e diesel). Pode ser obtido também através do craqueamento térmico de cadeias pesadas, e em menor quantidade no craqueamento catalítico já que este último favorece a formação de compostos alicíclicos e aromáticos [1]. O etanol é um álcool produzido em larga escala no Brasil a partir do processamento da cana-de-açúcar, sendo, dentre outras finalidades, utilizado como combustível automotivo, sendo assim uma alternativa à gasolina em motores ciclo Otto; ele também é utilizado na composição da gasolina tipo C, que é a gasolina tipo A (produzida em refinarias de petróleo) acrescida de 25-27,5% de etanol pelo distribuidor [2]. O etanol, além de ser um combustível de origem não-fóssil, possui maior detergência garantindo assim menor formação de depósitos no motor e sistema de injeção de combustível, além possuir maior resistência à detonação (número de octano) do que a gasolina, contudo sua competitividade ainda é bastante limitada pela alta razão entre o preço final ao consumidor e a energia unitária disponibilizada na queima do combustível (conhecida na comunidade técnica como poder calorífico inferior – PCI).
O 1-butanol e o 1-hexanol são alcoóis alifáticos com amplo interesse na indústria de energia porque podem ser obtidos a partir de síntese bioquímica e tem um grau de toxicidade bem menor que o do metanol, por exemplo [3]. Além disso esses alcoóis são menos voláteis que o metanol o que diminui o risco em termos de manipulação dos fluidos. Os dados de equilíbrio desse sistema são essenciais para o estudo do processo de destilação e obtenção das substâncias com o grau de pureza exigido pela indústria.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 No presente trabalho, os dados do equilíbrio do sistema 1-butanol/1-hexanol foram obtidos a partir de uma isoterma a 343,15K com pressões variando da ordem de 3 a 13 kPa. Enquanto é que os dados para o sistema n-octano/etanol foram obtidos a partir de uma isobárica a 101,3 kPa com temperaturas variando da ordem de 350 a 360 K. Com o objetivo de avaliar os dados experimentais de diferentes sistemas para o Equilíbrio Líquido-Vapor (ELV) foram coletados dados experimentais na literatura e a partir destes foram desenvolvidos a correlação e análise de consistência desses dados.
2 MATERIAIS E MÉTODOS
Os dados experimentais de equilíbrio líquido-vapor do sistema butanol (1) com o 1-hexanol (2) a 343,15K são apresentados na Tabela 01.
Tabela 01- Dados experimentais para a Isoterma do sistema 1-butanol (1) e 1-hexanol (2)[4].
Dimetil éter e metanol a T = 343,15K
P (kPa) x1 y1 3,0 0,0495 0,1614 3,3 0,1000 0,2848 3,8 0,1503 0,4161 4,2 0,1995 0,5143 4,8 0,2526 0,6047 5,3 0,2998 0,6699 5,9 0,3474 0,7279 6,5 0,3987 0,7774 7,0 0,4480 0,8112 7,7 0,4998 0,8508 8,3 0,5497 0,8736 8,9 0,6008 0,8969 9,6 0,6500 0,9193 10,1 0,7007 0,9348 10,8 0,7515 0,9508 11,4 0,8002 0,9627 12,0 0,8498 0,9732 12,5 0,8994 0,9821 13,0 0,9459 0,9916
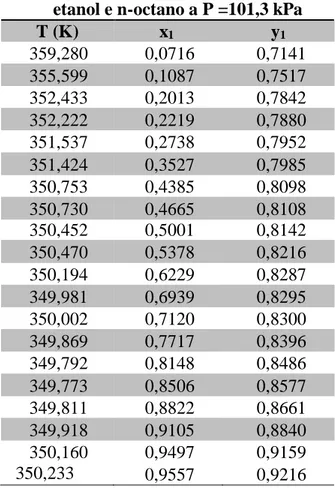
Os dados experimentais do sistema em equilíbrio líquido-vapor etanol (1) e n-octano (2) a pressão constante de 101,3 kPa são apresentados na Tabela 02.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Tabela 02- Dados experimentais para a Isobárica do sistema etanol (1) e n-octano (2) [5].
etanol e n-octano a P =101,3 kPa
T (K) x1 y1 359,280 0,0716 0,7141 355,599 0,1087 0,7517 352,433 0,2013 0,7842 352,222 0,2219 0,7880 351,537 0,2738 0,7952 351,424 0,3527 0,7985 350,753 0,4385 0,8098 350,730 0,4665 0,8108 350,452 0,5001 0,8142 350,470 0,5378 0,8216 350,194 0,6229 0,8287 349,981 0,6939 0,8295 350,002 0,7120 0,8300 349,869 0,7717 0,8396 349,792 0,8148 0,8486 349,773 0,8506 0,8577 349,811 0,8822 0,8661 349,918 0,9105 0,8840 350,160 350,233 0,9497 0,9557 0,9159 0,9216
Para o tratamento dos dados experimentais foi necessário o levantamento das propriedades dos componentes puros nas condições críticas. As propriedades de cada componente obtidas no DIPPR são observadas na Tabela 03.
Tabela 03 – Propriedades termodinâmicas para cada substância pura.
Tc Pc Vc
1-butanol 563,05 4423 0,275
1-hexanol 611,35 4050 0,381
Etanol 513,9 6140 0,167
n-Octano 568,8 2490 0,492
Para o cálculo da pressão de vapor de cada componente puro foi utilizada a Equação de Antoine, conforme a Equação 01.
𝑙𝑜𝑔𝑃𝑠𝑎𝑡(𝑘𝑃𝑎) = 𝐴 − 𝐵
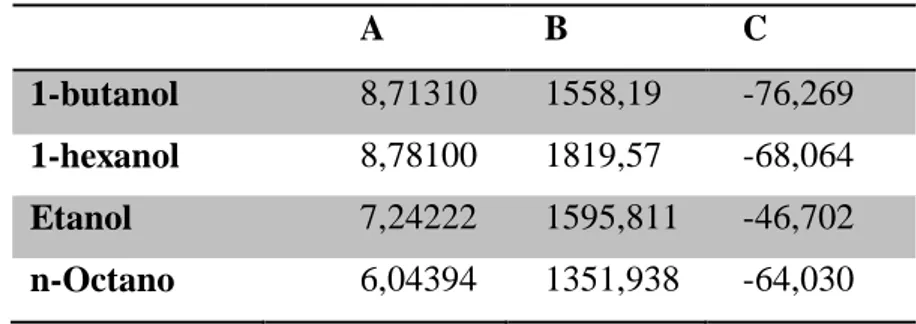
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Tabela 04 apresenta os valores das constantes de Antoine para cada componente puro.
Tabela 04 – Constantes de Antoine.
A B C
1-butanol 8,71310 1558,19 -76,269
1-hexanol 8,78100 1819,57 -68,064
Etanol 7,24222 1595,811 -46,702
n-Octano 6,04394 1351,938 -64,030
Objetivando a correlação dos dados experimentais foi realizado o teste de desvio UNIQUAC com o auxílio do programa Specs, no qual a partir dos dados experimentais de equilíbrio líquido-vapor e das propriedades dos componentes puros, utilizando a equação do tipo virial para a fase vapor e o modelo Rackett para a fase líquida foi possível obter valores calculados para fração molar da fase vapor e da pressão ou temperatura do sistema estudado, assim foi obtido um desvio entre os dados experimentais e os dados consistentes UNIQUAC, o que possibilitou a validação dos dados estudados.
Ainda para a correlação dos dados foram utilizados os parâmetros de UNIQUAC, obtidos na literatura, para cada componente puro, conforme a Tabela 05.
Tabela 05 – Parâmetros UNIQUAC.
R Q
1-butanol 3,4542 3,0480
1-hexanol 4,8029 4,1320
Etanol 2,1055 1,9720
n-Octano 5,8484 4,9360
Além do método de consistência dos desvios UNIQUAC, para a predição dos dados do equilíbrio líquido-vapor dos sistemas binários, também foi empregado modelo UNIFAC, que consiste em um modelo de contribuição de grupos, que considera que cada molécula de uma mistura é constituída por diferentes grupos funcionais. Essa predição foi realizada com o auxílio do software Specs.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Para a determinação da consistência dos dados experimentais foi aplicado o teste de consistência das áreas, o qual assume a fase vapor como ideal, possibilitando calcular valores do coeficiente de atividade a partir da equação de Raoult, de acordo com as Equaçãoes 02 e 03. 𝛾1 = 𝑦1𝑃 𝑥1𝑃1𝑠𝑎𝑡 (02) 𝛾2 = (1−𝑦1)𝑃 (1−𝑥1)𝑃2𝑠𝑎𝑡 (03)
Com os valores do coeficiente de atividade determinados foi calculado, através da Equação 04, os valores da área resultante do gráfico do logaritmo natural da razão entre os coeficientes de atividade do composto (1) e do composto (2) versos fração molar da fase líquida.
∫ 𝑙𝑛𝛾𝛾1
2𝑑𝑥1 1
0 = 0 (04)
Posteriormente, foi calculada razão entre as áreas acima da curva e abaixo considerando que 𝑙𝑛𝛾1
𝛾2 deveria ser igual a zero, obtendo-se um valor avaliado de acordo com
a Tabela 06.
Tabela 06 – Critério de qualidade dos dados de ELV baseado no teste de consistência dos desvios e da área.
Classe A/B Definição
A 0,95-1,00 Dados precisos, adequados para qualquer uso B 0,90-0,95 Bons dados, aplicáveis para projeto e correlação
C 0,80-0,90 Aplicáveis para trabalhos onde alta precisão não é requerida
D 0,70-0,80 Podem ser aplicados mas com bastante precaução
E <0,70 Inaceitáveis, sugere-se estimar o ELV por outro caminho
Os dados experimentais de todos os sistemas também foram preditos com os dados estimados a partir da equação de Peng-Robinson com o auxílio do software do Sandler, a fim de avaliar a consistência do modelo para os requeridos sistemas.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 3 RESULTADOS E DISCUSSÕES
3.1 ISOBÁRICA ELV PARA O SISTEMA BINÁRIO ETANOL (1) E N-OCTANO (2) A P = 101,3 KPA
A consistência dos dados experimentais obtidos a partir do equilíbrio líquido-vapor do sistema etanol (1) + n-octano (2) foi avaliada a partir do teste de desvio UNIQUAC. O resultado dessa análise é observado na Figura 01.
Figura 01- Diagrama para o ELV para o sistema Binário etanol (1) e n- octano (2).
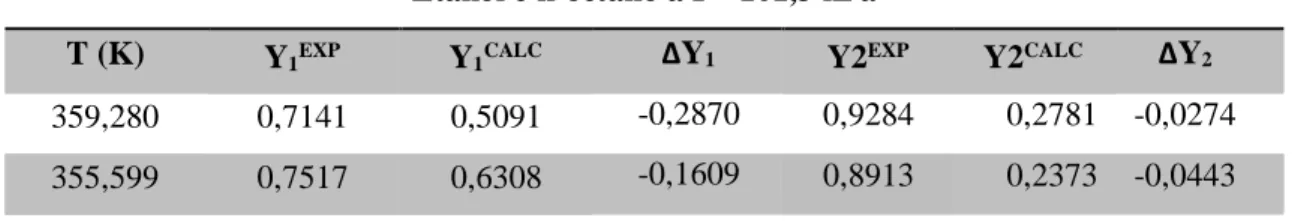
Analisando a Figura 01 observa-se que os dados experimentais referentes tanto ao ponto de orvalho quanto ao de bolha ajustaram-se ao envelope binário resultante dos dados consistentes de Modelo UNIQUAC, apresentando um desvio médio para a fração molar da fase vapor igual a 0,0337, os dados dos desvios para cada ponto do sistema podem ser observado na Tabela 07. Assim, pode-se afirmar que os dados experimentais estudados são consistentes para esse modelo.
Tabela 07 - Desvios da fração molar de vapor para a mistura etanol (1) + n-octano (2), pela correlação UNIQUAC.
Etanol e n-octano a P =101,3 kPa
T (K) Y1EXP Y1CALC ∆Y1 Y2EXP Y2CALC ∆Y2
359,280 0,7141 0,5091 -0,2870 0,9284 0,2781 -0,0274 355,599 0,7517 0,6308 -0,1609 0,8913 0,2373 -0,0443
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 352,433 0,7842 0,7794 -0,0061 0,7987 0,2015 -0,0663 352,222 0,7880 0,7974 0,0119 0,7781 0,1984 -0,0641 351,537 0,7952 0,8172 0,0276 0,7262 0,1908 -0,0683 351,424 0,7985 0,8366 0,0477 0,6473 0,1878 -0,0682 350,753 0,8098 0,8186 0,0109 0,5615 0,1833 -0,0363 350,730 0,8108 0,8175 0,0083 0,5335 0,1832 -0,0315 350,452 0,8142 0,8072 -0,0086 0,4999 0,1819 -0,0208 350,470 0,8216 0,8063 -0,0186 0,4622 0,1823 0,0217 350,194 0,8287 0,7975 -0,0377 0,3771 0,1806 0,0545 349,981 0,8295 0,7967 -0,0395 0,3061 0,1768 0,0369 350,002 0,8300 0,8002 -0,0359 0,2880 0,1755 0,0321 349,869 0,8396 0,8090 -0,0364 0,2283 0,1665 0,0379 349,792 0,8486 0,8204 -0,0332 0,1852 0,1555 0,0271 349,773 0,8577 0,8349 -0,0266 0,1494 0,1418 -0,0033 349,811 0,8661 0,8520 -0,0163 0,1178 0,1256 -0,0621 349,918 0,8840 0,8724 -0,0132 0,0895 0,1064 -0,0827 350,160 0,9159 0,9082 -0,0084 0,0503 0,0702 -0,1657 350,233 0,9216 0,9155 -0,0066 0,0443 0,0634 -0,1908
A Tabela 08 apresenta os parâmetros para a equação de UNIQUAC obtidos a partir da simulação no Regress.
Tabela 08 – Parâmetros UNIQUAC para o sistema Etanol (1) e n-octano (2).
A12 A21
804,2 -5,152
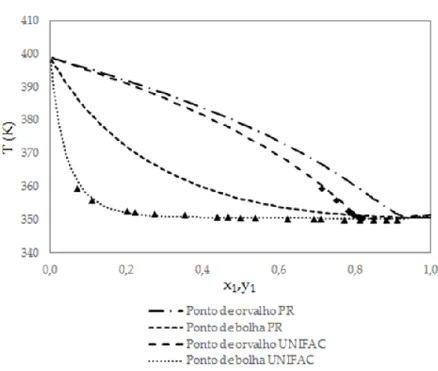
Além da correlação realizada com os valores consistentes UNIQUAC, os dados experimentais também foram correlacionados a partir do modelo termodinâmico UNIFAC e preditos a partir da simulação com base na Equação de Peng-Robinson para a pressão de vapor. O gráfico comparativo dessas análises é observado na Figura 02.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761
Figura 02 - Diagrama ELV dos dados experimentais, UNIFAC e Peng-Robinson para o sistema isobárico.
Avaliando o comportamento apresentado pelo sistema em relação a predição UNIFAC, observa-se que os valores dos dados experimentais se ajustam a curva de equilíbrio obtida para o modelo UNIFAC, donde se conclui que o mesmo pode ser utilizado para a modelagem desse tipo de sistema. A consistência desses dados em relação a o modelo UNIFAC é reforçada com a análise da Figura 3. Todavia, ao comparar o envelope experimental com o envelope obtido a partir da Equação de Peng-Robison observa-se uma diferença dos dados principalmente para a fração molar do ponto de orvalho, observa-se ainda que neste modelo a curva de ponto de bolha é linear com o aumento da composição do componente 1, indicando uma idealidade para essa solução, todavia os dados experiemntais e correlacionados por UNIQUAC apresentam desvio da idealidade. Assim, conclui-se que a equação de estado de Peng-Robinson não é adequada para modelagem do sistema, o que já era esperado uma vez o sistema trata de substâncias polares e com forte interação entre as moléculas e que a equação de Peng-Robinson não apresenta bons resultados para esse tipo de sistema.
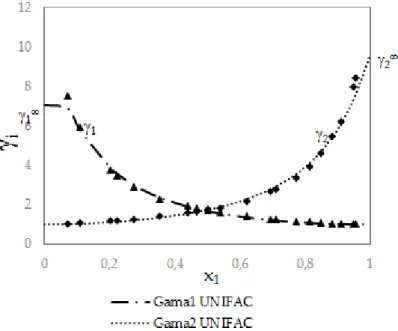
A Figura 03 apresenta o gráfico do coeficiente de atividade infinito, na diluição máxima, para o sistema Etanol (1) e n-octano (2) a P = 101,3 kPa.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761
Figura 03 - Coeficientes de atividade para o sistema isobárico.
Analisando os dados obtidos na Figura 03 constatou-se que o erro relativo entre os valores do coeficiente de atividade experimental e o obtido a partir do Modelo UNIFAC foi de 0,82% para o γ1 e de 0,44% para o.γ2.
A Figura 04 apresenta o comportamento da energia livre de de Gibbs em excesso para o presente sistema.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761
Figura 04 – Compotamento da Energia Livre de Gibbs em excesso para o sistema etanol (1) n- octano (2),
utilizando-se dos dados obtidos com o modelo UNIFAC.
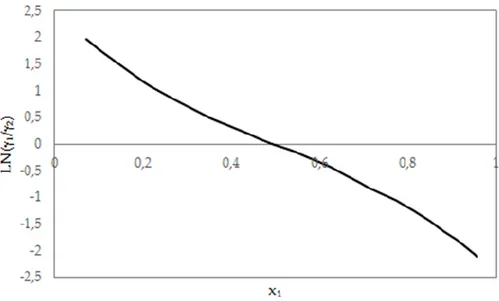
A análise da consistência dos dados a partir do Teste de Consistência da Área resultou em um valor igual a 0,85289 entre razão das áreas do gráfico apresentado na Figura 05. Assim de acordo com a Tabela 06 pode-se afirmar que dados experimentais obtidos são aplicáveis a trabalhos onde não é demandada precisão muito elevada.
Figura 05 - Teste de Consistência da Área para o sistema isobárico.
3.2. ISOTERMA ELV PARA O SISTEMA BINÁRIO 1-BUTANOL (1) 1-HEXANOL (2)
Assim como a isoterma apresentada para o sistema anterior, a isobárica para o sistema binário do Equilíbrio Líquido-Vapor para a mistura 1-propanol + 1-butanol a consistência dos dados experimentais foram testados de acordo o teste de área e preditos pela equação de Peng- Robinson, além disso, também foram correlacionados a partir to teste de consistência UNIQUAC.
A Figura 06 apresenta a representação gráfica para os dados experimentais e os preditos a partir do modelo UNIQUAC.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Figura 06 - Diagrama para o ELV para o sitema binário 1-butanol (1) e 1- hexanol (2).
Mediante a análise do gráfico de equilíbrio apresentado na Figura 06, observa-se que os dados experimentais se aproximaram dos dados obtidos a partir da predição UNIQUAC.
A Tabela 09 apresenta os parâmetros UNIQUAC estimados para o sistema 1-butanol (1) 1-hexanol (2).
Tabela 09 – Parâmetros UNIQUAC para o sistema 1-butanol (1) e 1-hexanol (2).
A12 A21
-216,30
216,4 9
A Figura 07 apresenta o comportamento do logaritmo da razão dos coeficientes de atividade com a composição do componente 1, bem como as áreas estudadas para a realização do teste de consistência.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Figura 07 - Teste de Consistência da Área para o sistema isotérmico.
Foi observado que a razão entre as áreas apresentadas na Figura 8 foi de 0,6527, assim de acordo com a Tabela 06 os dados experimentais obtidos não podem ser aplicados. Portanto, analisando o resultado da consistência para ambos os testes mencionados podemos afirmar que os presentes dados não satisfazem uma correlação adequada para o uso presente sistema, apresentando-se inconsistentes quando considerado a fase vapor e líquida como real. A polaridade das moléculas de 1-butanol e 1-hexanol, e as interações decorrentes dessa propriedade, justificam a baixa aderência de um modelo que tem a idealidade como premissa. A Figura 08 apresenta representação gráfica para o coneficiente de atividade para a diluição infinita em relação ao 1-butanol na fase líquida.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 Assim como os dados experimentais do sistema isobárico a isoterma foi predita e comparada aos dados experimentais a partir da equação de Peng-Robinson. A Figura 09 mostra a comparação gráfica desses dados.
Figura 09 - Diagrama ELV dos dados experimentais, Peng-Robinson e UNIFAC para o sistema isotérmico.
De acordo com a Figura 09, nota-se que os dados experimetais não se ajustam bem aos dados preditos a partir da equação de Peng-Robinson, isso se deve à baixa aderência deste modelo para álcoois, por serem polares. As Figuras 06 e 09 denotam, respectivamente, uma melhor aderência dos modelos UNIQUAC e UNIFAC, que se utilizam de parâmetros de interação, o primeiro par a par de moléculas, e o último segundo a contribuição de grupos estruturais, corrigindo o desvio de idealidade através do coeficiente de atividade.
4 CONCLUSÕES
O modelo de equação de estado de Peng-Robinson apresentou uma aderência limitada na avaliação dos conjuntos de dados objeto deste artigo, notadamente nos pares de substâncias aqui apresentados por manterem interações do tipo ligação de hidrogênio. Os modelos de coeficiente de atividade UNIQUAC e UNIFAC corrigem com propriedade este desvio, tendo este último a melhor aderência.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21819-21833 oct. 2019 ISSN 2525-8761 REFERÊNCIAS
[1] PAGANI, Adriana Siviero. Estudo cinetico do craqueamento catalitico de moleculas modelo de hidrocarbonetos em catalisadores de FCC. 2009. 170 p. Tese (doutorado) - Universidade Estadual de Campinas, Faculdade de Engenharia Quimica, Campinas, SP.
[2] SPERLING, D.; GORDON, D. Two billion cars: driving toward sustainability. Oxford University Press, 2010.
[3] SANTASALO-AARNIO, A., PELJO, P., ASPBERG, E., KONTTURI, K., KALLIO; Electrochemical society methanol, ethanol and iso-propanol performance in alkaline direct alcohol fuel cell (ADAFC); v. 33; p. 1701-1714; 2010.
[4] LEE, H.; PARK, S. Isothermal vapor-liquid equilibria, excess molar volume and the deviation of refractive indices for binary mixtures of 1-butanol, 1-hexanol, 3-methyl- 1-butanol and butyl acetate. Fluid Phase Equilibria 436 (2017) 47–54. Elsevier Science Publishers B.V., Amsterdam.
[5] HIAKI, T.; TAKAHASHI, K.; TSUJI, T.; HONGO, M.; KOJIMA, K. Vapor-liquid equilibria of ethanol with 2,2,4-trimethylpentane or octane at 101.3 kPa. Journal Chemical Engineering Data, 39 (1994) 720-722. American Chemical Society, Washington DC.
![Tabela 01- Dados experimentais para a Isoterma do sistema 1-butanol (1) e 1-hexanol (2)[4]](https://thumb-eu.123doks.com/thumbv2/123dok_br/18012924.858581/3.892.289.610.517.961/tabela-dados-experimentais-para-isoterma-sistema-butanol-hexanol.webp)