CENTRO DE CIÊNCIA E TECNOLOGIA – CCT DEPARTAMENTO DE ENGENHARIA MECÂNICA – DEM
PROGRAMA DE PÓS GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM
GUILHERME FORBECK
OBTENÇÃO DE PÓS DE DIÓXIDO DE TITÂNIO PARA CÉLULAS SOLARES SENSIBILIZADAS POR CORANTE VIA ROTA SOL GEL.
OBTENÇÃO DE PÓS DE DIÓXIDO DE TITÂNIO PARA CÉLULAS SOLARES SENSIBILIZADAS POR CORANTE VIA ROTA SOL GEL.
Dissertação apresentada para a obtenção do título
de mestre em Ciência e Engenharia de Materiais
do Centro de Ciências Tecnológicas da
Universidade do Estado de Santa Catarina,.
Orientador: Prof.ª Marilena V. Folgueras, Drª.
Coorientador: Prof. Adilson L. Chinelatto, Dr.
F692o
Forbeck, Guilherme
Obtenção de Pós de Dióxido de Titânio para Células Sola-res Sensibilizadas por Corante via Rota Sol Gel / Guilherme Forbeck;
orientadora: Marilena Valadares Folgueras;
coorientador: Adilson Luiz Chinelatto – Joinville, 2012.
97 f. : il ; 30 cm.
Incluem referências.
Dissertação (mestrado) – Universidade do Estado Santa Catarina, Centro de Ciências Tecnológicas, Mestrado em Ci-ência e Engenharia de Materiais, Joinville, 2012.
1. Materiais Cerâmicos. 2. Energia solar. 3. Materiais nano-estruturados. 4. Células solares sensibilizadas por corante. I. Folgueras, Marilena Valadares.
Agradeço, acima de tudo, à Consciência Suprema, em todas as suas formas e manifestações, por todas as oportunidades que tive até hoje.
À Clau, minha companheira, mãe dedicada, que me apoiou nos momentos difíceis com carinho e tranquilidade. Aos nossos filhos Cainã e Ian, pequenos professores que nos trazem ensinamentos diariamente. À minha mãe, pela relação madura e apoio incondicional em toda a minha caminhada. Ao meu pai, já em planos mais sutis, pelos ensinamentos que até hoje me traz. Aos meus irmãos Leandro e Letícia pela parceria e bons momentos vividos até hoje. Às minhas cunhadas Raquel e Maysa por seus valores e pela parceria e aos meus sogros Ana Maria e Rogério pelo carinho e consideração.
À Prof.ª Marilena Folgueras, minha orientadora, por ter acreditado na proposta de trabalho, munindo-me de todos os recursos para que ela se concretizasse. Orientadora eficiente e pessoa virtuosa que muitas lições ensinou. Ao Murilo e Rafael, simpática família de nobres valores.
Ao meu coorientador, Prof. Adilson Chinelatto, forte parceiro nas etapas de caracterização, que foi quem plantou a semente das CSSCs em minha mente.
Ao coordenador do PGCEM, Prof. Luiz Dalla Valentina, pelos ensinamentos, apoio e conversas construtivas.
Ao Agnaldo Gonçalves, da Tezca P&D de Células Solares, pelas valiosas dicas e acessibilidade. Ao Prof. Agnaldo Santos, da Universidade Federal de Alagoas pela ajuda e boa vontade.
À CAPES pela bolsa de estudos. Ao PGCEM da UDESC pela oportunidade e infra estrutura disponibilizada. À Universidade Estadual de Ponta Grossa (UEPG) pela infra estrutura disponibilizada para as etapas de caracterização.
À Maria Eugênia, secretária eficiente do PGCEM, sempre à frente da demanda. Ao Douglas Migliorini e Nilson Sabino, da UEPG, pela parceria nas análises de DRX e AFM. Ao Tarcísio Sene pelas construtivas discussões, científicas ou não. À Sonia Prim pelas discussões científicas e importantes dicas no laboratório.
À Vidraçaria Santana, de Ponta Grossa – PR, pelo apoio com o corte preciso dos substratos condutores transparentes.
nossas necessidades, mas somente o necessário.”
FORBECK, Guilherme. Obtenção de Pós de Dióxido de Titânio para Células Solares Sensibilizadas por Corante via Rota Sol Gel. 2012. 97 f. Dissertação (Mestrado em Ciência e Engenharia de Materiais – Área: Materiais Cerâmicos) – Universidade do Estado de Santa Catarina. Programa de Pós-graduação em Ciência e Engenharia de Materiais, Joinville, 2012.
A energia solar fotovoltaica é uma forma interessante de obtenção de energia elétrica por apresentar baixo impacto ambiental. Quando utilizada na geração distribuída, permite reduzir custos com balanço do sistema (baterias, etc). O processo de operação das células solares não gera impacto ambiental, mas sua produção sim, em função da utilização de materiais de elevado grau de pureza, como o silício grau solar (SoG-Si: 99,9999% ou 5N). As células solares sensibilizadas por corante (CSSCs) são uma opção interessante, pois utilizam um um óxido metálico como material semicondutor. O dióxido de titânio (TiO2), em sua fase polimórfica anatase, apresenta propriedades interessantes, tais como separação entre bandas adequada para dificultar a corrosão, elevado índice de refração e alta constante dielétrica. Neste trabalho, foram produzidos pós de dióxido de titânio nanocristalino pelo método sol-gel em ambiente ácido, com peptização em temperatura ambiente. Diferentes tempos de tratamento térmico dos pós foram estudados. Camadas porosas foram depositadas sobre substratos condutores transparentes a partir de amostras de TiO2 em pó. Uma amostra de TiO2 comercial (P25, Evonik) foi utilizada como referência. Diferentes tempos de tratamento térmico destas camadas porosas também foram estudados. Com o objetivo de observar a influência do tempo de aquecimento nos materiais resultantes, os fotoeletrodos foram caracterizados por microscopia eletrônica de varredura (MEV), microscopia de força atômica (AFM), análise de área superficial (BET) e difração de raios-X (DRX). As CSSCs foram montadas a partir dos fotoeletrodos produzidos com os diferentes pós e suas propriedades elétricas foram avaliadas através da curva característica corrente – tensão (I – V). Cristalitos nanométricos predominaram em todos os lotes estudados. O tamanho médio de partícula aumentou com o aumento no tempo de aquecimento, especialmente para amostras em pó submetidas a um tempo de aquecimento de 120min. As amostras apresentaram também um aumento na cristalinidade e uma redução no teor da fase anatase após tratamento térmico a 450°C. As CSSCs apresentaram eficiências compatíveis com o teor de anatase presente nas amostras, evidenciando que o tempo de aquecimento no patamar de 450°C é significativo para a variável resposta eficiência de conversão energética.
FORBECK, Guilherme. Obtaining of Titanium Dioxide Powders for Dye-sensitized Solar Cells by Sol-gel Route. 2012. 97 f. Dissertation (Master in Science and Engineering of Materials - Area: Ceramic Materials) – Santa Catarina State University, Post Graduation Program in Science and Materials Engineering, Joinville, 2012.
Photovoltaic solar energy is an interesting way of generating electricity in light because of its low environmental impact, particularly for on-grid application in order to mitigate BOS (balance of system: batteries, etc) costs. The method of operation of the solar cell does not generate environmental impact, but their production does, especially when high-purity materials are used, such as solar grade silicon (SoG-Si: 99,9999% or 5N). Dye-sensitized solar cells (DSCs) are an interesting option since they are based on metal oxides as semiconductor materials. Titanium dioxide (TiO2) in its anatase polymorphic crystalline phase, presents interesting properties, such as a wide bandgap to minimize photocorrosion issues, high refractive index and high dielectric constant. In this work, nanocrystalline TiO2, predominantly in its anatase crystalline phase, was prepared by the sol-gel process under acid medium. Peptization was carried out at room temperature. Porous layers were deposited onto transparent conducting oxide substrates from powder TiO2 samples. A commercial TiO2 powder sample (P25, Evonik) was used as a reference. Different heat treatment times for the powder TiO2 samples and also for the porous TiO2 layers were studied. In order to analyze the influence of heating time on the morphological e crystalline structure of the resulting porous TiO2 layers, photoelectrodes were characterized by scanning electron microscopy (SEM), atomic force microscopy (AFM), surface area analysis (BET) and X-ray diffraction (DRX). DSCs were assembled from photoelectrodes produced by using different powder samples and their characteristic current-voltage (I-V) curves were measured. Nanosized crystallites were
predominant in all studied batches. The average particle size increased under increasing heating time, especially for powders submitted to a heating time of 120min. The heat treatment at 450°C for 30 min provided powder samples endowed with higher crystallinity, but a lower anatase content. The anatase content was reflected in the power energy conversion efficiency (η) of the DSCs, which provides evidence for the importance of the heat treatment of 450°C for 30min on the dependent variable (η).
Figura 1: Espectro eletromagnético contendo as regiões da radiação solar e da luz
visível...19
Figura 2: Desvio padrão da temperatura global no período de 1860 a 2000...21
Figura 3: Concentrações globais de gases do efeito estufa (GEE) na atmosfera, em partes por milhão (ppm), no período entre os anos 1850 e 2000...22
Figura 4: Matriz energética mundial – 2008...23
Figura 5: Estruturas de bandas eletrônicas para diferentes tipos de materiais a 0K. a) materiais metálicos; b) materiais isolantes; c) materiais semicondutores...26
Figura 6: Curva característica corrente – tensão, com seus principais parâmetros...29
Figura 7: Espectro de absorção e ação fotocorrente de filmes de TiO2 em substrato condutor transparente...35
Figura 8: Célula unitária de dióxido de titânio, fase polimórfica rutilo...38
Figura 9: Célula unitária de dióxido de titânio, fase polimórfica anatase...39
Figura 10: Célula unitária de dióxido de titânio, fase polimórfica bruquita...39
Figura 11: Mecanismo de reação de hidrólise do tetraisopropóxido de titânio...44
Figura 12: Mecanismo de reação de condensação do hidróxido de titânio...44
Figura 13: Fluxograma do trabalho experimental...46
Figura 14: Fluxograma do processo de limpeza dos eletrodos condutores transparentes...47
Figura 15: Lâmina de FTO após aplicação da suspensão de TiO2, após aplicação do bastão de vidro e após desmoldagem...48
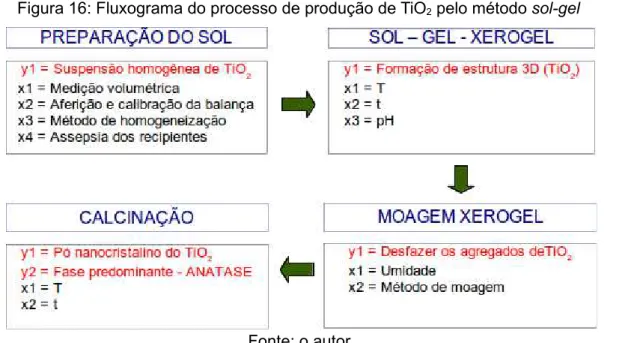
Figura 16: Fluxograma do processo de produção de TiO2 pelo método sol-gel...49
Figura 17: Mistura obtida na fase inicial, intermediária e final de peptização...50
Figura 18: Fluxograma do processo de sensibilização dos fotoeletrodos...52
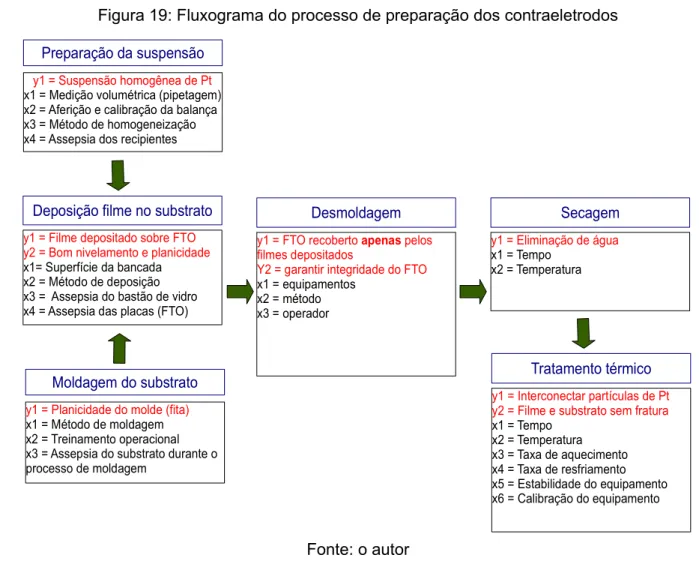
Figura 19: Fluxograma do processo de preparação dos contraeletrodos...54
Figura 20: CSSC montada, antes da adição do eletrólito...55
Figura 21: Diagrama elétrico do sistema de medição...56
Figura 22: Difratograma de Raios-X de amostra do TiO2 de referência (P25)...57
térmico...80 Figura 41: Imagens de AFM de 1μm x 1μm de amostra SG02.120, sem tratamento térmico e com permanência de 20min e 120min no patamar de 450°C. ...81 Figura 42: Tendências de tamanho médio de cristalito para os lotes SG02.20 e SG02.120...82 Figura 43: Difratogramas dos filmes depositados a partir de TiO2 SG02.120,
Tabela 1 - Valores de Massa de Ar para diferentes interações com a atmosfera...20
Tabela 2 - Valores de resistividade (ρ) para diferentes tipos de materiais...25
Tabela 3 - Valores de energia de banda proibida para alguns semicondutores...30
Tabela 4 - Diferentes materiais para células solares e suas respectivas eficiências em laboratório...32
Tabela 5 - Comprimentos de ligação e densidade do TiO2...38
Tabela 6 - Diferentes sistemas coloidais e suas respectivas fases...42
Tabela 7 - Teores das fases do TiO2 de referência (P25)...58
Tabela 8 - Diâmetro médio de cristalito dos pós de TiO2 com diferentes tempos a 450°C...64
Tabela 9 - Diâmetro médio de cristalito e área superficial específica para diferentes tempos a 450°C...66
Tabela 10 - Diâmetro médio de aglomerado para diferentes tempos a 450°C...70
Tabela 11 - Valores de rugosidade média (Ra) e rugosidade total (Rz) para diferentes tempos no patamar de 450°C...74
Tabela 12 - Diâmetro médio de cristalito para filmes sem tratamento térmico, com 10 e 30min no patamar de 450°C. Filmes obtidos a partir do TiO2 SG02.20...78
Tabela 13 - Diâmetro médio de cristalito para filmes (a) SG02.120.0, (b) SG02.120.10 e (c) SG02.120.30...82
Tabela 14 - Parâmetros das células solares do lote SG02 obtidos com 100h da adição do eletrólito...87
1 INTRODUÇÃO...16
1.1 JUSTIFICATIVA...17
1.2 OBJETIVOS...17
1.3 ESTRUTURA DO TRABALHO ...18
2 REVISÃO DA LITERATURA...19
2.1 A LUZ SOLAR...19
2.2 ENERGIA E MEIO AMBIENTE...20
2.3 BREVE HISTÓRICO DAS CÉLULAS SOLARES...24
2.4 CONDUÇÃO ELÉTRICA NOS SÓLIDOS...25
2.5 JUNÇÕES P-N...26
2.6 CÉLULAS SOLARES...27
2.6.1 Tipos de Células Solares...31
2.6.2.1 Células Solares Sensibilizadas por Corante (CSSC)...34
2.7 DIÓXIDO DE TITÂNIO...36
2.8 SÍNTESE DE TIO2 PELO MÉTODO SOL-GEL...40
3 MATERIAIS E MÉTODOS...46
3.1 CÉLULA FOTOVOLTAICA DE REFERÊNCIA (P25) - FOTOELETRODO...47
3.2 CÉLULA FOTOVOLTAICA DE ANÁLISE (SG) - FOTOELETRODO...48
3.2.1 Obtenção de TiO2 pelo Método sol-gel...49
3.2.2 Caracterização dos pós obtidos (SG)...50
3.2.3 Deposição do filme de TiO2 em substrato condutor transparente (FTO). .51 3.3 CARACTERIZAÇÃO DOS FOTOELETRODOS...51
3.4 SENSIBILIZAÇÃO DOS FOTOELETRODOS...52
3.5 PREPARAÇÃO DO ELETRÓLITO...52
3.6 CONTRAELETRODO...53
3.7 MONTAGEM DAS CÉLULAS SOLARES...54
3.8 CARACTERIZAÇÃO DAS CÉLULAS SOLARES...55
4 RESULTADOS E DISCUSSÃO...57
4.1 CARACTERIZAÇÃO DO TIO2 DE REFERÊNCIA (P25) ...57
4.2 CARACTERIZAÇÃO DOS PÓS DE TIO2 OBTIDOS POR SOL-GEL (SG) ...59
4.3 CARACTERIZAÇÃO DOS FOTOELETRODOS DE TIO2 ...68
4.4 PROPRIEDADES ELÉTRICAS ...84
5 CONCLUSÕES...91
1 INTRODUÇÃO
O Meio Ambiente vem sofrendo processos naturais de transformação com o passar do tempo, tais como inundações, secas, avalanches, terremotos, erupções vulcânicas, entre outros, desde antes do início da vida humana na Terra. Segundo Pires (2010), estes processos, exceto o vulcanismo e tectonismo, passaram a ter sua frequência, intensidade e local de ocorrência associados a mudanças ambientais contemporâneas, tais como o aquecimento global e a poluição da atmosfera.
O Painel Intergovernamental de Mudanças Climáticas divulgou que o planeta está aquecendo e atribui o aquecimento ao aumento na concentração de gases do efeito estufa (IPCC, 2001). A queima de combustíveis fósseis é uma das principais causas das emissões de dióxido de carbono na atmosfera, segundo a Organização Mundial de Meteorologia (WMO, 2011).
Cerca de 80% da matriz energética mundial está baseada em recursos não renováveis. Além dos aspectos ambientais e de segurança do armazenamento e queima do petróleo, sua obtenção apresenta riscos de acidentes ambientais graves, como os vazamentos ocorrido no Golfo do México em 2010 e o ocorrido na Bacia de Campos em 2011. A queima de carvão ou lenha exige a remoção de florestas, que causa desertificação e suprime a capacidade de sequestro de carbono, além da poluição atmosférica gerada com a queima, com a emissão de gases do efeito estufa.
1.1 JUSTIFICATIVA
A energia solar fotovoltaica é limpa e abundante em países como o Brasil. Correspondendo à grande maioria do mercado destes dispositivos (PIETRUSZKO, 2005), as células solares de silício apresentam eficiência elevada (~ 24,5%) em comparação à maioria das demais células solares, porém, com custo de produção ainda elevado em função de suas especificidades, já que é necessária a utilização do silício grau solar (SoG-Si: 99,9999% ou 5N).
Em 1991, O'Regan e Grätzel desenvolveram uma célula fotovoltaica a partir de dióxido de titânio (TiO2) nanocristalino, reportando baixo custo de produção e eficiência de conversão energética de aproximadamente 11%. Estas células ainda não são comercializadas em larga escala, mas vem sendo objeto de estudo de muitos pesquisadores de diversas áreas, trabalhando com diferentes parâmetros, com o objetivo de conhecer melhor o processo e seus parâmetros de significância, para obter uma célula solar mais eficiente ou de menor custo.
1.2 OBJETIVOS
Este trabalho está baseado em conceitos já estudados em nível internacional e também nacional. Entretanto, sabe-se que no desenvolvimento de células solares sensibilizadas por corante (CSSC) muito existe ainda a ser desenvolvido para aumentar a eficiência de conversão energética e reduzir custos de produção, desde a melhoria de processos existentes até a proposição de novos processos e/ou novos materiais. Assim, pretende-se com esta proposta contribuir para a evolução nesta área de pesquisa através da obtenção de novas informações que possam contribuir para avanços concretos.
Especificamente, o presente trabalho tem como objetivos:
• Desenvolvimento de CSSC a partir de materiais já otimizados para esta finalidade, sendo o fotoeletrodo produzido a partir de pós de dióxido de titânio P25 (Degussa), para avaliar a influência do tempo de tratamento térmico em parâmetros micro e nanoestruturais dos filmes depositados em substrato condutor transparente e seu efeito na eficiência de conversão energética das células;
para CSSCs, por meio do método sol-gel em ambiente ácido, sendo utilizado como precursor tetraisopropóxido de titânio, com peptização em temperatura ambiente;
• Construção de CSSC com fotoeletrodo produzido a partir dos pós obtidos pelo método sol-gel, visando avaliar a influência do tempo de tratamento térmico em parâmetros estruturais dos filmes e seu efeito na eficiência de conversão;
• Caracterização dos pós e filmes obtidos através de avaliação micro e nanoestrutural por microscopia eletrônica de varredura (MEV) e microscopia de força atômica (AFM); análise por difração de raios-X (DRX), objetivando conhecer os materiais obtidos e observar eventuais variações nas propriedades observadas;
• Caracterização das propriedades elétricas com a obtenção da curva característica fotocorrente – tensão, visando observar possíveis correlações dos parâmetros de processo com a eficiência de conversão energética das CSSCs obtidas.
1.3 ESTRUTURA DO TRABALHO
2 REVISÃO DA LITERATURA
2.1 A LUZ SOLAR
No Sol, a cada segundo, 6 x 1011 kg de moléculas de Hidrogênio (H
2) são convertidas em moléculas de Hélio (He) por reações de fusão nuclear. As reações geram uma perda de massa da ordem de 4 x 103 kg, ou, em termos de energia, 4 x 1020 J, levando em consideração que a toda massa existe uma energia associada (Teoria da Relatividade Restrita de Einstein). A energia gerada neste processo é emitida, entre outras formas, como radiação nas faixas do ultravioleta ao infravermelho do espectro eletromagnético (200nm a 3000nm) (SZE; NG, 2007), conforme mostrado na Figura 1.
A radiação que incide sobre o Planeta Terra sofre interações com a atmosfera. A radiação ultravioleta (UV) interage com a camada de ozônio, que absorve parte da energia radiante. Já a radiação infravermelha (IV) é parcialmente absorvida pelo vapor de água, dióxido de carbono e demais gases do efeito estufa (SZE; NG, 2007). Após as interações com a atmosfera, a radiação solar incidente na crosta terrestre corresponde à faixa de comprimentos de onda de 390 a 1100 nm (FALCÃO, 2005).
Além do comprimento de onda, o comprimento do caminho da radiação através da atmosfera é de fundamental importância para aplicações terrestres. A este comprimento de caminho denomina-se Massa de Ar. Massa de Ar ou Air Mass
(AM) é a unidade utilizada para quantificar o grau em que a luz solar recebida na Figura 1: Espectro eletromagnético contendo as regiões da radiação solar e da luz visível.
superfície da Terra é afetada pela atmosfera, sendo a secante do ângulo (sec θ) entre o sol e seu zênite. A Tabela 1 mostra valores de Massa de Ar, com seus respectivos ângulos de referência. O valor AM 0 representa a radiação solar fora da atmosfera do planeta.
Tabela 1: Valores de Massa de Ar para diferentes interações com a atmosfera
Massa de Ar Intensidade (W.m-2) Θ (°) Referencial
AM 0 1353 --- Fora da atmosfera terrestre
AM 1 925 0 Sol em seu zênite
AM 1,5 844 45 Sol a 45° do zênite
AM 2 691 60 Sol a 60° do zênite
Fontes: (BUBE, 1998) (FALCÃO, 2005)
2.2 ENERGIA E MEIO AMBIENTE
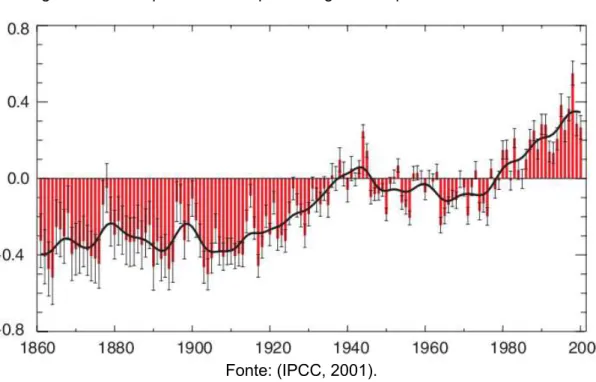
O aquecimento global e a poluição da atmosfera causam alterações nos padrões de circulação de massas de ar, na temperatura dos oceanos e na circulação das correntes marinhas, que determinam, por sua vez, o padrão de ocorrência destes desastres naturais (PIRES, 2010). O reflexo imediato e mais comentado destas alterações atmosféricas é o aumento da temperatura global. Este aquecimento é associado ao efeito estufa, que é o aumento da temperatura da atmosfera do planeta por meio do impedimento da dissipação do excesso de calor da crosta terrestre no espaço. Dados recentes mostram o um aumento na temperatura global em relação à temperatura média no período de 1860 a 2000 (Figura 2). Afirma-se que este aumento é consequência do aumento na concentração de gases poluentes como dióxido de carbono, metano, óxido nitroso e vapor de água, conhecidos como gases do efeito estufa (GEE), ou ainda
Conforme relatado por Nogueira (2001), 30 bilhões de toneladas de gases do efeito estufa são injetados na atmosfera por ano pela queima de combustíveis fósseis para transportes, geração de eletricidade, aquecimento, entre outras atividades. O Painel Intergovernamental de Mudanças Climáticas relatou que aproximadamente 75% das emissões antropogênicas de CO2 na atmosfera, no período de 1981 a 2001, foi devido a queima de combustíveis fósseis, sendo o restante predominantemente devido à mudança do uso da terra, especialmente o desmatamento (IPCC, 2001). Em seu reporte de número 7, a Organização Mundial de Meteorologia, ou World Meteorological Organization (WMO, 2011) atribuiu como
principais causas das emissões de dióxido de carbono na atmosfera a queima de combustíveis fósseis e desmatamento. A Figura 3 mostra a variação das concentrações globais de dióxido de carbono e metano presentes na atmosfera, em partes por milhão (ppm), no período de 1850 a 2000.
Figura 2: Desvio padrão da temperatura global no período de 1860 a 2000.
A WMO, órgão vinculado à Organização das Nações Unidas (ONU), reportou também um novo aumento dos teores de gases do efeito estufa em 2010, para 389 ppm de dióxido de carbono e 1,8 ppm de metano (WMO, 2011), representando um aumento de aproximadamente 6% e 16%, respectivamente, em relação ao reportado para o ano 2000 (IPCC, 2001). Estes dados, por si só, justificam os estudos voltados à compreensão dos princípios de evolução dos processos de produção de energia.
A utilização de energia a partir de fontes renováveis, tais como água, vento, sol e biomassa predominou até a sociedade pré industrial. Por volta do século XVIII, iniciou-se a queima de combustíveis fósseis para funcionar máquinas a vapor e para fundir o ferro. As usina termoelétricas emitem grandes quantidades de cinzas e gases do efeito estufa pela queima de combustíveis fósseis, além de demandar muita água para o resfriamento do sistema de condensação. Usinas hidrelétricas exigem a construção de reservatórios que causam impactos ao meio ambiente, como a redução da capacidade de sequestro de carbono por desflorestamento e a liberação de carbono da floresta, sob a forma de metano, durante sua decomposição. Vogt e Januzzi (2001) afirmam que tais usinas provocam mudanças na composição e propriedades químicas da água, mudanças na temperatura, concentração de sedimentos, além de prejudicar a manutenção da diversidade de Figura 3: Concentrações globais de gases do efeito estufa (GEE) na atmosfera, em partes
por milhão (ppm), no período entre os anos 1850 e 2000.
espécies de fauna e flora. A energia nuclear fornece eletricidade sem emissão de gases do efeito estufa, mas apresenta riscos de impacto ambiental e à saúde humana em caso de acidente.
A Figura 4 mostra a matriz energética mundial de 2008, com cerca de 81% do suprimento de energia baseado em fontes não renováveis, os combustíveis fósseis. No mesmo período, somando-se aos recursos fósseis a utilização de energia nuclear, hidrelétrica e a queima de biomassa, somente 0,7% do total do suprimento de energia de 2008 foi proveniente de energia solar, eólica e geotérmica. Além de conhecer as fontes de energia, é importante saber também onde estão localizados os maiores consumidores desta e qual é o comportamento de crescimento deste consumo. Sabe-se que nos últimos 50 anos, a demanda global de energia triplicou, principalmente em função dos países industrializados, que satisfizeram 90% da demanda de energia com combustíveis fósseis (HINRICHS et al., 2010).
Os Estados Unidos, com apenas 4,6% da população mundial, consomem em torno de 25% de toda a energia utilizada no planeta. Segundo Hinrichs e colaboradores (2010) projeta-se um novo aumento triplo da demanda de energia para os próximos 30 anos, porém, a maior parte dessa demanda virá dos países em desenvolvimento. Se tais projeções se confirmarem, os países em desenvolvimento estarão consumindo mais energia que os países industrializados por volta de 2025.
Com base no exposto acima pode-se compreender que energia, meio Figura 4: Matriz energética mundial – 2008.
Fonte: (INTERNATIONAL ENERGY AGENCY, 2011).
ambiente e desenvolvimento econômico estão intimamente ligados. O balanço entre estes três aspectos deve ter uma só direção, a sustentabilidade.
2.3 BREVE HISTÓRICO DAS CÉLULAS SOLARES
As células solares são dispositivos baseados no efeito fotovoltaico, que consiste na conversão de energia luminosa incidente sobre um material semicondutor, tratado adequadamente, em eletricidade. Em 1839, Becquerel montou uma junção utilizando dois eletrodos de prata e um eletrólito e a expôs à luz, gerando uma pequena diferença de potencial (BUBE, 1998). Após a descoberta de Becquerel, outros materiais foram utilizados para gerar o efeito fotovoltaico, porém, somente em 1940, Ohl obteve uma fotovoltagem significativa a partir de uma junção
p-n de Silício (SZE; NG, 2007). Nas décadas de 1940 e 1950, foi desenvolvido o
processo Czochralski, criado em 1916 pelo polonês Jan Czochralski para o crescimento de monocristais de Silício puro. Em 1954, Chapin e colaboradores, do
Bell Labs, desenvolveram uma célula solar de Silício monocristalino com eficiência
2.4 CONDUÇÃO ELÉTRICA NOS SÓLIDOS
Em um átomo isolado, os elétrons ocupam níveis e subníveis discretos de energia. Em um cristal contendo muitos átomos, como no caso de um material sólido, os níveis de energia se sobrepõem e são substituídos por bandas densamente preenchidas, denominadas bandas de energia (PADILHA, 2000), podendo ser a banda de valência ou a banda de condução, esta última a mais externa. A ocupação das bandas de energia são diferentes para metais, semicondutores e isolantes, conferindo a estes materiais diferentes propriedades elétricas. A Tabela 2 mostra valores de resistividade (ρ), em Ω.m, para materiais condutores (metálicos), semicondutores e isolantes à temperatura ambiente.
Tabela 2: Valores de resistividade (ρ) para diferentes tipos de materiais
Material Resistividade elétrica (Ω.m)
Condutor - Cobre 2,0 x 10-8
Semicondutor - Silício 3,0 x 103
Isolante – Diamante > 1016
Fonte: (HALLIDAY et al., 1991)
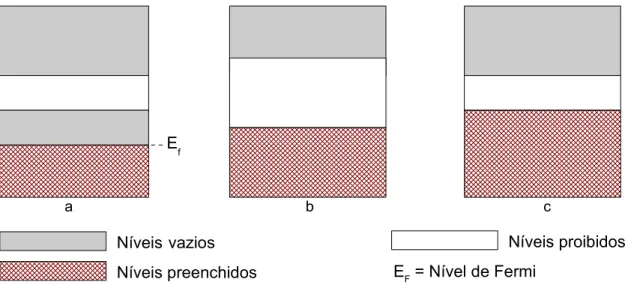
Metais, na temperatura do zero absoluto (T = 0 K), apresentam o mais alto nível eletrônico na metade da banda de valência. Como a banda de valência é parcialmente preenchida, existe mobilidade de elétrons no sólido, sendo estes denominados elétrons livres. O nível energético mais baixo preenchido corresponde a E = 0, e o nível mais alto é denominado nível de Fermi, sendo sua energia correspondente chamada energia de Fermi (EF), mostrado na Figura 5a. Havendo a aplicação de um campo elétrico a este metal, ocorre o aumento da energia cinética dos elétrons, exigindo uma alteração de nível energético destes. Como existem níveis energéticos disponíveis, ocorre movimento de elétrons (HALLIDAY et al., 1991).
proibida, bandgap ou energy gap (Eg). A diferença entre estes dois materiais está no valor de energia da banda proibida. Semicondutores possuem menores valores para a banda proibida que materiais isolantes, sendo possível nos semicondutores que os elétrons “saltem” a banda proibida ao absorverem energia maior que a desta banda (HALLIDAY et al., 1991). Segundo Callister (2007), a fonte de excitação para elétrons pode ser térmica ou ótica.
2.5 JUNÇÕES P-N
Semicondutores intrínsecos apresentam o comportamento elétrico com base na estrutura do material puro. Por outro lado, semicondutores extrínsecos têm suas características ditadas por átomos de impurezas, que introduzem na estrutura do semicondutor um excesso ou falta de elétrons. Semicondutores com excesso de elétrons são denominados tipo n, sendo os elétrons livres os portadores majoritários,
em função de sua densidade superior à densidade de buracos. Semicondutores com falta de elétrons ou excesso de buracos são denominados semicondutores tipo p.
Quando dois semicondutores estão em contato, um tipo p e um tipo n,
forma-se uma junção p-n. A diferença de densidades eletrônicas dos semicondutores faz
com que portadores majoritários (elétrons livres) próximos ao plano da junção migrem do semicondutor tipo n para o semicondutor tipo p, criando uma região de
cargas fixas positivas em n e uma região de cargas fixas negativas em p, formando
Figura 5: Estruturas de bandas eletrônicas para diferentes tipos de materiais a 0K. a) materiais metálicos; b) materiais isolantes; c) materiais semicondutores.
Fonte: adaptado de (CALLISTER JR., 2007).
a b c
Ef
Níveis vazios Níveis preenchidos
assim uma região denominada zona de depleção (HALLIDAY et al., 1991). As cargas fixas originam um campo elétrico orientado de n para p, que impede o retorno dos
portadores (PORST, 1976). Desta forma se dá o mecanismo de funcionamento de um diodo e também de uma célula solar no escuro, permitindo a passagem de elétrons em uma única direção, denominada corrente no escuro (ID) ou ainda densidade de corrente no escuro (JD) .
2.6 CÉLULAS SOLARES
Quando um fóton é absorvido por um material semicondutor e possui energia maior que a banda proibida deste semicondutor, ocorre a formação de portadores por fotoexcitação, sendo um elétron livre e um buraco. O campo elétrico interno mantém os portadores separados, gerando um fluxo de carga para o circuito externo, antes que os portadores recombinem-se entre si (BUBE, 1998). Este fluxo de transportadores de carga constitui uma densidade de corrente elétrica reversa, que é dada pela diferença entre a densidade de corrente no escuro (JD) e a densidade de corrente gerada sob iluminação (JL), como mostra a Equação 1.
(1)
A densidade de corrente no escuro (JD) é a corrente direta impulsionada pela tensão V, também denominada corrente de saturação ou ainda corrente de
vazamento, a qual pode ser determinada por meio da equação de Shokley, mostrada
na Equação 2. O segundo termo do lado direito da Equação 1 é a corrente reversa associada com a fotoexcitação (BUBE, 1998).
(2)
O termo J0 é denominado corrente de saturação reversa, q é a carga
elementar do elétron (1,602 x 10-19 C), V é a tensão, A corresponde ao fator de Equação 1
J
=
J
D−
J
LEquação 2
J
D=
J
0[
exp
(
q.V
idealidade, cujo valor depende do mecanismo de transporte na junção, k é a
constante de Boltzmann (1,38 x 10-23 JK-1) e T é a temperatura em K. Substituindo a Equação 2 na Equação 1, obtém-se:
(3)
A uma tensão nula (condição de curto circuito R=0), no escuro, a densidade de corrente é nula (Equação 4), enquanto sob condições de iluminação (JL) o fluxo de elétrons é chamado de densidade de corrente de curto circuito (Jsc) e pode ser definida pela Equação 5:
Equação 4
(4)
Equação 5 (5)
A densidade de corrente de curto circuito é a máxima corrente de saída de uma célula, correspondendo a uma tensão nula (V = 0). A densidade de corrente de curto circuito é controlada somente pela corrente gerada sob iluminação e processos de recombinação.
Sob condições de circuito aberto (J = 0; R = ∞), a diferença de potencial é chamada tensão de circuito aberto (VOC), que corresponde a um fluxo de elétrons nulo. A tensão de circuito aberto corresponde à máxima tensão da célula solar, e pode ser determinada pela Equação 6. É controlada pela corrente gerada sob iluminação, processos de recombinação e também pela natureza das correntes de transporte na junção, que depende de A e J0.
Voc=A.k.T q ln[(
JL
J0)+1] E
quação 6
(6)
Os parâmetros de uma célula solar são verificados através da curva característica tensão – fotocorrente. A corrente e a tensão em que a célula solar
J
D=
0
JSC=−JL
Equação 3
J=J0[exp( q.V
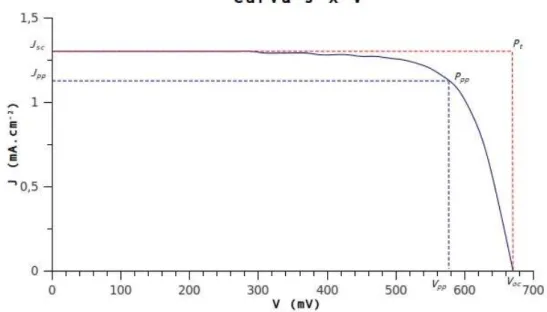
opera são determinadas pela radiação incidente, pela temperatura ambiente e pelas características da carga conectada ao mesmo. Na Figura 6 pode ser observada uma curva característica, juntamente com seus principais parâmetros.
A curva fornece uma estimativa de como a célula solar pode se comportar sob a ação de várias demandas de corrente. O método utilizado para sua obtenção está descrito na página 55. Os parâmetros significativos da curva são a densidade de corrente de curto circuito (Jsc), tensão de circuito aberto (Voc) e a potência pico (Ppp). A partir destes parâmetros podem ser obtidos o fator de preenchimento (FF) e a
eficiência de conversão energética (η).
A corrente total gerada pelo dispositivo é dada pela Equação 7, onde A é a área através da qual ocorre o fluxo de corrente.
I=J.A
Equação 7 (7)
A potência pico (Ppp) é o valor máximo de potência que pode ser gerada pelo dispositivo, e é obtida a partir do produto entre a corrente de máxima potência (Ipp) e a tensão de máxima potência (Vpp), como pode ser observado na Equação 8. Os parâmetros corrente e tensão de máxima potência são utilizados como os valores nominais de corrente e tensão do dispositivo (TOLMASQUIM, 2003).
Figura 6: Curva característica corrente – tensão, com seus principais parâmetros.
Equação (8 (8)
Outros parâmetros importantes são o fator de preenchimento ou fill factor (FF)
e a eficiência de conversão de energia (η). O fator de preenchimento é dado pela razão da potência pico (Ppp) pela potência teórica (Pt), conforme mostrado na Equação 9.
Equação 9
(9)
A eficiência de conversão energética, parâmetro adimensional de suma importância em células solares, é mostrada na Equação 10, sendo o parâmetro W a
irradiação absorvida pela célula, em W/cm2 e A a área da célula, em cm2.
Equação 10
(10)
Conforme já descrito na página 19, a maior parte da radiação solar que incide na crosta terrestre está na região do visível e infravermelho próximo, correspondendo a comprimentos de onda entre 390 e 1100 nm (FALCÃO, 2005). Sendo assim, materiais semicondutores com energia de banda proibida entre 1,1 e 3,2 eV são candidatos para o efeito fotovoltaico em células solares. A Tabela 3 mostra os valores de energia de banda proibida (Eg), em elétron volts, para alguns materiais semicondutores utilizados para células solares.
Tabela 3: Valores de energia de banda proibida para alguns materiais semicondutores
Material Semicondutor Eg (eV)
Silício (Si) 1,1
Arseneto de gálio (GaAs) 1,4
Telureto de cádmio (CdTe) 1,5
Sulfeto de cádmio (CdS) 2,4
Dióxido de titânio* 3,2
Dióxido de titânio* sensibilizado por corante à base de rutênio** 2,3
* fase predominante anatase
** corante cis - diisotiocianato - bis (2,2 - bipyridyl-4,4 - dicarboxilato) rutênio(II) bis (tetrabutilamônio) ʼ ʼ Fontes: (O’REGAN; GRÄTZEL, 1991) (PADILHA, 2000) (ATKINS; PAULA, 2006)
Ppp=Ipp.Vpp
ηmax=Ipp.Vpp
Materiais com menor energia de banda proibida geram um número maior de portadores de carga em função de absorver radiação em uma região maior do espectro eletromagnético, enquanto materiais com maior banda proibida apresentam maior tensão de circuito aberto (VOC), já que a tensão é dada pelo campo elétrico da junção (FALCÃO, 2005).
2.6.1 Tipos De Células Solares
As células solares podem ser classificadas quanto aos materiais que as compõem, como homojunção e heterojunção (BUBE, 1998). Podem também possuir uma ou mais bandas proibidas. As células solares mais comumente encontradas são as de uma banda, as quais podem ser classificadas em quatro tipos, sendo células solares de silício cristalino, de filmes finos, células solares orgânicas e células solares fotoeletroquímicas (SANTOS, 2005).
Tabela 4: Diferentes materiais para células solares e suas respectivas eficiências em laboratório
Materiais Eficiência (laboratório)
a - Si 10,1%
Células solares sensibilizadas por corante 11,4% Heterojunção a-Si:H/CuInSe2 15,6%
Homojunção CdTe 16%
Homojunção ZnSe 16,5%
Homojunção CuInGaSe2 18%
p - Si 19,8%
Heterojunção GaAs/CuInSe2 21,3%
m - Si 24,7%
Heterojunção GaInP2/GaAs 28,7%
Homojunção GaAs 30%
Heterojunção GaAs/Si 31%
Fonte: (BUBE, 1998; NOGUEIRA, 2001; OLSON et al., 1990; O’REGAN; GRÄTZEL, 1991; SCHOONMAN, 2005)
Outro tipo de homojunção são as células solares de filmes finos, que, assim como as células de silício cristalino, utilizam materiais de alto custo, porém, em quantidades menores. O arseneto de gálio (GaAs) tem sido utilizado para a construção de células com boa eficiência. Porém, o gálio é um material raro (NOGUEIRA, 2001) e o arsênio apresenta toxicidade (WEBB et al., 1986). Também são utilizados materiais como telureto de cádmio (CdTe) e disseleneto de cobre índio gálio (CuInGaSe2), materiais com elevada eficiência de absorção da radiação solar. Por outro lado, o cádmio é um material cancerígeno, o que gera uma problemática no processo de produção e no manejo do resíduo no final do ciclo de vida do material (TOLMASQUIM, 2003).
valores de energia de banda proibida (Eg), ocorrendo a transferência de cargas de um lado para outro, de forma semelhante às junções p-n. Um exemplo deste tipo de
heterojunção são as heterojunções de GaAs – Ga1-xAlxAs, utilizadas em lasers semicondutores (REZENDE, 2004).
Heterojunções de metal – semicondutor são utilizadas em dispositivos de alta frequência. Materiais metálicos e semicondutores, quando separados entre si, possuem níveis de Fermi em diferentes posições relativas. Nos metais o nível de Fermi localiza-se no mais alto nível preenchido da banda de valência, parcialmente preenchida. Nos semicondutores localiza-se no interior da banda proibida, não havendo elétrons neste nível. Quando metal e semicondutor são colocados em contato, ocorre a transferência de cargas de um lado para outro de modo a igualar os dois níveis de Fermi, de maneira semelhante às junções p-n, já descritas na
página 26. Porém, como buracos existem apenas em materiais semicondutores, estes não migram para o metal na transferência de carga, criando camadas de carga nos dois lados da junção, que formam uma barreira de potencial, chamada barreira de Schottky. Em heterojunções metal – semicondutor, a corrente é dominada por portadores majoritários (REZENDE, 2004).
Nas células fotoeletroquímicas, diferentemente das demais células solares, o efeito fotovoltaico não ocorre em uma junção p-n, mas sim na interface entre um
semicondutor (tipo n) e um eletrólito (NOGUEIRA, 2001). Neste tipo de célula, pares
elétron – buraco são excitados em um semicondutor de grande banda proibida e a absorção de radiação provoca uma reação de oxidação em uma superfície e uma reação de redução em outra, causando um fluxo de elétrons.
fotoeletroquímicas fotovoltaicas convertem a luz incidente diretamente em energia elétrica. Neste tipo de célula, a radiação é absorvida por um semicondutor tipo n,
ocorrendo a formação de um par elétron – buraco, sendo um elétron promovido à banda de condução, formando um buraco na banda de valência do semicondutor. O elétron da banda de valência é transportado pelo semicondutor até um eletrodo condutor, ligado ao circuito externo. O buraco formado na banda de condução do semicondutor migra até um eletrólito. O eletrólito é um par REDOX com potencial químico suficiente para permitir a coleta e redução deste “buraco”. O par REDOX, oxidado, difunde-se até um contraeletrodo, sendo reduzido ao recombinar o buraco com o elétron que passou pelo circuito externo, fechando o ciclo. Exemplos de semicondutores utilizados neste tipo de dispositivo são óxido de zinco (ZnO), dióxido de titânio (TiO2) e dióxido de estanho (SnO2), que apresentam energias de banda proibida da ordem de 3,3 eV, 3,2 eV e 3,6 eV. Tais bandas proibidas correspondem a comprimentos de onda abaixo de 390nm, absorvendo apenas cerca de 5% da radiação. Em semicondutores com pequeno espaçamento de banda proibida pode ocorrer a fotocorrosão do eletrodo pela presença de portadores minoritários, que podem ser elétrons livres em um semicondutor tipo-p ou buracos em um
semicondutor tipo-n. Portadores minoritários aumentam também as perdas por
recombinação de cargas (NOGUEIRA, 1998; O’REGAN; GRÄTZEL, 1991).
2.6.2.1 Células Solares Sensibilizadas Por Corante (CSSC)
Visando aumentar a eficiência de coleta de fótons em células fotoeletroquímicas, corantes têm sido utilizados como absorvedores de radiação na região da luz visível. Tais dispositivos são denominados células solares sensibilizadas por corante (CSSC). As CSSC diferem das células fotoeletroquímicas fotovoltaicas porque separam a função de absorção da luz do transporte de carga. Nestes dispositivos, a corrente elétrica é gerada quando um fóton absorvido por uma molécula de corante dá origem à injeção de um elétron na banda de condução do semicondutor (O'REGAN; GRÄTZEL, 1991). O circuito se completa da mesma forma das células fotoeletroquímicas fotovoltaicas, ou seja, o corante é regenerado por meio de um par REDOX em solução, que é então reduzido no contraeletrodo.
corante é realizada na região espectral do visível, tornando possível um melhor aproveitamento da radiação incidente do sol. O’Regan e Grätzel (1991) reportaram que o comprimento de onda em que inicia a absorção foi modificado para 750 nm (1,6 eV), com eficiência de coleta de luz próxima de 100% no total da região visível abaixo de 550 nm (2,3 eV), conforme mostra a Figura 7.
Para o material não sensibilizado por corante foi observado o início da absorção em 450nm, com eficiência próxima de 100% a aproximadamente 350nm.
Porém, a sensibilização de semicondutores ainda não representou por si só um aumento significativo na eficiência das células solares. Em uma superfície plana, uma camada monomolecular de corante absorve menos que 1% da radiação incidente. Tentativas de aumentar a coleta de fótons pela utilização de multicamadas de corante também não obtiveram sucesso. Uma outra opção foi aumentar a rugosidade da superfície semicondutora, visando a adsorção de um maior número de moléculas de corante na superfície, que pode simultaneamente estar em contato direto com o eletrólito REDOX. Partindo desta premissa, pesquisadores Figura 7: Espectro de absorção e ação fotocorrente de filmes de TiO2 em substrato condutor
transparente. a) Sem sensibilização. b) Sensibilizado com corante à base de rutênio.
Adaptado de (O'REGAN; GRÄTZEL, 1991) pelo autor. Comprimento de onda (nm)
E
fic
iê
n
ci
conseguiram aumentar significativamente a eficiência de coleta de fótons, utilizando os semicondutores ZnO e SnO2, porém ainda não haviam conseguido um aumento significativo na eficiência global das células solares, em função da instabilidade dos corantes utilizados, que se degradavam rapidamente (NOGUEIRA, 1998).
O'Regan e Grätzel (1991) produziram filmes semicondutores mesoporosos de TiO2 (predominantemente na fase cristalina anatase, definida na página 38) com cristalitos de tamanho nanométrico, junto com novos corantes de transferência de carga, e construíram uma célula solar estável com eficiência da ordem de 11%. Filmes mesoporosos (diâmetro médio de cristalito de 20 nm) possuem grande área superficial, cerca de mil vezes maior que um filme compacto (KAY; GRÄTZEL, 1996; NOGUEIRA, 2001). O'Regan e Grätzel buscaram otimizar os parâmetros tamanho de cristalito, consequentemente poros, e área superficial específica, objetivando alta eficiência de coleta de luz e poros com tamanhos a permitir a fácil difusão do eletrólito REDOX. A substituição do semicondutor compacto pelo semicondutor poroso, de estrutura nanocristalina e alta rugosidade superficial foi a maior contribuição destes pesquisadores.
As células solares sensibilizadas por corante (CSSCs) apresentam algumas vantagens, tais como o aumento da faixa útil do espectro eletromagnético pela utilização de corantes; maior geração de densidade de corrente em luz difusa que em luz direta, operando bem em condições de nebulosidade parcial e com luz refratada e refletida; operam em temperaturas mais altas em relação às células solares convencionais; menor custo de produção e são ambientalmente amigáveis, já que o semicondutor é obtido a partir de um óxido metálico.
2.7 DIÓXIDO DE TITÂNIO
em alguns outros óxidos e silicatos. Cerca de 95% do titânio utilizado no mundo não é aplicado em forma metálica, mas sim na forma de óxido, o dióxido de titânio (TiO2) (FILHO, 2007).
O dióxido de titânio apresenta propriedades interessantes, tais como alta dureza, baixa reatividade química, alto índice de refração e semicondutância fotossensível. Em sua forma alotrópica rutilo, é utilizado como pigmento opacificante em tintas, plásticos, papéis e cremes dentais (NOGUEIRA, 1998). A indústria de pigmentos consome mais que 90% de todo o TiO2 extraído no planeta. O dióxido de titânio nanocristalino se torna transparente à luz visível, mantendo suas propriedades de espalhamento e reflexão de raios UV, sendo por esta razão, utilizado em protetores solares. É também utilizado como fotocatalisador para a degradação de poluentes orgânicos na água, em função de sua capacidade de gerar hidroxilas em meio aquoso (FILHO, 2007; FORCE, 1991). Características como o
bandgap, índice de refração (η) e constante dielétrica (ε) fazem com que o TiO2, preferencialmente em sua fase polimórfica anatase, seja um material atrativo para a construção de fotoeletrodos para células solares sensibilizadas por corante (CSSCs) (NOGUEIRA, 2001).
Tabela 5: Comprimentos de ligação e densidade do TiO2 nas fases anatase, bruquita e rutilo.
Anatase Bruquita Rutilo
Sistema cristalino Tetragonal Ortorrômbico Tetragonal
Parâmetro rede → a (Å) 3,784 9,184 4,584
Parâmetro rede → b (Å) 5,447
Parâmetro rede → c (Å) 9,515 5,145 2,953
Comprimento ligação Ti – O (Å) 1,92 – 1,95 1,87 – 2,04 1,91 – 1,94
Densidade (g.cm-3) 3,89 4,12 4,25
Fontes: (SMYTH, 1997) (TSAI, L.; HUANG, L., 2003) (PARK et al., 2009)
A fase cristalina rutilo apresenta estrutura que consiste de redes de octaedros de TiO6 que compartilham um par de arestas opostas, arranjados no sistema cristalino tetragonal (Figura 8). A estrutura tridimensional se forma pelo compartilhamento de vértices dos octaedros. Todas as distâncias entre átomos de Ti são iguais (WELLS, 1975). Os octaedros do rutilo apresentam menor distorção ortorrômbica em comparação aos octaedros das fases anatase e bruquita.
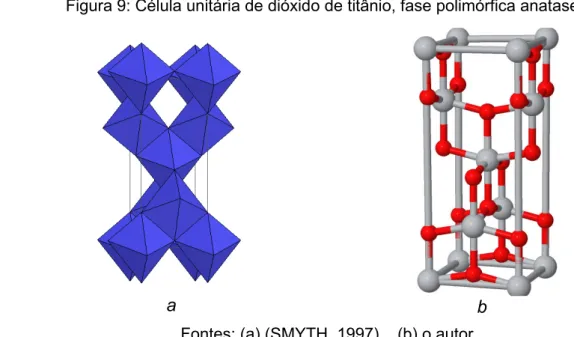
A estrutura da fase anatase é arranjada em um sistema cristalino tetragonal (Figura 9), que consiste de octaedros distorcidos de TiO6 que formam a rede tridimensional com octaedros adjacentes pelo compartilhamento de quatro arestas (PAULING, 1929). O oxigênio tem coordenação trigonal planar (WELLS, 1975).
Figura 8: Célula unitária de dióxido de titânio, fase polimórfica rutilo.
a b
Fontes: (a) (SMYTH, 1997) (b) o autor
Células unitárias da fase rutilo. a) Vista dos octaedros de TiO6. b) Átomos que compõem a
Já a bruquita tem seus octaedros de TiO6 arranjados no sistema cristalino ortorrômbico, cuja célula unitária pode ser vista na Figura 10. Os octaedros de bruquita compartilham três arestas e vértices com octaedros adjacentes, visando obter a composição estequiométrica correta (PAULING, 1929).
As fases anatase e bruquita são metaestáveis, sofrendo transformação irreversível e exotérmica para a fase rutilo quando submetidas a aquecimento em temperatura e tempo adequados (HU et al., 2003; NONÔ, 2005). A transformação
Figura 10: Célula unitária de dióxido de titânio, fase polimórfica bruquita.
Fonte: (SMYTH, 1997)
Figura 9: Célula unitária de dióxido de titânio, fase polimórfica anatase.
Fontes: (a) (SMYTH, 1997) (b) o autor
Células unitárias da fase anatase. a) Vista dos octaedros de TiO6. b) Átomos que compõem
a célula unitária. Esferas cinzas representam átomos de titânio, e esferas vermelhas átomos de oxigênio.
ocorre em um processo de nucleação e crescimento de cristalitos (SHANNON; PASK, 1965).
Gemelli e colaboradores (2006) reportaram o início da transformação de fase anatase - rutilo a aproximadamente 450°C, coexistindo as fases anatase e rutilo até aproximadamente 718°C, temperatura em que se reportou o fim da transformação da fase anatase em rutilo, único óxido estável acima de tal temperatura.
Porém, o critério de estabilidade é função do tamanho de partícula. Observações experimentais mostraram que a fase anatase é a forma alotrópica mais estável em tamanho nanométrico (HU et al., 2003). Zhang e Banfield (2000) concluíram que a fase anatase é a termodinamicamente favorável para cristalitos com tamanho inferior a 11nm, bruquita é a fase mais estável para cristalitos entre 11 e 35nm e rutilo para tamanhos de cristalito acima de 35nm. A força motriz das transformações de fase é a redução da energia livre de superfície dos cristalitos. Segundo Cheng e colaboradores (1995) as propriedades eletrônicas e fotocatalíticas do TiO2 são melhores quando o tamanho de partícula é pequeno.
A transformação de fase anatase - rutilo também é dependente do pH do meio no processo de obtenção do TiO2. Hu e colaboradores (2003) reportaram a presença de rutilo em temperaturas acima de 450°C para pH=2 e de 600°C para pH=9. Observaram também as transformações de fase anatase–rutilo e bruquita–rutilo para baixos valores de pH. Por outro lado, não observaram a presença de bruquita com valores altos de pH, caracterizando somente a transformação anatase–rutilo, e concluíram que a presença de bruquita aumentou as temperaturas de início e fim da transformação anatase – rutilo.
2.8 SÍNTESE DE TIO2 PELO MÉTODO SOL-GEL
magnésio (MgO), dióxido de titânio (TiO2), entre outros (FILHO, 2007). Na década de 1980 observou-se um crescimento significativo no interesse pelo processo sol-gel, crescimento este motivado por diversos fatores, tais como baixa temperatura de processamento e a pureza e homogeneidade que podem ser obtidas nos produtos (HENCH, 1990). Tais fatores têm como consequência redução no custo de processo e na emissão de poluentes, mostrando-se um método promissor para a obtenção de filmes. O método baseia-se no preparo e manipulação controlada de suspensões coloidais, que pode gerar uma ampla variedade de composições e morfologias pela variação de alguns parâmetros simples como concentração e temperatura de preparo (FILHO, 2007).
Colóides são partículas com dimensões entre 1 e 100 nm (HENCH, 1990). Sistemas coloidais apresentam duas ou mais fases em equilíbrio metaestável, sendo uma fase dispersa de partículas coloidais distribuída em um meio contínuo, a fase dispersante. Nestes sistemas não há dispersão em nível molecular nem divisão aparente de fases. Podem ser preparados por dispersão, condensação ou pela combinação dos dois métodos. Sistemas coloidais preparados por dispersão têm seu processamento caracterizado pela fragmentação de agregados, ao passo que o processo de condensação caracteriza-se pelo agrupamento de moléculas em estruturas (FILHO, 2007).
Tabela 6: Diferentes sistemas coloidais e suas respectivas fases
Sistema Fase dispersa Fase dispersante
Sol Sólidos finamente divididos Líquida
Gel Agregados ou moléculas interligadas em
estrutura tridimensional Líquida
Dispersão sólida Sólida Sólida
Emulsão Líquida Líquida
Aerossol Sólida ou líquida Gasosa
Aerogel / xerogel Agregados ou moléculas interligadas em estrutura tridimensional Gasosa
Fonte: (FILHO, 2007; HENCH, 1990)
Segundo Hench (1990), quando o líquido dos poros é removido da rede sólida interconectada do gel como uma fase gasosa sob condições hipercríticas, a rede não colapsa, e um aerogel de baixa densidade é formado. Um xerogel é formado quando o líquido dos poros é removido em pressão ambiente por evaporação térmica, ocorrendo uma retração.
No método sol-gel, podem ser utilizados como precursores sais ou alcóxidos, sendo que a rota com alcóxidos aparece como a mais versátil para a obtenção de sóis estáveis e com partículas de dimensões nanométricas (ALFAYA; KUBOTA, 2002). Tal método utilizando como precursor o tetraisopropóxido de titânio é de grande interesse por seu baixo custo e viabilidade comercial. Grupos de pesquisa têm produzido bons fotoeletrodos para células solares sensibilizadas por corante com filmes de TiO2 nanoparticulado obtido a partir do método sol-gel (TIPPARACH et al, 2008).
Barbé e colaboradores (1997) produziram TiO2 nanoparticulado pelo método sol-gel a partir do tetraisopropóxido de titânio em solução ácida (pH = 1) e alcalina (pH = 11 e pH = 13), obtendo materiais com área superficial (BET) de 108m2/g, 76m2/g e 42m2/g, respectivamente, em tratamento de autoclave a 250°C.
titânio, em solução ácida (ácido nítrico). Obteve teores de fase anatase de 63% e tamanho médio de cristalito de 12,4nm para o precursor isopropóxido de titânio e para o n-butóxido de titânio um teor de 52% de anatase, com tamanho médio de 14,6nm em pós aquecidos a 500°C por 3 horas. Foram obtidos valores de área superficial de aproximadamente 75m2/g e 50m2/g, respectivamente, para cada um dos precursores. Os materiais obtidos foram aquecidos a diferentes temperaturas, de 100°C a 900°C, havendo predominância da fase anatase até 500°C. Acima de 500°C foi observado um crescimento significativo dos cristalitos, reduzindo a área superficial. Concluiu que, dentre as rotas analisadas, a rota sol-gel com tetraisopropóxido de titânio apresenta as vantagens de apresentar a maior estabilidade de fase anatase, além de possibilitar a eliminação de etapas de processo, tais como a decantação, tratamento hidrotérmico e a queima, entretanto, foi a rota que demandou mais tempo.
Tipparach e colaboradores (2008) utilizaram a rota sol-gel para obter TiO2, predominantemente em fase anatase, a partir de tetraisopropóxido de titânio em solução de ácido nítrico, em atmosfera de nitrogênio e reportaram a obtenção de um material com tamanho médio de cristalito entre 2,7nm e 8,1nm em uma faixa de temperaturas de processamento entre 200°C e 500°C, respectivamente. Observaram também que o tamanho médio de cristalito variou suavemente na faixa entre 200°C e 300°C, mas que, entre 450°C e 500°C, variou abruptamente. Os difratogramas de raios-X mostraram o surgimento da fase rutilo acima de 450°C.
Nogueira (2001) sintetizou TiO2, com predominância de fase anatase, pelo método sol-gel, hidrolisando tetraisopropóxido de titânio em solução ácida, aquecendo posteriormente a 450°C por 30min.
As unidades de hidróxido sofrem então a policondensação, que é a formação tridimensional de partículas a partir dos centros tetraédricos formados pelos átomos de titânio. A reação pode ser observada na Figura 12.
Segundo Alfaya e Kubota (2002), as reações de condensação começam antes das reações de hidrólise terminarem, tornando complexo o mecanismo. Barbé e colaboradores (1997), reportaram a formação instantânea de precipitados brancos durante a adição de cada gota do precursor. Para a formação do sol é necessária a peptização, etapa de processo na qual os precipitados são divididos e dispersados, na presença de íons peptizantes. Os íons peptizantes dissolvidos e adsorvidos na superfície do material em suspensão formam camadas dielétricas, que auxiliam na dispersão. Filho (2007) afirma que o pH do sistema é um fator importante para determinar o tamanho final das partículas de um sol, já que os próprios íons H+ podem ser os íons peptizantes.
À medida em que o líquido dispersante do sol volatiliza, começa a ocorrer a Figura 11: Mecanismo de reação de hidrólise do tetraisopropóxido de titânio
sua transformação em gel, com redes tridimensionais de TiO2. Segundo Hench (1990), as características físicas da rede do gel dependem fortemente do tamanho de partícula e da extensão de ligações cruzadas antes da gelificação, etapa em que a viscosidade aumenta rapidamente. Para Hench (1990), o ponto de gelificação de qualquer sistema pode ser facilmente observado de forma qualitativa, porém, extremamente difícil de ser medido de forma analítica.
O gel obtido é submetido a secagem para a obtenção de um xerogel, a ser calcinado em etapa subsequente. Para Alfaya e Kubota (2002), as propriedades físicas de um xerogel, tais como área superficial, tamanho de poros e sua distribuição, dependem fortemente dos parâmetros de processo da rota sol-gel. Tal sistema, mais rígido, ainda é composto por redes tridimensionais.
Quando o xerogel é calcinado, ocorre a densificação e o aumento da cristalinidade. Em função da coalescência das partículas originais, ocorre o colapso dos poros. Controlando-se variáveis como tempo e temperatura de calcinação, pode-se encontrar um bom equilíbrio entre porosidade e cristalinidade. Hench (1990) reportou que as variáveis de maior importância no processo sol-gel são temperatura, natureza do líquido dispersante e tipo do precursor alcóxido.
3 MATERIAIS E MÉTODOS
O procedimento experimental foi dividido em 3 fases, conforme ilustra a Figura 13. Foram construídas células solares com diferentes fotoeletrodos. Na célula de referência foi produzido o fotoeletrodo a partir do dióxido de titânio P25 (Evonik Degussa).
Para as células de análise foram produzidos pós de dióxido de titânio pelo método sol-gel, tendo como precursor tetraisopropóxido de titânio (Ti[OCH(CH3)2]4). Após a produção e caracterização dos fotoeletrodos, as células solares foram montadas e caracterizadas.
3.1 CÉLULA FOTOVOLTAICA DE REFERÊNCIA (P25) - FOTOELETRODO
O procedimento experimental foi iniciado com a caracterização do TiO2 P25 (Degussa) por difração de raios-X (DRX), objetivando conhecer os teores de cada fase do material e estimar o tamanho médio de cristalito. Para tal, foi utilizado um difratômetro Shimadzu XRD6000 , utilizando alvo de cobalto (radiação Kα com λ=1,7890Ẳ), potência de 40kV, corrente de 30mA, com taxa de varredura de 2°min-1. Foi, então, iniciada a preparação da suspensão de TiO2 para a deposição dos filmes, com base nos métodos utilizados por Barbé et al. (1997), Filho (2007) e Nogueira (1998). Em um béquer, foi produzida uma solução de Triton X100 (0,1mL) em água deionizada (0,5mL). Em um almofariz, foram misturados 6g de TiO2 P25 (Evonik Degussa), 2,0mL de água deionizada e 0,2mL de acetilacetona, sem exercer forte pressão com o pistilo, por aproximadamente 30min, até que uma coloração esverdeada foi obtida. Foram, então, adicionadas 3 porções de 2,5mL de água deionizada, gota a gota, e a solução de Triton X100, detergente que tem a função de melhorar as condições de deposição da suspensão sobre o substrato condutor transparente. A suspensão obtida foi transferida para um recipiente fechado e protegido de radiação ultravioleta.
Foi, então, realizada a limpeza dos eletrodos condutores transparentes, substrato onde o filme é depositado. Tal substrato é composto por vidro de cal de soda, recoberto por com uma fina camada de dióxido de estanho dopado com flúor (FTO – Fluorine Tin Oxide), que garante ao substrato baixa resistividade elétrica
(~7Ω/cm2), mantendo boa transmitância (> 80% na região do visível). A limpeza foi realizada conforme ilustra o fluxograma da Figura 14, em lavadora ultrassônica, com frequência de 25KHz e potência de 154Watts.
Para a deposição da suspensão, foram fixados os substratos condutores transparentes (FTO) em superfície plana, com a face condutora para cima, utilizando
Figura 14: Fluxograma do processo de limpeza dos eletrodos condutores transparentes
Fonte: o autor Banho de ultrassom:
Solução Triton X100 em água deionizada
t = 15 min 1
Imersão das placas em água deionizada a 60°C
t = 30 min 2
Banho de ultrassom com isopropanol
t = 15 min 3
Imersão das placas em água deionizada a 60°C
t = 30 min 4
Banho de ultrassom com metanol
fita adesiva (Scotch Magic Tape – 3M). Além de fixação da lâmina, a fita atuou como molde para os filmes nas lâminas, tendo cada cavidade uma área de 25mm2 (5 x 5mm). Foi, então, gotejada a suspensão nas cavidades do molde, sendo então espalhada com bastão de vidro (Método Doctor Blading). A Figura 15 mostra uma
lâmina moldada, logo após a aplicação da suspensão de TiO2, após rolagem de bastão de vidro e após desmoldagem. Foi realizada a desmoldagem dos fotoeletrodos, que tiveram secagem ao ar por 10min, seguida de secagem em estufa a 50°C por 20min.
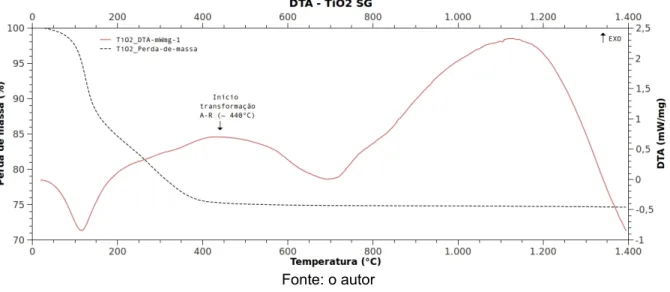
Os fotoeletrodos foram, então, submetidos a tratamento térmico, que consistiu no aquecimento a uma taxa de 5°C/min até o patamar de 450°C com o tempo no patamar variando em 10min, 30min e 50min. Foi escolhida a temperatura de 450°C visando formar a rede tridimensional de cristalitos, sem perder a predominância da fase anatase. Gemelli et al. (2006) observaram o início da transformação de fase anatase – rutilo a aproximadamente 450°C. Tsai e Huang (2003) constataram que a transformação de fase anatase – rutilo iniciou logo acima do patamar térmico de 450°C para sóis com baixo pH (pH=2).
3.2 CÉLULA FOTOVOLTAICA DE ANÁLISE (SG) - FOTOELETRODO
Para a produção do fotoeletrodo da célula fotovoltaica de análise (SG), inicialmente foi obtido o TiO2, por meio do método sol-gel, utilizando como precursor o tetraisopropóxido de titânio, que foi hidrolisado em meio ácido (ácido nítrico).
Figura 15: Lâmina de FTO (a) após aplicação da suspensão de TiO2, (b) após aplicação
do bastão de vidro e (c) após desmoldagem
a b c
3.2.1 Obtenção De TiO2 Pelo Método Sol-gel
Para a produção de anatase foi escolhida a rota sol-gel, sendo utilizado como precursor tetraisopropóxido de titânio. A Figura 16 mostra o fluxograma macro do processo de produção de TiO2 pelo método sol-gel, que inicia pela preparação do sol.
Inicialmente, foi preparada uma solução de 0,9mL de HNO3 em 128mL de água deionizada, sendo, então, medido pH = 1. Foram, então, adicionados 21,1mL de tetraisopropóxido de titânio Ti(i-OPr)4, gota a gota, em temperatura ambiente, sob agitação vigorosa. Formou-se, a cada gota do precursor na solução, um precipitado branco de aspecto floculado. Tal precipitado indica a formação de Ti(OH)4 por policondensação, reação esta que ocorre simultaneamente com a hidrólise do precursor (FILHO, 2007).
Após a adição de Ti(i-OPr)4, foi medido o pH (pH ~ 1) e colocado o material em repouso para a reação de peptização, a qual durou aproximadamente 4 dias (94h). O pH não alterou significativamente até o fim da peptização, ficando próximo de 1. A Figura 17 mostra a aparência da mistura nos diferentes estágios de peptização, desde o início, quando é possível a visualização dos precipitados de aspecto floculado até o final, quando está formada uma suspensão coloidal, o sol.
Figura 16: Fluxograma do processo de produção de TiO2 pelo método sol-gel