Universidade de Trás-os-Montes e Alto Douro
Mestrado em Biologia Clínica Laboratorial
Avaliação da acção do pó da folha de oliveira (D-lenolato) em
indicadores fisiológicos do murganho
Dissertação de Mestrado apresentada por
Regina Arantes
Sob Orientação
Universidade de Trás-os-Montes e Alto Douro
Mestrado em Biologia Clínica Laboratorial
Avaliação da acção do pó da folha de oliveira (D-lenolato) em
indicadores fisiológicos do murganho
Dissertação de Mestrado em Biologia Clínica Laboratorial, submetida à Universidade de Trás-os-Montes e Alto Douro, para cumprimento dos requisitos necessários à obtenção de grau de Mestre em Biologia, elaborada sob a orientação das Professoras Doutoras Paula A. Oliveira e Aura Colaço.
Orientadores:
Professora Doutora Paula A. Oliveira
Departamento de Ciências Veterinárias, UTAD
Professora Doutora Aura Colaço
A presente dissertação termina após um ano de grande dedicação e esforço. Contudo este trabalho não seria possível sem as pessoas e instituições, que directa ou indirectamente intervieram. Assim sendo expresso os meus mais que agradecimentos:
À Professora Doutora Paula Oliveira, orientadora da presente dissertação. Todo o seu empenho tem sido uma lição e um exemplo de vida para mim. O seu apoio incondicional e a sua disponibilidade dedicada foram uma constante desde o primeiro dia. Por todos os conhecimentos transmitidos, pela leitura crítica da presente dissertação, pelo seu entusiasmo, incentivo, amizade e encorajamento que nunca faltaram, os meus sinceros agradecimentos!
À Professora Doutora Aura Colaço, minha orientadora. O meu muito obrigado por todo o apoio prestado, pela leitura crítica da dissertação, pelo incentivo e motivação.
À Professora Maria dos Anjos Pires por ter disponibilizado o Laboratório de Histopatologia da Universidade de Trás-os-Montes e Alto Douro para o processamento do material e para a realização das diferentes técnicas de histologia.
À técnica de Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro, Srª Dª Lígia Bento, pela preciosa ajuda no processamento do material e na realização dos cortes histológicos e colorações histoquímicas.
À Professora Doutora Maria João Pires agradeço pela ajuda na interpretação dos dados relativos às análises bioquímicas.
Ao Professor Francisco Peixoto pela sua disponibilidade na realização e ajuda na interpretação dos resultados relativos ao estudo bioenergético.
À Srª Dª Ana Maria Machado, obrigada por todo o auxílio prestado na limpeza e desinfecção do material utilizado.
À Andreia Henriques, minha colega de trabalho. Obrigada por todo o apoio prestado e pela amizade que daqui surgiu.
A todos os elementos do curso de Biologia que de algum modo estiveram presentes no meu percurso académico.
Às minhas primas Helena e Carina, às minhas amigas Isabel, Filipa e Raquel, que mesmo estando longe de mim sempre estiveram presentes na minha memória, apoiando-me em tudo… Obrigado pela amizade que nos tem unido ao longo de todos estes anos!
À Carina Boavida, obrigada pela amizade e apoio que sempre demonstrou.
À Ana Isabel, ela que sempre me compreendeu e me apoiou. Nos momentos de menos esperança, desânimo e cansaço esteve sempre a meu lado, com um pequeno gesto ou com uma simples palavra.
A todas as pessoas e colegas de trabalho que se cruzaram no meu caminho durante a realização desta dissertação e que sempre me apoiaram…
Ao Nelson, por todo o seu apoio, amizade, incentivo e encorajamento.
À Lúcia e à Bruna, elas que foram das pessoas que melhor me acompanharam ao longo desta caminhada. Nos melhores e piores momentos vocês estiveram sempre presentes, convosco ri e convosco chorei. Pela forte amizade que sempre tivemos, OBRIGADO!
Às minhas irmãs, irmão e cunhado, Dora, Marta, José Carlos e Rodrigo. Obrigado pelo que sempre significaram para mim, pelo vosso apoio, incentivo e amizade… À Inês, minha sobrinha, que sendo apenas uma criança sempre me soube
amor, apoio, carinho, compreensão e encorajamento que nunca me faltou, por tudo o que hoje sou, MUITO OBRIGADO!!!
Agradecimentos II Índice V
Índice de Quadros VIII
Índice de Figuras IX
Quadro de Abreviaturas XI
Resumo XII Abstract XIII
1. Introdução 1
1.1. Importância das plantas 1
1.2. A oliveira (Olea europaea L.) 1
1.3. Produtos com origem na oliveira 2
1.3.1. Azeitona e azeite 2 1.3.2. Folha de oliveira 3 1.4. Compostos fenólicos 4 1.4.1. Oleuropeína 5 1.4.2. Hidroxitirosol 6 1.5. D-lenolato 7 1.6. Mus musculus 7
1.6.1. O murganho como animal de experimentação 7 1.6.2. Manutenção do murganho em laboratório 8
1.7. Fígado do murganho 9 1.7.1. Aspecto macroscópico 10 1.7.2. Aspecto microscópico 10 1.7.3. Funções do fígado 11 1.8. Bioenergética 11 1.8.1. A mitocôndria 11
1.8.2. A mitocôndria: modelo para o estudo da toxicidade 12
2. Objectivos 14
3. Material 15
4.1. Condições experimentais 16
4.2. Características do alimento 17
4.3. Características do pó da folha de oliveira 17 4.4. Procedimento utilizado para a preparação da dieta 17
4.5. Procedimentos experimentais 18
4.5.1. Pesagens 18
4.5.2. Índice de perdas 19
4.5.3. Índice de Homogeneidade ponderal (Hp) 19
4.5.4. Ganho ponderal (Gp) 19
4.5.5. Eutanásia dos animais 20
4.5.6. Recolha das amostras 20
4.5.7. Estudo histológico e histopatológico 20 4.5.7.1. Técnica de coloração pela hematoxilina-eosina 21 4.5.7.2. Técnica de coloração pela reticulina 21
4.5.7.2.1. Metodologia 21
4.5.7.3. Técnica de coloração pelo tricómio de masson 23
4.5.7.3.1. Metodologia 23
4.5.7.4. Classificação histológica 24
4.5.8. Parâmetros bioquímicos 24
4.5.9. Estudo bioenergético 25
4.5.9.1. Isolamento das mitocôndrias de fígado do murganho
25
4.5.9.2. Quantificação da proteína – Método do Biureto 25
4.5.9.3. Consumo de oxigénio 26
4.5.9.4. Medição do potêncial membranar mitocôndrial 27
4.5.9.5. Ensaios enzimáticos 28
4.5.9.6. Medição da peroxidação lipídica 29 4.5.9.7. Ensaio do peróxido de hidrogénio 29
4.5.10. Estatística 30
5. Resultados 31
5.4. Variação média do peso corporal 33
5.4.1. Consumo de água 33
5.4.2. Consumo de alimento 33
5.5. Aspecto geral dos animais 35
5.6. Variação do peso médio inicial e peso médio final dos murganhos e dos órgãos recolhidos
36
5.7. Pesos relativos dos diferentes órgãos entre os animais dos diferentes grupos
36
5.8. Exame macroscópico 39
5.9. Estudo histopatológico 39
5.9.1. Avaliação da reticulina 44
5.9.2. Avaliação do tricómio de masson 48
5.10. Avaliação dos parâmetros bioquímicos 52
5.11. Estudo bioenergético 53
5.11.1. Respiração e fosforilação oxidativa das mitocôndrias isoladas
53
5.11.2. Potêncial transmembranar mitocôndrial 55 5.11.3. Actividade enzimática da cadeia de electrões mitocôndrial 56
5.11.4. Susceptibilidade das mitocôndrias ao stresse oxidativo atribuído ao pó da folha de oliveira
57
6. Discussão 60
7. Conclusão 65
Quadro 1 Condições ambientais necessárias para a manutenção de murganhos 9
Quadro 2 Vitaminas e minerais presentes na ração 17
Quadro 3 Índice de perdas 31
Quadro 4 Índice de homogeneidade ponderal 32
Quadro 5 Ganho ponderal 32
Quadro 6 Animais que apresentaram icterícia no decorrer do trabalho
experimental nos diferentes grupos
35
Quadro 7 Variação do peso médio inicial e peso médio final dos murganhos e
dos órgãos recolhidos (média±SD)
37
Quadro 8 Pesos relativos dos diferentes órgãos entre os animais dos diferentes
grupos (média±SD) segundo a fórmula (peso médio dos órgãos por grupo/peso médio final dos animais por grupo)
38
Quadro 9 Lesões histológicas identificadas no fígado dos animais do grupo
controlo e dos animais alimentados com o pó da folha de oliveira nas três concentrações diferentes
41
Quadro 10 Resultados da expressividade da reticulina nos diferentes grupos
do ensaio experimental
45
Quadro 11 Resultados obtidos com a coloração tricómio de masson 49
Quadro 12 Parâmetros avaliados nos diferentes grupos experimentais
(média±SD)
53
Quadro 13 Efeito do tratamento com o pó da folha de oliveira nos índices
respiratórios
54
Figura 1 Procedimento experimental 15
Figura 2 Exemplificação de uma etiqueta 16
Figura 3a Ração proveniente da Harlan Teklad 18
Figura 3b Dieta preparada para o ensaio 18
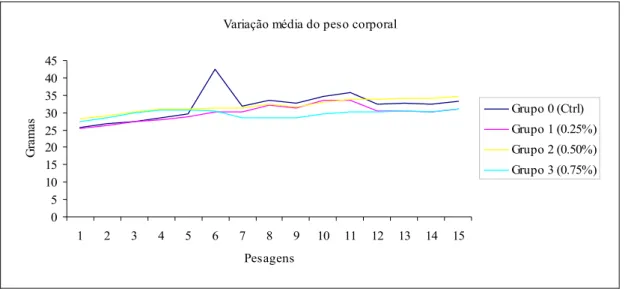
Figura 4 Variação média do peso corporal 34
Figura 5 Variação do consumo médio de água 34
Figura 6 Variação do consumo médio de alimento 34
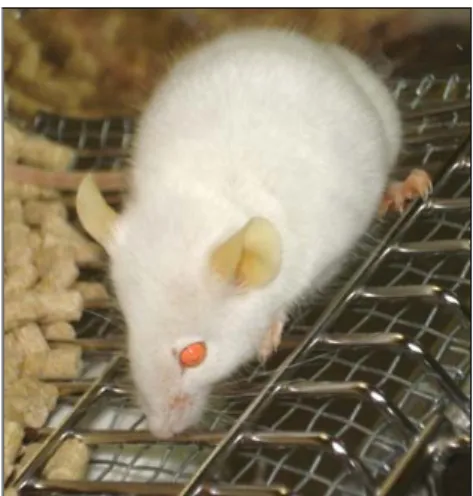
Figura 7 Aspecto geral de um murganho ictérico 35
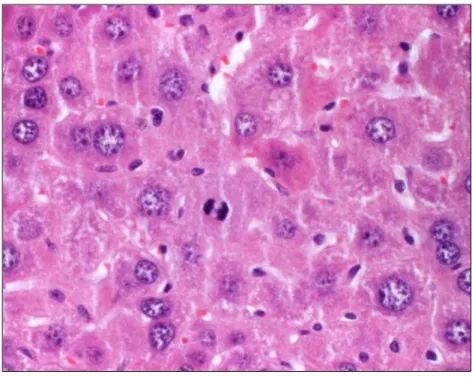
Figura 8 Arquitectura normal do fígado (H&E, 200x) 42
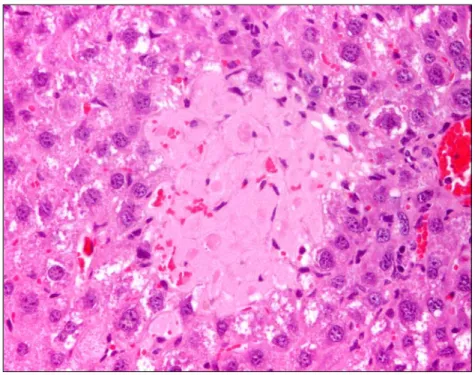
Figura 9 Hiperplasia dos ductos biliares (H&E, 200x) 43
Figura 10 Área de necrose (H&E, 400x) 43
Figura 11 Mitose (H&E, 600x) 44
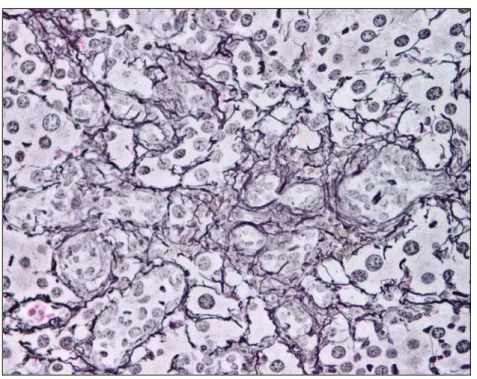
Figura 12 Expressividade da reticulina no fígado de um animal pertencente
ao grupo controlo (200x)
46
Figura 13 Aumento da expressividade da reticulina no parênquima hepático
(400x)
47
Figura 14 Observar a formação de pontes de colagénio entre espaços porta
adjacentes (reticulina, 100x)
47
Figura 15 Expressividade do tricómio de masson no fígado de um animal
pertencente ao grupo controlo (200x)
50
Figura 16 Presença de colagénio no parênquima hepático (tricómio de
masson, 200x)
51
Figura 17 Formação de pontes entre espaços porta adjacentes (tricómio de
masson, 100x)
51
Figura 18 Efeito do tratamento com o pó da folha de oliveira na
concentração de 0.75% na taxa respiratória das mitocôndrias hepáticas. As mitocôndrias (1 mg) foram incubadas em 1 mL de meio respiratório padrão. O estado 4 da respiração foi iniciado com a adição de 10 mM de succinato (a branco). O estado 3 da respiração foi energizado pela adição de 5 mM de succinato e iniciado com a adição de 1.5 mM de ADP (a cinzento). *Valores estatisticamente significativos (p <0.05).
dos murganhos. As linhas do gráfico representam os resultados recolhidos de vários ensaios com quatro preparações diferentes de mitocôndrias na bioenergética mitocôndrial.
Figura 20 Efeito do tratamento com 0.75% do pó da folha de oliveira na
permeabilidade do poro de transição induzido pelo cálcio em mitocôndrias isoladas do fígado do murganho. As linhas representam os registos típicos de vários ensaios com quatro amostras diferentes de mitocôndrias.
56
Figura 21 Taxa e extensão da oxidação mitocôndrial induzida pelo
ADP/Fe2+ avaliada como consumo de oxigénio. As linhas representam os valores observados após análise de quatro amostras diferentes.
58
Figura 22 Peróxido de hidrogénio produzido pelas mitocôndrias frescas
isoladas do fígado dos murganhos com uma dieta suplementada com 0.75% do pó da folha de oliveira e dos murganhos do grupo controlo. Os ensaios na ausência de inibidores da respiração mitocôndrial estão representados a branco. Os ensaios que decorreram na presença de 1 µM de rotenona e 10 µM de antimicina A estão representados a cinzento. *Valores estatisticamente significativos (p <0.05).
A Ausente KI Iodeto de potássio
ADN Ácido desoxirribonucleico K3PO4 Fosfato de potássio
ADP Adenosina difosfato KH2PO4 di-hidrogenofosfato de potássio
ADP/O Adenosina difosfato + Oxigénio
L Lobular
ADP/Fe2+ Adenosina difosfato/Ferro Li Linfócitos
ADP+Pi Adenosina difosfato + Fosfato inorgânico
M Moderado
ALT Alanina aminotransferase Ma Muito alterada
ATP Adenosina trifosfato Mc Macrófagos
BSA Albumina do soro de bovino MgCl2 Cloreto de magnésio
C Conservada MPT Poro de transição mitocôndrial
Ce Células epitelioides MPTP Poro de transição da
permeabilidade mitocôndrial
Cl Centrolobular N Não
Cp Com ponte Ne Neutrófilos
Ctrl Controlo No Nodular
CuSO4.5H2O Sulfato de cobre
pentahidratado
NADH Dinucleotídeo adenina nicotinamida
D Difuso NaOH Hidróxido de sódio
Eo Eosinófilos Na2SO4 Sulfato de sódio
Ep Em ponte NaKC4H4O6.4H
2O
Tartarato de sódio e potássio
EGTA Ácido tetraacético
etileno glicol
P Portal
F Focal Pa Pouco alterada
FA Fosfatase alcalina Po Pouco
FADH2 Dinucleotídeo adenina flavina PVC Cloreto de polivinil
FeSO4 Sulfato de ferro P1 Peso inicial
G Granulomas P2 Peso final
Gp Ganho ponderal Pi Peso inferior
Hp Homogeneidade ponderal Ps Peso superior
Hepes 2-[4-(2-hidroxietil) 1-piperazinil] -etanosulfónico
RCR Estado 3/estado 4
HRP Peroxidase “horseradish” ROS Espécies reactivas de oxigénio
HVA Ácido homovalínico S Sim
H2O2 Peróxido de hidrogénio SDS Dodecilsulfato de sódio
H&E Hematoxilina-eosina TPP+ Catião lipofílico tetrafosfónio
I Intenso v Volume mitocôndrial
Il Intralobular V Volume do meio de incubação
IP Índice de perdas ǻE Deflexão do potêncial do eléctrodo
KCl Cloreto de potássio ǻȥ Potêncial membranar
O pó da folha de oliveira, devido aos compostos fenólicos presentes na sua constituição, é utilizado como um suplemento dietético e considerado eficaz na prevenção e no tratamento de doenças cardiovasculares e vários tipos de cancro.
O objectivo deste trabalho experimental foi avaliar os efeitos do pó da folha de oliveira no fígado e em parâmetros hepáticos de fêmeas de murganho, da estirpe ICR, com 4 a 5 semanas de idade. À ração comercial Teklad Global Diet (Harlan-Interfauna, Espanha) foi adicionado pó da folha de oliveira em três concentrações diferentes (0.25%, 0.50% e 0.75%). Os animais foram distribuídos ao acaso por quatro grupos, um grupo controlo e três grupos suplementados com o pó da folha de oliveira. O ensaio experimental teve a duração de 14 semanas. No fim do ensaio, foram recolhidas amostras de vários órgãos e de sangue, para avaliar: alterações histológicas, a função hepática e stresse oxidativo.
Nos grupos alimentados com as concentrações de 0.50% e 0.75% do pó da folha de oliveira morreram 2 e 5 animais, respectivamente. Nestes mesmos grupos alguns animais apresentaram icterícia e perda de peso. No grupo suplementado com 0.75% do pó da folha de oliveira observaram-se alterações macroscópicas nos fígados, nomeadamente a coloração esverdeada, a dilatação dos ductos biliares e a vesícula biliar distendida. No estudo histológico dos vários órgãos recolhidos não se observaram alterações, à excepção do fígado. Na análise histológica do grupo suplementado com maior concentração do pó da folha de oliveira observou-se alteração da arquitectura normal do fígado, nomeadamente hiperplasia dos ductos biliares, áreas de necrose e mitoses. Nos ensaios da respiração observámos uma diminuição significativa da respiração no grupo suplementado com a maior concentração do pó da folha de oliveira. As alterações morfológicas do fígado induzidas pela dieta suplementada com o pó da folha de oliveira podem estar relacionadas com a diminuição da energia da célula resultante da má funcionalidade da mitocôndria.
Os resultados por nós obtidos sugerem que ao contrário do que alguns autores afirmam, o extracto da folha de oliveira não é um produto benéfico para a saúde, podendo conter substâncias que o tornam num produto perigoso e tóxico.
The olive leaf extract, due to the phenolic compounds present in its constitution, is used as a dietary supplement, considered effective in the prevention and treatment of cardiovascular diseases and several types of cancer.
This experimental work aimed to assess the effect of olive leaf extract in both liver and liver parameters of female ICR strain of mice with 4 to 5 weeks of age. To the Teklad Global Diet (Harlan-Interfauna, Spain) feed was added olive leaf extract in three different concentrations (0.25%, 0.50% and 0.75%). Animals were distributed randomly in four groups, one control group and three groups supplemented with olive leaf extract. The experimental test had the duration of fourteen weeks. At the end of the test, samples were collected from several organs and blood, to evaluate: histological changes, liver function and oxidative stress.
In groups fed with 0.50% and 0.75% concentrations of olive leaf extract, 2 and 5 animals died respectively. In these groups some animals showed icterus and lost weight. In group supplemented with 0.75% of olive leaf extract, there were observed macroscopic changes in livers, namely a green coloration, expansion of bile ducts and gallbladder slack. In the histological study of various organs collected, no changes were observed, with the exception of the liver. In the histological analysis of group supplemented with highest concentration of olive leaf extract there were changes in the normal architecture of the liver namely hyperplasia of the bile ducts, areas of necrosis and mitoses. In the test of respiration, it was observed a significant decrease of breathing in the group supplemented with the highest concentration of olive leaf extract. Morphological changes in the liver induced by supplemented diet with olive leaf extract may be related to the reduction of cell energy resulting from the inadequate feature of mitochondria.
The results we obtained suggest that contrary to what some authors say, that the olive leaf extract is not a beneficial product to health, and may contain substances that make it a dangerous and toxic product.
1. Introdução
1.1. Importância das plantas
As plantas como alimentos ou no âmbito botânico têm sido utilizadas com sucesso na cura e na prevenção de doenças ao longo da história (Raskin et al., 2002). O consumo de frutas e vegetais está associado a uma diminuição na incidência do cancro, da osteoporose, da diabetes e das doenças cardiovasculares, entre outras (Lotito e Frei, 2006; Rao e Rao, 2007). Os efeitos protectores das dietas, ricas em frutos e vegetais, contra as doenças cardiovasculares e o cancro foram atribuídos principalmente aos antioxidantes que deles fazem parte, nomeadamente os compostos fenólicos (Benavente-Garcia et al., 2000; D’Angelo et al., 2001; Briante et al., 2002; Hamdi e Castellon, 2005; Singh et al., 2006).
Uma das classes de compostos fenólicos de maior prevalência nos vegetais, na fruta e em bebidas obtidas de plantas (chá, café e vinho tinto) são os flavonóides (Lolito e Frei, 2006; Moon et al., 2006). Estes compostos fenólicos são considerados promotores da saúde e utilizados como suplementos dietéticos na prevenção de doenças. São considerados seguros e estão associados a uma baixa toxicidade (Moon et al., 2006).
1.2. A oliveira (Olea europaea L.)
A oliveira pertence à família das oleáceas (do latim olivum), é uma árvore dicotiledónea, do género Olea e da espécie Olea europaea L. (Ferreira, 2007). É das árvores mais citadas na literatura botânica e das mais importantes nos países mediterrânicos. Ocupa uma superfície de 8 milhões de hectares, o que demonstra a sua importância ao nível económico e social (Ferreira et al., 2007). Distingue-se das outras espécies frutíferas pela sua longevidade, chegando a existir árvores com centenas de anos. É um símbolo de paz, de sabedoria e de vitória (Soni et al., 2006).
Dependendo do local onde se encontram, as oliveiras florescem entre o final de Abril e o princípio de Junho. É uma árvore de folha perene, com folhas de cor cinza a
esverdeado. Na Primavera dá origem a pequenas flores hermafroditas de cor branca, que podem ser funcionalmente monossexuadas. Estas folhas, estreitas e pontiagudas, possuem uma epiderme superior muito cutinizada e pêlos na parte inferior que contribuem para reduzir a taxa de transpiração e proteger a árvore da desidratação. As suas raízes podem chegar a uma profundidade de 6 metros. Devido ao seu sistema radicular, esta árvore adapta-se facilmente a todos os tipos de solos, crescendo quer em solos silícos quer em solos calcários. As suas profundas raízes procuram no solo todos os elementos de que necessita para o seu desenvolvimento, conseguindo resistir a longos períodos de seca (Caldeira, 2002).
O início do cultivo da oliveira coincide com a expansão da civilização Mediterrânea. Cultivada inicialmente na Ásia rapidamente se alargou ao Mediterrâneo, começando a ser cultivada em Portugal, Marrocos, Tunísia, Grécia e Itália, entre outros (Lee-Huang et al., 2003; Molina-Alcaide e Yáñez-Ruiz, 2007). Além da sua história na civilização, a oliveira tem sido alvo de estudos a nível médico e nutricional. O primeiro estudo científico sobre o uso da oliveira em Medicina data de 1854, quando o pó da folha de oliveira foi estudado para o tratamento da febre e da malária (Lee-Huang et al., 2003). Actualmente, a medicina popular utiliza o pó da folha de oliveira devido às suas propriedades anti-sépticas e diuréticas (Abaza et al., 2007; Ferreira et al., 2007).
1.3. Produtos com origem na oliveira
1.3.1. Azeitona e azeite
O fruto da oliveira é uma drupa denominada azeitona, um fruto com caroço revestido de uma polpa mole. Enquanto não amadurece é verde e quando madura torna-se preta ou violeta-acastanhada. À medida que a azeitona torna-se detorna-senvolve sofre uma série de modificações na sua composição, as quais podem influenciar de forma decisiva a qualidade da matéria-prima destinada à elaboração quer das azeitonas de mesa quer do azeite. As principais vitaminas presentes nas azeitonas são os carotenos, nomeadamente vitamina A, tiaminae riboflavina. Os principais constituintes da polpa das azeitonas são a água (50%) e o azeite (22%). No entanto, os açúcares (19%), a celulose (5.8%) e as
O cultivo da oliveira produz um alimento utilizado no tempero da comida, o azeite. Trata-se de um alimento antigo, com elevado valor biológico, utilizado na culinária contemporânea e regular na dieta mediterrânea. A sua composição dá-lhe vantagem sobre outras gorduras vegetais, obtidas de sementes e em cuja composição predominam os ácidos gordos polinsaturados, muito mais propensos aos fenómenos de oxidação e portanto, mais instáveis. O azeite contém na sua constituição uma elevada percentagem de ácido oleico (um ácido gordo monoinsaturado) e um teor baixo de ácidos gordos polinsaturados (Caldeira, 2002).
Estudos realizados sugerem que o consumo de azeite, juntamente com a ingestão de vegetais e frutas é considerado benéfico para a saúde, diminuindo a incidência das doenças degenerativas, doenças cardiovasculares e vários tipos de cancro nomeadamente cancro da próstata, da pele, do cólon e da glândula mamária (D’Angelo et al., 2001; Briante et al., 2004; Polzonetti et al., 2004; Hamdi e Castellon, 2005; Luaces et al., 2005; Singh et al., 2006; Escrich et al., 2007). Dietas semelhantes, mas nas quais não são incorporadas frutas, vegetais e produtos derivados da oliveira não são tão protectoras (Hamdi e Castellon, 2005).
1.3.2. Folha de oliveira
O pó da folha de oliveira é comercializado como um suplemento alimentar, está disponível no comércio sob várias apresentações (pó, cápsulas ou xarope). O pó pode ser incorporado na alimentação ou utilizado na preparação de chás. A sua composição é variável, os seus constituintes dependem da sua origem, das condições climáticas do cultivo da oliveira, da humidade relativa e do grau de contaminação dos solos (Molina-Alcaide e Yáñez-Ruiz, 2007).
Desde a segunda metade do século XX que o pó da folha de oliveira tem sido investigado e as suas vantagens para a saúde são consequência dos biofenóis presentes na oliveira. Os biofenóis são absorvidos no tracto gastrintestinal atingindo concentrações significativas na circulação (Abaza et al., 2007; Bao et al., 2007). Estudos com animais revelam que o pó da folha de oliveira diminui a pressão sanguínea, aumenta o fluxo sanguíneo nas artérias coronárias, diminui a incidência das arritmias e previne espamos musculares intestinais (Benavente-García et al., 2000;
Singh et al., 2006; Pereira et al., 2007). Estudos experimentais recentes demonstram que o pó da folha de oliveira tem uma forte capacidade contra a actividade do HIV (Bao et al., 2007).
Os extractos das plantas são alternativas naturais aos antioxidantes sintéticos (Floch et al., 1998). A azeitona, o azeite e a folha de oliveira representam uma valiosa fonte de compostos antioxidantes (Ferreira et al., 2007). Dos compostos antioxidantes fazem parte um grupo heterogéneo de substâncias, como é o caso das vitaminas, dos minerais, dos pigmentos naturais e das enzimas. Estes compostos impedem a oxidação dos constituintes químicos da célula e juntamente com os compostos fenólicos desempenham um papel importante na redução do risco de desenvolvimento de doenças crónicas devido à sua capacidade em proteger o organismo contra os radicais livres (Floch et al., 1998; Soni et al., 2006).
Um radical livre é definido como qualquer átomo, grupo de átomos ou molécula com um electrão não emparelhado ocupando uma orbital externa. O anião superóxido, o radical hidroxilo e o óxido nítrico são exemplos de radicais livres. Estas estruturas são muito instáveis, e de modo a tentar atingir o equilíbrio, desencadeiam reacções que danificam as moléculas e os átomos que estão em seu redor, podendo lesionar o ADN. O tabaco, o sol (raios ultravioleta) e o álcool são ricos em radicais livres. Os radicais livres e a sua produção incontrolável são responsáveis por diversas doenças, tais como tumores (cancro da próstata e do cólon) e doenças coronárias (Briante et al., 2002).
1.4. Compostos fenólicos
Os compostos fenólicos são metabolitos secundários sintetizados pelas plantas face à agressão por microorganismos e radiações ultravioleta. Estão presentes em toda a planta, no entanto, a sua natureza e concentração depende da parte da planta (Floch et al., 1998; Ryan et al., 2002). Caracterizam-se por possuírem uma forte actividade antioxidante (Ryan et al., 2002; Hamdi e Castellon, 2005; Micol et al., 2005; Savarese et al., 2007), sendo esta tão ou mais eficaz do que a actividade de outros compostos antioxidantes, tais como as vitaminas C e E, e o beta-caroteno (Ferreira, 2007). Vários estudos comprovam que os antioxidantes protegem a dupla hélice da molécula de ADN
da ruptura, uma situação frequente na carcinogénese (Valko et al., 2004; Hamdi e Castellon, 2005).
A maioria dos compostos fenólicos são armazenados quase que exclusivamente como conjugados. O produto final da conjugação hepática dos compostos fenólicos é relativamente tóxico. A conjugação melhora a sua solubilidade e pode estar relacionada com o bloqueio de alguns compostos fenólicos em compartimentos intracelulares específicos. A conjugação pode também favorecer o transporte dos compostos fenólicos para o interior das células (Ryan et al., 2002).
Os compostos fenólicos presentes na folha de oliveira constituem uma fracção muito complexa formada por um número variado de produtos, alguns dos quais permanecem por identificar (Ferreira, 2007). Deles fazem parte os pertencentes à família dos secoiridóides, nomeadamente a oleuropeína. Os compostos fenólicos classificados como secoiridóides caracterizam-se pela presença de ácido elenólico na sua molécula e são os mais abundantes na folha de oliveira. Contudo, da folha fazem parte outros fenóis mais simples, é o caso do hidroxitirosol (3,4-dihidroxifeniletanol), do tirosol (3-hidroxifeniletanol), do ácido vanílico, do ácido p-cumárico e do ácido cafeico (Caturla et al., 2005; Micol et al., 2005). As actividades biológicas da folha de oliveira devem-se maioritariamente a estes compostos (Bao et al., 2007). As folhas da oliveira são ricas em biofenóis, dos quais se destacam a oleuropeína e o hidroxitirosol (Micol et al., 2005).
Devido às suas propriedades antioxidantes, os compostos polifenólicos podem contribuir para prevenir doenças coronárias e cancro, quer pela inibição da peroxidação das lipoproteínas de baixa densidade e dos lípidos em geral, quer pela inibição das enzimas envolvidas nos processos inflamatórios (Caturla et al., 2005; Ferreira, 2007).
1.4.1. Oleuropeína
A oleuropeína (C25H32O13) é um éster heterocíclico não tóxico, que foi
descoberta em 1908 por Bourquelet e Vintilesco (Benavente-García et al., 2000; Ranalli et al., 2006). Representa cerca de 73% da totalidade dos compostos constituintes da folha de oliveira (Japón-Luján et al., 2006; Pereira et al., 2007), sendo o composto fenólico presente em maior quantidade (Briante et al., 2002; Japón-Luján et al., 2006).
Encontra-se presente em concentrações acima de 140 mg/gde matéria seca na azeitona verde e 60-90 mg/g de matéria seca nas folhas. Além das suas propriedades antioxidantes são-lhe atribuídas propriedades anti-inflamatórias e anti-carcinogénicas, inibe o crescimento, a motilidade e a metastização das células neoplásicas (Savarese et al., 2007); actua contra vírus, fungos e bactérias (Benavente-García et al., 2000) que afectam o sistema respiratório e gastrintestinal (Pereira et al., 2007). Este composto é responsável pelo aroma amargo da fruta, influenciando as suas propriedades organolépticas (Briante et al., 2002; Manna et al., 2004) e pode ser hidrolizado em hidroxitirosol, ácido elenólico glucosido, aglicona oleuropeína e glucose (Manna et al., 2004).
No pó da folha de oliveira estão presentes agliconas secoiridóides e, acima de tudo, glicosidos, tais como, a dimetiloleuropeína que sob condições de biotransformação próprias é hidrolizada em hidroxitirosol (Briante et al., 2004).
1.4.2. Hidroxitirosol
Apesar da importância que o hidroxitirosol (C8H10O3) assume esta molécula não
está disponível no mercado. As suas propriedades antioxidantes são bem conhecidas (Briante et al., 2004) e a sua presença, à semelhança da oleuropeína, diminui o desenvolvimento das doenças tumorais e cardíacas, protege ainda contra a aterosclerose e previne as neuropatias diabéticas (Japón-Luján et al., 2006). Galli e seus colaboradores (1999) afirmam que este composto é capaz de actuar contra os radicais livres (Briante et al., 2002). O hidroxitirosol e o tirosol são alguns dos compostos fenólicos que contribuem para a adstringência da azeitona e resistência à oxidação (Singh et al., 2006).
O hidroxitirosol e a oleuropeína demonstraram, em estudos efectuados, que podem ter influência na inibição ou atraso na taxa de crescimento de diversos agentes patogénicos presentes no tracto gastrintestinal e no respiratório, nomeadamente Salmonella typhi, Staphylococcus aureus, Vibrio cholerae e Vibrio alginoliticus (Briante et al., 2004).
oleuropeína aumenta, havendo um desaparecimento, por oxidação, quase completo de todos os outros polifenóis. A secagem das folhas a temperaturas superiores a 37ºC, provoca uma activação das enzimas biossintéticas presentes nas folhas, com a produção de compostos de defesa contra o stresse oxidativo provocado pela temperatura, formando-se então a oleuropeína (Ferreira, 2007).
1.5. D-lenolato
O D-lenolato de acordo com os produtos existentes no mercado, é um extracto em pó obtido a partir da folha de oliveira, ao qual são atribuídas propriedades de protecção e fortalecimento do sistema imunitário. Serve também para ajudar a eliminar toxinas do organismo humano. No entanto, escasseiam as publicações científicas sobre o produto.
1.6. Mus musculus
O murganho é um pequeno mamífero conhecido pelo nome científico Mus musculus. É um roedor da ordem Rodentia e pertence à família Muridae. Um murganho adulto possui normalmente um peso compreendido entre 25 e 40g e apresenta uma variedade de cores, nomeadamente o albino, preto, castanho e cinzento (Hrapkiewicz et al., 1998).
1.6.1. O murganho como animal de experimentação
Os murganhos são utilizados com sucesso há várias décadas na investigação, como um modelo vivo. São uma forma eficaz para entender o funcionamento dos vários sistemas do organismo e têm sido fulcrais no estudo e no auxílio do desenvolvimento de novas terapias contra doenças humanas e animais (Jentsch et al., 2000). Utilizam-se com fins experimentais em medicina, biologia, estudos de comportamento, em testes para avaliar o efeito de químicos perigosos, alimentos, tabaco e medicamentos.
O desenvolvimento, a fisiologia e a bioquímica são muito semelhantes entre o murganho e o Homem, o que faz com que este animal seja amplamente utilizado na pesquisa biomédica, não só pela facilidade na sua manipulação, mas também pelas suas características biológicas. São seres pequenos, fáceis de manter em laboratório, pouco dispendiosos, com uma elevada taxa de reprodução e que tal como o Homem, são mamíferos. Contudo também podem ser utilizados em trabalhos experimentais ratos, cães, coelhos, cobaios e hamsters. No entanto, devido a questões económicas e éticas a maioria dos trabalhos experimentais são executados com murganhos e ratos (Oliveira, 2006). Relativamente a outras espécies animais usadas em investigação, este animal não é caro e é de fácil manutenção. Este factor torna-se uma grande vantagem, na medida em que nos estudos de toxicidade e carcinogénese, são necessários um número significativo de animais, para que estatisticamente os resultados possam ser considerados válidos (Oliveira, 2006).
1.6.2. Manutenção do murganho em laboratório
Durante o período experimental em que os murganhos são mantidos num biotério, são vários os parâmetros que devem ser controlados, são eles: a iluminação, a temperatura, a humidade relativa e a ventilação (quadro 1).
O controlo do ambiente em que se realiza uma experiência é de extrema importância, para que as respostas fisiológicas e comportamentais nos animais sejam constantes e previsíveis.
Os murganhos são animais sociáveis, podendo ser mantidos em grupos. Em certas circunstâncias os machos podem entrar em conflito para estabelecer uma hierarquia dominante, provocando ferimentos graves devido às dentadas nas zonas dorsal e genital. As fêmeas por norma não lutam, excepto quando defendem as crias e quando se sentem ameaçadas. Nestas situações, o animal ferido deve ser colocado numa gaiola sozinho, de modo a prevenir lesões maiores ou evitar a sua morte (Hrapkiewicz et al., 1998).
1.7. Fígado do murganho
O fígado é um dos maiores órgãos do corpo, representando cerca de 2% do peso corporal total. Desenvolve-se como uma bolsa embrionária a partir do duodeno e é o responsável pela detoxificação e metabolização do organismo (Kolb, 1987).
Quadro 1 Condições ambientais necessárias para a manutenção de murganhos (Hrapkiewicz et al.,
1998).
Iluminação 12 Horas O fotoperíodo dos murganhos é normalmente de 12 horas de luz por dia.
Temperatura 23 ± 2ºC
A temperatura do local onde estão os murganhos deve ser controlada e mantida a 23ºC, podendo haver uma oscilação de ±2ºC.
Humidade relativa
55 ± 5%
A humidade relativa é influenciada pelo número de animais que se encontram distribuídos por gaiola e pela frequência com que as camas são mudadas. Deve-se encontrar a 55%, com um intervalo de 5% para variações.
Ventilação
10 a 15 mudanças de ar
por hora
A ventilação é de grande importância, dado que ajuda a manter a temperatura apropriada, serve para remover gases (dióxido de carbono e amónia), odores, pó, partículas existentes e renovar o ar.
1.7.1. Aspecto macroscópico
O fígado de murganho apresenta 2 superfícies: uma superfície parietal e uma superfície visceral. Observando a superfície visceral encontram-se 3 lobos distintos:
• Lobo lateral esquerdo
• Lobo lateral direito
• Lobo medial
• Processo papilar
O lobo lateral direito apresenta-se subdividido num lobo direito propriamente dito e num lobo caudado. O lobo medial apresenta-se subdividido em lobo medial direito e lobo medial esquerdo. Na superfície visceral do fígado observamos a presença da vesícula biliar, órgão em forma de pêra (Konig e Liebich, 2005).
1.7.2. Aspecto microscópico
O fígado está recoberto por uma cápsula, a cápsula de Glissom, constituída por tecido conjuntivo. Cerca de 60% do fígado é constituído por células denominadas hepatócitos, células eosinófilas com núcleo basófilo central. Estas células encontram-se organizadas num labirinto de espaços ou lacunas, com a espessura de uma só célula, onde estão suspensos os vasos sanguíneos. São células com forma poliédrica e que normalmente possuem seis faces cobertas com microvilosidades. Estas faces estão ligadas a hepatócitos adjacentes formando paredes complementares, resultando nos canículos biliares. Os canículos biliares são adjacentes às paredes dos sinusóides, mas encontram-se separados por um espaço perisinusoidal, o espaço de Disse, que forma um labirinto de microlacunas (Konig e Liebich, 2005).
Nos espaços sinusóides encontram-se as células de Kupffer, células fagocitárias. As células de Ito ou denominadas células “estreladas” são activadas quando ocorre uma lesão no fígado. São responsáveis pela síntese de fibrina e transformam-se em miofibroblastos contrácteis, formando-se por último a fibrose. Estas células são identificadas pela presença da actina do músculo liso. No interstício de 3 ou mais lóbulos surgem os espaços Porta, componentes suportados por tecido conjuntivo. Em
cada espaço Porta observam-se uma veia porta, uma artéria hepática, um ducto biliar e um vaso linfático (Young e Heath, 2000).
1.7.3. Funções do fígado
O fígado desempenha muitas funções vitais. Trata-se de um órgão que funciona como glândula exócrina e como glândula endócrina. É essencial na regulação do metabolismo, na síntese das proteínas do plasma, no armazenamento das vitaminas e do ferro e na metabolização das hormonas. O fígado é responsável pela destruição das hemácias, emulsifica as gorduras no processo digestivo através da secreção que produz, a bílis, converte amónia em ureia e purifica o organismo contra toxinas e drogas (Kolb, 1987; Young e Heath, 2000).
1.8. Bioenergética
1.8.1. A mitocôndria
A mitocôndria (do grego mito: filamento e chondrion: grânulo) é um organito celular que se encontra disperso no citoplasma de todas as células eucarióticas, sendo caracterizada por uma série de propriedades morfológicas, bioquímicas e funcionais. É uma estrutura cilindrica com aproximadamente 0.5 µm de diâmetro e vários micrómetros de comprimento. O número de mitocôndrias varia com o tamanho da célula e com a sua actividade fisiológica, sendo tanto maior a sua quantidade quanto maior for a actividade metabólica da célula. A sua forma e posição modifica-se ao longo da vida da célula e só a microscopia electrónica permitiu conhecer a sua estrutura (Azevedo, 1994). São organitos constituídos por uma dupla membrana:
• Membrana mitocôndrial externa: permeável a moléculas; separa a mitocôndria do hialoplasma
• Membrana mitocôndrial interna: impermeável a iões e moléculas polares; forma uma série de pregas orientadas para o interior da mitocôndria. São as
denominadas cristas mitocôndriais (aumentam a área superficial total) (Junqueira e Carneiro, 1973).
O espaço compreendido entre duas membranas mitocôndriais chama-se espaço intermembranar. O espaço que fica para dentro da membrana interna é ocupado pela matriz mitocôndrial, constituída por uma substância finamente granulosa. É um órgão semi-autónomo (capaz de se dividir), possui ribossomas e ADN, que programa a síntese de proteínas (Júnior et al., 2007).
1.8.2. A mitocôndria: modelo para o estudo da toxicidade
Há muito tempo que a mitocôndria é reconhecida como o principal organito produtor de energia celular e exerce um papel fundamental na manutenção de numerosas funções celulares. É responsável pela produção de energia e pela respiração celular através do Ciclo de Krebs, pela regulação iónica, mobilidade e proliferação celular (Wallace, 1999; Peixoto et al., 2003). Mais de 90% da energia utilizada pelas células animais é obtida através da fosforilação oxidativa associada à membrana interna da mitocôndria (Mitchell, 1961). As alterações na sua actividade podem ser detectadas através de vários métodos como o da permeabilidade aos iões, polarografia, potênciais membranares e actividade enzimática (Peixoto et al., 2003).
O rato e o murganho são animais utilizados nestes estudos (Wallace, 1999; Petrosillo et al., 2008). As preparações obtidas a partir de mitocôndrias do fígado são um bom modelo para o estudo da toxicidade na bioenergética. São preparações relativamente fáceis de obter, com um elevado grau de pureza e integridade (Peixoto et al., 2003).
Dado que a mitocôndria é o órgão responsável pela intensa actividade da cadeia respiratória faz de si o local de maior produção de radicais livres e stresse oxidativo (Petrosillo et al., 2008).
A membrana mitocôndrial interna contém os complexos da cadeia respiratória, organizados em quatro complexos (Azevedo, 1994; Champe e Harvey, 1994; Harris, 1995):
• Complexo II: complexo succinato desidrogenase. Transfere os electrões do succinato até à ubiquinona.
• Complexo III: complexo dos citocromos bc1. Transfere os electrões da
ubiquinona até ao citocromo c.
• Complexo IV: complexo citocromo oxidase. Reduz o oxigénio. Transfere os electrões do citocromo c até ao oxigénio.
As moléculas de NADH e de FADH2, formadas no ciclo de Krebs, transferem os
electrões para as proteínas da cadeia transportadora de electrões. Esta energia libertada será utilizada na síntese das moléculas de ATP, a partir de ADP+Pi, e parte desta dissipa-se na forma de calor. Cada molécula de NADH permite a síntese de três moléculas de ATP, enquanto que a molécula de FADH2 apenas permite a síntese de
duas moléculas de ATP. No final da cadeia transportadora, os electrões são transferidos para um aceitador final – oxigénio, que capta dois protões, formando-se uma molécula de água. Na membrana interna da mitocôndria encontra-se ainda a ATPsintase, responsável pela fosforilação oxidativa, um processo metabólico da síntese de ATP a partir da energia libertada pelo transporte de electrões na cadeia respiratória (Campos, 1998).
Sob o ponto de vista analítico a respiração mitocôndrial divide-se em quatro estados, estado 1, 2, 3 e 4. O estado 1 corresponde à fase de isolamento mitocôndrial e o estado 2 corresponde à adição do substrato (neste estado a respiração é baixa devido à falta de ADP). O estado 3 da respiração mitocôndrial é denominado de estado activo (fase activa da fosforilação oxidativa com consumo de oxigénio e formação de ATP). A fase lenta que se segue à fosforilação do ADP em ATP é designada de estado 4 (ocorre uma diminuição na taxa respiratória devido ao consumo do ADP). A razão entre a taxa de respiração activa (estado 3) e de repouso (estado 4) é referida como RCR (Miranda et al., 2005).
2. Objectivos
Foram objectivos deste trabalho:
• Acompanhar a manutenção dos murganhos no que diz respeito à sua manipulação, mudança das camas, pesagem da comida e da água
• Avaliar as alterações histológicas hepáticas induzidas pela exposição oral dos murganhos a três concentrações diferentes do D-lenolato (extracto do pó da folha de oliveira)
• Avaliar as alterações induzidas pelo D-lenolato em alguns parâmetros bioquímicos (albumina, bilirrubina total, alanina aminotransferase e fosfatase alcalina)
3. Material
3.1. Animais
Para a realização deste trabalho experimental, adquiriu-se à empresa Harlan-Interfauna (Barcelona, Espanha) 40 murganhos, da espécie Mus musculus, estirpe ICR, do sexo feminino e com idades compreendidas entre as 4 e 5 semanas. Os murganhos foram distribuídos ao acaso por 4 grupos de 10 animais por gaiola. O início do estudo ocorreu após um período de 8 dias de quarentena, para adaptação às condições experimentais. Todo o trabalho experimental foi feito em conformidade com as directivas comunitárias e de acordo com a portaria 1005/92.
3.2. Protocolo experimental
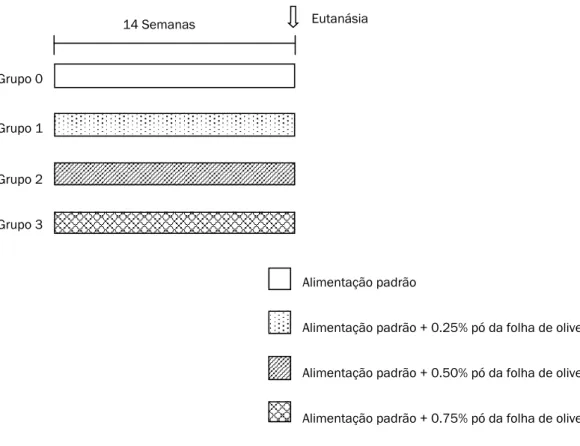
Na figura 1 encontra-se descrito o procedimento experimental realizado.
Figura 1 Procedimento experimental.
Alimentação padrão + 0.25% pó da folha de oliveira Alimentação padrão + 0.50% pó da folha de oliveira Alimentação padrão
Alimentação padrão + 0.75% pó da folha de oliveira 14 Semanas Eutanásia
Grupo 0
Grupo 1
Grupo 2 Grupo 3
4. Metodologia
4.1. Condições experimentais
Os animais foram colocados em gaiolas de policarbonato com superfícies lisas e de cantos redondos. A cama utilizada para revestir a gaiola consistiu em aparas duras de madeira, guardada em locais secos, fora do alcance de outros animais e de substâncias químicas, de modo a evitar contaminações. Cada uma das gaiolas foi devidamente identificada com uma etiqueta, que continha o número do grupo, o ensaio experimental em causa, a dose do pó da folha de oliveira administrada, o número de animais existentes e a data do início do ensaio (figura 2).
Figura 2 Exemplificação de uma etiqueta.
Como enriquecimento ambiental e de modo a quebrar a monotonia, colocaram-se no interior das gaiolas vários tubos de plástico. A água e o alimento foram disponibilizados ad libitum. Durante a experiência os animais permaneceram numa câmara ventilada Tecniplast, referência 9ARMV8124LR.
Grupo: 3
Ensaio: Acção de alguns compostos na dieta mediterrânica na variação de parâmetros
fisiológicos e histológicos em ratinhos. 0.75%
Número de animais: 10 Marcação: 1 - 10 Data de início: 20/11/2007
4.2. Características do alimento
A ração Teklad Global Diet foi adquirida à empresa Harlan Interfauna, Espanha. Este alimento é constituído por: trigo, milho, glúten de milho, fosfato de dicálcio, óleo de soja, óxido de magnésio, cloreto de sódio, l-lisina e d,l-metionina. A ração é ainda constituída por água, proteínas, gordura, fibras, vitaminas e minerais (quadro 2).
Quadro 2 Vitaminas e minerais presentes na ração. Adição por kg
Vitaminas Minerais
Vitamina A I.U. 21000 Ferro mg 50
Vitamina D3 I.U. 1100 Magnésio mg 44
Vitamina E (alfa-tocoferol) mg 107 Zinco mg 30
Vitamina K3 mg 70 Cobre mg 7 Vitamina B1 mg 102 Cobalto mg 0.5 Vitamina B2 mg 17 Iodo mg 6.1 Vitamina B6 mg 13 Crómio mg 0.5 Vitamina B12 mg 0.112 Niacina mg 57 Ácido d-Pantoténico mg 114 Ácido Fólico mg 6 Botina mg 0.59 Colina mg 300
4.3. Características do pó da folha de oliveira
O pó da folha de oliveira foi adquirido à empresa East Park Research (Las Vegas, USA). O pó utilizado no trabalho experimental pertencia todo ao mesmo lote e foi conservado nas mesmas condições de acordo com as instruções do fabricante.
4.4. Procedimento utilizado para a preparação da dieta
Para a preparação da dieta, foi necessário calcular a quantidade necessária do alimento padrão e da quantidade necessária do pó da folha de oliveira para de seguida preparar a ração. Tendo em conta que o consumo médio de alimento descrito para o murganho por Harkness e Wagner (1989) é de 15g/100g, calculámos o total de alimento
necessário para a duração do trabalho experimental e considerando que temos 10 animais por grupo. Quatro dietas diferentes foram preparadas, uma dieta controlo e três dietas com as concentrações 0.25%, 0.50% e 0.75% do pó da folha de oliveira de acordo com o procedimento abaixo descrito.
Para moer o alimento padrão, utilizámos um moinho de facas.Estas entram em contacto com os pellets de modo a obter grãos mais pequenos até que estes passem por um crivo de 2 mm. Terminada esta etapa, efectuou-se a mistura do alimento padrão com o pó da folha de oliveira. Enquanto estes dois componentes eram misturados adicionámos cerca de 5% de água, o que corresponde a 400 mL, de modo a que a mistura final não fique demasiado em pó e se desfaça facilmente. Por último, recorreu-se a um granulador (modelo CPM, C-300) que transformou farinha em grânulos. Também neste instrumento estão incorporadas facas que definem o comprimento dos grãos e o seu diâmetro é definido por uma matriz, para este ensaio utilizámos a matriz de 4 mm, a maior disponível. A figura 3a ilustra o alimento padrão, a figura 3b ilustra o alimento que foi dado aos murganhos durante o ensaio experimental.
Figura 3a Ração proveniente daHarlan Teklad. Figura 3b Dieta preparada para o ensaio.
4.5. Procedimentos experimentais
4.5.1. Pesagens
nível da alimentação. Duas vezes por mês procedeu-se à pesagem individual dos murganhos. Para tal utilizou-se uma balança METTLER PM 4000.
4.5.2. Índice de perdas
No final do estudo calculou-se o índice de perdas (IP*), isto é, o número de animais que morreram durante o ensaio experimental e não entram no estudo.
4.5.3. Índice de Homogeneidade ponderal (Hp)
Em cada grupo foi calculado o índice de homogeneidade ponderal no início do estudo, tendo em conta o peso inferior (Pi) e o peso superior (Ps) do grupo segundo a
fórmula:
4.5.4. Ganho ponderal (Gp)
Em cada grupo experimental foi feito o estudo do ganho ponderal em comparação com o grupo controlo segundo a fórmula a seguir descrita, em que P1 é o
peso inicial e P2 é o peso final:
Gp = P2 – P1/P2 x 100
*IP = (nº de animais que morreram e não entram no estudo/nº de animais iniciais) x 100
4.5.5. Eutanásia dos animais
Antes de se proceder à eutanásia dos murganhos pesou-se individualmente cada um dos animais, de modo a ser calculada a dose adequada de anestesia a aplicar em função do peso do animal. Utilizou-se uma overdose de pentobarbital administrada por via intraperitonial.
4.5.6. Recolha das amostras
A necrópsia foi efectuada em todos os animais sacrificados. A necrópsia consistiu no estudo e descrição do exterior do animal e observação macroscópica do seu interior. Em todos os animais foram colhidos para histopatologia de rotina fragmentos do fígado, rins, baço, pulmão, coração e bexiga. Os fragmentos foram fixados em formol tamponado a 10%, durante 12 horas. Na recolha das bexigas procedeu-se à sua distensão in situ através de uma injecção transuretral com 0.2 mL de formol, colocando em seguida uma ligadura em volta da uretra. Cada um destes órgãos foi pesado individualmente.
4.5.7. Estudo histológico e histopatológico
Após fixação os tecidos foram seccionados, e observados para identificar lesões macroscópicas. De seguida, cada órgão foi cortado em 4 tiras e processado em parafina, dos blocos resultantes realizaram-se vários cortes com 2 µm de espessura, num micrótomo de rotação Leica® 20035, para os estudos histopatológicos. Para o estudo histopatológico as preparações foram desparafinadas em xilol, hidratadas numa série de álcoois de concentração decrescente, coradas pelo método convencional de hematoxilina-eosina (H&E), desidratadas numa série de álcoois de concentração crescente e montadas com Entellen® (Merck).
4.5.7.1. Técnica de coloração pela hematoxilina-eosina
1. Colher o material
2. Fixar o material em formol a 10%
3. Desidratar em banhos de álcool de concentrações crescentes 4. Impregnar em xilol
5. Inclusão em parafina 6. Cortar
7. Colagem em Entellan 8. Desparafinar em xilol
9. Hidratar em banhos de álcool de concentração decrescente 10. Corar com hematoxilina-eosina
A hematoxilina, corante básico, cora os núcleos. A eosina, corante ácido, cora o citoplasma. O procedimento da técnica histológica é semelhante à técnica de coloração pela reticulina e à técnica de coloração pelo tricómio de masson até à hidratação. A partir deste ponto, cada um dos protocolos segue passos distintos. Os procedimentos descritos para cada uma destas técnicas são os utilizados no laboratório de Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro.
4.5.7.2. Técnica de coloração pela reticulina
A técnica de reticulina marca as fibras de colagéneo do tipo III. Neste tipo de técnica convém que a fixação dos tecidos seja feita em formol e obtêm-se melhores resultados na impregnação se a fixação durar pelo menos há 15 dias.
4.5.7.2.1. Metodologia
1. Oxidar o corte, durante 3, minutos numa solução aquosa de permanganato de potássio a 0.75%
3. Descorar durante 1 minuto numa solução aquosa de metabissulfito de potássio a 2%
4. Lavar em água corrente durante 10 minutos
5. Mordançagem durante 1 minuto numa solução aquosa de alúmen de ferro a 2% 6. Lavar em água da torneira durante 3 minutos
7. Lavar em água destilada mudando 2 vezes
8. Impregnar durante 1 minuto na seguinte solução amoniacal de prata:
A 10 mLde uma solução aquosa de nitrato de prata a 10%, adiciona-se 2 mL de uma solução aquosa de potassa cáustica a 10%. Forma-se um precipitado castanho que se dissolve em amoníaco puro, gota a gota e sob agitação. Sucessivamente adiciona-se a solução a 10% de nitrato de prata, também gota a gota, até que o precipitado que se forma, desapareça agitando ligeiramente. De seguida, adiciona-se água destilada até perfazer o dobro do volume. Esta solução só é activa durante 2 dias.
9. Lavar em água destilada durante 10 segundos
10. Redução durante 3 minutos numa solução a 15% de formol 11. Lavar em água da torneira durante 3 minutos
12. Viragem durante 8 minutos numa solução aquosa de cloreto de ouro a 0.20% 13. Lavar em água destilada
14. Mergulhar durante 1 minuto numa solução aquosa de metabissulfito de potássio a 2%
15. Mergulhar durante 1 minuto numa solução aquosa de ipossulfito de sódio a 1% 16. Lavar em água da torneira
17. Lavar em água destilada
18. Colocar as lâminas em eosina e 1% de solução alcoólica durante 2 minutos 19. Desidratação
20. Colocar em xilol
4.5.7.3. Técnica de coloração pelo tricómio de masson
A técnica histoquímica do tricómio de masson diferencia mediante três corantes distintos, 3 tipos de estruturas, nomeadamente os núcleos, o citoplasma e o tecido conjuntivo.
4.5.7.3.1. Metodologia
1. Remover os pigmentos de mercúrio por passagens em tiossulfato 2. Lavar em água da torneira
3. Corar os núcleos pelo método de azul Celestino 4. Diferenciar com álcool ácido a 1%
5. Lavar bem em água da torneira
6. Corar em solução de ácido fuchinico durante 5 minutos 7. Lavar em água destilada
8. Tratar com ácido fosfomolibidico durante 5 minutos 9. Drenar
10. Corar com solução azul-de-metileno durante 2 a 5 minutos 11. Lavar em água destilada
12. Tratar com ácido acéticodurante 2 minutos
13. Desidratar os cortes histológicos por passagens sucessivas em soluções alcoólicas de concentração crescente
14. Colocar em xilol 15. Montar em Entellan
4.5.7.4. Classificação histológica
De modo a avaliar e classificar as lesões observadas histologicamente foram estabelecidos vários parâmetros, nomeadamente:
• Arquitectura • Fibrose
• Hiperplasia de canais biliares • Colestase
• Necrose de hepatócitos • Necrose em peace meal
• Presença de células inflamatórias • Padrão do infiltrado inflamatório • Hemossiderose
• Mitoses
4.5.8. Parâmetros bioquímicos
As amostras de sangue foram recolhidas por punção cardíaca para tubos sem heparina, sendo após a sua coagulação colocadas a centrifugar a 2000 rotações durante 15 minutos e mantidas a 4ºC até serem analisadas, pelo aparelho Aeroset C800 Abbott. Devido a questões de ordem financeira e dada a pequena quantidade de sangue recolhido, foram avaliados os seguintes parâmetros: albumina, bilirrubina total, alanina aminotransferase e fosfatase alcalina.
4.5.9. Estudo bioenergético
O estudo bioenergético foi realizado no laboratório de Química da Universidade de Trás-os-Montes e Alto Douro, apenas foram analisadas amostras do grupo controlo e do grupo alimentado com 0.75% do pó da folha de oliveira.
4.5.9.1. Isolamento das mitocôndrias de fígado do murganho
Após eutanasiar os animais, uma pequena amostra de fígado foi recolhida e colocada num meio de isolamento com BSA (albumina do soro de bovino) (225 mmol/l de manitol, 75 mmol/l de sacarose, 5 mmol/l de Hepes (2-[4-(2-hidroxietil)1-piperazinil]-etanosulfónico), 1 mmol/l de EGTA (ácido tetraacético etileno glicol) e 1 mg/mL BSA [pH 7-7.4]). A amostra foi cortada em pequenas fracções com ajuda de uma tesoura e posteriormente homogeneizada. Este processo foi executado sempre em gelo.
O homogeneizado de fígado foi transferido para um tubo de centrifuga de 30 mL, onde se perfez o volume com o meio de isolamento e procedeu-se a nova centrifugação (900 rotações) durante 5 minutos. No sedimento ficaram depositados núcleos, eritrócitos e gorduras, no sobrenadante as mitocôndrias. Este último, foi transferido para um novo tubo de centrifuga de 30 mL e procedeu-se a uma nova centrifugação, a 10000 rotações, durante 10 minutos. O sobrenadante foi rejeitado (constituído por retículo endoplasmático e tecidos), as mitocôndrias ficaram na parte inferior do tubo. De seguida, adicionou-se meio de lavagem novo e procedeu-se a uma nova centrifugação a 10000 rotações durante 10 minutos. O precipitado resultante ressuspendeu-se em 300 µL de meio, sem BSA, transferiu-se para um eppendorf e conservou-se em gelo, a 4ºC.
4.5.9.2. Quantificação da proteína – Método do Biureto
A concentração da proteína da preparação mitocôndrial foi determinada pelo método do Biureto. Este método baseia-se na reacção de uma mistura de cobre e
hidróxido de sódio com um agente complexante que estabiliza o cobre em solução. O produto da reacção apresenta duas bandas de absorção, uma a 270 nm e outra a 540 nm. Apesar da banda na região de 270 nm aumentar em seis vezes a sensibilidade do método do Biureto, a banda na região de 540 nm é a mais utilizada para fins analíticos, porque diversas substâncias, normalmente presentes na maioria dos meios analisados, absorvem na região de 270 nm o que interfere nos resultados (Zaia et al., 1998).
O procedimento experimental teve início com a solubilização das amostras da suspensão mitocôndrial (20 µL), adicionou-se 100 µL de SDS (dodecilsulfato de sódio) a 10% (p/v). Posteriormente adicionou-se água destilada até perfazer o volume de 2 mL e, por fim, 2 mL de reagente alcalino de cobre [reagente do “Biureto”: CuSO4.5H2O a
0.15% (p/v), NaKC4H4O6.4H2O (tartarato de sódio e potássio) a 0.6% (p/v), NaOH
(hidróxido de sódio) a 3% (p/v) e KI (iodeto de potássio) a 0.1% (p/v)]. A preparação dos padrões de BSA (0, 0.8, 1.6 e 2.4 mg) ocorreu nas mesmas condições das outras amostras, contendo 100 µL de meio de lavagem.
As absorvâncias das amostras e dos padrões foram lidas 10 minutos após o início da reacção, a 540 nm, contra um branco que continha todos os reagentes excepto a proteína.
4.5.9.3. Consumo de oxigénio
Para determinar o consumo de oxigénio através da cadeia transportadora de electrões da mitocôndria utilizou-se o método polarográfico descrito por Estabrook (Estabrook, 1967).
Para tal, utilizou-se um eléctrodo de oxigénio do tipo Clark a 25ºC, numa câmara termostática de incubação contendo 1 mL de água (CB1-D Hansatech). Nesta etapa, as mitocôndrias estavam suspensas num tampão constituído por 100 mM de KCl (cloreto de potássio), 20 mM Tris, 3 mM de KH2PO4 (di-hidrogenofosfato de potássio)
e 3 mM de MgCl2 (cloreto de magnésio) a pH 7.2.
Dois minutos depois de fazer a mistura deu-se início à respiração mitocôndrial com a adição de succinato a uma concentração final de 5 mM.
O estado 4 foi avaliado como sendo a taxa de consumo de oxigénio na ausência de ADP.
A taxa RCR (razão entre o estado 3/estado 4) e a razão ADP/O foi calculada de acordo com Estabrook (1967). A concentração da solução de ADP adicionada foi confirmada a 260 nm por espectrofotómetro, utilizando um coeficiente de extinção molecular de 16 cm-1M-1.
4.5.9.4. Medição do potêncial membranar mitocôndrial
O potêncial membranar mitocôndrial (∆ψ) foi estimado através da monitorização da acumulação e libertação do catião lipofílico tetrafenilfosfónio (TPP+) com um eléctrodo sensível ao TPP+ preparado de acordo com o procedimento descrito por Kamo (Kamo et al., 1979). Um mini-eléctrodo foi construído com um tubo de PVC (cloreto de polivinil), o tubo foi fechado com uma membrana feita à base de PVC contendo tetrafenilboro como um permutador de catiões. Este mini-eléctrodo continha no seu interior uma solução TPP+ (10 mM). Como eléctrodo de referência, usou-se um
eléctrodo saturado de prata/cloreto de prata. Ambos os eléctrodos (TPP+ e o eléctrodo de referência) foram conectados a um potenciómetro e inseridos numa câmara de vidro termostática. Os sinais foram registados por um sistema de aquisição Hansatech.
As mitocôndrias foram incubadas no meio de reacção (130 mM de sacarose, 50 mM de KCl, 2.5 mM de KH2PO4 e 5 mM de tampão Hepes a pH 7.4) suplementado
com 3 µM de TPP+. Esta concentração de TPP+ foi escolhida para conseguir uma alta sensibilidade e para evitar possíveis efeitos tóxicos na mitocôndria.
O potencial eléctrico transmembranar foi calculado a 25ºC de acordo com a seguinte equação, assumindo que a distribuição de TPP+ entre a mitocôndria e o meio segue a equação de Nernst
aonde v, V e ∆E representam o volume mitocôndrial, o volume do meio de incubação e a deflexão do potêncial do eléctrodo a partir da linha basal respectivamente.
Não foi feita nenhuma correcção para a constituição da ligação passiva do TPP+ às membranas das mitocôndrias, uma vez que o propósito deste ensaio é mostrar mudanças relativas no potêncial em vez de alterações nos valores absolutos. Os cálculos do potêncial transmembranar basearam-se num volume de 1.1 µL/mg de proteína da matriz mitocôndrial.
4.5.9.5. Ensaios enzimáticos
Todos os ensaios foram realizados a 25ºC, num espectrofotómetro Varian Cary 50. A actividade dos complexos I e IV da cadeia respiratória foi medida de acordo com o descrito por Taylor e seus colaboradores (Taylor et al., 1993) com ligeiras modificações.
As amostras de mitocôndrias foram sujeitas a três ciclos rápidos de congelamento e descongelamento numa solução hipotónica (20 mM de K3PO4 (fosfato
de potássio) a pH 7.2) antes de começarem os ensaios enzimáticos. O NADH desidrogenase foi quantificado através da taxa de oxidação do NADH obtido a 340 nm. O meio de ensaio da NADH ubiquinona oxirredutase (complexo I) continha 25 mM de K3PO4 a pH 7.2, 5 mM de MgCl2, 2.5 mg/mL BSA (fracção V), 0.13 mM de NADH e
65 µM de decilubiquinona, um análogo solúvel da cadeia da ubiquinona e suplementado com 2 µg/mL de antimicina A e 2 mM de KCN (cianeto de potássio) para bloquearem o transporte de electrões provenientes do complexo I. Um minuto depois, foi adicionado 0.25 mg de mitocôndria para iniciar a reacção e a taxa inicial de oxidação do NADH foi monitorizada a 340 nm (ε=6.81 mM-1 cm-1) durante 1 minuto. A actividade do complexo I foi inibida pela adição de 2 µg/mL de rotenona. A actividade específica do complexo IV foi determinada como a taxa de oxidação do citocromo c reduzido aos 550 nm. O ferrocitocromo c foi preparado através da redução do ferricitocromo c na presença de ditionite de sódio, seguido da realização de cromatografia por Sephadex G-25 para remover o Na2SO4 (sulfato de sódio) que não reagiu (Trounce et al., 1996). A mistura da
reacção, consistindo em 20 mM do tampão K3PO4 a pH 7.0, 0.45 mM de
n-dodecil-ß-D-maltosido e 15 µM de ferrocitocromo c foi incubada a 25ºC durante 1 minuto sendo depois as mitocôndrias (10 µg de proteína) adicionadas de modo a iniciar a reacção. A
primeira ordem foi calculada e os resultados estão apresentados como min mg-1 de proteína.
4.5.9.6. Medição da peroxidação lipídica
A peroxidação lipídica foi determinada de acordo com o método descrito por Sassa et al. (1990). O consumo de oxigénio foi medido em 1 mL de meio de reacção (175 mM de KCl e 10 mM de Tris-Cl a pH 7.4, com um suplemento de 3 µM de rotenona) contendo 0.5 mg de proteína e utilizando um eléctrodo do tipo Clark (Hansathech Oxygraph Plus Acquisition System) numa câmara de vidro fechado equipada com um eléctrodo magnético e termostatizada a 25ºC. O registo foi obtido 15 minutos após o início da incubação com 1 mM de ADP e 0.1 mM de FeSO4 (sulfato de
ferro).
4.5.9.7. Ensaio do peróxido de hidrogénio
O peróxido de hidrogénio (H2O2) libertado pela mitocôndria no meio
circundante foi determinado através de uma modificação do método descrito por Valletta e Berton (1987). Este método baseia-se na conversão do ácido homovalínico (HVA) no seu dímero fluorescente na presença de H2O2 e da peroxidase “horseradish”
(HRP). As mitocôndrias foram incubadas num meio tampão de 130 mM de sacarose, 50 mM de KCl, 2.5 mM de KH2PO4, 5 mM de tampão Hepes e pH 7.4, suplementado com
0.1 mM de HVA, 3 U/mL de HRP, 1 mM de succinato, 0.25 mM/0.25 mM de piruvato/malato, 20 µg de antimicina A e 2 µM de rotenona.
Após 15 minutos de incubação adicionou-se 0.5 mL de tampão de glicina frio (pH 12.0) para parar a reacção. As suspensões de mitocôndrias foram centrifugadas durante 10 minutos, a 850 rotações. A fluorescência do sobrenadante foi medida a 312 nm como excitação e a 420 nm como emissão de ondas. Em cada experiência, a incubação foi realizada também com uma amostra controlo que continha apenas a mistura de reagentes (isto é, sem mitocôndria) de modo a corrigir qualquer dimerização espontânea do HVA. A formação de H2O2 foi calculada usando uma curva padrão de
H2O2 e os níveis de H2O2 foram expressos em nmoles H2O2/15 minutos/mg de proteína
mitocôndrial.
4.5.10. Estatística
A análise estatística foi realizada com o programa SPSS (Statistical Pachage for the Social Sciences, Chicago, Il, USA), versão 12. As diferenças de peso corporal entre os diferentes grupos e o peso de cada órgão de cada um dos animais foram interpretadas utilizando a análise de variância (ANOVA) seguida do teste de Bonferroni. A correlação de Pearson foi utilizada para avaliar a associação entre o peso de vários órgãos. Obtiveram-se correlações estatisticamente significativas nas associações entre o peso do baço e o peso do fígado, entre o peso do rim direito e o valor do peso do rim esquerdo e entre o peso do coração e o peso do animal. Os valores obtidos foram considerados como significativos para valores de p <0.05.
5. Resultados
5.1. Características dos animais utilizados no estudo
No final do trabalho experimental foi calculado o índice de perdas (quadro 3). Analisando o quadro 3, verifica-se que durante o ensaio experimental morreram 8 murganhos. No grupo 0 morreu 1 murganho. No grupo 1 todos os animais sobreviveram ao trabalho experimental. No grupo 2 morreram 2 murganhos. O grupo 3, alimentado com a maior concentração do pó da folha de oliveira, foi o grupo no qual se registou maior de índice de perdas, durante o ensaio morreram 5 murganhos.
Quadro 3 Índice de perdas. Início da quarentena Início do estudo Final do estudo Índice de perdas % (IP) Grupo 0 10 10 9 10 Grupo 1 10 10 10 0 Grupo 2 10 10 8 20 Grupo 3 10 10 5 50