Universidade de Trás-os-Montes e Alto Douro
Estudo das potenciais vantagens da analgesia epidural em
cirurgia ortopédica
Tese de Dissertação de Mestrado em Medicina Veterinária
Catarina Cardoso Ferreira Mendes
Orientador:
Professor Doutor Luís Miguel Marques Antunes
Co-orientador:
Doutor Amândio José Soares Dourado
II
Estudo das potenciais vantagens da analgesia epidural em cirurgia ortopédica
Tese de dissertação de mestrado em medicina Veterinária
Catarina Cardoso Ferreira Mendes
Orientador: Professor Doutor Luís Marques Antunes
Co-orientador: Doutor Amândio José Soares Dourado
Composição do júri:
__________________________________________________________ __________________________________________________________ __________________________________________________________
III
Termo de responsabilidade
IV
Agradecimentos
No fim deste trabalho torna-se imperativo agradecer a todos aqueles que tornaram a sua realização possível:
Ao professor Luís Antunes por toda a orientação, dedicação e disponibilidade que sempre mostrou. Ao grupo de investigação do IBMC especialmente à Dra. Sónia Campos e ao Dr. Manuel Sant’ana pela atenção e ajuda imprescindíveis.
Ao Dr. Amândio pela orientação, paciência e colaboração, bem como a toda a equipa do HVP, especialmente ao Dr. Luís Lobo e às queridas Natividade Silva e Lurdes Borges, pelo enorme apoio e motivação que sempre me deram. A todos os meus fantásticos colegas de estágio, foram indispensáveis na realização deste trabalho, não podia ter conhecido pessoas melhores, obrigada por todos os bons momentos. Um muito obrigado especial aos macacos Sandra, Tiago e Hélder, e à minha soulsister Teresa, por cada risada, cada lágrima, por cada abracinho.
Ao laboratório INNO pela prontidão no apoio à realização das medições de cortisol.
A toda a equipa do hospital Medivet em Hendon-Londres pela hospitalidade e oportunidades que me deram. À Christine Cuttler e Hollie Walsh a quem agradeço toda a simpatia e apoio. A toda a minha família, aos avós, tios e primos. Aos meus padrinhos Tonito e Elvira por estarem sempre prontos a ajudar. Aos meus primos Henrique e João porque são uns antisstress fórmula concentrada.
À minha família do coração Paula, Aníbal, Márcia, André e Simba, pela ajuda, interesse e por toda a dedicação e carinho, é impagável tudo o que me dão.
A todos os meus amigos mas em especial ao Davide pelo ombro sempre disponível para as minhas mágoas, à Daniela Simões por todos os bons momentos, e ao Gil por ser uma inspiração para ser mais e melhor.
A todos aqueles cujos nomes não estão aqui mas que de alguma forma me inspiraram e me ajudaram a cumprir os meus objetivos.
Quero agradecer principalmente aos meus pais por tudo, pelo apoio, sacrifícios e paciência, sem eles nada disto seria possível. Ao meu pai por ser um exemplo de trabalho e dedicação, à minha mãe por ter sempre as palavras certas nos momentos certos e à minha irmã por estar sempre lá quando eu preciso.
V
Resumo
A preocupação crescente com o bem-estar levou a um crescente interesse pelas técnicas de analgesia bem como à realização de estudos de modo a desenvolver novos protocolos anestésicos balanceados.
Em particular, as técnicas de analgesia epidural têm sido cada vez mais implementadas em ambientes hospitalares pelo seu descrito benefício em termos de analgesia e estabilidade nos períodos intra e pós-cirúrgica.
De modo a avaliar a influência da técnica anestésica, no grau de analgesia intra e pós-operatória, bem como nas implicações no tempo de recuperação e analgesia, foi desenvolvido um estudo com caracter prospetivo, realizado de forma cega e aleatória em ambiente hospitalar em que foram estudados 6 cães com necessidade de realização de cirurgia ortopédica no membro posterior, submetidos a anestesia geral com e sem combinação de epidural.
Os animais incluídos no estudo tiveram uma média de idades de 3 anos, variando entre 1 e 6 anos, com peso médio 28 (+/-19) kg. Os cães foram divididos aleatoriamente em dois grupos - sem epidural (SE) e com epidural (CE). Todos os animais receberam anestesia e analgesia sistémica, tendo como pré-medicação com morfina e robenacoxib, pré-indução com diazepam, e indução com propofol. Nos animais do grupo SE, foi apenas administrado este protocolo. Nos animais do grupo CE foi também administrada por via epidural uma solução de morfina e bupivacaina. Em ambos os grupos o controlo analgésico pós-cirúrgico foi feito com morfina.
Neste estudo foram avaliados pré-cirurgicamente a frequência respiratória (FR), a frequência cardíaca (FC), as pressões arteriais não invasivas (PANI), o nível de dor através da escala modificada de Glasgow e efetuadas colheitas de sangue para doseamento do cortisol sérico. No período intra-cirúrgico foram avaliadas a FR, FC, PANI e a fração inspirada de isoflurano (Fi iso %) e a fração expirada de dióxido de carbono (ET CO2). No
pós-cirúrgico cada animal foi monitorizado imediatamente após a extubação e 1, 4, 8, 12 e 24 horas após a referida extubação. Nestes momentos foram registadas a FR, FC, PANI e avaliada a dor através da escala modificada de Glasgow. Às 4 horas, pós-extubação, foi colhido sangue para doseamento do cortisol sérico. Durante o período de observação no pós-operatório foi ainda recolhida informação acerca do tempo decorrido deste a extubação até ao primeiro apoio do membro e à primeira micção voluntária.
Neste trabalho a pequena amostra estudada levou à obtenção de resultados sem significado estatístico, em todos os parâmetros estudados. Contudo, ficou reconhecida a vantagem no
VI uso das escalas de dor, uma vez que permitiu um melhor controlo e seguimento da recuperação dos animais e da sua analgesia.
VII
Abstract
The increasing concerns about the animal welfare leaded to an increased interest for the analgesic techniques and, as well, an increase of new studies to develop balanced anesthetic protocols.
Particularly the epidural techniques has been more frequently used in hospital environments due to the described benefits in the analgesia a stability either intra and post surgery. Six dogs, aged 3 years average (1 to 6 years), weighing an average of 28 (+/-) kg.all in need of orthopedic surgery on the hind limb, were observed and studied on prospective, blinded and randomized study. Animals were anesthetized with general anesthesia, with and without epidural in order to evaluate the influence of the anesthetic technique, in the level of analgesia during and post- surgery, as well as the implications in the time of recovery and analgesia, in hospital settings.
Animals were randomly divided in two groups without epidural (SE) and with epidural (CE) randomly. All dogs received systemic anesthesia and analgesia which. The premedication was morphine and robenacoxib, pre-induction with diazepam and induction with propofol. Animals in the group SE received only this anesthetic protocol. Animals in the group CE had the same anesthetic protocol and in addiction an epidural solution of morphine and bupivacaine. In both groups morphine was used as post-surgery analgesic.
In this study during the pre-surgery period we measured the heart rate, respiratory rate, non invasive blood pressure, score the pain with the short-form Glasgow composite measured pain scale and measured the serum cortisol. During the surgery were measured the heart rate, respiratory rate, non invasive blood pressure, inspired fraction of isoflurane (Fiiso ) and end tidal carbon dioxide (ETCO2). In the post-surgery each dog was monitored immediately
after the extubation and 1, 4, 8, 12 and 24 hours after that. In those moments we recorded the heart rate, respiratory rate, non invasive blood pressure and pain score with the short-form Glasgow composite measured pain scale. At the 4 hours after extubation we took blood to measure the serum cortisol. During the post-surgery time it was also recorded the time between the extubation and the first ambulation bearing weigh and the time of the first urine. In this study due to the small population we couldn’t obtain significant statistic results in any of the parameters in study. Although it was recognize that the use of the Glasgow pain scale was highly advantageous, once it allowed a better control and monitoring of the analgesia during the recovery.
VIII
Índice geral
Termo de responsabilidade III
Agradecimentos IV
Resumo V
Abstract VII
Índice geral VIII
1. Introdução geral 1
1.1. Anestesia – perspetiva histórica 1
1.2. Dor 1
1.2.1. Avaliação da dor 2
1.2.2. Resposta sistémica à dor 2
1.2.3. Tratamento da dor 4
1.2.3.1. Analgesia preventiva 4
1.3. Anestesia balanceada 4
1.3.1. Efeitos colaterais 5
1.3.2. Opióides como parte da anestesia balanceada 5
1.3.3. Epidural como parte da anestesia balanceada 6
1.3.3.1. Perspetiva histórica 6
1.3.3.2. Fármacos usados 7
1.3.3.3. Efeitos secundários da epidural 9
1.3.3.4. Contra indicações 11
1.4. Objetivos 12
2. Materiais e métodos 13
3. Resultados 18
3.1. Análise comparativa entre os grupos sem epidural e com
epidural 18
3.2. Análise comparativa entre o pré-cirúrgico e o intra-cirúrgico e
recuperação dos grupos sem epidural e com epidural 27
4. Discussão 38
5. Conclusão 42
6. Competências adquiridas 44
7. Bibliografia 48
1
1.Introdução geral
1.1. Anestesia – Perspetiva histórica
A primeira referência à anestesia geral remonta às escrituras bíblicas, sendo a primeira anestesia com fins cirúrgicos descrita em 1849, após Crawford Long utilizar pela primeira vez o éter etílico em 1842 (Boland, 2009).
A anestesia aplicada aos animais está intimamente relacionada com a evolução da anestesia humana, uma vez que a aplicação de anestésicos em animais foi realizada pelos investigadores, com vista a prever o comportamento e reação humana aos fármacos usados (Eldor, 1995; Jones, 2001; Jones, 2002). O primeiro livro dedicado exclusivamente à anestesia veterinária é publicado apenas em 1915 por Hobday (Jones, 2002).
Na medicina veterinária o uso da anestesia/sedação não se restringe à prática cirúrgica, sendo também indispensável no decorrer de procedimentos médicos, principalmente em animais dolorosos, ansiosos ou menos cooperantes (Hall et al, 2001).
Atualmente, e ainda que a preocupação pelo bem-estar animal tenha vindo a crescer, o tratamento da dor é por vezes subvalorizado. Estudos sugerem que o uso de analgesia em pequenos animais é insuficiente (Lascelles et al, 1995). A dor não tratada vai ter várias consequências nefastas que contribuem para um agravamento e prolongamento da condição clínica do animal (Wetmore, 2000).
Os princípios da anestesia assentam na perda de consciência (hipnose), promoção de ausência de dor (analgesia) e de relaxamento muscular (Hall et al, 2001).
1.2.Dor
A dor é um fenómeno fisiológico complexo e interessante, difícil de definir. Nos animais é mais difícil de identificar e interpretar. Respostas subjetivas encontradas nos humanos são comparáveis às encontradas nos animais usando analogias baseadas em estudos anatómicos, fisiológicos e patológicos. A dor é tida como uma perceção e não como uma entidade física. A perceção daquela depende da funcionalidade do córtex cerebral, no entanto, não há uma área específica do córtex cerebral responsável pela perceção da dor (Sawyer, 1998).
Em Medicina Veterinária a avaliação de dor tornou-se uma preocupação crescente, dificultada pelo facto de os animais não se expressarem verbalmente, sendo por isso baseada na interpretação comportamental, já que outros sinais vitais são descritos como
2 não sendo indicadores fiáveis de dor em ambiente hospitalar (Holton et al, 1998). Isto torna a avaliação muito dependente do observador e da sua capacidade de a reconhecer e medir.
1.2.1.Avaliação da dor
A dificuldade de reconhecimento da dor foi descrita como uma das causas mais comuns de descontinuação de analgésicos, sugerindo assim a necessidade de desenvolver ferramentas que facilitem a sua medição (Lascelles et al, 1995).
No âmbito de mensurar a dor, foram desenvolvidos vários tipos de escalas de dor.
Escalas como o sistema de gradação preditiva, escala visual analógica, escala descritiva simples e escala de pontuação numérica são escalas de dor subjetivas ou semi-objetivas. Estas escalas têm a vantagem de serem facilmente aplicáveis em ambiente clínico e a sua utilização é bastante intuitiva. Pelo contrário, têm como desvantagem a influência do observador e a falta de sensibilidade para alterações comportamentais (Coutinho, 2012). Para colmatar estas fraquezas, as Universidades de Melbourne e do Colorado desenvolveram escalas que têm em conta o carater comportamental da dor, no entanto as mesmas carecem de validação por estudos clínicos. A escala de dor desenvolvida pela Universidade de Glasgow, na sua forma abreviada, é atualmente a única escala de dor para animais validada e que permite a avaliação comportamental do animal, tendo associado um sistema de pontuação que facilita o acompanhamento, evolução e tomada de decisões quanto à dor aguda do paciente (Coutinho, 2012; Reid et al, 2007).
Atividade excessiva ou letargia relativa são ambos comportamentos relacionados com o estado doloroso. As expressões de dor podem manifestar-se em comportamentos como gemer, chorar, ganir, rosnar, olhar para a área afetada, lamber ou morder, ou simplesmente depressão (Sawyer, 1998).
1.2.2. Resposta sistémica à dor
A lesão tecidular provoca dois tipos de alteração na resposta do sistema nervoso central: 1) sensibilização periférica com redução do limiar nociceptivo e 2) sensibilização central com aumento da excitabilidade dos neurónios espinhais. Estes fatores juntos contribuem para o estado de hipersensibilidade e dor pós-cirúrgico, manifestado com uma diminuição do limiar de dor e maior resposta aos estímulos dolorosos quer na região lesada quer na zona envolvente (Ilkiw, 1999).
O prolongamento de estados dolorosos, inicialmente agudos, leva ao estabelecimento de dor crónica, mais difícil e morosa de tratar. Assim, o tratamento da dor aguda deve ser parte integrante do tratamento, de modo que a dor crónica não se estabeleça (Chohan, 2010).
3 ESTIMULO DOLOROSO Somático Sensitivo Dor Motor Movimento Autonómico Respiração Hemodinâmico Pressão Arterial Sudomotor Sudorese Hormonal Resposta de Stress
Os anestésicos gerais, por definição, suprimem a perceção do estimulo doloroso, no entanto podem não suprimir outros reflexos somáticos e autonómicos causados pelo ato cirúrgico. A resposta a esses reflexos pode ser modificada pelo uso da anestesia balanceada, beneficiando o paciente (Ilkiw, 1999).
A perceção e reconhecimento da dor podem ser suprimidos com concentrações sanguíneas de anestésicos, que são insuficientes para suprimir as respostas motoras. Estas respostas são caracterizadas por movimentos da cabeça ou extremidades (Ilkiw, 1999). Contudo, embora os reflexos motores sejam suprimidos, o estimulo doloroso pode ainda assim ativar o sistema nervoso simpático, resultando em respostas autonómicas classificadas como sudomotor, hemodinâmicas ou hormonais (Ilkiw, 1999).
Ao nível hormonal as respostas à estimulação cirúrgica são caracterizadas pela alteração da homeostase proteica, hipermetabolismo, alteração do metabolismo dos hidratos de carbono, retenção de água e sódio, aumento da lipólise e alterações no sistema imunitário (correlacionadas com aumento do risco de sépsis e mortalidade). Os anestésicos voláteis são no geral e por si só, incapazes de suprimir estas respostas ao stress, sendo estas evidenciadas sistemicamente pelo aumento do cortisol, causando o aumento da glicemia, do catabolismo das proteínas e interferindo no equilíbrio hídrico. Taquicardia, arritmias ventriculares e hipertensão são exemplos de disturbios hemodinâmicos causados pelas catecolaminas libertadas em consequência do stress. Todos estes fatores vão interferir com a adequada perfusão dos tecidos, lesando-os e aumentando o consumo de oxigénio
Esquema 1.1: Representação esquemática das respostas reflexas ao estímulo doloroso, organizadas da direita para a esquerda por ordem de supressão pelos anestésicos gerais (adaptado de Ilkiw, 1999).
4 (Wetmore, 2000), com atraso na cicatrização das feridas e suturas. Astécnicas de anestesia balanceada têm capacidade de suprimir total ou parcialmente as respostas hemodinâmicas, metabólicas e de stress levando a uma menor morbilidade e mortalidade pós-cirúrgica (Ilkiw, 1999; Liu, et al, 1995).
1.2.3.Tratamento da dor
1.2.3.1. Analgesia preventiva
A analgesia preventiva, administrada antes que o estímulo doloroso ocorra é uma técnica com cada vez mais enfase na prática cirúrgica. O objetivo é proporcionar uma cirurgia mais estável, prevenir ou reduzir os níveis de dor resultantes da cirurgia e minorar a necessidade de analgesia no pós-cirúrgico. Este objetivo pode ser alcançado com a administração de opióides, α2- agonistas e anti-inflamatórios não esteroides (AINE) no período de
pré-medicação (Chohan, 2010). É por isso crucial o desenvolvimento de um protocolo anestésico/analgésico individual que tenha em conta o estado hígido e fisiológico do animal e o nível de dor previsto para cada situação, tendo em vista diminuir os níveis de stress e dos tempos de recuperação (Liu, et al, 1995; Wetmore, 2000; Yeager et al,1987).
1.3. Anestesia balanceada
A anestesia balanceada comporta várias combinações de fármacos, dando origem a protocolos anestésicos diferentes, que cada anestesista decidirá em função do material existente, da experiência no uso da técnica escolhida, do prognóstico para a recuperação e dor pós-operatória, da espécie, idade, temperamento e estado hígido do animal, da intervenção cirúrgica e duração prevista (Johnson, 1999).
O procedimento anestésico pode ser decomposto em três partes principais: pré-medicação, indução e manutenção.
A pré-medicação constitui uma parte importante da anestesia uma vez que proporciona um alívio da ansiedade bem como uma diminuição do stress, produzindo uma sedação e analgesia moderada e aumentando o relaxamento muscular. A pré-medicação pode ainda diminuir as secreções salivares e aéreas, diminuir os efeitos secundários dos fármacos anestésicos subsequentes, suprimir o vómito e a regurgitação, reduzir a dose de anestésico necessária para a promoção do estado de inconsciência e contribuir para melhorar a analgesia pós-operatória (Lukasik, 1999).
5 A indução pode ser conseguida com o uso de apenas um fármaco ou da combinação de vários fármacos administrados por diferentes vias (intravenosa, intramuscular ou inalatória). A indução é o período mais instável da anestesia tendo em conta os efeitos dos fármacos e todas as alterações fisiológicas a que o animal está sujeito, principalmente a nível cardiovascular. Para uma boa indução é importante que a pré-medicação tenha sido adequadamente escolhida (Sawyer et al, 2007).
A manutenção anestésica pode ser feita recorrendo a anestésicos injetáveis ou voláteis, os primeiros são maioritariamente usados em procedimentos mais rápidos, uma vez que necessitam de uma monitorização mais efetiva. Em cirurgias prolongadas o uso de agentes injetáveis não está recomendado, visto que os seus efeitos são mais difíceis de reverter (Nolan et al, 1999).
1.3.1.Efeitos colaterais
Tanto em cães como em gatos o uso de anestésicos voláteis como o isoflurano e o sevoflurano são responsáveis pela depressão progressiva do sistema nervoso central, conduzindo também a uma depressão dose dependente dos sistemas cardiovascular e respiratório (Ilkiw, 1999; Chohan, 2010). Embora a reconhecida segurança associada aos agentes voláteis, estes não são isentos de complicações ou efeitos colaterais aos quais o anestesista deve estar atento. Assim, o isoflurano, um dos anestéticos voláteis mais vulgarmente utilizados, é responsável por acentuada depressão respiratória e hipotensão, sendo no entanto estável a nível do outputcardíaco (Chohan, 2010; Ilkiw, 1999).
Esta depressão cardiorrespiratória causada pelos anestésicos voláteis vai, a nível sistémico, dar origem a problemas como uma inadequada perfusão dos órgãos vitais, especialmente quando a profundidade anestésica é aumentada de modo a atenuar as respostas autonómicas aos estímulos dolorosos (Chohan, 2010; Ilkiw, 1999).
1.3.2.Opióides como parte da anestesia balanceada
O uso de opióides é tido como promotor e produtor de maior estabilidade hemodinâmica na presença de estímulo doloroso (Chohan, 2010; Ilkiw, 1999).
Os opióides eliminam significativamente as respostas hemodinâmicas ao estímulo doloroso e induzem uma depressão cardíaca mínima (Ilkiw, 1999).
A sua administração conjunta com os anestésicos inalatórios vai diminuir a dose destes. No caso da morfina, pode levar a uma redução da concentração mínima alveolar (CAM) na ordem dos 63% (Ilkiw, 1999).
6 Os opióides podem ser administrados em bolus, ou em infusão a taxa contínua. A infusão é por muitos descrita como a técnica mais benéfica a nível de estabilidade hemodinâmica e redução de doses de outros fármacos. A administração de fármacos por infusão permite ainda a diminuição dos efeitos secundários, mais rápida recuperação de consciência, menor depressão respiratória e melhor analgesia preventiva (Ilkiw, 1999).
1.3.3. Epidural como parte da anestesia balanceada
Tem-se verificado nos últimos anos um interesse crescente na utilização de técnicas de anestesia local como parte dos protocolos de anestesia balanceada. A anestesia local pode ser administrada de várias formas consoante o efeito e local que se pretende insensibilizar. Neste contexto, a anestesia epidural pode ser considerada como fazendo parte da anestesia balanceada.
1.3.3.1. Perspetiva histórica
A primeira analgesia espinhal foi feita em 1885 por Corning, neurologista, que acidentalmente perfurou a duramater do seu cão enquanto experimentava a injeção de cocaína nos nervos espinhais deste (Eldor, 1995; Jones, 2001).
A anestesia local é hoje amplamente utilizada como protocolo standard para toracotomias, resolução de fraturas de bacia e dos membros posteriores, procedimentos cirúrgicos caudais ao umbigo, cirurgias abdominais caudais, perineais e da cauda, proporcionando analgesia e relaxamento muscular de modo simples e seguro (Sawyer, 1998; Zhang et al, 2011).
Nas últimas décadas em medicina humana o uso da anestesia loco-regional tem sido cada vez mais popular. Os efeitos benéficos, como a diminuição da hemorragia intra-cirúrgica, do catabolismo pós-cirúrgico e da incidência de episódios de tromboembolismo, melhorando a recuperação e função pulmonar pós-cirúrgica, têm contribuído para o incremento da sua prática (Liu et al, 1995; Yeager et al, 1987). Para além disso, o uso de anestesia/analgesia epidural tem sido associado a uma menor sedação pós-cirúrgica, recuperação dos movimentos mais rápida e melhor oxigenação (Stegmann, 2010; Yearger, et al, 1987). Pacientes anestesiados com recurso a anestesia e analgesia epidural apresentam uma maior estabilidade anestésica intra-cirúrgica e uma redução na morbilidade e das complicações pós-cirúrgicas, menor incidência de falha cardiovascular e infeções (Baron, et al,1991; Eldor, 1995; Liu, et al, 1995; Stegmann, 2010).
7 1.3.3.2. Fármacos usados
O uso simples de anestésicos locais, como a lidocaína e a bupivacaína, está associado ao bloqueio das fibras simpáticas e da dor em conjunto com a perda da sensação e da função motora, proporcionando um alívio completo da dor. Este potente efeito analgésico tem efeitos intra-cirúrgicos e durante o período de recuperação (Ilkiw, 1999). No entanto, estes anestésicos locais têm potencial neurotóxico em altas concentrações, podendo causar morte neural. Mesmo fármacos mais recentes como a ropivacaína e a levobupivacaína, têm potenciais efeitos neurotóxicos e efeitos colaterais cardíacos, embora mais reduzidos (Allegri et al, 2009).
Fármacos como a lidocaina são amplamente utilizados em anestesia local, no entanto esta é desaconselhada na epidural por estar associada a alterações neurológicas, após administração intratecal (Allegri et al, 2009; Zaric et al, 2005a). A bupivacaina é uma das alternativas ao seu uso, uma vez que é bem tolerada por todos os tecidos. No entanto a administração intravenosa involuntária de bupivacaina pode dar origem a arritmias e falhas cardíacas (Allegri et al, 2009).
Os opióides atuam nos recetores opióides no corno dorsal da medula espinhal (Wetmore, 2000). Os recetores opióides são os locais normais de ligação de várias substâncias endógenas, responsáveis pela dor. Existem três tipos de recetores opióides designados de mu, kappa e sigma. Analgésicos agonistas como a morfina, fentanil e oxymorfona, exercem a sua ação atuando nos recetores mu. Os opióides antagonistas são substâncias que se ligam aos recetores opióides exercendo um ligeiro ou nenhum efeito agonista como a naxolona. Compostos que exercem ambos os efeitos são designados opióides agonistas-antagonistas (Sawyer, 1998).
A associação de analgésicos opióides, como morfina, na solução anestésica epidural ou espinhal, vai bloquear seletivamente a condução do estímulo doloroso, prolongando a analgesia, sem interferir na função neuromuscular e depressão do sistema nervoso simpático, não comprometendo a ambulação, como acontece com o uso simples de analgésicos locais (Ilkiw, 1999; Sawyer, 1998; Stegmann, 2010; Wetmore, 2000).
Para além disso, o bloqueio da função sensorial durante a cirurgia vai permitir uma redução na CAM, proporciona estabilidade hemodinâmica e bloqueio das respostas autonómicas ao estímulo doloroso. Enquanto o estímulo se encontrar bloqueado, no período pós-cirúrgico, vai permitir o prolongamento da analgesia (Ilkiw, 1999; Stegmann, 2010).
8 O uso combinado de um opióide e anestésico local, como a morfina e a bupivacaina na injeção epidural promove uma melhor analgesia do que a injeção simples de morfina (Liu, et al, 1995; Smith, 2013). Assim, a combinação de um opióide com um anestésico local vai promover uma melhor analgesia, minimizando os efeitos colaterais associados a ambos os fármacos. O objetivo desta co-administração é a potenciação (Aminkov, 2001), sem prolongar a efeito motobloqueador do anestésico local (Ilkiw, 1999; Jones, 2001; Wetmore, 2000).
A rapidez de atuação e duração do efeito dos opióides está ligada á sua solubilidade. Assim, opióides com boa lipossolubilidade como a meperedina e o fentanil, produzem um efeito rápido mas de curta duração, e opióides com baixa lipossolubilidade como a morfina levam mais tempo a produzir o seu efeitos (30-60min) (Jones, 2001; Sawyer, 1998) mas a sua duração é mais prolongada (6-12 horas). Esta característica pode levar a potenciais riscos, permitindo a sua difusão pelo líquido cefalorraquidiano, podendo ocorrer absorção sistémica com risco de depressão respiratória, mesmo horas após a sua administração (Allegri et al, 2009; Wetmore, 2000). A baixa lipossolubilidade de morfina torna-a um opióide de elevada potência, sendo a sua administração por via epidural 10 vezes mais potente que a sua administração por via sistémica (Jones, 2001; Wetmore, 2000).
Existe ainda a possibilidade de adicionar na solução epidural α2-agonistas, que tal como os
opióides induzem analgesia sem perda significativa da função motora. Tal como os opióides atuam no corno dorsal da medula espinhal, deprimindo a transmissão do estímulo doloroso proveniente da periferia para o cérebro. Os α2-agonistas têm uma longa duração quando comparados com doses semelhantes de lidocaína. Os mais utilizados em animais de companhia são a medetomidina e a dexmedetomidina (Wetmore, 2000). Estudos recentes indicam que o uso de Dexmedetomidina na epidural tem um grande poder analgésico em ratos (Asano et al, 2000) e cães (Sabbe et al, 2007), reduzindo também a CAM dos agentes voláteis utilizados. Embora os α2-agonistas possam ser utilizados sozinhos na epidural a sua
qualidade e duração de analgesia é melhorada quando utilizados em conjunto com opióides e/ou anestésicos locais (Wetmore, 2000).
9 As tabelas seguintes apresentam as propriedades de alguns dos fármacos mais utilizados nas administrações epidurais:
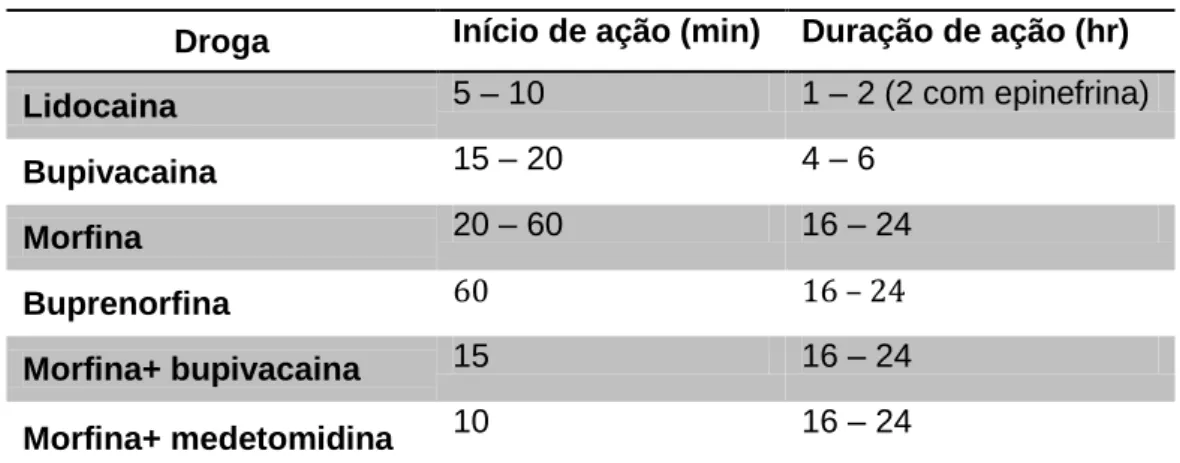
Tabela 1.2: Tempos de início de ação e duração de ação dos fármacos e combinações de fármacos mais utilizadas em administrações epidurais (adaptado de Dugdale, 2010).
1.3.3.3. Efeitos secundários da epidural
As complicações associadas à analgesia epidural são raras, quando o paciente é cuidadosamente preparado, e são consideradas todas as contraindicações à sua realização e a experiência do técnico responsável pela administração (Wetmore, 2000).
Quando é utilizada a combinação de um anestético local com um opióide, por ação do anestésico local, pode haver paralisia motora mesmo depois de o paciente recuperar a consciência. Nesses casos é aconselhada a contenção dos membros posteriores, de modo a prevenir a abertura excessiva com lesão dos músculos adutores e nervos obturadores (Campoy et al, 2012).
A dispersão craneal, a nível torácico, dos anestésicos locais pode levar a estados hipotensivos. O bloqueio simpático vai inibir o reflexo vasoconstritor em resposta à hipovolémia, o que pode levar à hipotensão. Esta situação pode ser prevenida ou tratada
Lipossolubilidade relativa Toxicidade Potência relativa Ligação às proteínas Lidocaina 150 Médio 2 65% Mepivacaina 50 Baixo 2,5 75% Bupivacaina 1000 Elevado 8 95% Ropivacaina 400 Médio 6 95%
Tabela 1.1: Propriedades dos anestésicos locais mais utilizados em administração epidural (adaptado de Dugdale, 2010).
Droga Início de ação (min) Duração de ação (hr)
Lidocaina 5 – 10 1 – 2 (2 com epinefrina)
Bupivacaina 15 – 20 4 – 6
Morfina 20 – 60 16 – 24
Buprenorfina 60 16 – 24
Morfina+ bupivacaina 15 16 – 24
10 com fluidoterapia e administração de α1- agonistas como a fenilefrina (Campoy et al, 2012;
Chohan, 2010; Jones, 2001; Stegmann, 2010; Wetmore, 2000).
Outro potencial efeito secundário após a administração de anestésicos locais é a paralisia respiratória (Liu et all, 1995; Wetmore, 2000). Esta complicação tem maior probabilidade de ocorrer em animais obesos pois têm um canal epidural relativamente pequeno e grandes quantidades de gordura epidural. A injeção rápida dos fármacos e o posicionamento da cabeça em plano inferior ao corpo, pouco tempo após a administração pode causar uma migração craneal, promovendo a paralisia respiratória. A injeção intratecal inadvertida é outra das causas para paralisia respiratória devida á migração pelo líquido cefalorraquidiano. Esta depressão respiratória deve ser tratada com ventilação assistida e administração de baixas doses de naloxona intravenosa (Wetmore, 2000).
A injeção intramuscular acidental de anestésico local pode causar sinais de toxicidade como convulsões ou colapso cardiopulmonar (Zhang et al, 2011).
A administração conjunta de opióides, na epidural pode minimizar (não eliminar) a gravidade e incidência desses efeitos colaterais (Campoy et al, 2012).
Convencionalmente os opióides são administrados para proporcionar analgesia intra e pós-operatória, no entanto, os opióides estão associados a efeitos colaterais e secundários com relação dose/efeito, como depressão generalizada do sistema nervoso central ou disforia, esvaziamento gástrico prolongado, náusea, vómito e regurgitação, depressão respiratória, prurido e retenção urinária (Campoy et al, 2012; Liu et al, 1995). É contudo, pouco provável que uma única injeção epidural cause retenção urinária (Ilkiw, 1999). No entanto, é essencial (principalmente se o animal estiver sob fluidoterapia) verificar a bexiga frequentemente e se necessário recorrer ao esvaziamento intermitente (por compressão) ou cateterização uretral (Campoy et al, 2012; Jones, 2001).
A complicação mais comum da epidural é a falha do efeito anestésico. Em 12% dos casos devido à dificuldade de identificar as referências anatómicas, para a punção no local adequado e administração (Wetmore, 2000; Jones, 2001).
O prurido é normalmente associado à administração intratecal de morfina, mas a sua ocorrência é rara (Wetmore, 2000; Chohan, 2010; Jones, 2001). Esta situação pode ser tratada com anti-histaminicos, antagonistas dos recetores μ, como o butorfanol e a naloxona (Wetmore, 2000).
A lesão nervosa devido à punção e injeção inadvertida na medula ou grandes ramos nervosos, pode ocorrer causando alterações neurológicas. Aquando do acesso à epidural devem evitar-se movimentos bruscos ou laterais tendo atenção à resistência à entrada da
11 agulha ou à administração dos fármacos (Auroy et al, 1997; Wetmore, 2000). A solução anestésica também é suscetível de causar complicações neurológicas, como síndrome de Horner e reflexo de Shiff Sherrington dependendo do local de administração. Podem ainda ocorrer tremores musculares, coma ou convulsões (Jones, 2001).
O aparecimento de sangue pode ocorrer, sendo indicativo de lesão dos vasos sanguíneos do espaço epidural. Nesse caso deve reiniciar-se o processo, rejeitando a agulha. Normalmente estas situações são autolimitadas e não causam problemas, no entanto, pode ocorrer a formação de hematomas no espaço epidural, dando origem a sinais neurónio motor inferior no local onde se formou o hematoma e neurónio motor superior (hiperreflexia) abaixo deste. Nestes casos está aconselhada a descompressão cirúrgica (Jones, 2001; Wetmore, 2000). Esta situação tende a ser mais frequente quanto maior o número de tentativas realizadas (Zhang et al, 2011).
O aparecimento de líquido cefalorraquidiano na agulha significa a inserção desta no canal espinhal, nesse caso a agulha deve ser imediatamente removida, e o processo repetido com novo material. Nestes casos deve-se reduzir a dose do anestésico local a administrar para 50% (Jones, 2001). O elevado número de tentativas infrutíferas pode produzir trauma neurológico (Zhang et al, 2011).
Abcessos ou infeções no sistema nervoso central são pouco comuns em animais saudáveis, sendo mais frequentes em animais com quadros críticos com predisposição para sépsis (Wetmore, 2000).
1.3.3.4. Contra-indicações
A anestesia/analgesia epidural apresenta-se como uma técnica muito vantajosa na prática clínica, no entanto está associada a vários riscos. Assim a epidural está contraindicada em pacientes traumatizados com alterações neurológicas ou anatómicas nos membros posteriores ou em pacientes com infeções cutâneas ou subcutâneas na área de injeção, septicemia ou coagulopatias (Ilkiw, 1999; Jones, 2001; Sawyer, 1998; Wetmore,2000). Pacientes que apresentem hipovolemia devem vê-la corrigida antes da administração da epidural (Jones, 2001).
12
1.4. Objetivos
Este estudo teve como objetivo principal perceber as vantagens do uso da técnica epidural na analgesia no período peri-operatório em ambiente clínico. Para isso teve ainda o objetivo de elaborar e aplicar um protocolo de monitorização da dor peri-operatório (ANEXO I, II, III) e verificar a utilidade e facilidade de implementação da escala de dor modificada de Glasgow em ambiente hospitalar (ANEXO IV).
13
2. Material e métodos
Após aprovação do plano de tese pela comissão de Mestrado Integrado em Medicina Veterinária Universidade de Trás-os-Montes e Alto Douro e da direção clinica do Hospital Veterinário do Porto, foram utilizados neste estudo os dados relativos a 6 cães. Os animais foram divididos em 2 grupos – grupo SE (sem epidural) - 1 west highland terrier, 1 pastor
alemão e 1 golden retriever; Grupo CE (com epidural) - 1 rottweiler, 1 montanha dos pirinéus
e 1 epagneul berton. Inicialmente grupos A e B respetivamente. Os animais foram classificados segundo a escala da American Society of Anesthesiologists (ASA) com I ou II e apresentaram, uma idade média de 3 anos, variando entre os 1 e os 6. Estes animais tinham um peso médio de 28kg e um desvio padrão de 19kg. Todos os proprietários tomaram conhecimento do protocolo e assinaram o consentimento anestésico.
Neste estudo foram incluídos cães com necessidade de realização de cirurgia ortopédica nos membros posteriores, adultos, sem alterações fisiológicas ou doença prévia, passiveis da alteração dos dados recolhidos. As cirurgias incluídas foram, Tibial plateau leveling osteotomy – TPLO (dois animais) e recessão da cabeça do fémur (quatro animais).
Os critérios de exclusão foram os seguintes: animais com ASA igual ou superior a 3, animais nervosos ou agressivos, presença de alterações neurológicas ou neuromusculares, coagulopatias, alterações cutâneas (infeções ou inflamações), doença endócrina, hepática, renal ou gastrointestinal, contraindicações para o uso de AINE’s.
Os animais foram incluídos no grupo SE ou CE após análise do historial médico e das análises pré-anestésicas nomeadamente do hemograma, perfil bioquímico hepático e renal, e eletrocardiograma (ECG), de modo a garantir o seu estado de saúde. A divisão entre grupos foi realizada de forma aleatória entre o grupo sem epidural e grupo com epidural. Os animais permaneceram em jejum pré-anestésico durante 12 horas e sem água durante 4 horas.
Cada animal foi cateterizado na veia cefálica e conectado a um sistema de fluidos, através do qual se administrou lactato de ringer (LR®, Braun, Barcarena, Portugal), a uma taxa de 10ml/kg/hora. Caso fosse observada hipotensão (PAM <60 mmHg) seria administrado um bolus de fluidos 20ml/Kg durante 10 minutos. Se a hipotensão perdurasse após 2 bolus consecutivos sem efeito recorria-se à administração de coloides 5-10 ml/Kg (Tetraspan®, 100mg/ml, Brawn, Melsungen, Alemanha) em 10 minutos. A administração de dopamina 5ug/kg/min (Medopa®, 4mg/ml, Medinfar, Amadora, Portugal) seria utilizada se não houvesse resposta a 2 bolus de coloides.
14 No grupo SE foi utilizado o seguinte protocolo anestésico: pré-medicação com morfina (Morfina – Laboratório Militar, Lisboa, Portugal – 1% (0.1g/ml)) 0,5 mg/kg intramuscular 30 minutos pré-indução; robenacoxib (Onsior® – Novartis, Surrey, UK – 20mg/ml) 2mg/kg subcutâneo 30 minutos pré-indução; diazepam (Diazepam – Labesfal, Campo de Besteiros, Portugal – 5mg/ml) 0,5mg/kg intravenoso 5 min pré-indução. Os animais foram induzidos com propofol (Vetofol® – Esteve, Carnaxide, Portugal – 10mg/ml) 4mg/kg intravenoso 5 minutos após a administração do diazepam, o propofol foi administrado em bolus de 1/3 da dose (4 mg/Kg) até se obter o status ótimo para a intubação endotraqueal.
No grupo CE a pré-medicação e indução foi igual ao grupo SE. Contudo neste grupo, após indução, foi administrada epidural com 0,1 mg/kg morfina (Morfina – Laboratório Militar, Lisboa, Portugal – 1% (0.1g/ml)) e 0,5 mg/kg bupivacaina (Marcaína® – Astra Zeneca, Södertälje, Suécia – 5mg/mL) não excedendo 0,1 ml/kg de volume total.
Para a manutenção de ambos os grupos foi utilizado isoflurano (Isoflo® – Esteve, Carnaxide, Portugal – 100% p/p) 0,5-2% e oxigénio, em caso de superficialização súbita recorreu-se a administração de propofol até atingir o status anestésico desejado (incrementos de 0,4 mg/kg/min).
A profundidade anestética foi avaliada tendo em conta os reflexos palpebral, rotação ocular e reflexo pedal (avaliado membro anterior exercendo pressão na pele interdigital durante 1 segundo) e tónus muscular do músculo masséter.
Durante o período pós-cirúrgico, como protocolo de controlo de dor, foi administrada morfina (0,5mg/kg) a cada seis horas. A morfina foi também utilizada como fármaco de resgate sempre que o somatório da escala de dor de Glasgow fosse superior a 6. A frequência e dose poderiam também ser alteradas com base na escala de dor e avaliação geral sob indicação médico-veterinária.
Para a realização da epidural os pacientes foram posicionados em decúbito esternal, com os membros posteriores dirigidos cranealmente. Uma agulha (Dahlhausen – 22G x 3’’, P.J. Dahlhausen & Co., Köln, Germany) foi inserida no espaço lumbosacral (L7-S1) até se sentir o característico som “pop”, causado pela penetração nos ligamentos amarelos e entrada na cavidade epidural (figura 2.1). A localização da agulha foi confirmada através da injeção de 0,5 cm3 de ar, com seringa estéril e verificação da não resistência à sua entrada. Após verificar que não havia extravasamento de fluido cerebrospinal ou sangue procedeu-se há injeção de morfina (0,1mg/kg) e bupivacaina (0,5mg/kg), com volume final de solução 0,1ml/kg. Todas as administrações foram feitas pelo mesmo clínico.
15 Todos os animais foram tricotomizados da mesma forma de modo a não se conseguir distinguir os grupos.
Foram recolhidos dados pré-cirúrgicos que funcionam como dados de controlo. Sensivelmente uma hora antes de iniciar a pré-medicação procedeu-se à recolha da frequência respiratória (FR), frequência cardíaca (FC) (Datex Ohmeda® S/5 – General Electric, HEALTHECARETM, Fairfield, USA), pressões arteriais não invasivas (PANI) (Dinamap® V100 – General Electric, CARESCAPETM, Fairfield, USA) e preenchimento da escala de dor modificada de Glasgow (ANEXO II), recolheram-se ainda 8ml de sangue para medição do cortisol pré-cirúrgico. A recolha destes dados foi feita algum tempo após a chegada do animal de modo a poder ambientar-se ao internamento, evitando a colheita de dados alterados por fatores de stress.
Os dados foram recolhidos com uma ordem específica de modo a causar o menor stress possível, evitando a viciação dos resultados. Assim iniciou-se a recolha pelo preenchimento dos campos da escala de dor modificada de Glasgow, que não requerem contacto com o cão, campos A e D. Não se preencheu o campo B uma vez que os animais tinham comprometido o andamento no seu membro posterior. Ainda sem manipular o cão registou-se a frequência respiratória. Com o mínimo de manipulação possível recolheu-registou-se a frequência cardíaca, seguida da medição das pressões arteriais não invasivas, foram realizadas 5 medições e registada a média destas. Preencheu-se o campo C da escala de dor modificada de Glasgow e por fim recolheram-se para tubo seco 8ml de sangue da veia jugular, que foi centrifugado a 5000 rotações por minuto, durante 5 minutos, refrigerado e enviado para laboratório (INNO laboratório Veterinário) etiquetado como T0, para medição
16 quantitativa de Cortisol (IMMULITE® 1000 systems – SIEMENS, Los Angeles, USA). Este equipamento permite-nos a quantificação do cortisol sérico através de um imunoensaio competitivo de fase sólida, de enzimas químico-luminosas.
Durante o período de preparação cirúrgica do animal e após este estar na mesa cirúrgica sob anestesia geral, foram recolhidos FR, FC, PANI, fração inspirada de isoflurano (Fi iso) e fração expirada de dióxido de carbono (ETCO2), aos 15, 10 e 5 minutos pré-incisão, sendo
considerando para análise estatística apenas os dados recolhidos 10 minutos pré-incisão. Intra-cirurgicamente foram recolhidas a cada 5 minutos a FR, FC, PANI, Fi iso e ETCO2,
sendo analisados estatisticamente apenas momentos considerados cruciais por serem os passiveis de causar maior estímulo doloroso, nomeadamente a incisão e a osteotomia. Procedeu-se ainda à recolha, durante o pós-cirúrgico, da FR, FC, PANI e preenchimento de escalas de dor modificada de Glasgow que neste caso poderia ter valores mínimos de 0 e máximos de 20, uma vez que a secção B da escala não foi preenchida.
Durante o pós-cirúrgico os animais foram colocados em ambiente calmo e confortável. As recolhas de dados foram feitas nos seguintes períodos: imediatamente pós-extubação, 1 hora, 4 horas, 8 horas, 12 horas e 24 horas extubação. Sendo que às 4 horas pós-extubação procedeu-se à recolha de 8 ml de sangue, seguida de centrifugação e refrigeração, para a segunda medição cortisol (identificada como T4).
Foram ainda recolhidos o tempo de primeiro apoio do membro e primeira micção voluntária. Todos os dados foram recolhidos por uma só pessoa, em todos os momentos de recolha. Para uma mais correta elaboração da escala de dor o operador realizou um treino prévio, aplicando a escala de dor a cerca de 30 animais internados.
Esquema 2.1: Representação temporal do período pré e intra-cirúrgico: A – monitorização pré-cirúrgica, 1 hora antes da pré-medicação; B – pré-medicação: morfina 0,5mg/kg IM e robenacoxib 2mg/kg SC, 30 minutos pré-indução; C – diazepam 0,5mg/kg IV, 5 minutos pré-indução; D – indução: propofol 4mg/kg IV; E – epidural: morfina 0,1mg/kg + bupivacaina 0,5mg/kg, após
entubação endotraqueal; F,G,H – monitorização 15,10 e 5 minutos respetivamente antes da
incisão cutânea; I – incisão cutânea; J – fim da sutura cutânea/ fim da cirurgia; i – tempo de preparação do animal cateterização; ii- preparação do animal, tricotomia e lavagem e assepsia; iii – período intra-cirúrgico, com monitorizações a cada 5 minutos até ao fim da cirurgia.
17 A análise estatística foi feita recorrendo ao programa Excel® (Microsoft corporation, versão 2007, Redmond, USA) e GraphPad Prism 6. (Graphpad Prism, versão 6.00 para Windows, Graphpad software, San-Diego, Califórnia, USA, e www.graphpad.com). Utilizando o teste de Mann-Whitney, para variáveis não paramétricas, que permite a análise comparativa de medianas de grupos de pequenas dimensões. Procedeu-se à comparação entre o grupo SE e CE e entre os valores de pré-cirúrgico (que funciona como grupo de controlo) e os intra- e pós-cirúrgico. Nas tabelas são apresentados os valores de P para as diferentes variáveis do grupo com epidural, comparadas com o grupo sem epidural.
18
Gráfico 3.1.1: Valores absolutos de frequência respiratória de todos os animais observados (A,B,C,D,E,F). Animais A, B e C pertencentes ao grupo SE e animais D, E e F pertencentes ao grupo CE. Os momentos 0,1,4,8,12, 24 horas representam os momentos de monitorização pós-extubação.
Frequência Respiratória
3. Resultados
A análise dos dados foi feita com o programa Excel® para processamento da informação e Graphpad® Prism para análise estatística. Os resultados foram obtidos através do teste estatístico de Mann-Whitney, teste de comparação de pares de dados para variáveis não paramétricas. Os resultados estão apresentados sob a forma de tabelas onde são representadas a mediana e o intervalo de confiança de 95%, bem como o valor de P. Os resultados observados mostraram uma ausência de significado estatístico, muito provavelmente devido à reduzida amostra em cada grupo de estudo.
Os resultados foram interpretados separando os períodos de observação em três fases. Assim, a primeira foi a fase peri-cirúrgica que inclui os 10 minutos pré-incisão, a incisão e a osteotomia. A segunda fase acompanha a recuperação pós cirúrgica nas primeiras 8 horas. A terceira fase corresponde ao período de recuperação mais tardio (12 e 24 horas).
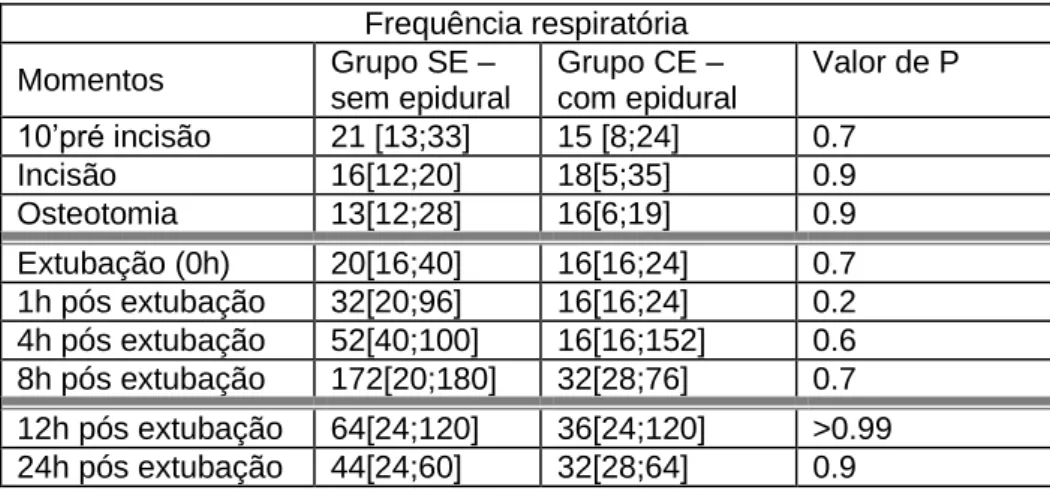
19 Não é possível inferir quanto a possíveis diferenças no que concerne à frequência respiratória. Contudo, no período intra-cirúrgico, embora muito estável em ambos os grupos, verifica-se uma ligeira disposição inicial para a frequência respiratória ser mais baixa no grupo com epidural. Durante a recuperação verifica-se que a frequência respiratória é também mais baixa no grupo em que se administrou epidural. Facto particularmente visível nas primeiras 8 horas, sendo mais marcada na primeira hora pós-extubação.
Frequência respiratória Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P 10’pré incisão 21 [13;33] 15 [8;24] 0.7 Incisão 16[12;20] 18[5;35] 0.9 Osteotomia 13[12;28] 16[6;19] 0.9 Extubação (0h) 20[16;40] 16[16;24] 0.7 1h pós extubação 32[20;96] 16[16;24] 0.2 4h pós extubação 52[40;100] 16[16;152] 0.6 8h pós extubação 172[20;180] 32[28;76] 0.7 12h pós extubação 64[24;120] 36[24;120] >0.99 24h pós extubação 44[24;60] 32[28;64] 0.9
Tabela 3.1.1: Comparação estatística dos valores de frequência respiratória, dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
20
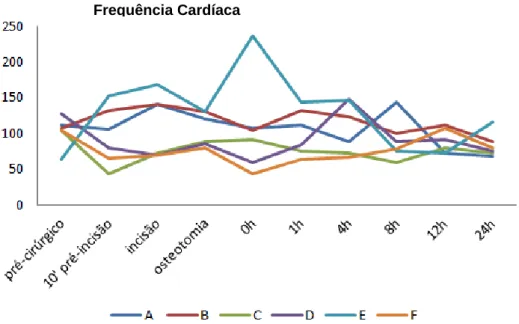
Gráfico 3.1.2: Valores absolutos de frequência cardíaca de todos os animais observados (A,B,C,D,E,F). Animais A, B e C pertencentes ao grupo SE e animais D, E e F pertencentes ao grupo CE. Os momentos 0,1,4,8,12, 24 horas representam os momentos de monitorização pós-extubação.
Frequência Cardíaca
Quanto à frequência cardíaca, não observamos quaisquer diferenças, no entanto existem valores mais baixos no grupo sob epidural durante a cirurgia. Durante o período de recuperação não é possível retirar conclusões.
Frequência cardíaca Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P 10’pré incisão 106[43;132] 79[65;153] 0.9 Incisão 140[72;141] 70[69;168] 0.7 Osteotomia 120[88;130] 86[80;130] 0.5 Extubação (0h) 104[92;108] 60[44;236] 0.7 1h pós extubação 112[76;132] 84[64;144] 0.9 4h pós extubação 88[72;124] 146[67;148] 0.7 8h pós extubação 100[60;144] 78[76;88] 0.7 12h pós extubação 80[72;112] 92[72;107] >0.99 24h pós extubação 72[68;88] 80[76;116] 0.4
Tabela 3.1.2: Comparação estatística dos valores de frequência cardíaca, dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
21
Gráfico 3.1.3: Valores absolutos da PAM de todos os animais observados (A,B,C,D,E,F). Animais A, B e C pertencentes ao grupo SE e animais D, E e F pertencentes ao grupo CE. Os momentos 0,1,4,8,12, 24 horas representam os momentos de monitorização pós-extubação.
Pressão Arterial Média
A variação da PD, PAM e PS é equivalente nos três períodos analisados. Não é possível inferir quanto a possíveis diferenças nos valores das pressões arteriais não invasivas. No entanto, no período intra-cirúrgico verifica-se que as pressões arteriais são mais elevadas no grupo CE, sendo no entanto mais baixas nas primeiras 8 horas recuperação. Às 12 e 24horas de recuperação estes voltam a ser superiores no grupo em que se administrou epidural.
Pressão Arterial Média (PAM) Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P 10’pré incisão 53[49;62] 80[76;96] 0.1 Incisão 64[58;74] 72[63;99] 0.7 Osteotomia 76[72;83] 85[74;95] 0.4 Extubação (0h) 93[75;107] 92[74;105] 0.7 1h pós extubação 108[93;110] 93[82;97] 0.3 4h pós extubação 99[93;99] 100[95;115] 0.4 8h pós extubação 113[107;124] 107[103;108] 0.3 12h pós extubação 104[93;108] 110[94;125] 0.4 24h pós extubação 106[105;107] 120[102;124] 0.7
Tabela 3.1.3: Comparação estatística dos valores de pressão arterial média, dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
22
Gráfico 3.1.4: Gráfico representativo dos níveis de dor de todos os animais observados (A,B,C,D,E,F), obtidos através da escala modificada de Glasgow. Animais A, B e C pertencentes ao grupo SE e animais D, E e F pertencentes ao grupo CE. A linha vermelho sombreado representa o nível de dor de resgate (6) acima do qual o protocolo analgésico do animal é ponderado. Os momentos 0,1,4,8,12, 24 horas representam os momentos de monitorização pós-extubação.
Nível de dor
Os níveis de dor calculados, com recurso à escala de dor modificada de Glasgow, não revelam diferenças entre os grupos SE e CE e durante o período de recuperação não se podem retirar conclusões. Existem no entanto, contrariamente ao esperado, dois animais do grupo CE com necessidade de resgate de dor ao passo que no grupo SE apenas um necessitou desse resgate. Apenas às 8 horas de recuperação os níveis de dor são mais baixos no grupo com epidural.
Nível de dor Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P Pré-cirúrgico 2[0;3] 1[1;5] >0.99 Extubação (0h) 2[1;4] 2[1;2] >0.99 1h pós extubação 3[1;3] 2[1;5] >0.99 4h pós extubação 3[2;4] 5[1;6] 0.7 8h pós extubação 4[4;6] 3[3;5] 0.3 12h pós extubação 2[1;7] 8[5;8] 0.2 24h pós extubação 2[2;4] 5[1;7] 0.6
Tabela 3.1.4: Comparação estatística dos níveis de dor, dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
23 Cortisol
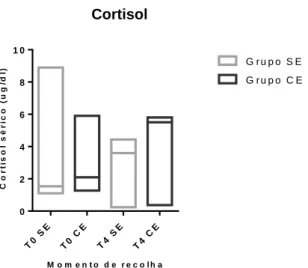
Gráfico 3.1.5: Gráfico de barras referente aos níveis de cortisol sérico (ug/dl), nos grupos sem epidural (SE) e com epidural (CE). Em que T0 é referente ao valor 1 horas antes de iniciar o procedimento anestésico e T4 o valor 4 horas após extubação. Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos corresponde aos máximos e mínimos do intervalo de confiança de 95%).
Cortisol (ug/dl) Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P Pré-cirúrgico 1.54[1.1-8.9] 2.1[1.27-5.9] 0.9 4h pós extubação 3.6[0.24-4.44] 5.5[0.37-5.8] 0.4
Não é possível verificar uma diferença que concerne aos valores de cortisol sérico, visto observar-se uma grande disparidade de valores.
M o m e n t o d e r e c o l h a C o r t is o l s é r ic o ( u g /d l) T0 SE T0 CE T4 SE T4 CE 0 2 4 6 8 1 0 G r u p o S E G r u p o C E
Tabela 3.1.5: Comparação estatística dos valores de cortisol sérico (ug/dl), dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
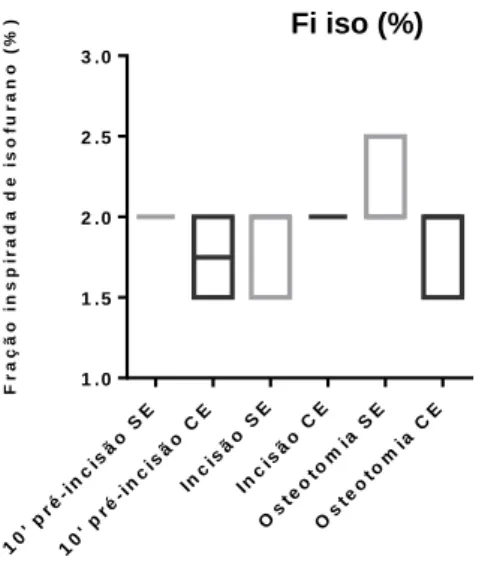
24 Fi iso (%)
Gráfico 3.1.6: Gráfico de barras referente à fração inspirada de isoflurano (%),nos grupos sem epidural (SE) e com epidural (CE). Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos corresponde aos máximos e mínimos do intervalo de confiança de 95%).
Tabela 3.1.6: Comparação estatística dos valores de fração inspirada de isoflurano, dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
Não é possível inferir quanto a possíveis diferenças da fração inspirada de isoflurano durante o decorrer da cirurgia.
Fração inspirada de isoflurano (Fi iso (%)) Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P 10’pré incisão 2[2;2] 1.75[1.5;2] 0.4 Incisão 2[1.5;2] 2[2;2] >0.99 Osteotomia 2[2;2.5] 2[1.5;2] 0.6 10 ' p ré-i nc isã o S E 10 ' p ré-i nc isã o C E Inc isã o S E Inc isã o C E Os teo tom ia S E Os teo tom ia C E 1 .0 1 .5 2 .0 2 .5 3 .0 G r u p o S E G r u p o C E F r a ç ã o i n s p ir a d a d e i s o f u r a n o ( % ) M o m e n t o d e r e c o l h a
25
Gráfico 3.1.7: Gráfico de barras referente à fração expirada de CO2 (%), nos grupos sem
epidural (SE) e com epidural (CE). Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos corresponde aos máximos e mínimos do intervalo de confiança de 95%).
ETCO2
Tabela 3.1.7: Comparação estatística da fração expirada de CO2, dos animais sob anestesia geral, com e sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
Os valores obtidos não nos permitem retirar conclusões quanto a possíveis diferenças.
Fração expirada de CO2 (ETCO2) (%)
Momentos Grupo SE – sem epidural Grupo CE – com epidural Valor de P 10’pré incisão 37[36;45] 36[35;49] 0.8 Incisão 44[42;53] 41[40;46] 0.4 Osteotomia 43[37;55] 48[43;63] 0.5 10 ' p ré-i nc isã o S E 10 ' p ré-i nc isã o C E Inc isã o S E Inc isã o C E Os teo tom ia S E Os teo tom ia C E 3 0 4 0 5 0 6 0 7 0 G r u p o S E G r u p o C E F r a ç ã o e x p ir a d a d e C O 2 (% ) M o m e n t o d e r e c o l h a
26 Apoio
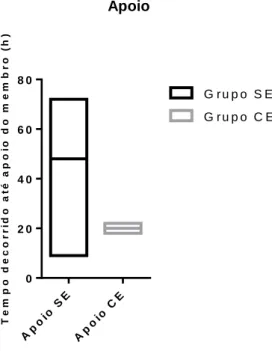
Gráfico 3.1.8: Gráfico de barras referente ao tempo decorrido deste a extubação até ao momento em que o animal realiza o apoio completo do corpo sobre o membro, nos grupos sem epidural (SE) e com epidural (CE). Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos corresponde aos máximos e mínimos do intervalo de confiança de 95%).
Tabela 3.1.8: Comparação estatística do tempo decorrido deste a extubação até ao momento em que o animal realiza o apoio completo do corpo sobre o membro, entre os animais sob anestesia geral, com e sem anestesia epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Calculados pelo teste estatístico de Mann-Whitney, para variáveis não paramétricas.
Embora sem diferença significativa é possível verificar que no grupo com epidural o suporte de peso no membro intervencionado é feito mais cedo do que no grupo em que não se administrou epidural.
Tempo decorrido até apoio do membro (Horas) Grupo SE – sem epidural Grupo CE – com epidural Valor de P 48 [9;72] 20 [18;22] 0,7 T e m p o d e c o r r id o a t é a p o io d o m e m b r o ( h ) Ap oio S E Ap oio C E 0 2 0 4 0 6 0 8 0 G r u p o S E G r u p o C E
27 Primeira micção voluntária
Gráfico 3.1.9: Gráfico de barras referente ao tempo decorrido deste a extubação até à primeira micção voluntária, nos grupos sem epidural (SE) e com epidural (CE). Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos corresponde aos máximos e mínimos do intervalo de confiança de 95%).
Tabela 3.1.9: Comparação estatística do tempo decorrido deste a extubação até à primeira micção espontânea, entre os animais sob anestesia geral, com e sem anestesia epidural. (*) Animais que necessitaram de algaliação. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Calculados pelo teste estatístico de Mann-Whitney, para variáveis não paramétricas.
Tempo decorrido até primeira micção voluntária (Horas) Mediana do grupo SE Mediana do grupo CE Valor de P Tendência 12 [6;17*] 20* [17*;20*] 0,2 ↗
Tabela 3.1.9: relativa à comparação estatística do tempo decorrido deste a extubação até à primeira micção espontânea, entre os animais sob anestesia geral, apenas, e os animais sob anestesia geral e anestesia epidural. (*) Animais que necessitaram de algaliação. Apresentação das medianas, dos intervalos de valores [min;máx], valor de P e tendência, avaliada pela diferença entre medianas. Calculados pelo teste estatístico de Mann-Whitney.
Não é possível retirar conclusões no que concerne ao tempo decorrido até à primeira micção, no entanto verificamos que todos os animais do grupo CE necessitaram de algaliação, por ultrapassarem as 16 horas sem urinar. Ao passo que no grupo SE apenas um animal necessitou de algaliação. Notamos então uma maior espera até à primeira micção voluntária no grupo CE.
3.2 Comparação entre o pré-cirúrgico de cada grupo e o seu intra- e
pós- cirúrgico
As tabelas e gráficos seguintes correspondem à comparação do período pré-cirúrgico com cada momento do período intra-cirúrgico e recuperação de cada grupo individualmente. O objetivo desta comparação é observar as diferenças causadas pelo procedimento anestésico e cirúrgico dentro do próprio grupo.
Tempo decorrido até primeira micção voluntária (Horas) Grupo SE Grupo CE Valor de P 12 [6;17*] 20* [17*;20*] 0,2 T e m p o a t é p r im e ir a M ic ç ã o v o lu n t á r ia ( h ) Uri na SE Uri na CE 0 5 1 0 1 5 2 0 2 5 G r u p o S E G r u p o C E
28 Frequência respiratória
Gráfico 3.2.1: Gráfico de barras referente à comparação da frequência respiratória (rpm) no grupo SE, dos diferentes momentos de intra-cirúrgico e de recuperação com os valores de pré-cirúrgico. Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos aos máximos e mínimos do intervalo de confiança de 95%).
Tabela 3.2.1: Comparação estatística dos valores de frequência respiratória entre o pré-cirúrgico e os períodos intra-pré-cirúrgicos e de recuperação dos animais sob anestesia geral sem epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas. Frequência Respiratória (rpm) Momentos Pré-cirúrgico SE Grupo SE Valor de P 10’pré incisão 28[28;48] 21 [13;33] 0.4 Incisão 16[12;20] 0.1 Osteotomia 13[12;28] 0.3 Extubação (0h) 20[16;40] 0.4 1h pós extubação 32[20;96] >0.99 4h pós extubação 52[40;100] 0.2 8h pós extubação 172[20;180] 0.6 12h pós extubação 64[24;120] 0.6 24h pós extubação 44[24;60] >0.99
A comparação dos valores pré-cirúrgicos com os valores intra-cirúrgicos não nos permite inferir quanto a possíveis diferenças. Contudo, nota-se uma queda nos valores de frequência respiratória no intra-cirúrgico, verificando-se o oposto no período de recuperação.
M o m e n t o d e r e c o l h a F r e q u ê n c ia r e s p ir a t ó r ia ( r p m ) Pré -cir úrg ico SE 10 ' p ré-i nc isã o S E Inc isã o S E Os teo tom ia S E 0h SE 1h SE 4h SE 8h SE 12 h S E 24 h S E 0 5 0 1 0 0 1 5 0 2 0 0 P r é - c ir ú r g ic o S E R e c u p e r a ç ã o S E In t r a - c ir ú r g ic o S E
29
Tabela 3.2.2: Comparação estatística dos valores de frequência respiratória entre o pré-cirúrgico e os períodos intra-pré-cirúrgicos e de recuperação dos animais sob anestesia geral com epidural. Apresentação das medianas, dos intervalos confiança de 95% [min;máx], valor de P. Resultados calculados pelo teste estatístico de Mann-Whitney para variáveis não paramétricas.
Frequência respiratória
Gráfico 3.2.2: Gráfico de barras referente à comparação da frequência respiratória (rpm) no grupo CE, dos diferentes momentos de intra-cirúrgico e de recuperação com os valores de pré-cirúrgico. Representação de valor mínimo, máximo e mediana (a representação dos bigodes gráficos corresponde aos máximos e mínimos do intervalo de confiança de 95%).
Frequência respiratória (rpm) Momentos Pré-cirúrgico CE Grupo CE Valor de P 10’pré incisão 40[28;68] 15 [8;24] 0.1 Incisão 18[5;35] 0.2 Osteotomia 16[6;19] 0.1 Extubação (0h) 16[16;24] 0.1 1h pós extubação 16[16;24] 0.1 4h pós extubação 16[16;152] 0.6 8h pós extubação 32[28;76] >0.99 12h pós extubação 36[24;120] 0.9 24h pós extubação 32[28;64] 0.8
A comparação entre o grupo CE e o seu pré-cirúrgico não nos permite inferir quanto a possíveis diferenças, podemos no entanto, ver uma ligeira redução de frequência respiratória durante a cirurgia e toda a recuperação.
M o m e n t o d e r e c o l h a F r e q u ê n c ia r e s p ir a t ó r ia ( r p m ) Pré -cir úrg ico C E 10 ' p ré-i nc isã o C E Inc isã o C E Os teo tom ia C E 0h CE 1h CE 4h CE 8h CE 12 h C E 24 h C E 0 5 0 1 0 0 1 5 0 2 0 0 P r é - c ir ú r g ic o C E R e c u p e r a ç ã o C E In t r a - c ir ú r g ic o C E