Institu
to Pol
itécnico
d
e V
iseu
Es
c
ol
a Su
perior Ag
rár
ia de V
is
AVALIAÇÃO DA TÉCNICA IMUNOHISTOQUÍMICA COMO
MÉTODO DE DETEÇÃO DA APOPTOSE A NÍVEL CELULAR
Trabalho de Projeto
Mestrado em Tecnologias da Produção Animal
Novembro, 2013
Institu
to Pol
itécnico
d
e V
iseu
Es
c
ol
a Su
perior Ag
rár
ia de V
is
AVALIAÇÃO DA TÉCNICA IMUNOHISTOQUÍMICA COMO
MÉTODO DE DETEÇÃO DA APOPTOSE A NÍVEL CELULAR
Trabalho de Projeto
Mestrado em Tecnologias da Produção Animal
Trabalho efetuado sob orientação de Prof.ª Doutora Helena Vala
Trabalho co-orientado por Prof. Doutor David Ferreira
Novembro, 2013
Carla Sofia Pires Garcia
E
sc
ol
a
Su
pe
rio
r
Ag
rár
ia
de
Vi
se
u
I
n
st
it
ut
o
P
ol
it
é
c
ni
c
o
d
e
Vi
s
e
u
Financiado por Programa COMPETE e pela Fundação para a Ciência e a Tecnologia (COMPETE: FCOMP-01-0124-FEDER-009525)
“As doutrinas expressas neste trabalho são da exclusiva responsabilidade do autor”
Not everything that counts can be counted. And not everything that can be counted counts.
V Ao concluir esta dissertação gostaria de expressar o meu sincero agradecimento a um conjunto de pessoas que tornaram possível a sua realização.
À Professora Doutora Helena Vala, responsável pelo laboratório de Anatomia Patológica da ESAV e minha orientadora, pela preocupação, colaboração e disponibilidade sempre demonstradas, seja na elaboração deste trabalho ou nas mais diversas rotinas diárias.
Ao Professor Doutor David Ferreira pela disponibilidade na análise do presente documento.
Ao meu marido José Luís, pela dedicação e cuidados redobrados durante este período e à minha filha Constança que, ainda na barriga e, mais tarde, a meu lado, me deu ânimo e força para ultrapassar esta etapa da vida.
Aos meus pais, sempre presentes, pelo apoio demonstrado e a quem devo toda a minha formação e valores.
VI A apoptose constitui um processo fisiológico de morte celular, caracterizado por alterações morfológicas distintas e mecanismos bioquímicos e moleculares bem definidos. O seu papel de destaque em numerosos eventos biológicos e importantes processos patológicos conduziu a um crescente interesse na investigação dos mecanismos celulares que regulam o processo apoptótico. A aplicação de metodologias capazes de identificar células apoptóticas despoletou um enorme desenvolvimento de técnicas. No entanto, as propriedades demonstradas por estes ensaios nem sempre se aplicam ao estudo de amostras tecidulares, pelo que a escolha dos diferentes métodos deverá ser criteriosamente avaliada, tendo em conta a aplicação pretendida e as alterações morfológicas que se pretendem detetar.
Das várias técnicas disponíveis para deteção da apoptose em tecidos, muitos investigadores recomendam o método TUNEL, o qual se baseia na marcação de produtos endonucleossómicos resultantes da fragmentação do DNA. Outros métodos histoquímicos também disponíveis incluem a deteção do citocromo c, libertado da mitocôndria ou a deteção das proteínas pró e anti-apoptóticas, Bax, Bid e Bcl-2, envolvidas nos mecanismos intrínsecos da apoptose. Mais recentemente, a marcação de produtos específicos resultantes da clivagem de proteínas alvo pelas caspases, tem vindo a ser considerada uma abordagem promissora.
Como principal objectivo deste trabalho pretendeu-se avaliar a técnica imunohistoquímica como método de deteção da apoptose a nível celular, em tecidos animais, tendo por base o método TUNEL, o qual permite a deteção de fragmentos de DNA. Os resultados obtidos permitiram concluir que, apesar do método TUNEL possuir as suas limitações ao nível da sensibilidade e especificidade, o mesmo constitui um mecanismo imunohistoquímico útil na deteção de células apoptóticas. Contudo, segundo opinião de vários autores, adverte-se para a necessidade da aplicação de pelo menos dois métodos imunohistoquímicos como forma de validar a ocorrência do processo apoptótico, razão pela qual se optou pela deteção do citocromo c citosólico como método complementar, uma vez que a sua libertação para o espaço citosólico se encontra implicada na ativação da apoptose.
Palavras-chave: apoptose, imunohistoquímica, tecidos parafinados, TUNEL, Citocromo c.
VII Apoptosis is a physiological cell death process characterized by distinctive morphological changes and biochemical and molecular mechanisms well defined. His leading role in many important biological events and pathological processes has led to a growing interest in investigating the cellular mechanisms that regulate the apoptotic process. The application of methodologies, capable of identifying apoptotic cells, triggered a huge development of techniques. However, the properties shown by these assays do not always apply to the study of tissue samples, whereby the choice of different methods must be carefully evaluated, taking into account the intended application and the morphological changes that are intended to detect.
Of the various available techniques for detection of apoptosis in tissues, many investigators recommend the TUNEL method, which is based on the labeling of endonucleossomic products resulting from DNA fragmentation. Other methods available include histochemical detection of cytochrome c release from mitochondria or detection of proteins pro-and anti-apoptotic Bax, Bid and Bcl-2, involved in the intrinsic mechanisms of apoptosis. More recently, the marking of specific products resulting from cleavage by caspases target proteins, has been regarded as a promising approach.
The main objective of this work intended to evaluate the immunohistochemical technique as a method for detection of apoptosis at cellular level, in animal tissues, based on TUNEL method, which allowsthe detection of DNA fragments. The results showed that, despite the TUNEL method has its limitations in terms of sensitivity and specificity, it constitutes a mechanism useful for immunohistochemical detection of apoptotic cells. However, according to the opinion of several authors, attention is drawn to the need to apply, at least, two immuhistochemical methods as a way to validate the occurrence of apoptosis, so, for that reason, we opted for the detection of cytosolic cytochrome c as a complementary method, since their release into the cytosolic space is implicated in the activation of apoptosis.
Keywords: apoptosis, immunohistochemistry, paraffin embedded tissues, TUNEL, Cytochrome c.
VIII AGRADECIMENTOS... V RESUMO... VI ABSTRACT... VII
ÍNDICE GERAL... VIII ÍNDICE DE FIGURAS………... Xii
ÍNDICE DE QUADROS……… XIV
1. INTRODUÇÃO GERAL... 1
2. MECANISMOS DE MORTE CELULAR... 4
2.1. Apoptose, necrose e autofagia... 4
2.2. Bases moleculares da apoptose... 8
2.2.1. O processo apoptótico………... 8
2.2.1.1. Caspases como elementos iniciadores e executores da apoptose. 8 2.2.1.2. Vias de ativação da apoptose... 10
2.2.1.2.1. Via extrínseca (citoplasmática)... 11
2.2.1.2.2. Via intrínseca (mitocondrial)... 13
2.3. Métodos para deteção da apoptose... 15
2.3.1. Ativação das caspases... 16
2.3.1.1. Citoqueratina, citoesqueleto e apoptose... 17
2.3.2. Alterações de membrana... 18
2.3.3. Fragmentação do DNA... 20
2.3.4. Ensaios mitocondriais... 22
2.3.5. Deteção em peças inteiras... 24
IX
3.2. Aplicações e importância... 28
3.3. Limitações, dificuldades e problemas associados à imunohistoquímica... 29
3.3.1. Fatores pré-analíticos... 30
3.3.2. Fatores analíticos... 32
3.3.3. Fatores pós-analíticos... 33
3.4. Métodos de recuperação antigénica... 34
3.4.1. Tratamentos mediados pelo calor... 34
3.4.2. Digestão enzimática... 35
3.5. Seleção de anticorpos... 37
3.5.1. Anticorpos policlonais... 37
3.5.2 Anticorpos monoclonais... 39
3.6. Métodos imunohistoquímicos... 41
3.6.1. Método de deteção por imunofluorescência... 42
3.6.1.1. Imunofluorescência direta... 42
3.6.1.1.1. Vantagens e desvantagens... 43
3.6.1.2. Imunofluorescência indireta... 43
3.6.1.2.1. Vantagens e desvantagens... 44
3.6.2. Métodos de deteção imunoenzimática... 45
3.6.2.1. Sistemas de deteção diretos... 46
3.6.2.2. Sistemas de deteção indiretos... 46
3.6.2.2.1. Simples... 46
X
3.6.2.3. Sistemas Avidina-Biotina………. 48
3.6.2.4. Sistema do polímero……… 51
3.6.2.5. Sistema de amplificação da tiramina... 53
3.6.3. Cromogénios... 55
3.6.4. Validação de resultados... 56
3.6.4.1. Controlos... 56
3.6.4.2. Marcação inespecífica/Marcação de fundo e suas principais causas... 57
3.6.4.2.1. Atividade da peroxidase endógena... 57
3.6.4.2.2. Atividade da fosfatase alcalina endógena... 58
3.6.4.2.3. Atividade das proteínas Avidina e Biotina... 59
3.6.4.2.4. Interações hidrofóbicas das proteínas... 60
3.6.4.2.5. Interações iónicas e eletrostáticas... 62
3.6.4.2.6. Pigmentos... 63
4. MATERIAL E MÉTODOS... 65
4.1. Amostras recolhidas………... 65
4.2. Metodologia………... 65
4.2.1. Preparação das amostras………... 65
4.2.2. Imunohistoquímica………... 66
4.2.2.1. TUNEL... 66
4.2.2.2. Citocromo C... 68
5. RESULTADOS... 70
XI
5.2. Avaliação da imunomarcação pelo Citocromo c……….. 73
5.2.1. Intestino……….. 73
5.2.2. Rim……….. 75
6. DISCUSSÃO... 77
7. CONCLUSÕES... 83
XII
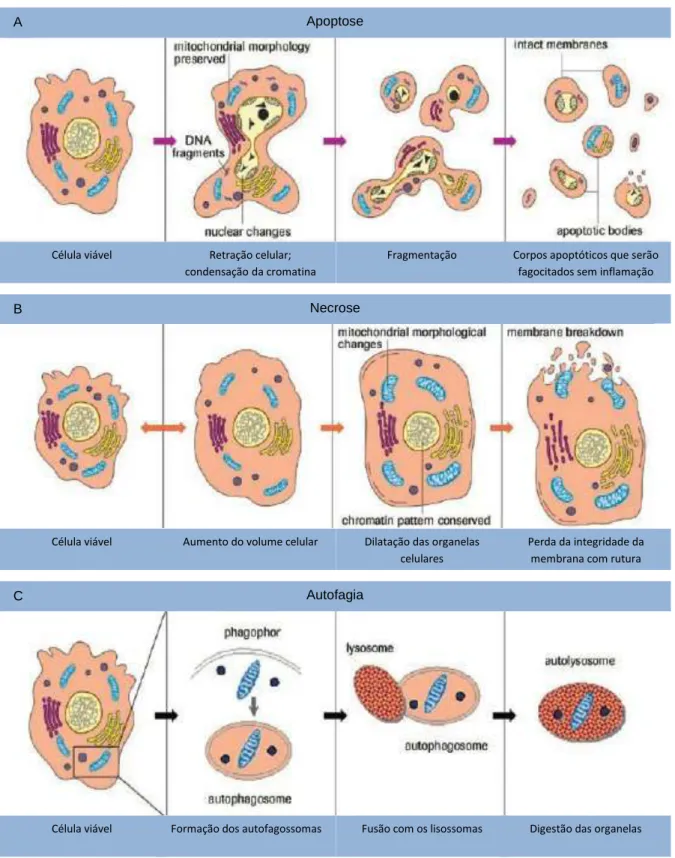
Figura 1. Principais mecanismos de morte celular... 7
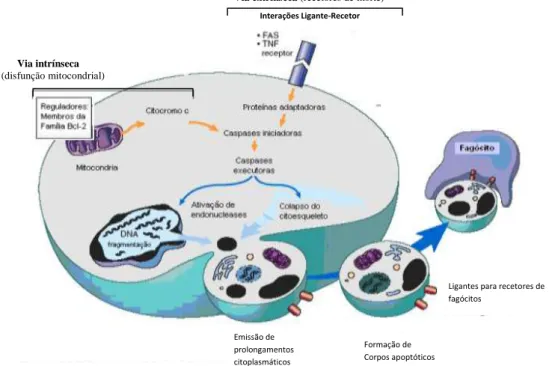
Figura 2. Mecanismos de ativação da apoptose... 11
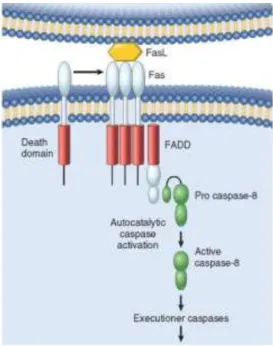
Figura 3. Via extrínseca de ativação da apoptose (recetores de morte)... 12
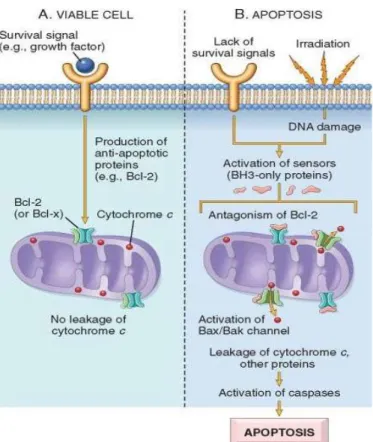
Figura 4. Via intrínseca de ativação da apoptose (mitocondrial)... 14
Figura 5. Métodos para deteção da apoptose... 16
Figura 6. Sequência de aminoácidos da região Linker 1-2 do domínio central dos diferentes membros da família IF... 17
Figura 7. Príncipio do método de fragmentação de DNA – TUNEL... 21
Figura 8. Diagnóstico histogenénico de neoplasias usando a técnica de imunohistoquímica... 28
Figura 9. Expressão da heparanase no diagnóstico de tumores carcinóides broncopulmonares... 29
Figura 10. Representação esquemática de anticorpos policlonais... 38
Figura 11. Processo de produção de anticorpos policlonais... 38
Figura 12. Representação esquemática de anticorpos monoclonais... 40
Figura 13. Processo de produção de anticorpos monoclonais... 40
Figura 14. Imunofluorescência direta e indireta... 43
Figura 15. Método direto e indireto de uma reação de imunoperoxidase... 4
Figura 16. Método indireto peroxidase-antiperoxidase (PAP)... 47
Figura 17. Método imunohistoquímico através do complexo ABC e do complexo LSAB... 50
Figura 18. Método indireto através do polímero... 52
Figura 19. Método de amplificação da tiramina... 53
Figura 20. Atividade da peroxidase endógena antes e após tratamento com peróxido de hidrogénio a 3%... 58
XIII Figura 22. Bloqueio de fundo não específico através de soro normal... 62 Figura 23. Reação positiva débil (+) em 75-100% das células epiteliais das vilosidades intestinais. TUNEL... 70 Figura 24. Reação positiva moderada (++) em 75-100% das células epiteliais das vilosidades intestinais. TUNEL... 71 Figura 25. Reação positiva intensa em A) 75-100% e B) 0-25% das células epiteliais das vilosidades intestinais. TUNEL... 71 Figura 26. Reação positiva muito intensa (++++) em 0-25% das células epiteliais das vilosidades intestinais. TUNEL... 71 Figura 27. Tubulos contornados proximais do rim com A) imunoreação positiva débil (+) em 75-100% das células epiteliais e B) imunoreação positiva moderada (++) em 75-100% das células epiteliais. TUNEL... 72 Figura 28. Tubulos contornados proximais do rim com A) imunoreação positiva intensa (+++) em 75-100% das células epiteliais e B) tubulos contornados distais do rim com imunoreação positiva muito intensa (++++) em 75-100% das células epiteliais. TUNEL...
72
Figura 29. Imunoreação positiva moderada (++) em A) 75-100% das células epiteliais dos tubulos coletores e B) imunoreação positiva muito intensa (++++) em 75-100% das células epiteliais dos tubulos coletores, intensa (+++) nas células epiteliais do segmento espesso da ansa de Henlé. TUNEL...
73
Figura 30. Reação positiva muito intensa (++++) em 75-100% das células epiteliais das vilosidades intestinais. Citocromo C.………... 73 Figura 31.Reação positiva moderada (++) em 75-100% das células epiteliais das vilosidades intestinais. Citocromo C………... 74 Figura 32.Reação positiva A) moderada (++) e B) intensa (+++) em 75-100% das células glandulares da mucosa. Citocromo C………... 74 Figura 33. Reação positiva A) moderada (++) em 25-50% das células epiteliais das glândulas mucosas e B) intensa (+++) em 75-100% das células dos gânglios nervosos da submucosa. Citocromo C………... 74 Figura 34. Reação positiva A) muito intensa (++++) em 75-100% das células epiteliais dos tubulos contornados distais do rim e B) moderada (++) em 75-100% das células epiteliais dos tubulos contornados proximais do rim. Citocromo C... 75
XIV (++++) em 100% das células epiteliais do segmento espesso da ansa de Henlé. Citocromo C.
75
Figura 36. A) e B) Reação negativa nos glomérulos. Citocromo C. …………... 76
ÍNDICE DE QUADROS
Quadro 1. Classificação das caspases nos mamíferos e respetiva representação do domínio efetor de morte (DED) nas caspases – 8 e 10 e do domínio de ativação e recrutamento (CARD) nas caspases -1, -2, -4, -5 e -9... 9 Quadro 2. Vantagens dos anticorpos monoclonais e policlonais... 41
1
Carla Garcia 1. INTRODUÇÃO
A apoptose, também designada de morte celular programada, constitui um processo fisiológico fundamental ao desenvolvimento dos seres vivos, garantindo o mecanismo homeostático essencial à manutenção das populações celulares que formam os tecidos (Meier et al., 2000). Desta forma, a sua regulação adquiriu uma importância central em vários aspetos biológicos, incluindo estudos embrionários, processos patogénicos de doenças, resposta celular a administrações terapêuticas, tornando-se a deteção precisa da apoptose um processo crucial no desenvolvimento destes estudos biomédicos (Wyllie, 1992). Considerando todas as observações morfológicas que distinguem a apoptose da necrose, o campo de pesquisa associado ao processo de morte celular tem sido objeto de um crescente interesse, originando uma riqueza de conhecimento acerca dos mecanismos genéticos e bioquímicos que regulam este processo (Barrett et al., 2001). A necessidade de métodos histoquímicos como forma de avaliar a morte celular, especialmente em tecidos, levou ao desenvolvimento de diversas técnicas, as quais, presentemente, são aplicadas de forma extensiva a estudos fisiológicos e de desenvolvimento, assim como a uma grande variedade de eventos patológicos (Wyllie, 1992).
Os mecanismos que regulam o processo apoptótico ocorrem como resposta a uma grande variedade de estímulos, suportados por duas grandes vias de ativação. A via extrínseca, envolvendo a participação dos chamados recetores de morte, localizados na superfície celular, e a via intrínseca, envolvendo a presença das mitocôndrias, através da indução da perda de integridade da membrana mitocondrial externa, levando à libertação do citocromo c para o citosol. Estas duas grandes vias determinam a ativação de uma família específica de proteases citoplasmáticas designadas por caspases, responsáveis por desencadear todos os mecanismos que conduzem às alterações morfológicas e bioquímicas da apoptose (Willingham, 1999).
Um grande e, muitas vezes, inapreciado aspeto da morte celular por apoptose reside na assíncronia do processo. Esta deriva do facto das células de uma determinada população celular, após a receção de um estímulo iniciador, poderem desencadear o processo em diferentes intervalos de tempo, levando a que a duração dos vários estádios de alterações morfológicas apoptóticas possam variar
2
Carla Garcia
de célula para célula. Alguns ensaios detetam alterações morfológicas que ocorrem em fases precoces do processo, enquanto outros apenas são capazes de detetar fases mais tardias de apoptose. Adicionalmente, a lise que eventualmente ocorre no final da apoptose, corresponde essencialmente ao mesmo evento de perda de integridade de membrana verificado no processo de necrose, embora as alterações específicas decorridas até esse ponto sejam muito diferentes. Estes constrangimentos apontam para a necessidade de uma análise ponderada de toda a cinética e sincronia do sistema, assim como para a escolha apropriada dos ensaios que permitem detetar com precisão todas as alterações morfológicas (Willingham, 1999).
Para secções de tecido, muitos investigadores recomendam a deteção de fragmentos de DNA através das técnicas TUNEL (“Terminal Dutp Nick End-Labeling”) ou ISNT (“In situ Nick Translation”), em conjunto com observações morfológicas nucleares (Barrett et al., 2001). Embora a deteção de quebras na cadeia de DNA constitua um método de base para uso em secções de tecido, torna-se necessário um rigoroso cuidado na sua interpretação, pois existem problemas de especificidade associados a estas técnicas (Willingham, 1999; Barrett et al., 2001).
Outro método histoquímico também utilizado para deteção da apoptose consiste na marcação, através da Anexina V, da fosfatidilserina exposta para o exterior da membrana plasmática das células apoptóticas. Embora este método seja capaz de detetar a apoptose num estado anterior às técnicas TUNEL e ISNT, apenas uma minoria de células apoptóticas são marcadas pela Anexina V antes da lise celular verificada no final do processo apoptótico (Barrett et al., 2001).
Mais recentemente tem vindo a ser demonstrada a eficácia de um anticorpo capaz de detetar fragmentos específicos resultantes da clivagem da citoqueratina 18 pelas caspases. Para além de detetar, com elevada especificidade, células apoptóticas em culturas celulares, demonstrou também resultados favoráveis na utilização de secções de tecido. A citoqueratina 18 apenas é expressa em determinados tipos celulares (epitélios simples), tornando assim limitada a aplicação deste anticorpo. Outros métodos que incluem a ativação das caspases (como por exemplo, caspase 3) poderão garantir maior aplicabilidade (Barrett et al., 2001).
Encontram-se também disponíveis estudos mitocondriais capazes de monitorizar o processo apoptótico, os quais se baseiam na expressão de
3
Carla Garcia
determinadas moléculas, tais como o citocromo c libertado para o citosol, ou a expressão de proteínas pró e anti-apoptóticas, permitindo a deteção de fases iniciais da via intrínseca da apoptose (Bedner et al., 1999; Darzynkiewicz et al., 1999).
Assim, a seleção do método de deteção da apoptose em células, tecidos ou órgãos deve ser cautelosamente avaliada, ponderando as vantagens e os inconvenientes associados a cada método. Como consequência, o desenvolvimento de novas técnicas terá de confrontar as muitas facetas de apenas um único, apesar de complexo, mecanismo biológico (Willingham, 1999).
Dada a importância do processo apoptótico e, consequentemente, dos seus mecanismos biológicos regulatórios, pretendemos, com o presente trabalho, desenvolver métodos imunohistoquímicos capazes de detetar eventos apoptóticos a nível celular, em tecidos animais. A deteção pelo método TUNEL, o qual permite a avaliação dos produtos endonuleossómicos resultantes da fragmentação do DNA, constituiu o método escolhido. Contudo, dadas as limitações que apresenta ao nível da sensibilidade e especificidade, vários autores consideram a aplicação de um segundo método como forma de validar a ocorrência do processo apoptótico, razão pela qual se optou pela avaliação da expressão do citocromo c citosólico, uma vez que o mesmo se encontra descrito como um fator necessário para ativação da apoptose.
4
Carla Garcia 2. MECANISMOS DE MORTE CELULAR
O desenvolvimento e a manutenção dos organismos multicelulares integram processos dependentes da interação entre as células que os constituem. Durante o desenvolvimento embrionário, muitas células são produzidas em excesso com o objetivo de conduzir à formação de órgãos e tecidos, no entanto, mecanismos como a morte celular programada atuam como que esculpindo os tecidos em questão, mantendo um equilíbrio homeostático entre as populações celulares (Meier et al., 2000). Uma vez que a morte celular se encontra intimamente ligada à homeostase dos tecidos, este processo tem sido, não surpreendentemente, implicado em numerosos estados patológicos. Anomalias ocorridas ao nível da regulação da morte celular podem constituir um fator significativo em determinadas doenças, tais como cancro, síndromes autoimunes, SIDA, isquémia, doenças hepáticas e certos distúrbios neurodegenerativos (Fischer & Schulze-Osthoff, 2005).
2.1. APOPTOSE, NECROSE E AUTOFAGIA
De acordo com as suas características morfológicas e bioquímicas, os processos de morte celular podem classificar-se em vários tipos, destacando-se com maior importância, a apoptose, a necrose e a autofagia. No entanto, existem dois outros eventos pelos quais as células perdem as suas capacidades funcionais, nomeadamente através da mitose catastrófica e da senescência (Okada & Mak, 2004; Castedo et al., 2004).
As células possuem várias opções de morte celular, sendo a apoptose apenas uma em particular, contudo considerada por muitos como o mais importante mecanismo de morte celular.
A apoptose, também conhecida como “morte celular programada”, ocorre nas mais diversas situações, como por exemplo, na organogénese e hematopoiese normal e patológica, na reposição fisiológica de certos tecidos maduros, na atrofia dos órgãos, na resposta inflamatória e na eliminação de células após dano celular causado por agentes genotóxicos (Ranganath & Nagashree, 2001).
A apoptose desenvolve-se através de uma série de eventos morfológicos bem coordenados (Figura 1A). De um modo geral, é um fenómeno que ocorre de
5
Carla Garcia
forma muito rápida, iniciando-se com a retração da célula e consequente perda de aderência com a matriz extracelular e células circundantes. Com exceção, em alguns casos, das mitocôndrias, que podem apresentar rutura da membrana externa, as organelas celulares preservam a sua morfologia. A cromatina sofre condensação e concentra-se junto à membrana nuclear, a qual permanece intacta. Seguidamente, a membrana celular forma prolongamentos, denominados “blebs”, ocorrendo desintegração do núcleo em pequenos fragmentos envoltos pela membrana nuclear. Os prolongamentos da membrana celular rompem, dando origem a estruturas celulares designadas por corpos apoptóticos, as quais envolvem organelas intactas, assim como porções do núcleo. Estas estruturas são rapidamente reconhecidas, sendo fagocitadas por macrófagos ou por células vizinhas e removidas sem causar uma resposta inflamatória (Kerr et al., 1972; Ziegler & Groscurth, 2004).
O conceito de apoptose foi inicialmente descrito na década de setenta por Kerr, Wyllie e Currie, baseado em estudos de morte celular fisiológica. Estes investigadores propuseram a ideia de que a apoptose constitui um mecanismo para eliminação ou deleção de células, programado durante o desenvolvimento celular, sugerindo a existência de algum tipo de relógio molecular interno responsável pelo desencadeamento da morte celular, indiferentemente aos sinais subjacentes. Atualmente, estudos comprovam a existência de inúmeros fatores externos capazes de danificar o DNA, tais como radiações X e raios UV, agentes quimioterapêuticos e várias toxinas (Guerrero & Arias, 1998).
A apoptose define-se como um programa de morte celular extremamente regulado e de grande eficiência, requerendo a interação de inúmeros fatores. As alterações morfológicas observadas resultam como consequência de uma série específica de mecanismos moleculares e bioquímicos geneticamente regulados (Saraste & Pulkki, 2000).
A necrose, por sua vez, é por muitos considerada como um processo acidental e descontrolado de morte celular. Em termos bioquímicos, as principais características associadas a este processo incluem uma depleção energética massiva, a formação de espécies oxigénio-reativas e a ativação de proteases não apoptóticas. Todos estes eventos culminam na perda da função homeostática da bomba de iões e na degradação da membrana lipídica, levando à tumefação e
6
Carla Garcia
consequente rutura da membrana celular. As células necróticas apresentam um típico acréscimo do volume celular, condensação moderada da cromatina, desorganização do citoplasma com dilatação das organelas celulares (mitocôndrias, retículo endoplasmático e complexo de Golgi), perda da integridade da membrana e consequente rutura (Figura 1B) (Festjens et al., 2006). Durante este processo, o conteúdo celular é libertado, causando danos às células vizinhas, promovendo no local uma reação inflamatória (Ziegler & Groscurth, 2004). A necrose é considerada como uma resposta passiva a um efeito celular prejudicial, no entanto, estudos recentes sugerem que este processo possa ser regulado mediante controlo genético, facto que pode ser relevante em múltiplos processos fisiológicos e patológicos (Zong & Thompson, 2006; Festjens et al., 2006).
O processo de autofagia define-se como sendo um processo adaptativo conservado evolutivamente e controlado geneticamente. Ocorre como resposta a um estado de stress metabólico, resultando na degradação dos componentes celulares através do processo lisossómico. O mecanismo mais conhecido de autofagia envolve a formação de uma membrana em torno de porções do citoplasma, originando estruturas vesiculares denominadas por autofagossomos (Figura 1C). De seguida, as vesículas resultantes fundem-se com um lisossoma e, por intermédio das hidrolases lisossomais, o seu conteúdo é degradado (Danial & Korsmeyer, 2004; Kelekar, 2005; Lum et al,, 2005).
A mitose catastrófica, em geral, não é considerada uma forma de morte, mas sim uma sinalização irreversível para a morte. Trata-se de um processo passivo que envolve uma mitose aberrante, resultando numa segregação cromossómica errada (Weaver & Cleveland, 2005).
Por último, a senescência trata-se de um processo metabólico ativo essencial para o envelhecimento, o qual ocorre mediante programação genética, envolvendo a deterioração dos telómeros e a ativação de genes supressores tumorais. As células sujeitas a este processo, após um determinado número de divisões celulares, entram em senescência e perdem a sua capacidade proliferativa (Mooi & Peeper, 2006).
7
Carla Garcia 2.2. BASES MOLECULARES DA APOPTOSE
2.2.1. O PROCESSO APOPTÓTICO
Figura 1. Principais mecanismos de morte celular: apoptose, necrose, autofagia.
A) As células apoptóticas revelam alterações características na morfologia nuclear, incluindo condensação e fragmentação da cromatina, retração celular, emissão de prolongamentos citoplasmáticos e formação de corpos apoptóticos contendo material nuclear ou citoplasmático. B) A necrose é morfologicamente definida por um inchaço citoplasmático e dilatação das organelas, com consequente vacuolização celular e rutura da membrana plasmática com extravasamento do conteúdo intracelular. C) A autofagia envolve a acumulação massiva de uma membrana dupla em torno de uma região destino da célula, separando o conteúdo do resto do citoplasma, formando os chamados autofagossomas. Estes fundem-se com os lisossomas para formar os autolisossomas que, por intermédio de hidrolases promovem a degradação do seu conteúdo (Adaptado de Schulze-Osthoff, 2008).
Corpos apoptóticos que serão fagocitados sem inflamação
Apoptose
Célula viável Retração celular;
condensaçãoda cromatina
Fragmentação
A
Perda da integridade da membrana com rutura
Necrose
Célula viável Aumento do volume celular Dilatação das organelas
celulares
B
Digestão das organelas
Autofagia
Célula viável Formação dos autofagossomas Fusão com os lisossomas
8
Carla Garcia 2.2. BASES MOLECULARES DA APOPTOSE
2.1.1. O PROCESSO APOPTÓTICO
Ainda que qualquer uma das formas de morte celular assuma a sua relevância, a abordagem deste trabalho inclui um maior enfoque no processo apoptótico.
A apoptose resulta de um colapso da estrutura celular através de uma digestão proteolítica interna, originando desintegração do citoesqueleto, distúrbios metabólicos e fragmentação genómica (Taylor et al., 2008). Uma família de proteases conhecidas como caspases (cystein-dependent aspartate-specific
proteases) possui a capacidade de clivar substratos que contenham resíduos de
aspartato e constitui o motor central da apoptose, encontrando-se envolvidas nas fases de iniciação, execução e regulação do mecanismo apoptótico (Los et al., 1999).
2.2.1.1. CASPASES COMO ELEMENTOS INICIADORES E EXECUTORES DA APOPTOSE
Até ao momento, foram identificadas 14 diferentes caspases em mamíferos (Boatright & Salvensen, 2003), onze das quais em humanos, possuindo uma estrutura semelhante na forma de proenzimas. Basicamente, são constituídas por um segmento N-terminal, também designado por pró-domínio (longo nas caspases iniciadoras-p20 e curto nas caspases efetoras-p10) e por duas subunidades, uma longa e uma curta, que possuem as sequências que participam no domínio catalítico (Sambade, 2005).
De acordo com a sua estrutura (Quadro 1) e o seu papel na apoptose, as caspases podem ser classificadas em:
Caspases iniciadoras da apoptose: caspases que possuem pró-domínios
longos, encontrando-se envolvidas na iniciação da cascata proteolítica. Incluem as que pertencem ao domínio efetor de morte (DED), caspases -8 e -10, e as caspases do domínio de ativação e recrutamento (CARD), caspases -2 e -9 que vão mediar a interação na direção das moléculas adaptadoras.
9
Carla Garcia
Caspases efetoras/executoras da apoptose: incluem as caspases -3, -6 e
-7, constituindo caspases que possuem pró-domínios curtos ou inexistentes, responsáveis por darem continuidade ao processo apoptótico através da clivagem de substratos celulares, após ativação por parte das caspases iniciadoras (Rupnarain et al.,2004; Jin & El-Deiry, 2005).
Caspases inflamatórias: incluem as caspases -1, -4, -5, -11, -12, -13 e -14,
encontrando-se envolvidas na inflamação e a sua contribuição na apoptose permanece não esclarecida.
INICIADO RA S Caspase 2 Caspase 9 Caspase 8 Caspase 10 E X E CUT O RA S Caspase 3 Caspase 6 Caspase 7 INF L AMAT Ó RIA S Caspase 1 Caspase 4 Caspase 5 Caspase 14 DED L C DED DED L C DED CARD CARD L C L C L C L C L C L C L C L C CARD CARD CARD L C
Quadro 1. Classificação das caspases nos mamíferos e respetiva representação do domínio
efetor de morte (DED) nas caspases – 8 e 10 e do domínio de ativação e recrutamento
(CARD) nas caspases -1, -2, -4, -5 e -9. L e C correspondem às subunidades longa e curta,
10
Carla Garcia
Uma vez ativadas, as caspases efetoras clivam aproximadamente cerca de 400 substratos, incluindo proteínas envolvidas na estrutura do citoplasma, proteínas reguladoras dos sinais de transdução e transcrição, componentes controladores do ciclo celular e proteínas envolvidas na replicação e reparação do DNA. Para muitos dos substratos identificados, as consequências funcionais da sua clivagem são desconhecidas e têm sido simplesmente inferidas nas suas normais funções. Em outros casos, a proteólise de determinados componentes pode ser associada a alterações morfológicas discretas (Fisher et al., 2003).
Mais ainda, as caspases são responsáveis pela destruição de muitas proteínas responsáveis pela manutenção da arquitetura do citoesqueleto, nomeadamente as chamadas citoqueratinas 8 e 18, principais componentes dos filamentos intermediários. Contudo, a ativação das caspases não é necessariamente sinónimo de morte celular; ou seja, por um lado, é evidente que as células podem sobreviver sob ativação limitada das caspases, sendo que, reciprocamente, esta inibição das caspases provoca um bloqueio das alterações morfológicas da apoptose, muitas vezes sem influenciar a morte celular final (Chipuk e Green, 2005). Por outro lado, determinadas caspases encontram-se envolvidas em processos regulatórios da inflamação, controlando a maturação de precursores de citoquinas. Para além da sua função na morte celular, as caspases podem também participar em diversos processos não apoptóticos, controlando mecanismos de proliferação e diferenciação celular (Schwerk & Schulze-Osthoff, 2003; Kuranaga & Miura, 2007).
2.2.1.2. VIAS DE ATIVAÇÃO DA APOPTOSE
Os fatores desencadeadores de apoptose são diversos, destacando-se entre eles: ligação de moléculas a recetores de membrana, agentes quimioterapêuticos, radiação ionizante, danos estruturais do DNA, choque térmico, deficiente quantidade de nutrientes, privação de fatores de crescimento e níveis aumentados de espécies reativas de oxigénio (Hengartner, 2000).
A mais estudada via de sinalização da apoptose é a cascata apoptótica. Esta pode ser iniciada por duas diferentes vias de sinalização, respetivamente pela via extrínseca (citoplasmática), através de recetores específicos localizados na superfície celular, denominados recetores de morte ou, por via intrínseca, mediante
11
Carla Garcia
estímulos internos de stress intracelular (mitocondrial) (Figura 2). Estas diferentes vias culminam na ativação das caspases presentes no citoplasma, sob a forma de proenzimas inativas, tornando-se ativas após clivagem proteolítica ao nível dos resíduos de ácido aspártico (Green & Reed, 1998; Parolin & Reason, 2001; Amarante-Mendes, 2003).
AS
2.2.1.2.1. VIA EXTRÍNSECA (CITOPLASMÁTICA)
Nesta via de sinalização, o sinal é desencadeado pela interação de ligantes específicos a um grupo de recetores de membrana, designados como recetores de morte. A grande maioria destes recetores pertencem à superfamília de recetores para o fator de necrose tumoral (TNF-R), os quais possuem uma região extracelular rica em cisteína e uma região citoplasmática chamada domínio de morte (“death
Via extrínseca (recetores de morte)
Interações Ligante-Recetor
Via intrínseca
(disfunção mitocondrial)
Ligantes para recetores de fagócitos
Formação de Corpos apoptóticos
Figura 2. Mecanismos de ativação da apoptose
As duas vias de sinalização da apoptose diferem nos mecanismos que envolvem a sua indução e regulação, culminando ambas na ativação das caspases executoras. A ativação destas caspases pela via mitocondrial e/ou recetores de morte envolve a ação de endonucleases e proteases que degradam proteínas nucleares e do citoesqueleto, originando uma cascata de degradação intracelular que inclui a fragmentação genómica e a desintegração do citoesqueleto. Os corpos apoptóticos resultantes, contendo organelas intactas e outros componentes citosólicos, são reconhecidos e rapidamente fagocitados (Adaptado de Kumar et al., 2010).
Emissão de prolongamentos citoplasmáticos
12
Carla Garcia
domain – DD”), importante para transdução intracelular do sinal apoptótico e ativação imediata da cascata de caspases (Gupta, 2003).
Os recetores de morte mais conhecidos incluem citocinas, tais como TNF-R1 (cujo ligante específico se designa por TNF-α) e Fas (cujo ligante específico é normalmente designado por Fas ligante, FasL, uma citocina produzida pelas células do sistema imune). Quando os recetores de morte reconhecem o ligante específico, os seus domínios de morte interagem com moléculas conhecidas como FADD (“Fas-associated death domain”). Essas moléculas, por sua vez, possuem a capacidade de recrutar formas inativas de caspase-8. Várias moléculas denominadas de pro-caspase-8 aproximam-se do local, transformando-se, através de clivagem proteolítica, em moléculas caspase-8 ativas, as quais irão, por sua vez, ativar as caspases executoras responsáveis por dar continuidade ao processo apoptótico (Figura 3) (Callus & Vaux, 2007; Debatin & Krammer, 2004).
A caspase 8 ativa, para além de ativar as caspases executoras possui a capacidade de clivar a proteína pró-apoptótica Bid, presente no citosol, gerando um fragmento truncado dessa proteína, que se liga à mitocôndria, permeabilizando as suas membranas (Parolin & Reason, 2001).
Figura 3. Via extrínseca de ativação da apoptose (recetores de morte)
13
Carla Garcia
2.2.1.2.2. VIA INTRÍNSECA (MITOCONDRIAL)
A apoptose pode também ser iniciada por sinais de stress intra ou extracelular que resultem em disfunção mitocondrial, tais como danos no DNA, privação de fatores de crescimento, hipóxia, perda de adesão, entre outros (Green & Kroemer, 2004).
A via mitocondrial constitui o principal mecanismo de apoptose em todas as células de mamíferos e o seu papel encontra-se bem estabelecido numa grande variedade de processos fisiológicos e patológicos. Esta via de apoptose surge como resultado da alteração da permeabilidade mitocondrial e libertação de moléculas pró-apoptóticas (indutores da morte) para o citoplasma (Figura 4). Como elemento chave para este estímulo apoptótico encontra-se a libertação do citocromo c, presente no espaço mitocondrial intermembranário, para o citosol (Danial & Korsmeyer, 2004).
As mitocôndrias são organelas importantes, na medida em que participam da manutenção de funções celulares vitais, tais como a respiração celular e a síntese de ATP, modulação do estado redox da célula, regulação osmótica, controlo de pH, homeostasia do cálcio no citoplasma e sinalização intracelular. Paradoxalmente, a mitocôndria contêm no espaço intermembranário proteínas letais, capazes de desencadear o processo de morte celular, entre as quais figura o citocromo c. A libertação destas proteínas mitocondriais é controlada por um balanço orquestrado entre membros pró e anti-apoptóticos (Parolin & Reason, 2001; Cory & Adams, 2002). O equilíbrio de ações entre os elementos pró-apoptóticos (ex. Bax, Bak, Bad, Bid, Bcl-Xs, Bag, Bik e Hrk) e anti-apoptóticos (ex. Bcl-2, Bcl-xL, Bcl-w, Mcl-1, Bfl-1, Brag-1 e A1) da família Bcl-2 irá determinar a sentença da célula. Existem mais de 20 membros da família Bcl e a maior parte deles funcionam de modo a regular a apoptose. Fatores de crescimento e outros sinais de sobrevivência estimulam a produção de proteínas anti-apoptóticas, sendo as principais Bcl-2, Bcl-x. Estas proteínas encontram-se normalmente no citoplasma e nas membranas mitocondriais, onde controlam a permeabilidade mitocondrial e previnem a fuga de proteínas mitocondriais que possuem a capacidade para desencadear a morte celular (Figura 4A) (Riedl & Salvesen, 2007).
Para a manutenção da integridade celular, é necessário que os componentes pró-apoptóticos, presentes no interior da mitocôndria, não sejam
14
Carla Garcia
libertados para o citoplasma. Contudo, quando as células são privadas de sinais de sobrevivência ou o seu DNA se encontra danificado, sensores de stress são ativados. Estes sensores constituem também membros da família Bcl, denominados “BH3 only proteins” que, por sua vez, irão ativar dois efetores críticos (pró-apoptóticos), respetivamente Bax e Bak, os quais formam oligómeros que se inserem na membrana mitocondrial, criando canais que permitirão a passagem de proteínas da membrana mitocondrial interna para o citoplasma. O resultado da ativação Bax-Bak, juntamente com a perda das funções de proteção dos membros anti-apoptóticos da família Bcl, traduz-se na libertação, para o citoplasma, de várias proteínas mitocondriais capazes de desencadear a cascata de caspases (Figura 4B) (Riedl & Salvesen, 2007).
Figura 4. Via intrínseca de ativação da apoptose (mitocondrial)
A) a viabilidade celular é mantida pela indução de proteínas anti-apoptóticas, tais como Bcl-2, por intermédio de sinais de sobrevivência. Estas proteínas permitem manter a integridade da membrana mitocondrial, evitando fuga de proteínas mitocondriais. B) a perda de sinais de sobrevivência, danos no DNA e outros fatores de stress ativam sensores que antagonizam as proteínas anti-apoptóticas, ativando proteínas pró-apoptóticas, tais como Bax e Bak, as quais formam canais na membrana mitocondrial. A libertação subsequente do citocromo c (e de outras proteínas) origina a ativação das caspases e a apoptose. (Adaptado de Kumar et al., 2010).
15
Carla Garcia
Uma das proteínas libertadas é o citocromo c, muito conhecido pelo papel que desempenha ao nível da respiração mitocondrial. Uma vez libertado no citosol, o citocromo c liga-se a uma proteína denominada Apaf-1 (“apoptosis-activating factor-1”) e à pro-caspase 9, formando um complexo designado por apoptossomo. Este complexo promove a clivagem da pró-caspase-9, libertando a caspase-9 ativa que, por sua vez, ativará uma protease executora por excelência, a caspase-3, desencadeando a apoptose (Vaux & Silke, 2003; Shiozaki & Shi, 2004).Além disso, uma supra-regulação da indução da síntese do óxido de azoto (iNOS) foi também relacionada com um aumento da permeabilidade mitocondrial e a libertação do citocromo c (Kim et al., 2002; Atre et al., 2006).
Existem algumas evidências de que a via intrínseca da apoptose pode ser desencadeada sem intervenção das mitocôndrias. A apoptose pode ser iniciada por ativação das caspases a montante da mitocôndria e o subsequente aumento da permeabilidade mitocondrial e a libertação de moléculas pró-apoptóticas servem para amplificar o sinal de morte. No entanto, os mecanismos de apoptose independentes de mitocôndrias não se encontram ainda bem definidos (Joza et al., 2002).
Tanto a via intrínseca como a via extrínseca da apoptose convergem na ativação da caspase-3, dando continuidade a uma via comum de morte celular (Mitchell & Cotran, 2007).
2.3. MÉTODOS PARA DETEÇÃO DA APOPTOSE
Uma vez que a apoptose ocorre através de uma cascata muito bem regulada de eventos, existem muitas possibilidades para medir a atividade destes reguladores ou as consequências funcionais da sua ação. Um grande número de ensaios para deteção e contagem de células apoptóticas tem vindo a ser desenvolvido, no entanto, todos eles apresentam as suas vantagens e desvantagens (Figura 5). Por exemplo, determinadas características da apoptose podem surgir apenas transitoriamente, enquanto outras podem sobrepôr-se parcialmente com a necrose. É por isso importante efetuar dois ou mais ensaios distintos para confirmar que a morte celular está de facto a ocorrer pelo processo de apoptose. Mais ainda, alguns métodos podem ser mais adequados para culturas celulares mas inapropriados para
16
Carla Garcia
detetar apoptose em secções de tecidos. Por este motivo, a escolha dos métodos de deteção de apoptose em células, tecidos ou órgãos deve ser sempre bem estudada, avaliando-se de forma prévia as vantagens e os inconvenientes associados a cada método (Watanabe et al., 2003; Otsuki et al., 2003).
2.3.1. ATIVAÇÃO DAS CASPASES
Quando as caspases são ativadas, clivam substratos específicos, tornando-os ativtornando-os ou inativtornando-os. Estas clivagens produzem alterações morfológicas associadas ao processo apoptótico (Taylor et al., 2008; Fischer et al., 2003). Existem anticorpos contra uma grande variedade de substratos de caspases, tais como PARP-1 e muitos outros, sendo que várias empresas têm vindo a desenvolver anticorpos que detetam exclusivamente a forma clivada da caspase mas não a forma nativa de um substrato proteico. Estes anticorpos específicos para identificação de um determinado local de clivagem de caspases, como por exemplo os anticorpos desenvolvidos para interagir com a citoqueratina 18 (M30 CytoDEATH), são particularmente úteis para deteção de estados iniciais de apoptose em ensaios celulares e mesmo em biópsias tecidulares através de técnicas imunohistoquímicas (Fuentes-Prior & Salvesen, 2004).
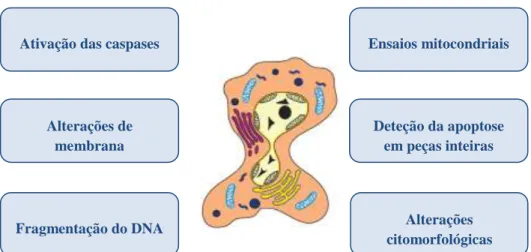
Figura 5. Métodos para deteção da apoptose
A apoptose pode incluir ativação das caspases, fragmentação do DNA, assim como alterações na membrana plasmática e nas mitocôndrias, alterações citomorfológicas, entre outras, podendo ser avaliada por vários métodos em culturas celulares ou biópsias tecidulares (Adaptado de Schulze-Osthoff, 2008).
Ensaios mitocondriais Ativação das caspases
Alterações de membrana Fragmentação do DNA Deteção da apoptose em peças inteiras Alterações citomorfológicas
17
Carla Garcia
2.3.1.1. CITOQUERATINA, CITOESQUELETO E APOPTOSE
O citoesqueleto celular é suportado por uma rede de sustentação formada por filamentos e túbulos de reduzidas dimensões. É composto principalmente por elementos estruturais de três tipos: microfilamentos, microtúbulos e filamentos intermediários, assim como proteínas acessórias responsáveis pela ligação destes elementos entre si, bem como à membrana plasmática e às membranas das organelas celulares (Young & Heath, 2001).
Os filamentos intermediários (IF) são constituídos por membros de uma família de proteínas, designadas por queratinas, as quais se organizam de modo a formar filamentos de 10-nm, podendo ser subdivididas em tipo I e II. As queratinas possuem um domínio central α-hélice (“central α helical rod domain”), ladeado por dois domínios não hélicos, NH2- terminal (“head”) e COOH-terminal (“tail”), estes
últimos contendo os locais sujeitos a muitas das modificações pós-translacionais, inclusivamente fosforilação (Omary et al., 1998). As citoqueratinas 8 (K8) e 18 (K18) integram os principais constituintes dos filamentos intermediários das células epiteliais, estando ambas sujeitas ao processo de fosforilação. Vários estudos demonstraram que, durante a apoptose, os filamentos K18 sofrem reorganização em estruturas granulares, sendo que esta se encontra associada à fosforilação da citoqueratina 18 em serina 53. Para além disso, foi demonstrado que a citoqueratina 18, mas não a citoqueratina 8, sofre clivagem pelas caspases na região “Linker” L1-2 do domínio central α-hélice (Figura 6).
Figura 6. Sequência de aminoácidos da região Linker 1-2 do domínio central dos diferentes membros da família IF. Os potenciais locais de clivagem pelas
18
Carla Garcia
As caspases, ativadas durante a apoptose, clivam a citoqueratina 18 na sua sequência VEVD/A, localizada entre os dois domínios não hélicos. Outro local de clivagem da caspase é o domínio COOH terminal da K18 (Caulín et al., 1997). As caspases -6, -3 e -7 são as principais responsáveis pela clivagem da citoqueratina 18, determinando o aparecimento de um neoepítopo (ausente em células necróticas) que é especificamente reconhecido pelo anticorpo monoclonal M30 CytoDeath, tendo este vindo a ser sugerido como um marcador da apoptose, validado in vitro (Leers et al., 1999) mas também in vivo nos trofoblastos da placenta humana (Austgulen et al., 2002; Chiu et al., 2001), endométrio (Morsi et al., 2000), cólon (Backus et al., 2002; Carr, 2000) e glândulas salivares (Kusama et al., 2000).
Em conclusão, o anticorpo M30 define um epítopo na CK18 que é independente dos eventos de fosforilação das citoqueratinas, permitindo a deteção de fases iniciais de apoptose, antecedendo os ensaios da anexina V ou a positividade dos métodos de deteção da fragmentação do DNA (TUNEL). A reatividade do epítopo em tecidos fixados em formol e embebidos em parafina torna o M30 uma ferramenta adicional na rotina patológica no que se refere ao impacto da apoptose, tanto retrospetiva como prospetivamente. Uma vez que a exposição do neoepítopo de M30 parece ocorrer numa fase inicial da cascada apoptótica, pode tornar-se vantajoso no estudo da dinâmica deste processo, através da monitorização de procedimentos de indução ou inibição da apoptose, permitindo inclusivamente a quantificação de células epiteliais apoptóticas ao nível do citoesqueleto. A definição do local do epítopo mostra uma correlação com propriedades moleculares conhecidas dos locais de clivagem das caspases. Este facto fornece uma base molecular para um evento apoptótico inicial, oferecendo a possibilidade de intervenção terapêutica quando os processos apoptóticos estão fora de equilíbrio (Leers et al., 1999).
2.3.2. ALTERAÇÕES DE MEMBRANA
Outra característica específica da apoptose é a exposição da fosfatidilserina (PS) para o exterior da membrana plasmática das células apoptóticas. A fosfatidilserina encontra-se normalmente confinada no interior da membrana plasmática de células saudáveis, no entanto, pode ser translocada para o folheto
19
Carla Garcia
exterior da membrana como resposta a estímulos pró-apoptóticos. Este mecanismo é dependente da ação das caspases, contudo, o processo pelo qual as caspases promovem a externalização da PS continua por desvendar. A externalização da fosfatidilserina é importante na eliminação de células apoptóticas pois representa um sinal para o envolvimento por macrófagos após ligação a um recetor putativo. Este processo garante a captação precoce de células apoptóticas sem que ocorra libertação dos componentes celulares e sem provocar uma resposta inflamatória (Lauber et al., 2004).
Experimentalmente, a externalização da fosfatidilserina é detetada via Anexina-V, uma proteína que se liga à PS. Podem ser encontrados vários derivados de Anexina-V, associados a diferentes fluorocromos, fornecendo múltiplas possibilidades para medição da apoptose, por exemplo através de citometria de fluxo multicolor ou microscopia de fluorescência. As vantagens incluem a sensibilidade (podem detetar uma única célula apoptótica), a capacidade para confirmar a atividade das caspases iniciadoras, assim como a rapidez do processo. A desvantagem verifica-se ao nível das células necróticas, as quais são também marcadas após rutura da sua membrana plasmática. Desta forma, um controlo crítico consiste na demonstração da integridade da membrana das células PS positivas. Uma vez que a perda de integridade da membrana é uma característica patognomónica do processo necrótico de morte celular, as células necróticas irão corar através de corantes nucleicos ácidos membrano-impermeáveis, tais como iodeto de propídio ou azul tripano. Do mesmo modo, a integridade da membrana das células apoptóticas pode ser demostrada pela ausência desta marcação. Nestes ensaios, as células viáveis são negativas para a Anexina-V e para o iodeto de propídio, enquanto que as células em fases iniciais de apoptose se apresentam positivas à Anexina-V mas negativas à coloração de iodeto de propídio, sendo que as células necróticas demonstram positividade tanto à Anexina-V como ao iodeto de propídio. A transferência da fosfatidilserina para o exterior da membrana celular permite igualmente o transporte de determinados corantes para o interior da célula de uma forma unidirecional. À medida que a célula acumula o corante e encolhe em volume, o conteúdo celular de corante torna-se mais concentrado, podendo ser visualizado através de microscopia de luz. Este bioensaio de captação de corante
20
Carla Garcia
funciona bem em culturas celulares e apresenta um elevado grau de sensibilidade (Elmore, 2007).
2.3.3. FRAGMENTAÇÃO DO DNA
A técnica “DNA laddering” é usada para visualizar os produtos resultantes da clivagem endonucleossómica pelo processo de apoptose. Este ensaio envolve a extração de DNA de uma célula lisada, seguida por eletroforese em gel de agarose. Este processo resulta numa “escada de DNA” característica, em que cada banda da escada se encontra separada por uma sequência de 180 pares de bases de tamanho. Esta metodologia torna-se fácil de executar, possui uma sensibilidade de 1x106 células (isto é, o nível de deteção é de cerca de 1.000.000 células), mostrando-se útil para tecidos e culturas celulares com um elevado número de células apoptóticas por massa de tecido ou de volume, respetivamente. Por outro lado, não é recomendada em casos que apresentem baixo número de células apoptóticas. Existem no entanto outras desvantagens neste ensaio. Uma vez que a fragmentação do DNA ocorre numa fase posterior da apoptose, a ausência de uma escada de DNA não elimina o potencial de que as células possam estar a sofrer apoptose precoce (Elmore, 2007).
A apoptose tem sido commumente identificada em tecidos através da aplicação do método TUNEL (“Terminal Dutp Nick End-Labeling”). Este método é utilizado para medição da fragmentação do DNA, baseando-se na avaliação dos produtos endonucleossómicos resultantes da clivagem do DNA (Kressel & Groscurth, 1994). A marcação enzimática, através da enzima deoxinucleotidil transferase terminal (TdT), cataliza a rotulagem das quebras de DNA por intermédio de derivados de UTP (deoxiuridina trifosfato) (Figura 7B), os quais, associados a uma variedade de sondas, permitem a sua deteção por microscopia de luz (técnicas de imunoperoxidase), microscopia de fluorescência ou citometria de fluxo (Alison, 1999; Cuello-Carrion & Ciocca, 1999; Jerome et al., 2000).
É uma técnica rápida, podendo ser concluída no espaço de algumas horas, no entanto, apresenta desvantagens associadas ao seu elevado custo e ao desconhecimento de quantas quebras de ligação do DNA são necessárias para deteção por este método. Este ensaio encontra-se também sujeito ao aparecimento
21
Carla Garcia
de falsos positivos derivados de células necróticas e células em processo de reparação de DNA, sendo que, por estas razões, deverá ser acompanhado por outro ensaio de deteção de apoptose (Elmore, 2007).
Vários kits encontram-se comercialmente disponíveis para deteção pelo método TUNEL, no entanto, vários investigadores relatam a incidência de elevada coloração de fundo, assim como elevada marcação de falsos-positivos, tornando difícil a interpretação de resultados (Labat-Moleur et al., 1998; Willingham, 1999; Cuello-Carrion & Ciocca, 1999; Jerome et al., 2000). Esta alta taxa de falsos positivos pode potencialmente surgir a partir de vários fatores. Em primeiro lugar, há a considerar as situações de fixação muito extensa de cortes de tecido ou fixação incompleta ou retardada, podendo levar a coloração inespecífica. Em segundo lugar, a necessidade de desmascaramento após o processo de fixação em formol e inclusão em parafina (através de tratamentos proteolíticos), pode produzir ruturas artificiais no DNA, tornando incapaz a diferenciação imunohistoquímica do
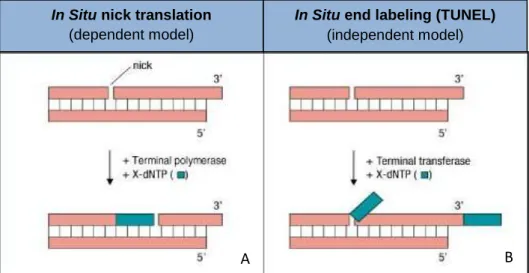
Figura 7. Príncipio do método de fragmentação de DNA – TUNEL. Durante
a apoptose, a atividade da DNAse não gera apenas cadeias duplas e fragmentos de DNA de baixo peso molecular (mono e oligonucleosomos), mas também introduz quebras no DNA de elevado peso molecular. Estes processos podem ser identificados por marcação dos grupos terminais 3´- OH com nucleótidos modificados, através de reações enzimáticas. Existem 2 diferentes métodos: A) utiliza a polimerase terminal para incorporar nucleótidos marcados em locais de quebra de DNA, enquanto que o segundo método B) utiliza a transferase terminal (TdT) para acoplar nucleótidos a todos os grupos terminais OH (Adaptado de Anónimo s/d)
In Situ nick translation
(dependent model)
In Situ end labeling (TUNEL)
(independent model)
(
22
Carla Garcia
verdadeiro processo de apoptose. Finalmente, a necrose também resulta em quebras no DNA e, como tal, representa um alvo para a enzima TdT (Grasl-Kraupp
et al., 1995; Cummings et al., 1997; Labat-Moleur et al., 1998; Cuello-Carrion &
Ciocca, 1999). Por todas estas razões, muitos investigadores têm sugerido que a interpretação correta dos resultados TUNEL requer a aplicação de um segundo ensaio de deteção para confirmação da apoptose (Collins et al., 1992; Grasl-Kraupp
et al., 1995; Elmore, 2007).
2.3.4. ENSAIOS MITOCONDRIAIS
Durante o processo de apoptose, as alterações verificadas ao nível da mitocôndria são mais difíceis de detetar, no entanto, os ensaios mitocondriais e a libertação do citocromo c permitem a deteção em fases iniciais da via intrínseca da apoptose (Bedner et al., 1999; Darzynkiewicz et al., 1999).
A via mitocondrial inicia-se com a permeabilização da membrana mitocondrial externa por inativação dos membros anti-apoptóticos da família Bcl-2, resultando na libertação do citocromo c e outras proteínas do espaço intermembranário para o citosol. O citocromo c é uma hemoproteína que atua como transportadora de eletrões na cadeia respiratória de todos os organismos aeróbios, encontrando-se localizada no espaço mitocondrial intermembranário. Estudos recentes têm identificado o citocromo c citosólico como um fator necessário para ativação da apoptose. Durante este processo, o citocromo c é translocado a partir da membrana mitocondrial para o citoplasma, onde se torna necessário para ativação da caspase-3. A libertação destas proteínas pode ser determinada por imunohistoquímica ou por Western blotting das frações citosólicas, mitocondriais e nucleares (Kroemer et al., 2007).
Também a microscopia de varrimento a laser confocal permite criar fatias óticas submicrométricas através de células vivas, as quais podem ser utilizadas na monitorização de vários eventos mitocondriais em células individuais intactas ao longo do tempo (Bedner et al., 1999; Darzynkiewicz et al., 1999). A alteração da permeabilidade mitocondrial, a despolarização da membrana mitocondrial interna, os fluxos de Ca2+, o estado redox mitocondrial e as espécies reativas de oxigénio podem ser avaliadas segundo esta metodologia. A grande desvantagem deste
23
Carla Garcia
método relaciona-se com o facto dos parâmetros mitocondriais monitorizados poderem também ocorrer durante o processo de necrose (Poot & Pierce, 1999).
Outro evento igualmente observado durante o processo de morte celular é a perda do potencial transmembranário interno da mitocôndria, ou seja, o gradiente eletroquímico de protões gerado pela cadeia respiratória. Este processo é designado por transição de permeabilidade mitocondrial (TPM), caracterizando-se pela abertura de um poro proteíco não seletivo na membrana mitocondrial interna, o qual é induzido por fluxos de Ca2+, contribuindo para a libertação do citocromo c (Kroemer
et al., 2007). O colapso do gradiente eletroquímico pode ser facilmente avaliado
através de uma variedade de corantes catiónicos associados a técnicas de citometria de fluxo ou de microscopia de fluorescência (Poot & Pierce, 1999). Em células saudáveis, estes corantes lipofílicos acumulam-se na mitocôndria, formando agregados que emitem uma fluorescência específica. Em células apoptóticas, a membrana mitocondrial externa não mantém o gradiente eletroquímico e o corante catiónico difunde-se para o citoplasma, onde emite uma fluorescência diferente da forma agregada (Elmore, 2007).
Outros corantes mitocondriais podem ser usados para avaliar o potencial redox ou a atividade mitocondrial das células, contudo, estes corantes não consideram o mecanismo de morte celular, devendo sempre ser utilizados em conjugação com outros métodos de deteção da apoptose, nomeadamente ensaios de avaliação de caspases (Elmore, 2007).
A libertação do citocromo c da mitocôndria pode também ser avaliada através de microscopia eletrónica e de fluorescência em células vivas ou fixadas (Scorrano et al., 2002). No entanto, após a sua libertação para o citosol, o citocromo c torna-se uma proteína instável (Goldstein et al., 2000). Deste modo, um controlo não-apoptótico deve ser usado por forma a garantir que as condições de coloração utilizadas são capazes de detetar qualquer citocromo c que se encontre disponível (Elmore, 2007).
Reguladores proteícos apoptóticos ou anti-apoptóticos tais como Bax, Bid e Bcl-2 podem também ser detetados por intermédio da microscopia confocal e de fluorescência (Tsien, 1998; Zhang et al., 2002).
24
Carla Garcia 2.3.5. DETEÇÃO EM PEÇAS INTEIRAS
A apoptose pode também ser visualizada em peças integrais de embriões, utilizando determinados corantes tais como Laranja de acridina, Sulfato Azul de Nilo e Vermelho neutro (Zucker et al., 2000). Uma vez que estes corantes são acidófilos, concentram-se em áreas de elevada atividade lisossómica e fagocítica. Os resultados obtidos com estes métodos terão de ser validados em conjugação com outros ensaios apoptóticos, pois estes corantes não permitem a distinção entre detritos lisossómicos apoptóticos degradados e a degradação de outros detritos tais como microorganismos. Ainda que todos estes métodos sejam considerados rápidos e pouco dispendiosos, apresentam certas desvantagens. Por exemplo, o Laranja de acridina é um corante tóxico e mutagénico, extinguindo-se rapidamente sob condições normais, enquanto que o Sulfato Azul de Nilo e o Vermelho neutro não conseguem penetrar tecidos mais grossos, podendo perder-se durante o processamento. O Lysotracker red é outro corante que atua de forma similar, podendo ser usado em microscopia confocal de laser, de forma a proporcionar uma imagem tridimensional de células apoptóticas. Este corante mantém-se estável durante o processamento, consegue penetrar em tecidos mais espessos, não se extinguindo facilmente e pode ser utilizado em culturas celulares assim como em peças de embriões, tecidos e órgãos (Elmore, 2007).
2.3.6. ALTERAÇÕES CITOMORFOLÓGICAS
A avaliação microscópica de secções de tecidos coradas através da hematoxilina-eosina permite a visualização de células apoptóticas. Embora este método permita a deteção de uma única célula apoptótica, torna-se necessária a confirmação através de métodos adicionais. Uma vez que os eventos morfológicos da apoptose ocorrem de forma rápida e os fragmentos são rapidamente fagocitados, pode ocorrer apoptose em determinados tecidos mesmo antes desta ser histologicamente visível. Além disso, este método deteta os eventos mais tardios da apoptose, pelo que células em estádios mais precoces de apoptose não são detetáveis (Elmore, 2007).
25
Carla Garcia
Secções ultrafinas obtidas a partir de blocos embebidos em resinas sintéticas podem ser coradas através do Azul de Toluidina ou do Azul de Metileno, de forma a revelar intensamente células apoptóticas coradas, quando submetidas a microscopia de luz. Esta metodologia depende da condensação nuclear e citoplasmática que ocorre durante a apoptose. A preservação de detalhes tecidulares e celulares e a possibilidade de avaliar grandes porções de tecido constituem vantagens distintas deste método. No entanto, pequenos corpos apoptóticos não serão detetados e células saudáveis com elevada densidade de grânulos intracelulares podem ser confundidas com células apoptóticas ou com detritos. Além disso, ocorre uma perda de antigenicidade durante o processamento, facto que impede a execução de técnicas imunohistológicas ou enzimáticas no mesmo tecido, contudo, este tecido pode ser utilizado em microscopia eletrónica de transmissão (Elmore, 2007).
A microscopia eletrónica de transmissão é considerada a fórmula de ouro para confirmação da apoptose. Isto porque a categorização de uma célula apoptótica é irrefutável se a célula apresentar determinadas características morfológicas e estruturais (White & Cinti, 2004). Estas características incluem: 1) núcleos eletrodensos (marginalização na fase inicial); 2) fragmentação nuclear; 3) membrana celular intacta mesmo no final da fase de desintegração celular; 4) desorganização das organelas citoplasmáticas; 5) grandes vacuolos claros; e 6) projeções na superfície celular. À medida que a apoptose progride, estas células irão perder as adesões celulares que mantinham entre si, separando-se das células vizinhas. Durante a fase tardia da apoptose, a célula fragmentar-se-á em pequenos corpos apoptóticos com membranas celulares intactas, contendo organelas citoplasmáticas com ou sem fragmentos nucleares. A fagocitose destes corpos apoptóticos pode também ser visualizada através da microscopia eletrónica de transmissão. As grandes desvantagens deste método são o seu elevado custo, grande dispêndio de tempo e a possibilidade de avaliar apenas, num determinado momento, uma pequena região. Outras desvantagens incluem a dificuldade de deteção de células apoptóticas devido à sua natureza transiente e a incapacidade de deteção de células apoptóticas em estádios iniciais (Elmore, 2007).