28
Eficácia e Segurança dos Agonistas dos
Recetores GLP-1 no Tratamento da Diabetes
Mellitus Tipo 2: Revisão Sistemática
Efficacy and Safety of GLP-1 Receptor Agonists for Type 2 Diabetes
Mellitus Treatment: Systematic Review
Resumo
Introdução: Os análogos peptídicos glucagon-like são uma nova classe de fármacos usada no tratamento da diabetes mellitus tipo 2 que mimetiza a hormona endógena glucagon-like peptide 1. A glucagon-like peptide 1 regula os níveis de glucose através da estimulação da secreção de insulina de uma forma dependente da glucose, diminuindo a secreção de glucagon, atrasando o esvaziamento gástrico e promovendo a saciedade. O tratamento individualizado da diabetes mellitus tipo 2, usando vários agonistas dos recetores peptídicos glucagon-like, foi recentemente descrito e o seu interesse continua a crescer.
Objetivo: Fazer uma revisão da eficácia e segurança dos agonistas glucagon-like peptide 1 nos doentes que não conseguem controlar a diabetes mellitus tipo 2 com metformina, colocando em evidência o seu valor terapêutico acrescentado, quando comparados com terapêuticas orais usadas em segunda linha na diabetes mellitus tipo 2.
Métodos: Os estudos foram obtidos nas bases de dados The Cochrane Library e PubMed. Foram selecio-nados ensaios controlados e aleatorizados, com uma duração de pelo menos oito semanas, que comparam um análogo dos recetores glucagon-like peptide 1 com um agente antidiabético oral em doentes com um con-trolo glicémico inadequado e a fazer monoterapia com metformina e que reportam a hemoblogina A1c em homens e mulheres não grávidas com diabetes mellitus tipo 2.
Resultados: De 72 artigos identificados e potencialmente relevantes, 23 foram selecionados para uma avaliação mais detalhada e dez cumpriram os critérios de inclusão. A maioria dos agonistas dos recetores glucagon-like peptide 1 demonstrou uma eficácia equivalente ou superior à maioria dos comparadores ativos na redução da hemoglobina A1c, com uma proporção superior de doentes a atingir uma hemoglobina A1c <7%. Estes agonistas também demonstraram efeitos extraglicémicos, como a perda de peso e a redução de alguns aspetos importantes a nível cardiovascular. Os efeitos secundários incluíram efeitos gastrointesti-nais, nomeadamente náuseas, vómitos e diarreia. A incidência de hipoglicemias foi menos comum para esta classe de agentes.
Conclusão: Os agonistas dos recetores do glucagon-like peptide 1 são opções eficazes e seguras como trata-mento em segunda linha da diabetes mellitus tipo 2.
Palavras-chave: Agonistas dos Receptores GLP 1/uso terapêutico; Diabetes Mellitus Tipo 2/tratamento; Exenatido; Liraglutido; Resultado do Tratamento; Segurança.
Ana Paula Martins1; Rodrigo Miguel Martins Murteira2
1.Faculdade de Farmácia da Universidade de Lisboa, Lisboa, Portugal 2.Faculdade de Farmácia da Universidade de Lisboa, Lisboa, Portugal
Correspondência:
Rodrigo Murteira, rodrigomiguelmurteira@gmail.com Recebido: 21/10/2015; Aceite: 15/03/2016
29
Abstract
Introduction: Glucagon-like peptide analogues are a new class of drugs used in the treatment of type 2 diabetes mellitus that mimic the endogenous hormone glucagon-like peptide 1. Glucagon-like peptide 1 regulates glucose levels by stimulating glucose-dependent insulin secretion, suppressing glucagon secretion, delayed gastric emptying and promoting satiety. The individualized treatment of type 2 diabetes mellitus, using various glucagon--like peptide receptor agonists, has recently been described and the interest related to these drugs continues to grow.
Objectives: To review the efficacy and safety of glucagon-like peptide 1 agonists in patients with inadequately controlled type 2 diabetes mellitus on metformin alone, highlighting their added value in therapeutic use comparatively to second line oral therapies used in type 2 diabetes mellitus.
Methods: Studies were obtained from electronic searches of The Cochrane Library and PubMed. Randomized controlled trials were selected if they were at least 8 weeks in duration; compared a glucagon-like peptide 1 analogue with an oral anti-diabetic agent in patients experiencing inadequate glycemic control with metformin monotherapy; and reported hemoglobin A1c data in non-pregnant adults with type 2 diabetes mellitus.
Results: Of 72 potentially relevant articles identified, 23 were retrieved for detailed evaluation and 10 met the inclusion criteria. The majority of glucagon-like peptide 1 agonists showed equivalent or superior efficacy than most active comparators for reducing hemoglobin A1c, with a greater proportion of patients achieving hemoglobin A1c <7%. Glucagon-like peptide 1 agonists also showed extra-glycemic effects such as weight loss and the reduction of important cardiovascular parameters. Side effects included gastrointestinal complications, mainly nausea, vomiting and diarrhea. The incidence of hypoglycemia was less common for this class of agents. Conclusion: Glucagon-like peptide 1 agonists are an efficient and safe second-line option for treatment of type 2 diabetes.
Keywords: Diabetes Mellitus, Type 2/drug therapy; Exenatide; Glucagon-Like Peptide 1/therapeutic use; Glucagon-Like Peptide 1/analogs & derivatives; Liraglutide; Safety; Treatment Outcome.
Introdução
A diabetes mellitus tipo 2 (DMT2) é uma doença cró-nica e progressiva, com um mecanismo fisiopatológi-co fisiopatológi-complexo subjacente caracterizado por deficiên-cias na secreção de insulina, no excesso de produção hepática de glucose e na resistência à insulina, quer a nível dos tecidos periféricos quer a nível hepático.1 À medida que esta afeção progride, o risco de comor-bilidades cardiovasculares aumenta, pelo que a ma-nutenção de níveis glicémicos normais torna-se cada vez mais importante, e também mais difícil de gerir. De facto, o aparecimento de sucessivos novos fár-macos não tem trazido simplicidade ao tratamento desta doença.2 As alterações no estilo de vida são a base em que assenta o tratamento não farmacológico da DMT2 e a metformina é largamente aceite como a terapêutica de primeira linha.3 O problema, e o ponto em que as guidelines não são claras, está em como pros-seguir a terapêutica quando a monoterapia com me-tformina é insuficiente para controlar a hiperglicemia. Segundo as «Recomendações Nacionais da Sociedade Portuguesa de Diabetologia para o Tratamento da Hiperglicemia na Diabetes Tipo 2», que foram
adap-tadas e recentemente atualizadas com base na de-claração de posição conjunta da American Diabetes Association (ADA) e da European Association for the Study of Diabetes (EASD), a escolha do fármaco a as-sociar à metformina deverá ser individualizada, com base nas características do doente e das diferentes classes farmacológicas.4,5 Preconiza-se assim a in-dividualização da escolha, por um lado com base no estádio da doença, na idade do doente e na existência de comorbilidades e, por outro lado, com base na efi-cácia, no risco de hipoglicemia, no efeito sobre o peso, nos efeitos secundários e no custo. Desta forma, todas as classes terapêuticas se afiguram como possíveis candidatas a uma associação com metformina. Os agonistas dos recetores glucagon-like peptide-1 (GLP-1), ou incretinomiméticos, são fármacos que mimetizam as ações das incretinas, hormonas intes-tinais que são produzidas após a ingestão de gluco-se, e que, entre outros efeitos, são responsáveis pela regulação dos níveis de glucose ao estimularem a secreção de insulina de uma forma dependente da glucose.6,7 Além dos efeitos anti-hiperglicémicos que lhes são reconhecidos, talvez o que tem gerado maior
30
interesse nesta nova classe de fármacos seja o seu potencial extraglicémico, em que a redução do peso se apresenta como um dos principais benefícios.6 Dentro da classe dos incretinomiméticos existem os agonistas de curta duração, como o exenatido, o li-raglutido e o lixisenatido, e as formulações de liber-tação prolongada, como o exenatido long acting release (LAR), o albiglutido e o dulaglutido.
Segundo as recomendações internacionais mais re-centes, estes agonistas podem ser utilizados em qual-quer altura da evolução da DMT2, qual-quer em monote-rapia, em associação a outros antidiabéticos orais ou também associados à insulina.5,8
Objetivo
O objetivo do presente artigo é fazer uma revisão so-bre o conhecimento atual desta nova classe de fárma-cos, colocando em evidência o seu valor terapêutico acrescentado relativamente às terapêuticas de segun-da linha utilizasegun-das no tratamento segun-da DMT2, e tentar perceber de que forma e em que lugar da cascata tera-pêutica é que este tipo de fármacos melhor se adequa.
Métodos
Foi realizada uma revisão sistemática de ensaios clí-nicos aleatorizados cujos métodos e resultados são apresentados de acordo com as recomendações dos «Preferred Reporting Items for Systematic Reviews and Meta-Analyses» (PRISMA).9
Critérios de Elegibilidade
Os ensaios clínicos aleatorizados foram considerados elegíveis se cumprissem os seguintes requisitos: (1) incluíssem adultos com mais de 18 anos de idade e com DMT2 não controlada com metformina; (2) ti-vessem duração superior a oito semanas; (3) avalias-sem a eficácia e a segurança de um agonista dos re-cetores GLP-1 em combinação com metformina e em que o comparador ativo seja metformina associada a um antidiabético oral; e (4) incluíssem a hemoglobi-na glicada (HbA1c) como outcome.
Fontes de Pesquisa
Foi realizada uma pesquisa da literatura consultando as bases de dados PubMed e Cochrane Library, de ja-neiro de 2007 até julho de 2015, utilizando os termos glucagon-like peptide 1 receptor agonists; liraglutide; exenatide; lixisenatide; albiglutide; dulaglutide; efficacy; safety e type 2 diabetes mellitus. Com o objetivo de localizar artigos que não tivessem sido encontrados na pesquisa inicial, utili-zaram-se as listas de referências bibliográficas dos arti-gos selecionados.
Seleção e Análise dos Ensaios e dos Dados
A seleção dos ensaios não foi verificada independen-temente por mais de um autor. Para a identificação dos artigos analisou-se o título e o abstract de todos os artigos recolhidos e apenas os potencialmente rele-vantes foram analisados na íntegra. Os dados relevan-tes sobre a intervenção, como o desenho do estudo, o tamanho da amostra, a duração, as características da população e da intervenção, bem como todos os outco-mes de eficácia e de segurança, foram registados. Para avaliar a eficácia foram registadas a alteração da HbA1c, a glucose em jejum (FPG) e a glucose pós- -prandial (PPG), desde o início até final do estudo. Foi também registada a proporção de doentes que atingiu um valor de HbA1c menor do que 7% e a alte-ração do peso. Quando incluídos, a altealte-ração do perfil lipídico e da pressão arterial também foram regista-dos. Para avaliar a segurança foram registadas a inci-dência de efeitos adversos gastrointestinais (náuseas, vómitos e diarreia), e de outros efeitos adversos cli-nicamente relevantes, e a percentagem de eventos de hipoglicemia.
Resultados
Resultados da Pesquisa
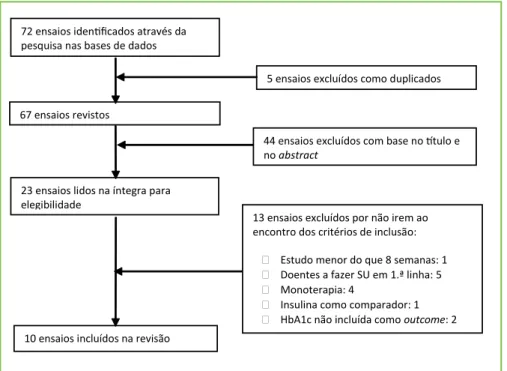
A Fig. 1 exemplifica o processo de seleção dos ensaios. Foram incluídos nesta revisão dez ensaios controla-dos e aleatorizacontrola-dos. Quatro controla-dos ensaios analisaram o exenatido, um analisou o exenatido LAR, um inves-tigou o albiglutido, três o liraglutido e um ensaio o dulaglutido. Na Tabela 1 estão descritas as caracterís-ticas basais de cada ensaio incluído. A duração média dos ensaios foi de 52 semanas (20-113), a idade média variou entre os 52 e os 57 anos e a HbA1c média foi de 8,2% (7,5-8,9). Todos os dez ensaios comparam um tipo de análogo GLP-1 com um fármaco antidiabético oral em terapia dupla com metformina. De sublinhar que no ensaio de DeFronzo et al, uma das interven-ções que incluía o exenatido associado à rosiglitazo-na não foi considerada, pelo que não vem aqui descri-ta.10 Alguns dos dados relativos à eficácia e segurança apresentam-se na Tabela 2.
Eficácia HbA1c
Derosa et al, nos dois estudos que compararam o exenatido de toma bidiária com uma sulfonilureia, verificaram que ambas as sulfonilureias, nos dois ensaios, tiveram uma redução superior de HbA1c (-1,8% vs -1,5% e -1,4% vs -1,2%) (p <0,05 e p <0,01, respetivamente).11,12
931
No ensaio de DeFronzo et al, o exenatido teve uma redução de HbA1c semelhante à rosiglitazo-na (-0,9% e -1,0% para o exerosiglitazo-natido e rosiglitazorosiglitazo-na, respetivamente).10
Gallwitz et al compararam o exenatido de toma bidiá-ria e a glimepirida. Neste ensaio, a redução de HbA1c foi duas vezes superior no tratamento com exenati-do relativamente ao tratamento com a glimepirida (-0,4% vs -0,2%). A proporção de doentes que atingiu um valor de HbA1c menor que 7% também foi supe-rior no grupo do exenatido (45% contra os 31% obti-dos com a glimepirida) (p <0,0001).13
No ensaio DURATION-2, que comparou o exenatido de libertação prolongada com a sitagliptina e com a pioglitazona, verificou-se uma redução significativa da HbA1c com o exenatido LAR relativamente à sita-gliptina (-1,5% vs -0,9%, p <0,00001) e à pioglitazona (-1,5% vs -1,2%, p =0,02). Da mesma maneira, a pro-porção de doentes que atingiu uma percentagem de HbA1c menor que 7% foi significativamente superior com o exenatido LAR do que com a sitagliptina (60% vs 35%, p <0,0001), mas não foi muito diferente da ob-tida com a pioglitazona (60% vs 52%, p =0,15).14 No estudo LEAD-2 avaliou-se o efeito da administra-ção de uma das três doses de liraglutido (0,6, 1,2 ou 1,8 mg/dia), em comparação com glimepirida ou placebo. A análise estatística revelou uma redução significa-tiva (-0,7%, -1,0% e -1,0%) da HbA1c após a adição de liraglutido à metformina e comparável à obtida
Figura 1 – Fluxograma da seleção de ensaios
23 ensaios lidos na íntegra para elegibilidade
5 ensaios excluídos como duplicados pesquisa nas bases de dados
67 ensaios revistos
10 ensaios incluídos na revisão
13 ensaios excluídos por não irem ao encontro dos critérios de inclusão:
Estudo menor do que 8 semanas: 1 Doentes a fazer SU em 1.ª linha: 5 Monoterapia: 4
Insulina como comparador: 1 HbA1c não incluída como outcome: 2 no abstract
com glimepirida (-1,0%) (p <0,001 vs placebo). As percentagens de doentes a fazer 1,2 mg e 1,8 mg de liraglutido que atingiram a meta definida pela ADA para a HbA1c foram com-paráveis à obtida no grupo de doentes a fazer glime-pirida (35,3%, 42,4% e 36,3%, respetivamente).15 Seguindo um esquema similar de terapia dupla, ainda que com melhores resultados do que no LE-AD-2, Pratley et al avalia-ram a eficácia do liraglu-tido em comparação com a sitagliptina, em associa-ção com metformina. Num estudo de 52 semanas, em relação ao valor basal, a re-dução de HbA1c consegui-da com liraglutido 1,8 mg diários (-1,51%) e 1,2 mg di-ários (-1,29%) foi superior à redução conseguida com sitagliptina (-0,88%) (p <0,0001). Além disso, quase o dobro dos doentes tratados com liraglutido atingiu o objetivo da ADA, em comparação com o grupo sita-gliptina (44% e 56% nos grupos de liraglutido 1,2 mg e 1,8 mg, contra 22% no grupo sitagliptina; p <0,001).16 Charbonnel et al também investigaram as diferenças entre a dosagem de 1,2 mg de liraglutido e a sitaglip-tina. A redução de HbA1c foi semelhante nos dois grupos, -1,4% para o liraglutido 1,2 mg e -1,3% para a sitagliptina. A proporção de doentes com uma HbA1c menor que 7% foi menor com a terapêutica oral do que com a terapêutica injetável (62,8% vs 72,3%, respetivamente).17
No estudo AWARD-5, que comparou diferentes do-sagens de dulaglutido com sitagliptina, a redução na HbA1c foi quase três vezes superior no tratamento com dulaglutido do que no tratamento com sitaglip-tina. Para as doses de 0,75 mg e 1,5 mg de dulaglutido, as reduções de HbA1c foram de -0,87% e de -1,10%, respetivamente, a comparar com os -0,39% de sita-gliptina (p <0,001). No final do ensaio, a proporção de doentes a atingir a meta de HbA1c foi superior com o dulaglutido do que com a sitagliptina (49%, 58% e 33%, respetivamente) (p <0,001, para ambas as doses de dulaglutido vs sitagliptina).18
Num estudo em que se comparou o albiglutido com a sitagliptina e glimepirida houve uma ligeira melhoria
Tabela 1 – Características dos ensaios incluídos
Estudo Ano Tipo de ensaio Duração
(semanas) HbA1c (%) Peso (Kg) Tratamento
DeFronzo et al10 2010 Ensaio c ontrolado aleatorizado, sem ocultação 20 Monoterapia com MET (n=90) 7,8 92,4 Exenatido 10 µg 2x/dia Rosiglitazona 4 mg 2x/dia
Derosa et al11 2010 Ensaio controlado aleatorizado,
duplo-cego
52 Monoterapia com MET
(n=128)
8,9 82,2 Exenatido 10 µg 2x/dia Glibenclamida 15 mg
Derosa et al12 2011 Ensaio c ontrolado aleatorizado,
ocultação única
52 Monoterapia com MET
(n=111)
8,8 80,8 Exenatido 10 µg 2x/dia Glimepirida 6 mg
et al13 2012
Ensaio c ontrolado aleatorizado, sem ocultação
102-113 Monoterapia com MET (n=977)
7,5 92,0 Exenatido 10 µg 2x/dia Glimepirida 4 mg et al DURATION-214 2010 Ensaio aleatorizado de superioridade, duplo-cego 26 Monoterapia com MET (n=491) 8,5 88,0 Exenatido LAR 2 mg Sitagliptina 100 mg Pioglitazona 45 mg Nauck et al LEAD-215 2009 Ensaio c ontrolado aleatorizado, duplo-cego
26 Monoterapia com MET (n=1091) 8,4 - Liraglutido 0,6 mg Liraglutido 1,2 mg Liraglutido 1,8 mg Glimepirida 4 mg
Pratley et al16 2011 Ensaio c ontrolado aleatorizado, s em
ocultação
52 Monoterapia com MET (n=665) 8,4 93,8 Liraglutido 1,2 mg Liraglutido 1,8 mg Sitagliptina 100 mg Charbonnel 17 2013 Ensaio c ontrolado aleatorizado, s em ocultação 26 Monoterapia com MET (n=653) 8,2 91,6 Liraglutido 1,2 mg Sitagliptina 100 mg Nauck et al AWARD-518 2014 Ensaio c ontrolado aleatorizado, duplo-cego
52 Monoterapia com MET (n=1098) 8,1 86,4 Dulaglutido 1,5 mg Dulaglutido 0,75 mg Sitagliptina 100 mg Ahrén et al HARMONY-319 2014 Ensaio c ontrolado aleatorizado, duplo-cego 104 Monoterapia com MET (n=1012). 8,1 90,8 Albiglutido 50 mg Sitagliptina 100 mg Glimepirida 4 mg MET: metformina; n: tamanho da amostra; HbA1c: hemoglobina A1c.
População
na HbA1c com o albiglutido (-0,63%, -0,28% e -0,36% para o grupo de albiglutido, sitagliptina e glimepirida, respetivamente). Neste ensaio, 31,6%, 31,4% e 38,6% dos doentes a fazer sitagliptina, glimepirida e albiglutido, respetivamente, atingiram uma HbA1c menor que 7%.19 Glucose em jejum e glucose pós-prandial
DeFronzo et al observaram uma redução nos níveis de glucose em jejum nos valores de 26 e 32 mg/dL nos grupos de exenatido e rosiglitazona, respetivamente (p =0,331).10
Nos ensaios de Derosa et al observaram-se melhorias na glucose em jejum e na glucose pós-prandial; no entanto, não houve diferenças significativas entre os grupos. Nos grupos do exenatido a FPG diminui 27 mg/dL em ambos os estudos, enquanto nos grupos a fazer a terapêutica com a glibenclamida e glimepiri-da diminui 32 e 28 mg/dL, respetivamente. Relativa-mente à glucose pós-prandial, nos grupos de exenati-do esta diminui cerca de 30 e 45 mg/dL e nos grupos a fazer sulfonilureias esta diminui 37 e 46 mg/dL.11,12 Gallwitz et al verificaram que a glucose em jejum des-ceu consideravelmente no grupo do exenatido depois do primeiro (p =0,048), segundo (p =0,004) e terceiro (p <0,0001) ano de tratamento (os valores não estão disponibilizados no artigo).13
No ensaio DURATION-2 verificou-se que a redução da glucose em jejum não foi diferente entre os
gru-pos de exenatido LAR e de pioglitazona (-32 mg/dL vs -27 mg/dL, p =0,33). Ainda neste estudo verificaram- -se diferenças significativas em favor do exenatido LAR relativamente à sitagliptina (-16 mg/dL, p =0,0038).14 No ensaio LEAD-2, não foi verificada qualquer dife-rença significativa na redu-ção dos valores de glucose em jejum nos grupos do liraglutido e da glimepiri-da (-20, -29, -31, -23 mg/dL para o liraglutido 0,6 mg, 1,2 mg, 1,8 mg e glimepiri-da, respetivamente). Hou-ve uma redução dos níHou-veis de glucose pós-prandial com todos os grupos (-31 mg/dL para a dosagem de 0,6 mg de liraglutido, -41,4 mg/dL para o liraglutido 1,2 mg, -46,8 mg/dL para o grupo a fazer liraglutido 1,8 mg e -2,5 mmol/L para a glimepirida), mas a diferença só foi significativa para os grupos de liraglutido, em comparação com o placebo (-11 mg/dL, p <0,001).15 Charbonnel et al observaram uma redução significa-tiva dos valores de glucose em jejum em ambos os grupos (-34 mg/dL e -40 mg/dL para a sitagliptina e liraglutido, respetivamente).17
Tal como a HbA1c, também o liraglutido foi mais efi-caz a reduzir a glucose em jejum do que a sitagliptina, no ensaio de Pratley et al. Após 52 semanas de trata-mento, o liraglutido foi mais eficaz do que a sitaglip-tina a reduzir o valor da FPG. A redução média de FPG foi significativamente superior com o liraglutido (-31 mg/dL e -37 mg/dL, respetivamente, para o lira-glutido em doses de 1,2 mg e 1,8 mg; e -11 mg/dL para sitagliptina (p <0,0001). No que toca à glucose pós- -prandial, os autores reportaram que, durante o estu-do, foi bastante variável, sugerindo que a maior parte dos valores não correspondia aos valores de glucose pós-prandial.16
Em comparação com a sitagliptina, as diferenças dos valores de glucose em jejum, desde o início até ao final do estudo do dulaglutido relativamente à sitaglipti-na, foram significativamente superiores (p <0,001) para ambas as dosagens de dulaglutido (-26 mg/dL e -13 mg/dL para 1,5 mg e 0,75 mg de dulaglutido respetivamente).18
32
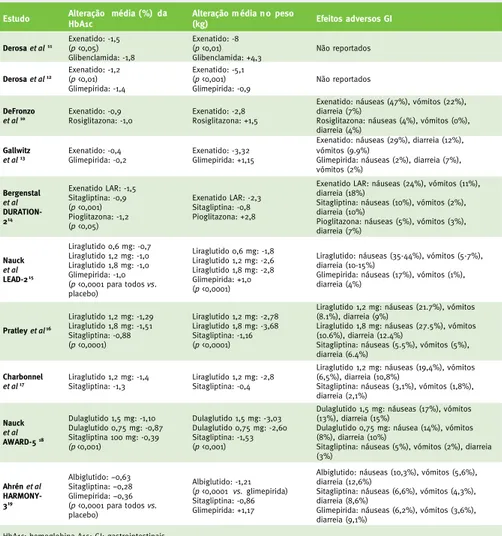
Tabela 2 – Alguns outcomes reportados nos ensaios clínicos que avaliam os agonistas
GLP-1 em terapêutica dupla com a metformina em adultos com diabetes tipo 2
Estudo Alteração média (%) da HbA1c Alteração m édia n o peso (kg) Efeitos adversos GI
Derosa et al11 Exenatido: -1,5 (p <0,05) Glibenclamida: -1,8 Exenatido: -8 (p <0,01) Glibenclamida: +4,3 Não reportados Derosa et al12 Exenatido: -1,2 (p <0,01) Glimepirida: -1,4 Exenatido: -5,1 (p <0,001) Glimepirida: -0,9 Não reportados DeFronzo
et al10 Exenatido: -0,9 Rosiglitazona: -1,0 Exenatido: -2,8 Rosiglitazona: +1,5
Exenatido: náuseas (47%), vómitos (22%), diarreia (7%)
Rosiglitazona: náuseas (4%), vómitos (0%), diarreia (4%)
Gallwitz
et al13 Exenatido: -0,4 Glimepirida: -0,2 Exenatido: -3,32 Glimepirida: +1,15
Exenatido: náuseas (29%), diarreia (12%), vómitos (9.9%)
Glimepirida: náuseas (2%), diarreia (7%), vómitos (2%) Bergenstal et al DURATION-214 Exenatido LAR: -1,5 Sitagliptina: -0,9 (p <0,001) Pioglitazona: -1,2 (p <0,05) Exenatido LAR: -2,3 Sitagliptina: -0,8 Pioglitazona: +2,8
Exenatido LAR: náuseas (24%), vómitos (11%), diarreia (18%)
Sitagliptina: náuseas (10%), vómitos (2%), diarreia (10%)
Pioglitazona: náuseas (5%), vómitos (3%), diarreia (7%) Nauck et al LEAD-215 Liraglutido 0,6 mg: -0,7 Liraglutido 1,2 mg: -1,0 Liraglutido 1,8 mg: -1,0 Glimepirida: -1,0 (p <0,0001 para todos vs. placebo) Liraglutido 0,6 mg: -1,8 Liraglutido 1,2 mg: -2,6 Liraglutido 1,8 mg: -2,8 Glimepirida: +1,0 (p <0,0001)
Liraglutido: náuseas (35-44%), vómitos (5-7%), diarreia (10-15%)
Glimepirida: náuseas (17%), vómitos (1%), diarreia (4%) Pratley et al16 Liraglutido 1,2 mg: -1,29 Liraglutido 1,8 mg: -1,51 Sitagliptina: -0,88 (p <0,0001) Liraglutido 1,2 mg: -2,78 Liraglutido 1,8 mg: -3,68 Sitagliptina: -1,16 (p <0,0001)
Liraglutido 1,2 mg: náuseas (21.7%), vómitos (8.1%), diarreia (9%)
Liraglutido 1,8 mg: náuseas (27.5%), vómitos (10.6%), diarreia (12.4%)
Sitagliptina: náuseas (5.5%), vómitos (5%), diarreia (6.4%)
Charbonnel
et al17 Liraglutido 1,2 mg: -1,4 Sitagliptina: -1,3 Liraglutido 1,2 mg: -2,8 Sitagliptina: -0,4
Liraglutido 1,2 mg: náuseas (19,4%), vómitos (6,5%), diarreia (10,8%)
Sitagliptina: náuseas (3,1%), vómitos (1,8%), diarreia (2,1%) Nauck et al AWARD-518 Dulaglutido 1,5 mg: -1,10 Dulaglutido 0,75 mg: -0,87 Sitagliptina 100 mg: -0,39 (p <0,001) Dulaglutido 1,5 mg: -3,03 Dulaglutido 0,75 mg: -2,60 Sitagliptina: -1,53 (p <0,001)
Dulaglutido 1,5 mg: náuseas (17%), vómitos (13%), diarreia (15%)
Dulaglutido 0,75 mg: náusea (14%), vómitos (8%), diarreia (10%)
Sitagliptina: náuseas (5%), vómitos (2%), diarreia (3%) Ahrén et al HARMONY-319 Albiglutido: −0,63 Sitagliptina: −0,28 Glimepirida: −0,36 (p <0,0001 para todos vs. placebo) Albiglutido: -1,21 (p <0,0001 vs. glimepirida) Sitagliptina: -0,86 Glimepirida: +1,17
Albiglutido: náuseas (10,3%), vómitos (5,6%), diarreia (12,6%)
Sitagliptina: náuseas (6,6%), vómitos (4,3%), diarreia (8,6%)
Glimepirida: náuseas (6,2%), vómitos (3,6%), diarreia (9,1%)
HbA1c: hemoglobina A1c; GI: gastrointestinais.
No HARMONY-3 verificou-se que a diferença na re-dução dos níveis de glucose em jejum do albiglutido foi estatisticamente superior ao placebo (-27 mg/dL, p <0,0001), sitagliptina (-16 mg/dL, p =0,0002) e glime-pirida (-11 mg/dL, p =0,0133).19
Peso
Nos estudos de Derosa et al houve uma redução signi-ficativa (p <0,01 e p <0,001) do peso que não foi verifi-cada com a glibenclamida e glimepirida. Nos grupos a fazer exenatido, a redução de peso foi de -8 kg e de -5,1 kg no final das 52 semanas dos dois estudos, com-parativamente ao aumento de peso de +4,3 kg verifi-cado no estudo de 2010 no grupo da glibenclamida e à ligeira diminuição (-0,9 kg) observada no estudo de 2011 com a glimepirida.11,12
DeFronzo et al obtiveram uma redução de peso signi-ficativa com o exenatido e um aumento de peso tam-bém ele significativo nos doentes a fazer terapêutica com rosiglitazona (-2,8 kg vs +1,5 kg, p <0,001).10
Ainda em relação ao exena-tido bidiário e com o mes-mo resultado, Gallwitz et al obtiveram uma redução de peso com o exenatido e um aumento de peso com a glimepirida (-3,32 kg vs +1,15 kg) (p <0,001).13 No ensaio DURATION-2, os doentes tratados sema-nalmente com exenatido perderam 2,3 kg, em com-paração com os 0,8 kg de sitagliptina (p =0,0009) e com o aumento de peso ve-rificado com a pioglitazona (+2,8 kg) (p <0,00001).14 No que toca ao liraglutido, no ensaio LEAD-2 a per-da de peso dependeu per-da dose nos grupos de liraglu-tido (-1,8 kg, -2,6 kg e -2,8 kg para as doses de 0,6 mg, 1,2 mg e 1,8 mg de liraglutido) e foi significativamente dife-rente (p <0,0001) do aumento de peso verificado no grupo da glimepirida (+1,0 kg).15 No ensaio de Charbonnel et al, a perda de peso foi sig-nificativamente menor nos doentes tratados com sitagliptina (-0,4 kg) do que com liraglutido 1,2 mg (-2,8 kg).17
Pratley et al também obtiveram o mesmo resultado: a perda de peso foi consideravelmente maior com li-raglutido comparativamente à sitagliptina. No final da semana 52, a redução de peso com o liraglutido 1,2 mg foi de -2,78 kg, -3,68 kg para o liraglutido 1,8 mg e -1,16 kg para a sitagliptina.16
Relativamente ao dulaglutido, o estudo AWARD-5 verificou, no final das 52 semanas de estudo, que a redução de peso foi significativamente superior (p <0,001) para o grupo tratado com dulaglutido 1,5 mg (-3,03 kg) e com dulaglutido 0,75 mg (-2,60 kg), quando comparado com a sitagliptina (-1,53 kg).18 No HARMONY-3, a perda de peso verificou-se nos doentes a fazer albiglutido (-1,21 kg), placebo (-1,0 kg) e sitagliptina (-0,86 kg), enquanto se verifi-cou um aumento de peso nos doentes a fazer glimepiri-da (+1,17 kg) (p <0,0001, em relação ao albiglutido).19
Pressão arterial
Gallwitz et al verificaram que a pressão arterial sistólica diminui nos doentes a fazer exenatido (-1,9 mmHg, p =0,006), mas não nos doentes a fazer tra-tamento com glimepirida (+1,1 mmHg, p =0,096), o que resultou em diferenças significativas entre os dois gru-pos.13
No ensaio DURATION-2, a redução da pressão arterial sistólica e diastólica não foi significativa entre os gru-pos a fazer exenatido LAR e pioglitazona. No entanto, o exenatido LAR 2 mg mostrou uma maior capacidade para causar uma redução significativa da pressão arte-rial sistólica, quando comparado com a sitagliptina (-4 mmHg, p =0,0055). A redução da pressão arterial diastó-lica não foi diferente nos dois grupos.14
Relativamente ao liraglutido, houve uma diferença sig-nificativa a favor das dosagens de 1,2 e 1,8 mg de liraglu-tido quando comparados com a glimepirida, no ensaio LEAD-2. Neste ensaio, a pressão arterial sistólica re-duziu entre 2,3 e 2,8 mmHg nos grupos de liraglutido e aumentou cerca de 0,4 mmHg no grupo da glimepirida (p =0,01). A pressão arterial diastólica não sofreu altera-ções.15
Pratley et al verificaram que a redução da pressão arte-rial sistólica foi de -0,37, -2,55 e -1,03 mmHg para o li-raglutido 1,2 mg, 1,8 mg e sitagliptina, respetivamente, e o efeito na pressão arterial diastólica foi superior com a sitagliptina comparativamente ao liraglutido 1,8 mg (-1,47 vs -0,87 mmHg) e com o liraglutido 1,2 mg (-1,47 vs -0,53 mmHg).16
Ainda no grupo do liraglutido, Charbonnel et al observa-ram que, no grupo da sitagliptina, não houve alterações significativas na pressão arterial sistólica (+0,9 mmHg) e diastólica (+0,8 mmHg). Quanto à terapêutica com li-raglutido, a pressão diastólica também não sofreu gran-des modificações (+0,4 mmHg), mas na sistólica foi ob-servada uma ligeira diminuição (-1,9 mmHg).17
No estudo que comparou o dulaglutido com a sita-gliptina, a pressão arterial sistólica desceu em todos os grupos de tratamento, com as maiores descidas a serem observadas durante os primeiros três a seis me-ses. As reduções da pressão arterial sistólica até às 26 semanas foram significativamente superiores em ambas as doses de dulaglutido (-1,7 e -1,4 mmHg para as doses de 1,5 e 0,75 mg, respetivamente) e sitaglip-tina (-1,9 mmHg), quando comparadas ao placebo (p <0,05). No entanto, às 52 semanas e relativamente à pressão sistólica basal as diferenças já não foram signi-ficativas (-0,8, -0,5 e -0,5 mmHg para o grupo de du-laglutido 1,5 mg 0,75 mg e sitagliptina, respetivamen-te). As alterações na pressão arterial diastólica foram
mínimas e sem expressão clinica significante (0,3, 0,2 e -0,2 para dulaglutido 1,5 mg, 0,75 mg e sitagliptina).18 Quanto às alterações na pressão arterial, no HARMONY-3 estas foram também mínimas e sem significado clinico relevante. As reduções da pres-são arterial diastólica e sistólica foram, respetiva-mente: placebo (2,2 e 0 mmHg), sitagliptina (0,2 e 0,2 mmHg), glimepirida (1,5 e 1,0 mmHg), albiglutido (-1,0 e -0,7 mmHg).19
Perfil lipídico
DeFronzo et al verificaram que o colesterol total au-mentou significativamente no grupo da rosiglitazona (+17,01 mg/dL), relativamente ao grupo do exena-tido (-5,03 mg/dL, p <0,001). O colesterol-HDL não sofreu alterações significativas em ambos os grupos (0,77 e 2,32 mg/dL para o exenatido e rosiglitazo-na, respetivamente). O colesterol-LDL também so-freu alterações com significado clínico comparan-do a rosiglitazona (+12,76 mg/dL) com o exenaticomparan-do (-1,93 mg/dL) (p <0,008). Os triglicéridos também so-freram alterações, ainda que sem significado clínico (-30,12 e +6,2 mmol/L para o exenatido e rosiglitazo-na, respetivamente).10
No ensaio que comparou o exenatido LAR observou--se que apenas a pioglitazona levou a uma significa-tiva redução nos níveis de triglicéridos. O exenatido LAR 2 mg levou à redução do colesterol total e nos níveis de LDL. Pelo contrário, a pioglitazona e a sita-gliptina levaram a um aumento desses níveis. Todas estas alterações não foram significativas. Também se verificou que ambas as terapêuticas levaram a um au-mento dos níveis de HDL.14
Charbonnel et al não observaram alterações significati-vas entre os dois grupos de tratamento, relativamente ao perfil lipídico. No grupo da sitagliptina houve um ligeiro aumento no colesterol total, colesterol-HDL e colesterol-LDL, ao passo que um ligeiro aumento no colesterol-HDL foi observado com o liraglutido. Em ambos os grupos foi observada uma ligeira redução nos triglicéridos.17
No AWARD-5, ao fim de 52 semanas de tratamen-to foi observada uma diferença significativa (p =0,03) relativamente ao colesterol-LDL. No grupo a fazer dulaglutido 1,5 mg foi observada uma redução do colesterol-LDL, enquanto no grupo a fazer sitaglipti-na foi verificado um aumento. Não foram observadas mais diferenças no perfil lipídico.18
No ensaio que comparou o albiglutido com a sitagliptina e com a glimepirida não foram observadas alterações clinica-mente relevantes no perfil lipídico ao longo do estudo.19
Segurança
Efeitos gastrointestinais (GI)
No ensaio de DeFronzo et al, os doentes tratados com exenatido relataram náuseas e vómitos numa frequência muito superior do que os doentes tratados com rosigli-tazona (47% e 22% vs 4% e 0%). Tal facto levou dois do-entes a descontinuarem a terapêutica.10
A descontinuação da terapêutica devido a efeitos GI também se verificou no ensaio feito por Gallwitz et al, no qual 49 doentes a fazer exenatido abandonaram a te-rapêutica, contra 17 doentes que também abandonaram a fazer glimepirida (p <0,001). Esta descontinuação, no entanto, foi apenas significativa nos primeiros seis me-ses do estudo (32 doentes no grupo do exenatido vs seis doentes no grupo da glimepirida; p <0,0005). Neste en-saio, as náuseas, diarreia e vómitos foram muito mais frequentes nos doentes a fazer exenatido (29%, 12% e 9,9%) do que nos doentes a fazer glimepirida (2%, 7% e 2%).13
Derosa et al não incluíram a presença de efeitos adver-sos como outcome nos seus estudos.11,12
No que toca à formulação do exenatido LAR, o estudo DURATION-2 revela uma incidência de náuseas, vó-mitos e diarreia também superior às verificadas com a sitagliptina e pioglitazona (24%, 10% e 5% para as náuseas, 11%, 2% e 3% para os vómitos e 18%, 10% e 7% para a diarreia, respetivamente).14
Os doentes tratados durante 26 semanas com liraglu-tido e metformina experienciaram episódios de náu-seas (35-44%), vómitos (5-7%) e diarreia (10-15%) mais frequentemente do que os doentes tratados com glimepirida ou placebo (17%, 1% e 4%, respetivamen-te para ambos).15
No primeiro estudo de eficácia e segurança comparan-do o liragluticomparan-do com sitagliptina observou-se que 21,7 a 27,5% dos doentes tratados com liraglutido, contra apenas 5,5% dos iDPP-4 tratados, experienciaram náuseas. Vómitos (8,1-10,6%) e diarreia (9-12,4%), no grupo dos doentes a fazer liraglutido, também foram dos efeitos adversos mais observados, quando com-parados com os doentes tratados com sitagliptina (5% e 6,4%, respetivamente).16
Num segundo ensaio, que comparou também o li-raglutido com a sitagliptina, os efeitos adversos GI foram igualmente muito superiores no grupo do lira-glutido relativamente ao grupo da sitagliptina.17 No estudo AWARD-5, a redução na HbA1c foi quase três vezes superior no tratamento com dulaglutido em relação ao tratamento com sitagliptina, apesar dos efeitos GI ocorrerem também numa taxa três ve-zes superior.18
Ao contrário de todos os outros agonistas GLP-1, o al-biglutido parece ser aquele que é melhor tolerado. No HARMONY-3 há uma diferença mínima nos efeitos GI do albiglutido comparado com o placebo.19 Hipoglicemia
No que toca aos ensaios com o exenatido, no ensaio DURATION-2 a incidência de hipoglicemia foi míni-ma (1%) e semelhante à verificada com a sitagliptina (3%) e com a pioglitazona (1%).14
Gallwitz et al, utilizando um modelo binomial nega-tivo e o método dos mínimos quadrados para estimar a taxa média para hipoglicemias de qualquer tipo re-portadas durante o estudo, chegaram aos valores de 1,52 episódios por ano para o grupo do exenatido e 5,32 episódios por ano para a glimepirida.13
Relativamente ao liraglutido, no ensaio LEAD-2 de-monstrou-se que a incidência de hipoglicemias com liraglutido em associação com metformina foi quase seis vezes mais baixa do que a associação metformina com glimepirida (3% vs 17%).15
Os resultados obtidos por Charbonnel et al e por Pratley et al foram diferentes no que toca à incidên-cia de hipoglicemias com liraglutido, em compa-ração com a sitagliptina. No primeiro, a incidência de hipoglicemia no grupo de liraglutido foi de 4%, contra os 12% verificados nos doentes tratados com sitagliptina. Este resultado explica-se na medida em que, nas últimas semanas do estudo, a glimepirida foi adicionada à terapêutica no grupo de doentes a fazer o tratamento com sitagliptina. Até à sua adição, as in-cidências foram semelhantes nos dois grupos. Já no ensaio de Pratley et al, a incidência de hipoglicemia foi muito similar entre os dois grupos: 8,1%, 8,3% e 6,4% para o liraglutido 1,2 mg, 1,8 mg e sitagliptina, respetivamente.16,17
No ensaio HARMONY-3, as taxas de hipoglicemia observadas foram semelhantes nos grupos do albi-glutido, sitagliptina e placebo (3%, 4% e 1,7%, res-petivamente) e mais altas no grupo da glimepirida (17,9%).19
A incidência de episódios de hipoglicemia permaneceu muito baixa também em ambos os grupos de dulagluti-do e de sitagliptina. A taxa média ajustada da ocorrên-cia de um episódio de hipoglicemia por doente por ano foi de 0,4, 0,3, e 0,1, para o grupo de dulaglutido 0,75, dulaglutido 1,5 mg e sitagliptina, respetivamente.18 Reações no local de administração
As reações no local de administração são uma caracte-rística diferenciadora neste tipo de agonistas. Nos es-tudos incluídos, o exenatido LAR e o albiglutido têm
alguma incidência deste tipo de reação (até 5% para o exenatido LAR e 9,6% para o albiglutido), algumas delas, no caso do albiglutido, suficientemente inten-sas para levar à descontinuação da terapêutica.14,19 Nos ensaios do liraglutido, exenatido bidiário e dula-glutido, não foi registado qualquer tipo de reação. Carcinoma da tiroide e pancreatite
Durante os ensaios foram descritos alguns casos de pancreatite e, no ensaio que comparou o albiglutido, foi também registado um doente que desenvolveu car-cinoma folicular da tiroide. O carcar-cinoma da tiroide, segundo os investigadores, não teve qualquer tipo de relação com a administração do albiglutido e o pos-sível efeito de causalidade entre a administração dos agonistas GLP-1 e o desenvolvimento de pancreatite nas terapêuticas incretinicas foi recentemente supri-mido pela norma conjunta da USFDA e da EMA.19,20
Discussão
Na sua generalidade, todos os estudos incluídos nesta revisão revelam o potencial terapêutico destes agonistas, que não se limita apenas ao efeito anti-hiperglicémico, que é tão ou mais eficaz ao obtido em outros antidiabé-ticos orais, mas também inclui efeitos extraglicémicos. Os resultados dos dez ensaios incluídos demonstraram que os análogos dos recetores GLP-1 aqui estudados são tão ou mais eficazes na redução da HbA1c, FPG e PPG que os comparadores ativos. Ademais, os doentes com DMT2, além da hiperglicemia, apresentam, na maior parte das vezes, problemas a nível da obesidade, hiper-tensão e hipercolesterolemia. Estes agonistas demons-traram ter um papel importante em todos estes aspetos. As reduções da pressão arterial, as melhorias no perfil lipídico (diminuição do CT e LDL e aumento do HDL) e, principalmente, a perda de peso são benefícios que devem ser considerados na gestão da terapêutica destes doentes. Esta última propriedade, talvez a que tenha ge-rado maior interesse nesta classe terapêutica, é conse-guida de uma forma dependente da dose, e foi muito evi-dente nestes ensaios. Recentemente, o liraglutido numa dose de 3 mg foi mesmo aprovado para o tratamento da obesidade, mesmo em pessoas que não cursem com diabetes.21
Não há dúvidas de que parte da perda de peso conse-guida com os agonistas GLP-1 resulta dos seus efeitos secundários GI. A sua frequência superior e significa-tiva relasignifica-tivamente às outras classes terapêuticas foi um denominador comum em todos os ensaios inclu-ídos, e são estas queixas o principal obstáculo para uma maior adesão por parte destes agentes
terapêuti-cos. Os efeitos GI mais comuns são náuseas, vómitos e diarreia, que, por si só, não implicam grandes pro-blemas de saúde, apesar de poderem ser incómodos o suficiente para conduzir à descontinuação terapêuti-ca. Estes efeitos típicos de classe são vistos principal-mente nas etapas mais precoces do tratamento, dimi-nuindo progressivamente ao longo do tempo, como foi reportado nos ensaios.
Uma das grandes vantagens desta classe terapêutica, além da redução de peso, é estarem associados a um baixo risco hipoglicémico e, ao mesmo tempo, contro-larem de uma forma eficaz a glicemia. Teoricamente, o mecanismo de ação destes agonistas faz com que o risco associado à ocorrência de episódios de hipogli-cemia seja baixo, e, de facto, nos ensaios clínicos é o que se verifica. Como os efeitos insulinotrópicos são dependentes da glucose, a incidência de hipoglicemia é mínima nesta classe de agentes.
A explicação do potencial terapêutico destes agonis-tas ainda não está completa e mantém-se em constante atualização. O uso dos agonistas dos recetores GLP-1 como tratamento da obesidade é um passo importante. O facto dos agonistas dos recetores GLP-1 serem os úni-cos antidiabétiúni-cos com efeitos benéfiúni-cos nas células-β, incluindo a estimulação da neogénese, a proliferação e o prolongamento da sua sobrevivência, diz muito so-bre o grande potencial destes agentes.22,23 Ainda está para ser provado conclusivamente se o tratamento com estes agonistas consegue contrariar a progressiva disfuncionalidade das células-β, a qual contribui para o agravamento da DMT2 ao longo do tempo.
De modo a desempenharem um papel cada vez mais marcado na gestão dos doentes com DMT2, estes ago-nistas apresentam-se como medicamentos inteligen-tes e cada vez mais individualizados. Devido aos seus efeitos extraglicémicos, temos uma terapêutica muito dirigida e um ajustamento ao individuo, e isso é uma característica da inovação e do potencial terapêutico destes agonistas.
Perspetivas Futuras
Quando os agentes hipoglicemiantes orais não con-seguem atingir uma supressão suficiente da hipergli-cemia, geralmente o próximo passo é a adição de uma insulina de longa duração de ação ao esquema terapêu-tico. Com a chegada dos agonistas GLP-1 de longa du-ração de ação, as injeções diárias de insulina podem ser suplementadas por uma injeção semanal de um destes agonistas. Uma alternativa à administração separada de insulina com estes agentes é misturar os dois numa única seringa. Provou-se que isto era possível com o
liraglutido e com a degludec, uma insulina de longa duração de ação, em que se demonstrou que os bene-fícios individuais de cada uma das classes terapêuticas podem ser atingidos com doses mais reduzidas de cada um. Consequentemente, os efeitos adversos da insu-lina (hipoglicemia e o aumento de peso) e os efeitos adversos do liraglutido são ambos reduzidos. Assim, é muito mais razoável usar as duas para obter benefícios combinados das duas modalidades terapêuticas, ao in-vés de olhar para elas como alternativas.24,25
Conclusão
O objetivo da maioria dos clínicos que gerem a diabe-tes é atingir um controlo glicémico ótimo, juntamente com perda de peso e com um número mínimo de epi-sódios de hipoglicemia. A associação destes agonistas com a metformina alcança este objetivo confirmando estes agonistas como opções terapêuticas eficazes em segunda linha, sobretudo em subpopulações com de-terminadas especificidades clínicas.
Limitações
Sendo talvez a diabetes a grande epidemia do século XXI, a que nos fará perder mais anos de vida com qua-lidade, falta perceber realmente até que ponto estes medicamentos têm impacto a nível de outcomes finais cardiovasculares. Até que ponto estes agonistas con-seguem atrasar, ou até mesmo evitar, a progressão das complicações micro e macrovasculares que levam ao aumento da morbilidade nestes doentes. Seria também interessante clarificar, com o uso destes agonistas, quanto tempo decorre até à utilização de insulina, vis-to ser um marcador importante, uma vez que estes do-entes acabam sempre por recorrer à insulinoterapia.
Conflitos de Interesse
Os autores declaram não ter quaisquer conflitos de interesse.
Suporte Financeiro
O presente trabalho não foi suportado por nenhum subsídio ou bolsa.
Referências
1. Alberti K, Aschner P, Assal J-P, Bennett PP, Groop L, Jervell J, et al. Definição, Diagnóstico e Classificação da Diabetes Mellitus [Internet]. Sociedade Portuguesa de Diabetologia. 2013. [Ace-dido em 10/4/2015]. Disponível em http://www.spd.pt/index. php?option=com_content&task=view&id=58&Itemid=175. 2. Turner LW, Nartey D, Stafford RS, Singh S, Alexander GC.
Ambulatory treatment of type 2 diabetes in the U.S., 1997-2012. Diabetes Care. 2014;37:985-92.
3. Duarte R, Nunes JS, Dores J, Medina JL. Recomendações Na-cionais da SPD para o tratamento da hiperglicemia na diabetes tipo 2 (com base na posição conjunta ADA/EASD). Rev Port Dia-betes. 2013;8:4-29 .
4. Duarte R, Melo M, Nunes JS. Recomendações Nacionais da SPD para o tratamento da hiperglicemia na diabetes tipo 2 – pro-posta de actualização (adaptação do recente “Update” 2015 da Declaração de Posição Conjunta ADA/EASD). Rev Port Diabetes. 2015;10:64.
5. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2012;35:1364-79. 6. Silva JA, Vilão S, Silva BA, Figueiredo C, Gonçalves E, Charrua F, et al. A Diabetes em síntese: contributo para um melhor conhe-cimento e gestão da doença. 2nd ed. Estoril: Rev Port Farmacoter; 2015.
7. De León DD, Crutchlow MF, Ham J-YN, Stoffers DA. Role of glucagon-like peptide-1 in the pathogenesis and treatment of dia-betes mellitus. Int J Biochem Cell Biol. 2006;38:845-59.
8. Garber AJ, Abrahamson MJ, Barzilay JI, Blonde L, Bloomgar-den ZT, Bush MA, et al. American Association of Clinical Endo-crinologists’ Comprehensive Diabetes Management Algorithm 2013 Consensus Statement. Endocr Pract. 2013;19:1-48.
9. Moher D, Liberati A, Tetzlaff J, Altman DG. Reprint – prefer-red reporting items for systematic reviews and meta-analyses: the PRISMA statement. Phys Ther. 2009;89:873-80.
10. DeFronzo RA, Triplitt C, Qu Y, Lewis MS, Maggs D, Glass LC. Effects of exenatide plus rosiglitazone on beta-cell function and insulin sensitivity in subjects with type 2 diabetes on me-tformin. Diabetes Care. 2010;33:951-7.
11. Derosa G, Maffioli P, Salvadeo SA., Ferrari I, Ragonesi PD, Querci F, et al. Exenatide versus glibenclamide in patients with diabetes. Diabetes Technol Ther. 2010;12:233-40.
12. Derosa G, Putignano P, Bossi AC, Bonaventura A, Querci F, Franzetti IG, et al. Exenatide or glimepiride added to metformin on metabolic control and on insulin resistance in type 2 diabetic patients. Eur J Pharmacol. 2011;666:251-6.
13. Gallwitz B, Guzman J, Dotta F, Guerci B, Simó R, Basson BR, et al. Exenatide twice daily versus glimepiride for prevention of glycaemic deterioration in patients with type 2 diabetes with metformin failure (EUREXA): An open-label, randomised con-trolled trial. Lancet. 2012;379:2270-8.
14. Bergenstal RM, Wysham C, MacConell L, Malloy J, Walsh B, Yan P, et al. Efficacy and safety of exenatide once weekly versus sitagliptin or pioglitazone as an adjunct to metformin for tre-atment of type 2 diabetes (DURATION-2): A randomised trial. Lancet. 2010;376:431-9.
15. Nauck M, Frid A, Hermansen K, Shah NS, Tankova T, Mitha
IH, et al. Efficacy and safety comparison of liraglutide, glimepi-ride, and placebo, all in combination with metformin, in type 2 diabetes: the LEAD ( liraglutide effect and action in diabetes)-2 study. Diabetes Care. 2009;32:84-90.
16. Pratley R, Nauck M, Bailey T, Montanya E, Cuddihy R, Filet-ti S, et al. One year of liragluFilet-tide treatment offers sustained and more effective glycaemic control and weight reduction compared with sitagliptin, both in combination with metformin, in pa-tients with type 2 diabetes: A randomised, parallel-group, open-label trial. Int J Clin Pract. 2011;65:397-407.
17. Charbonnel B, Steinberg H, Eymard E, Xu L, Thakkar P, Pra-bhu V, et al. Efficacy and safety over 26 weeks of an oral treat-ment strategy including sitagliptin compared with an injectable treatment strategy with liraglutide in patients with type 2 diabe-tes mellitus inadequately controlled on metformin: A randomi-sed clinical tri. Diabetologia. 2013;56:1503-11.
18. Nauck M, Weinstock RS, Umpierrez GE, Guerci B, Skrivanek Z, Milicevic Z. Efficacy and safety of dulaglutide versus sitaglip-tin after 52 weeks in type 2 diabetes in a randomized controlled trial (AWARD-5). Diabetes Care. 2014;37:2149-58.
19. Ahrén B, Johnson SL, Stewart M, Cirkel DT, Yang F, Perry C, et al. HARMONY 3: 104-week randomized, double-blind, place-bo- and active-controlled trial assessing the efficacy and safety of albiglutide compared with placebo, sitagliptin, and glimepi-ride in patients with type 2 diabetes taking metformin. Diabetes Care. 2014;37:2141-8.
20. Egan AG, Blind E, Dunder K, de Graeff PA, Hummer BT, Bour-cier T, et al. Pancreatic Safety of Incretin-Based Drugs – FDA and EMA Assessment. N Engl J Med. 2014;370:792-4.
21. European Medicines Agency. News and Events: Saxen-da recommended for approval in weight management in adults [Internet]. 2015. [Acedido em 29/6/2015]. Disponí-vel em http://www.ema.europa.eu/ema/index.jsp?curl=pages/ news_and_events/news/2015/01/news_detail_002255. jsp&mid=WC0b01ac058004d5c1.
22. Brubaker PL, Drucker DJ. Minireview: Glucagon-like pepti-des regulate cell proliferation and apoptosis in the pancreas, gut, and central nervous system. Endocrinology. 2004;145:2653-9. 23. Buteau J. GLP-1 receptor signaling: effects on pancreatic be-ta-cell proliferation and survival. Diabetes Metab. 2008;34 Suppl 2:S73-7.
24. Gough SCL, Bode BW, Woo VC, Rodbard HW, Linjawi S, Zacho M, et al. One-year efficacy and safety of a fixed combina-tion of insulin degludec and liraglutide in patients with type 2 diabetes: results of a 26-week extension to a 26-week main trial. Diabetes Obes Metab 2015. 2015;38:740-7.
25. Gough SC, Bode B, Woo V, Rodbard HW, Linjawi S, Poulsen P, et al. Efficacy and safety of a fixed-ratio combination of insulin degludec and liraglutide (IDegLira) compared with its compo-nents given alone: results of a phase 3, open-label, randomised, 26-week, treat-to-target trial in insulin-naive patients with type 2 diabetes. Lancet Diabetes Endocrinol. 2014;2:885-93.