EXPERIMENTO 3
USO DO BICO DE BUNSEN E CENTRÍFUGA
1. INTRODUÇÃO
1.1. BICO DE BUNSEN
O bico de Bunsen foi inventado por Robert Wilhelm Bunsen em 1965. É utilizado em
laboratório com a finalidade de produzir calor através da combustão. Para que ocorra a
combustão é necessária a reação entre o combustível e o comburente.
O combustível usado no laboratório é o gás comum de rua ou G.L.P (propano, C3H8 e
butano, C4H10) e o comburente o oxigênio do ar atmosférico. Desta reação temos como
produtos o gás carbônico (CO2), o monóxido de carbono (CO), vapor d’água e calor.
Quando as quantidades dos componentes da combustão
são estequiométricas, isto é, não existe excesso de nenhum
deles, obtém-se a maior quantidade de calor da reação.
Qualquer componente da reação sem reagir, rouba o calor da
reação, abaixando o poder calorífico da chama.
O bico de bunsen é constituído de: base (local por onde
entra o combustível); anel (controla a entrada de ar –
comburente) e corpo (onde ocorre a mistura dos
componentes da combustão).
Como vemos na figura acima, com o anel de ar primário parcialmente fechado,
distinguimos três zonas da chama:
a) Zona Externa: Violeta pálida, quase invisível, onde os gases expostos ao ar sofrem
combustão completa, resultando CO2 e H2O. Esta zona é chamada de zona oxidante.
b) Zona Intermediária: Luminosa, caracterizada por combustão incompleta, por
deficiência do suprimento de O2.
O carbono forma CO (monóxido de carbono) o qual se decompõe pelo calor, resultando
em diminutas partículas de C que, incandescentes dão luminosidade à chama. Esta zona é
chamada de zona redutora.
c) Zona Interna: Limitada por uma “casca” azulada, contendo os gases que ainda não
Dependendo do ponto da chama a temperatura varia, podendo atingir 1560 ºC.
Abrindo-se o registro de ar, dá-se entrada de suficiente quantidade de O2 (do ar), dando-se
na região intermediária combustão mais acentuada dos gases, formando, além do CO, uma
maior quantidade de CO2 (dióxido de carbono) e H2O, tornando assim a chama quase
invisível.
Os procedimentos básicos, na operação correta do bico de Bunsen são:
1. Fechar o anel de entrada do ar primário (combustão incompleta).
2. Abrir moderadamente a válvula do gás.
3. Acender a chama.
4. Abrir o anel de ar primário e ajuste a cor da chama regulando a entrada de ar (uma chama
azul tendo um cone interno é a mais adequada).
5. Fechar a entrada de ar primário.
6. Fechar a válvula do gás.
1.2. TESTE DE CHAMA
Sólidos inorgânicos típicos são composto iônicos, o que faz com que, em solução,
existam dois tipos de íons provenientes da dissociação do composto: um cátion e um ânion.
A Química Analítica Qualitativa é a área da Química que cria, desenvolve, estuda e
aplica métodos para a determinação da natureza de uma substância ou dos seus
constituintes.
A identificação de cátions e ânions através da análise qualitativa envolve,
geralmente, uma reação com formação de um produto facilmente perceptível aos nossos
sentidos (formação de precipitado, liberação de gases, etc.). Entretanto, alguns cátions,
entre eles os cátions dos metais alcalinos, sódio e potássio, formam compostos
normalmente muito solúveis, o que dificulta a detecção desses íons em solução por meio de
reações de precipitação. Este problema é contornado através dos testes de chama. Nestes
testes, a amostra é levada à chama de um bico de Bunsen. Inicialmente, há evaporação do
solvente, deixando um resíduo sólido. Em seguida, há vaporização do sólido, com
dissociação em seus átomos componentes que, inicialmente, estarão no estado
fundamental. Alguns átomos podem ser excitados a níveis de energia mais elevados, isto é,
para níveis de menor energia, é acompanhada da emissão de radiação característica de
cada íon. Se o comprimento de onda da radiação estiver na faixa de 400 a 760 nm,
observaremos a emissão de luz visível.
Tabela I: Comprimentos de onda aproximados das cores
Violeta 400-450 nm Amarelo 570-590 nm
Azul 450-500 nm Alaranjado 590-620 nm
Verde 500-570 nm Vermelho 620-760 nm
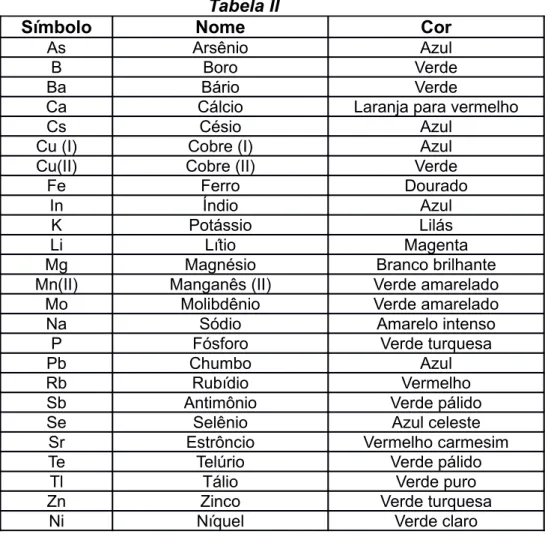
A Tabela II indica as cores que alguns elementos químicos geram quando seus
átomos são excitados.
Tabela II
Símbolo
Nome
Cor
As Arsênio Azul
B Boro Verde
Ba Bário Verde
Ca Cálcio Laranja para vermelho
Cs Césio Azul
Cu (I) Cobre (I) Azul
Cu(II) Cobre (II) Verde
Fe Ferro Dourado
In Índio Azul
K Potássio Lilás
Li Lítio Magenta
Mg Magnésio Branco brilhante
Mn(II) Manganês (II) Verde amarelado
Mo Molibdênio Verde amarelado
Na Sódio Amarelo intenso
P Fósforo Verde turquesa
Pb Chumbo Azul
Rb Rubídio Vermelho
Sb Antimônio Verde pálido
Se Selênio Azul celeste
Sr Estrôncio Vermelho carmesim
Te Telúrio Verde pálido
Tl Tálio Verde puro
Zn Zinco Verde turquesa
1.3. CENTRIFUGAÇÃO
Na natureza, raramente encontramos substâncias puras. Em função disso, é
necessário utilizarmos métodos de separação se quisermos obter uma determinada
substância. Para a separação dos componentes de uma mistura, ou seja, para a obtenção
separada de cada uma das suas substâncias puras que deram origem à mistura, utilizamos
um conjunto de processos físicos denominados análise imediata. Esses processos não
alteram a composição das substâncias que formam uma dada mistura. A escolha dos
melhores métodos para a separação de misturas exige um conhecimento anterior de
algumas das propriedades das substâncias presentes. Assim, se tivermos uma mistura de
açúcar e areia, devemos saber que o açúcar se dissolve na água, enquanto a areia não se
dissolve. Muitas vezes, dependendo da complexidade da mistura, é necessário usar vários
processos diferentes, numa seqüência que se baseia nas propriedades das substâncias
presentes na mistura. Alguns dos métodos de separação são tão comuns que nem
pensamos neles como processos de separação, por exemplo, a "escolha" dos grãos de
feijão (catação) e a separação de amendoim torrado das suas cascas (ventilação), ou ainda
as máquinas existentes em bancos, as quais separam as moedas em função de seus
tamanhos (tamisação). Esse processo é também usado para separar laranjas em diferentes
tamanhos ou quando usamos uma peneira. Dentre os métodos físicos de separação, temos
a centrifugação.
A centrifugação é uma maneira de acelerar o processo de decantação, utilizando um
aparelho denominado centrifuga. Na centrífuga, devido ao movimento de rotação, as
partículas de maior densidade, por inércia, são arremessadas para o fundo do tubo.
2. OBJETIVOS
•
Aprender a utilizar o bico de Bunsen•
Aprender técnicas deaquecimento em laboratório.
•
Aprender a utilizar centrífuga.2.1. MATERIAIS E REAGENTES NECESSÁRIOS
•
bico de Bunsen•
Fósforos•
garras•
pérolas de vidro ou cerâmica•
béquer•
termômetro (0 a 100°C)•
água destilada•
tela de amianto•
tripé ou suporte de ferro•
Solução de CuSO4•
Solução de NaOH 30%•
Soluções de: Ba(NO3)2, K2SO4, Na2SO4, KCl, NaCl, CaCl2, BaCl2, NiCl2, NiSO4, CuSO4 e Li2CO33.
PROCEDIMENTO EXPERIMENTALPARTE A
3.1.
Uso do bico de Bunsena.
Acenda o bico de gás, seguindo as instruções apresentadas anteriormente.b.
Regule os controles do bico de gás no sentido de obter a chama mais quente.c.
Na sequência para ajustar o bico, primeiro ajuste a altura da chama abrindo oufechando a válvula de controle de gás. A chama apropriada será a menor chama
necessária para executar a tarefa. Uma chama que tem em torno de 5 a 8 cm de
altura é suficiente para a maioria das tarefas no laboratório.
d.
Ajuste o controle de ar até que a chama do bico esteja azul e contenha dois ou maiscones distintos. Chamas amarelas são resultados de pouco oxigênio na mistura
gasosa. Fluxo de oxigênio pode ser reduzido na mistura do gás ajustando o
controlador da entrada de ar.
a.
Em um tubo de ensaio, adicione 3 mL de solução de CuSO4. Em seguida,adicione 3 gotas de solução de NaOH 30%.
b.
Observe o que ocorreu.c.
Utilize a centrífuga para realizar a separação entre sólido e líquido da mistura.3.3.
Aquecimentos de líquidos no béquera.
Coloque cerca de 20 mL de água destilada em um béquer de 50 mL;b.
Coloque algumas pérolas de vidro ou de cerâmica e em seguida coloque o béquersobre uma tela de amianto, suportada pelo tripé (este procedimento evita que
líquidos entrem em ebulição de forma violenta);
c.
Adicione o precipitado obtido no procedimento;d.
Aqueça o béquer com a chama forte do bico de gás;e.
Anote a temperatura a cada 1 minuto;f.
Observe o que ocorre com a mistura;g.
Após 8 minutos, finalize o processo de aquecimento.PARTE B
3.4.
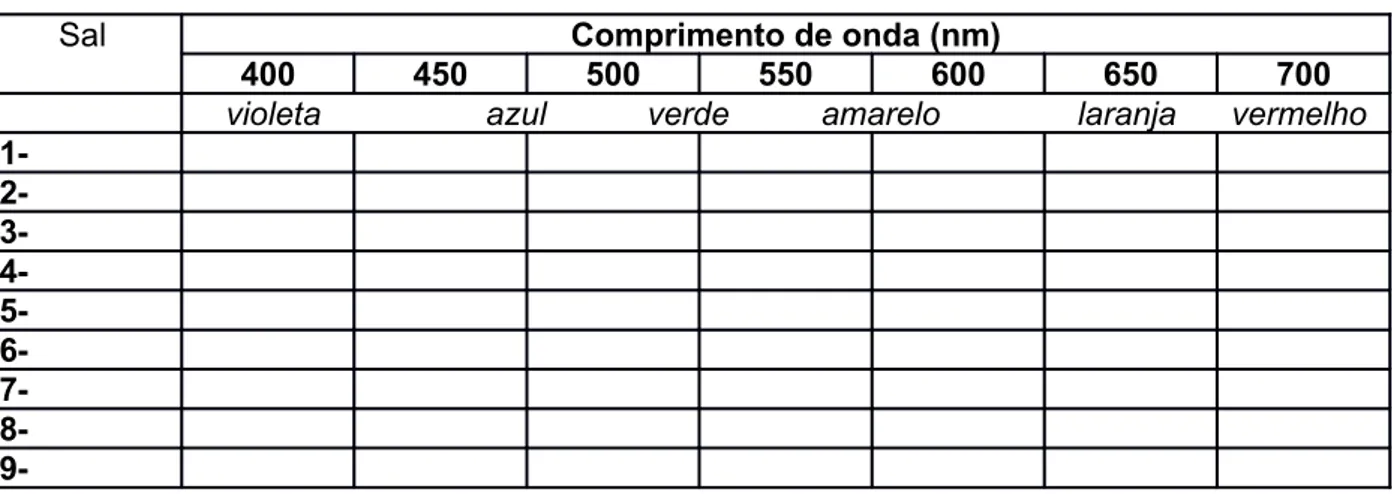
Testes de chamas4.
Vaporizar uma pequena quantidade de cada solução aquosa a disposição na chama dobico de Bunsen e anotar a cor observada. Correlacionar a cor da chama com seu
comprimento de onda dominante, usando a Tabela III.
5.
Descubra quais são as soluções numeradas de 1 a 11.Tabela III – Teste da chama
Sal Comprimento de onda (nm)
400 450 500 550 600 650 700
violeta azul verde amarelo laranja vermelho
8- 10-
11-4. Questões
1)
Discutir as diferenças entre os tipos possíveis de chama produzidas num bico de gásconsiderando as proporções relativas dos gases.
2)
Associar a cada parte da chama não-luminosa a composição, ou seja, a mistura dosgases. Quais são as regiões fria e quente, redutora e oxidante? Justifique.
3)
Na parte A do experimento, o que ocorreu após a mistura das soluções de CuSO4 eNaOH? Escreva a equação química.
4)
O que ocorreu durante o aquecimento desta mistura?1)
Na parte B da prática, observe os resultados obtidos e responda: Para um mesmo cátione diferente ânion, a coloração da chama mudou ou se manteve a mesma? Portanto, o
responsável pela coloração da chama é o ânion (não metal) ou o cátion (metal)?
6. REFERÊNCIAS
1.
GIESBRECHT, E.; "Experiências de Química, Técnicas e Conceitos Básicos - PEQ -Projetos de Ensino de Química"; Ed. Moderna - Universidade de São Paulo, SP (1979).
2.
RUSSELL, J.B.; "Química Geral", 2a Edição, Makron Books Editora Ltda., São Paulo(1994).
3.
TRINDADE, D.F., OLIVEIRA, F.P., BANUTH, G.S. & BISPO,J.G.; "Química BásicaExperimental"; Ícone editora, São Paulo (1998).