DEPARTAMENTO DE ENGENHARIA DE PESCA
ACOMPANHAMENTO DO PROCESSO DE REVERSÃO SEXUAL DA TILÁPIA DO NILO Oreochromis Mloticus, NO CENTRO DE PESQUISAS EM
AQÜICULTURA RODOLPHO VON IHERING, PENTECOSTE, CEARÁ
ALEX MILLER CYSNE DIOGO
Relatório de Estágio Supervisionado apresentado ao Departamento de Engenharia de Pesca do Centro de Ciências Agrárias da Universidade Federal do Ceará, como parte das exigências para a obtenção do título de Engenheiro de Pesca.
FORTALEZA - CEARÁ - BRASIL DEZEMBRO/2008"
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
D622a Diogo, Alex Miller Cysne.
Acompanhamento do processo de reversão sexual da Tilápia do Nilo Oreochromis niloticus, no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará / Alex Miller Cysne Diogo. – 2008.
36 f. : il. color.
Trabalho de Conclusão de Curso (graduação) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Curso de Engenharia de Pesca, Fortaleza, 2008.
Orientação: Prof. Me. Silvana Saker Sampaio.
5-- p
Prof2 Silvana Saker Sampaio, Ph.D.Orientadora
Prof. Celso Shiniti Nagano, D.Sc. Membro
Prof. José Wilson Calíope de Freitas, D.Sc. Membro
ORIENTADOR TÉCNICO
Engenheira de Pesca Josenilde Castro Henrique Centro de Pesquisas em Aqüicultura - DNOCS
VISTO
Prof. Moisés Almeida de Oliveira, D.Sc. Chefe do Departamento de Engenharia de Pesca
iii
AGRADECIMENTOS
Primeiramente a Deus, por ter me dado a vida, por sempre estar comigo, acompanhando meus passos, me guiando no caminho da verdade, levando-me em seus braços nos momentos em que não suportei a dor.
Ao meu pai, pelo tempo que passou comigo, que apesar de ter sido pouco, me ensinou tudo o que sei a respeito de princípios e valores morais que fazem de mim o que sou hoje, e apesar de não está mais entre nós, está e sempre estará vivo em minha memória. Uma saudade eterna.
A minha mãe, por dedicar a mim um amor incondicional, companheira de todas as horas, a pessoa que mais amo em minha vida.
As minhas irmãs Milena e Maynna, pela presença, amor e carinho.
Ao meu tio Gonçalo, uma pessoa que amo como um pai, a quem tenho um respeito muito grande e uma gratidão eterna, por sempre me estender a mão em todos os momentos, se fazendo presente em minha vida.
A minha namorada Cleuma, que amo muito, por sempre estar ao meu lado dividindo as tristezas e multiplicando as alegrias não me deixando abater nos momentos de dificuldade, fazendo-me pensar no futuro.
Aos meus amigos, por serem verdadeiros amigos.
A minha orientadora Silvana Saker Sampaio, pela orientação, carinho e por ser uma educadora de verdade, a quem tenho muito respeito e admiração.
SUMÁRIO
Página
AGRADECIMENTOS iii
SUMÁRIO iv
LISTA DE FIGURAS
LISTA DE TABELAS vii
RESUMO viii
1 INTRODUÇÃO 1
1.1 Produção da aqüicultura no mundo 1
1.2 Produção da aqüicultura no Brasil 2 1.3 Tilápia do Nilo Oreochromis niloticus 3 1.4 Produção de tilápia do Nilo Oreochromis niloticus 5 1.5 Métodos para obtenção de populações monosexo de tilápias 5
1.5.1 Sexagem manual 6
1.5.2 Hibridação 6
1.5.3 Produção de super macho 7
1.5.4 Reversão sexual através de hormônio masculinizante 10
2 REVERSÃO SEXUAL DE TILÁPIAS NO CENTRO DE PESQUISAS EM AQÜICULTURA RODOLPHO VON IHERING — DNOCS 11
2.1 Seleção e Manutenção de reprodutores e reprodutrizes 11 2.2 Estocagem de reprodutores nos hapas e Reprodução 13 2.3 Recepção, Limpeza e Profilaxia de ovos, larvas e pós-larvas 17 2.4 Estocagem de pós-larvas em calhas e hapas de reversão
sexual 20
2.5 Preparação da ração contendo hormônio masculinizante 23
3 CONSIDERAÇÕES FINAIS 26
LISTA DE FIGURAS
Página Figura 1. Tilápia do Nilo (Oreochromis niloticus). 4
Figura 2. Esquema de produção de híbridos inter-específicos
100% masculinos. 7
Figura 3. Esquema de produção de super-macho (YY). 9
Figura 4. Papila urogenital do macho de tilápia do Nilo
(Oreochromis niloticus). 11
Figura 5. Papila urogenital da fêmea de tilápia do Nilo
(Oreochromis niloticus). 11
Figura 6. Vista dos tanques utilizados para o repouso de reprodutores no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará. 13
Figura 7.
Figura 8.
Recipientes utilizados no transporte de reprodutores no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
Vista dos hapas utilizados na reprodução no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
14
15
Figura 9. Despesca dos hapas de reprodução no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering,
Pentecoste, Ceará. 16
Figura 10. Coleta de ovos e larvas da boca das fêmeas no Centro de Pesquisas em Aqüicultura Rodolpho von lhering,
Pentecoste, Ceará. 17
Figura 11. Selecionador utilizado na classificação de pós-larvas no Centro de Pesquisas em Aqüicultura Rodolpho von
Ihering, Pentecoste, Ceará. 18
Figura 12. Peneira utilizada para retirada de sujidades que ficam agregadas aos ovos no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará. 19
Figura 13. Sistema de incubadora de ovos utilizada no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering,
Pentecoste, Ceará. 20
Figura 14. Calhas utilizadas na reversão sexual no Centro de Pesquisas em Aqüicultura Rodolpho von lhering,
Pentecoste, Ceará. 21
Figura 15. Hapas utilizados na reversão sexual no Centro de Pesquisas em Aqüicultura Rodolpho von lhering,
Pentecoste, Ceará. 22
Figura 16. Tanques de alvenaria utilizados na estocagem dos alevinos revertidos no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará. 23
Figura 17.
Figura 18.
Incorporação do hormônio na ração de reversão sexual no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
Secagem da ração contendo o hormônio masculinizante no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
24
LISTA DE TABELAS
Página Tabela 1. Produção mundial da aqüicultura (FAO, 2007). 2
Tabela 2. Produção da aqüicultura brasileira em 2006 (IBAMA,
2008). 3
RESUMO
ACOMPANHAMENTO DO PROCESSO DE REVERSÃO SEXUAL DA TILÁPIA DO NILO Oreochromis niloticus, NO CENTRO DE PESQUISAS EM
AQÜICULTURA RODOLPHO VON IHERING, PENTECOSTE, CEARÁ
ALEX MILLER CYSNE DIOGO
1 INTRODUÇÃO
1.1 Produção da aqüicultura no mundo
A contribuição da aqüicultura para o abastecimento mundial de peixes, crustáceos, moluscos e outros animais aquáticos continua a aumentar, já que ela passou de 3,9% do total da produção em 1970 para 27,1% em 2000 e para 32,4 % em 2004. Esse crescimento é mais rápido do que o atingido em qualquer outra área de produção de alimentos de origem animal. Mundialmente, a taxa média de crescimento da aqüicultura foi 8,8% por ano desde 1970, enquanto no mesmo período, a produção oriunda das capturas da pesca cresceu a uma taxa de apenas 1,2% e os sistemas de produção de carne em fazendas terrestres, 2,8%. O aumento da produção da aqüicultura tem sido muito mais elevado do que o crescimento da população, e a sua oferta média anual per capita aumentou de 0,7 kg em 1970 para 7,1 kg em 2004, representando um aumento médio anual de 7,1% (FAO, 2007).
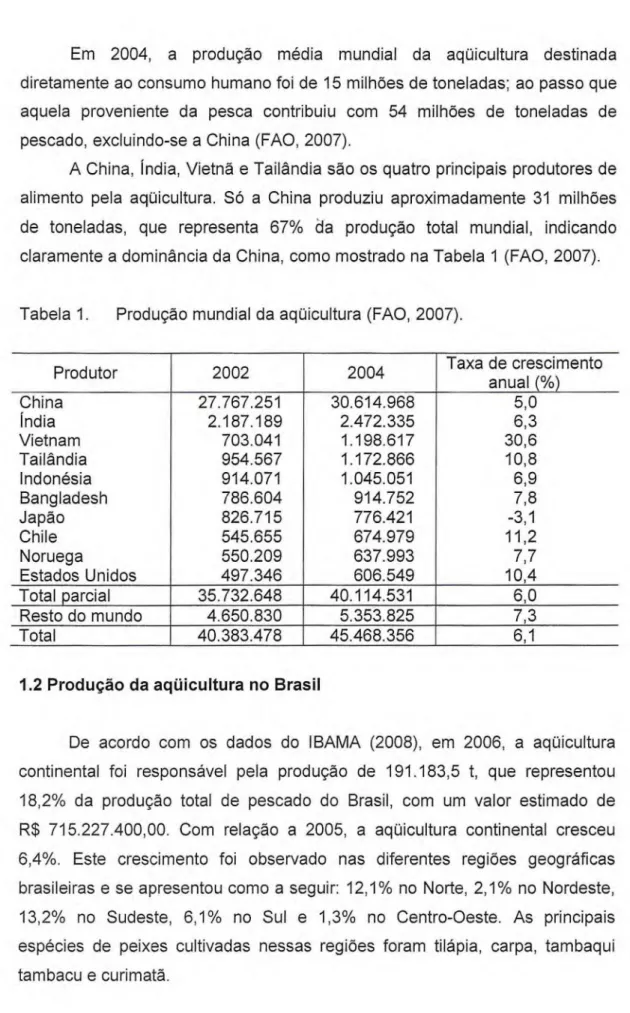
Em 2004, a produção média mundial da aqüicultura destinada diretamente ao consumo humano foi de 15 milhões de toneladas; ao passo que aquela proveniente da pesca contribuiu com 54 milhões de toneladas de pescado, excluindo-se a China (FAO, 2007).
A China, Índia, Vietnã e Tailândia são os quatro principais produtores de alimento pela aqüicultura. Só a China produziu aproximadamente 31 milhões de toneladas, que representa 67% da produção total mundial, indicando claramente a dominância da China, como mostrado na Tabela 1 (FAO, 2007).
Tabela 1. Produção mundial da aqüicultura (FAO, 2007).
Produtor 2002 2004 Taxa de crescimento anual (%)
China 27.767.251 30.614.968 5,0
Índia 2.187.189 2.472.335 6,3
Vietnam 703.041 1.198.617 30,6
Tailândia 954.567 1.172.866 10,8
Indonésia 914.071 1.045.051 6,9
Bangladesh 786.604 914.752 7,8
Japão 826.715 776.421 -3,1
Chile 545.655 674.979 11,2
Noruega 550.209 637.993 7,7
Estados Unidos 497.346 606.549 10,4 Total parcial 35.732.648 40.114.531 6,0 Resto do mundo 4.650.830 5.353.825 7,3
Total 40.383.478 45.468.356 6,1
1.2 Produção da aqüicultura no Brasil
3
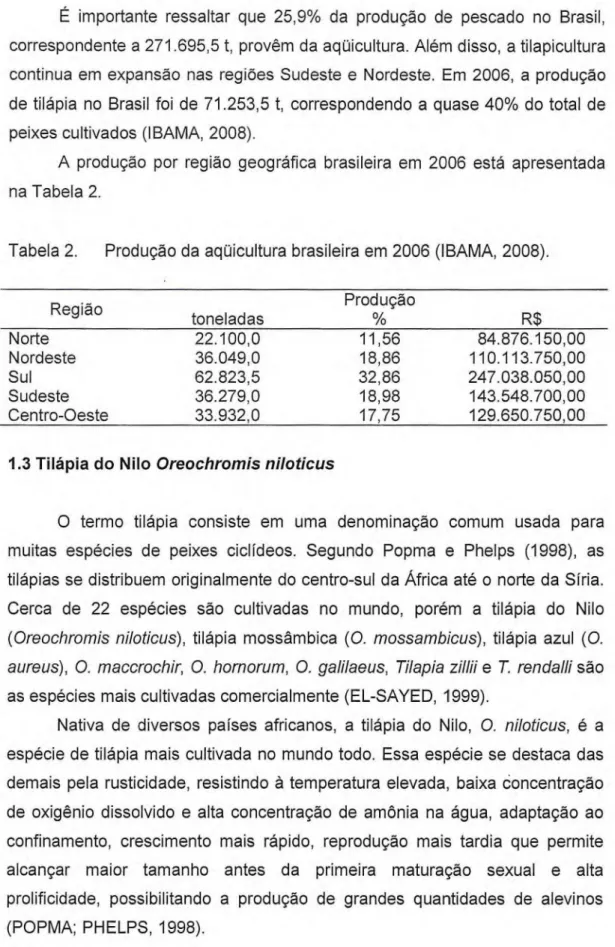
É importante ressaltar que 25,9% da produção de pescado no Brasil, correspondente a 271.695,5 t, provêm da aqüicultura. Além disso, a tilapicultura continua em expansão nas regiões Sudeste e Nordeste. Em 2006, a produção de tilápia no Brasil foi de 71.253,5 t, correspondendo a quase 40% do total de peixes cultivados (IBAMA, 2008).
A produção por região geográfica brasileira em 2006 está apresentada na Tabela 2.
Tabela 2. Produção da aqüicultura brasileira em 2006 (IBAMA, 2008).
Região toneladas Produção R$
Norte 22.100,0 11,56 84.876.150,00
Nordeste 36.049,0 18,86 110.113.750,00
Sul 62.823,5 32,86 247.038.050,00
Sudeste 36.279,0 18,98 143.548.700,00
Centro-Oeste 33.932,0 17,75 129.650.750,00
1.3 Tilápia do Nilo Oreochromis nilotícus
O termo tilápia consiste em uma denominação comum usada para muitas espécies de peixes ciclídeos. Segundo Popma e Phelps (1998), as tilápias se distribuem originalmente do centro-sul da África até o norte da Síria. Cerca de 22 espécies são cultivadas no mundo, porém a tilápia do Nilo
(Oreochromis niloticus), tilápia mossâmbica (O. mossambicus), tilápia azul (O.
aureus), O. maccrochir, O. hornorum, O. galilaeus, Tilapia zillii e T. rendalli são as espécies mais cultivadas comercialmente (EL-SAYED, 1999).
A tilápia do Nilo possui hábito alimentar onívoro e aceita rações com grande facilidade, desde o período de pós-larva até a fase de terminação. Além disso, parece ter grande capacidade filtradora, alimentando-se de organismos planctônicos. Assim, quando cultivada em viveiros de águas verdes, ela geralmente supera em crescimento e conversão alimentar, as demais espécies de tilápias (HAYASHI, 1995; KUBITZA, 2000).
A tilápia do Nilo, proveniente da Costa do Marfim no Oeste africano, foi introduzida no Nordeste brasileiro em 1971 e, então, distribuída pelo País. Atualmente, a tilápia do Nilo (Figura 1) e algumas tilápias vermelhas híbridas são as espécies mais cultivadas no Brasil, desde a bacia do rio Amazonas até o Rio Grande de Sul. O interesse pelo cultivo dessa espécie no sul e sudoeste do Brasil cresceu rapidamente nos últimos oito anos. Esse crescimento tem sido atribuído à introdução da tecnologia da reversão sexual e à pesca esportiva, representada pelos empreendimentos conhecidos como pesque-pague. A tilápia é cultivada em diversos sistemas desde a cultura semi-intensiva em tanques que recebem dejetos animais, como em cultivo intensivos em "raceways" e tanques-rede (LOVSHIN; CYRINO, 1998).
5
1.4 Produção de tilápia do Nilo Oreochromis niloticus
A tilápia do Nilo apresenta desova parcelada e baixa fecundidade, que é
compensada pelas desovas assincrônicas, assim como pela alta taxa de sobrevivência da prole (PHELPS; POPMA, 2000). A sobrevivência elevada está
relacionada a características específicas, como a incubação de ovos e/ou
larvas na boca, o tamanho das larvas ao nascer e o cuidado parental
(TURNER; ROBINSON, 2000).
Além dessas características reprodutivas, as tilápias apresentam ainda
maturação gonadal precoce, que pode acarretar problemas em condições de
cultivo, como desvio da energia destinada ao crescimento para a reprodução,
superpopulação e queda da qualidade de água (STICKNEY, 2000).
O maior desafio no cultivo dessa espécie consiste no controle
reprodutivo, pois a maturação precoce e a reprodução descontrolada levam ao superpovoamento dos tanques, implicando em competição por espaço e
alimento, resultando em baixo crescimento e heterogeneidade no tamanho,
dificultando uma criação mais racional e produtiva (WOHLFARTH; HULATA,
1981; MACINTOSH et al., 1985).
Assim, na tentativa de minimizar os problemas relacionados à
precocidade reprodutiva e à elevada prolificidade das tilápias em condição de
cultivo, muitos pesquisadores têm estudado técnicas visando à produção de
populações monossexuais (PHELPS; POPMA, 2000), como a incorporação de
andrógeno na ração (MACINTOSH; LITTLE, 1995; LEONHARDT, 1997;
BEARDMORE et al., 2001), que é a mais utilizada atualmente na tilapicultura.
Apesar da simplicidade e facilidade de aplicação, esta técnica pode ocasionar
reduzidas taxas de masculinização, e as hierarquias sociais acabam
influenciando a competição pelo alimento (MACINTOSH; LITTLE, 1995).
1.5 Métodos para obtenção de populações monossexo de tilápias
Segundo Phelps e Cerezo (1992), a utilização de hormônios
masculinizantes é a técnica mais prática e efetiva para a produção de machos
proporciona a obtenção de populações constituídas apenas por machos com
maior potencial de crescimento.
Inúmeras são as vantagens que podem ser obtidas com a produção de
lotes monossexo, principalmente quando um dos sexos apresenta uma
marcada superioridade na taxa de crescimento em relação ao outro.
Dependendo da espécie, as técnicas de controle dos sexos podem trazer
também outros benefícios, tais como: supressão da reprodução, contenção de
gastos de energia metabólica com a atividade reprodutiva, uniformidade de
tamanho na despesca, redução dos efeitos da maturação gonadal na aparência e na qualidade da carne, bem como diminuição dos riscos de impactos
ambientais decorrentes da fuga de peixes para os sistemas naturais
(BEARDMORE et al., 2001).
Muitas estratégias de produção de populações masculinas de tilápia foram desenvolvidas, como por exemplo, sexagem manual, hibridação,
produção de super macho e reversão sexual. Dentre as técnicas, a mais
utilizada atualmente em pisciculturas comerciais, é a da reversão sexual, com a
utilização de hormônios masculinizantes incorporados à ração.
1.5.1 Sexagem manual
A sexagem manual é feita separando-se os indivíduos pelo sexo,
mediante observação da papila urogenital. Para que haja precisão na seleção é
necessário que a tilápia do Nilo tenha pelo menos entre 25 e 30 g. A vantagem é não necessitar da utilização de hormônios esteróides (POPMA; LOVSHIN,
1995).
1.5.2 Hibridação
O cruzamento de algumas espécies de tilápias resulta na produção de
híbridos machos. Esta técnica é fundamentada na base genética da
determinação do sexo da tilápia.
Na tilápia do Nilo (O, niloticus) e na tilápia de Moçambique (O.
mossambicus) o sexo é determinado por cromossomos X e Y, onde a fêmea é
XX homogamética e o macho XY heterogamético. Na tilápia azul (O. aureus) e
na tilápia de Zanzibar (O. hornorum) ocorre o inverso, os machos são ZZ
x
Oreochromis hornorum
(macho)
Oreochromis nitofkus (fêmea)
Híbrido 100% macho
7
realiza um cruzamento entre fêmeas puras homogaméticas XX e machos puros homogaméticos ZZ, os híbridos resultantes, teoricamente, seriam heterogaméticos (XZ) e todos machos (Figura 2). No entanto, nem todos os cruzamentos híbridos resultam em progênie 100% masculina, podendo variar de 70 a 100%. Isto pode ser atribuído a alguns fatores: contaminação das linhagens parentais através do cruzamento com outras espécies de tilápia; cruzamento dos filhos híbridos (geração F1), que são machos férteis, com as fêmeas originalmente estocadas nos tanques de hibridação; e presença de outros genes em autossomos que podem influenciar a manifestação dos genes presentes nos cromossomos Y e Z (cromossomos determinantes do sexo da tilápia). Uma das principais vantagens da utilização da técnica da hibridação é a eliminação da necessidade do uso de hormônios masculinizantes na alimentação das pós-larvas (KUBITZA, 2000).
Figura 2. Esquema de produção de híbridos inter-específicos 100% masculinos.
1.5.3 Produção de super macho
que a aparência e a capacidade reprodutiva do peixe tenha sido alterada. Este método abrange seis etapas.
Na primeira etapa utilizam-se hormônios esteróides femininos (etinilestradiol) em lotes de pós-larvas de tilápia, obtendo-se fêmeas funcionais a partir de machos genéticos (XY).
A segunda etapa consiste no cruzamento dessas fêmeas funcionais (XY) com machos normais (XY). Desse cruzamento, 75% dos alevinos são machos (2/3 XY e 1/3 YY).
Na terceira etapa são realizados cruzamentos sucessivos das fêmeas XY com machos normais XY. As fêmeas são descartadas e os machos são avaliados com teste de progênie, tendo em vista que não é possível distinguir os machos normais dos super machos.
Na quarta etapa, os machos XY e YY são cruzados com fêmeas normais XX. Desse cruzamento, os alevinos provenientes de machos YY serão 100% XY e os oriundos de machos XY serão 50% machos e 50% fêmeas. Identificados os super machos, estes devem ser escolhidos como reprodutores. A quinta etapa consiste na manutenção da produção de super machos com a feminilização de lotes oriundos de cruzamentos entre fêmeas funcionais XY com machos YY, que resultarão em 50% de fêmeas XY e 50% de fêmeas YY. As "fêmeas" YY deverão produzir progênies 100% macho e devem ser selecionadas.
Na sexta e última etapa, as progênies 100% macho são obtidas a partir do cruzamento contínuo entre super machos YY e "fêmeas" YY.
22 etapa
(3' x 9
XY XY
l 25% fAmAa XX
I
50% macho XY
25% machn YY 12 etapa
I
i
i
50% XX
I sn% fêmea XX
50% XY
[ sn% fêmea XY
etinilestradiol
1
25% fêmea XX 25% machn YY
I
50% macho XY
3! etapa
c3' x y
XY XXd x ?
XY XY9
4! etapa / N
XY XX YY XX
. À
I I
I I
100% macho XY 50% fêmea XX 50% macho XY
52 etapa
d x ?
YY XYsn% YY I
sn% XY etinilestradiol
I
50% fêmea YY 50% fêmea XY
V- etapa r
d
x
Y
super-macho
super-fêmea
YY YY
I
,
100% super-macho
YY À
1.5.4 Reversão sexual através de hormônio masculinizante
A reversão sexual baseia-se na alteração do sexo morfológico, ou seja, na expressão fenotípica. É possível fazer com que indivíduos que geneticamente são fêmeas desenvolvam fenótipos de machos, através da administração de hormônios masculinizantes incorporados à ração. Este manejo faz com que os tecidos, ainda indiferenciados, dos peixes geneticamente fêmeas se desenvolvam em tecido testicular, produzindo indivíduos que crescem e funcionam reprodutivamente como machos.
A administração do hormônio esteróide masculino é feita por via oral através da alimentação. Para obter alevinos revertidos, as pós-larvas devem ser alimentadas com ração contendo de 40 a 60 mg de 17-a-metil-testosterona por quilograma de ração durante um período de três a quatro semanas. A ração deve ser oferecida diariamente, pelo menos duas vezes ao dia. Ao final do tratamento, as pós-larvas revertidas normalmente apresentam entre 0,1 e 0,5 g, dependendo basicamente da temperatura e da qualidade da ração
Durante o processo de reversão sexual, uma sobrevivência de 70 a 80% é considerada normal. O percentual de machos após o tratamento hormonal freqüentemente fica acima de 95%, mas, ocasionalmente, podem ocorrer percentuais de 80 a 90%. A eficácia da reversão sexual é similar para O.
niloticus, O. aureus e O. mossambicus (POPMA; LOVSHIN, 1995).
11
2 REVERSÃO SEXUAL DE TILÁPIAS NO CENTRO DE PESQUISAS EM AQÜICULTURA RODOLPHO VON 1HERING — DNOCS
2.1 Seleção e Manutenção reprodutores e reprodutrizes
A seleção dos reprodutores e das reprodutrizes no CPAq consistiu no manejo adequado para o sucesso da reversão, pois nesse momento os animais foram selecionados de acordo com peso e comprimento dos indivíduos e com características visuais como: corpo livre de deformidades, nadadeiras inteiras sem qualquer tipo de torção, escamas intactas, estado de sanidade sem a presença de ferimentos ou arranhões na epiderme.
Para determinar o sexo dos animais, foi realizada uma sexagem manual. Segundo Kubitza (2000), a diferenciação entre machos e fêmeas de tilápia do Nilo é feita observando a papila urogenital. Os machos apresentam a papila mais afastada do ânus, com formato mais afilado na extremidade posterior, quando comparada à das fêmeas, e têm apenas um único orifício, chamado orifício urogenital, por onde passam tanto a urina como o sêmen (Figura 4).
Ainda segundo Kubitza (2000), as fêmeas apresentam a papila urogenital mais próxima do ânus, com formato mais arredondado na extremidade posterior, quando comparada à dos machos, e possuem dois orifícios: a uretra, para excreção da urina, e o oviduto para a saída dos ovos. O oviduto apresenta-se como um corte transversal situado entre o ânus e a uretra (Figura 5).
Figura 5. Papila urogenital da fêmea de tilápia do Nilo (Oreochromis niloticus).
Para selecionar as fêmeas que estavam preparadas para a reprodução outras características foram observadas como por exemplo o abaulamento da região ventral e a coloração avermelhada na região do oviduto, que indicavam um bom estado reprodutivo.
Com o intuito de facilitar o manuseio, foram utilizados indivíduos com peso médio de 400 g para fêmeas e 600 g para os machos, já que indivíduos maiores dificultam o manejo.
13
telada, para evitar a ação de predadores. Essa área era constituída de 26 tanques de alvenaria (Figura 6), sendo 24 de 33 m3 (3 m x 11 m x 1 m), doze para os machos e doze para as fêmeas, e dois tanques de 66 m3 (6 m x 11 m x 1 m) usados como reserva, com densidade de estocagem de 2 peixes/m2. Os tanques possuíam renovação constante de água para manter os reprodutores com um certo nível de conforto, com relação ao oxigênio dissolvido e parâmetros físico-químicos da água.
Figura 6. Vista dos tanques utilizados para o repouso de reprodutores no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
2.2 Estocagem dos reprodutores nos hapas e Reprodução
Figura 7. Recipientes utilizados no transporte de reprodutores no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
O cloreto de sódio foi utilizado para amenizar os efeitos do estresse fisiológico sobre os peixes durante o transporte e foi usado em concentrações de 0,1 a 0,3% (1 a 3 kg/m3 de água). A elevação nos níveis de corticosteróides no sangue dos peixes, em resposta ao estresse durante o manuseio pré-transporte, causa o aumento na permeabilidade das membranas das células do epitélio branquial. Em conseqüência pode ocorrer excessiva difusão de íons (principalmente Na+ e
co
para a água, acarretando um desequilíbrio osmorregulatório nos peixes. O sal estimula a produção de muco, ajudando a recobrir arranhões surgidos durante a despesca, a pesagem e o carregamento dos peixes. Além disso, o muco produzido sobre o epitélio branquial reduz a passagem de íons através das membranas celulares. O aumento da concentração de íons sódio e cloreto na água doce, pela adição de sal, reduz as perdas de íons por diminuir o gradiente osmótico entre o plasma sangüíneo do peixe e a água doce, podendo também favorecer a excreção de amônia através de transporte ativo (KUBITZA, 1997).15
pelas estacas de madeira fixadas no fundo do viveiro, amarradas às extremidades laterais da malha. Os hapas apresentavam volume de 15 m3 (10 m x 1,5 m x 1,0 m) e malha de 1,5 mm. Quarenta e oito hapas foram instalados em um viveiro escavado de 5.000 m3 (100 m x 50 m x 1 m) e dezenove hapas, em outro de 2.500 m3 (100 m x 25 m x 1 m). Semanalmente, entre segunda-feira e quinta-feira, seis hapas foram estocados e outros seis foram despescados.
Figura 8. Vista dos hapas utilizados na reprodução no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
Os hapas facilitavam o manejo com os peixes e a despesca, proporcionavam um melhor aproveitamento da área do viveiro, possibilitavam a obtenção de ovos e pós-larvas com idade conhecida e, ainda, tinham custo de fabricação menor. Entretanto, essas estruturas exigiam uma manutenção freqüente como limpeza, além do risco de rompimento das malhas e fuga de reprodutores, larvas e pós-larvas.
Os animais ficaram estocados nos hapas de reprodução durante quinze dias. No decorrer da primeira semana, os reprodutores foram alimentados duas vezes ao dia, com ração comercial extrusada contendo 32% de proteína bruta e taxa de arraçoamento de 1% da biomassa por dia. Na segunda semana, a alimentação foi suspensa já que nesse período as fêmeas estavam incubando os ovos na boca e praticamente não se alimentavam. Segundo Kubitza (2000), a suspensão da oferta de ração nesse período, reduz as perdas.
Ao fim de quinze dias, os hapas de reprodução foram despescados. A operação de despesca foi realizada por três funcionários do CPAq, que suspendiam uma das extremidades do hapa com o auxílio de um cano de ferro (Figura 9), que corria ao longo de toda extensão do hapa, com a finalidade de concentrar os peixes em uma das extremidades do hapa.
Figura 9. Despesca dos hapas de reprodução no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
17
depois foi feita a retirada de ovos da boca das fêmeas (Figura 10), que foram colocados também em recipientes de mesma capacidade. Após a coleta de nuvens de larvas, pós-larvas e ovos, um funcionário retirou os machos e as fêmeas com o auxílio de um puçá com abertura de malha de 14 mm, separando-os em bombonas plásticas de 50 litros contendo aproximadamente 20 litros de água e cloreto de sódio. Após a despesca os reprodutores foram levados para a área de descanso, onde permaneciam por um período aproximado de 15 dias.
Figura 10. Coleta de ovos e larvas da boca das fêmeas no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
2.3 Recepção, Limpeza e Profilaxia de ovos, larvas e pós-larvas
Figura 11. Selecionador utilizado na classificação de pós-larvas no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
O selecionador interno possuía uma malha rígida de 2,5 mm de diâmetro e o externo, malha de 1,5 mm. As pós-larvas retidas no selecionador interno apresentavam comprimento médio superior a 12,0 mm, e como não correspondiam ao tamanho adequado para a reversão sexual foram estocadas em tanques de alvenaria para posterior uso em programas de peixamento de açudes. As pós-larvas com comprimento inferior a 12,0 mm que ficaram retidos no selecionador externo foram destinadas ao processo de reversão sexual.
Figura 12. Peneira utilizada para retirada de sujidades que ficam agregadas aos ovos no Centro de Pesquisas em Aqüicultura Rodolpho von lhering, Pentecoste, Ceará.
Após a limpeza, ovos, larvas e pós-larvas passavam por um banho de imersão em solução de formalina, preparada pela adição de 1 mL de formol comercial a 40% para cada 1 L de água, por 30 segundos, com o objetivo de eliminar a maior parte dos possíveis ectoparasitas, tais como Trichodina, Chilodonella, Gyrodactylus, Dactylogyrus, dentre outros.
Depois da profilaxia com a formalina, ovos e larvas foram levados para o setor de incubação artificial, onde foram estocados na proporção de até 300 g de ovos ou larvas por incubadora com capacidade para 2 L de água. Essas incubadoras encontravam-se conectadas a bandejas plásticas retangulares de 29 cm x 19 cm x 5 cm com abertura nas laterais protegidas por telas com malha de 1,0 mm para permitir um fluxo contínuo de água com uma vazão de 4 L/min, mas mantendo as larvas dentro das bandejas. Quando transferidas para as incubadoras, as larvas migravam para as bandejas, onde permaneceram até a absorção do saco vitelínico. Os ovos permaneceram nas incubadoras por um período de aproximadamente 72 h, até sua eclosão e, à medida que eclodiam, as larvas caíam nas bandejas (Figura 13).
Figura 13. Sistema de incubadora de ovos utilizada no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
2.4 Estocagem de pós-larvas nas calhas e hapas de reversão sexual
21
Figura 14. Calhas utilizadas na reversão sexual no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
Em cada calha foram estocadas 10.000 pós-larvas, ficando uma densidade de 100 pós-larvas/L. Elas permaneceram durante um período de cinco dias para adaptação ao alimento artificial, recebendo ração em pó com 50% de proteína bruta contendo o hormônio masculinizante (17-a-metil-testosterona), na proporção de 60 mg/kg de ração, que foi ofertada à vontade em seis tratos diários. As calhas foram sifonadas duas vezes ao dia para retirada de restos de ração e matéria orgânica, cujo acúmulo resulta em perda da qualidade da água.
Figura 15. Hapas utilizados na reversão sexual no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
Figura 16. Tanques de alvenaria utilizados na estocagem dos alevinos revertidos no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
2.5 Preparação da ração contendo hormônio masculinizante
Durante os primeiros quinze a trinta dias de vida, dependendo da temperatura da água, as pós-larvas de tilápia ainda não apresentam sexo morfológico definido. Desta forma é possível, através da administração contínua de hormônios, obter populações masculinas ou femininas, de acordo com o tipo de hormônio utilizado. Embora vários produtos sejam eficazes na reversão sexual de tilápias, o 17-a-metil-testosterona é o hormônio mais utilizado pela sua grande eficácia, facilidade de aquisição e baixo custo, comparado a hormônios tais como a fluoximesterona, acetato de trembolona e outros esteróides masculinizantes (KUBITZA, 2000).
ração foi misturada uma solução contendo o hormônio masculinizante diluído em álcool.
Inicialmente foi preparada uma solução-estoque, utilizando 6,0 g de hormônio diluído em 1 L de álcool etílico a 96%. Essa solução foi armazenada em frasco de vidro na cor âmbar e mantido sob refrigeração. Nessas condições, a solução se mantém viável por um prazo de até três meses. Este volume foi suficiente para tratar 30.000 pós-larvas.
O hormônio foi utilizado na concentração de 60 mg para cada 1,0 kg de ração. A cada 10 dias foram preparados 3 kg de ração, onde se retirava uma porção de 30 mL de solução-estoque e diluía-se em 1 L de álcool comum, para em seguida incorporar a ração. A incorporação foi feita manualmente (Figura 17) por um funcionário devidamente protegido com equipamentos de proteção individual, como máscara e luvas para evitar o contato direto com o hormônio e impedir que ele seja incorporado à pele ou inalado.
Figura 17. Incorporação do hormônio na ração de reversão sexual no Centro de Pesquisas em Aqüicultura Rodolpho von Ihering, Pentecoste, Ceará.
25
ração em camadas de até 5 cm de altura. Passado esse tempo, a ração contendo o hormônio foi acondicionada em sacos plásticos escuros e conservada em local fresco e arejado, mantendo assim sua qualidade.
3 CONSIDERAÇÕES FINAIS
4 REFERÊNCIAS
BEARDMORE, J. A.; MAIR, G. C.; LEWIS, R. I. Monosex male production in finfish as exemplified by tilapia: applications, problems and prospects. Aquaculture, Amsterdam, v. 197, n. 1-4, p. 283-301, June 2001.
EL-SAYED, A. F. M. Alternative dietary protein sources for farmed tilapia, Oreochromis spp. Aquaculture, Amsterdam, v. 179, n. 1-4, p. 149-168, Sept. 1999.
FAO. Fisheries Department. El estado mundial de Ia pesca y Ia acuicultura — 2006 (SOFIA). 2007. 176 p. Disponível em:
<http://www.fao.org/docrep/009/a0699s/A0699SO4.htm#4.1.3> Acesso em: 19 out 2008.
HAYASHI, C. Breves considerações sobre as tilápias. In: RIBEIRO, R. P., HAYASHI, C., FURUYA, W. M. (Eds.). Curso de piscicultura. Criação racional de tilápias. p. 4. 1995.
IBAMA. Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais
Renováveis. Estatística da Pesca 2006. Brasil: grandes regiões e unidades da federação. Brasília: Ibama, 2008. 174 p. Disponível em:
<http://www.ibama.gov.br/recursos-pesqueiros/> Acesso em: 19 out 2008.
KUBITZA, F. Transporte de peixes vivos — Parte I. Panorama da Aqüicultura, Rio de Janeiro, v. 7, n. 43, p. 20- 26, set/out 1997.
KUBITZA, F. Tilápia: tecnologia e planejamento na produção comercial. Jundiaí: F. Kubitza, 2000. 285 p.
LEONHARDT, J. H. Efeito da reversão sexual em tilápia do Nilo, Oreochromis niloticus (Linnaeus, 1757). Jaboticabal: Universidade Estadual Paulista, 1997. 128f. Tese (Doutorado em Aqüicultura) - Universidade Estadual Paulista, 1997.
LOVSHIN, L. L., CYRINO, J. E. P. Status of commercial fresh water fish cultura in Brazil. In: SIMPÓSIO SOBRE MANEJO E NUTRIÇÃO DE PEIXES, 2, 1998, Piracicaba. Anais... Piracicaba: CBNA, 1998. p. 1-20.
MACINTOSH, D. J.; LITTLE, D. C. Mie tilapia (Oreochromis niloticus) In: BROMAGE, N. R.; ROBERTS, R. J. (Eds.). Broodstock management and egg and larva! quality. London: Blackwell Science Ltd, 1995. p. 277-320.
MACINTOSH, D. J., VARGHESE, T. J., RAO, G. P. S. Hormonal sex reversal of wild spawned tilapia in India. Journal of Fish Biology, London, v. 26, n. 2, p. 87-94, 1985.
PHELPS, R. P., CEREZO, G. The effect of confinement in hapas on sex reversal and growth of Oreochromis niloticus. Journal of Applied Aquaculture, v. 1, n. 4, p. 73-81, 1992.
PHELPS, R.P.; POPMA, T.J. Sex reversal of tilapia In: COSTA— PIERCE, B.A.; RAKOCY, J.E (Eds.) Tilapia aquaculture in the Americas. Louisiana: World Aquaculture Society, 2000. v. 2, p . 34-59.
POPMA, T.; LOVSHIN, L. L. Aspectos relevantes da biologia e do cultivo de tilápias. Panorama da Aqüicultura, Rio de Janeiro, v. 5, n. 27, p. 8-13, jan/fev 1995.
POPMA, T. J., PHELPS, R. P. Status report to commercial tilapia producers on monosex fingerling productions techniques. In: AQOICULTURA BRASIL'98, 1998, Recife. Anais... Recife: SIMBRAQ, 1998. p. 127-145.
STICKNEY, R. R. Status of research on tilapia. In: COSTA—PIERCE, B. A.; RAKOCY, J. E. (Eds.). Tilapia aquaculture in the Americas. Louisiana: World Aquaculture Society, 2000. v. 2, p. 21-33.
TURNER, G. F.; ROBINSON, R. L. Reproductive biology, mating systems and parental care In: BEVERIDGE, M. C. M.; MCANDREW, B. J. (Eds.). Tilapias: biology and explotation. London: Kluwer Academic Publishers, 2000. p. 33-58.