UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS AGRÁRIAS
DEPARTAMENTO DE ENGENHARIA DE PESCA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA DE RECURSOS NATURAIS
LYNDERVAN OLIVEIRA DE ALCÂNTARA
AVALIAÇÃO DE PROPRIEDADES DE SUPERFÍCIE DE REVESTIMENTOS APLICADOS A FILÉS DE TILÁPIA (Oreochromis niloticus) E CAMARÃO
(Litopenaeus vannamei)
LYNDERVAN OLIVEIRA DE ALCÂNTARA
AVALIAÇÃO DE PROPRIEDADES DE SUPERFÍCIE DE REVESTIMENTOS APLICADOS A FILÉS DE TILÁPIA (Oreochromis niloticus) E CAMARÃO
(Litopenaeus vannamei)
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Biotecnologia de Recursos Naturais, da Universidade Federal do Ceará, como requisito parcial para obtenção do Título de Mestre em Biotecnologia de Recursos Naturais. Área de Concentração: Biotecnologia de Recursos Naturais.
Orientador: Prof. Dr. Bartolomeu Warlene Silva de Souza.
Co-orientador: Prof. Dr. Men de Sá Moreira de Souza Filho.
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
A319a Alcântara, Lyndervan Oliveira de.
Avaliação de Propriedades de Superfície de Revestimentos Aplicados a Filés de Tilápia (Oreochromis niloticus) e Camarão (Litopenaeus vannamei) / Lyndervan Oliveira de Alcântara. – 2015.
119 f. : il. color.
Dissertação (mestrado) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Programa de Pós-Graduação em Biotecnologia de Recursos Naturais, Fortaleza, 2015. Orientação: Prof. Dr. Bartolomeu Warlene Silva de Souza.
Coorientação: Prof. Dr. Men de Sá Moreira de Souza Filho.
1. Propriedades de superfície. 2. Revestimentos comestíveis. 3. Oreochromis niloticus. 4. Litopenaeus vannamei. I. Título.
A Deus.
Aos meus pais, Edvan Lopes e Rosália Lúcia.
Aos meus irmãos, Eryvan e Edvan Filho. Aos meus padrinhos de Batismo, Rita Maria e José Iran.
AGRADECIMENTOS
Primeiramente a Deus, por sempre iluminar e guiar os meus caminhos, concedendo-me muita Fé, Perseverança e Determinação.
A Toda Minha Família, Alicerce da Minha Vida, em especial ao meu pai Edvan Lopes de Alcântara, minha mãe Rosália Lúcia Oliveira de Alcântara, aos meus irmãos Eryvan Oliveira e Edvan Filho, por todo o apoio e incentivo incondicional. A minha Avó Lúcia, a todos os meus tios, tias, primos e primas.
Aos meus Padrinhos de Batismo Rita Maria de Lima da Silva e José Iran Alves da Silva por sempre me apoiar e incentivar nos meus estudos.
A minha namorada Ana Vitória pelo apoio incondicional e toda sua família, em especial à Dona Cacilda e Aldeni.
A minha cunhada Odileuda.
Ao Prof. Dr Bartolomeu Warlene Silva de Souza pela orientação e por todo apoio, estímulo, colaboração e confiança, demonstrados ao longo destes dois anos.
Ao Prof. Dr. Men de Sá Moreira de Souza Filho pela co-orientação e úteis contribuições dadas a este trabalho.
Aos Profs. Drs. André Luis Coelho da Silva e Álvaro Marcos Pereira Lima, bem como a Dra. Juliana Rabelo de Sousa por participarem como membros da banca examinadora.
Francisco Avelino, Gleyciara Cavalcante, Hélder Levi, Hálisson Lucas, Lícia Braga; e Laboratório de Embalagens: em especial a Arcelina Pacheco, Delane Rodrigues e Talita Santos.
Ao Prof. Dr. Antoninho Valentini do Departamento de Química e Analítica e Físico-Química da Universidade Federal do Ceará por permitir a utilização do Tensiômetro, bem como ao monitor Samuel Veloso e a Técnica do Laboratório de Química Ana Cristina pelo auxílio prestado.
Ao Prof. Jackson de Queiroz Malveira do Laboratório de Referências em Biocombustíveis (LARBIO) da Fundação Núcleo de Tecnologia Industrial do Ceará (NUTEC).
A Camila Peixoto do LARBIO (NUTEC)
A todos os meus companheiros da primeira turma do Programa de Pós-Graduação em Biotecnologia de Recursos Naturais da UFC, em especial Leonardo Silva e Agena Câmara.
Ao Instituto Federal de Educação, Ciência e Tecnologia do Ceará (IFCE), instituição pela qual obtive formação no Curso Superior de Tecnologia em Processos Químicos.
Ao meu prof. e orientador do período de graduação no IFCE Hugo Leonardo de Brito Buarque.
A todos os meus amigos do IFCE, em especial aos que fizeram parte do Laboratório de Química Analítica (LQA): Mabel Ribeiro, Marcio Roberto, Erilany Morais, Isabel Freitas, Bruno Vasconcelos, Lorena Guerreiro, Jordana Nepomuceno, Camila Viana, Bruno Pereira, Patrícia Buarque, Olinda Chagas, Beatriz Colares.
Aos amigos Victor Conde, Eveline, Gustavo Braga, Gleyciane Nobre, Juliana Pitombeira, Macson Sousa, Janelane Coelho, Solange, Elcivânia, Matias Lopes, Vitor Alves.
Aos amigos Fábio Marques e Lana Mazzone.
Aos amigos Glautemberg, Luciana e família.
A minha amiga Kamilla Maia.
À Embrapa Agroindústria Tropical pela disponibilização do suporte analítico.
À FUNCAP pela Bolsa Concedida.
RESUMO
mN/m), 1,5% de gelatina e 0,2% de glicerol (Ws = -6,739 mN/m). Logo, estas são as melhores composições sugeridas para uma aplicação futura nestes filés de pescado em pesquisas posteriores.
ABSTRACT
The impressive world development has provided over the years an increased demand for food and changes in dietary patterns, generating a growing demand for fresh food and good quality, especially the Nile tilapia (Oreochromis niloticus) and shrimp (Litopenaeus vannamei). However, these are food products of high perishability, subject to biochemical and microbial changes. In this context, the edible coatings emerge as one of the main techniques developed in order to increase the storage capacity of food and improve existing technology, replacing partially the use of chemical preservatives. The biopolymer chitosan and gelatin are important elements to achieve these goals. In this scenario, the study of surface properties is a tool for the correct choice of the formulations to be used in food products. In this context, this study aimed to characterize surface properties of edible coatings based on polysaccharides and proteins, especially the biopolymer chitosan and gelatin in fillets of Nile tilapia (Oreochromis niloticus) and shrimp (Litopenaeus vannamei). For this, the properties of surfaces of fillets of Nile tilapia and shrimp were evaluated, and the wettability of coatings on these fish fillets. In accordance it concluded that both surfaces Nile tilapia as the shrimp are characterized as low-energy (<100 mN/m) with its surface tension 63.80 and 59.93 mN/m, respectively, meaning that the Zisman method for the determination of wettability could be applied. The values of the polar and dispersive components of the superficial tension of the Nile Tilape to be 49.98 and 13.82 mN/m, respectively, for shimp, 45.79 and 14.14, respectively. The best experimental values of wettability were obtained for the following coating composition: 1) for Nile Tilapia: 1.0% chitosan and 0% glycerol (Ws = -13.565 mN/m) 1.0 % chitosan and 0.1% glycerol (Ws = -11.609 mN/m); 1.0% gelatin and 0.1% glycerol (Ws = -10.762 mN/m) 1.0% gelatin and 0.2% glycerol (Ws = -10.029 mN/m) 1.5% and 0.2% gelatin (Ws = -10.920 mN/m); 2) To the shrimp: 1.0% chitosan and 0.0% glycerol (Ws = -12.934 mN/m); 1.0% gelatin and 0.0% glycerol (Ws = -5.588 mN/m) 1.5% gelatin and 0.2% glycerol (Ws = -6.739 mN/m). So these are the best compositions suggested for future application in these fish fillets in further research.
LISTA DE ILUSTRAÇÕES
Figura 1 – Produção mundial de pesca de captura e aqüicultura 27 Figura 2 – Produção aquícola mundial pelos 15 maiores produtores em 2012 29 Figura 3 – Produção de pescado (t) da aqüicultura continental no período de 2009 a
2011 32
Figura 4 – Estados produtores de cada espécie no quadro atual brasileiro 34 Figura 5 – Tilápia do Nilo, Oreochromis niloticus 35 Figura 6 – Camarões, Litopenaeus vannamei 36 Figura 7 – Consumo per capitaversus a produção brasileira de pescado 39 Figura 8 – Representação esquemática da estrutura primária da quitosana 42
Figura 9 – Estrutura básica da gelatina 44
Figura 10 – Esquema representativo das três tensões interfaciais existentes em um sistema trifásico, em que duas fases são condensadas 47 Figura 11 – Ângulos de contato formado por uma gota de líquido séssil em uma
superfície sólida homogênea 48
Figura 12 – O desequilíbrio das forças das moléculas do líquido na superfície
ocasiona o fenômeno da tensão superficial 49
Figura 13 – Imagem das amostras de filés de pescado utilizado neste estudo: (a)
Tilápia do Nilo e (b) Camarão 55
Figura 14 – Quitosana Comercial 56
Figura 15 – Fluxograma simplificado do procedimento de extração de gelatina de
escama de tilápia (Oreochromis niloticus) 57
Figura 16 – Equipamento utilizado nos ensaios de tensão superficial das soluções
testadas 60
Figura 17 – Imagem do software ImageJ 61
LISTA DE GRÁFICOS
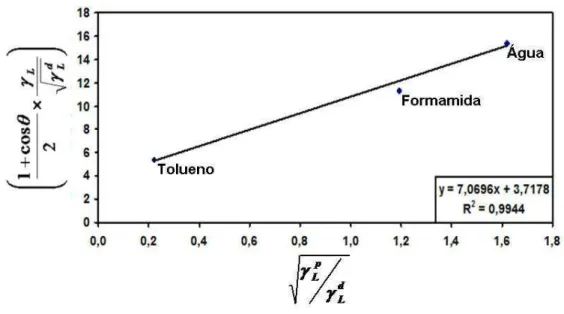
Gráfico 1 – Ajuste dos dados experimentais a um modelo linear para filés de tilápia do Nilo de acordo com a equação 10 (95% de confiança e n=15) 67 Gráfico 2 – Extrapolação do gráfico de Zisman, para a superfície em filés de tilápia
do Nilo (95% de confiança, n=15) 69
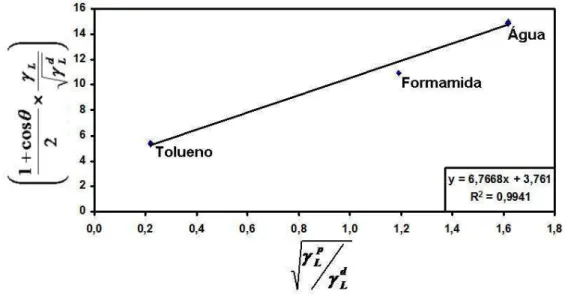
Gráfico 3 - Ajuste dos dados experimentais a um modelo linear para o filé de camarão de acordo com a equação 12 (95% de confiança e n=16) 71 Gráfico 4 – Extrapolação de Zisman, para a superfície em filés de camarão (95% de
confiança, n = 16) 73
Gráfico 5 – Variação do coeficiente de adesão (Wa) dos revestimentos de quitosana, em filés de Tilápia do Nilo (Oreochromis niloticus), em função das concentrações de
glicerol e quitosana, à temperatura de 20ºC 77
Gráfico 6 – Variação do coeficiente de coesão (Wc) dos revestimentos de quitosana, em filés de Tilápia do Nilo (Oreochromis niloticus), em função das concentrações de
glicerol e quitosana, à temperatura de 20ºC 78
Gráfico 7 – Variação do coeficiente de espalhamento (Ws) dos revestimentos de quitosana, em filés de Tilápia do Nilo (Oreochromis niloticus), em função das concentrações de glicerol e quitosana, à temperatura de 20ºC 80 Gráfico 8 – Variação do coeficiente de adesão (Wa) dos revestimentos de gelatina em filés de Tilápia do Nilo (Oreochromis niloticus), em função das concentrações de
glicerol, à temperatura de 20ºC 83
Gráfico 9 – Variação do coeficiente de coesão (Wc) dos revestimentos de gelatina, em filés de Tilápia do Nilo (Oreochromis niloticus), em função das concentrações de
glicerol e gelatina, à temperatura de 20ºC 84
Gráfico 12 – Variação do coeficiente de coesão (Wc) dos revestimentos de quitosana, em filés de Camarão (Litopenaeus vannamei), em função das concentrações de glicerol e quitosana, à temperatura de 20ºC 90 Gráfico 13 – Variação do coeficiente de espalhamento (Ws) dos revestimentos de quitosana, em filés de camarão (Litopenaeus vannamei), em função das concentrações de glicerol e quitosana, à temperatura de 20ºC 92 Gráfico 14 – Variação do coeficiente de adesão (Wa) dos revestimentos de gelatina, em filés de camarão (Litopenaeus vannamei), em função das concentrações de
glicerol e gelatina, à temperatura de 20ºC 95
Gráfico 15 – Variação do coeficiente de coesão (Wc) dos revestimentos de gelatina, em filés de camarão (Litopenaeus vannamei), em função das concentrações de
glicerol e gelatina, à temperatura de 20ºC 96
LISTA DE TABELAS
Tabela 1 – Produção de pescado (t) dos 20 maiores produtores em 2009 e 2010 28 Tabela 2 – Representação simplificada, em termos de produção de pescado (t), tanto na pesca extrativa marinha quanto na continental, pelos Estados da Bahia,
Maranhão e Ceará 31
Tabela 3 – Produção aquícola marinha (t) no ano de 2011, pelos estados do Ceará,
Rio Grande do Norte e Santa Catarina 31
Tabela 4 – Produção de pescado (t) da aqüicultura marinha brasileira pela
malacocultura e carcinicultura 32
Tabela 5 - Produção aquícola continental dos estados do Ceará, Maranhão, Bahia e
Piauí no período de 2011 33
Tabela 6 - Produção de pescado (t) da aqüicultura continental por espécie no ano de
2011 33
Tabela 7 – Tensão superficial crítica e tensão superficial para diversos materiais 53 Tabela 8 – Teor de biopolímero (quitosana ou gelatina) e plastificante utilizado no
preparado das soluções de revestimentos 59
Tabela 9 – Tensão superficial dos líquidos testados e suas componentes, à
temperatura de 20ºC 66
Tabela 10 – Análise de variância do modelo descrito pela equação 10 (95% de confiança e n=15) para filés de tilápia do Nilo 68 Tabela 11 – Análise de variância do modelo descrito pela equação 11 (95% de confiança e n = 15) para filés de tilápia do Nilo 69 Tabela 12 – Análise de variância do modelo descrito pela equação 12 (95% de
confiança e n = 16) para o filé de camarão 72
Tabela 13 – Análise de variância do modelo descrito pela equação 13 (95% de
confiança e n = 16) para filés de camarão 73
Tabela 14 – Resumo dos resultados obtidos a partir do estudo das propriedades de
superfície da tilápia do Nilo e do camarão 74
Tabela 17 – Teste de Tukey para os valores do coeficiente de espalhamento dos revestimentos de quitosana em filés de tilápia do Nilo 81 Tabela 18 – Teste de Tukey para os valores do coeficiente de adesão dos revestimentos de gelatina em filés de tilápia do Nilo 83 Tabela 19 – Teste de Tukey para os valores do coeficiente de coesão dos revestimentos de gelatina em filés de tilápia do Nilo 85 Tabela 20 – Teste de Tukey para os valores do coeficiente de espalhamento dos revestimentos de gelatina em filés de tilápia do Nilo 87 Tabela 21 – Teste de Tukey para os valores do coeficiente de adesão dos revestimentos de quitosana em filés de camarão 89 Tabela 22 – Teste de Tukey para os valores do coeficiente de coesão dos revestimentos de quitosana em filés de camarão 91 Tabela 23 – Teste de Tukey para os valores do coeficiente de espalhamento dos revestimentos de quitosana em filés de camarão 93 Tabela 24 – Teste de Tukey para os valores do coeficiente de adesão dos revestimentos de gelatina em filés de camarão 95 Tabela 25 – Teste de Tukey para os valores do coeficiente de coesão dos revestimentos de gelatina em filés de camarão 97 Tabela 26 – Teste de Tukey para os valores do coeficiente de espalhamento dos revestimentos de gelatina em filés de camarão 99 Tabela 27 – Resumo das composições que otimizam a molhabilidade dos
revestimentos para cada material estudado 100
LISTA DE ABREVIATURAS E SIGLAS
ABCC Associação Brasileira de Criadores de Camarão ADH (DHA) Ácido Docosahexaenóico
EMBRAPA Empresa Brasileira de Pesquisa Agropecuária (Agroindústria Tropical)
AEP (EPA) Ácido Eicosapentaenóico
FAO Food and Agriculture Organization of the United Nations LATEPE Laboratório de Tecnologia do Pescado
LTB Laboratório de Tecnologia da Biomassa MPA Ministério da Pesca e Aqüicultura
OMS Organização Mundial da Saúde PIB Produto Interno Bruto
TSC Tensão Superficial Crítica
LISTA DE SÍMBOLOS
Letras Latinas
A Área do Revestimento m2
H Histerese
a
W Coeficiente de adesão mN/m
c
W Coeficiente de coesão mN/m
s
W Coeficiente de espalhamento mN/m
Letras Gregas
G
∆ Energia Livre do Processo
C
γ Tensão superficial crítica do processo de espalhamento mN/m
L
γ Tensão superficial do líquido mN/m
d L
γ Tensão superficial dispersiva do líquido mN/m p
L
γ Tensão superficial polar do líquido mN/m
LV
γ Tensão interfacial líquido-vapor mN/m
SL
γ Tensão interfacial sólido-líquido mN/m
SV
γ Tensão interfacial sólido-vapor mN/m
θ Ângulo de contato de um líquido em determinado sólido rad
a
θ Ângulo de avanço
r
SUMÁRIO
RESUMO ABSTRACT
LISTA DE ILUSTRAÇÕES LISTA DE GRÁFICOS LISTA DE TABELAS
LISTA DE ABREVIATURAS E SIGLAS LISTA DE SÍMBOLOS
1 INTRODUÇÃO 23
2 OBJETIVOS 26
2.1 Objetivo Geral 26
2.2 Objetivos Específicos 26
3 FUNDAMENTAÇÃO TEÓRICA 27
3.1 Produção Mundial de Pescado 27
3.2 Produção Nacional de Pescado 30
3.3 Produção de Tilápia do Nilo e de Camarão 34
2.3.1 Tilápia do Nilo 35
2.3.2 Camarão 36
3.4 Importância Nutricional e Consumo Per Capita do Pescado 37
3.5 Revestimentos Comestíveis 39
3.6 Revestimentos Comestíveis a Base de Quitosana e de Gelatina 42
3.6.1Quitosana 42
3.6.2 Gelatina 43
3.7 Plastificantes 45
3.8 Estudo dos Fenômenos de Superfície 46
3.8.1 Estudo da Capacidade Molhante 46
3.8.2 Tensão Superficial Crítica 50
3.8.3 Método de Zisman para o Estudo das Superfícies dos Filés de Tilápia do Nilo (Oreochromis niloticus) e do Camarão (Litopenaeus
vannamei) 50
3.9 Eficiência do Revestimento 51
3.10 Caracterização de Vários Materiais Através do Estudo das
4 METODOLOGIA 55
4.1 Obtenção do Pescado 55
4.1.1 Tilápia do Nilo (Oreochromis niloticus) 55
4.1.2 Camarão (Litopenaeus vannamei) 55
4.2 Biopolímeros Utilizados 56
4.2.1 Biopolímero de Quitosana 56
4.2.2 Biopolímero de Gelatina de Escama a partir da Pele de Tilápia do
Nilo (Oreochromis niloticus) 56
4.3 Preparação dos Revestimentos 58
4.3.1 Revestimentos de Quitosana 58
4.3.2 Revestimentos de Gelatina 58
4.4 Propriedades dos Revestimentos Comestíveis: Capacidade Molhante 60
4.5 Análise Estatística 63
5 RESULTADOS E DISCUSSÃO 65
5.1 Propriedades de Superfície dos Revestimentos 65 5.1.1 Tensão superficial e tensão superficial crítica 65 5.1.1.1 Ajuste Experimental do Ensaio: Biopolímeros de Quitosana e Gelatina em Filés de Tilápia do Nilo (Oreochromis niloticus) 67 5.1.1.2 Ajuste Experimental do Ensaio: Biopolímeros de Quitosana e Gelatina em Filés de Camarão (Litopenaeus vannamei) 71
5.1.2 Molhabilidade 76
5.1.2.1 Quitosana em Filés de Tilápia do Nilo 76 5.1.2.2 Gelatina em Filés de Tilápia do Nilo 82
5.1.2.3 Quitosana em Filés de Camarão 88
5.1.2.4 Gelatina em Filés de Camarão 94
6 CONCLUSÃO 101
7 PROPOSTAS PARA TRABALHOS FUTUROS 103
7.1 Medição da Rugosidade das Superfícies 103
7.2 Histerese de Molhabilidade 103
7.4 Preparação e Caracterização dos Filmes 104
7.5 Estudo da Vida de Prateleira dos Pescados 104
REFERÊNCIAS 105
A.1 Ângulos de Contato dos Compostos Puros 111 A.2 Ângulos de Contato das Soluções de Revestimento 113
A.3 Tensão Superficial dos Revestimentos 117
1 INTRODUÇÃO
O impressionante desenvolvimento mundial tem proporcionado ao longo dos anos uma maior demanda por alimentos. Esta demanda por alimentos está intimamente correlacionada com o aumento da renda e um significativo crescimento urbano. Além disso, este desenvolvimento tem sido facilitado por uma maior expansão da produção de produtos alimentícios e por uma maior eficiência dos canais de distribuição (FAO, 2014). Aliado a isto, as mudanças nos padrões nutricionais e os benefícios provenientes de uma alimentação mais saudável, rica em fontes de nutrientes para o organismo humano, têm gerado uma crescente demanda por alimentos frescos e de boa qualidade, dentre as quais se podem destacar o pescado.
Dentro desse contexto, em se tratando da produção de pescado, o Brasil tem se destacado especialmente no cultivo da tilápia do Nilo (Oreochromis niloticus) e do camarão (Litopenaeus vannamei). Segundo ROCHA e ROCHA (2011) da Associação Brasileira de Criadores de Camarão (ABCC), a exemplo da aqüicultura mundial, a composição da produção aquícola brasileira em 2008 foi formada principalmente por: peixes (72,68%), estritamente representados pela piscicultura de água doce (210.812 t); crustáceos (22,49%), cuja carcinicultura marinha, predominantemente representada pelo camarão Litopenaeus vannamei, participou com 65.000 t, enquanto que o camarão de água doce (Macrobrachium rosenbergii, camarão da Malásia) contribuiu com apenas 250 t; moluscos (4,62%) representados por mexilhões e ostras e, anfíbios (0,21%), basicamente, jacarés e rãs.
Diante disso, as empresas alimentícias, bem como pesquisadores de diversas áreas têm procurado, continuamente, por novas estratégias que visem aumentar a capacidade de armazenamento dos alimentos e aperfeiçoar a tecnologia existente, com o intuito de elevar a qualidade e, conseqüentemente, prolongar a vida útil de alimentos frescos (PINHEIRO et al., 2010; CERQUEIRA et al., 2010). Nesse sentido, numerosos estudos têm sido direcionados na utilização de elementos naturais para melhorar a qualidade do pescado e prolongar o seu tempo de prateleira, e uma das principais técnicas desenvolvidas para esta finalidade é a utilização de revestimentos comestíveis que substituem, pelo menos de forma parcial, o uso de conservantes químicos.
Nos últimos anos, os filmes e revestimentos edíveis têm sido considerados uma das tecnologias potenciais que podem atingir tais objetivos, garantindo a segurança microbiana e a preservação dos alimentos da influência de fatores externos (CERQUEIRA et al., 2010). A literatura reporta que existe uma variedade de materiais oriundos de fontes naturais que podem ser utilizados para produzir revestimentos/filmes comestíveis (PINHEIRO et al., 2010; CERQUEIRA, 2010). Dentre estes, se podem mencionar os biopolímeros a base de polissacarídeos e de proteínas, particularmente os biopolímeros de quitosana e gelatina.
Na literatura existem vários trabalhos que reportam a determinação da capacidade molhante, bem como as propriedades de superfície das soluções formadoras de revestimentos a serem aplicados em frutos, legumes e outros alimentos como o queijo. (RIBEIRO et al., 2007; CASARIEGO et al., 2008; CERQUEIRA et al., 2009; LIMA et al., 2010; MARTINS et al., 2010; COZMUTA et al., 2015). Porém, a investigação dessas propriedades em pescado, em particular os filés de camarão (Litopenaeus vannamei) e de tilápia do Nilo (Oreochromis niloticus), ainda não foram relatados até o momento. Infere-se ainda, que o único trabalho de pesquisa voltado para esse tipo de finalidade em pescados, foi o estudo dessas propriedades em salmão, Salmo salar, realizado por SOUZA et al., 2010.
2 OBJETIVOS
2.1 Objetivo Geral
Caracterizar as propriedades de superfície de revestimentos comestíveis a base de polissacarídeos e de proteínas, especialmente os biopolímeros de quitosana e gelatina em filés de tilápia do Nilo (Oreochromis niloticus) e camarão (Litopenaeus vannamei).
2.2 Objetivos Específicos
•
Determinar o ângulo de contato das soluções de revestimento e dos compostos de referência sobre a superfície dos filés de pescado, bem como as tensões superficiais dos revestimentos;•
Verificar se o método de Zisman pode ser aplicado as superfícies dos filés de pescado;•
Determinar os coeficientes de adesão (Wa), coesão (Wc), bem como acapacidade molhante (WS) das soluções de revestimentos comestíveis a base de polissacarídeos e de proteínas a serem aplicados em filés de pescado;
•
Realizar análise estatística de Tukey ( =0,05) dos dados dos coeficientes de adesão (Wa), coesão (Wc) e de espalhamento (WS);3 FUNDAMENTAÇÃO TEÓRICA
3.1 Produção Mundial de Pescado
Cada vez mais o pescado tem tido destaque na produção e na economia mundial. Isso se deve ao crescimento populacional mundial, bem como o aumento da renda e o processo de urbanização ao longo dos anos, os quais têm influenciado de forma significativa a demanda por produtos alimentícios. Segundo o Ministério da Pesca e Aqüicultura – MPA (2014), “Mercado é o que não falta. O consumo de pescado está em alta no mundo inteiro. O pescado é um alimento saudável e cada vez mais procurado pela população, em todas as faixas de renda [...]”.
Nas últimas cinco décadas, a produção mundial de pescado tem crescido constantemente, sendo que a oferta de alimentos do pescado tem aumentado a uma taxa média anual de 3,2 %, ultrapassando o crescimento da população mundial em 1,6% (FAO, 2014). A Figura 1 representa a produção mundial de pesca de captura e aqüicultura.
Figura 1 – Produção mundial de pesca de captura e aqüicultura.
Nesse contexto, o próprio MPA (2011) também menciona que a produção mundial de pescado, incluindo tanto a pesca extrativa quanto a aqüicultura, atingiu em torno de 168 milhões t no ano de 2010. Os países que mais se destacaram nessa produção foram: a China (63,5 milhões t), a Indonésia (11,7 milhões t), a índia (9,3 milhões t) e o Japão (5,2 milhões t). Já o Brasil contribuiu com apenas 0,75% (1.264.765 t), ocupando a 19º colocação, estando entre os vinte maiores produtores mundiais. A Tabela 1 representa a produção total de pescado (em toneladas, t) dos 20 maiores produtores em 2009 e 2010.
Tabela 1 – Produção de pescado (t) dos 20 maiores produtores em 2009 e 2010.
Produção % Produção %
1º China 60.474.939 36,95 63.495.197 37,69 2º Indonésia 9.820.818 6,00 11.662.343 6,92 3º índia 7.865.598 4,81 9.348.063 5,55 4º Japão 5.465.155 3,34 5.292.392 3,14 5º Filipinas 5.083.218 3,11 5.161.720 3,06 6º Vietnã 4.870.180 2,98 5.127.600 3,04 7º Estados Unidos 4.710.653 2,88 4.874.183 2,89 8º Peru 6.964.446 4,26 4.354.480 2,59 9º Rússia 3.949.267 2,41 4.196.539 2,49 10º Mianmar 3.545.186 2,17 3.914.169 2,32 11º Chile 4.702.902 2,87 3.761.557 2,23 12º Noruega 3.486.277 2,13 3.683.302 2,19 13º Coréia do Sul 3.201.134 1,96 3.123.204 1,85 14º Tailândia 3.287.370 2,01 3.113.321 1,85 15º Bangladesh 2.885.864 1,76 3.035.101 1,80 16º Malásia 1.874.064 1,15 2.018.550 1,20 17º México 1.773.713 1,08 1.651.905 0,98 18º Egito 1.092.889 0,67 1.304.795 0,77 19º Brasil 1.240.813 0,76 1.264.765 0,75 20º Espanha 1.184.862 0,72 1.221.144 0,72
2009 2010
Posição País
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011) com Adaptações.
Além disso, no mesmo ano, em todo o mundo, 15 países se destacaram na produção aquícola. Esses países produziram juntos em sua totalidade um percentual de 92,7%. Deste percentual total, 61,7% foi produzida somente pela China, a 1ª colocada no ranking mundial. Já o Brasil, ocupando a 12ª posição no ranking, produziu 1,1% (FAO, 2014). A Figura 2 ilustra a produção aquícola mundial por esses 15 maiores produtores.
Figura 2 – Produção aquícola mundial pelos 15 maiores produtores em 2012.
Ademais, segundo um levantamento preliminar de 2013, atualmente o Brasil produz aproximadamente 2 milhões de toneladas de pescado, sendo 40% destinado a cultivados. A atividade proporciona um PIB pesqueiro de R$ 5 bilhões, mobilizando 800 mil profissionais entre pescadores e aquicultores, proporcionando 3,5 milhões de empregos diretos e indiretos. O País possui um enorme potencial, podendo se tornar um dos maiores produtores mundiais de pescado (MPA, 2014). “A aqüicultura cresce sem precedentes e se desponta como o principal vetor de produção de pescado para a alimentação da humanidade nas próximas décadas [...]” (REVISTA DA ABCC, 2014).
3.2 Produção Nacional de Pescado
No ano de 2011, a produção de pescado nacional foi de 1.431.974,4 t, compreendendo um incremento aproximado de 13,2% em relação a 2010. A pesca extrativa marinha permaneceu como a principal fonte de produção de pescado nacional, sendo responsável por 553.670,0 t (38,7% do total de pescado), seguida pela aquicultura continental (544.490,0 t; 38,0%), pesca extrativa continental (249.600,2 t; 17,4%) e aquicultura marinha (84.214,3 t; 6%). A região Nordeste, no ano de 2011, permaneceu registrando a maior produção de pescado do País, com 454.216,9 t, respondendo por 31,7% da produção nacional.
Em se tratando da pesca extrativa marinha, a região Nordeste no ano de 2011 manteve-se como o maior responsável pela parcela da produção nacional, com 186.012,0 t. Os Estados da Bahia (59.293,0 t), Maranhão (44.599,0 t) e Ceará (21.788,0) registraram a maior produção, ocupando o primeiro, segundo e terceiro colocados, respectivamente.
Tabela 2 – Representação simplificada, em termos de produção de pescado (t), tanto na pesca extrativa marinha quanto na continental, pelos Estados da Bahia, Maranhão e Ceará.
Estado Produção (t) Estado Produção (t)
1º Bahia 59.293,00 Maranhão 25.743,50
2º Maranhão 44.599,00 Bahia 17.508,40
3º Ceará 21.788,00 Ceará 11.307,10
Pesca Extrativa Marinha Pesca Extrativa Continental Posição
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011) com Adaptações.
Na produção aquícola marinha, a região Nordeste, em 2011, destaca-se como o maior produtor de pescado, contribuindo com 77,4% da totalidade, assim como foi observado nos três anos antecedentes. O Ceará (29.095,4 t) detém a liderança, enquanto que os estados do Rio Grande do Norte (22.299,7 t) e Santa Catarina (18.621,5 t) ocupam a segunda e terceira posições, respectivamente. A Tabela 3 representa a produção de pescado (t) da aqüicultura marinha em 2011, pelos estados do Ceará, Rio Grande do Norte e Santa Catarina.
Tabela 3 – Produção aquícola marinha (t) no ano de 2011, pelos estados do Ceará, Rio Grande do Norte e Santa Catarina.
Estado
1º Ceará
2º Rio Grande do Norte 3º Santa Catarina
29.095,40 22.299,70 18.621,50
Produção Aquícola Marinha Produção (t) Posição
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011) com Adaptações.
Tabela 4 – Produção de pescado (t) da aqüicultura marinha brasileira pela malacocultura e carcinicultura.
1º Camarão 65.670,60 2º Mexilão 15.989,90
3º Ostra 2.538,40
4º Vieira 13,40
Carcinicultura
Malacocultura
Posição Espécie Produção (t) Tipo de Cultura
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011) com Adaptações.
A produção aquícola nacional de origem continental cresceu significativamente do ano de 2010 para 2011, representando um incremento de 38%, corroborando consistentemente com o crescimento desse setor da aqüicultura. A Figura 3 ilustra a produção de pescado (t) da aqüicultura continental no período de 2009 a 2011.
Figura 3 – Produção de pescado (t) da aqüicultura continental no período de 2009 a 2011.
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011).
A tilápia (253.824,2 t) e o tambaqui (111.084,1 t) compreendem as espécies mais cultivadas. As duas juntas somam 67% de toda a produção nacional do pescado nesta modalidade. Neste cenário, também merecem destaque a produção de tambacu (49.818,0 t), carpa (38.079,1 t) e pacu (21.689,3), as quais somam 20,1% do total produzido. A Tabela 6 apresenta a produção de pescado (t) da aqüicultura continental por espécie no ano de 2011.
Tabela 5 - Produção aquícola continental dos estados do Ceará, Maranhão, Bahia e Piauí no período de 2011.
Estado 1º Ceará 2º Maranhão 3º Bahia 4º Piauí 20.703,60 17.000,70
Posição Produção Aquícola Continental Produção (t)
36.066,30 32.238,00
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011) com Adaptações.
Tabela 6 - Produção de pescado (t) da aqüicultura continental por espécie no ano de 2011. Espécie 1º Tilápia 2º Tambaqui 3º Tambacu 4º Carpa 5º Pacu
Posição Produção Aquícola Continental Produção (t) 253.824,20 111.084,10 49.818,00 38.079,10 21.689,30
Fonte: Ministério da Pesca e Aqüicultura, MPA (2011) com Adaptações.
3.3 Produção de Tilápia do Nilo e de Camarão
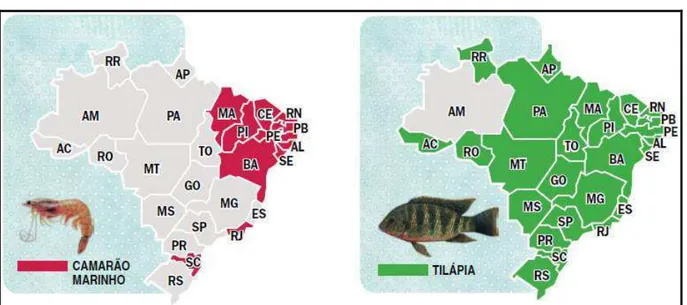
Mediante ao cenário apresentado da produção do pescado, tanto o mundial (seção 3.1) quanto nacional (seção 3.2), é que se pode dar destaque da representatividade dos pescados: tilápia do Nilo (Oreochromis niloticus) e o camarão (Litopenaeus vannamei), os quais compreendem espécies de suma relevância para o desenvolvimento, não apenas da economia brasileira, mas também para a economia cearense. Segundo o ANUÁRIO BRASILEIRO DA PESCA E AQUICULTURA (2014), “a região Nordeste, a preferência é pela tilápia e pelo camarão marinho”. A Figura 4 ilustra os estados produtores de cada espécie no quadro atual brasileiro.
Figura 4 – Estados produtores de cada espécie no quadro atual brasileiro.
3.3.1 Tilápia do Nilo
A tilápia do Nilo é um peixe de água doce não nativo no Brasil, sendo introduzida no Brasil em 1952. Dentre as diversas espécies, constitui a mais utilizada para o cultivo, pois a mesma apresenta o melhor desempenho, especialmente dos machos. A espécie Oreochromis niloticus é um peixe de origem africana, consiste em um animal rústico e de carne saborosa e possui hábito alimentar planctófago e detritívoro. Em um período de seis a oito meses, este animal pode atingir de 400g a 600g. A reprodução precoce é a maior restrição ao seu cultivo, o que pode gerar superpovoamento de tanques. Porém, a utilização de peixes alevinos machos pode ser a solução para sanar este problema (SEBRAE, 2008). A Figura 5 ilustra a imagem de uma tilápia do Nilo da espécie Oreochromis niloticus.
Figura 5 – Tilápia do Nilo, Oreochromis niloticus.
Fonte: MARTINS (2015).
3.3.2 Camarão
Na atualidade, o Camarão Cinza do Ocidente (Litopenaeus vannamei), espécie nativa da costa sul-americana do Pacífico, é cultivado em todos os países produtores do Ocidente. De maneira geral, apresenta taxa uniforme de crescimento; sendo considerada uma variedade de tamanho médio e de excelente aceitação nos mercados: americano e europeu. A carcinicultura do Brasil explora unicamente esta espécie que, confirmando suas características, adaptou-se bem aos ecossistemas costeiros do país. No ano de 2008, o L. vannamei participou com 16% da produção mundial de camarão cultivado (SEBRAE, 2008). A espécie L. vannamei, apresenta uma capacidade extraordinária de adaptar-se a uma variedade de condições das áreas costeiras tropicais e semitropicais dos continentes, compreendendo a primeira que se adaptou, com produção comercial, as águas de baixa salinidade ou oligohalinas, não somente no Nordeste do País, mas em diversos países do Sudoeste da Ásia, centro mundial produtor de camarão por excelência (REVISTA DA ABCC, 2015). A Figura 6 ilustra a imagem de camarões da espécie Litopenaeus vannamei.
Figura 6 – Camarões, Litopenaeus vannamei.
O Ceará, atualmente, é o principal representante do País, sendo responsável por quase metade da totalidade da produção nacional de camarão. No ano de 2011, respondeu por 35 mil das 75 mil toneladas em todo o Brasil. O Estado é composto por 6.800 produtores, dos quais 70% são de micro e pequeno porte, 20% são de médio porte e apenas 10% de grande porte, gerando nessa atividade 20 mil empregos diretos (ANUÁRIO BRASILEIRO DA PESCA E AQUICULTURA, 2014). No interior da região Nordeste, a produção do camarão (Litopenaeus vannamei) já é uma realidade. Além do Ceará, os estados da Paraíba, Rio Grande do Norte, Sergipe e Pernambuco correspondem os mais representativos pela quantidade de empreendimentos interiorizados e em plena produção (REVISTA DA ABCC, 2015).
3.4 Importância Nutricional e Consumo Per Capita do Pescado
Os peixes e os produtos provenientes da atividade pesqueira destacam-se em termos nutricionais de outros alimentos de origem animal. Afim de comparações, eles são constituídos por uma grande quantidade de micronutrientes como sais minerais e vitaminas: vitaminas lipossolúveis A, D e E, do complexo B (niacina e ácido pantotênico, por exemplo), sódio, potássio, cálcio, magnésio, manganês, fósforo, ferro, cobre, selênio e, no caso dos peixes de água salgada, iodo. O teor de vitaminas e minerais sofre grandes variações dentro dos organismos aquáticos (LARSEN, EILERTSEN e ELVEVOLL, 2011; SARTORI e AMANCIO, 2012; ANUÁRIO BRASILEIRO DA PESCA E AQUICULTURA, 2014).
transformados em prostaglandinas antitrombóticas e devido aos estudos com os eicosanóides, tem-se conhecido suas ações vasculares e hemostáticas. Já o DHA, o maior constituinte da porção fosfolipídica de células receptoras, está altamente presente em grandes concentrações no tecido cerebral e na retina e tem sido demonstrado que está relacionado com o desenvolvimento do cérebro e da visão e da atividade neuronal. Além disso, estudos epidemológicos e pré-clínicos sugerem que o DHA pode ter ação protetora contra a demência, a doença de Alzheimer e a degeneração macular (VICENTAINER et al., 2000; LARSEN, EILERTSEN e ELVEVOLL, 2011; SARTORI e AMANCIO, 2012; ANUÁRIO BRASILEIRO DA PESCA E AQUICULTURA, 2014; FAO, 2014).
Dada a importância do valor nutricional do pescado como fonte de alimento para a saúde e qualidade de vida dos seres humanos é que podemos mencionar um pouco sobre o consumo per capita desse tipo de produto. A China, além de ser o maior produtor mundial é também o país que mais consome pescado no mundo. Somente no ano de 2010 a China consumiu em sua totalidade, 42,5 milhões de t de pescado, apresentando um consumo anual per capita de 31,9 Kg (INFOPESCA, 2014).
Figura 7 – Consumo per capitaversus a produção brasileira de pescado.
Fonte: Anuário Brasileiro da Pesca e Aquicultura(2014).
Nesse contexto, a tilápia do Nilo e o camarão, assim como outros tipos de pescados, além de serem importantes fontes nutricionais para o organismo humano, constituem produtos alimentícios altamente perecíveis, sujeitos tanto a alterações bioquímicas quanto microbiológicas. Por isso, que ao longo dos anos estudos têm sido desenvolvidos com o objetivo de elevar a vida de prateleira de alimentos frescos. Daí a importância dos revestimentos comestíveis tanto como uma ferramenta tecnológica para atingir estes objetivos, como também uma alternativa a utilização de conservantes químicos.
3.5 Revestimentos Comestíveis
de interesse para a indústria alimentícia, pois é um problema de importância econômica e de saúde pública. Embora alguns conservantes sintéticos sejam muito eficientes no aumento da vida útil, somente alguns compostos são aprovados para ser utilizados na indústria de alimentos. As principais preocupações destas aplicações consistem nos seus potenciais carcinogênicos e de toxicidade, e se eles podem ocasionar benefícios ou malefícios. Nesse sentido, numerosos estudos têm-se centrado sobre os ingredientes naturais para a contêm-servação de alimentos. Os revestimentos comestíveis consistem em uma tendência na aplicação em operações de embalagem de alimentos com o objetivo de substituir, pelo menos parcialmente, conservantes químicos tradicionais (HUANG et al., 2012).
Os revestimentos/filmes comestíveis a base de polímeros biodegradáveis têm sido utilizado com o objetivo de minimizar os efeitos da deterioração dos alimentos, incluindo a perda de água, o crescimento microbiano, o escurecimento enzimático, entre outros (GERALDINE et al., 2008). Estes também podem funcionar como portadores de aditivos alimentares, por exemplo, como agentes antimicrobianos e antioxidantes, sabores, corantes e especiarias (PRANOTO, RAKSHIT e SALOKHE, 2005). Ademais, a utilização de revestimentos ou filmes a base de polímeros naturais e em aditivos reconhecidos como seguros têm crescido na indústria alimentar (PINHEIRO et al., 2010).
Diante deste cenário, tem-se investido cada vez mais na utilização de biopolímeros naturais, os quais constituem uma fonte alternativa ao uso de polímeros sintéticos devido à sua biodegradabilidade. Nesse âmbito, os revestimentos comestíveis tem tido destaque, visto que além de constituírem uma fonte biodegradável, estes têm sido empregados como novas fontes alternativas para aumentar a vida de prateleira dos alimentos.
como: ácido acético e ácido lático (BRAVIN, PERESSINI e SENSIDONI, 2006; PINHEIRO et al., 2010; FALGUERA et al., 2011). Ademais, os revestimentos podem incorporar diversos compostos para influenciar as suas características mecânicas, protetoras, sensoriais e nutritivas, funcionando como veículos para a incorporação de aditivos alimentares na superfície dos alimentos, tanto para evitar o crescimento microbiano, como para favorecer as características organolépticas e nutricionais do produto (KESTER e FENNEMA, 1986).
3.6 Revestimentos Comestíveis a Base de Quitosana e de Gelatina
3.6.1 Quitosana
A quitosana, [β -(1,4)-2-amino-2-desoxi-D-glicopiranose], constitui um polissacarídeo natural, que é um derivado parcialmente desacetilado da quitina, a segunda maior fonte de hidratos de carbono da Terra (MUZZARELLI et al., 2012). A Figura 8 abaixo ilustra a representação esquemática da estrutura primária da quitosana. O quitosano não é apenas uma unidade química única e definida, mas sim uma família de polissacarídeos que apresentam variedade entre si na sua composição e tamanho molecular (SANTOS, 2006).
Figura 8 – Representação esquemática da estrutura primária da quitosana.
Fonte: ASSIS e BRITTO, 2008.
A quitosana é insolúvel em água, porém forma soluções viscosas em vários ácidos orgânicos, sendo solúvel em ácidos diluídos, tais como: ácidos acético, fórmico, lático, entre outros (PARK, MARSH e RHIM, 2002; SANTOS, 2006). O ácido acético tem sido utilizado continuamente na produção de filmes/revestimentos de quitosana (CANER, VERGANO e WILES, 1998), no entanto, tem conferido forte sabor ácido e aroma aos alimentos nos quais é utilizado. O ácido lático tem sido usado ao invés do ácido acético, pois possui sabor e aroma mais fraco. (FORERO, 2001 apud CASARIEGO et al., 2008).
A quitosana consiste em um polímero biocompatível e biodegradável derivado de fontes naturais com várias aplicações em diversos campos, e uma das áreas de destaque são o ramo dos filmes e revestimentos comestíveis. Os materiais à base de quitosano podem ser utilizados como filmes/revestimentos, devido à sua propriedade única de aumento da viscosidade após a hidratação. Os filmes de quitosana são resistentes, de longa duração, flexíveis e de difícil quebra. A maioria das propriedades mecânicas desse tipo de filme é comparável ao de muitos polímeros comerciais de força média. Este biopolímero apresenta propriedades antibacterianas e antifúngicas que o qualifica para a proteção de produtos alimentícios. (CERQUEIRA et al., 2010; ELSABEE e ABDOU, 2013).
Na indústria alimentar, a quitosana propicia uma ampla gama de aplicações, tais como: agente antimicrobiano, como polímero na formação de filmes biodegradáveis, no tratamento de água e como agentes emulsificante e estabilizante, enfocando-se na sua capacidade quanto à manutenção da qualidade microbiológica do alimento (BORGOGNONI, POLAKIEWICZ e PITOMBO, 2006). Além disso, o efeito dos revestimentos a base de biopolímeros de quitosana sobre a vida de prateleira em pescado têm sido investigado (GÓMEZ-ESTACA et al., 2010; SOUZA et al., 2010; MOHAN et al., 2012, HUANG et al., 2012).
3.6.2 Gelatina
Figura 9 – Estrutura básica da gelatina.
Fonte: SMITHA et al. (2007).
Em todo o mundo, o volume anual de gelatina utilizada na indústria alimentar é significativamente considerável e crescente. A gelatina é utilizada não apenas pelas suas propriedades funcionais, mas também para elevar o teor de proteína dos produtos alimentícios, podendo funcionar como um filme externo para a proteção contra desidratação, luz e oxigênio. A qualidade da gelatina de grau alimentício, entretanto, depende das suas propriedades reológicas, principalmente viscosidade e força gel. Porém, também é determinada por outras características, tais como: cor, transparência, sabor/flavor e pela facilidade de dissolução (MONTERO e GÓMEZ-GUILLÉN, 2000).
3.7 Plastificantes
Os filmes e revestimentos podem ser produzidos por uma ampla gama de produtos, tais como: polissacarídeos, proteínas, lipídios, resinas, com o acréscimo de plastificantes e surfactantes (PINHEIRO et al., 2010).
Na maioria dos casos, os plastificantes constituem elementos importantes para os filmes e revestimentos comestíveis, em particular para os polissacarídeos e as proteínas. Estas estruturas de filmes são freqüentemente duras e quebradiças em virtude das intensas interações entre as moléculas do polímero. Nesse contexto, os elementos plastificantes consistem em agentes de baixo peso molecular que incorporados aos materiais poliméricos formadores de filmes, reduzem a temperatura de transição vítrea dos polímeros. Os plastificantes são agentes capazes de se posicionar entre as moléculas do polímero, interferindo com as interações polímero-polímero e originando uma maior flexibilidade e capacidade de processamento. Os plastificantes podem aumentar o volume livre das estruturas poliméricas ou a mobilidade molecular das moléculas do polímero. Estas propriedades sugerem que os plastificantes reduzem a proporção de regiões cristalinas em relação às amorfas, diminuindo a temperatura de transição vítrea. A incorporação de plastificantes influencia não apenas o módulo da elasticidade e de outras propriedades mecânicas, mas também na resistência dos filmes/revestimentos à permeabilidade a vapores e a gases (PINHEIRO et al., 2010; HAN e GENNADIOS, 2005).
Além da água, Han e Gennadios (2005) mencionam diversos outros materiais que podem ser utilizados como elementos plastificantes na composição de filmes/revestimentos comestíveis, tais como: glicerina (glicerol), propilenoglicol, sorbitol, sacarose, polietilenoglicol, xarope de milho. Além disso, infere-se ainda que, na literatura, diversos autores têm incorporado plastificantes na composição dos filmes/revestimentos comestíveis (SOTHORNVIT e KROCHTA, 2000; SOTHORNVIT e KROCHTA, 2001; RIBEIRO, 2005; BRAVIN, PERESSINI e SENSIDONI, 2006; RIBEIRO et al., 2007; CASARIEGO et al., 2008; CERQUEIRA et al., 2010; LIMA et al., 2010; MARTINS et al., 2010; NOWZARI, SHÁBANPOUR e OJAGH, 2013; COZMUTA et al., 2015).
3.8 Estudo dos Fenômenos de Superfície
3.8.1 Estudo da Capacidade Molhante
A capacidade molhante de um sólido por um líquido é determinada pelo balanço entre as forças adesivas (coeficiente de adesão, Wa, equação [1]) do líquido no sólido e as forças coesivas (coeficiente de coesão, Wc, equação [2]) do líquido. Enquanto que as forças adesivas promovem o espalhamento do líquido sobre a superfície sólida, as forças coesivas fazem com que o fluido se contraia (RIBEIRO, 2005; RIBEIRO et al., 2007; CERQUEIRA et al., 2009; CERQUEIRA et al., 2010; LIMA et al., 2010; MARTINS et al., 2010; SOUZA et al., 2010).
SL SV LV a
W =γ +γ −γ Eq. (1) WC = 2×γLV Eq. (2)
sólida é definido pelo equilíbrio mecânico da gota sob a ação de três tensões interfaciais (linha de contato trifásico): sólido-vapor (γSV), sólido-líquido (γSL) e líquido-vapor (γLV), (RIBEIRO, 2005; YUAN e LEE, 2013).
Figura 10 – Esquema representativo das três tensões interfaciais existentes em um sistema trifásico, em que duas fases são condensadas.
Fonte: Próprio autor.
Esta relação de equilíbrio é conhecida como equação de Young (RULON e ROBERT, 1993 apud RIBEIRO, 2005):
(
)
LV SL SV
γ γ γ
θ = −
cos Eq. (3)
A equação de Young fornece uma definição termodinâmica do ângulo de contato. No entanto, a sua verificação experimental é dificultada pelo fato dos valores de γSL e γSV não poderem ser determinados diretamente. Geralmente, assume-se que a superfície sólida em questão é lisa ou plana, ausente de qualquer tipo de irregularidades. Porém, em regra geral isso não ocorre. Sabendo disso, visando minimizar os problemas relacionados das irregularidades das superfícies, é que se determinam várias medidas de ângulo de contato para que se possa garantir a fidelidade dos resultados obtidos.
ou não molhante (θ > 0º). Este termo denomina-se coeficiente de espalhamento (WS).
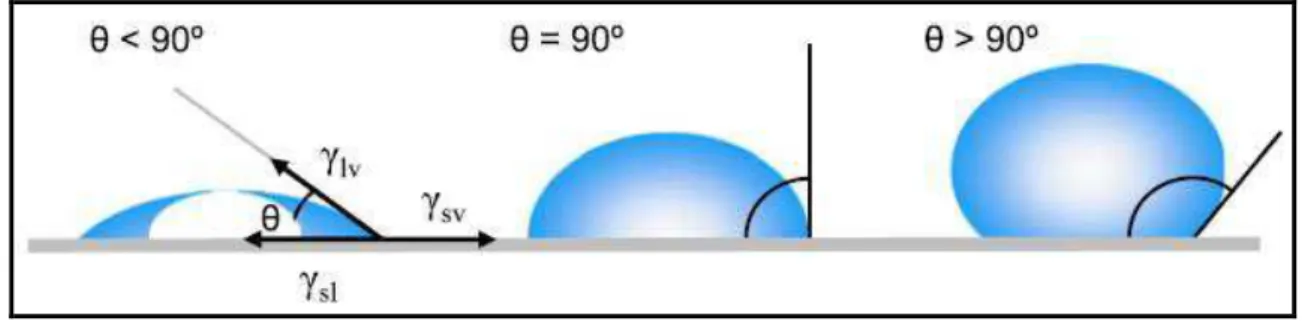
Yuan e Lee (2013) mencionam que, mais especificamente, um ângulo de contato inferior a 90º indica que o umedecimento da superfície é favorável, e o fluido irá espalhar-se sobre uma grande área na superfície, enquanto que ângulos de contato superiores a 90º, em geral, significam que o umedecimento da superfície é desfavorável de modo que o fluido irá minimizar o seu contato com a superfície e formará uma gota de líquido compacta. Por exemplo, o umedecimento completo ocorrerá quando o ângulo de contato for de 0º. Para superfícies hidrofóbicas, o ângulo de contato da água é superior a 150º, mostrando ausência de contato entre a gota líquida e a superfície, o que pode racionalizar o “efeito de lótus”. A Figura 11 ilustra ângulos de contato formado por uma gota de líquido séssil em uma superfície sólida homogênea.
Figura 11 – Ângulos de contato formado por uma gota de líquido séssil em uma superfície sólida homogênea.
Fonte: YUAN e LEE (2013).
externas como a gravidade deformam a gota; Por conseguinte, o ângulo de contato é determinado por uma combinação da tensão superficial e forças externas normalmente (gravidade). Teoricamente, o ângulo de contato deverá ser característica para um dado sistema sólido-líquido em um ambiente específico (YUAN e LEE, 2013). A Figura 12 mostra que o desequilíbrio das forças de moléculas do líquido na superfície ocasiona o fenômeno da tensão superficial.
Figura 12 – O desequilíbrio das forças de moléculas do líquido na superfície ocasiona o fenômeno da tensão superficial.
Fonte: YUAN e LEE, 2013.
Quando um sólido entra em contato com um líquido na presença de vapor, a interação do líquido com a superfície sólida será termodinamicamente favorável, se a energia livre (∆G) necessária para a formação de uma nova interface é reduzida, isto é, o trabalho necessário para separar o sólido e o líquido da interface sólido-líquido terá que diminuir. O coeficiente de espalhamento (WS) no equilíbrio é definido pela equação [4]; para que o espalhamento ocorra espontaneamente a energia livre do processo (ΔG), dada pelo produto do coeficiente de espalhamento (WS) pela área de superfície (A), terá que ser inferior à zero, segundo a equação 5 (RULON e ROBERT, 1993 apud RIBEIRO, 2005).
SL LV SV c a
S W W
W = − =γ −γ −γ Eq. (4) ∆G=WS ×A Eq.(5)
3.8.2 Tensão Superficial Crítica
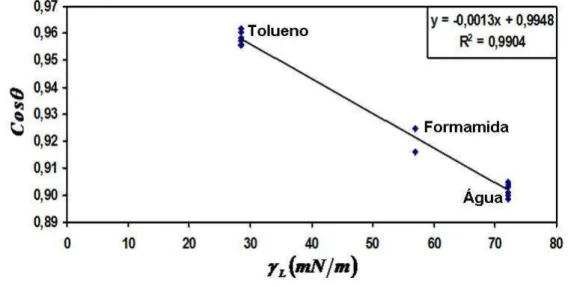
Zisman (1964) desenvolveu um método prático que visa caracterizar a capacidade molhante de superfícies sólidas. O sistema é baseado na observação de que em superfícies sólidas com uma tensão superficial inferior a 100 mN/m, geralmente classificadas como superfícies de baixa energia, o ângulo de contato formado por uma gota de líquido na superfície sólida seria função aproximadamente linear de γLV (onde a fase V é ar saturado com o vapor do líquido). Para líquidos não polares esta relação é linear. Porém, para líquidos polares observa-se uma ligeira curvatura.
Construindo um gráfico cosθ versus γLV poderá obter-se o valor da tensão superficial do líquido para o qual cosθ =1. Este valor denomina-se tensão superficial crítica do processo de umedecimento (γC), sendo definido como o valor de γLV de um líquido abaixo do qual o espalhamento desse líquido em determinada superfície sólida é completo. Segundo Daltin (2011), a tensão superficial crítica (TSC) é uma característica de cada material. O referido autor também menciona que, caso a tensão superficial do líquido seja inferior a TSC, o líquido se espalhará sobre a superfície, ocasionando a molhabilidade. Porém, se a tensão superficial do líquido for superior a TSC, o líquido formará gotas na superfície, com ângulo de contato diferente de zero.
A determinação da tensão superficial crítica é bastante atraente, uma vez que permite caracterizar a superfície sólida em estudo de uma forma bastante prática (ZISMAN, 1964).
3.8.3 Método de Zisman para o Estudo de Superfícies em Filés de Tilápia do Nillo (Oreochromis niloticus) e do Camarão (Litopenaeus vannamei)
Conforme referenciado, o método de Zisman é aplicável apenas em superfícies consideradas de baixa energia, condição esta, necessária para se determinar a tensão superficial da tilápia do Nilo (Oreochromis niloticus) e do camarão (Litopenaeus vannamei) visando garantir a aplicabilidade deste método.
dos tipos de interações intermoleculares, sendo estas as interações polares e dispersivas. A contribuição polar e dispersiva na tensão superficial são então somadas, obtendo-se:
p L d L L γ γ
γ = + Eq. (6) e p
S d S S γ γ
γ = + Eq. (7)
Assim sendo, para determinado líquido puro cuja tensão superficial dispersiva e polar são conhecidas, e sendo θ o ângulo de contato do líquido em determinado sólido, a interação pode ser descrita em termos de coeficientes de adesão reversível, Wa, isto é:
) .( 2 p L p S d L d S a p a d a
a W W W
W = + ⇔ = γ +γ + γ +γ Eq. (8)
onde p S γ e d
S
γ são as contribuições polares e dispersivas do sólido a ser estudado. Combinando esta relação com as equações 1 e 3 (apresentadas na seção 3.8.1), obtém-se: d S d L p L p S d L L γ γ γ γ γ γ
θ × = × +
+ 2 cos 1
Eq. (9)
3.9 Eficiência do Revestimento
A eficiência dos revestimentos comestíveis nos frutos e legumes, assim como em pescado, depende principalmente do controle da capacidade molhante das soluções formadoras de revestimentos afetando a espessura do revestimento (PARK, 1999; SOUZA et al., 2010).
produtos, torna-se fundamental para que haja a correta aplicação desses revestimentos (PINHEIRO et al., 2010).
O processo de revestimento consiste no molhamento do produto a ser revestido com a solução de revestimento [...] (HERSHKO, KLEIN e NUSSINOVITCH, 1996), e a tensão superficial ou energia de superfície é um fator de controle nos processos envolvendo a molhabilidade e a superfície do revestimento (HONG, HAN, e KROCHTA, 2004).
3.10 Caracterização de Vários Materiais Através do Estudo das Propriedades de Superfícies
A caracterização de vários outros materiais por meio do estudo das propriedades de superfície tem sido relatada por diversos pesquisadores. A Tabela 7 apresenta de forma resumida os valores de tensão superficial crítica e os valores de tensão superficial reportados na literatura para diversos materiais.
Tabela 7 – Tensão superficial crítica e tensão superficial para diversos materiais.
Amostra Tensão Superficial Crítica (mN/m)
Tensão Superficial
(mN/m)
Temperatura
(ºC) Autores
Morango 18,84 28,94 19,0 ± 1 (1)
Tomate 17,4 28,71
20,0 ± 1 (2)
Cenoura 24,1 26,48
Acerola 9,39 27,94
21,3 ± 0,5 (3)
Cajá 23,92 30,15
Manga 22,68 29,04
Pitanga 13,42 26,95
Seriguela 19,62 31,48
Manga 19,5 26,48
20,0 ± 1 (4)
Maçã 25,4 27,81
Salmão (Salmo
Salar) 30,13 60,64 21,1 ± 0,4 (5)
Fonte: Dados adaptados de (1) RIBEIRO et al., 2007; (2) CASARIEGO et al., 2008; (3) CERQUEIRA et al., 2009; (4) LIMA et al., 2010; (5) SOUZA et al., 2010.
4 METODOLOGIA
4.1 Obtenção do Pescado
4.1.1 Tilápia do Nilo (Oreochromis niloticus)
Os exemplares de filés tilápia do Nilo utilizados nesta pesquisa foram comprados em um supermercado de Fortaleza, Ceará, Brasil. Esses exemplares foram devidamente acondicionados em um freezer do Laboratório de Tecnologia da Biomassa (LTB) da Embrapa Agroindústria Tropical até posterior uso.
4.1.2 Camarão (Litopenaeus vannamei)
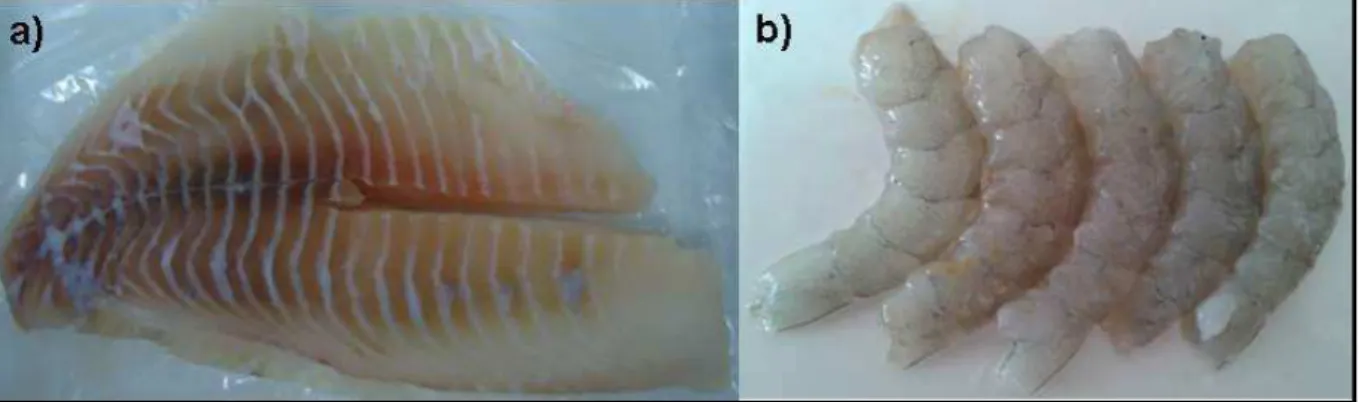
Os exemplares de Camarão (Litopenaeus vannamei) foram obtidos do Mercado de Peixe de Fortaleza, Ceará, Brasil. Após a obtenção, os camarões foram cuidadosamente acondicionados em gelo e transportados para o Laboratório de Tecnologia da Biomassa (LTB) da Embrapa Agroindústria Tropical. Os exemplares foram limpos em água corrente, filetados e armazenados em sacos estéreis e mantidos refrigerados até posterior uso. A Figura 13 ilustra as amostras de filés de pescado utilizados neste estudo.
Figura 13 – Imagem das amostras de filés de pescado utilizado neste estudo: (a) Tilápia do Nilo e (b) Camarão.
4.2 Biopolímeros Utilizados
4.2.1 Biopolímero de Quitosana
A quitosana utilizada para preparação das soluções de revestimentos nessa pesquisa de dissertação foi a quitosana comercial (Marca Polymar) com um grau de desacetilação de 95,1%. A Figura 14 ilustra a imagem do biopolímero de quitosana utilizada neste estudo.
Figura 14 – Quitosana Comercial.
Fonte: Próprio Autor.
4.2.2 Biopolímero de Gelatina de Escama a partir da Pele de Tilápia do Nilo (Oreochromis niloticus)
representa o fluxograma simplificado do procedimento de extração de gelatina de escama de tilápia (Oreochromis niloticus) proposto por Martins (2015).
Figura 15 – Fluxograma simplificado do procedimento de extração de gelatina de escama de tilápia (Oreochromis niloticus).
4.3 Preparação dos Revestimentos
4.3.1 Revestimentos de Quitosana
As soluções de revestimento a base de quitosana foram preparadas em diferentes concentrações de quitosana e de plastificante. Glicerina (Glicerol, Marca VETEC, 99,5%) PA ACS foi utilizada como plastificante na preparação das soluções. Ácido Lático (Marca VETEC, 84,4-85,5%) também foi utilizado no preparo das soluções.
As soluções de revestimentos foram preparadas dissolvendo a quitosana em uma solução 1% (v/v) de ácido lático, adicionando em seguida o plastificante. As soluções previamente preparadas foram submetidas à agitação, utilizando um agitador magnético durante um período de 2 horas a uma temperatura ambiente de 20ºC, ±1ºC (CASARIEGO et al., 2008; CERQUEIRA et al., 2009; SOUZA et al., 2010; MARTINS et al., 2010). Os revestimentos de quitosana preparados diferiram tanto no teor de quitosana quanto no teor de plastificante conforme a Tabela 8.
Após a preparação das soluções mencionadas, efetuaram-se posteriormente as análises descritas na seção 4.4. Considerando os valores descritos de capacidade molhante obtidos para as diferentes soluções, foi selecionado o revestimento que apresentou o melhor valor do coeficiente de espalhamento (WS).
4.3.2 Revestimentos de Gelatina
Tabela 8 – Teor de biopolímero (quitosana ou gelatina) e plastificante utilizado no preparado das soluções de revestimentos.
Quitosana / Gelatina Glicerol
1 1,0 0,0
2 1,0 0,1
3 1,0 0,2
4 1,5 0,0
5 1,5 0,1
6 1,5 0,2
7 2,0 0,0
8 2,0 0,1
9 2,0 0,2
% (m/v) Solução
Fonte: Próprio autor.
4.4 Propriedades dos Revestimentos Comestíveis: Capacidade Molhante
Todos os revestimentos desenvolvidos na seção 4.3, bem como os compostos de referência (puros): Formamida (Marca VETEC, 99,5%) PA e Tolueno (Toluol – Marca VETEC, 99,5%) e Água Milli-Q foram testados.
As tensões superficiais das várias soluções de revestimento testadas foram determinadas por meio da utilização do Tensiômetro TD1C LAUDA (Alemanha), utilizando-se como princípio de medição o Método do Anel de Platina (Método Du Nouy). Este procedimento foi repetido 20 vezes para cada solução em estudo. A Figura 16 ilustra o equipamento utilizado nos ensaios de tensão superficial das soluções testadas.
Figura 16 – Equipamento utilizado nos ensaios de tensão superficial das soluções testadas.
As amostras do revestimento, bem como os compostos puros mencionados foram retiradas com uma seringa de vidro de 1 mL (Fortuna® Optima) sendo o diâmetro da agulha (0,815 mm) determinado com um micrômetro digital 0-25mm (Mitutoyo, Japan) com precisão de 0,001mm.
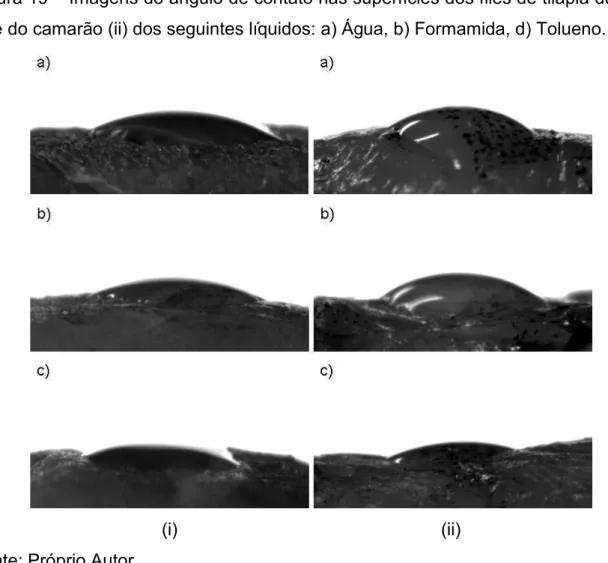
Na determinação do ângulo de contato utilizou-se como amostras os filés de tilápia do Nilo (Oreochromis niloticus) e o camarão (Litopenaeus vannamei). Para cada amostra dos filés eram retiradas seções retangulares, os quais eram fixados a uma placa de petri. Após a fixação das amostras, era realizada a gravação de vídeos do gotejamento de cada solução na superfície do filé de pescado. Os vídeos eram realizados através da câmera pixeLink Nikon, o qual é acoplada ao medidor de ângulo de contato GBX Instrumentation Scientifique. Após a gravação dos vídeos, a medição do ângulo de contato era realizada no momento em que a gota se fixava na superfície do filé de pescado. A medição dos ângulos de contato se deu de duas formas: Na primeira, efetuou-se as medições em um software de domínio público ImageJ; Na segunda, as medições foram efetuadas no próprio equipamento GBX Instrumentation Scientifique . As Figuras 17 e 18 ilustram o software ImageJ e o medidor de ângulo de ângulo de contato GBX Instrumentation Scientifique, respectivamente.
Figura 17 – Imagem do software ImageJ.
Figura 18 – Equipamento utilizado na medição do ângulo de contato.
Fonte: Próprio autor.
Os experimentos referentes à quitosana em filés de camarão e gelatina de escama em filés de tilápia, bem como os ensaios com os compostos puros em ambos os filés, se deu no software de domínio público ImageJ. A determinação do ângulo de contato de cada imagem de cada solução e de cada composto puro por intermédio deste software foi efetuada em triplicata. Já os experimentos referentes á quitosana na tilápia e gelatina de escama no camarão, as medições foram efetuadas no próprio medidor de ângulo de contato GBX Instrumentation Scientifique por intermédio do software Visiodrop deste equipamento, utilizando o método polinomial como forma de medição.