CENTRO DE CIÊNCIAS DEPARTAMENTO DE BIOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA E RECURSOS NATURAIS
FREDERICO ALEKHINE CHAVES GARCIA
ASSEMBLEIA DE MACROINVERTEBRADOS EM POÇAS TEMPORÁRIAS DE CLIMA SEMIÁRIDO
ASSEMBLEIA DE MACROINVERTEBRADOS EM POÇAS TEMPORÁRIAS DE CLIMA SEMIÁRIDO
Dissertação submetida à Coordenação do Curso de Pós-Graduação em Ecologia e Recursos Naturais, da Universidade Federal do Ceará como requisito parcial para a obtenção do grau de mestre Ecologia e Recursos Naturais.
Área de concentração: Ecologia
Orientador: Prof. Dr. José Roberto Feitosa Silva
ASSEMBLEIA DE MACROINVERTEBRADOS EM POÇAS TEMPORÁRIAS DE CLIMA SEMIÁRIDO
Dissertação submetida à Coordenação do Curso de Pós-Graduação em Ecologia e Recursos Naturais, da Universidade Federal do Ceará como requisito parcial para a obtenção do grau de mestre Ecologia e Recursos Naturais. Área de concentração: Ecologia
Aprovada em ____/____/_____
BANCA EXAMINADORA
Prof. Dr. José Roberto Feitosa Silva (Orientador) Universidade Federal do Ceará (UFC)
Prof. Dr. Luiz Felipe Mendes de Gusmão Universidade Federal de São Paulo (UNIFESP)
AGRADECIMENTOS
A Deus, pelo amor com que me conduziu durante todo tempo.
Aos meus orientadores, pela imensa paciência dispensada a mim.
Aos familiares e amigos, pelo apoio incondicional nos momentos mais difíceis.
À minha companheira, pela ajuda prestada durante todo o percurso.
Aos amigos e colegas de curso, pelos momentos de companheirismo e reflexões ao longo da caminhada acadêmica.
“A única coisa criada para a qual não podemos olhar é a única coisa em cuja luz olhamos para tudo. (Como o sol ao meio-dia, o misticismo explica todas as outras coisas por meio da luz ofuscante de sua vitoriosa invisibilidade). O intelectualismo independente é (no sentido exato da frase popular) só brilho de lua; pois é luz sem calor, e é luz
As poças temporárias são ambientes lênticos presentes em todos os biomas do mundo, abrigando espécies de animais adaptadas a secas recorrentes. Este trabalhou objetivou descrever a assembleia de macroinvertebrados em poças temporárias do semiárido e relacioná-las à sazonalidade, fatores abióticos, interações bióticas e diferentes estratégias de vida. Para isso, foram amostradas 22 poças no município de Itapipoca-Ce. Elas tiveram suas variáveis abióticas mensuradas e macroinvertebrados coletados nos períodos de cheia e de seca. A sazonalidade possuiu influência fundamental na assembleia de macroinvertebrados, enquanto as variáveis abióticas e as interações bióticas com os peixes não mostraram efeito significativo na composição de macroinvertebrados.
Rock pools are lentic water environments that occur all over the world, hosting animal species adapted to recurrent droughts. The present study aimed to describe macroinvertebrate assemblages in semiarid rockpools and relate them to seasonality, abiotic factors, biotic interactions with fish and different life-strategies. 22 rock pools were sampled in Itapipoca-CE. Their abiotic variables were measured and macroinvertebrate were collected in each rock pool. This procedure was performed in flood and dry periods. Seasonality had large influence on macroinvertebrate assemblages, but abiotic factors and biotic interaction with fish had no significant effects on macroinvertebrate composition.
1 INTRODUÇÃO ... 8
1.1 Objetivo Geral ... 16
1.2 Objetivos Específicos ... 16
2 MATERIAL E MÉTODOS ... 17
2.1 Área de estudo ... 17
2.2 Caracterização física da poça ... 18
2.3 Parâmetros físico-químicos ... 19
2.4 Coleta de macroinvertebrados aquáticos ... 19
2.5 Análises estatísticas ... 20
3 RESULTADOS ... 22
4 DISCUSSÃO ... 30
5 CONCLUSÕES ... 35
6 CONSIDERAÇÕES FINAIS ... 36
7 PERSPECTIVAS FUTURAS ... 37
REFERÊNCIAS ... 37
APÊNDICE A ... 45
1 Introdução
Os ambientes de água doce ocupam menos de 1% da superfície da terra e representam 0,01% do total de água no planeta. Entretanto, são o habitat de pelo menos 100.000 espécies (quase 6% de todas descritas), o que os caracterizam como local de grande biodiversidade (Strayer; Dudgeon, 2010). Além disso, eles proporcionam benefícios aos seres humanos, como disponibilidade de água potável e para irrigação e indústria (Dudgeon et al., 2006).
Os ambientes aquáticos são classificados em lóticos e lênticos. O primeiro tipo corresponde a rios e riachos (corpos d’água com fluxo de água contínuo e unidirecional da nascente até a foz, descarregando no mar ou em outro rio). Esse fluxo influencia o transporte e alimentação dos organismos e é um fator importante na estrutura de comunidades aquáticas (Lampert; Sommer, 2007).
Os ambientes lênticos, como lagos e lagoas, não possuem fluxo unidirecional de água. Isso faz com que haja uma estratificação dos componentes abióticos ao longo da coluna d´água. Este gradiente leva a uma heterogeneidade na composição biótica do ambiente.
Dentre os ambientes lênticos, destacam-se as poças temporárias, formadas por depressões que eventualmente podem apresentar água devido às condições hidrológicas. Esse tipo de ambiente é encontrado com alguma variação em todos os grandes biomas do mundo (Williams et al., 2001).
Poças temporárias são corpos d’água oscilantes com fases secas recorrentes, podendo abrigar vegetação e animais aquáticos em determinados períodos do ano. Elas ocorrem em locais onde a evaporação consome, total ou parcialmente, as precipitações, os afluentes superficiais e subterrâneos (Williams, 1985).
bióticas (competição e predação) e a estratégia de vida dos animais (Romanuk; Kolasa, 2002; Hamilton IV et al., 2012).
Estudos em poças temporárias demonstram que elas possuem variações em suas características físico-químicas maiores do que corpos d’água permanentes (Smith; Pearson, 1987). Isso faz com que esses ambientes temporários possuam condições abióticas desfavoráveis à maioria dos seres vivos (Bronmark; Hansson, 2005).
A temperatura determina, em parte, a composição e diversidade de macroinvertebrados em ambientes lênticos. Além disso, influencia a distribuição dos animais dentro das poças, uma vez que a região superficial tem uma exposição maior ao sol do que as regiões mais profundas. O oxigênio dissolvido é um fator limitante de ambientes lênticos temporários, fazendo com que muitos animais habitem a região superficial da poça ou utilizem pigmentos respiratórios.
A acidez possui uma variação considerável ao longo do dia, como resultado de processos metabólicos dos seres vivos. Valores extremos de pH podem tornar o ambiente desfavorável, embora alguns grupos de animais estejam adaptados a essas variações. Esses aspectos físico-químicos não devem ser analisados de maneira isolada. Uma vez que um fator altera o valor de outro, a distribuição dos macroinvertebrados é melhor entendida quando esses fatores são considerados de forma única, e não separadamente.
Além desses parâmetros de qualidade ambiental, a dimensão da poça também é um fator a ser levado em consideração. De maneira geral, as poças diferem na sua forma, tamanho e profundidade, por isso espera-se encontrar assembleias distintas, mesmo que os parâmetros físico-químicos sejam semelhantes (Schwartz; Jenkins, 2000). As dimensões das poças também interferem no volume e no tempo de permanência da coluna d’ água, dois atributos que influenciam a riqueza de animais no ambiente (Garmendia; Pedrola-Monfort, 2010).
pode facilitar ou dificultar a perda de água por infiltração, a cobertura vegetal interfere na evaporação e a topografia no transbordamento de água.
Poças que possuem água durante mais tempo no ano possibilitam que animais com ciclos de vida mais longos possam habitar nelas, aumentando a riqueza local (Kiflawi et al., 2003). A forma da poça também afeta essa dinâmica, uma vez que quanto mais cilíndrica ela for, uma maior quantidade de água estará em contato com o sol e haverá mais evaporação, diminuindo a duração da água na poça.
A topografia da poça também interfere na dinâmica da seca e cheia, porque uma chuva, mesmo de pouca duração, pode encher completamente uma poça, caso esta tenha uma topografia que facilite esse processo. Além disso, a topografia pode favorecer ou dificultar a perda de água por transbordamento durante o período chuvoso.
Em um clima semiárido, marcado pela irregularidade das chuvas, o regime hidrológico é um fator fundamental na seleção dos indivíduos. A dinâmica de seca e cheia é caracterizada por três componentes: duração, frequência e previsibilidade das chuvas (Urban, 2004). Para se inferir esses aspectos, são necessários dados históricos sobre pluviosidade da região e características físicas das poças.
Durante o período anual de inundação em poças temporárias, algumas fases características relacionadas ao regime hídrico são descritas: inundação, período curto que ocorre a partir das primeiras chuvas; cheia, correspondente a um longo período com maior estabilidade da coluna d´água; secagem, quando a evaporação somada à infiltração se torna maior que a precipitação (Boix et al., 2004; Culioli et al., 2006).
As poças temporárias podem ocorrer em depressões endorréicas (sem contato com o mar) que permanecem submersas por tempo suficiente para permitir o desenvolvimento de solos e de comunidades de plantas e animais. No entanto, existem aquelas que secam constantemente e não é possível o desenvolvimento do solo e consequentemente a sucessão ecológica, impossibilitando o estabelecimento de animais adaptados a ambientes estáveis e permanentes.
Deve-se ressaltar uma diferença em relação ao abastecimento de poças de água doce. Existem poças cuja água é proveniente apenas da chuva, não havendo conexão com rio ou lençol freático, e há poças que recebem água da chuva e de outros corpos d’água (Jocque et al., 2010). Esses dois tipos de ambiente abrigam espécies de animais diferentes. Poças que dependem exclusivamente da pluviosidade abrigam animais adaptados a ambientes temporários, enquanto poças conectadas a rios ou lençóis freáticos possuem também espécies típicas de ambientes permanentes.
Os animais especialistas em ambientes temporários possuem adaptações específicas à dissecação, um custo desnecessário para poças permanentes. Em contrapartida, espécies que habitam corpos d’água permanentes gastam recursos em atividades (como fugir da predação por peixes) desnecessárias em poças isoladas de rios (Wissinger; Greig; McInotsh, 2009).
Dentre os animais que compõem o ambiente aquático, destacam-se os macroinvertebrados aquáticos. São invertebrados que podem ser capturados por uma malha maior que 500mm, pertencentes a diversos grupos taxonômicos: insetos, crustáceos, moluscos e anelídeos são os mais comuns (Hauer, Resh, 2006). Estes animais são, em sua maioria, provenientes do ambiente terrestre e desenvolveram diferentes adaptações às condições aquáticas. Durante essa evolução, os animais tiveram que modificar processos fisiológicos (como respiração e alimentação) e sua morfologia para maior sobrevivência e reprodução nesses ambientes (Resh; Solem, 1996).
Em um ambiente de água doce, os principais aspectos que requerem adaptações fisiológicas dos indivíduos são o oxigênio dissolvido, salinidade, temperatura e pH. Esses fatores são modificados com a mudança no nível da água ao longo das estações e com a interferência humana no ambiente. De maneira geral, os indivíduos possuem um nível considerado ótimo para cada um desses parâmetros. As alterações nesses parâmetros causam uma mudança natural na composição dos macroinvertebrados (Porst et al., 2012).
Devido a essa variação na taxa de sobrevivência em diferentes condições ambientais, os macroinvertebrados começaram a ser utilizados para biomonitoramento da qualidade de água (Hawkes, 1997). Através desse processo, pode-se inferir o nível de poluição da água pela abundância e riqueza dos animais encontrados. Sabe-se que alguns seres são mais sensíveis e outros mais tolerantes à poluição. Dessa forma, ao se encontrar uma grande abundância de macroinvertebrados tolerantes à poluição e poucos sensíveis, pode-se inferir que o ambiente possui certo nível de contaminação, enquanto um local conservado possuirá maior abundância de animais sensíveis à poluição do que tolerantes (Ferreira; Paiva; Callisto, 2011).
Apesar de haver grande abundância e riqueza dos macroinvertebrados em ambientes aquáticos, a maior parte deles ainda depende do ambiente terrestre para completar o ciclo de vida, o que dificulta a ocorrência de indivíduos em poças profundas (Anderson; Wallace, 1996).
Os macroinvertebrados aquáticos ocupam diversos habitats e são componentes importantes do ambiente (Merrit; Cummins, 1996). Isso porque regulam as taxas de produção primária, decomposição e estratificação térmica e são a principal fonte de alimentos para muitos animais vertebrados (Graça, 2001; Vaughn; Hakenkamp, 2001; Vanni, 2002). Eles podem ser classificados de acordo com seu hábito alimentar: fragmentadores utilizam matéria orgânica maior que 1mm; coletores e filtradores se alimentam de matéria orgânica menor que 1mm;, raspadores ingerem perifíton e predadores matam outros animais para se alimentar (Wallace; Webster 1980; Moreno; Callisto, 2006).
apresentam mudanças consideráveis como respostas a essas variações (Jacobsen et al., 1997; Álvarez-Cabria et al., 2011). Para se entender as diferenças espaciais e temporais na distribuição dos organismos, é preciso relacionar as distintas condições ambientais com determinados padrões morfológicos, fisiológicos e comportamentais desenvolvidos pelos animais (Southwood, 1977).
As estratégias de história de vida, principalmente em relação à reprodução, permitem ao indivíduo lidar com uma abrangência de situações ecológicas diferentes (Stearns, 1976). Para se entender a estratégia de vida de um organismo, é necessário compreender diferentes aspectos, como reprodução e dispersão.
Em relação aos macroinvertebrados aquáticos, os padrões de história de vida são complexos, uma vez que eles correspondem a diferentes grupos taxonômicos e ocorrem em habitat diversos, desde rios perenes a poças temporárias. Em cada ambiente, os parâmetros físico-químicos e a hidrologia influenciam a seleção de determinadas estratégias de vida.
Existem quatro aspectos de história de vida que devem ser levados em consideração para se inferir a estratégia de vida dos macroinvertebrados: reprodução, dispersão, desenvolvimento e sincronização (Siepel, 1994). Para cada tipo de estratégia, alguns aspectos podem ser considerados mais relevantes que outros.
A reprodução pode ser entendida como a combinação do investimento de recursos per capita nos descendentescom o investimento na longevidade do adulto. De maneira geral, o investimento per capita diminui com o aumento da quantidade de descendentes. O investimento na reprodução diminui com o aumento da longevidade do adulto. A alocação de recursos para o desenvolvimento faz com que os animais reproduzam com tamanhos menores. Entretanto, investimento no crescimento e consequentes adaptações ambientais atrasam o tempo do desenvolvimento. Essa taxa de crescimento pode ser uma adaptação bastante flexível (Abrams et al., 1996). A sincronização também é um aspecto importante, tendo em vista que eventos como diapausa e quiescência dos animais devem ocorrer quando as condições físico-químicas forem adversas.
movimento pode ser passivo, através da água, vento ou em outro animal, ou ativo, geralmente por indivíduos alados (Williams, 1997). Os macroinvertebrados com capacidade de dispersão ativa colonizam primeiro as poças e podem permanecer nelas por mais tempo que os animais de dispersão passiva, por isso eles estão em maior abundância quando as poças estão enchendo e secando (Ribera; Isart; Régil, 1994; Gascón et al., 2008).
Organismos que frequentemente convivem com distúrbios abióticos podem desenvolver, ao longo do tempo evolutivo, adaptações fisiológicas, comportamentais e/ou de história de vida que minimizem o efeito desses impactos (Díaz; Alonso; Gutierrez, 2008). Cada modo de adaptação desenvolvido é mais afetado por determinado componente do regime hídrico.
A alteração fisiológica mais importante em um regime de seca e cheia é o animal possuir algum estágio de vida que sobreviva à seca até o próximo período chuvoso. Esse tipo de padrão responde principalmente à frequência das chuvas, uma vez que o organismo pode não conseguir resistir muito tempo durante um período seco prolongado. Muitos macroinvertebrados de dispersão passiva possuem capacidade de dormência no período seco.
As adaptações comportamentais podem estar relacionadas à previsibilidade de seca e cheia da poça. Nesse caso, os macroinvertebrados aquáticos utilizam gatilhos ambientais para prever quando determinada poça irá secar ou encher. Isso permite o organismo reagir a eventos isolados. Portanto, em locais onde secas e cheias são imprevisíveis, adaptações comportamentais tornam-se muito importantes (Lytle; Poff, 2004).
Os padrões de história de vida tipicamente sincronizam eventos do ciclo de vida, como crescimento e reprodução, à ocorrência de eventos relacionados ao regime hídrico (Lytle, 2002), Desse modo, os animais se adaptam a um tempo médio de secas e cheias, necessitando que esses eventos sejam previsíveis e frequentes.
Durante a fase de cheia, algumas poças podem conectar-se a rios. Quando isso ocorre, pode haver a movimentação de peixes para as poças. Portanto, a fauna de macroinvertebrados presente nesse ambiente deve ser adaptada não somente às condições ambientais adversas, mas também fugir de um possível predador.
Portanto, vários fatores que atuam em diferentes escalas espaço-temporais influenciam a estrutura da assembleia de macroinvertebrados em poças temporárias. Em escala maior, o regime hídrico é um fator importante a ser levado em consideração. Em menor escala, as características das poças e os parâmetros físico-químicos da água e as interações bióticas devem ser levadas em conta.
Sistemas aquáticos pequenos, como as poças, possuem um grande potencial para estudos de ecologia e biogeografia, pois é fácil de se realizar coletas e elas estão espalhadas ao longo de gradientes ecológicos, o que permite uma comparação maior entre os dados (Brendonck et al., 2010). Além disso, elas são de fácil replicação e manipulação, devido ao seu tamanho pequeno. São sistemas antigos e possuem comunidades com grande diversidade. Este tipo de ecossistema abriga muitos animais e plantas raros. Esses aspectos fazem com que os estudos de ecologia em poças tenham sido intensificados (Jocque et al., 2006).
Entretanto, Bilton et al., 2009 ressaltam que poucos trabalhos analisam a estrutura de comunidade e o nível de conservação desses ambientes. De acordo com Jackson; Fureder (2006), o fato de a maioria dos macroinvertebrados que habitam essas poças não terem importância econômica ou médica dificulta o investimento maior em pesquisas em longo prazo.
As principais ameaças à conservação biológica dos sistemas de água doce são a perda ou degradação dos habitats (devido à perda da heterogeneidade do ambiente), contaminação por substâncias químicas (provenientes da agricultura), excesso de matéria orgânica (esgotos de cidades), introdução de espécies exóticas, exploração comercial, manipulações hidrológicas (como barreiras e canalizações) e mudanças climáticas globais (Abell, 2002; Carpenter et al., 2011; Strayer; Dudgeon, 2010).
e da sua relação com a composição e distribuição espaço-temporal das assembleias de macroinvertebrados presentes nas mesmas.
Objetivo Geral
Analisar a composição e distribuição de macroinvertebrados aquáticos em poças temporárias de clima semiárido.
Objetivos Específicos
1. Comparar a composição da assembleia de macroinvertebrados entre os períodos de cheia e de seca
2. Identificar quais fatores abióticos determinam a composição e a distribuição dos macroinvertebrados.
2 Material e Métodos
Área de estudo
A pesquisa foi desenvolvida no Sítio Paleontológico Lajinhas (coordenadas: 03º25’18’’ S e 39º41’39’’ W), que faz parte do município de Itapipoca, noroeste do Ceará (Figura 2.1). Ele abrange uma área de cerca de 2km2 e contém afloramentos rochosos com tamanhos e formas variadas, que acumulam água durante o período de cheia (Ximenes et al., 2008).
A região faz parte da sub-bacia hidrográfica do rio Cruxati, que integra a bacia do litoral, com área de drenagem de 8.619km2. A pluviosidade média anual ultrapassa 1000mm, mas as precipitações possuem variação espaço-temporal típica de ambiente semiárido, o que torna essa região hidrográfica uma das mais áridas do Ceará (Kelting, 2009).
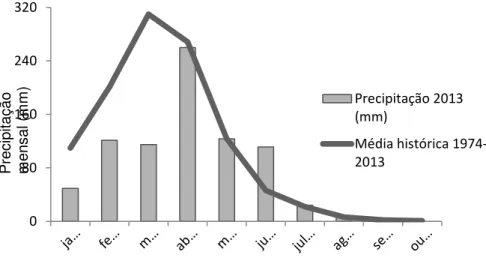
O nível de pluviosidade observado no ano de 2013 foi de 813mm, o que representa um decréscimo de 22,7% em relação à média anual histórica (FUNCEME, 2013). Entretanto, em alguns meses, como junho e julho, houve precipitações acima da média (Figura 2.2). Desse modo, o período chuvoso iniciou e terminou mais tardiamente do que o esperado.
Fig. 2.2. Precipitação total no município de Itapipoca-CE (FUNCEME, 2013).
Foram utilizadas vinte e duas poças da localidade Lajinhas para o desenvolvimento do trabalho. Cada poça teve suas dimensões medidas, os parâmetros físico-químicos verificados e a coleta de macroinvertebrados realizada. Esses procedimentos ocorreram nos períodos de cheia (junho de 2013) e de seca (setembro de 2013).
Caracterização física da poça
A dimensão da poça é uma informação importante para se entender a distribuição dos macroinvertebrados aquáticos, tendo em vista que esse fator pode determinar a persistência e abundância de determinados táxons ao longo dos períodos (Garmendia; Pedrola-Monfort, 2010).
A área da superfície da poça foi inferida marcando-se diversos pontos com o GPS ao redor do seu perímetro, e com o programa Quantum Gis 2.0 foi possível calcular a área abrangida por essas coordenadas. A profundidade foi registrada com
0 80 160 240 320
Precipitação 2013 (mm)
Média histórica 1974-2013
P
rec
ipi
taç
ão
m
en
sal
(
m
m
um bastão graduado a cada dez metros ao longo do maior comprimento da poça. A profundidade máxima foi o maior valor encontrado.
Com a área de superfície e a profundidade medidas na estação seca e na chuvosa, foi possível verificar se essas dimensões influenciam os componentes bióticos de maneira semelhante em ambos os períodos. Além disso, cada uma dessas medidas foi relacionada com abundância, diversidade e riqueza da assembleia de macroinvertebrados.
Parâmetros físico-químicos
Além da medição de cada uma das poças em cada estação, foram verificados quatro parâmetros físico-químicos de qualidade da água (pH, oxigênio dissolvido, temperatura e condutividade). Eles foram registrados utilizando-se uma sonda multi paramétrica “YSI 7000”.
Cada variável abiótica foi comparada entre as poças em uma mesma estação e entre as estações, a fim de se relacionar a variação desses aspectos físico-químicos com a abundância, riqueza e diversidade dos macroinvertebrados.
Coleta de macroinvertebrados aquáticos
Depois de mensuradas as variáveis abióticas das poças, foi realizada a coleta dos macroinvertebrados. Para isso, foi necessário um puçá com malha de 0,25mm. Em cada poça foram efetuados cinco arrastos de 1m cada com o puçá em microhabitats diversos quando disponíveis (macrófitas, areia e perifíton).
Imediatamente após a coleta em cada poça, as amostras foram conservadas em álcool a 70% até serem triadas no laboratório. No processo de triagem, os animais foram separados do substrato com o auxílio de uma peneira de 0,5mm. Após a triagem, os animais foram novamente conservados em álcool a 70% até a etapa de identificação.
Cummings (1996) e Mugnai; Nessimian; Baptista (2009). Os animais foram identificados até o mínimo nível taxonômico possível.
Análises estatísticas
As variáveis abióticas mensuradas entre as estações foram comparadas com o teste de Mann-Whitney a fim de se verificar possíveis diferenças significativas entre grupos de dados não normais. Foi realizada uma Análise de Componente Principal (PCA) para ambas as estações com o intuito de calcular quais variáveis abióticas são mais importantes para explicar a variação entre as poças.
Após a identificação dos macroinvertebrados, foram tabuladas as quantidades destes por estação. Foi verificado também se há diferença na composição, abundância, riqueza e diversidade de macroinvertebrados entre os períodos e entre poças de uma mesma estação.
Para se verificar a existência de diferença na composição da assembleia entre as estações, foi feita uma análise de agrupamento com o método de similaridade de Raup-Crick (presença-ausência) com todas as poças dos dois períodos. Esse método atribui valor de 0 a 1 de acordo com a semelhança de cada par de poças, sendo 1 o valor de maior similaridade e 0 o de menor similaridade.
Além disso, foram calculadas abundância, riqueza e diversidade de Shannon-Wiener das assembleias de macroinvertebrados e estes foram testados para normalidade e homoscedasticidade. Uma vez que estes se mostraram não normais e não homogêneos a comparação foi feita através do teste de Mann-Whitney para se conferir a existência de diferença significativa entre os períodos de cheia e seca. A fim de se comparar as riquezas de poças com abundâncias muito diferentes, utilizou-se a técnica da rarefação para padronizar o tamanho amostral e estimar uma riqueza padronizada.
Para analisar a influência das interações bióticas, as poças da estação chuvosa foram classificadas de acordo com a presença ou ausência de peixes. Esses dois grupos foram comparados em relação à assembleia de macroinvertebrados.
Para isso, utilizou-se a análise de agrupamento de Raup-Crick para se verificar se o fator presença de peixe agrupava adequadamente as poças em relação à composição dos macroinvertebrados. Estes dois tipos de poças também foram comparados em relação à abundância, riqueza e diversidade de macroinvertebrados.
3 Resultados
No período de cheia, os dados foram coletados de 22 poças. Dentre essas, 20 são oriundas de depressões rochosas do Sítio Paleontológico Lajinhas (Figura 3.1) e duas fazem parte do riacho da Lajinha, estas tendo areia como substrato predominante (Figura 3.2).
Figura 3.1. Poça no sítio paleontológico Lajinhas, Itapipoca-CE.
Figura 3.2. Poça no riacho da Lajinha, Itapipoca-CE.
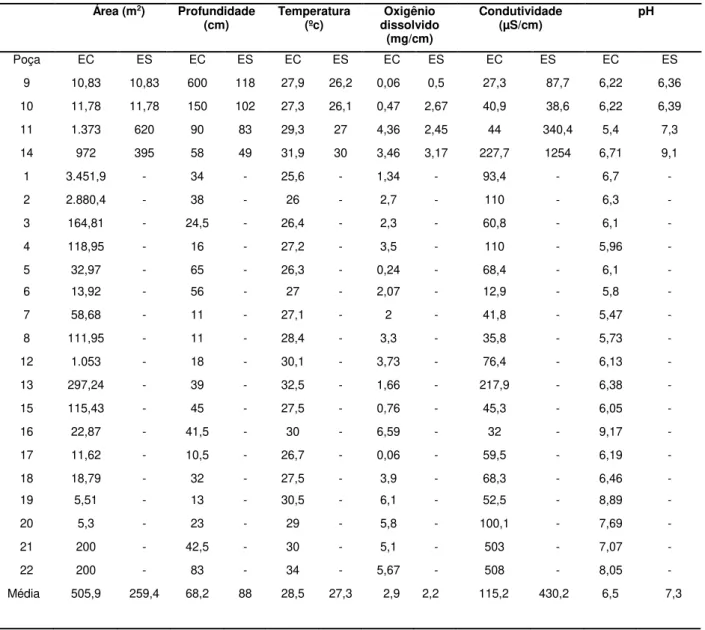
Durante a fase de seca, apenas quatro poças das 22 permaneceram com água (poças 9, 10, 11 e 14). Elas persistiram devido a sua grande área superficial (11 e 14) ou pela grande profundidade (9 e 10). Dentre as 22 poças da estação de cheia, a área variou de 5,3m2 (poça 19) a 3.451,9m2 (poça 1) e a profundidade de a 11cm (poça 8) de 600cm (poça 9). Dentre os parâmetros limnológicos, a condutividade, o pH e o oxigênio dissolvido sofreram variações significativas entre as poças, mostrando condições variadas de habitat (tabela 3.1.
Tabela 3.1. Variáveis abióticas de 22 poças nas estações chuvosa (EC) e seca (ES) do Sítio Paleontológico Lajinhas, Itapipoca-CE.
Área (m2) Profundidade
(cm) Temperatura (ºc) dissolvido Oxigênio (mg/cm)
Condutividade
(µS/cm) pH
Poça EC ES EC ES EC ES EC ES EC ES EC ES
9 10,83 10,83 600 118 27,9 26,2 0,06 0,5 27,3 87,7 6,22 6,36 10 11,78 11,78 150 102 27,3 26,1 0,47 2,67 40,9 38,6 6,22 6,39 11 1.373 620 90 83 29,3 27 4,36 2,45 44 340,4 5,4 7,3
14 972 395 58 49 31,9 30 3,46 3,17 227,7 1254 6,71 9,1 1 3.451,9 - 34 - 25,6 - 1,34 - 93,4 - 6,7 -
2 2.880,4 - 38 - 26 - 2,7 - 110 - 6,3 - 3 164,81 - 24,5 - 26,4 - 2,3 - 60,8 - 6,1 - 4 118,95 - 16 - 27,2 - 3,5 - 110 - 5,96 -
5 32,97 - 65 - 26,3 - 0,24 - 68,4 - 6,1 - 6 13,92 - 56 - 27 - 2,07 - 12,9 - 5,8 -
7 58,68 - 11 - 27,1 - 2 - 41,8 - 5,47 - 8 111,95 - 11 - 28,4 - 3,3 - 35,8 - 5,73 -
12 1.053 - 18 - 30,1 - 3,73 - 76,4 - 6,13 - 13 297,24 - 39 - 32,5 - 1,66 - 217,9 - 6,38 - 15 115,43 - 45 - 27,5 - 0,76 - 45,3 - 6,05 -
16 22,87 - 41,5 - 30 - 6,59 - 32 - 9,17 - 17 11,62 - 10,5 - 26,7 - 0,06 - 59,5 - 6,19 -
18 18,79 - 32 - 27,5 - 3,9 - 68,3 - 6,46 - 19 5,51 - 13 - 30,5 - 6,1 - 52,5 - 8,89 -
20 5,3 - 23 - 29 - 5,8 - 100,1 - 7,69 - 21 200 - 42,5 - 30 - 5,1 - 503 - 7,07 -
22 200 - 83 - 34 - 5,67 - 508 - 8,05 - Média 505,9 259,4 68,2 88 28,5 27,3 2,9 2,2 115,2 430,2 6,5 7,3
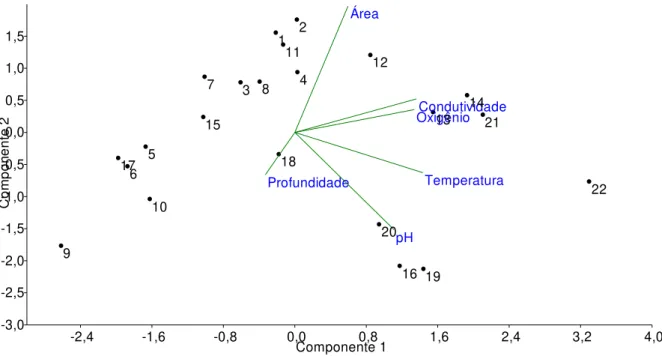
Figura 3.3. PCA das variáveis abióticas no período de cheia.
Figura 3.4. PCA das variáveis abióticas no período de seca.
Foi capturado um total de 9.289 macroinvertebrados, distribuídos em 35 famílias e 54 gêneros de Insecta; 3 famílias e 4 gêneros de Mollusca, 1 ordem de Annelida e 1 classe de Crustacea. A maioria dos animais foi identificada até gênero. As exceções foram: Ostracoda (classe), Oligochaeta (ordem), Chironomidae, Dryopidae e Aphididae (família).
Área Profundidade Temperatura Oxigênio dissolvido Condutividade pH P9 P10 P11 P14
-3,0 -2,4 -1,8 -1,2 -0,6 0,0 0,6 1,2 1,8 2,4
Componente 1 -0,9 -0,6 -0,3 0,0 0,3 0,6 0,9 1,2 1,5 1,8 C o m p o ne n te 2 Profundidade Temperatura OxigênioCondutividade pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22
-2,4 -1,6 -0,8 0,0 0,8 1,6 2,4 3,2 4,0
Foram coletados 56 táxons em 22 poças durante o período chuvoso (Apêndice A) e 32 táxons em quatro poças no período seco (Apêndice B). Dentre os grupos de macroinvertebrados coletados, 32 foram exclusivos do período de cheia, 7 exclusivos da estação seca e 25 comuns aos dois períodos.
Os grupos coletados nas amostras foram: Ostracoda (51,5%), Insecta (40,5%), Mollusca (7,3%) e Oligochaeta (0,7%). Dentre os insetos, os grupos com maior abundância foram Coleoptera (33%), Odonata (24%), Hemiptera (23%) e Diptera (18%).
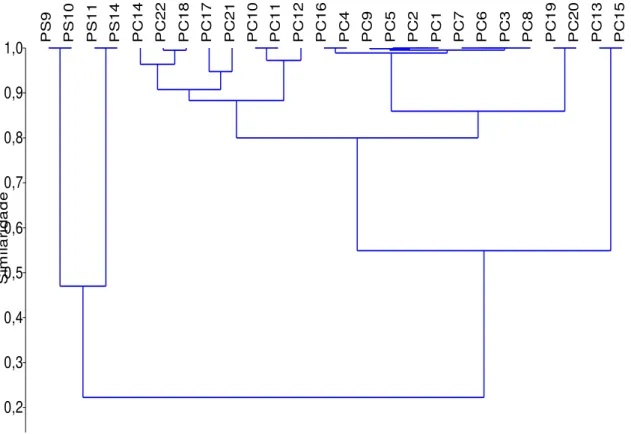
Foi realizada uma análise de Cluster com similaridade de Jaccard entre as 26 poças (22 do período chuvoso e 4 do período seco) em relação à composição da assembleia de macroinvertebrados (figura 3.5). Foi possível agrupar as poças de acordo com os períodos de cheia e de seca.
Figura 3.5. Agrupamento com similaridade de Raup-Crick das poças de acordo com a composição de macroinvertebrados. PC – Poça no período chuvoso; PS – Poça no período seco.
Diferentes poças em uma mesma estação apresentaram maior similaridade em relação à assembleia de macroinvertebrados do que a mesma poça entre estações diferentes. Isso indica que mudança das estações ao longo do ano apresenta uma influência significativa na distribuição dos macroinvertebrados.
As poças 21 e 22, pertencentes ao riacho da Lajinha, apresentaram grande similaridade em relação à assembleia de macroinvertebrados (índice de 0,72). A distância entre as poças não interferiu na distribuição dos animais, uma vez que algumas mais próximas apresentaram baixa similaridade (poças 9 e 11 com índice de 0,39) e algumas mais distantes tiveram alta similaridade (poças 2 e 8 com índice de 0,8).
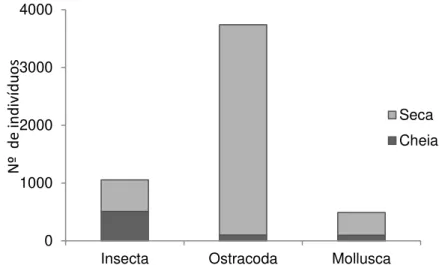
A diferença na composição da assembleia de macroinvertebrados entre as estações ocorreu devido ao período de cheia ser caracterizado pelo predomínio de insetos, enquanto o período de seca apresentou grande abundância de Ostracoda e Molusco (figura 3.6).
Figura 3.6. Abundância de macroinvertebrados nas quatro poças presentes no período de cheia e de seca.
A diferença entre as estações de cheia e de seca também é identificada dentro do grupo dos insetos (figura 3.7). A ordem Odonata apresentou diminuição considerável no período seco, enquanto Hemiptera foi o único táxon de inseto a aumentar a abundância nessa estação. Os grupos Coleoptera e Diptera permaneceram com abundâncias semelhantes em ambos os períodos.
0 1000 2000 3000 4000
Insecta Ostracoda Mollusca
Seca Cheia
Nº
d
e
in
d
iví
du
o
Figura 3.7. Abundância de insetos nas quatro poças presentes no período de cheia e de seca.
A abundância, a riqueza e o índice de diversidade de Shannon-Wiener dos macroinvertebrados foram medidas nas poças em cada estação. No período chuvoso, a riqueza por poça variou de 14 táxons (poça 9) a 32 (poça 11) e a diversidade de 1,4 (poça 19) a 2,8 (poça 14). Na estação seca, a riqueza máxima foi de 19 (poça 14) e a mínima foi de 13 (poça 9), enquanto a diversidade variou de 0,5 (poça 9) a 1,3 (poça 14).
A abundância e riqueza foram comparadas entre as estações de cheia e seca nas quatro poças encontradas em ambas as estações (figuras 3.7 e 3.8, respectivamente). Houve grande variação na abundância entre as estações (680 indivíduos na cheia e 4593 na seca). A abundância de macroinvertebrados na seca é significativamente maior que na cheia (Mann-Whitney, p=0,028). A diversidade foi maior no período de cheia (p=0,028) e a riqueza estimada não variou de forma significativa entre os períodos (p=0,056).
Figura 3.7. Abundância das quatro poças presentes no período chuvoso e seco. 0
100 200 300 400 500
Coleoptera Diptera Odonata Hemiptera Outros
Seca Cheia
Nº
de
indi
ví
Figura 3.8. Riqueza estimada das quatro poças remanescentes no período de cheia e seca.
Os grupos funcionais classificados de acordo com a dispersão também foram analisados entre as estações (figura 3.9). Os animais que possuem dispersão ativa dominaram durante o período chuvoso (as únicas poças que na tiveram domínio de animais com dispersão passiva no período de cheia foram a 10, a 18 e a 21), enquanto na estação seca houve predomínio de animais com dispersão passiva.
Figura 3.9. Abundância dos tipos de dispersão de macroinvertebrados nas quatro poças presentes no período de cheia e de seca.
Tabela 3.3. Correlação de Spearman entre os fatores ambientais e a abundância, riqueza e abundância de macroinvertebrados.
Abundância Diversidade Riqueza
Área 0,91 0,02 0,01
Profundidade 0,33 0,07 0,56
Temperatura 0,33 0,81 0,81
Oxigênio
dissolvido 0,88 0,77 0,85
Condutividade 0,01 0,87 0,32
pH 0,21 0,01 0,09
. A abundância de macroinvertebrados mostrou-se correlacionada com a área
e o oxigênio dissolvido da poça. A diversidade apresentou maior correlação com a temperatura e a condutividade, enquanto a riqueza de macroinvertebrados possuiu maior relação com a temperatura e o oxigênio dissolvido.
A presença de peixes não influenciou de forma significativa a abundância de Ostracoda (U=49,5, p=0,09), de Insecta (U=76, p=0,75) e de Mollusca (U=65,5, U=38,8). Entretanto, há um indício de que a presença de peixe diminui a variação da abundância de Insecta e Ostracoda entre as estações de cheia e seca.
A diversidade de macroinvertebrados não foi influenciada de forma significativa pela presença de peixes (U=54, p=0,14). Entretanto, a riqueza de macroinvertebrados na presença de peixes foi significativamente maior (U=44, p=0,047) que na ausência.
Dentre os insetos, a maioria dos grupos teve um acréscimo na abundância relativa em poças que não continham peixes. A única exceção foi o grupo Diptera, que teve um pequeno aumento no número de indivíduos por poça na presença de peixes (figura 3.10).
4 Discussão
A variação entre os parâmetros físico-químicos dos ambientes amostrados faz com que cada poça seja um habitat único para os animais. Por isso, observou-se uma grande variação na composição de macroinvertebrados entre as poças, mesmo que a distância entre elas seja muito pequena.
A pequena diferença das variáveis abióticas entre a estação de seca e cheia provavelmente foi devido à baixa precipitação no ano de 2013, fazendo com que os níveis de água das poças na cheia fossem menores que o esperado. A baixa quantidade de poças no período seco dificultou a comparação de médias utilizando-se o teste de Mann-Whitney.
Em um ambiente com chuvas irregulares ao longo do ano, a maioria das poças tem duração temporária, variando seu nível de água de acordo com o regime hidrológico. Isso fez com que a composição da assembleia de macroinvertebrados aquáticos no presente trabalho variasse ao longo das estações como encontrado em ambientes temperados por Brooks (2000) e Álvarez-Cabria et al. (2011).
Essa mudança na composição relacionada ao ciclo hidrológico também foi encontrada por Lahr et al. (1999),; Jocque et al. (2007), Vanschoenwinkel et al. (2009). Entretanto, nesses trabalhos, as poças estudadas durante o período seco praticamente não apresentavam macrófitas, enquanto as poças da presente pesquisa permaneceram com vegetação até evaporarem completamente.
Isso fez com que as poças permanecessem com uma grande heterogeneidade de habitats, mesmo no período de seca. O aumento na riqueza de macroinvertebrados na presença de macrófitas também foi encontrado por Solimini et al. (2003) e Walker; Wijnhoven; Velde (2012).
Diante disso, quando se comparou a composição de macroinvertebrados com a similaridade de Jaccard, todas as poças de um mesmo período apresentaram maior similaridade entre si do que com poças da outra estação. Dessa forma, o ciclo hidrológico mostrou-se importante para se entender a mudança na composição dos macroinvertebrados ao longo das estações.
A diferença entre as estações ocorreu principalmente pelo desaparecimento de muitos grupos na transição da cheia para a seca, uma vez que apenas sete grupos de macroinvertebrados que não estavam presentes na estação chuvosa apareceram na seca. Isso pode ser evidência de que as condições do período seco são desfavoráveis à persistência da maioria dos grupos de macroinvertebrados.
Outra diferença entre as poças ao longo do ano foi a variação da abundância de insetos e ostracodas. No período de cheia, houve um grande predomínio da classe Insecta, enquanto na estação seca a classe Ostracoda apresentou grande abundância. Isso é reflexo da diferença na capacidade de dispersão dos animais.
Insetos possuem dispersão ativa, enquanto os ostracodas têm dispersão passiva. Durante o período de cheia, as variáveis limnológicas permanecem mais estáveis, favorecendo o estabelecimento de grupos competidores que colonizam a poça através de dispersão ativa. Esses animais dominam o ambiente durante a fase cheia, utilizando-a para se reproduzir antes que a poça seque.
A colonização da maioria dos grupos de macroinvertebrados de forma ativa no mesmo período mostra uma sincronização com o evento de cheia. Durante essa fase, o animal deve encontrar a poça e reproduzir rapidamente, para que seus descendentes se desenvolvam na água e cresçam até a fase adulta antes da poça secar.
Por isso, muitos animais nesse ambiente possuem ciclos de vida curtos e sincronizados com o período de cheia, de modo que os descendentes desenvolvem-se em adultos terrestres antes da desenvolvem-seca ou em estágios de vida com capacidade de resistência à seca (Lytle, 2002; Lytle; Poof, 2004; Díaz et al., 2008).
seco em um estágio resistente a essa condição. Por isso, esse grupo apresentou grande abundância nessa estação.
Apesar das poças serem formadas por depressões rochosas, a sucessão ecológica ao longo do tempo foi acompanhada pela formação de vegetação e solo, o que permite a permanência desses animais em estágios de dormência durante o período de seca. Caso o ambiente fosse novo e a sucessão ecológica estivesse no início, o substrato exclusivamente de rocha dificultaria a permanência desses macroinvertebrados.
A abundância semelhante de indivíduos entre as 22 poças da cheia e as 4 da seca mostram que durante esse último período há um grande predomínio dos táxons que conseguem sobreviver às condições adversas e por isso dominam as poças numericamente. Por isso, apesar de possuir uma menor riqueza, as poças do período de seca têm uma abundância maior de macroinvertebrados do que no período de cheia, como observado em relação gênero Biomphalaria e à classe Ostracoda, ambos com dispersão passiva.
Estes dois táxons são dominantes no período seco possivelmente devido a adaptações morfológicas (conchas) que protegem as suas partes moles da dissecação. Além disso, há uma maior facilidade de coleta no período de seca, o que pode favorecer a coleta de mais macroinvertebrados, provocando um aumento da abundância desses animais.
Por outro lado, a diminuição significativa da riqueza e diversidade na transição da cheia para a seca mostra que, apesar do período chuvoso possuir menos indivíduos por poça, o aumento no nível da água favorece a reprodução e permanência de uma grande quantidade de indivíduos diferentes, principalmente devido à estabilidade nos níveis dos parâmetros físico-químicos e ao aumento do número de microhabitats.
profundidade leva a uma menor variação dos parâmetros físico-químicos. Tendo em vista que muitos animais não conseguem resistir a extremos desses parâmetros, essa estabilidade permite uma maior riqueza no ambiente durante o período de cheia do que de seca (Romanuk; Kolasa, 2002).
Os resultados mostraram que a riqueza de macroinvertebrados está relacionada com a temperatura e o oxigênio dissolvido e tem pouca relação com a área da poça. A relação área-espécie é bem conhecida e foi testada em diversos trabalhos com macroinvertebrados. Esta relação foi considerada significativa em alguns trabalhos (Spencer et al., 1999; Oertli et al., 2001; Maltchik et al., 2010; Brooks; Colburn, 2012), enquanto outros não encontraram nenhuma relação área-riqueza (Bilton et al., 2009; Hamilton IV et al., 2012).
A abundância de macroinvertebrados mostrou-se correlacionada com a área da poça. Provavelmente, as poças persistentes do período seco, que tinham grande área e muitos macroinvertebrados, contribuíram para essa relação. Isso corrobora a ideia de que ambientes maiores abrigam populações maiores, que são extintas com mais dificuldade (MacArthur; Wilson, 1967). Esta ideia foi verificado por Lassen et al., 1975 em seu trabalho com moluscos.
O agrupamento com a similaridade de Raup-Crick mostrou que as composições das assembleias de macroinvertebrados não pareceram ser afetadas pela presença ou ausência de peixes. A abundância e diversidade de macroinvertebrados foram semelhantes de forma independente à presença ou ausência de peixes. Entretanto, a riqueza de macroinvertebrados foi significativamente maior em poças que possuíam peixes do que nas que não tinham.
A entrada de um predador de topo pode aumentar a riqueza no ambiente ao diminuir a população de um macroinvertebrado dominante em uma poça. Isso acontece porque os peixes geralmente se alimentam de macroinvertebrados carnívoros. Com isso, outros macroinvertebrados que são presas dessas espécies dominantes terão mais chance de sobrevivência ao explorar o ambiente e a poça pode abrigar um maior número de grupos de macroinvertebrados (Heino, 2000).
riqueza de macroinvertebrados, podendo estas ser consequências da maior heterogeneidade de habitats, pois a riqueza de peixes, assim como a de macroinvertebrados, aumenta em ambientes maiores e mais heterogêneos.
O fator que melhor explicou as diferenças entre as composições dos táxons descritos foi o período da coleta (seca e cheia). Algumas poças de um mesmo período possuíram níveis de variáveis abióticas bem diferentes entre si, mas ainda assim a composição dos organismos foi semelhante. Por outro lado, poças de diferentes estações com níveis variáveis abióticas parecidas tiveram grande diferença na composição dos animais.
Dessa maneira, as diferentes estratégias de vida dos macroinvertebrados parecem exercer um papel essencial na colonização desses ambientes. Provavelmente, esses animais apresentam adaptações comportamentais sincronizadas com os eventos de cheia e seca das poças.
5 Conclusões
Algumas variáveis abióticas mensuradas foram preditoras importantes da riqueza e diversidade da assembleia de macroinvertebrados. A área e profundidade da poça possuíram grande influência na persistência dos animais no período de seca, ressaltando a importância do ciclo hidrológico nesses ambientes.
A conservação das poças deve ser feita de modo a priorizar aquelas que abriguem diversas espécies vegetais, uma vez que estas fornecem abrigo, alimento e oxigênio dissolvido para os macroinvertebrados, aumentando a riqueza de espécies desses animais. Além disso, as plantas reduzem a taxa de perda de água das poças, possibilitando maior chance de sobrevivência aos animais de colonização lenta e ciclo de vida mais longo.
A interação biótica com a presença de peixes não foi um fator importante na composição e distribuição da assembleia de macroinvertebrados. Além disso, o aumento na riqueza de macroinvertebrados em poças que continham peixes pode ter ocorrido devido a essas poças serem maiores e possuírem mais macrófitas.
Nesses locais, o ciclo hídrico representou um fator essencial para a sobrevivência e distribuição dos grupos de macroinvertebrados ao longo do ano. Poças distantes e com microhabitats diferentes apresentaram assembleia de macroinvertebrados parecidas em uma mesma estação, o que demonstrou a diferença na composição de táxons entre as estações seca e chuvosa. Dessa forma, o processo natural de variação hidrológica ao longo do ano permite a manutenção dessas diferentes assembleias.
Portanto, uma ação humana para tornar essas poças temporárias em permanentes durante todo o ano (prática comum em regiões semiáridas) deve ser feita com cautela, pois dificultaria aos grupos adaptados ao período de seca sobreviver e se reproduzir, provocando uma diminuição na riqueza e na diversidade dos macroinvertebrados
ambientes com frequências e intensidades de chuvas imprevisíveis, ciclos de vida curtos e grande dispersão são favorecidos.
Diante disso, a manutenção desses ecossistemas, que são muito importantes para a comunidade local, deve levar em consideração não apenas as maiores poças ou as que nunca secam. Antes, deve-se conservar o conjunto de poças existentes, que permitem a sobrevivência e reprodução de um grande número de espécies de animais com estratégias de vida diferentes.
6. Considerações finais
O presente trabalho descreveu e analisou diferentes assembleias de macroinvertebrados em poças temporárias do semiárido nordestino, a fim de se conhecer esse tipo de ambiente, bem como a variação de seus componentes bióticos ao longo do ano.
A pesquisa confirma a importância do ciclo hidrológico para a composição e distribuição dos animais no semiárido. Também foi verificada a importância das diversas estratégias de vida dos macroinvertebrados e a prevalência de algumas delas nos diferentes períodos do ano.
Entretanto, é necessário um trabalho a longo prazo que possa descrever os macroinvertebrados em diferentes estações e em níveis de precipitações variados, para que o papel do ciclo hidrológico na distribuição desses animais seja melhor entendido no semiárido e seja mais fácil o desenvolvimento de um trabalho de sustentabilidade desses ambientes.
7. Perspectivas futuras
As poças temporárias em clima semiárido representam um ambiente muito importante por fornecer água à população local para os mais diversos usos durante parte do ano. Além disso, suas características peculiares favorecem a existência de espécies endêmicas, havendo uma alta diversidade de seres vivos nesses ambientes.
Espera-se contribuir para a elaboração e execução de ações que visem conservar e manter os ambientes de poças temporárias. Para isso, é necessário um conhecimento das variáveis abióticas e dos componentes bióticos que habitam esses locais.
O conhecimento dos macroinvertebrados que habitam as poças temporárias e a sua relação com as variáveis abióticas podem auxiliar na realização de biomonitoramento, que é a utilização de animais para se inferir o nível de alguns parâmetros limnológicos de qualidade da água.
Dessa forma, será possível associar a abundância e riqueza de determinados grupos a um ambiente mais degradado ou menos degradado, através de um índice pré-estabelecido. Com isso, poderá se avaliar frequentemente a qualidade da água e tentar identificar possíveis fontes poluidoras.
Esse processo já é utilizado no Brasil, com índices europeus modificados. Entretanto, é necessária a adaptação para a região semiárida. Uma vez que os animais dessa região possuem estratégias de vida diferentes de regiões temperadas, a relação entre a sua abundância e os parâmetros limnológicos provavelmente difere dos índices feitos em outros continentes.
REFERÊNCIAS
Abell, R., 2002. Conservation biology for the biodiversity crisis: a freshwater follow‐up. Conservation Biology,16:1435‐1437.
Abrams, P. A.; Leimanr, O.; Nylin, S.; Wiklund, C., 1996. The effect of flexible growth rates on optimal size and development time in a seasonal environmental. The
American Naturalist. 147:381-395.
Allen, A. P.; Whittar, T. R.; Kaufman, P. R.; Larsen, D. P.; O’Connor, R. J.; Hughes, R. M.; Stemberg, R. S.; Dixit, S. S.; Brinkhurst, R. O.; Herlihy, A. T.; Paulsen, S. G., 1999. Concordance of taxonomic richness patterns across multiple assemblages in lakes of the northeastern United States. Canadian Journal of Fisheries and Aquatic Sciences, 56:739-747.
Álvarez-Cabria, M.; Barquím, J.; Juanes, J. A., 2011. Macroinvertebrate community dynamics in a temperate European Atlantic river. Do they conform to general
ecological theory? Hydrobiology, 658:277-291.
Anderson, N. H.; Wallace, J. B., 1996. Habitat, life-history and behavorial adaptations of aquatic insects, pp. 38-58. In: An introduction to the aquatic insects of North
America. Dubuque: Kendall/ Hunt Publishing, 862p.
Bilton, D.T.; McAbendroth, L. C.; Nicolet, P.; Bedford, A.; Rundle, S. D.; Foggo, A.; Ramsay, P. M., 2009. Ecology and conservation status of temporary and fluctuating ponds in two areas of southern England. Aquatic Conservation: Marine and
Freshwater Ecosystems 19: 134-146.
Blaustein, L.; Schwartz, S. S., 2001. Why study ecology in temporary pools? Israel Journal of Zoology. 47:303-312.
Boix, D.; Sala, J.; Quintana, X. D., Moreno-Amich, R., 2004. Succession of the animal community in a Mediterranean temporary pond. Journal of the North American Benthological Society. 23:29-49.
Brendock, L.; Jocque, H.; Hulsmans, A.; Vanschoenwinkel, B., 2010. Pools ‘on the rocks’: freshwater rock pools as model system in ecological and evolutionary research. Limnetica. 29:25-40.
Broenmark, C., 1985. Interactions between macrophytes, epiphytes and herbivores: an experimental approach. Oikos, 45: 26-30.
Brooks, R. T., 2000. Annual and seasonal variation and the effects of hydroperiod on benthic macroinvertebrates of seasonal forest (“vernal”) ponds in central
Massachussetts, USA. The Society of Wetland Scientists. 20:707-715.
Brooks, R. T.; Colburn, E. A., 2012. “Island” Attributes and Benthic
Carpenter, D. A. 2001. Testing the River Continuum Concept: exploring ecological processes in the wheeling creek watershed. Dissertação de mestrado, West Virginia University, Morgantown.
Culioli, J. L.; Foata, J.; Mori, C.;Orsini, A.; Marchand, B., 2006. Ttemporal succession of the macroinvertebrate fauna in a corsican temporary pond. Vie et milieu. 56:215-221.
Díaz, A. M.; Alonso, M. L. S.; Gutierrez, M. R. V. A., 2008. Biological traits of stream macroinvertebrates from a semi-arid catchment: patterns along complex
environmental gradients. Freshwater Biology. 53:1-21.
Diehl, S. 1992. Fish predation and benthic community structure: the role of omnivory and habitat complexity. Ecology, 73:1646-1661.
Dudgeon, D.; Arthington, A. H.; Gessner, M. O.; Kawabata, Z.;Knowler, D. J.; Lévêque, C.; Naiman, R. J.; Prieur-Richard, A. H.; Soto, D.; Stiassny, M. L. J.; Sullivan, C. A. 2006. Freshwater biodiversity: importance, threats, status and conservation challenges. Freshwater biodiversity, 81:163-182.
Fernandes,A. C. S.; Berbert-Born, M.; Queiroz, E. T., eds.). Brasília: SIGEP, Disponível: «http://www.unb.br/ig/sigep/sitio014/sitio014.pdf». Acesso: em 18 de novembro de 2013.
Ferreira, W. R.; Paiva, L. T.; Callisto, M., 2011.Development of a benthic multimetric index for biomonitoring of a neotropical watershed. Brazilian Journal of Biology. 71:15-25.
Florencio, M.; Serrano, L.; Gómez-Rodríguez, C.; Millán, A.; Díaz-Paniagua, C., 2009. Inter and intra-annual variations of macro invertebrate assemblages are related to the hydroperiod in Mediterranean temporary ponds. Hydrobiologia 634:167–183.
Florencio, M.; Gómez-Roqriguez, C.; Serrano, L.; Díaz-Paniagua, C., 2013. Competitive exclusion and habitat segregation in seasonal macroinvertebrate assemblages in temporary ponds. Freshwater science. 32: 650-662.
FUNCEME – Fundação Cearense de Meteorologia e Recursos Hídricos. Série histórica dos dados de precipitação do Ceará. FUNCEME, 2013, disponível em: http://www.funceme.br/index.php/areas/tempo/download-de-series-historicas.
Garmendia, A.; Pedrola-Monfort, J., 2010 - Simulation model comparing the hydroperiod of temporary ponds with different shapes. Limnetica, 29:145-152.
Gascón, S.; Boix, D.; Sala, J.; Quintana, X. D., 2008. Relation between
macroinvertebrate life strategies and habitat traits in Mediterranean salt marsh ponds (Emporda` wetlands, NE Iberian Peninsula). Hydrobiology. 597:71-83.
Grilas, P.; Gauthier, P.; Yavercovski, N.; Perennou, C., 2004. Mediterranean temporary pools I – issues relating to conservation, functioning and management. Arles: Station biologique de la tour du Valat. 120p.
Hamilton IV, R.; Kourtev, P. S.; Post, C.; Dillard, J.; Knepper, K. J., 2012.
Physicochemical Characteristics and Benthic macroinvertebrate Communities in Temporary Surface Waters of Northern Stark County, Ohio. The Open Entomology Journal, 6:1-8.
Hauer, F. R. and V. H. Resh. 2006. Macroinvertebrates. pp. 435-464. In: Methods in Stream Ecology (Hauer, Lamberti, eds.). New York: Academic Press/Elsevier, 877p. Hawkes, H. A.,1997. Origin and development of the biological monitoring working party score system. Water Research. 32:964-968.
Heino, J., 2000 - Lentic macroinvertebrate assemblage structure along gradients in spatial heterogeneity, habitat size and water chemistry. Hydrobiologia, 418: 229–242. Jackson, J. K.; Fureder, L., 2006. Long-term studies of freshwater
macroinvertebrates: a review of the frequency, duration and ecological significance. Freshwater Biology. 51:591-603.
Jacobsen, D.; Schultz, R.; Encalada, A., 1997. Structure and diversity of stream invertebrate assemblages: the influence of temperature with altitude and latitude. Freshwater Ecology, 38: 247-261.
Jocque, M.; Martens, K.; Riddoch, B.; Brendonck, L. 2006. Faunistics of ephemeral rock pools in southeastern Botswana. Archiv fur hydrobiologie. 165:415-431.
Jocque M.; Riddoch, B.; Brendonck, L., 2007. Successive phases and species replacements in freshwater rock pools with a biological definition of ephemeral water bodies. Freshwater Biology, 52, 1734–1744.
Jocque, M.; Vanschoenwinkel, B.; Brendonck, L., 2010. Freshwater rock pools: a review of habitat characteristics, faunal diversity and conservation value. Freshwater Biology. 55:1587-1602.
Kelting, F. M. S., 2009. O clima e a paisagem da bacia hidrográfica do litoral – estado do Ceará. Boletim Goiano de Geografia. 29:83-89.
Kiflawi, M.; Eitam, A.; Blaustein, L., 2003. The relative impact of local and regional processes on macro-invertebrate species richness in temporary pools. Journal of Animal Ecology. 72:447-452.
Lahr, J.; Diallo, A. O.; Ndour, K. B.; Badji, A.; Diouf, P. S., 1999. Phenology of Invertebrates living in a sahelian temporary pond. Hydrobiologia, 405: 189-205.
Lassen, H. H., 1975. The diversity of freshwater snails in view of the equilibrium theory of island biogeography. Oecologia, 19:1–8.
Lytle, D. A.; Poff, N. L., 2004. Adaptation to natural flow regimes. Trends in ecology and evolution. 19:95-100.
Lytle, D., 2002. Flash floods and aquatic insect life-history evolution: evalution of multiple models. Ecology. 83:370-385.
MacArthur, R., Wilson, E.O., 1967. The Theory of Island Biogeography. New Jersey: Princeton University Press, .
Maltchik, L.; Lanés, L. E. K.; Stenert, C.; Medeiros, ES F., 2010. Species-area relationship and environmental predictors of fish communities in coastal freshwater wetlands of southern Brazil. Environmental Biology of Fishes, 88:25–35.
Merrit, R. W.; Cummins, K. W., 1996. An introduction to the aquatic insects of North America. Dubuque. Kendall Hunt Publishing Company. 862p.
Moreno, P.; Callisto, M., 2006. Benthic macroinvertebrates in the watershed of an urban reservoir in southeastern Brazil. Hydrobiologia, 560:311–321.
Mugnai, R.; Nessimian, J. L.; Baptista, D. F., 2010. Manual de identificação de macroinvertebrados aquáticos. Rio de Janeiro: Technical Books Editora, 176p.
Oertli, B.; Joye, D. A.; Castella, E.; Juge, R.; Cambin, D.; Lachavanne, J. B., 2001. Does size matter? The relationship between pond area and biodiversity. Biological Conservation. 104: 59-70.
Porst, G.; Irvine, K., 2009. Distinctiveness of macroinvertebrate communities in turloughs (temporary ponds) and their response to environmental variables. Aquatic conservation: Marine and Freshwater Ecosystems, 19: 456–465.
Porst, G.; Naughton, O.; Gill, L.; Johnston, P.; Irvine, K., 2012. Adaptation, phenology and disturbance of macroinvertebrates in temporary water bodies. Hydrobiologia. 696:47–62.
Resh, V. H.; Solem, J. O., 1996. Phylogenetic relationships and evolutionary adaptations of aquatic insects. 98-107. In: An introduction to the aquatic insects of North. Dubuque, Kendall Hunt Publishing Company, 862p.
Ribera, I.; Isart, J.; Régil, J. A., 1994. Coleopteros acuaticos de lós estanys de capmany (Girona): Hydradephaga. Scientia Gerudensis. 20:17-34.
Ripley, B. J.; Simovich, M. A., 2009. Species richness on islands in time: variation in ephemeral pond crustacean communities in relation to habitat duration and size. Hydrobiologia, 617:181–196.
Romanuk, T.N.; Kolasa, J., 2006. Environmental variability alters the relationship between richness and variability of community abundances in aquatic rock pool microcosms. Écoscience. 9:55-62.
Schriever, T. A.; Williams, D. D., 2013. Influence of pond hydroperiod, size and community richness on food –chain length. Freshwater Science, 32:964-975. Schwartz, S. S.; Jenkins, D. G., 2000. Temporary aquatic habitats: constraints and opportunities. Aquatic Ecology. 34:3-8.
Siepel, H., 1994. Life-history strategies of soil microarthropods. Biology and fertility of soils. 18:263-278.
Smith, R.W.E.; Pearson, R. G., 1987. The macro-invertebrate communities of temporary pools in an intermittent stream in tropical Queensland. Hydrobiologia. 150:45-61.
Solimini, A. G.; Ruggiero, A.; Bernardini, V.; Carchini, G., 2003. Temporal pattern of macroinvertebrate diversity and production in a new man made shallow lake.
Hydrobiologia, 506-509: 373–379.
Southwood, T. R. E., 1977. Habitat, the templet for ecological strategies? Journal of animal ecology. 46:337-365.
Spencer, M.; Blaustein, L.; Schwartz, S. S.; Cohen, J. E., 1999. Species richness and the proportion of predatory animal species in temporary freshwater pools:
relationships with habitat size and permanence. Ecology Letters, 2: 157-166.
Stearns, S. C., 1976. Life-history tactics: a review of the ideas. The quarterly review of biology. 51:3-47.
Strayer, D.; Dudgeon, D. 2010. Freshwater biodiversity conservation: recent progress and future challenges. Journal of the North American Benthological Society, 29:344-358.
Sueiro, M. C.; Bortolus, A.; Schwindt, E., 2011. Habitat complexity and community composition: relationships between different ecosystem engineers and the
associated macroinvertebrate assemblages. Helgoland Marine Research, 65:467-477.
Underwood, A. J.; Skilleter, G. A., 1996. Effects of patch-size on the structure of assemblages in rock pools. Journal of Experimental Marine Biology and Ecology, 197:63–90.
Urban, M. C., 2004. Disturbance heterogeneity determines freshwater metacommunity structure. Ecology. 85:2971-2974.
Vanschoenwinkel, B.; Hulsmans, A.; Roeck, E.; Vries, C.; Seaman, M.; Brendonck, L., 2009. Community structure in temporary freshwater pools: disentangling the effects of habitat size and hydroregime. Freshwater Biology, 54: 1487–1500.
Vaughn, C. C.; Hakenkamp, C. C. 2001. The functional role of burrowing bivalves in freshwater ecosystems. Freshwater Biology, 46: 1431-1446.
Walker, P. D.; Wijnhoven, S.; Velde, G., 2012. Macrophyte presence and growth form influence macroinvertebrate. Aquatic Botany, 104:80–87.
Wallace, J. B.; Webster, J. R., 1996. The role of macroinvertebrate in stream ecosystem function. Annual Review of Entomology. 41:115-139.
Williams, D., 1985. Biotic adaptations in temporary lentic waters, with special reference to those in semi-arid and arid regions. Hydrobiologia. 125: 85-110.
Williams, D., 1997. Temporary ponds and their invertebrate communities. Aquatic conservation: marine and freshwater ecosystems. 7:105-117.
Williams, P.; Biggs, J.; Fox, G.; Nicolet, P.; Whitfield, M., 2001. History, origins and importance of temporary ponds. Freshwater Forum. 17:7-15.
Wissinger, S. A.; Greig, H.; McIntosh, A., 2009. Absence of species replacements between permanent and temporary lentic communities in New Zealand. Journal of the North American Benthological Society. 28:12-23.
APÊNDICE A – COMPOSIÇÃO DE MACROINVERTEBRADOS NO PERÍODO DE CHEIA NAS POÇAS DO SÍTIO PALEONTOLÓGICO LAJINHAS, ITAPIPOCA-CE.
Táxon P1 P2 P3 P4 P5 P6 P7 P8 P9 P10 P11 P12 P13 P14 P15 P16 P17 P18 P19 P20 P21 P22
OLIGOCHAETA - 2 5 15 - - 7 2- 2 1 - - - -
INSECTA Coleoptera Curculionidae
Listrotonotus 2 1 1 7 2 - 2 1 - - 1 1 - - - 1 - - - -
Steremnius 4 1 7 17 14 1 28 14 1 2 4 13 1 2 - 2 11 20 - 1 - -
Dytiscidae
Agabus - - - 2 - 2 - - - -
Cybister 3 2 1 1 2 3 2 2 - 1 6 1 - 1 - 2 - 2 1 4 8 6
Dytiscus 1 - - - 3 1 - 9 - - - - 1 20 6 2
Uvarus - - - 2 1 - 3 - 3 1 - - - 11 8 1
Elmidae
Ancyronix - 5 7 5 1 - - 1 - - - -
Dubiraphia - - - 10 1
Planocerus - - - 1 - - - -
Georyssidae
Georyssus 1 - - - -
Haliplidae
Haliplus 1 1 - - - 1 - - - - -
Hydrophilidae
Anacaena 10 7 17 41 12 14 15 5 8 2 6 12 10 12 3 - 15 26 - 48 3 5
Derallus - - - 2 - - - -
Paracymus 34 10 20 62 32 20 25 12 10 5 14 17 12 21 6 - 20 44 1 68 8 10
Tropisternus - - - - 7 - - 4 - - - 3 - - 11 - 2 - -
Staphylinidae
Bledius - - - 1 - - - -
Stenus 3 1 3 8 1 - 10 3 1 3 - 2 - - - 1 - - - -
Ceratopogonidae
Alluaudomyia - - - 1 - 1 - - - -
Probezzia - - - 1 - - - -
Chironomidae 20 15 11 2 27 11 7 13 8 3 38 21 18 10 34 4 20 14 17 45 10 6
Culicidae
Deinocerites - - 1 - 4 - - - 3 1 - 1 1 - - - 1 22 - -
Orthopodomyia - - 2 1 2 - - - - 2 13 5 2 10 8 1 3 1 9 19 - -
Dryomizidae
Oedoparena - - - 1 - - - -
Muscidae
Limnophora - - - 2 - - - -
Stratiomyidae
Odontomyia - - - 1 2 - - 4 - - - 1 -
Tabanidae
Chrysops 10 4 4 23 4 2 5 10 - - 6 4 2 - 4 - - 3 - 1 - -
Thaumaleidae
Thaumalea 1 - - - -
Ephemeroptera Baetidae
Baetis - - - - 3 - - - 32 12 13
Cloeon - - - 4 - - - 1 11 2 -
Hemiptera
Aphididae 4 - - 9 - - - 4 2 13 9 1 9 4 2 24 - 3 - -
Belostomatidae
Abedus - - - 1 - - - 12 8
Gerridae
Rheumatobates - - - 1 - - - -
Macroveliidae
Macrovelia 3 1 13 31 11 1 2 1 - - 4 4 3 12 1 2 3 4 1 - 1 -
Mesoveliidae
Mesovelia 5 - 7 23 3 - 6 - 3 5 3 1 3 4 - - 1 1 3 1 1 -