UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
DEPARTAMENTO DE PATOLOGIA E MEDICINA LEGAL PROGRAMA DE PÓS-GRADUAÇÃO EM MICROBIOLOGIA MÉDICA
BRUNA STEFÂNIA FERREIRA MELLO
EXPOSIÇÃO SISTÊMICA DE CAMUNDONGOS ADULTOS A
LIPOPOLISSACARÍDEO DE Escherichia coli: INFLUÊNCIA DO SEXO NAS ALTERAÇÕES COMPORTAMENTAIS E NEUROQUÍMICAS E EFEITO DO
TRATAMENTO COM ESCITALOPRAM E DOXICICLINA
BRUNA STEFÂNIA FERREIRA MELLO
EXPOSIÇÃO SISTÊMICA DE CAMUNDONGOS ADULTOS A
LIPOPOLISSACARÍDEO DE Escherichia coli: INFLUÊNCIA DO SEXO NAS ALTERAÇÕES COMPORTAMENTAIS E NEUROQUÍMICAS E EFEITO DO
TRATAMENTO COM ESCITALOPRAM E DOXICICLINA
Tese apresentada ao Programa de Pós-Graduação em Microbiologia Médica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Doutora em Microbiologia Médica.
Orientadora: Profa. Dra. Danielle Macêdo Gaspar.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
M476e Mello, Bruna Stefânia Ferreira.
EXPOSIÇÃO SISTÊMICA DE CAMUNDONGOS ADULTOS A LIPOPOLISSACARÍDEO DE Escherichia coli: INFLUÊNCIA DO SEXO NAS ALTERAÇÕES COMPORTAMENTAIS E NEUROQUÍMICAS E EFEITO DO TRATAMENTO COM ESCITALOPRAM E DOXICICLINA / Bruna Stefânia Ferreira Mello. – 2017.
178 f. : il. color.
Tese (doutorado) – Universidade Federal do Ceará, Faculdade de Medicina, Programa de Pós-Graduação em Microbiologia Médica, Fortaleza, 2017.
Orientação: Profa. Dra. Danielle Macêdo Gaspar.
1. Depressão. 2. Lipopolissacarídeo. 3. Neuroinflamação. 4. Doxiciclina. 5. Neuroproteção. I. Título.
BRUNA STEFÂNIA FERREIRA MELLO
EXPOSIÇÃO SISTÊMICA DE CAMUNDONGOS ADULTOS A
LIPOPOLISSACARÍDEO DE Escherichia coli: INFLUÊNCIA DO SEXO NAS ALTERAÇÕES COMPORTAMENTAIS E NEUROQUÍMICAS E EFEITO DO
TRATAMENTO COM ESCITALOPRAM E DOXICICLINA
Tese apresentada ao Programa de Pós-Graduação em Microbiologia Médica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Doutora em Microbiologia Médica.
Aprovada em: 26/10/2017. BANCA EXAMINADORA:
___________________________________________________ Profa. Dra. Danielle Macêdo Gaspar (Orientadora)
Universidade Federal do Ceará (UFC)
__________________________________________________ Profa. Dra. Larissa Deadame de Figueiredo Nicolete
Centro Universitário Christus (Unichristus)
_________________________________________________ Prof. Dr. Fábio Miyajima
Universidade Federal do Ceará (UFC)
________________________________________________ Profa. Dra. Francisca Cléa Florenço de Sousa
Universidade Federal do Ceará (UFC)
________________________________________________ Profa. Dra. Silvânia Maria Mendes Vasconcelos Patrocínio
Dedico este trabalho a Deus.
AGRADECIMENTOS
A Deus, pai de bondade, Senhor do impossível, fonte de toda a minha força, saúde, coragem e fé.
À Universidade Federal do Ceará – UFC e ao Programa de Pós Graduação em Microbiologia Médica - PPGMM, representado pelos professores e demais funcionários, pelo empenho na formação científica dos alunos, propiciando a realização desse projeto.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES pelo suporte financeiro que viabilizou a execução desse projeto.
À minha orientadora Profa. Dra. Danielle Macêdo Gaspar, por ter me aceitado e acreditado em mim, bem como por toda a sua orientação, dedicação e pelos ensinamentos fundamentais que contribuíram de forma essencial para meu amadurecimento científico.
A todos que fazem parte do Laboratório de Neuropsicofarmacologia do Núcleo de Pesquisa e Desenvolvimento de Medicamentos - NPDM/UFC pela colaboração na execução desse projeto.
À Charllyany Sabino Custódio e ao nosso aluno de iniciação científica, Adriano José Maia Chaves Filho, por todo o empenho e contribuições para a realização desse trabalho.
À Banca Qualificadora, Dr. Thyago Moreira de Queiroz e Dra. Camila Nayane de Carvalho Lima, pelas relevantes contribuições.
À Banca Examinadora, por aceitar cordialmente o convite.
Aos meus pais, José Valdízio de Oliveira Mello e Belaniza Ferreira Mello, por toda educação, orientação, apoio, encorajamento, cuidado e amor. Vocês são meus exemplos a serem seguidos.
Ao meu noivo Marcelo Sá por toda sua compreensão e apoio.
apoio, cuidado, amizade, pelo seu companheirismo.
À minha avó, Eloiza Ferreira Moura, por todo o seu exemplo de amor, força, orações e carinho, que sempre me incentivou a continuar seguindo em frente na constante busca pelo conhecimento.
Aos meus amigos de todas as épocas, aos meus colegas de doutorado e a todos aqueles que direta ou indiretamente contribuíram para a realização desse meu sonho.
“Sem sonhos, a vida não tem brilho. Sem metas, os sonhos não têm alicerces. Sem prioridades, os sonhos
RESUMO
A depressão é um dos mais prevalentes transtornos psiquiátricos, tendo como principais sintomas clínicos a anorexia, a redução da atividade locomotora, a anedonia e a falta de concentração. Há evidências de que alterações imunoinflamatórias estão subjacentes à depressão. Além disso, o sexo é um fator relevante para a manifestação de sintomas da depressão, embora evidências mais recentes apontem para uma gravidade semelhante da depressão em ambos os sexos. O tratamento da depressão é pouco eficaz devido ao fato das medicações existentes não atuarem nos diversos mecanismos fisiopatológicos deste transtorno. Nesse contexto, a combinação de antidepressivos com diferentes mecanismos de ação é uma prática comum em não-respondedores ou respondedores parciais aos antidepressivos. Vale destacar que fármacos antidepressivos e antimicrobianos têm demonstrado propriedades anti-inflamatórias. Os objetivos do presente estudo foram: i) investigar a influência do sexo nas alterações comportamentais e neuroinflamatórias/oxidativas no modelo animal de sintomas tipo depressão induzido por exposição única ao desafio imune por lipopolissacarideo (LPS) de Escherichia coli e ii) avaliar em animais machos submetidos à exposição repetida ao LPS, os efeitos terapêuticos da doxiciclina e escitalopram sozinhos e em associação. Para atingir os objetivos propostos o presente estudo se dividiu em dois protocolos. No primeiro protocolo, o modelo de depressão foi induzido pela exposição sistêmica e única de camundongos Swiss machos e fêmeas ao lipopolissacarídeo de E. coli (LPS – 0,5 mg/kg) e avaliação após 24 horas. No segundo protocolo, apenas animais machos foram submetidos à exposição repetida de LPS por 10 dias sendo que após 5 dias de exposição ao LPS os animais receberam doxiciclina ou escitalopram sozinhos ou em associação. Foram avaliadas alterações inflamatórias/oxidativas, bem como em vias de sinalização protetoras. O protocolo 1 mostrou que apenas animais machos apresentaram alteraçōes comportamentais tipo-depressivo, como aumento de imobilidade do nado forçado e diminuição na preferência por sacarose. As fêmeas apresentaram comportamento ansiogênico no labirinto em cruz elevado. Tanto machos quanto fêmeas apresentaram alterações neuroinflamatórias e oxidativas. No protocolo 2, doxiciclina (DOXI - 10 mg/Kg) ou escitalopram (ESCI - 4 mg/kg) sozinhos ou em associação reverteram o aumento de imobilidade induzido pela exposição repetida ao LPS. Os níveis de IL-1β e TNF-α aumentaram após exposição LPS, enquanto DOXI e ESCI reverteram esses níveis. DOXI e o ESCI reverteram o aumento dos níveis de nitrito induzido por LPS. Os níveis de expressão proteica do fator nuclear kappa B (NF-κB) e o marcador da molécula adaptadora de ligação de cálcio ionizada-1 (IBA-1) expresso na microglia ativada foram aumentados no grupo exposto ao LPS sendo revertidos pela DOXI e ESCI, enquanto que os níveis de glicogênio sintase quinase-3 (GSK3β) fosforilada e a proteína quinase regulada extracelular (ERK 1/2) fosforilada foram diminuídos no grupo do LPS e revertidos após o protocolo de tratamento. A DOXI também aumentou os níveis proteicos da ERK 1/2 total e do fator transcripcional da proteína de ligação ao elemento de resposta de AMPc (CREB). Com base nos resultados do presente estudo, a DOXI quando administrada sozinha ativou mais mecanismos neuroprotetores em comparação ao ESCI, como aumento dos níveis cerebrais de GSH e CREB fosforilado, além da combinação das duas drogas ter reduzido os níveis de NF-κB e aumentado GSK3β fosforilado. Portanto, sugere-se que a DOXI pode atuar como um antidepressivo, apresentando efeitos superiores aos observados com o escitalopram.
ABSTRACT
Depression is one of the most prevalent psychiatric disorders, having the main clinical symptoms anorexia, reduced locomotor activity, anhedonia and lack of concentration. There is evidence that immunoinflammatory changes underlie depression. In addition, sex is a relevant factor for the manifestation of depression symptoms, although more recent evidence points to a similar severity of depression in both sexes. The treatment of depression is ineffective due to the fact that existing medications do not act on the different pathophysiological mechanisms of this disorder. In this context, the combination of antidepressants with different mechanisms of action is a common practice in non-responders or partial responders to antidepressants. It is worth mentioning that antidepressant and antimicrobial drugs have shown anti-inflammatory properties. The objectives of the present study were: i) to investigate the influence of sex on behavioral and neuroinflammatory/ oxidative changes in the animal model of depression-induced symptoms induced by single exposure to the lipopolysaccharide immune challenge (LPS) of Escherichia coli; and ii) to evaluate male animals under repeated exposure to LPS, the therapeutic effects of doxycycline and escitalopram alone and in combination. To reach the proposed objectives, the present study was divided into two protocols. In the first protocol, the depression model was induced by systemic and single exposure of male and female Swiss mice to E. coli
lipopolysaccharide (LPS - 0.5 mg/kg) and evaluation after 24 hours. In the second protocol, only male animals were submitted to repeated exposure of LPS for 10 days and after 5 days of exposure to LPS the animals received doxycycline or escitalopram alone or in combination. Inflammatory/oxidative alterations were evaluated, as well as in protective signaling pathways. Protocol 1 showed that only male animals presented behavioral-type depressive changes, such as increased immobility of forced swimming and decrease in the preference for sucrose. The females presented anxiogenic behavior in the high cross labyrinth. Both males and females presented neuroinflammatory and oxidative alterations. In protocol 2, doxycycline (DOXI - 10 mg/kg) or escitalopram (ESCI - 4 mg/kg) alone or in combination reversed the increase in immobility induced by repeated exposure to LPS. Levels of IL-1β and TNF-α increased after LPS exposure, while DOXI and ESCI reversed these levels. DOXI and ESCI reversed the increase in nitrate levels induced by LPS. Protein expression levels of the nuclear factor kappa B (NF-κB) and the marker of the ionized calcium binding adapter molecule-1 (IBA-1) expressed in the activated microglia were increased in the group exposed to LPS being reverted by DOXI and ESCI, whereas phosphorylated glycogen synthase kinase-3 (GSK3β) and phosphorylated extracellular regulated kinase (ERK 1/2) levels were decreased in the LPS group and reversed after the treatment protocol. DOXI also increased the protein levels of total ERK 1/2 and the transcriptional factor of the binding protein to the cAMP response element (CREB). Based on the results of the present study, DOXI when administered alone activated more neuroprotective mechanisms compared to ESCI, such as increased brain levels of GSH and phosphorylated CREB, in addition to the combination of the two drugs having reduced levels of NF-kB and increased GSK3β phosphorylated. Therefore, it is suggested that DOXI may act as an antidepressant, presenting higher effects than those observed with escitalopram.
LISTA DE FIGURAS
Figura 1 - Interação entre as Monoaminas e seus Correlatos Clínicos... 22
Figura 2 - Teorias Inflamatórias da Depressão... 26
Figura 3 - Fisiopatologia da Depressão desencadeada pela inflamação... 28
Figura 4 - Estrutura Química do LPS... 31
Figura 5 - Mecanismos Inflamatórios do LPS... 33
Figura 6 - Após o estímulo extracelular por LPS ou citocinas pró-inflamatórias ocorre a formação de ROS e RNS... 38
Figura 7 - Mecanismos das vias intracelulares no processo inflamatório... 44
Figura 8 - Estrutura Química do Escitalopram... 50
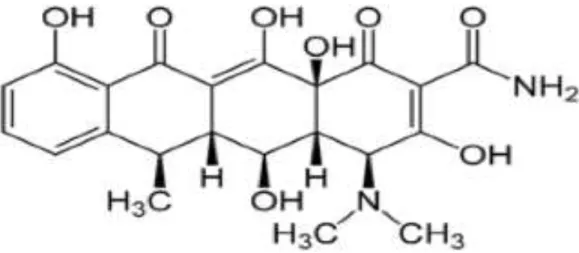
Figura 9 - Estrutura Química da Doxiciclina... 53
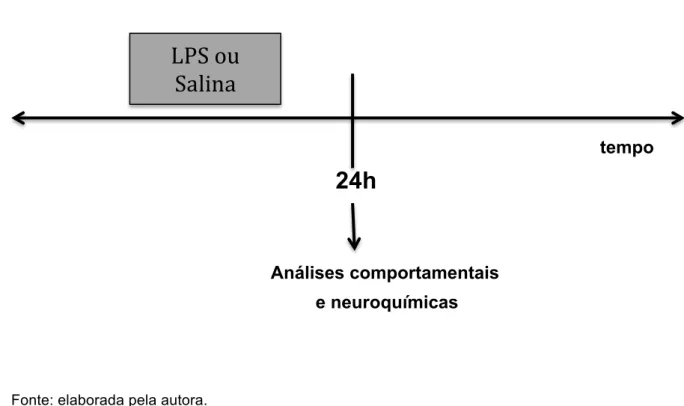
Figura 10 - Demonstração esquemática para o protocolo de administração única de LPS... 60
Figura 11 - Modelo Experimental do Protocolo de Tratamento... 61
Figura 12 - Tempo de Imobilidade no Teste Nado Forçado em animais machos e fêmeas tratados com administração única de LPS... 71
Figura 13 - Teste de Preferência de Sacarose em animais machos e fêmeas tratados com administração única de LPS... 72
Figura 14 - Teste no Campo Aberto sobre atividade locomotora de animais machos e fêmeas tratados com administração única de LPS... 74
Figura 15 - Teste no Plus Maze sobre o comportamento de ansiedade em animais machos e fêmeas tratados com administração única de LPS... 76
Figura 16 - Níveis de MDA em animais machos e fêmeas tratados com administração única de LPS... 78
Figura 18 - Atividade inflamatória na Mieloperoxidase (MPO) de animais machos e fêmeas tratados com administração única de LPS... 82 Figura 19 - Níveis de IL-1β em animais machos e fêmeas tratados com
administração única de LPS... 84 Figura 20 - Níveis de BDNF em animais machos e fêmeas tratados
comadministração única de LPS... 85 Figura 21 - Tempo de imobilidade no teste do nado forçado em animais machos
tratados com DOXY ou ESCI após administração repetida de LPS... 86 Figura 22 - Atividade locomotora no campo aberto em animais machos tratados
com DOXY ou ESCI após admistração repetida de LPS... 88 Figura 23 - Mapa do trajeto percorrido pelos animais no teste do campo aberto... 89 Figura 24 - Tempo de Latência no teste da alimentação suprimida pela novidade
em animais machos tratados com DOXY ou ESCI após
administração repetida de LPS... 90 Figura 25 - Níveis de MDA em animais machos tratados com DOXY ou ESCI
após administração repetida de LPS... 92 Figura 26 - Níveis de GSH em animais machos tratados com DOXY ou ESCI
após administração repetida de LPS... 93 Figura 27 - Níveis de nitrito em animais machos tratados com DOXY ou ESCI
após administração repetida de LPS... 95 Figura 28 - Níveis de IBA-1 no hipocampo emanimais machos tratados com
DOXY ou ESCI após administração repetida de LPS... 96 Figura 29 - Níveis hipocampais de NF-κB em animais machos tratados com
DOXY ou ESCI após administração repetida de LPS... 97 Figura 30 - Níveis hipocampais de IL-1β e TNF-α em animais machos tratados
com DOXY ou ESCI após administração repetida de LPS... 99 Figura 31 - Níveis de ERK1/2 fosforilada e total no hipocampo de animais
Figura 32 - Níveis de GSK-3β fosforilado e total no hipocampo de animais machos tratados com DOXY ou ESCI após administração repetida
de LPS... 102 Figura 33 - Níveis de CREB fosforilada no hipocampo de animais machos
LISTA DE TABELAS
LISTA DE ABREVIATURAS E SIGLAS
5-HT – Serotonina ACh – Acetilcolina
ACTH – Hormônio adrenocorticotrófico AKT – Proteína quinase serina/treonina AMPc – Adenosina 3',5'-monofosfato cíclico ANOVA – Análise de variância
AP-1 – Proteína ativadora 1
BDNF – Fator neurotrófico derivado do cérebro CE – Corpo Estriado
COMT – Catecol-O-metiltransferase COX-2 – Ciclooxigenase-2
CPF – Córtex Pré-frontal
CREB – Proteína de ligação ao elemento de resposta de AMPc CRH – Hormônio liberador de corticotrofina
DA – Dopamina DOXI – Doxiciclina
DSM-V – V Manual Diagnóstico e Estatístico de Doenças Mentais ERK – Proteína quinase regulada extracelular
ESCI – Escitalopram et al – E colaboradores
GSH – Glutationa reduzida
GSK-3β – Glicogênio sintase quinase-3β h – Hora
HP – Hipocampo
HPA – Hipotálamo-pituitária-adrenal HT – Hipotálamo
H2O2 – Péróxido de hidrogênio
H2SO4 – Ácido sulfúrico
IBA1 – Molécula adaptadora de ligação de cálcio ionizada-1 IDO – Indoleamina 2,3-dioxigenase
i.p. – Intraperitoneal IFN-γ – Interferon gama
IkB – Proteína inibitória de kappa B IKK – IkB quinase
IL – Interleucina IL-1β – Interleucina 1β
IL-6 – Interleucina 6 IL-10 – Interleucina 10
IO&NS – Inflamatória por vias de estresse oxidativo e nitrosativo I&ND – Inflamatória & neurodegenerativa
iNOS – Óxido nítrico sintase induzida
ISRS – Inibidor Seletivo de Recaptação de Serotonina KCl – Cloreto de potássio
Kg – Quilograma
LBP – Proteína ligadora de LPS LPS – Lipopolissacarídeo
MAO – Monoamina oxidase MDA – Malondialdeído
MPO – Mieloperoxidase
MPP – Matriz metaloproteinase
MPTP –1-metil-4-fenil-1,2,3,6-tetra-hidropiridina MyD88 – Fator de diferenciação mielóide 88 NA – Noradrenalina
(NaNO
!) – Nitrito de sódio
NE – Norepinefrina
NF-κB – Fator Nuclear Kappa B NO – Óxido Nítrico
NO !
! – Nitrito
NO!! – Nitrato
NS – Não Significativo N2O – Óxido nitroso
O2 – Oxigênio
O
!
!– Superóxido
OH!– Hidroxila OH-
ONOO!– Peroxinitrito
O&NS – Vias de estresse oxidativo e nitrosativo PBS – Tampão fosfato salino
PI3K – Fosfatidilinositol 3-quinase PKA – Proteína quinase A
RNAt – RNA transportador
RNS – Espécies reativas de nitrogênio RO!– Alcoxila
ROO!– Peroxila
SRI – Sistema de Resposta Inflamatória
TAK1 – Fator de crescimento transformador β-ativado quinase 1 TBARS – Substâncias reativas de ácido tiobarbitúrico
Th1 – T helper do tipo 1 Th2 – T helper do tipo 2 TLRs – Receptores Toll-like
TNF-α – Fator de Necrose Tumoral α
SUMÁRIO
1 INTRODUÇÃO ... 19
2 REVISÃO DE LITERATURA ... 21
2.1 Fisiopatologia da Depressão... 21
2.2 Hipótese Inflamatória da Depressão ... 24
2.3 O papel do LPS na Depressão... 30
2.4 O Envolvimento do Estresse Oxidativo na Depressão……....….…... 35
2.5 Participação de Mecanismos protetores/inflamatórios pelas vias NF-kB, ERK, GSK, IBA-1,CREB... 39
2.6 Diferenças de Genêro da Depressão………... 45
2.7 Tratamento Farmacológico da Depressão………... 47
2.7.1 Inibidores Seletivos de Recaptação de Serotonina (ISRS)………... 49
2.7.2 Doxiciclina e seu Papel Neuroprotetor……….……...….………... 52
3 HIPÓTESES……….……. 56
4 OBJETIVOS……….……….… 57
4.1 Objetivos Gerais………... 57
4.2 Objetivos Específicos………... 57
5 MATERIAIS E MÉTODOS ………...………..……... 59
5.1 Animais... 59
5.2 Drogas... 59
5.3 Procedimento Experimental... 60
5.4 Testes Comportamentais... 62
5.4.1 Teste do Nado Forçado... 62
5.4.2 Teste do Campo Aberto... 62
5.4.3 Labirinto em Cruz Elevado (Pluz maze)... 63
5.4.5 Teste da Alimentaçāo Suprimida pela Novidade... 64
5.5 Testes Neuroquímicos... 64
5.5.1 Determinação das Alterações Oxidativas... 65
5.5.1.1 Determinaçāo dos níveis de TBARS... 65
5.5.1.2 Determinaçāo dos níveis de Glutationa reduzida (GSH)... 65
5.5.1.3 Determinaçāo do conteúdo de Nitrito... 66
5.6 Determinação de parâmetros relacionados a sinalizações pró-inflamatórias e protetoras... 66
5.6.1 Atividade da Mieloperoxidase (MPO)... 66
5.6.2 Teste de Elisa para dosagem dos níveis de IL1β, TNFα e BDNF... 67
5.7 Expressāo proteica de ERK, IBA, GSK, NFkB, p-CREB por Western Blotting... 68
5.7.1 Preparação do extrato total de proteínas... 68
5.7.2 Método Bradford para dosagem de proteínas ... 68
5.7.3 Western Blotting... 69
5.8 Análise estatística dos resultados... 70
6 RESULTADOS... 71
6.1 Influência do sexo sobre o tempo de imobilidade no nado forçado em camundongos expostos ao LPS... 71
6.2 Influência do sexo sobre a preferência por sacarose em camundongos expostos ao LPS... 72
6.3 Influência do sexo sobre a atividade locomotora no Campo Aberto em camundongos expostos ao LPS... 73
6.4 Influência do sexo sobre o comportamento de ansiedade no Labirinto em Cruz elevado em camundongos expostos ao LPS... 75
6.6 Influência do sexo sobre os níveis cerebrais de GSH em
camundongos expostos ao LPS... 79 6.7 Influência do sexo sobre a atividade da mieloperoxidase em áreas
cerebrais de camundongos expostos ao LPS... 81 6.8 Influência do sexo sobre os níveis cerebrais de IL1β em
camundongos expostos ao LPS... 83 6.9 Influência do sexo sobre os níveis hipocampais de BDNF em
camundongos expostos ao LPS... 85 6.10 Efeito do tratamento com doxiciclina ou escitalopram sobre o
comportamento tipo-depressivo induzido por administração repetida
de LPS... 86 6.11 Efeito do tratamento com doxiciclina ou escitalopram sobre a atividade
locomotora... 87 6.12 Efeito do tratamento com doxiciclina ou escitalopram sobre o teste da
alimentação suprimida pela novidade... 90 6.13 Efeito do tratamento com doxiciclina ou escitalopram sobre o estresse
oxidativo induzido por LPS... 91 6.14 Efeito do tratamento com doxiciclina ou escitalopram sobre as
alterações nos níveis de nitrito induzidas por LPS... 94 6.15 Efeito do tratamento com doxiciclina ou escitalopram sobre a
expressao de proteína IBA-1em animais expostos ao LPS... 96 6.16 Efeito do tratamento com doxiciclina ou escitalopram sobre a
expressão do fator de transcrição NF-κB em animais expostos a
LPS... 97 6.17 Tratamento com doxiciclina ou escitalopram reverte as alterações nos
níveis de IL-1β e TNF-α induzidas por LPS... 98 6.18 Efeito do tratamento com doxiciclina ou escitalopram sobre a
expressão da proteína ERK 1/2 fosforilada em animais expostos ao
6.19 Efeito do tratamento com doxiciclina ou escitalopram sobre a expressão da proteína GSK-3βfosforilada em animais expostos ao
LPS... 102 6.20 Efeito do tratamento com doxiciclina ou escitalopram sobre a
expressão de CREB fosforilado em animais expostos ao LPS... 103 7 DISCUSSĀO... 106 8 CONCLUSÃO... 122
REFERÊNCIAS... ANEXOS...
1 INTRODUÇÃO
A depressão é um transtorno mental crônico, comum e recorrente, tendo uma estimativa de 350 milhões de pessoas afetadas mundialmente. É a principal causa de incapacidade em todas as faixas etárias, desde os jovens até os idosos, prevalecendo mais em mulheres que em homens. Esse transtorno psiquiátrico pode acarretar ao suicídio, no qual cerca de 800 mil pessoas morrem a cada ano, sendo a segunda principal causa de morte entre pessoas com idade entre 15 e 29 anos (OMS, 2016).
Segundo o Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM-V), a depressão pode manifestar-se como transtorno depressivo maior. Nesse caso, os critérios do DSM-V especificam que pelo menos cinco dos nove sintomas que se seguem devem estar presentes: humor deprimido, redução do interesse ou prazer em todas ou quase todas as atividades, perda ou ganho de peso, insônia ou hipersonia, agitação ou retardo psicomotor, fadiga ou perda de energia, sentimentos de desvalia ou culpa inapropriados, redução da concentração e pensamentos de morte ou de suicídio. Para o diagnóstico, é necessário que os sintomas durem pelo menos duas semanas e um deles seja, obrigatoriamente, humor deprimido ou perda de interesse ou prazer (AMERICAN PSYCHIATRY ASSOCIATION, 2013).
Nesse contexto, estudos com modelos animais vêm demonstrando que a estimulação do sistema imune, através de administração do lipopolissacarídeo (LPS), de citocinas pró-inflamatórias ou de indução de uma infecção bacteriana pode resultar na neuroinflamação (O'CONNOR et al., 2003; JOHNSON et al., 2004; JI et al., 2014; ZHANG et al., 2014; BIESMANS et al., 2015) e no desenvolvimento de comportamento tipo-depressivo, evidenciado pelo desespero comportamental (O'CONNOR et al., 2003; JI et al., 2014; ZHANG et al., 2014; ZHU et al., 2015) ou anedonia (KASTER et al., 2012; JI et al., 2014; ZHANG et al., 2014). Assim, em uma inflamação periférica, induzida pelo LPS, causaria sintomas depressivos em humanos e comportamento tipo-depressivo em roedores (REICHENBERG et al., 2001; RAETZ & WHITFIELD, 2002; DANTZER et al., 2008).
Há um crescente número de evidências sobre as diferenças de comportamento entre mulheres e homens, sendo as mulheres mais suscetíveis ao desenvolvimento de distúrbios psicossociais relacionados ao estresse, incluindo depressão (HANKIN et al., 1998), ansiedade (LEWINSOHN et al., 1998) e transtorno de estresse pós-traumático (BRESLAU, 2002). Estudos revelam que a depressão clínica é acompanhada pela ativação de vias/mecanismos imuno-inflamatórios, oxidativos e nitrosativos (MAES et al., 1995; MAES, 2011; KUBERA et al., 2011b; LEONARD & MAES, 2012).
Destarte, a terapia clínica utilizada no tratamento da depressão é realizada com os antidepressivos clássicos, tais como os inibidores da monoamina oxidase, os inibidores seletivos da recaptação da serotonina e da norepinefrina e os tricíclicos (MAES et al., 1997; UHER et al., 2014). Porém, estudos em animais revelaram que o uso de antimicrobianos, como a doxiciclina, minociclina, ceftriaxona possuem efeitos neuroprotetores, semelhantes aos antidepressivos, evidenciando o uso dessas drogas no tratamento de transtornos neurodegenerativos (ROTHSTEIN et al., 2005; KIM et al., 2007; ARAKAWA et al., 2012; MELLO et al, 2013).
2 REVISÃO DE LITERATURA
2.1 Fisiopatologia da Depressão
A etiologia da depressão não é completamente conhecida, sendo de característica multifatorial com influências biológicas, psicológicas, ambientais e genéticas. Em relação às possíveis causas biológicas, a primeira hipótese a ser considerada foi a deficiência funcional dos neurotransmissores monoaminérgicos, os quais são serotonina (5-HT), noradrenalina (NA) e dopamina (DA). Portanto, considera-se que esses neurotransmissores estão envolvidos na fisiopatologia da depressão (SCHILDKRAUT, 1965; COPPEN, 1972; AGUIAR et al., 2011).
A esse respeito, a serotonina é o neurotransmissor mais extensamente estudado na etiologia da depressão (VAN PRAAG & KORF, 1971). A molécula é sintetizada a partir do aminoácido triptofano, pela ação da enzima triptofano hidroxilase, a qual converte o triptofano em 5-hidroxitriptofano. Além disso, o L-aminoácido aromático descarboxilase converte o 5-hidroxitriptofano em serotonina (STRASSER et al., 2016; PALEGO et al., 2016; BRUMMELTE et al., 2017). Porém, o triptofano pode ser degradado pela ação da indoleamina 2,3-dioxigenase (IDO), em quinurenina e posteriormente em ácido quinurênico e ácido quinolínico, através da ativação das via das quinureninas (FOWLER et al., 2015). Portanto, a ativação da via da IDO diminui os níveis de triptofano, consequentemente uma menor produção do neurotransmissor 5-HT (LEONARD & MAES, 2012). Esse neurotransmissor também sofre uma ação de degradação da enzima monoamina oxidase (MAO). Além disso, o desequilíbrio dos receptores serotonérgicos, também estariam envolvidos na fisiopatologia da depressão (WILLNER, 1990; DEAKIN et al., 1991; GRAEFF & BRANDÃO, 1999; FOWLER et al., 2015).
DA, pela ação da enzima DOPA descarboxilase. Por último, DA é convertida em NE, pela ação enzimática da dopamina β-hidroxilase. Porém, a ação das enzimas MAO e Catecol-O-metiltransferase (COMT) irão degradar os neurotransmissores DA e NE, ocorrendo um déficit na neurotransmissão e na alteração de seus respectivos receptores (ULMANEN et al., 1997; FINBERG, 2014).
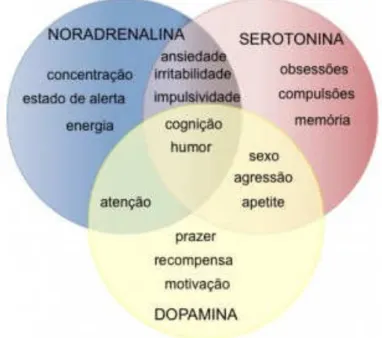
O modelo monoaminérgico é originado em pequenos núcleos no tronco cerebral e mesencéfalo e projetam-se difusamente pelo córtex e sistema límbico. Assim, as áreas límbicas (hipocampo, amígdala, cortex pré-frontal e hipotálamo) e demais áreas do circuito que regulam o humor apresentam uma interação com neurotransmissores 5-HT, NA, DA (NEMEROFF, 1998; ORDWAY et al., 1999; IROTANI et al., 2006). Portanto, os sistemas monoaminérgicos associados a acetilcolina (Ach), exercem efeitos de integração e modulação sobre vários sintomas comportamentais, como as atividades do humor, cognição, psicomotora, memória, prazer, concentração, sono, apetite, atenção (JOCA et al., 2007; DUNLOP & NEMEROFF, 2007). Ansiedade, irritabilidade e impulsividade também são evidenciadas, conforme figura abaixo (SUMEGI, 2008; WOOD & VALENTINO, 2016).
Figura 1 – Interação entre os sistemas monoaminérgicos e seus correlatos clínicos.
Há evidências que o modelo monoaminérgico estaria envolvido com o funcionamento neuroendócrino relacionado ao estresse e que a depressão seria uma resposta a esse estresse crônico (MUSSELAMAN et al., 2003; AGUIAR et al., 2011). Nesse sentido, estudos têm sugerido que o sistema monoaminérgico não representa a via final na regulação do humor, mas exerce uma influência modulatória. Assim, outros sistemas que estariam regulando a plasticidade neuronal e sináptica também teriam importância central na neurobiologia e tratamento desses transtornos (SANACORA et al., 2008; SENS, 2017).
Portanto, o estresse é o agente causal mais importante do desenvolvimento do transtorno depressivo maior (KASCKOW et al., 2001). Assim, o estresse ativa o eixo hipotálamo-hipófise-adrenal (HPA), pela via neuroendócrina, o qual desempenha um papel fundamental nas respostas ao estresse. Dessa forma, o estresse promove a secreção do hormônio liberador de corticotrofina (CRH), na área hipotalâmica, o qual promove a secreção do hormônio adrenocorticotrófico (ACTH) na hipófise anterior, que por sua vez, induz a secreção de glicocorticóides na glândula adrenal, os quais são mediadores do estresse. Nesse sentido, estudos indicaram que o aumento de CRH no líquor de pacientes deprimidos, evidenciando a hiperatividade do eixo HPA na patogênese de distúrbios depressivos (NEMEROFF et al., 1984; BALE & VALE, 2004; WOOD & WOODS, 2007; HOLSBOER & ISING, 2008).
emocional e na regulação do eixo HPA (DE KLOET et al., 1998; MAES et al., 2009c).
A esse respeito, há evidências que a neuroprogressāo, a qual está envolvida com o processo de neurodegeneração, neurogênese reduzida, plasticidade neuronal e apoptose celular, desempenha um papel na fisiopatologia da depressão (BERK et al, 1997; MAES et al., 2009c, 2011d). Nesse contexto, o estresse crônico diminui a expressão do fator neurotrófico derivado do cérebro (BDNF), o qual leva a alterações morfológicas dos neurônios no hipocampo (MONTEGGIA et al., 2007). Esse fator neutrófico está associado ao crescimento, função e aprendizado de células neuronais (DUMAN & MONTEGGIA, 2006; SCHMIDT & DUMAN, 2007; SCHMIDT & DUMAN, 2010), o qual é essencial para sobrevivência e diferenciação fenotípica de células neuronais durante o desenvolvimento e na manutenção e proteção/reparação de neurônios maduros em lesões cerebrais adultas (SAAVEDRA et al., 2008). Portanto, estudos clínicos demostraram baixos níveis de BDNF no soro de pacientes com transtorno depressivo maior (KAREGE et al., 2002; FUCHIKAMI et al., 2011).
2.2 Hipótese Inflamatória da Depressão
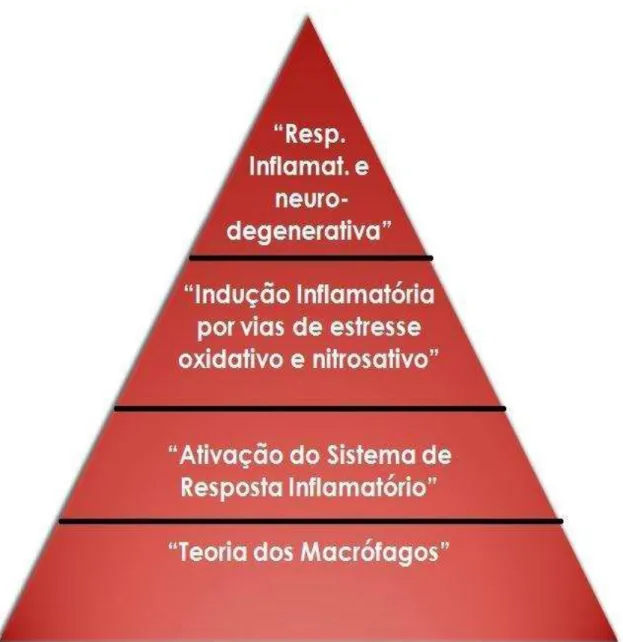
Além de todas as hipóteses elencadas para a fisiopatologia da depressão no item anterior, a depressão também pode ser originada por processos inflamatórios. Nesse sentido, desde a década de 80, foram publicados os primeiros estudos sobre depressão, desencadeada pela inflamação, pela ativação de células monocíticas e células T. Com isso, na prática clínica foram lançadas as bases para uma nova hipótese que a inflamação e a ativação imunitária mediada por células são fatores chaves para o desenvolvimento da depressão (MAES et al., 1990-1991, 1991b, 1992a, 1992b, 1993, 1993a).
de fase aguda. De acordo com essa teoria, as citocinas pró-inflamatórias são responsáveis pela resposta da fase aguda na inflamação, ocasionando vários aspectos clínicos de depressão, como hiperatividade do eixo HPA e distúrbio no metabolismo da serotonina (MAES, 1994c).
Com base nas evidências de investigação e revisão literária de Smith (1991), concordou-se que os macrófagos são ativados pelos linfócitos T e, portanto, que a depressão é caracterizada pela ativação imune mediada por células (MAES et al., 1995). Com isso, os sintomas psicossomáticos ou vegetativos que ocorrem na depressão são manifestações celulares, mediadas pela ativação imunitária, assemelhando-se aos comportamentos tipo-depressivos em modelos de animais (MAES, 1993; MAES et al., 1993).
Com essas novas evidências, a teoria dos macrófagos modificou-se para “Teoria de ativação do Sistema de Resposta Inflamatória (SRI)”, devido os vários aspectos do sistema inflamatório serem correlacionados com a imunidade celular durante a depressão maior (SONG et al., 1998; VANWEST & MAES, 1999). Assim, a inflamação envolve a síntese e liberação de mediadores pró-inflamatórios, tais como citocinas e quimiocinas. Nesse processo, são envolvidas células, como monócitos, neutrófilos, macrófagos e células da cascata do complemento (SCHIEPERS et al., 2005).
A ativação do SRI na depressão está relacionada com a hiperatividade do eixo HPA, sugerindo que a depressão é induzida por citocinas pró-inflamatórias. A hiperatividade do eixo ocorre pela interação imunoendócrina, ou seja, as citocinas pró-inflamatorias (IL-1β, IL-6 e TNF-α) também aumentam a secreção de hormônio adrenocorticotrófico (ACTH) por ação direta ou mediante aumento do efeito do homônio corticotrofina (CRH), evidenciando essa hiperatividade (MAES et al., 1993a, 1993d).
neurogênese (GARDNER & BOLES, 2010; MAES, 2010; ZUNSZAIN et al., 2013). Assim, a neurogênese reduzida é associada com níveis baixos de neurotrofinas, por exemplo, o fator neutrófico derivado no cérebro (BNDF), o qual regula a plasticidade neuronal e sináptica na depressão (TANCRED et al., 1992; MURRAY & LYNCH, 1998; ANGELUCCI et al., 2005). A figura seguinte (figura 2) sequencia as teorias inflamatórias de acordo com seus períodos de descoberta.
Figura 2 - Teorias Inflamatórias da Depressão.
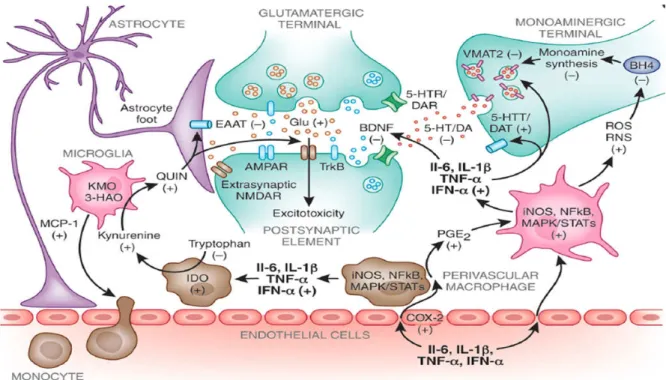
Baseada em todas as teorias, verificou-se que existe uma comunicação bidirecional entre o Sistema Nervoso Central (SNC) e o sistema imunológico, a qual é necessária para a montagem imunológica apropriada, ou seja, respostas comportamentais e fisiológicas à estimulação imune (KELLEY et al., 2003). Com isso, uma resposta aos estímulos imunes periféricos, decorrentes de uma administração sistêmica de um agente pró-inflamatório, são produzidas e liberadas citocinas pró-inflamatórias IL-1β, TNF-α e IL-6, por células gliais (astrócitos e microglia) no cérebro (LAYE et al., 1994), as quais servem como uma fonte e alvo de mediadores pró-inflamatórios. Dessa forma, a resposta dominante para vários tipos de lesões no SNC é a ativação da microglia e astrócitos, muitas vezes referida como gliose, nos locais de dano (KREUTZBERG, 1996; NORENBERG, 2005; O’CALLAGHAN & SRIRAM, 2005).
microglia M1 promove respostas pró-inflamatórias, como produção e liberação de TNF-α, IL-1β, produção de óxido nítrico sintase induzida (iNOS) e as espécies reativas de oxigênio (ROS) (LE et al., 2001; BLOCK et al., 2007; AUDET et al., 2011; PATKI et al., 2013), contribuindo para uma disfunção da rede neural. Por outro lado, a microglia M2 está associada a uma regulação positiva de citocinas anti-inflamatórias, produção de fatores neutróficos e de crescimento, desempenhando um papel na restauração da homeostase, envolvida na neuroproteção (PONOMAREV et al., 2007; POLLAZI & MONTI, 2010).
A esse respeito, microglia e astrócitos exercem efeitos imunomoduladores (MILLER, 2003; DAVALOS et al., 2005; NIMMERJANH et al., 2005; LYNCH, 2009), possuindo propriedades neuroinflamatórias e neuroprotetoras. Os astrócitos desempenham um papel fundamental na recuperação de uma lesão cerebral, regulando as moléculas antioxidantes e fatores neurotróficos (HENEKA et al., 2010; BUFFO et al., 2010; JURGENS & JOHNSON, 2012). Os astrócitos ativados modulam funções microgliais, tais como proliferação celular, migração, adesão e ativação (GODBUT et al., 2005; BARRIETOS et al., 2006; ABRHAM et al., 2006). Tem sido demonstrado que os astrócitos podem reduzir os efeitos potencialmente prejudiciais da microglia (GAYKEMA et al., 2006; HUANG et al., 2007; CHEN et al., 2008; LYNCH, 2009).
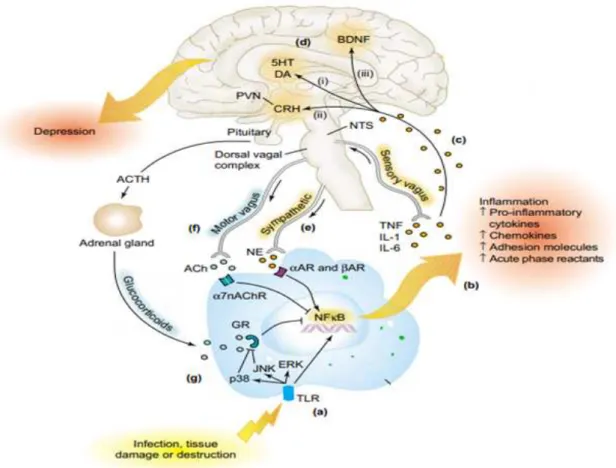
Figura 3: Fisiopatologia da depressão desencadeada pela inflamação.
Com isso, várias evidências sugerem que a inflamação desempenha um papel na fisiopatologia da depressão (HASHIMOTO, 2009, 2015, MILLER et al., 2009, RAISON et al., 2010, DANTZER et al., 2008, ZHANG et al., 2016), inclusive em disfunções cognitivas, emocionais e ansiedade (LEONARD & SONG, 1996; HEYSRR et al., 1997; ANISMAN & MERALI, 1999; VALLIERES et al., 2002). Desse modo, as citocinas TNF-α e IL-6 mostram um efeito direto sobre a neurotransmissão serotoninérgica e noradrenérgica (DUNN et al., 2005, SCHIEPERS et al., 2005, HAASE & BROWN, 2015). Assim, as citocinas pró-inflamatórias podem influenciar a síntese e a recaptação de 5-HT e NA, levando à sua redução nos níveis extracelulares (MCNAMEE et al., 2010; JI et al., 2014). Nesse contexto, estudos envolvendo pacientes deprimidos demonstraram que possuem o sistema imunitário desregulado, caracterizado pelo aumento da produção de citocinas pró-inflamatórias, tais como IL-1β, IL-6 e TNF-α (CONNOR & LEONARD, 1998; MAES et al., 1999; MIKOVA et al., 2001). Portanto, várias ações das citocinas alteram funções do organismo, tais como febre, anedonia, alterações neuroendócrinas, alterações no sono e outras alterações comportamentais (atividades exploratórias, sexuais e sociais) (MAES, 1999; LEONARD & SONG, 1999). Portanto, as citocinas podem desempenhar um papel importante no aparecimento de comportamentos depressivos (KONSMAN et al., 2008; YIRMIYA & GOSHEN, 2011).
2.3 O papel do LPS na Depressão
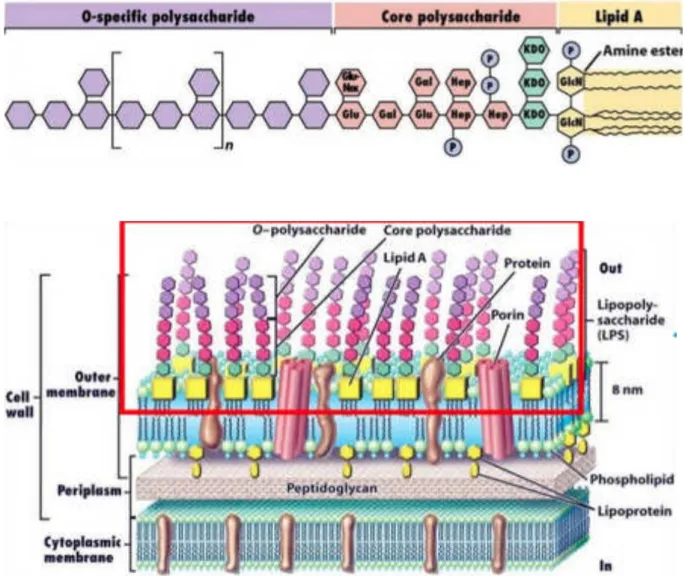
O lipopolissacarídeo (LPS) é o principal componente da parede celular externa de bactérias Gram-negativas, como por exemplo a Escherichia coli, funcionando como uma endotoxina bacteriana que estimula o sistema imune inato de forma semelhante a uma infecção bacteriana (BISWAS & LOPEZ-COLLAZO, 2009). O LPS induz uma cascata de processos imunológicos que contribuem para uma série de respostas fisiológicas, metabólicas, neuroendócrinas e comportamentais (HART, 1990; DANTZER, 2001).
Figura 4 – Estrutura química do LPS.
Fonte: http://www.ebah.com.br/content/ABAAABrwUAL/bacterias
Por conseguinte, o novo complexo formado, chamado de LPS-CD14, ativa a sinalização do receptor Toll-like, tipo 4 (TLR-4) (MEANS et al., 2000; ANDERSON, 2000; BEUATLER, 2001), que tem um papel fundamental no reconhecimento de antígenos patogênicos, ao qual é complexada à proteína MD-2, gerando o sinal transmembranar para o núcleo (JEAN-BAPTISTE, 2007). Assim, dentro do macrófago ocorre uma série de reações em cascata celulares, incluindo a atuação de MyD88, p38, JNK, TAK-1, proteína quinase IkB, proteína ativadora 1 (AP-1), até a ativação do fator nuclear de transcrição NF-κB (envolvido no desenvolvimento, plasticidade e neurodegeneração em neurônios e células da glia), que ativa os genes que codificam as proteínas envolvidas na defesa contra a infecção, que são as citocinas pró-inflamatórias (IL-1β, IL-6, IL-12, TNF-α) (INGALLS et al., 1995; ADEREM & ULEVITCH, 2000; HAVA et al., 2006; ROMERO et al., 2007; JEAN-BAPTISTE, 2007). Essa endotoxina bacteriana pode atuar em macrófagos, monócitos, neutrófilos, plaquetas sanguíneas e células endoteliais (SALUK-JUSZCZAK & WACHOWICZ, 2005).
Durante um episódio inflamatório, as reações inflamatórias consistem em cascatas celulares a uma resposta de fase aguda. Assim, após exposição ao LPS, ocorre uma secreção elevada de citocinas pró-inflamatórias periféricas, quimiocinas, moléculas de adesão, produção de ciclooxigenase 2 (COX-2) e prostaglandinas, resultando em uma inflamação periférica (CUNNINGHAM & SANDERSON, 2008; BILBO et al., 2008; TARR et al., 2011). Além disso, o LPS ativa células da glia, como microglia e astrócitos. A microglia ativada estimula a produção de citocinas e mediadores inflamatórios através de diferentes vias no SNC (HENEKA et al., 2010; BUFFO et al., 2010; JURGENS & JOHNSON, 2012). Assim, a indução de mediadores pró-inflamatórios afeta o metabolismo de neurotransmissores, como 5-HT e DA (DUNN, 1988; KABIERSCH et al., 1988, DUNN, 2006) a ativação do eixo hipotálamo-pituitária-adrenal (HPA), ocorrendo um aumento de concentrações de ACTH e glicocorticóides (BESEDOVSKY et al., 1986; DUNN, 2000) e uma diminuição de fatores neurotróficos, produção da enzima óxido nítrico sintase induzida
,
evidenciando uma neuroinflamação e danos neuronais (SCHNYDRIG et al., 2007; BILBO et al., 2008). Portanto, uma ativação inflamatória neural causa umà indução de uma sintomatologia depressiva, conforme figura abaixo (PITYCHOUTIS & PAPADOPOULOU-DAIFOTI, 2010).
Figura 5 – Mecanismos inflamatórios do LPS.
Fonte: RAISON et al., 2006.
ao estresse, medo e ansiedade, podendo ser mediadores dos efeitos de LPS (MILLAN, 2003; WIECZOREK et al., 2005).
Evidências também mostram que a estimulação do sistema imune inato por administração periférica de LPS induz profundas alterações centrais monoaminérgicas em animais (LINTHORST et al., 1995, LINTHORST & REUL, 1998; DANTZER et al., 2008). Em seu estudo, O'Connor et al., 2009, demonstrou que as alterações induzidas na atividade serotoninérgica podem ser atribuídas à ativação induzida por LPS da enzima indolamina 2,3-dioxenase (IDO) no cérebro, desenvolvida com triptofano. Dado que o triptofano é a molécula precursora limitante da taxa na biossíntese de 5-HT, a hipótese é de que as alterações no seu metabolismo possam explicar o desenvolvimento dos sintomas depressivos (DANTZER et al., 2008). Além disso, verificou-se também que a administração da endotoxina bacteriana aumenta o metabolismo da DA na maioria das regiões do cérebro em roedores (DUNN, 1992; DUNN et al., 2005).
2.4 O Envolvimento do Estresse Oxidativo na Depressão
Os radicais livres são produzidos naturalmente ou por alguma disfunção biológica em nosso organismo. Esses radicais livres cujo elétron desemparelhado encontra-se centrado nos átomos de oxigênio ou nitrogênio são denominados ROS (espécies reativas de oxigênio) ou RNS (espécies reativas de nitrogênio) (WALKO et al., 2007). Essas espécies desempenham um duplo papel como espécies deletérias e benéficas, uma vez que podem trazer benefícios ou prejuízos ao organismo (VALKO et al., 2006). Desse modo, os efeitos benéficos das ROS ocorrem em concentrações baixas a moderadas e envolvem papéis fisiológicos nas respostas celulares, como na defesa contra agentes infecciosos e na função de vários sistemas de sinalização celular. Porém, o desequilíbrio da produção elevada de ROS/RNS e uma deficiência de antioxidantes enzimáticos e não-enzimáticos desencadeia o estresse oxidativo e nitrosativo (KOVACIC & JACINTHO, 2001; VALKO et al., 2001; RIDNOUR et al., 2005).
O organismo humano sofre ação constante de ROS e RNS geradas em processos inflamatórios, por alguma disfunção biológica ou mesmo provenientes dos alimentos. Nesse sentido, as principais ROS são: hidroxila (OH!), superóxido (O
! !),
peroxila (ROO!) e alcoxila (RO!), oxigênio (O2), peróxido de hidrogênio (H2O2) e
ácido hipocloroso (HClO). Dentre as RNS incluem-se nitritos (NO !
!), nitratos (NO!!),
peroxinitritos (ONOO!), óxido nítrico (NO), óxido nitroso (N
2O), ácido nitroso (HNO2)
inflamatórias e envelhecimento, podendo ser a causa ou o fator agravante do quadro geral da doença (DHALLA et al., 2000; SAYRE et al., 2001; JENNER, 2003; DALLE-DONNE et al., 2006; WALKO et al., 2007).
Todos os componentes celulares são suscetíveis à ação das espécies reativas de oxigênio (ROS), porém a membrana é um dos mais atingidos, em decorrência da peroxidação lipídica, que acarretam alterações na estrutura e permeabilidade das membranas celulares. Consequentemente, há perda da seletividade na troca iônica e liberação do conteúdo das organelas, como as enzimas hidrolíticas dos lisossomas e formação de produtos citotóxicos (como o malonaldeído), culminando com a morte celular. A peroxidação lipídica também pode estar associada aos mecanismos de envelhecimento, de câncer, de doenças neurodegenerativas e inflamatórias (NAKAMURA & LIPTON, 2009).
Há evidências de que a depressão clínica é acompanhada pela ativação de mecanismos imuno-inflamatórios, oxidativos e nitrosativos (MAES et al., 1995; MAES, 2011a; KUBERA et al., 2011b; LEONARD & MAES, 2012; KUBERA et al., 2013). Nesse contexto, estudos revelam que o estresse oxidativo desempenha um papel importante na fisiopatologia da ansiedade e da depressão (BOUAYED et al., 2009; SULAKHIYA et al., 2014; GRASES et al., 2014). Assim, o aumento da peroxidação lipídica, redução nos níveis de atividades enzimáticas antioxidantes e defesas antioxidantes, como GSH, catalase e dano ao DNA têm sido relatados (BOUAYED et al., 2009; CUSTODIO et al. 2013; GRASES et al., 2014; JANGRA et al., 2014).
Evidências também têm sido apresentadas acerca do papel do óxido nítrico (NO) em alguns processos patológicos no SNC, por exemplo, dano isquêmico-hipóxico, e desordens neurodegenerativas, como o Mal de Alzheimer e Mal de Parkinson (MONCADA et al., 1991; WALKO et al., 2007). Nesse contexto, o nitrito é frequentemente utilizado como marcador do NO (FLATOW et al., 2013), pois em solução aquosa, o NOreage com o oxigênio molecular e se acumula no plasma/soro como os íons nitrito (NO
!
!) e nitrato (NO!!) (KOLTUKSUZ et al., 2000).
de defesa, neurotransmissão, como transmissão neuronal e plasticidade sináptica (BERGENDI et al., 1999). Assim, a superprodução de RNS é evidenciada pelo estresse nitrosativo (KLATT & LAMAS, 2000; RIDNOUR et al., 2004). Desse modo, o estresse nitroso pode levar a reações de nitrosilação que podem alterar a estrutura das proteínas e, assim, inibem sua função normal. Em determinadas condições, o (NO) e o (O
!
!)podem interagir, resultando em um produto muito tóxico, peroxinitrito
(ONOO!), que é capaz de reagir rapidamente com diversas moléculas (proteínas,
lipídeos, carboidratos e ácidos nucleicos), danificando-as (CARR et al., 2000). Além disso, outras RNS, como (OH!), dióxido de nitrogênio, possuem semelhante
potencial deletério, como fragmentação do DNA e oxidação lipídica e têm sido associadas a diversos processos patológicos (WANG et al., 2002).
Os mecanismos de defesas também são desenvolvidos através da exposição de radicais livres (CADENAS, 1997). Esses mecanismos contra o estresse oxidativo, envolvem: (i) mecanismos preventivos, (ii) mecanismos de reparação, (iii) defesas físicas e (iv) defesas antioxidantes. Assim, as defesas antioxidantes enzimáticas incluem superóxido dismutase, glutationa peroxidase, catalase e antioxidantes não enzimáticos são representados pelo ácido ascórbico, vitamina E, glutationa reduzida (GSH), carotenóides, flavonóides e outros antioxidantes (NOGUEIRA et al., 2004; JONES et al., 2000). Em condições normais, existe um equilíbrio entre as atividades e os níveis intracelulares desses antioxidantes, o qual é essencial para a sobrevivência dos organismos (MASELLA et al., 2005).
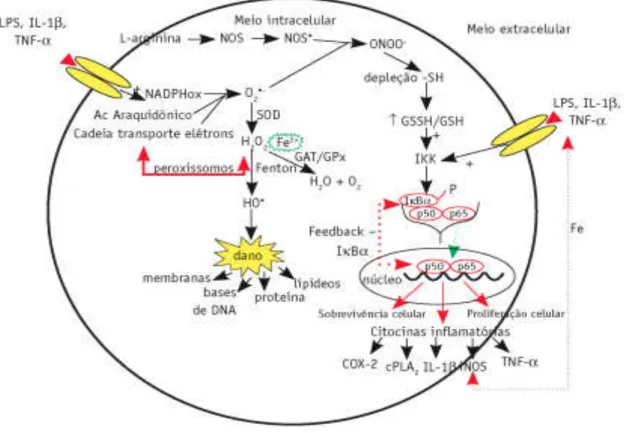
Figura 6 - Após o estímulo extracelular por LPS ou citocinas pró-inflamatórias, ocorre a formação de ROS e RNS.
Fonte: FILIPPIN et al., 2008.
A esse respeito, estudos têm evidenciado que as ROS, derivadas da respiração mitocondrial, atuam como moléculas de sinalização para acionar a produção de citocinas pró-inflamatórias, como IL-1β, através da ativação da cascata dependente do fator nuclear kB (NF-kB), às respostas inflamatórias (ZHOU et al., 2011; NAKAHIRA et al., 2011). Além disso, a administração de citocinas pró-inflamatórias, como TNF-α, IL-1β, IL-6; IFN-γ e fatores de crescimento geram concentrações elevadas de ROS e RNS em células fagocíticas (ZOU & CREWS, 2005), consequentemente medeiam funções celulares importantes, como indução e manutenção de caminhos de transdução de sinal envolvidos no crescimento, proliferação e diferenciação celular e apoptose, em condições patológicas (THANNICKAL & FANBURG, 2000; DROGE, 2002; DIKALOV et al., 2004; STORZ, 2005).
comportamento semelhante à depressão (LEONARD & MAES, 2012; MAES et al., 2012c) . Por exemplo, citocinas inflamatórias no SNC sobrerregulam a enzima IDO, a qual metaboliza o triptofano em L-quinurenina. Portanto, níveis reduzidos de triptofano irão influenciar a síntese da serotonina. Assim, a produção elevada de mediadores neuroativos, incluindo 3-hidroxiquinurenina e ácido quinolínico induzem danos neuronais por estresse oxidativo. Nesse sentido, estudos demostraram um importante mecanismo de complicações do comportamento de humor com a inflamação, devido à degradação do triptofano, impactando nas vias serotoninérgicas e glutamatérgicas (DANTZER et al., 2008; NG et al., 2008).
Portanto, a indução da via O&NS pode se desenvolver quando a produção de ROS/RNS for muito alta e/ou as defesas antioxidantes diminuírem. Assim, o transtorno depressivo maior é evidenciado por níveis aumentados de ROS/RNS e danos mediados por O&NS ao DNA, proteínas, ácidos graxos e mitocôndrias, bem como baixos níveis de antioxidantes, como coenzima Q10, zinco e GSH (PEET et al., 1998; MAES et al., 1999a,b; MAES et al., 2000; BILICI et al., 2001, IRIE et al., 2003; KHANZODE et al., 2003; MAES et al., 2011a; LEONARD & MAES, 2012).
2.5 Participação de Mecanismos Inflamatórios pelas vias NF-κB, ERK, GSK, IBA-1 e CREB.
Há crescentes evidências que a sinalização intracelular no sistema nervoso central fornece novas perspectivas para a compreensão dos mecanismos envolvidos nos processos inflamatórios, neurodegenerativos e de plasticidade que ocorrem ou que estão comprometidos em uma série de doenças neurológicas e psiquiátricas (MATTSON, 1998; PENNYPACKER, 1998; GORENSTEIN et al., 2000).
induzida (iNOS) e as espécies reativas de oxigênio (ROS), contribuindo para a disfunção da rede neural (LE et al., 2001; BLOCK et al., 2007). Com isso, o marcador de mólecula adaptadora de ligação de cálcio ionizada-1 (IBA-1) é expresso quando ocorre a ativação da microglia (PONOMAREV et al., 2007; XU et al., 2017).
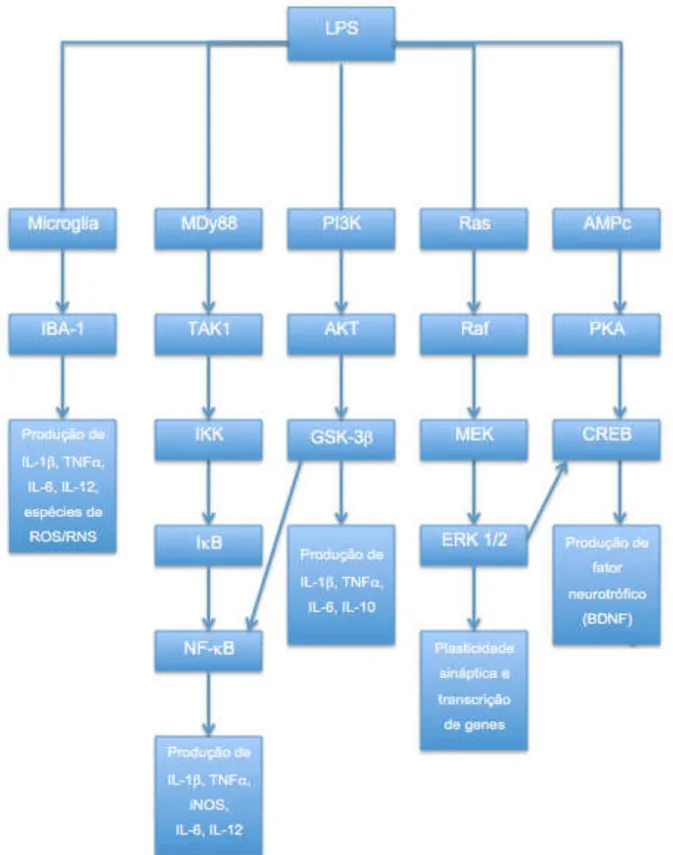
Após a ativação da microglia, identificou-se a ativação da via inflamatória do fator de transcrição NF-κB. Vários estímulos ativam este fator, entre os quais estão os neurotransmissores (como o glutamato), neurotrofinas, proteínas neurotóxicas (β-amilóide), citocinas (IL-1β e TNF-α), glicocorticóides, produtos provenientes de vírus e bactérias (LPS), irradiação ultravioleta, produtos de reações de enzimas como a óxido nítrico sintase induzida (iNOS) e a ciclooxigenase-2 (COX-2) (O’NEILL & KALTSCHMIDT, 1997). Independentemente do estímulo, parece haver participação de espécies reativas de oxigênio, pelo estresse oxidativo e o aumento de cálcio intracelular para a ativação do NF-κB. A estimulação ocorre através da cascata dependente do fator de diferenciação mielóide 88 (MyD88), a qual irá ativar a proteína quinase TAK1. Esta por sua vez, ativa o complexo de quinase IKK, a qual irá degradar a proteína inibitória kappa B (IκB), ocorrendo a ativação, por fosforilação, do fator de transcrição NF-κB. Assim, ocorre a translocação desse fator do citoplasma para o núcleo (BAEUERLE & BALTIMORE, 1996; BALDWIN, 1996).
Outro mecanismo importante envolvido na fisiopatologia da depressão são as vias de sinalização que regulam a sobrevivência e neuroplasticidade celular, bem como a resposta a antidepressivos, como a enzima fosfatidilinositol 3-quinase (PI3K), a proteína quinase serina/treonina (AKT), a enzima glicogênio sintase quinase-3β (GSK-3β) (BEAULIEU et al., 2009). Nesse sentido, a via PI3K/AKT atua na regulação da atividade GSK-3β, levando à sua inativação, através da fosforilação direta no resíduo de Serina9-GSK-3β (GRIMES & JOPE, 2001; BEAULIEU et al., 2009).
Há evidências que GSK-3β está envolvida na neuroinflamação, em doenças como Mal de Alzheimer, diabetes mellitus tipo 2 e vários carcinomas (PEINEAU et al., 2008; KANNINEN et al., 2011; BEUREL, 2011), a qual tem como função a regulação da produção de citocinas pró e anti-inflamatórias, através dos sistemas imunes tanto inatos quanto adaptativos (WANG et al., 2011a). Nesse contexto, estudos anteriores em modelos de animais em condições inflamatórias, forneceram evidências de uma série de conexões entre a GSK-3β e distúrbios do humor. Esses achados sugerem que a desregulação da GSK-3β promove a suscetibilidade aos transtornos do humor, através da produção de citocinas pró-inflamatórias, como IL-6, IL-1β e TNF-α, após estimulação de vários TLRs e uma diminuição da citocina anti-inflamatória IL-10 (MARTIN et al., 2005). Por outro lado, os inibidores da GSK3β
reduzem a produção de citocinas pró-inflamatórias, através da inibição do fator transcricional NF-κB, aumentam a produção de citocinas anti-inflamatórias, diminuem a produção de NO e iNOS (JOPE et al., 2007; JOPE, 2011).
Outra via de sinalização intracelular envolvida no processo ou mecanismo inflamatório é a proteína quinase regulada extracelular (ERK 1/2), a qual está associada à patogênese e ao tratamento da depressão (GROVES, 2007; MATHEW et al., 2008; PANDYA et al., 2013). Assim, sinais extracelulares, como os fatores de crescimento ou BDNF, ativam a cascata Ras-Raf-MEK-ERK, ativando a ERK, através de sua fosforilação e translocação nuclear (HUANG & REICHARDT, 2003). Nesse contexto, a ERK 1/2 está envolvida na plasticidade sináptica, na transcrição de genes, como o fator de transcrição CREB e em eventos comportamentais (MAZZUCCHELLI & BRAMBILLA, 2000; SWEATT, 2001; SELCHER et al., 2001; MAZZUCCHELL et al., 2002; RODRIGUES et al., 2004; BLENDY, 2006).
Há evidências de estudos realizados anteriormente, da diminuição na expressão de ERK 1/2 em comportamentos tipo-depressivos em modelos de roedores (GUAN, 2013; KUO et al., 2013; LEEM et al., 2014; CHEN et al., 2015). A esse respeito, um estudo relatou que a ativação e a expressão da ERK1/2 são reduzidas nas áreas cerebrais pós-mortem de pacientes deprimidos (DWIVEDI et al., 2001). Por outro lado, os antidepressivos podem aliviar os sintomas da depressão, através do aumento da expressão de ERK 1/2 total (LIU et al., 2014) e da ERK 1/2 fosforilada (QI et al., 2008; GOURLEY et al., 2008; FIRST et al., 2011; HUANG et al., 2013).
A fisiopatologia da depressão também pode ser mediada pela sinalização intracelular do fator transcripcional CREB, o qual está envolvido com déficits cognitivos, na aprendizagem e memória, nas regiões cerebrais (ABEL et al., 1997; TAYLOR et al., 1999; WALLACE et al., 2009). A fosforilação de CREB pode ocorrer por meio da ativação da cascata de adenosina 3’,5’-monofosfato cíclico (AMPc) e da proteína quinase A (PKA), mas também pela ativação de proteínas quinases dependentes de cálcio (proteína quinase C e proteína quinase dependente de cálcio/calmodulina) (DUMAN et al., 1997, 1999). Nesse contexto, a função do CREB é regulada pelo seu estado de fosforilação no Ser133, o que resulta na ativação da transcrição de genes alvo, como por exemplo, o fator neurotrófico BDNF (MONTMINY, 1990; MEYER & HABENER, 1993).
contexto, um estudo realizado por Simona et al., 2015, verificou que após o tratamento com LPS e TNF-α em células neuronais, houve uma diminuição dos níveis de expressão de CREB e consequentemente de BDNF. Após o tratamento com trazadona, antidepressivo atípico, aumentou os níveis dos fatores neutróficos BDNF e de sua transcrição. Outros estudos evidenciaram que o tratamento com antidepressivo crônico aumentou a regulação de fosforilação de CREB (THOME et al., 2000; KRISHMAN & NESTLER, 2008) e o aumento dessa ativação de CREB em modelos de animais com depressão, evidenciando efeitos neuroproterores dos antidepressivos (THOME et al., 2000; BLENDY, 2006; SIMONA et al., 2015).
Figura 7 - Mecanismos das vias intracelulares no processo inflamatório.
2.6 Diferenças de gênero na Depressão
O gênero afeta muitos aspectos psicopatológicos, como a prevalência de distúrbios específicos, a expressão dos sintomas, o curso da doença, o comportamento e a resposta ao tratamento (AFIFI, 2007). Assim, homens e mulheres diferem na ocorrência e apresentação de vários distúrbios psiquiátricos (MCCARTHY et al., 2005; KARATSOREOS & MCEWEN, 2011). Existe uma diferença de gênero na prevalência da depressão de 2:1, sendo mais prevalente nas mulheres que nos homens (NESTLER et al., 2002; KOSKINAS et al., 2002; KUEHNER, 2003; BERTON & NESTLER, 2006). Além disso, as mulheres apresentam preponderância de sintomas atípicos (ANGST et al., 2002b; LAMERS et al., 2010), ansiedade (CLAYTON et al., 1991; WEICH et al., 2001; DE GRAAF et al., 2002) e transtornos psicossomáticos (SILVERSTEIN, 2002; MATZA et al., 2003; MARCUS et al., 2005, 2008; PENNELL et al., 2012; SCHUCH et al., 2014).
O dimorfismo sexual pode ser definido como as diferenças inerentes a cada gênero no que se refere às predisposições. Por exemplo, em funções cognitivas, como processamento, concentração, aprendizado, memória, têm sido demonstradas como sexualmente dimórficas na espécie humana, de modo que o gênero é um forte preditor de como tal habilidade específica pode ser desenvolvida (LINTHORST et al., 1995; PITYCHOUTIS et al., 2009 KORNSTEIN et al., 2000; BERTON & NESTLER, 2006). Grande parte do controle das funções sexuais começa em ambos os gêneros com a secreção do hormônio liberador das gonadotrofinas pelo hipotálamo, o qual promove a secreção pela adenohipófise de dois hormônios: hormônio folículo-estimulante e hormônio luteinizante, estimulando a produção de estrógeno, progesterona e testosterona. Esses hormônios estariam associados a aspectos comportamentais observáveis ao longo do desenvolvimento, corroborando a hipótese de que os padrões típicos de gênero estariam relacionados à produção hormonal (KRAEMER et al., 2009).
importante nas diferenças de susceptibilidade associadas ao sexo em certas doenças infecciosas e auto-imunes (SPINEDI et al., 1994; DE LEÓN-NAVA & MORALES-MONTOR, 2006). Nesse contexto, os modelos animais semelhantes à depressão, representam uma ferramenta útil para a investigação das diferenças sexuais na neurobiologia da depressão e da resposta antidepressiva (GAILLARD & SPINEDI, 1998; PITYCHOUTIS et al., 2009; DALLA et al., 2010; SENS et al., 2017).
A esse respeito, as respostas comportamentais induzida por LPS têm sido referenciadas como diferencialmente expressas nos machos e fêmeas. É evidenciado que as fêmeas apresentam uma forte resposta imune em relação aos machos quando expostos a agentes patogênicos e possuem uma elevada proporção de sobrevivência contra infecções (WEINSTEIN et al., 1984; VERTHELYI, 2001). Também é verificada esse padrão específico do sexo nas áreas cerebrais, onde as fêmeas mostraram um aumento da resposta imune central contra inoculação cerebral de agentes bacterianos e virais (BARNA et al., 1996; SOUCY et al., 2005; KLEIN, 2012). No entanto, apesar das fêmeas, inicialmente, montarem uma resposta imune mais vigorosa, sua resposta anti-inflamatória e de recuperação também é mais rápida (BOUMAN et al., 2005; DARNALL & SUAREZ, 2009). Essas diferenças na responsividade do sistema imunológico têm sido associadas aos distintos efeitos de hormônios sexuais em órgãos e células imunes.
Como mencionado anteriormente, os hormônios influenciam a resposta imune, modulando a sinalização inflamatória. Nesse sentido, a testosterona parece ser imunossupressora, uma vez que deprime a função imunológica dos macrófagos (WICHMANN et al., 1997; OLSEN & KOVACS, 2001), enquanto que os estrogênios são conhecidos por atuar como potenciadores imunes imunológicos ou imunossupressores, dependendo do componente imune medido e do tempo de avaliação da resposta imune. Nesse sentido, os estrógenos parecem interagir com os fatores imunes de transcrição, influenciando a maturação dos linfócitos e aumentando a produção de anticorpos (BOUMAN et al., 2005; DARNALL & SUAREZ, 2009), contribuindo para que as fêmeas tenham reações imunes celulares e humorais mais intensas e se recuperem mais rapidamente das infecções que os machos (PENNEL et al., 2012).
indicaram uma maior sensibilidade das fêmeas aos efeitos do LPS e citocinas em relação aos aspectos comportamentais, tais como atividade sexual, recompensa de sacarose e consumo de alimentos (AVITSUR & YIRMIYA, 1999; MERALI et al., 2003). Por outro lado, um outro estudo realizado por Marriott et al., 2006, verificou que os machos produzem níveis mais elevados de citocinas inflamatórias em relação as fêmeas. Portanto, os influência do sexo nos efeitos comportamentais do LPS mudam acentuadamente de acordo com a dose do LPS, tempo de avaliação e espécie testada (BADALÀ et al., 2008; CAI et al., 2016).
2.7 Tratamento farmacológico da Depressão
Baseado na descoberta das teorias monoaminérgicas da depressão, várias classes de antidepressivos, como os inibidores de recaptação de serotonina (ISRS), inibidores da monoamina oxidase, inibidores da recaptação de serotonina e noradrenalina e inibidores seletivos de recaptução de dopamina, funcionam para reduzir os sintomas depressivos em pacientes com transtorno depressivo maior (MAES et al., 1997; UHER et al., 2014). Os efeitos terapêuticos iniciam-se após semanas de tratamento na maioria dos pacientes e aproximadamente um terço desses pacientes apresenta uma melhora significativa na resposta ao primeiro tratamento do antidepressivo (TRIVEDI et al., 2006).
Nessa mesma linha de descobertas, diversos estudos têm demonstrado o papel dos antidepressivos na resposta inflamatória, com resultados indicando a diminuição na produção de citocinas pró-inflamatórias in vitro e mudança de padrão de linfócitos T helper, de linfócitos T helper Th1 para Th2, os quais são anti-inflamatórios e protetores. Por conseguinte, a neuroproteção e/ou proliferação de células neuronais seria o mais provável mecanismo molecular da terapia antidepressiva, já que o tratamento crônico com antidepressivos também é responsável pelo aumento de fatores neurotróficos, como o BDNF (NISHIDA et al., 2002; CASTREN et al., 2007; MULLER & SCHWARZ, 2007).
Há evidências que os antidepressivos exercem parte da sua eficácia através da supressão das vias inflamatórias. Um estudo realizado por Xia et al., 1996, verificou que os antidepressivos tricíclicos suprimiram a produção de citocinas pró-inflamatórias IL-1β, TNF-α e IL-6 em células de monócitos. Em outro estudo envolvendo modelos de animais semelhantes à depressão, os antidepressivos seletivos de serotonina bloquearam a produção de IL-1β e TNF-α (KUBERA et al., 2011). No mesmo modo, o antidepressivo bupropiona, da classe de inibidores de recaptação de noradrenalina e dopamina, reduziu a produção de IL-1β, TNF-α e IFN-γ em modelo de animal induzido por LPS (BRUSTOLIM et al., 2006). Outro antidepressivo venlafaxina, inibidor seletivo da recaptação da serotonina e da noradrenalina, apresentou efeitos antiinflamatórios através da supressão da razão de produção de IFN-γ/IL-10, ou seja, pela diminuição de produção de IFN-γ e aumento da liberação de citocina antiinflamatória IL-10 (KUBERA et al., 2001).