UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA GRUPO DE ELETROQUÍMICA E CORROSÃO
Eletr odeposição e Car acter ização de
Revestimentos de Co-Mo e Avaliação Fr ente
à Cor r osão e à Reação de Despr endimento
de Hidr ogênio
Paulo Naftali da Silva Casciano
Dissertação de Mestrado submetida à Comissão Julgadora do Curso de Pós-Graduação em Química da Universidade Federal do Ceará, como um dos requisitos para obtenção do título de Mestre em Química.
Or ientador a: Prof. Dra. Adriana Nunes Correia
De que se queixa, pois, o homem vivente? Queixe-se cada um dos seus pecados. Esquadrinhemos os nossos caminhos,
A Deus pelo que tem feito em minha vida: “E em nenhum outro há salvação,
porque também debaixo do céu nenhum outro nome há, dado entre os homens, pelo qual devamos ser salvos (Atos 4:12)”.
Aos meus pais, Francisco Casciano Neto e Maria Cléia da Silva Casciano, por terem me ensinado o caminho da verdade em que hoje acredito por minha decisão:
“Tão somente guarda-te a ti mesmo, e guarda bem a tua alma, para que não te esqueças das coisas que os teus olhos viram, e que elas não se apaguem do teu coração todos os dias da tua vida; porém as contarás a teus filhos, e aos filhos de teus filhos
(Deuteronômio 4:9)”. Também pelo investimento em meus sonhos.
Ao restante de minha família, especialmente à minha prima Sônia Casciano de Queiroz Paiva pelo incentivo em estudar.
Aos meus amigos, especialmente do GELCORR e da Banda Adhonay que, de certa forma, contribuíram na minha vida em todos os sentidos.
À Profa. Simone da Silveira Sá Borges pela orientação durante a minha graduação.
Ao Renato Alexandre Costa de Santana pela co-orientação em meu mestrado. Em especial, aos meus eternos orientadores: Adriana Nunes Correia e Pedro de Lima Neto, pela confiança e ensino.
À Universidade Federal do Ceará, ao Departamento de Química Analítica e Físico-Química e ao Programa de Pós-Graduação em Química.
Aos Laboratórios de Caracterização de Materiais do Departamento de Engenharia Metalúrgica e de Materiais da UFC pelas análises de MEV, EDX e Microdureza, Laboratório de Raios-X do Departamento de Física da UFC pelas análises de Difração de Raios-X, Grupo de Espalhamento de Luz do Departamento de Física da UFC pelas análises de Espectroscopia Raman e Laboratório de Microscopia Atômica do Departamento de Física da UFC pelas análises de MEV e EDX.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro concedido.
LISTA DE FIGURAS ... 6
LISTA DE TABELAS ... 9
RESUMO ... 10
ABSTRACT ... 11
CAPÍTULO I – INTRODUÇÃO ... 12
I.1. Definição de Corrosão ... 13
I.2. Corrosão Eletroquímica e Passivação... 15
I.3. Hidrogênio ... 16
I.4. Eletrocatálise – Reação de Desprendimento de Hidrogênio ... 17
I.5. Eletrodeposição ... 20
I.6. Eletrodepósitos de Co-Mo ... 21
I.7. Planejamento Experimental... 24
CAPÍTULO II – TÉNICAS UTILIZADAS 26 II.1. Caracterização Física... 26
II.1.1. Microscopia Eletrônica de Varredura e Energia Dispersiva de Raios-X ... 26
II.1.2. Cálculo da Eficiência de Corrente Catódica ... 26
II.1.3. Determinação da Microdureza dos Revestimentos ... 27
II.1.4. Difração de Raios-X ... 28
II.1.5. Espectroscopia Raman ... 29
II.2. Ensaios Eletroquímicos... 29
II.2.1. Curva de Polarização Potenciodinâmica Linear ... 29
II.2.2. Espectroscopia de Impedância Eletroquímica ... 30
II.2.3. Voltametria Cíclica ... 31
II.2.4. Curva de Polarização em Estado Estacionário ... 32
CAPÍTULO III – OBJ ETIVOS... 34
CAPÍTULO IV – PROCEDIMENTO EXPERIMENTAL... 35
IV.1. Composição da Solução Eletrolítica... 35
IV.2. Célula Eletroquímica... 35
IV.3. Eletrodo... 35
IV.4. Obtenção do Depósito... 36
IV.5. Caracterização Física... 38
IV.5.1. Microscopia Eletrônica de Varredura e Energia Dispersiva de Raios-X ... 38
IV.5.2. Cálculo da Eficiência de Corrente Catódica ... 38
IV.5.5. Difração de Raios-X ... 39
IV.5.6. Espectroscopia Raman ... 40
IV.6. Ensaios Eletroquímicos... 40
IV.6.1. Curva de Polarização Potenciodinâmica Linear ... 40
IV.6.2. Espectroscopia de Impedância Eletroquímica ... 40
IV.6.3. Voltametria Cíclica ... 40
IV.6.4. Curva de Polarização em Estado Estacionário ... 41
IV.7. Equipamentos... 41
CAPÍTULO V – RESULTADOS E DISCUSSÃO ... 42
V.1. Caracterização Física... 42
V.1.1. Microscopia Eletrônica de Varredura e Energia Dispersiva de Raios-X... 42
V.1.2. Cálculo da Eficiência de Corrente Catódica... 46
V.1.3. Tratamento Térmico... 50
V.1.4. Medidas de Microdureza... 55
V.1.5. Difração de Raios-X... 56
V.2. Ensaios Eletroquímicos... 59
V.2.1. Curvas de Polarização Linear... 59
V.2.2. Espectroscopia Raman... 61
V.2.3. Ensaios de Impedância Eletroquímica... 64
V.2.4. Voltametria Cíclica... 65
V.2.5. Curvas de Polarização em Estado Estacionário... 68
CAPÍTULO VI - CONSIDERAÇÕES FINAIS... 71
6
Figura 1: Esquema para o cálculo da microdureza pela metodologia de Vickes... 27 Figura 2: Interferência entre raios a nível planar.... 28 Figura 3. Curva de polarização esquemática mostrando a extrapolação de Tafel..... 30 Figura 4: Representação de Nyquist (a);Circuito elétrico equivalente de uma interface metal-eletrólito(b)... 31 Figura 5: Programação de potencial imposta ao eletrodo de trabalho na voltametria
cíclica... 32 Figura 6: Representação esquemática da célula eletroquímica. Para eletrodeposição (a) e para os ensaios eletroquímicos (b). Indicados, tem-se: eletrodo auxiliar de Pt, eletrodo de trabalho, eletrodo de referência (eletrodo de Hg/HgO/ (HCO3-/CO32-) ou
calomelano saturado) e solução eletrolítica... 36 Figura 7: Fluxograma ilustrativo desde tratamento superficial até ao final da deposição. 37 Figura 8. Gráfico referente ao tratamento térmico das amostras... 39 Figura 9: Imagens de MEV para revestimento Co-Mo sobre cobre em diferentes condições de eletrodeposição, sendo (I) o substrato de cobre e os eletrodepósitos (II) tipo A, (III) tipo B, (IV) tipo C, (V) tipo D e (VI) tipo E... 42 Figura 10. Gráfico de Pareto para os efeitos do planejamento fatorial da liga Co-Mo sobre a porcentagem de molibdênio... 44 Figura 11. Superfície de resposta da liga Co-Mo para a porcentagem de molibdênio, por energia dispersiva de raios-X, em função da densidade de corrente e do pH da solução eletrolítica... 45 Figura 12: Imagens em seção transversal para revestimento CoMo sobre cobre em diferentes condições de eletrodeposição, sendo (I) o tipo A, (II) tipo B, (III) tipo C, (IV) tipo D e (V) tipo E... 46 Figura 13. Imagens frontal e transversal do revestimento CoMo... 47 Figura 14. Gráfico de Pareto para os efeitos do planejamento fatorial da liga Co-Mo sobre a espessura dos revestimentos... 48 Figura 15: Superfície de resposta da liga Co-Mo para a espessura dos revestimentos, em função da densidade de corrente e do pH da solução eletrolítica...
7
condições de eletrodeposição após o tratamento térmico em 200°C, sendo (I) o tipo A, (II) tipo B, (III) tipo C, (IV) tipo D e (V) tipo E... 50 Figura 17. Imagens de MEV para revestimento CoMo sobre cobre em diferentes condições de eletrodeposição após o tratamento térmico em 400°C para (I) o tipo B, (II) tipo C , e após o tratamento térmico em 600°C para (III) tipo B, (IV) tipo C..... 51 Figura 18. Porcentagem de molibdênio para os revestimentos submetidos a tratamento térmico... 52 Figura 19. Mapeamento da amostra B submetida a tratamento térmico em 600 °C. (I) imagem do mapeamento; (II) mapeamento do Co, Mo, O e Cu; (III) mapeamento do Co; (IV) mapeamento do Mo; (V) mapeamento do O; (VI) mapeamento do Cu... 53 Figura 20. Mapeamento da amostra B submetida a tratamento térmico em 600 °C. (I) imagem do mapeamento onde o círculo é referente a região da quantificação em linha. ; (II) mapeamento do Co, Mo, O e Cu; (III) mapeamento do Co; (IV) mapeamento do Mo; (V) mapeamento do O; (VI) mapeamento do Cu... 53 Figura 21. Imagem referente à quantificação em linha na amostra B submetida a 600 °C. 54 Figura 22. Porcentagem metálica em linha a partir da Figura 21... 54 Figura 23. Resultados de medidas de dureza para cada tipo de revestimento... 55 Figura 24. Difratogramas de raios-X para os revestimentos A, B, D e E sem tratamento térmico... 56 Figura 25. Difratogramas de raios-X para os revestimentos A, B, D e E com tratamento térmico a 200°C... 57 Figura 26. Difratogramas de raios-X para os revestimentos B e C com tratamento térmico a 400°C... 57 Figura 27: Difratogramas de raios-X para os revestimentos B, e C com tratamento térmico a 600°C... 58 Figura 28: Curvas de polarização potenciodinâmica para Co-Mo sobre cobre, obtidas a 1 mV s-1 após 30 minutos de imersão em meio de NaCl 0,1 M... 59 Figura 29: Curvas de polarização potenciodinâmica para CoMo sobre cobre, obtidas a 1 mV s-1 após 30 minutos de imersão em tampão de HCO3-/CO32-, com HCO3- 0,1875 Me
CO32- 0,0125 M... 60
8
para o revestimento D submetido à aplicação de potencial -0,4 V e para o revestimento E submetido à aplicação de potencial de -0,4 e a -0,8... 62 Figura 32: Diagrama de Nyquist com tempo de imersão do revestimento C em meio de solução de NaCl... 64 Figura 33: Diagrama de Nyquist com tempo de imersão do revestimento C em meio de HCO3-/CO32-... 65
9
Tabela 1: Exemplos de fontes de energia convencionais e renováveis... 13
Tabela 2: Composição da solução eletrolítica... 35
Tabela 3: Parâmetros de densidade de corrente e pH para a eletrodeposição... 37
Tabela 4: Resultado da ANOVA para a porcentagem de Mo da liga Co-Mo... 44
Tabela 5: Relação entre composição, espessura e eficiência dos revestimentos... 46
Tabela 6: Resultado da ANOVA para a espessura da liga Co-Mo... 48
Tabela 7: Compostos presentes nos revestimentos Co-Mo submetidos a 600°C... 58
Tabela 8: Atribuição das bandas existentes nos espectros de Raman... 63
Tabela 9: Razão entre as cargas obtidas para cada revestimento e a carga do cobalto puro... 66
Tabela 10: Resultado da ANOVA para a área eletroativa da liga Co-Mo... 66
10
Este trabalho objetiva a eletrodeposição de Co-Mo sobre substrato de cobre e analisar a influência da densidade de corrente e do pH da solução eletrolítica durante a eletrodeposição. Os revestimentos foram obtidos sob controle galvanostático no intervalo de densidade de corrente de 30 mAcm-2 a 60 mAcm-2 e pH de 6 a 8. Os revestimento de Co-Mo apresentaram morfologia nodular com trincas independente do valor de densidade de corrente e pH usado. Por meio de Energia Dispersiva de Raios-X, o revestimento obtido em 60 mA.cm-2 e pH 8 apresentou maior porcentagem de molibdênio, 32%. A análise por Difração de Raios-X mostra que os revestimentos são amorfos. A eficiência no processo de eletrodeposição é maior quando a densidade de corrente é de 30 mAcm-2 e pH igual a 6. O estudo eletroquímico para a corrosão foi realizado em meio de solução de NaCl e solução de HCO3-/CO32-. Entre os tipos de revestimentos não houve diferença nas propriedades
corrosivas, porém, entre os meios, o de HCO3-/CO32- mostrou-se mais agressivo e a
11
This work objective of this work was to electrodeposit Co-Mo on copper substrate and analyze the influence of current density and pH of the electrolytic solution during electrodeposition. Coatings were produced under galvanostatic control in the current density interval of 30 mAcm-2 to 60 mAcm-2 and pH 6 to 8. The Co-Mo coatings presented a nodular morphology with cracks, independently of the value of current density and pH employed. An analysis of the coating obtained with 60 mAcm-2 and pH 8 by energy-dispersive X-ray spectroscopy revealed a high percentage of molybdenum, 32%. An X-ray diffraction analysis indicated that the coating were amorphous. The efficiency of the electrodeposition process was highest at a current density of 30 mAcm
-2
and pH 6. The electrochemical corrosion study was carried out in a medium of NaCl solution and of HCO3-/CO32- solution. The corrosion property of the various types of
coatings showed no difference, but the HCO3-/CO32- medium was more aggressive and
12
CAPÍTULO I
INTRODUÇÃO
Devido à variedade de materiais (metais, ligas metálicas, polímeros, etc.) o papel de escolha destes, por um profissional, para uso em estruturas ou equipamentos se torna difícil. O material ideal terá que apresentar três características importantes: propriedades desejadas, menor custo possível e durabilidade. As propriedades intrínsecas dos materiais (físicas e mecânicas) são, na sua maioria, encontradas na literatura.
Porém, quando se relaciona a durabilidade do material com a sua resistência à corrosão, prever como será seu comportamento se torna trabalhoso. Isto porque a natureza do meio corrosivo e as condições de exposição do material a este meio têm que ser consideradas. Neste aspecto, os problemas causados pela corrosão de materiais se tornam frequentes em diversos setores da atividade humana (construção civil, automobilística, ferroviária, marítima, odontológica, indústria química, etc.) proporcionando grandes gastos econômicos diretos (substituição e prevenção dos materiais) e indiretos (conseqüência da corrosão dos materiais). Destas perdas, as mais prejudiciais são as indiretas, pois são de difícil avaliação e na maioria das vezes de custos bem mais elevados. Gentil aborda algumas perdas indiretas: paralisações acidentais, perdas de produtos, contaminações de produtos, etc. [1]. Deve-se considerar a importância social com relação a fatores de segurança à saúde humana, em que acidentes devido à corrosão são imprevisíveis. Como exemplo, há um artigo referente à queda de uma plataforma metálica: “Queda de plataforma pode ter sido provocada por mau estado dos
materiais”. A queda da plataforma metálica, em princípio, foi devida à corrosão. Os
trabalhadores caíram de uma altura de 9,5 metros do solo [2]. Mediante estes problemas que abrangem diversas áreas, causando gastos econômicos e riscos de vida, o estudo da corrosão, no que se refere na melhor forma de evitá-la ou até mesmo minimizá-la, tem crescido e se mostrado importante do ponto de vista tecnológico, econômico e social na preservação da natureza quanto do homem.
13
XVIII, marca um aumento intensivo de fontes energéticas (carvão) na Europa Ocidental e em seguida nos Estados Unidos. Uma sucessiva ampliação na produção, primeira nos Estados Unidos e depois no Oriente Médio, teve como conseqüência a entrada do petróleo na matriz energética mundial na metade do século XIX. Isso devido a uma facilidade econômica e técnica de exploração, transporte e armazenamento. Porém, com o aparecimento da eletricidade uma nova era da civilização é marcada no final do século XIX, dando à sociedade um novo patamar de qualidade de vida [4].
Atualmente, as fontes de energia se dividem em duas vertentes: fontes de energia renováveis (alternativas) e fontes de energia não renováveis (fósseis ou convencionais).
Tabela 1: Exemplos de fontes de energia convencionais e renováveis.
Fontes Convencionais Fontes Renováveis
Carvão Hídrica, marés
Petróleo Eólica, Ondas
Gás natural Solar, Biomassa de resíduos
Urânio Geotérmica, Hidrogênio
As fontes de energia alternativas são uma solução tanto do ponto de vista econômico como ambiental. O investimento neste tipo de energia aumenta a cada ano. Um estudo realizado pela ONU em julho de 2008 mostrou que os investimentos em energias renováveis e sustentáveis durante 2007 foram de US$ 148 bilhões, representando um aumento de 60% em relação ao ano de 2006. O estudo verificou também que para 2012 e 2020 os investimentos em energia deverão chegar a US$ 450 bilhões e 600 bilhões, respectivamente [5].
No presente trabalho será apresentado o estudo de revestimentos metálicos para possível utilização na proteção contra a corrosão e como material eletrocatalítico.
I.1. Definição de Cor r osão
Várias definições são apresentadas na literatura. Algumas definições são incompletas ou até mesmo apresentam exceções. Como exemplo há uma definição bastante simples e conhecida que considera os aspectos energéticos (equações 1e 2): “a corrosão é o processo
14
metalurgia extrativa” [6]. Ela também se limita apenas à corrosão metálica e não cita
influências do meio em que o material se encontra.
Metal Energia
Composto+ Metalurgica→ (1)
Energia Composto
Metal Corrosão→ + (2)
Outra definição, esta mais ampla, é: “a corrosão é a destruição e a inutilização para o
uso do material pela sua interação química ou eletroquímica com o meio em que se encontra” [1,6,7]. Embora esta definição não se limite a materiais metálicos e apresente a
importância do meio no processo de corrosão, ela não é feliz no que diz respeito ao termo inutilização do material por sofrer corrosão. O produto de corrosão do alumínio, óxido de alumínio, forma uma barreira de proteção não deixando o metal em contato com o meio e assim proporcionando-lhe maior durabilidade na sua utilização. Ao contrário da definição apresentada, a corrosão no alumínio, e assim como em outros materiais, é benéfica na sua proteção.
Devido a estas exceções, uma definição generalizada se torna necessária e assim muitas das vezes pouca utilizada para casos específicos de corrosão: “a corrosão é a
transformação de um material pela sua interação química ou eletroquímica com o meio em
que se encontra” [6]. A transformação do material é exclusivamente devida à interação do
material com o meio corrosivo.
O presente trabalho dará ênfase apenas à corrosão dos materiais metálicos. Assim, a transformação no processo corrosivo será de um metal para um íon metálico de acordo com a equação 3.
Energia Me
Meio metálico
Material( )+ Interação → z+ +∆ (3)
15 I.2. Cor r osão Eletr oquímica e Passivação
A classificação do processo de corrosão varia entre autores. Entre as classificações relatadas na literatura, a mais aceita é a classificação em corrosão química e corrosão eletroquímica. Para entender a diferença nas classificações partir-se-á do princípio de que a corrosão metálica é um processo de oxidação do metal, perdendo elétrons para outra espécie presente no meio. Quando esta transferência de elétrons do metal para a espécie oxidante é de forma direta, ou seja, sem condução elétrica, trata-se de uma corrosão química. Isto porque as espécies redutoras e oxidantes estão no mesmo local. Entretanto, quando existe uma distância, seja na ordem de Angstrons ou de metros, entre as espécies do processo redox, há uma condução elétrica caracterizando uma corrosão eletroquímica. Neste caso, o local onde ocorre o processo de oxidação chama-se de ânodo e o local onde ocorre o processo redução chama-se de cátodo. Nos casos de corrosão, o do tipo eletroquímico é o mais acentuado.
A oxidação dos materiais metálicos é representada por uma semi-reação anódica como é mostrada na equação 4. Os elétrons originados pela reação anódica são consumidos na redução das espécies eletroativas presente no meio (eletrólito). A semi-reação catódica representa a redução destas espécies. O deslocamento dos ânions do eletrólito para o ânodo e o deslocamento do cátion do eletrólito para o cátodo garante a neutralidade do sistema.
( )→Me( )+ +ne−
Me n
aq s
0 (4)
Existe uma dependência entre os tipos de semi-reações catódicas e o meio em que elas ocorrem. Considerando um eletrólito aquoso neutro ou ácido desaerado e um meio aquoso ácido aerado, o íon hidrogênio e o oxigênio gasoso são propícios à redução, respectivamente (equação 5 e 6). Para um meio aquoso neutro ou básico, a equação 7 representa o tipo de reação que ocorre.
) ( 2 )
( 2
2H+aq + e− →H g (5)
) ( 2 ) ( 2 )
( 4 2
4H+aq +O g + e− → H Ol (6)
− − →
+
+ 2( ) ( ) )
(
2 4 4
2H Ol O g e OHaq (7)
16
Esta película possui espessura na ordem de Angstrons e são frequentemente óxidos que agem como barreira entre o metal e o meio proporcionando uma diminuição na velocidade de corrosão. Quando este fenômeno ocorre diz-se que o metal sofreu passivação [1,6,7]. A equação 8 mostra de maneira generalizada a reação de formação da película de passivação.
b aO
Me O
b aMe+ 2 →
2
(8)
I.3. Hidrogênio
Das fontes de energias renováveis, o hidrogênio é considerado por especialistas como o combustível do futuro, pois possui pontos positivos no ramo econômico e ambiental (alta eficiência energética e não produz poluente) relativamente às outras. As células a combustível, hoje fonte de estudo para a geração de energia elétrica e o uso em veículos, deverão ser um grande avanço na tecnologia da próxima década, consistindo em um sistema que oxida hidrogênio e reduz oxigênio produzindo água e calor. O fluxo elétrico (corrente contínua) externo da célula fornece trabalho elétrico. Devido o fornecimento de hidrogênio a estes dispositivos, se torna necessário à produção de hidrogênio, visto que ele não é um combustível primário. Uma reportagem mostrada pela revista Época faz a propaganda do carro eleito o “carro verde mundial” durante o Salão do Automóvel de Nova York, o Honda FCX Clarity, que é movido a células a combustível, sendo três vezes mais econômico que a gasolina e atinge 160 Km/h [3].
17
I.4. Eletrocatálise - Reação de Despr endimento de Hidrogênio
Quando se aplica um mesmo sobrepotencial e uma dada reação eletroquímica se processa com velocidades diferentes dependendo do substrato eletródico, ocorre o fenômeno de eletrocatálise.
As reações nos eletrodos metálicos são reações heterogêneas, onde a transferência de carga ocorre entre o substrato e o reagente. Para que a transferência do elétron seja possível é necessário que a energia do elétron a ser transferido, do reagente, seja igual à energia do nível de Fermi no substrato. O mesmo para um processo inverso, onde o orbital molecular do reagente deverá possuir a mesma energia do elétron do nível de Fermi do substrato para que possa recebê-lo. Quando material eletródico participa da reação promovendo sítios para a adsorção dos participantes, a situação energética favorável à transferência de carga aumenta consideravelmente.
A eletrocatálise relacionada com a produção de hidrogênio é da maior importância quando se trata do custo do hidrogênio eletródico. O mecanismo para a reação de desprendimento de hidrogênio (RDH) é composto por três etapas onde pode haver a combinação de duas ou três delas. As três etapas são as de Volmer, Heyrovsky e Tafel. A primeira etapa, de Volmer, consiste no processo de adsorção do hidrogênio no substrato. Isto é possível pela descarga do próton hidratado em meio ácido (equação 9) ou das moléculas de água em meio alcalino (equação 10).
Etapa de Volmer:
M +H3O+ +e− →MHads+H2O (meio ácido) (9)
2 ads
M +H O +e−←→MH +OH− (meio alcalino) (10)
Esta descarga proporciona um grau de recobrimento θ de átomos de hidrogênios adsorvidos quimicamente nos sítios livre do metal (M).
18 Etapa de Heyrovsky:
3 2 2
ads
MH +H O++e−←→M+H +H O (meio ácido) (11)
2 2
ads
MH +H O +e−←→M +H +HO− (meio alcalino) (12)
Etapa de Tafel:
2
2MHads←→2M+H
(meio ácido ou alcalino) (13)
Assim, a RDH pode ocorrer em três combinações das etapas discutidas: Volmer - Heyrovsky, onde logo após a adsorção ocorre uma dessorção eletroquímica; Volmer – Tafel, onde logo após a adsorção ocorre uma dessorção química; Volmer – Heyrovsky – Tafel, onde após a adsorção é possível uma dessorção eletroquímica e química.
Faz-se necessário um estudo referente ao grau de recobrimento superficial já que há um processo de adsorção. O estudo do grau de recobrimento é possível por meio de isotermas de adsorção. Também se faz importante o estudo de parâmetros como coeficiente angular de Tafel e ordem eletroquímica de reação para o estudo cinético da RDH. Esse estudo cinético é possível por meio de curvas de polarização de estado estacionário.
Vários materiais eletródicos são propostos para promover a RDH. O estudo desses materiais é amplo na literatura. Trabalhos referentes a materiais eletródicos para eletrocatálise são citados a seguir como exemplo.
Tavares e colaboradores [9] realizaram o estudo da RDH em meio ácido de 0,5 M H2SO4, sobre microeletrodo de Pt, em várias temperaturas (25-75°C). Um novo modelo é
proposto como Volmer-Heyrovsky, sendo a etapa de Heyrovsky determinante da velocidade reacional.
Gonzalez e colaboradores [10] analisaram a RDH por meio de curvas de polarização em estado estacionário em eletrodos de Ni-S tendo aço como substrato, em meio de KOH 28 % a várias temperaturas (23-80°C) e pH. Os resultados sugerem uma rápida transferência de carga seguida por uma lenta dessorção eletroquímica. O mecanismo Volmer-Heyrovsky é confirmado por meio de medidas de impedância. Um valor de 85 mV dec-1 para a inclinação de Tafel é encontrado ser independente da temperatura.
19
com o grau de recobrimento, teve como conclusão que o processo reacional ocorre por meio de um mecanismo Volmer-Heyrovsky, onde a etapa determinante do processo é uma dessorção eletroquímica. Em outro trabalho, com o mesmo substrato, os autores analisam a RDH em meio de hidróxido de sódio tendo como resultado valores de 110 mV e 0,48 para a inclinação de Tafel e para a ordem reacional, respectivamente. O mecanismo proposto foi o de Volmer-Tafel [12].
Chialvo e Chialvo [13] estudaram ligas Ni-Mo com composições atômicas de 0, 1, 3, 5, 10, 20 e 25% são estudadas para RDH em solução de hidróxido de sódio 2 M a 30 °C. O trabalho revela que para baixos sobrepotenciais (< 0,2 V), a atividade eletrocatalítica é maior quando a liga é composta por 25 % de molibdênio. Para elevados valores de sobrepotenciais, a diferença no comportamento eletrocatalítico não é considerável. Os parâmetros cinéticos corresponderam para um mecanismo de Volmer-Heyrovsky-Tafel.
Um trabalho realizado por Simprega e colaboradores [14] mostra a influência eletrocatalítica de cádmio em eletrodepósitos de Ni-Mo. A comparação entre os eletrodepósitos de Ni-Mo e Ni-Mo-Cd é estudada em solução de KOH em uma faixa de temperatura de 298 a 348K. Tanto a cinética de evolução de hidrogênio como o comportamento de adsorção das espécies de hidrogênio são considerados para a comparação entre os dois tipos de eletrodepósitos. Os autores têm como resultado que a presença de cádmio aumenta a atividade eletrocatalítica do material eletródico.
Correia e Machado [15] realizaram o estudo da RDH em duas diferentes superfícies de eletrodepósitos em microeletrodos de Pt tanto em meio ácido como em meio básico. As superfícies analisadas foram de Pt/Hg ( em meio ácido de HClO4 0,5 M) e Pt/Ni (em meio
básico de NaOH 0,5 M). Como base em equações cinéticas, o mecanismo proposto foi o de Volmer-Heyrovsky como diferentes etapas determinantes para as superfícies estudadas. Para ambas as superfícies, curvas de polarização foram realizadas em intervalo de temperatura de 25 a 70°C. Para a superfície de Pt/Ni uma energia de ativação de 56 kJ mol-1 é obtida, indicando como etapa determinante a de Heyrovsky, enquanto que para superfície de Pt/Hg uma energia de ativação de 204 kJ mol-1 é obtida, tendo Volmer a etapa determinante.
20 I.5. Eletrodeposição
Como já foi mencionado, um dos métodos práticos para combater a corrosão é interpor uma barreira entre o metal e o meio corrosivo. Estas barreiras podem ser revestimentos orgânicos ou inorgânicos. Dentre os revestimentos inorgânicos, destacam-se as ligas metálicas. Algumas ligas são mais facilmente obtidas por eletrodeposição que por processo metalúrgico [17].
O método de eletrodeposição é bastante utilizado para projetar revestimentos protetores de superfícies que proporcionam elevada resistência à corrosão e ao desgaste mecânico. Muitos destes revestimentos possuem propriedades magnéticas. Em vista disto, há uma grande aplicação destes revestimentos na indústria eletrônica e automobilística.
A eletrodeposição possibilita o controle de parâmetros experimentais, como composição da solução eletrolítica, temperatura de deposição, densidade de corrente aplicada, carga a ser depositada. O controle destes parâmetros favorece o estudo das características físicas e químicas dos eletrodepósitos (revestimentos).
O processo de eletrodeposição está relacionado com parâmetros termodinâmicos, cinéticos e eletroquímicos, como transferência de massa e transferência de carga. As variáveis do processo, tais como densidade de corrente, temperatura, agitação, composição do banho eletrolítico, etc., exercem forte influência na estrutura e composição dos eletrodepósitos. Desta forma, a compreensão dos fenômenos envolvidos na eletrodeposição se torna necessária. Analisando a influência destas variáveis é possível classificar os processos de eletrodeposição em cinco sistemas [17]:
- codeposição regular; - codeposição irregular; - codeposição de equilíbrio; - codeposição anômala; - codeposição induzida.
21 I.6. Eletrodepósitos de Co-Mo
Mencionou-se anteriormente que o processo de eletrodeposição é um método extensamente usado para a produção de revestimentos metálicos. O presente trabalho tem como objetivo geral estudar o revestimento de Co-Mo obtidos por eletrodeposição. O estudo do mecanismo de eletrodeposição de Co-Mo se torna importante, já que o processo de eletrodeposição influencia nas características do eletrodepósito. A formação desse depósito é um processo por codeposição induzida, no qual é necessária a presença de íons de cobalto para que ocorra a redução do molibdato a molibdênio. Certos mecanismos são propostos [17,19] mostrando a influência de um metal M na redução do molibdato a molibdênio, em que M representa um elemento do grupo do ferro (M = Fe, Co e Ni).
Gómez e colaboradores [17, 19, 20] investigaram a eletrodeposição de Co-Mo na presença de citrato. Um mecanismo é proposto de modo a ocorrer à formação de um complexo intermediário. Segundo os autores, a formação de óxido de molibdênio é favorecida pela presença de CoCit-.
) aq ( ) s ( 2 CoCit ) l ( 2 ) aq ( 2
4 2H O 2e MoO 4OH
MoO − + + − →− + − (14)
Em seguida, a formação do complexo intermediário ocorre como produto da reação do óxido de molibdênio com CoCit-.
CoCit -(aq) + MoO2(s)→ [MoO2-CoCit -]ads (15)
É enfatizado pelos autores que é preciso haver Co(s) para favorecer a redução do
complexo intermediário à Mo(s).
) ( 3 ) ( )
(aq 2e Cos Cit aq
CoCit− + − → + − (16)
− −
−
− + + → + +
− 2 () ( ) ( ) ( )
2 ] 2 4 4
[MoO CoCit ads H Ol e Mos CoCitaq OH aq (17)
22
(equação 15). Sem uma concentração suficiente de citrato no meio, a eletrodeposição do molibdênio seria dificultada.
A literatura é bastante rica em informações, além dos eletrodepósitos de Co-Mo, sobre ligas de Co e de Mo, binárias ou ternárias com diversas aplicações, tais como revestimentos contra corrosão, materiais magnéticos, materiais eletrocatalíticos. Trabalhos estes que mostram como ocorre a influência de parâmetros operacionais nas características físicas e químicas dos eletrodepósitos.
Estudos também são realizados com base na modificação na concentração dos constituintes da solução eletrolítica. Sanches e colaboradores [21] investigaram a eletrodeposição da liga binária de Ni-Mo sobre disco de platina com diferentes razões molares (1:1, 1:10, 10:1) de Ni:Mo em citrato de sódio em pH 4,0, com a finalidade de observar o comportamento eletroquímico. O estudo voltamétrico mostrou que o potencial do processo de redução se torna menos nobre quando a razão molar passa de 1:1 para 1:10. Porém a corrente de pico do processo é a mesma. Por outro lado, quando a concentração de Ni aumenta (10:1), o potencial do processo é deslocado para potencial mais nobre e o aumento da corrente de pico do processo é observado. Unida à análise química dos filmes depositados é possível observar o processo de codeposição induzida para as razões molares de 1:1 e 1:10.
O estudo da influência de aditivos nos eletrodepósitos de Co-Ni em carbono vítreo foi realizado por Gómez e colaboradores [22]. O efeito do surfactante cloreto de dodeciltrimetilamônio (DTAC) no eletrodepósito de Co-Ni é considerável. O aumento da concentração do DTAC na solução eletrolítica leva a formação de eletrodepósitos mais ricos em cobalto e também a observação de potencial de oxidação menos positivo. A influência do DTAC está presente na estrutura, na morfologia e nas propriedades magnéticas do eletrodepósito.
O trabalho realizado por Pané e colaboradores [23] mostra a influência da presença do surfactante AZTMAI (4-butilazobenzeno-4´-(oxietil)trimetilamonio iodeto) na solução eletrolítica nas propriedades magnéticas da liga de Co-Ni. A concentração de surfactante na solução eletrolítica durante a eletrodeposição é alterada, apresentando modificações não só nas propriedades magnéticas, mas também estruturais.
23
A utilização de ligas como biomateriais metálicos é citada na literatura [25, 26, 27]. O estudo da corrosão destes materiais é essencial, visto que pode ocorrer a liberação de íons metálicos tóxicos desses biomateriais no organismo. Alguns estudos acerca destas ligas, com aplicação como biomateriais, é realizado em soro fisiológico simulado para a análise da resistência à corrosão [25, 26].
O processo de planejamento experimental foi utilizado por Santana e colaboradores [28] para otimização das condições operacionais como densidade de corrente e agitação mecânica na eficiência catódica para a eletrodeposição de Co-Mo em substrato de cobre. Foi observado que, para maiores agitações e menores densidades de correntes, dentro do planejamento experimental adotado, a eficiência catódica e a porcentagem de cobalto no eletrodepósito aumentam.
Trabalhos referentes ao estudo de eletrodeposição de cobalto também são mencionados. O trabalho realizado por Calderón e colaboradores [29] mostra a eletrodissolução do cobalto em solução tampão de carbonato/bicarbonato. Técnicas de polarização de estado estacionário, medidas de pH interfacial e espectroscopia Raman são usados. Segundo os autores, em princípio ocorre a formação de um filme de CoO e, em seguida, a sua transformação em Co3O4, proporcionando a passivação do metal.
Outro trabalho de Calderón, Barcia e Mattos [30] estuda a cinética do processo de corrosão do cobalto no mesmo eletrólito, solução tampão de carbonato/bicarbonato, utilizando polarização de estado estacionário e medidas de impedância eletroquímica. O mecanismo de dissolução do cobalto até a formação de CoO também é proposto de acordo com as equações 18-21.
−
− → +
+HCO CoHCO e
Co(s) 3(aq) ( 3)(ads) (18)
− − → ← − − + + +
+HCO OH Co CO H O e
CoHCO3)(ads) 3(aq) 2 (aq) ( 3)22 (aq) 2 2
( (19) − − → ← − + + +
+ OH CoO HCO H O e
CoHCO3)(ads) 2 (aq) 3(aq) 2
( (20)
− ++ +
→
+CoO Co CoO e
Co 2 2 (21)
Gómez e colaboradores [31] prepararam eletrodepósitos de Co-Mo a partir de uma solução eletrolítica de sulfato-citrato, analisando as propriedades morfológicas, estruturais e magnéticas. Eletrodepósitos com 20-23 % de Mo sobre substrato de cobre e carbono foram obtidos pelos autores a partir de um banho eletrolítico formado com CoSO4 0,1 M, Na2MoO4
24
eletrodepósitos apresentaram cristalinidade, com uma morfologia acicular. Quando a eletrodeposição era realizada em potenciais de deposição mais negativos os eletrodepósitos apresentaram uma estrutura mista (cristalina + amorfa).
A aplicação de eletrodepósitos também se direciona a materiais catódicos e a materiais eletrocatalíticos como já citado no item 1.4 [14-16].
I.7 Planejamento Exper imental
O planejamento experimental permite a determinação das variáveis que exercem maior influência no desempenho de um determinado processo, tendo como resultado:
1. redução da variação do processo e melhor concordância entre os valores nominais obtidos e os valores pretendidos;
2. redução do tempo do processo; 3. redução do custo operacional; 4. melhoria no rendimento do processo.
Esta técnica permite eficiência e economia no processo experimental e o uso de métodos estatísticos na análise dos dados obtidos resultando em objetividade científica nas conclusões. Desta forma, é obtido um modelo matemático apropriado para descrever certo fenômeno, utilizando o mínimo possível de experimentos[32].
O planejamento fatorial é uma técnica bastante utilizada quando se tem duas ou mais variáveis independentes (fatores). Ele permite uma combinação de todas as variáveis, sujeita a todas as combinações das demais.
Planejamentos fatoriais são extremamente úteis para medir os efeitos (ou influências) de uma ou mais variáveis na resposta de um processo. O usual é realizar um planejamento com dois níveis, no máximo três. O uso de mais níveis aumentaria sobremaneira o número de pontos experimentais, fato esse que se quer evitar quando se propõe um planejamento. Segundo Calado e Montgomery [32], o planejamento fatorial é a única maneira de prever interação entre os fatores.
25
todos os parâmetros fornecidos pelo modelo matemático, mais pontos devem ser adicionados ao planejamento fatorial de dois níveis. Estes pontos correspondem a pontos centrais, uma vez que eles não afetam as estimativas usuais dos efeitos. Devem-se considerar fatores
quantitativos.
O planejamento fatorial apresenta muitas vantagens sobre os métodos univariantes. Neste método os fatores são simultaneamente variados ao mesmo tempo e não um a um como nos métodos clássicos, permitindo observar as interações antagônicas e a sinergia envolvida nos fatores analisados. Métodos univariantes são incapazes de medir estas interações e por esta razão não são efetivos como técnicas de otimização.
26
CAPÍTULO II
Técnicas Utilizadas
II.1. Car acter ização Física
II.1.1. Micr oscopia Eletrônica de var r edur a e Ener gia Disper siva de Raios-X
O microscópio eletrônico de varredura utiliza um feixe de elétrons ao invés de fótons (microscópio óptico convencional) para aumentar a resolução da imagem. Sob uma voltagem suficientemente grande, por exemplo, 50 kV, elétrons de comprimento de onda extremamente curto são produzidos. Por possuírem cargas, os elétrons podem ser focalizados em campos elétricos ou eletrostáticos e, assim, formar imagens [34].
A Análise por Energia Dispersiva de Raios-X (EDX) possui o mesmo princípio físico, mas adquire resultados diferentes. O feixe de elétrons é suficientemente energético para ionizar as camadas profundas dos átomos e produzir emissões de raios-X. Por meio da análise dos espectros obtidos é possível determinar os elementos presentes na amostra.
II.1.2. Cálculo da Eficiência de Cor r ente Catódica
A necessidade de se conhecer a eficiência do processo de eletrodeposição dos metais de interesse existe devido à ocorrência de reações paralelas as de interesse como desprendimento de hidrogênio. O processo de eletrodeposição obedece à lei de Faraday, na qual a massa eletrodepositada é diretamente proporcional a carga (Q) aplicada na eletrodeposição (equação 23).
F Q E
m= . / (23)
A F d f Q n a f
27 em que:
E:equivalente químico das espécies;
fi: é a fração em átomos de cada elemento no revestimento;
ai: é a massa atômica de cada elemento;
ni: o número de elétrons envolvidos no processo de eletrodeposição de cada elemento.
Realizando arranjos matemáticos com a lei de Faraday e a densidade (d / g cm-3), pode-se obter a equação 24, a qual fornece a espessura, e, teórica do revestimento, onde
) / . (fiai ni
Σ é o equivalente químico médio ponderado e Σ(fi.di) é a densidade média ponderada dos elementos.
II.1.3. Deter minação da Microdur eza dos Revestimentos
O método se baseia na penetração de uma ponta de base quadrangular feita de diamante, como pode ser visto na Figura 1 [35]. As cargas aplicadas podem variar de 10 mN a 10 N com certo tempo de aplicação. A dureza é obtida por meio da medida das diagonais da impressão produzida na peça.
Figura 1. Esquema para o cálculo da microdureza pela metodologia de Vickers[35].
2
/ 854 ,
1 F D
28
em que F é a carga aplicada em Kgf e D é a diagonal média do quadrado de corte em mm.
II.1.4. Difr ação de Raios-X
Em 1914, Laue provou a natureza ondulatória dos raios-X provocando um padrão de difração da radiação e a difração se tornou útil para a determinação de estruturas cristalinas [36]. As estruturas monocristalinas são compostas por um conjunto básico de átomos que se repetem periodicamente nas três dimensões. A lei de Bragg, representada na equação 26, diz que para um feixe incidente monocromático, há direções para as quais o espelhamento produzido por todo o conjunto de átomos está em fase (interação construtiva) e produzem picos estreitos de difração responsáveis pelos pontos mais claros no padrão de Laue.
θ
λ =2dsen (26)
A Figura 2 ilustra o fenômeno descrito acima. Ao se incidir uma radiação de raios-X de comprimento de onda (λ) igual a 1,54 Ǻ sobre um conjunto de planos com distância (d) 1,994, obtém-se θ = 22,7°, ou seja, a incidência de um feixe de raios-X em um plano com ângulo de 22,7° produzirá um pico de intensidade referente a este conjuntos de planos de mesma direção cristalográfica. Caso a incidência por ângulo ocorra, outro plano terá preferência.
29 II.1.5. Espectr oscopia Raman
Em 1928, o físico indiano Chandrasekhara Vankata Raman verificou o efeito de espalhamento da luz. Observou-se que para um feixe de luz monocromática a radiação sofria mudança de direção (espalhamento) após atingir a amostra. Este espalhamento pode ser de dois tipos: espalhamento elástico (Rayleigh) e espalhamento inelástico (Raman) [35]. Somente uma pequena porção da luz é dispersada inelasticamente frente às rápidas mudanças de freqüência, devido à interação da luz com a matéria, e é uma característica intrínseca do material analisado e independe da freqüência da luz incidente.
II.2. Ensaios Eletr oquímicos
II.2.1. Cur vas de Polar ização Potenciodinâmica Linear
Quando um eletrodo metálico está em equilíbrio, a reação eletroquímica (equação 27) tanto no sentido de oxidação (iox) como de redução (ired), que ocorrem na superfície do
eletrodo, se processam com a mesma velocidade reacional de modo que as corrente são iguais (iox = ired = io) e chamadas de corrente de troca, io. Um potencial de equilíbrio, Ee, se
estabelece nesta situação. A aplicação de um potencial externo altera o Ee caracterizando a
polarização do eletrodo. A extensão dessa polarização é medida pela sobretensão representada na equação 28.
É possível mostrar a relação entre a corrente resultante, i, com a sobretensão por meio da equação de Tafel (equação 29), em que b é o coeficiente de Tafel.
Me(s) Me(zaq+) + ze
- (27)
e E E− =
η (28)
) / log(i io b
=
η (29)
30
Figura 3. Curva de polarização esquemática mostrando a extrapolação de Tafel [37].
Nesta Figura, η a, η c , ba e bc são o sobrepotencial anódico e catódico e o coeficiente de
Tafel anódico e catódico, respectivamente.
II.2.2. Espectr oscopia de Impedância Eletr oquímica
Esta técnica eletroquímica tem como principal diferença das outras técnicas eletroquímicas a aplicação de um potencial de corrente alternada com diferentes valores de freqüências (ƒ) ao invés da aplicação de um potencial em corrente contínua. A aplicação da corrente alternada pode ser em modo potenciostático ou galvanostático. Para um circuito de corrente alternada, o potencial elétrico E(t) e a corrente elétrica I(t) são expressas das seguintes formas:
t A t
E()= cosω (30)
) (
)
(t =Bsen t+Φ
I ω (31)
) ( ) (t ZI t
E = (32)
em que ω = 2πƒ e Φ é a defasagem entre o E(t) e I(t). A relação entre o E(t) e I(t) possui semelhança com a lei de Ohm como está descrito na equação 32, no qual Z é denominada de impedância.
31
Realizando rearranjos matemáticos, fora do interesse do trabalho, uma relação de Z com Zr (parte real) e Zi (parte imaginária) é obtida (equação 33). Estes parâmetros são
provenientes de números complexos, sendo de grande importância para analisar a técnica.
i
r jZ
Z
Z = + (33)
Graficamente, a impedância pode ser representada por meio do diagrama de Nyquist, como apresentado na Figura 4. Os dados fornecidos pelo gráfico são referentes a componentes de um circuito elétrico e este circuito elétrico é equivalente à interface metal-eletrólito, em que Re é a resistência elétrica do eletrólito, Rp é resistência de polarização e Cdc é capacitância
da dupla camada elétrica [37].
(a) (b)
Figura 4. Representação de Nyquist (a); Circuito elétrico equivalente de uma interface metal-eletrólito(b) [37].
II.2.3. Voltametr ia Cíclica
O método de varredura de potencial é largamente utilizado para estudo de processos eletródicos (oxidação e redução). O método consiste em, a partir de um potencial inicial (Ei),
variar o potencial do eletrodo com velocidade de varredura (v) constante até um potencial final (Ef) e retornar ao valor inicial. A Figura 5 mostra a programação de potencial em função
32
Figura 5. Programação de potencial imposta ao eletrodo de trabalho na voltametria cíclica.
A medida experimental consiste de gráficos (voltamogramas cíclicos) de variação de corrente em função do potencial.
II.2.4. Cur vas de Polar ização de Estado Estacionár io
O estudo da cinética da RDH é geralmente realizado por meio da relação entre sobrepotencial e o logaritmo da corrente. A obtenção dessa relação é possível pelo levantamento de curvas de polarização do estado estacionário. A equação de Butler-Volmer faz a relação entre a densidade de corrente aplicada no sistema com o sobrepotencial. [37].
]
/
)
1
(
exp
/
[exp
zF
RT
ZF
RT
i
i
=
oα
η
−
−
−
α
η
(34)em que:
i: é a densidade de corrente aplicada ao sistema; io: é a densidade de corrente de troca;
α: coeficiente de transferência ou de simetria; z: números de elétrons envolvidos;
F: constante de Faraday;
η: sobrepotencial (diferença entre o potencial aplicado e o de equilíbrio); R: constante dos gases;
33
Tal equação pode ser simplificada quando o sobrepotencial, em valores absolutos, supera 0,03 V. A equação simplificada se chama equação de Tafel (equação 35) que estabelece uma relação linear entre o sobrepotencial e a densidade de corrente.
o
i
b
i
b
ln
−
ln
=
η
(35)O coeficiente b é a inclinação de Tafel anódico ou catódico dependendo do tipo de processo ocorrendo na superfície do eletrodo. Como se trata da RDH, a inclinação de Tafel é catódico (bc) de acordo a equação 36.
zF
RT
b
c=
−
/(
1
−
α
)
(36)A energia de ativação envolvida no processo da RDH é determinada por meio de uma relação linear que há entre ln io e o inverso da temperatura, 1/T. Assim investigando a RDH
em diferentes temperaturas é possível determinar a energia de ativação envolvida ∆Gc *
no processo (equação 37).
RT
G
C
i
o c/
34
CAPÍTULO III
OBJ ETIVOS
A dissertação aqui apresentada tem como objetivo geral a obtenção do revestimento de Co-Mo, assim como sua caracterização no aspecto físico e químico e seu comportamento frente à corrosão eletroquímica, como parte de caracterização do revestimento. A análise do comportamento do revestimento de Co-Mo na Reação de Desprendimento de Hidrogênio (RDH) também será realizada.
Com base no objetivo geral é possível destacar alguns objetivos específicos como:
- caracterizar os revestimentos obtidos por meio da microscopia eletrônica de varredura, energia dispersiva de raios-X e difração de raios-X;
- determinar a eficiência catódica no processo de eletrodeposição da liga de Co-Mo;
- estudar o comportamento corrosivo dos revestimentos, por meio da técnica de polarização potenciodinâmica linear;
- monitorar o processo de corrosão por espectroscopia de impedância eletroquímica;
35
CAPÍTULO IV
PROCEDIMENTO EXPERIMENTAL
IV. 1. Composição da solução eletr olítica
A composição da solução utilizada na eletrodeposição é descrita na Tabela 2.
Tabela 2: Composição da solução eletrolítica [39].
Componentes Concentr ação Função
C6H5Na3O7.2H2O 50,5g/L Agente complexante
(NH4) 2SO4 8,5g/L Agente tamponante
Na2MoO4.2H2O 1,815g/L Fonte de molibdênio
CoSO4.7H2O 17,5g/L Fonte de cobalto
C12H25NaO4S 0,0175g/L Redutor da tensão superficial
As soluções foram preparadas como água destilada. O pH da soluções apresentou aproximadamente um valor de 7,4.
IV.2. Célula Eletr oquímica
Para a obtenção dos eletrodepósitos utilizou-se uma célula eletroquímica com dois eletrodos (trabalho e auxiliar). Quanto aos ensaios eletroquímicos uma célula eletroquímica convencional de três eletrodos foi usada (trabalho, auxiliar e referência). A Figura 1 apresenta a representação esquemática das células utilizadas.
IV.3. Eletr odos
36
(a) (b)
Figura6. Representação esquemática da célula eletroquímica. Para eletrodeposição (a) e para os ensaios eletroquímicos (b). Indicados, tem-se: eletrodo auxiliar de Pt, eletrodo de trabalho, eletrodo de referência (eletrodo de Hg/HgO/ (HCO3
-/CO3
2-) ou calomelano saturado2-) e solução eletrolítica.
Como eletrodo de referência para o estudo de corrosão utilizou-se o eletrodo de Hg/HgO/ (HCO3-/CO32-), nas concentrações de 0,1875 mol dm-3 e 0,0125 mol dm-3,
respectivamente. O eletrodo de referência para o estudo de corrosão em NaCl 0,1 mol dm-3 foi o de calomelano saturado (ECS). Para a realização do estudo eletrocatalítico do material utilizou-se o eletrodo de Hg/HgO/OH- em meio de NaOH 0,5 mol dm-3 como referência.
IV.4. Obtenção dos Depósitos
Para a otimização do processo de eletrodeposição das ligas de Co-Mo foi realizado um planejamento fatorial completo 22. A influência das variáveis de entrada (densidade de corrente de eletrodeposição e pH da solução eletrolítica ) foi avaliada quantitativamente sobre a porcentagem de Mo, Cálculo da Eficiência de Corrente Catódica e para a área ativa dos revestimentos, bem como suas possíveis interações, com a realização mínima de experimentos. Os experimentos foram realizados em ordem aleatória, para diminuir os erros sistemáticos, utilizando o software STATISTICA 5.0 como ferramenta computacional.
37
eletrodeposição, a densidade de corrente e o pH da solução eletrolítica. O tempo para cada deposição foi estimado por meio da Lei de Faraday:
Q = I.t (22) na qual Q é a carga em Coulomb (C), I é a corrente em Ampère (A) e t o tempo em segundos (s). A relação entre os parâmetros de densidade de corrente e pH são mostrados na Tabela 3.
Tabela 3: Parâmetros de densidade de corrente e pH para a eletrodeposição.
Depósito Densidade Corrente
(i / mAcm-2) pH
Tempo de Deposição (min)
A 30 6 80
B 60 6 40
C 45 7 53,33
D 30 8 80
E 60 8 40
O pH foi ajustado adicionando ácido sulfúrico concentrado e hidróxido de amônio para reduzir e elevar o pH, respectivamente. O ajuste da densidade de corrente foi realizado por uma fonte de corrente contínua. Todos os depósitos foram realizados em temperatura ambiente e em triplicata.
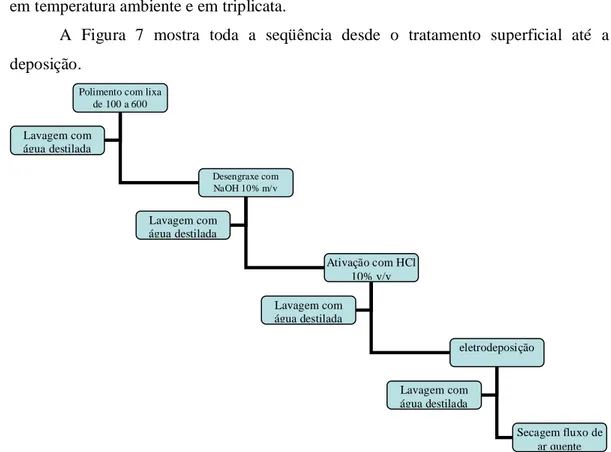
A Figura 7 mostra toda a seqüência desde o tratamento superficial até a deposição.
Figura 7. Fluxograma ilustrativo desde tratamento superficial até ao final da deposição.
Polimento com lixa de 100 a 600
Desengraxe com NaOH 10% m/v
Ativação com HCl 10% v/v
eletrodeposição
Secagem fluxo de ar quente Lavagem com
água destilada
Lavagem com água destilada
Lavagem com água destilada
38 IV.5. Car acter ização Física
IV.5.1. Micr oscopia Eletrônica de var r edura e Ener gia Disper siva de Raios-X
A caracterização morfológica dos revestimentos foi realizada por Microscopia Eletrônica de Varredura (MEV). Foram obtidas imagens frontais, com o objetivo de verificar a morfologia do revestimento Co-Mo, e transversais, com o intuito de determinar a espessura da camada do revestimento e observar a composição. A análise da composição química dos revestimentos foi realizada por EDX. As análises por EDX foram frontais a superfícies do revestimento, com ampliação de 100 vezes permitindo uma ampla faixa analisada, e na transversal. As análises foram realizadas em triplicata.
IV.5.2. Cálculo da Eficiência de Cor r ente Catódica
Para analisar a eficiência no processo de eletrodeposição, cálculos de acordo com a seção II.1.2 foram realizados para obter os valores de espessura teórica que são consideradas como rendimento de 100 %. Por meio da análise por MEV, a espessura real será medida e, em função dela, a eficiência do processo.
IV.5.3. Tr atamento Tér mico
39
Figura 8. Gráfico referente ao tratamento térmico das amostras.
IV.5.4. Deter minação da Microdur eza dos Revestimentos
Para as análises de microdureza usou-se uma carga de deposição de 1000 C para evitar qualquer influência do substrato de cobre sobre os resultados da medida. Cada medida foi repetida dez vezes sobre o mesmo revestimento em locais diferentes e posteriores cálculos estatístico foram realizados. A carga aplicada sobre o revestimento foi de 10 mg (0,01 N), com um tempo de aplicação de 30 segundos.
IV.5.5. Difr ação de Raios-X
40 IV.5.6. Espectr oscopia Raman
A espectroscopia Raman foi utilizada para caracterização do filme de passivação formado sobre os revestimentos em diferentes condições: filme de passivação formado por imersão em meio de NaCl 0,1 mol dm-3 e em solução tampão de bicarbonato/carbonato pH 8,8 por seis dias; e por aplicação de potencial na região de passivação por 30 minutos em meio de NaCl 0,1 mol dm-3 e em solução tampão de bicarbonato/carbonato pH 8,8
IV.6. Ensaios Eletr oquímicos
IV.6.1. Cur vas de Polar ização Potenciodinâmica Linear
Com o objetivo de determinar os valores de potenciais de corrosão (Ecorr) dos
depósitos de Co-Mo, a técnica de polarização potenciodinâmica foi utilizada. As curvas de polarização foram obtidas a uma velocidade de 1 mV s-1 em uma região de -1,3 V a 0 V em NaCl 0,1 mol dm-3 e em solução tampão de bicarbonato/carbonato pH 8,8 com objetivo de avaliar o comportamento dos revestimentos. As medidas foram realizadas em triplicata.
IV.6.2. Espectr oscopia de Impedância Eletr oquímica
Experimentos de espectroscopia de impedância eletroquímica (EIE) foram realizados nos mesmos eletrólitos utilizados (solução tampão de bicarbonato/carbonato pH 8,8 e em NaCl 0,1 mol dm-3) para a obtenção das curvas de polarização. Foram obtidos sob uma perturbação de potencial com freqüência entre 40 kHz e 6 mHz, enquanto que a amplitude do sinal senoidal foi de 10 mV.
IV.6.3. Voltametr ia Cíclica
41
IV.6.4. Cur vas de Polar ização de Estado Estacionár io
Com o intuito da avaliação da energia de ativação para a RDH no revestimentos de Co-Mo, as curvas de polarização de estado estacionário foram levantadas em diferentes temperaturas (30-60°C) em meio básico de NaOH 0,5 M.
IV.7. Equipamentos
Os equipamentos utilizados no presente trabalho foram:
- para ajuste de pH da solução eletrolítica: pHmetro modelo B474 (Micronal); - para obtenção dos eletrodepósitos: fonte de corrente contínua modelo DC Power Supply MPL-1303 (Minipa);
- para a realização de MEV e EDX: microscópio eletrônico modelo XL-30 (Philips) e modelo Vega XMU (Tecsan USA, Inc.);
- para tratamento térmico: forno do tipo túnel, com câmara interna de quartzo, dotado de controlador programável de temperatura;
- para medidas de microdureza dos revestimentos: microdurômetro modelo HMV-2-Series - Micro Hardness Tester (Shimadzu);
- para análises da cristanilidade dos revestimentos: difratômetro de raios-X DMAXB (Rigaku);
- para realização dos ensaios eletroquímicos: potenciostato/galvanostato modelo PGSTAT30 (Autolab, Metrohm-Eco Chemie).
42 CAPÍTULO V
RESULTADOS E DISCUSSÃO
V.1. Car acter ização Física
V.1.1. Microscopia Eletr ônica de Var r edur a e Ener gia Disper siva de Raios-X
O estudo prévio dos eletrodepósitos de Co-Mo consistiu na verificação da influência da densidade de corrente e do pH na morfologia do revestimento. A Figura 9 apresenta as micrografias superficiais dos revestimentos de Co-Mo para cada condição de eletrodeposição.
Figura 9. Imagens de MEV para revestimento Co-Mo sobre cobre em diferentes condições de eletrodeposição, sendo (I) o substrato de cobre e os eletrodepósitos (II) tipo A, (III) tipo B, (IV) tipo C, (V) tipo D e (VI) tipo E.
Os revestimentos apresentaram um aspecto brilhante com boa aderência e observa-se, pelo MEV, que em todas as condições de densidade de corrente e pH, os revestimentos mostraram-se homogêneos. Esta homogeneidade está relacionada como a concentração de citrato na solução eletrolítica para a formação de CoCit-. Quando a concentração de citrato é muito menor que a concentração de Co2+ na solução eletrolítica, revestimentos não homogêneos são obtidos [19].
(I) (II) (III)
(VI)
43
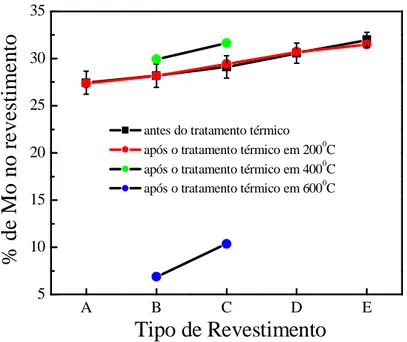
Todos os revestimentos apresentam trincas e a formação de nódulos. Para os obtidos em 60 mA cm-2 e em pH 8 há mais trincas e mais nódulos. Gómez e colaboradores [40] relatam que a porcentagem de Mo influencia a morfologia. As trincas ocorrem devido a uma alta porcentagem de Mo no revestimento sendo que para menos de 20 % de Mo não apresentam trincas de acordo com o trabalho desenvolvido pelos mesmos autores [41, 42].
A análise por EDX mostrou diferença na composição de Mo revestimento. É possível estabelecer um modelo matemático de primeira ordem considerando um valor de probabilidade de 95% de confiança satisfatório (P < 0,05). A influência das variáveis (densidade de corrente e pH da solução eletrolítica) sobre a porcentagem de Mo é mostrada na equação 38.
pH i Mo 13,83 0,033 2
% = + + (38)
O valor para o coeficiente de regressão (R2) para o modelo utilizado foi de 0,9807. Assim, o modelo de regressão prevê uma relação entre as variáveis independentes e a resposta (porcentagem de Mo) de aproximadamente 98%.
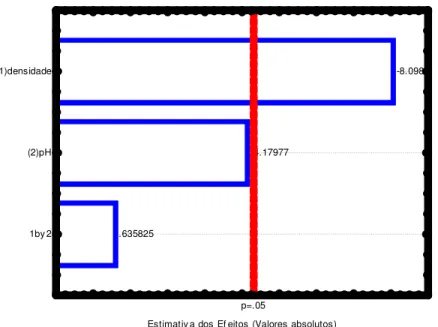
A Figura 10 mostra o gráfico de Pareto, com um nível de confiança de 95 %, para o cálculo dos efeitos lineares principais e o efeito de interação. A magnitude de cada efeito é representada por meio das barras e a linha tracejada corresponde ao valor de P = 0,05, o qual indica o quanto deve ser grande o efeito para que tenha significado estatístico. É possível perceber por meio da equação 38 e da Figura 10 que as variáveis influenciam positivamente nos valores de porcentagem de Mo e que a variável independente pH foi quem mais influenciou na porcentagem de Mo.
44
0.
2.44949
9.797959
p=.05
Estimativ a dos Ef eitos (v alores absolutos) 1by 2
(1)densidade (2)pH
Figura 10. Gráfico de Pareto para os efeitos do planejamento fatorial da liga Co-Mo sobre a porcentagem de molibdênio.
Tabela 4: Resultado da ANOVA para a porcentagem de molibdênio da liga Co-Mo.
Fatores Soma
Quadrática
Grau de Liberdade
Média
Quadrática F P
Densidade de Corrente 1 1 1 6 0,134
pH 16 1 16 96 0,01
Interação 0 1 0 0 1
Erro Residual 0,33 2 0,166
Soma Total 17,33 5
A análise de superfície de resposta (Figura 11) mostra muito bem como cada variável influencia na resposta. Observa-se certo crescimento na porcentagem de Mo com o aumento do pH da solução eletrolítica e da densidade de corrente. De acordo com Goméz e colaboradores [19] e Subramania e colaboradores [44], as espécies de CoCit -são convertidas em HCoCit quando o pH da solução eletrolítica passa de 6,6 para 4,0. A espécie HCoCit é mais susceptível para a redução do cobalto. Quanto mais básica for a solução eletrolítica mais predominante será a espécie CoCit-. O CoCit- é essencial para a formação de MoO2 e do intermediário, [MoO2-CoCit-]ads, como é visto nas equações 14
45
eletrodeposição de Mo é dificultada, assim proporcionando menor porcentagem do mesmo nos revestimentos.
Figura 11. Superfície de resposta da liga Co-Mo para a porcentagem de molibdênio, por energia dispersiva de raios-X, em função da densidade de corrente e do pH da solução eletrolítica.
Nestes mesmos artigos é apresentada certa dependência entre as espécies MoO4-
e o pH. Quanto mais básica for solução eletrolítica mais predominante serão as espécies de molibdato, pois a formação do complexo de HrMoO4Cit[5-r] é facilitada em meio
ácido, pois r aumenta em meio ácido. Novamente, a eletrodeposição do molibdênio se torna difícil, proporcionando menor porcentagem do mesmo na composição do revestimento.
46
V.1.2. Cálculo da Eficiência de Cor r ente Catódica
Examinando a equação 24 pode-se observar, que dentre os cincos tipos de revestimentos, o que pode modificar a eficiência do processo são as frações atômicas de cada elemento no revestimento. As análises por EDX não mostram diferença significativa na composição dos revestimentos, tendo como conseqüência valores próximos de espessura teórica, como é visto na Tabela 5. Porém, quando são analisadas por MEV as espessuras reais de cada revestimento, apresentadas na Figura 12, os valores não são aproximados como os teóricos.
Tabela 5: Relação entre composição, espessura e eficiência dos revestimentos.
Tipos de
revestimentos % Co % Mo
Espessura teórica (µ m)
Espessura real (µ m)
Eficiência (%)
A 73 ±1 27 ±1 41,44 13,11 31,63
B 72 ±1 28 ±1 41,24 8,92 21,63
C 71 ±1 29 ±1 40,98 10,60 25,80
D 69 ±1 31 ±1 40,58 10,80 26,61
E 68 ±1 32 ±1 40,19 7,22 17,65
Tipo A: 13,11 µm Tipo B: 8,52 µm Tipo C: 10,60 µm Tipo D: 10,80 µm Tipo E: 7,22 µm
I II
III IV V
![Figura 3. Curva de polarização esquemática mostrando a extrapolação de Tafel [37].](https://thumb-eu.123doks.com/thumbv2/123dok_br/15327501.555442/31.918.258.754.85.380/figura-curva-de-polarização-esquemática-mostrando-extrapolação-tafel.webp)