UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR
PROGRAMA DE PÓS GRADUAÇÃO EM BIOQUÍMICA
ANA KARLA MOREIRA LOBO
MODULAÇÃO DA FOTOSSÍNTESE POR AÇÚCARES E DEFICIÊNCIA HÍDRICA
EM PLANTAS DE CANA DE AÇÚCAR
FORTALEZA – CE
ANA KARLAMOREIRA LOBO
MODULAÇÃO DA FOTOSSÍNTESE POR AÇÚCARES E DEFICIÊNCIA HÍDRICA
EM PLANTAS DE CANA DE AÇÚCAR
Dissertação apresentada ao Curso de Mestrado em Bioquímica do Departamento de Bioquímica e Biologia Molecular da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Mestre em Bioquímica. Área de Concentração: Bioquímica Vegetal
Orientador: Prof. Dr. Joaquim Albenísio Gomes da Silveira
FORTALEZA – CE
AGRADECIMENTOS
Primeiramente a DEUS pelas oportunidades que tive em minha vida e por estar sempre ao meu lado iluminando e guiando os meus caminhos.
Em especial aos meus pais Ana Cleide e Carlos Augusto pelo carinho, apoio, incentivo e compreensão que foram fundamentais para a realização da conclusão deste curso de mestrado.
Aos meus irmãos Luiz Neto e Evelyn, pela amizade, apoio e convivência.
Aos meus avós (Laura, José, Maria e Luiz), tios e primos que tanto torceram por esta conquista.
Ao João Paulo pelo incentivo, carinho, atenção e por estar sempre ao meu lado. Ao meu orientador professor Joaquim Albenísio pela oportunidade, confiança, ensinamentos científicos e excelente orientação.
Ao meu coorientador Marcio de Oliveira Martins pelos ensinamentos científicos, paciência, colaboração nos experimentos e amizade.
Aos professores Eduardo Machado e Rafael Ribeiro pela colaboração científica nos experimentos.
Aos professores Sérgio Silva e Lucilene Soares pelas sugestões e contribuições oferecidas a este trabalho.
A todos do Labplant (Adilton, Aurenívia, Cínthia, Cristina, Evandro, Fabrício, Jamile, João Victor, Lara, Marcio, Milton, Nega, Rafael, Rachel e Tathiana) pela amizade, convívio, auxílio no laboratório e momentos de descontração.
Aos meus amigos do DBBM (Anna Lídia, Rodolpho e Vanessa) que contribuíram de alguma forma para na minha vida pessoal e profissional, por todo carinho e amizade.
A todos os professores do Departamento de Bioquímica e Biologia Molecular pelos ensinamentos repassados e dúvidas tiradas durante a minha jornada acadêmica.
À Universidade Federal do Ceará por proporcionar a minha capacitação profissional. À CAPES, pela bolsa concedida durante os meus trabalhos e pesquisas científicas. À FAPESP e ao CNPq, pelo financiamento do projeto temático BIOEN (proc. n° 2008/57495F3).
“A persistência é o menor caminho do êxito.”
RESUMO
condições controladas este tratamento gerou aumentos das atividades de NI e SPS enquanto que as atividades de SuSy e SPS em folhas não foram alteradas. A fotossíntese máxima foi diminuída acompanhando os decréscimos de Vpmax e Vpr, que foram associadas com diminuição nas atividades e expressões de PEPcase e Rubisco. Diante dos resultados, concluiF se que sacarose modula negativamente a fotossíntese em canaFdeFaçúcar por exercer uma regulação na expressão e atividade de Rubisco. Esse efeito induz uma redução na taxa de carboxilação de PEPcase provavelmente por um mecanismo indireto via modulação da enzima. Por outro lado, a seca modula negativamente a fotossíntese por mecanismos distintos, afetando as expressões e atividades de PEPcase e Rubisco que refletem em redução nas taxas de carboxilação do PEP. Nas duas situações estudadas não foi possível elucidar o papel das mudanças no metabolismo de açúcares na regulação da fotossíntese. Portanto, o presente estudo não conseguiu elucidar como sacarose e/ou hexoses modificam a expressão e atividade de Rubisco e a seca altera as expressões e atividades de PEPcase e Rubisco.
ABSTRACT
of Vpmax and Vpr that were associated with a decrease in the PEPcase and Rubisco activities and expressions. Considering the results, it is concluded that sucrose negatively modulates photosynthesis of sugarcane per exercise a regulation in the Rubisco expression and activity. This effect leads to a reduction in the rate of carboxylation PEPcase probably by an indirect mechanism via modulation of the enzyme. Moreover, drought negatively modulates photosynthesis by different mechanisms affecting the Rubisco and PEPcase expression and activities reflecting reduction in the rates of carboxylation of PEP. In both cases studied was not possible to elucidate the role of changes in the metabolism of sugars in the regulation of photosynthesis. Therefore, the present study did not elucidate as sucrose and/or hexoses modify the Rubisco expression and activity and drought alters the Rubisco and PEPcase expression and activity.
LISTA DE FIGURAS
CAPÍTULO I
Figura 1 Mecanismos de assimilação de CO2, síntese e remobilização de açúcares em plantas C4. Glic.: glicose; Frut.: frutose; Sac.: sacarose; Pi: fosfato inorgânico; transp.: transportador; P: fosfato; Bip: bisfosfato; Enz.: enzimas; SPS: sintase de sacarose fosfato; SS: sintase da sacarose; SAI, NI, PCAI: invertase ácida solúvel, neutra e de parede, respectivamente. ... 27
Figura 2 Fluxograma da mobilização de sacarose (Suc) e hexoses em diferentes órgãos e compartimentos celulares em milho. Quadrados pretos representam plasmodesmas e círculos pretos translocação membranar. Hex: hexoses (glicose ou frutose); HexFP: hexose fosfato; TP: triose fosfato; INVv, INVc, INVcw: invertase vacuolar, citosólica e de parede, respectivamente; SPS: sintase de sacarose fosfato (KIM et al., 2000) ... 28
Figura 3 Provável controle da atividade metabólica da fonte, como crescimento, respiração e armazenamento, pela demanda de tecidos drenos em plantas. A inibição da fotossíntese por feedback é realizada pela sensibilidade da concentração do intermediário no floema, neste caso o intermediário seria a sacarose (MCCORMICK et al., 2009). Modelo adaptado de Hofmeyer (1998) para espécies que acumulam altos níveis de fotoassimilados, como a canaFdeF açúcar ... 32
CAPÍTULO II
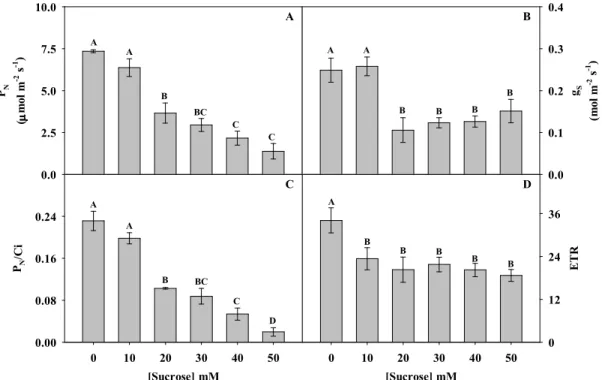
Figure 1 Net photosynthesis (A), stomatal conductance (B) and instantaneous carboxylation efficiency (C) in sugarcane intact plant leaves treated with water (control) or exogenous sucrose 50 mM for five days in a greenhouse. Each point represents average of four replicates (± SD) ... 56
five days in a greenhouse. Each point represents average of four replicates (± SD) ... 57
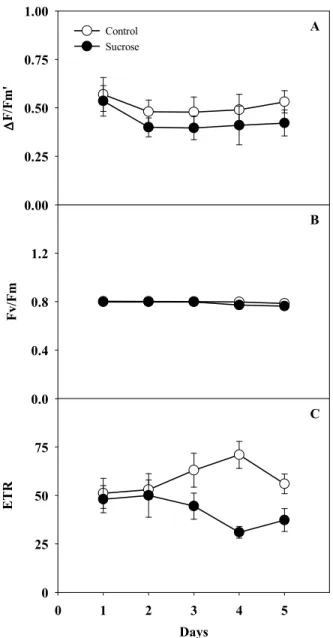
Figure 3 Photochemical quenching (A) and nonFphotochemical quenching (B) in sugarcane intact plant leaves treated with water (control) or exogenous sucrose 50 mM for five days in a greenhouse. Each point represents average of four replicates (± SD) ... 58
Figure 4 Net photosynthesis (A), stomatal conductance (B) instantaneous carboxylation efficiency (C) and rate electron transport (D) in sugarcane leaf segments incubated for 12 hours with increasing exogenous sucrose concentrations. Different letters represent significant difference among treatments by the t test ( <0.05) ... 59 Figure 5 TimeFcourse of net photosynthesis (A) and rate electron transport (B) in
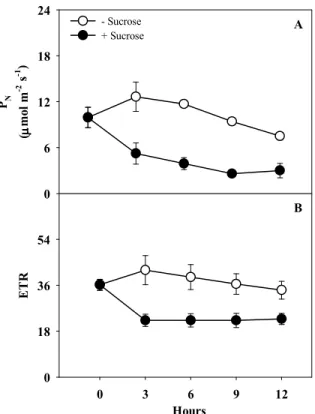
sugarcane leaf segments incubated with water (control) or sucrose 50 mM. Each point represents average of four replicates (± SD) ... 61
Figure 6 TimeFcourse of sucrose (A), glucose (B) and fructose contents (C) in sugarcane leaf segments incubated with water (Fsucrose) or sucrose 50 mM. Each point represents average of four replicates (± SD) ... 62
Figure 7 TimeFcourse of soluble acid (A) and neutral (B) invertases activities in sugarcane leaf segments incubated with water (control) or 50 mM sucrose. Each point represents average of four replicates (± SD) ... 63
Figure 8 Net photosynthesis (A), transpiration (B), stomatal conductance (C) and internal CO2 partial pressure (D) in sugarcane intact plant leaves treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 64
with water (control) or 50 mM of exogenous sucrose, glucose and fructose for five days. Each point represents average of four replicates (± SD) ... 65
Figure 10 Rubisco activity and activation state (A), rubisco relative amount and western blotting gel (B) in sugarcane leaves treated with water (control) and exogenous sucrose 50 mM in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 69
Figure 11 PEPcase activity (A) and PEPcase relative amount and western blotting gel (B) in sugarcane leaves treated with water (control) and exogenous sucrose 50 mM in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 70
CAPÍTULO III
Figura 1 Fotossíntese líquida (A), transpiração (B), condutância estomática (C) e eficiência instantânea de carboxilação (D) em folhas de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições de casa de vegetação. Cada ponto representa a média de quatro repetições (± DP) ... 88
Figura 2 Eficiência quântica efetiva do fotossistema II (A), eficiência quântica potencial do fotossistema II (B) e taxa de transporte de elétrons (C) em folhas de canaF deFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições de casa de vegetação. Cada ponto representa a média de quatro repetições (± DP) ... 89 Figura 3 Quenching fotoquímico (A) e quenching não fotoquímico (B) em folhas de
canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições de casa de vegetação. Cada ponto representa a média de quatro repetições (± DP) ... 90
cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 91
Figura 5 Curvas de assimilação de CO2 em respostas a pressão parcial intercelular (A) e curva de assimilação de CO2 em resposta ao aumento da densidade do fluxo de fótons fotossintéticos (B) em folhas de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Cada ponto representa a média de quatro repetições (± DP) ... 93
Figura 6 Atividade e estado de ativação da Rubisco (A) e quantidade relativa e western blotting de Rubisco (B) em folhas de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 97
LISTA DE TABELAS
CAPÍTULO II
Table 1 Content of sucrose, glucose, fructose and starch and activities of soluble acid invertases (SAI), neutral invertases (NI), sucrose synthase (SuSy) and sucrose phosphate synthase (SPS) in sugarcane leaf segments incubated for 12 hours with water (Fsucrose) or sucrose 50 mM. Different letters represent significant difference among treatments by the t test ( <0.05) ... 60
Table 2 Effective quantum efficiency of photosystem II (∆F/Fm’), potential quantum efficiency of photosystem II (Fv/Fm), electron transport rate (ETR), photochemical quenching (qP) and nonFphotochemical quenching (NPQ) in sugarcane intact plant leaves treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 64
Table 3 Parameters associated with photosynthetic efficiency calculated from the PN/PPFD and PN/Ci fitting curves in sugarcane leaves treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in a growth chamber for five days. PNmax is the maximum CO2 assimilation rate, RN is dark respiration, Vpmax is maximum velocity of PEPcase and Vpr is maximum rate of regeneration of PEP. Different letters represent significant difference among treatments by the t test ( <0.05) ... 66
Table 4 Sucrose content in leaf, sheath and stalk of sugarcane treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in sugarcane intact plant leaves in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 66
Table 6 Fructose content in leaf, sheath and stalk of sugarcane treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in leaves in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 67
Table 7 Starch content in leaf, sheath and stalk of sugarcane treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in leaves in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 67
Table 8 Sucrose/hexose ratios in leaf, sheath and stalk of sugarcane treated with water (control) or 50 mM of exogenous sucrose, glucose and fructose in leaves in a growth chamber for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 68
Table 9 Activities of soluble acid invertases (SAI), neutral invertases (NI), sucrose synthase (SuSy) and sucrose phosphate synthase (SPS) in leaf, sheath and stalk of sugarcane treated with water (control) or exogenous sucrose 50 mM in leaves for five days. Different letters represent significant difference among treatments by the t test ( <0.05) ... 68
CAPÍTULO III
Tabela 1 Conteúdo relativo de água (CRA) e vazamento de eletrólitos em folhas de canaF deFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições de casa de vegetação. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 90
Tabela 3 Eficiência quântica efetiva do fotossistema II (∆F/Fm’), eficiência quântica potencial do fotossistema II (Fv/Fm), taxa de transporte de elétrons (ETR), quenching fotoquímico (qP) e quenching não fotoquímico (NPQ) em folhas de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 92
Tabela 4 Conteúdo relativo de água (CRA) e vazamento de eletrólitos em folhas de canaF deFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 92
Tabela 5 Parâmetros associados com a eficiência fotossintética calculados a partir das curvas PN/PPFD e PN/Ci em folhas de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. α: eficiência quântica estimada; PNmax: taxa máxima de assimilação de CO2; RN: respiração no escuro; Vpmax: velocidade máxima da PEPcase; Vpr: taxa máxima de regeneração do PEP.Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 93
Tabela 6 Concentração de sacarose em folhas, bainha e colmo de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 94
Tabela 7 Concentração de glicose em folhas, bainha e colmo de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 94
em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 94
Tabela 9 Concentração de amido em folhas, bainha e colmo de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 95
Tabela 10 Relação sacarose/hexose em folhas, bainha e colmo de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 95
Tabela 11 Atividade de invertase ácida solúvel (SAI) e invertase neutra (NI) em folhas, bainha e colmo de canaFdeFaçúcar irrigadas diariamente (controle) ou submetidas à suspensão de rega (seca) por cinco dias em condições ambientais controladas. Letras diferentes representam diferenças significativas entre os tratamentos pelo teste t ( <0.05) ... 96
SUMÁRIO
INTRODUÇÃO ... 19
CAPÍTULO I ... 21
1 REVISÃO DE LITERATURA ... 22
1.1 Importância da canaFdeFaçúcar ... 22
1.2 A fotossíntese nas plantas C4 ... 23
1.3 Modulação da fotossíntese por açúcares ... 25
1.4 Fotossíntese e metabolismo de açúcares em canaFdeFaçúcar ... 31
1.5 Modulação da fotossíntese por deficiência hídrica em plantas C4 ... 33
2 REFERÊNCIAS ... 37
CAPÍTULO II ... 47
EXOGENOUS SUCROSE ALTERS SUGAR METABOLISM, REGULATES PHOTOSYNTHESIS BY INHIBITION OF RUBISCO ACTIVITY AND EXPRESSION AND PEP CARBOXYLATION IN SUGARCANE ... 48
ABSTRACT ... 48
INTRODUCTION ... 49
MATERIAL AND METHODS ... 50
RESULTS ... 55
DISCUSSION ... 70
REFERENCES ... 72
CAPÍTULO III ... 77
A SECA MODULA A ATIVIDADE FOTOSSINTÉTICA PELA INIBIÇÃO DA ATIVIDADE E EXPRESSÃO DE PEPCASE E RUBISCO EM PLANTAS DE CANAF DEFAÇÚCAR ... 78
RESUMO ... 78
ABSTRACT ... 79
INTRODUÇÃO ... 79
MATERIAL E MÉTODOS ... 81
RESULTADOS ... 87
DISCUSSÃO ... 98
INTRODUÇÃO
A canaFdeFaçúcar representa grande importância mundialmente por ser capaz de armazenar grandes quantidades de sacarose nos internódios do colmo. A sacarose é a fonte primária de açúcar no mundo e, atualmente, sua produção tem sido bastante valorizada por ser matéria prima para a produção de etanol. O etanol representa uma fonte de energia renovável que promove benefícios ambientais e econômicos, pois dispensa a queima de combustíveis fósseis (PAPINIFTERZI et al., 2009). Por ser, a canaFdeF açúcar, responsável pela produção de mais de 70% da sacarose no mundo (LAKSHMANAN et al., 2005), muitas indústrias têm incentivado pesquisas para melhorar o entendimento dos mecanismos de armazenamento de sacarose nos colmos dessa espécie, a fim de aumentar seu potencial produtivo (BRUMBLEY et al., 2008; SNYMAN et al., 2008). Nesta cultura a produção de açúcar é limitada em plantas adultas por regulações inibitórias das taxas fotossintéticas nas folhas promovidas pela demanda do dreno (MCCORMICK et al., 2006).
As plantas de canaFdeFaçúcar possuem um sistema fonte/dreno complexo que são intimamente coordenados. Geralmente a atividade fotossintética nas folhas decresce quando a demanda do dreno por carboidratos é limitada (FRANCK et al., 2006), nesta fase o nível de açúcar no floema e na folha aumentam. Estudos com plantas C3 indicam que o controle metabólico da atividade fotossintética na fonte pela demanda do dreno é promovido por sinalizações de feedback mediada por açúcares, que geralmente estão correlacionados com o aumento de sacarose e/ou suas hexoses constituintes (ABDIN et al., 1998; ROLLAND et al., 2002). Estudos recentes envolvendo canaFdeFaçúcar indicaram que a atividade fotossintética e a concentração de sacarose e hexose na folha parecem estar intimamente ligadas com a taxa de exportação de sacarose (MCCORMICK et al., 2006). O envolvimento de vários sistemas de sinalização por açúcares tem sido revelado em muitas espécies de plantas (PAUL; PELLNY, 2003; ROLLAND et al., 2006; PAUL, 2007). Porém, apesar de extensas pesquisas a dinâmica e a interação entre os processos de inibição da fotossíntese por açúcares não estão bem caracterizados e estão apenas começando a serem explorados (WATT et al., 2005; CASU et al., 2007).
fotossintéticas por limitações estomáticas ou bioquímicas. Diminuições no conteúdo relativo de água foliar, decréscimos das taxas transpiratórias, da condutância estomática, da taxa de transporte de elétrons e aumento da concentração interna de CO2 são algumas alterações promovidas pela seca, que modulam negativamente a assimilação do CO2 e, consequentemente, inibem o crescimento do vegetal (CHAVES et al., 2003).
1 REVISÃO DE LITERATURA
1.1 Importância da cana de açúcar
A canaFdeFaçúcar possui grande importância na economia de vários países tropicais e subtropicais (INMANFBAMBER et al., 2005). É uma gramínea perene de origem asiática que possui metabolismo fotossintético do tipo C4, podendo alcançar uma taxa fotossintética de 63 µmol CO2 mF2 sF1 e produzir cerca de 40 g de fitomassa por mF2 de área cultivada (MOORE; MARETZKI, 1996). Sua melhor adaptação nos trópicos deveFse ao seu metabolismo fotossintético, que em condições estressantes que acentuam a fotorrespiração (como altas temperaturas) são menos prejudicadas por apresentar mecanismos de concentração de CO2 do tipo C4 (LONG et al., 2006). Este mecanismo envolve a concentração do CO2 assimilado nas células da bainha vascular, na qual se encontra o sítio de atuação da ribulose 1,5 bisfostato carboxilase/oxigenase (Rubisco), promovendo diminuição das taxas fotorrespiratórias (SAGE, 2004).
A sacarose é o principal produto da fotossíntese (ROLLAND et al., 2006), sendo sintetizada no citosol das células do mesófilo de tecidos foliares (fonte) e transportada para tecidos drenos pelo floema ou de célula a célula pelos plasmodesmas (RAE et al., 2005). Em plantas de canaFdeFaçúcar, a maior parte do carbono produzido é armazenada nos vacúolos centrais das células parenquimáticas do entrenó localizado no colmo, na forma de sacarose e não de amido como na maioria das outras espécies (MOORE; MARETZKI, 1996). A sacarose é o principal produto de interesse da canaFdeFaçúcar e seu armazenamento depende do estádio de desenvolvimento, das condições de crescimento e de fatores genotípicos (INMANF BAMBER et al., 2008).
A canaFdeFaçúcar, no Brasil, representa uma das principais culturas cultivadas, sendo o agronegócio sucroFalcooleiro responsável por 2,4% do PIB nacional. Além disso, este setor promove 3,6 milhões de empregos diretos ou indiretos, congrega mais de 72.000 agricultores e 334 usinas (DIEESE, 2007). O Brasil é o maior produtor mundial de açúcar, obtendo 24 milhões de toneladas anoF1, das quais cerca de 60% são exportadas (ALBINO et al., 2006).
etanol brasileiro, produzido de canaFdeFaçúcar, reduz cerca de 80% a emissão de gases do efeito estufa em substituição à gasolina (UNICA, 2012). A produção de etanol no Brasil é uma das maiores do mundo devido a sua grande utilização como combustível renovável em automóveis. Por suas vantagens ambientais, sociais e econômicas diversos países têm demonstrado interesse crescente na tecnologia brasileira (ALBINO et al., 2006).
Pela importância econômica e ambiental que a canaFdeFaçúcar representa para vários países, muitas pesquisas e técnicas de melhoramento têm sido utilizadas para aumentar o potencial produtivo desta cultura. Apesar dos cultivares modernos de canaFdeFaçúcar (híbridos interespecíficos) acumularem mais de 20% da sua massa de matéria fresca na forma de sacarose no colmo (SALES, 2011) em relação a espécies selvagens (MOORE, 2005), o conteúdo de sacarose não tem aumentado significativamente por varias décadas (JACKSON, 2005). Diversas pesquisas comprovaram que os açúcares não apresentam apenas substrato energético para sustentar o crescimento de tecidos drenos, mas também são importantes sinalizadores que regulam o metabolismo entre fonte e dreno (PAUL; FOYER, 2001; PAUL; PELLNY, 2003).
Alguns autores afirmam que o acúmulo de altas concentrações de sacarose em canaFdeFaçúcar é regulado principalmente pela demanda de fotoassimilados no colmo, onde ocorre um equilíbrio entre as reações de síntese e degradação de sacarose (WHITTAKER; BOTHA, 1997). A atividade fotossintética nas folhas está intimamente relacionada com a maturidade do colmo, geralmente em plantas jovens a taxa fotossintética é significante maior do que em plantas velhas (ALLISON et al., 1997). Então, o entendimento dos mecanismos que governam a regulação feedback entre fonteFdreno são essenciais para a manipulação do conteúdo de sacarose no colmo (MCCORMICK et al., 2008a).
Apesar da realização de várias pesquisas, a dinâmica e a interação entre os processos de regulação fonteFdreno não estão bem caracterizados e apenas estão começando a serem explorados (WATT et al., 2005; CASU et al., 2007).
1.2 A fotossíntese nas plantas C4
de reações envolvendo o transporte de elétrons no centro de reação, resultando na oxidação de H2O, redução do NADP+ e formação de ATP. Na fase bioquímica ocorre a assimilação do CO2, onde o NADPH e o ATP formados nas reações fotoquímicas serão utilizados para gerar trioses fosfatos (HELDT, 2005). As reações fotossintéticas de assimilação do CO2 nas plantas são divididas em três grupos: o metabolismo C3, C4 e CAM (ácido das crassuláceas). O metabolismo fotossintético C4 e CAM são evoluções do ciclo C3, no qual o CO2 é assimilado pela Rubisco nas células do mesófilo (SAGE, 2004).
As plantas que apresentam fotossíntese do tipo C4 possuem mecanismos de concentração do CO2 nas folhas, os quais consistem de uma série de modificações bioquímicas e estruturais em relação à via fotossintética, ancestral, do tipo C3 (VON CAEMMERER; FURBANK, 2003). Nas folhas de plantas C4, os cloroplastos estão presentes em dois tipos de células: mesófilo e bainha vascular, denominada anatomia de Kranz (SAGE, 2004). As células da bainha e do mesófilo são separadas por uma parede celular, que em alguns casos possuem suberina que impede o vazamento de gás. Estas células são conectadas por plasmodesmas, que permitem o fluxo de metabólitos (HELDT, 2005).
O mecanismo fotossintético destas plantas consiste, primeiramente, na hidratação da molécula de CO2, gerando HCO3
F
no mesófilo, que pela ação da PEPcase (fosfoenolpiruvato carboxilase) é incorporado ao PEP (fosfoenolpiruvato) para produzir oxalacetato (GHANNOUM, 2009). O oxalacetato é, posteriormente, convertido em um ácido com quatro carbonos (malato ou aspartato) que é transportado para bainha vascular pelo plasmodesma, onde será descarboxilado liberando CO2, que entra no ciclo de Calvin (ciclo C3), e um composto com três carbonos (piruvato ou alanina) (VON CAEMMERER; FURBANK, 2003). O composto de três carbonos retorna para o mesófilo para ser convertido em PEP e completar o ciclo C4 (LONG et al., 2006).
O mecanismo de concentração de CO2 no ciclo C4 apresenta duas principais vantagens em relação ao ciclo C3: a presença da PEPcase, que tem grande afinidade pelo HCO3F e é insensível ao O2, e de barreiras nas células da bainha vascular que dificultam a difusão gasosa (VON CAEMMERER, 2003). Consequentemente, a alta concentração de CO2 nas células da bainha suprime a fotorrespiração, que ocorre mais frequentemente em plantas C3, que apresentam baixa concentração de CO2 próximo a Rubisco (GHANNOUM, 2009).
A Rubisco possui baixa afinidade pelo CO2 e baixa discriminação entre O2 e CO2 (PARRY et al., 2008). O oxigênio molecular está presente em maior quantidade no ambiente em relação ao dióxido de carbono e também é gerado na célula pelas reações luminosas da fotossíntese, sendo então, facilmente assimilado pela Rubisco (GHANNOUM, 2009). A fotorrespiração nas plantas é considerada um ciclo fútil, pois ocorre gasto energético e liberação do CO2 previamente fixado (PARRY et al., 2008). O ciclo fotossintético C4 concentra cerca de 10 vezes mais CO2 próximo a Rubisco em relação ao ambiente (VON CAEMMERER, 2003). Por isso, as plantas C4 são responsáveis por cerca de 20% da produtividade primária global, apesar de representarem apenas 4% da flora mundial (EHLERINGER et al., 1997; . HELDT, 2005).
As folhas das plantas C4 são altamente vascularizadas e possuem baixa relação mesófilo/bainha vascular para facilitar a difusão dos metabólitos C4 e minimizar o vazamento do CO2 da bainha vascular (SAGE; MCKOWN, 2006). Uma falha na coordenação estrutural entre mesofilo e bainha vascular reduz a capacidade fotossintética da planta (LEEGOOD; WALKER, 1999). Por exemplo, se o ciclo C4 for mais rápido do que o C3, o CO2 na bainha vascular poderá ser liberado para fora da célula, do contrário, se o ciclo C4 for mais lento que o C3, a taxa fotorrespiratória pode aumentar, gerando um ciclo fotossintético fútil (SAGE; MCKOWN, 2006).
1.3 Modulação da fotossíntese por açúcares
O dreno, aparentemente, regula as taxas fotossintéticas nas folhas através de mecanismos de feedback por meio de açúcares, tendo em vista que o acúmulo de carboidratos nas folhas diminuiu a assimilação de CO2 em várias espécies (FRANCK et al., 2006; ARAYA et al., 2006; MCCORMICK et al., 2008a). O particionamento de carboidratos entre a fonte e os diferentes tecidos dreno é um processo dinâmico que é influenciado pelo estádio de desenvolvimento do vegetal e pelo ambiente (KOCAL et al., 2008).
Este mecanismo regulatório, da fotossíntese por carboidratos, ainda não está bem entendido, embora vários níveis de regulação pareçam estar envolvidos (IGLESIAS et al., 2002). Alguns estudos demonstraram que açúcares alteram os níveis de nitrogênio (N) e fosfato inorgânico (Pi) nos cloroplastos, e estes influenciam as taxas fotossintéticas (PAUL; DRISCOLL 1997; HARMENS et al., 2000). O acúmulo de carboidratos nas folhas também foram correlacionados com a inibição de alguns genes relacionados à fotossíntese (PEGO et al., 2000; MCCORMICK et al., 2008b), principalmente os envolvidos com as enzimas do ciclo de Calvin (PAUL; PELLNY, 2003). Alguns autores supõem que este mecanismo regulatório envolva processos de sinalização promovidos pelo aumento da atividade de invertases (BARRATT et al., 2009; RUAN et al., 2009)e hexoquinase (JANG et al., 1997).
Figura 1 – Mecanismos de assimilação de CO2, síntese e remobilização de açúcares em plantas C4. Glic.: glicose; Frut.: frutose; Sac.: sacarose; Pi: fosfato inorgânico; transp.: transportador; P: fosfato; BiP: bisfosfato; 3F PGA: 3Ffosfoglicerato, Enz.: enzimas; SPS: sintase de sacarose fosfato; SS: sintase da sacarose; SAI, NI, PCAI: invertase ácida solúvel, neutra e de parede, respectivamente.
A regulação da fotossíntese por Pi foi observada em plantas mantidas em condições de baixa temperatura, a qual promoveu um decréscimo da síntese de sacarose e de Pi livre no cloroplasto (STRAND et al., 1999). Hurry et al. (1993) demonstraram que a fotossíntese pode ser recuperada pela administração de Pi nas folhas. Embora se reconheça que os mecanismos de sinalização por açúcares existam, os detalhes destes mecanismos ainda são superficiais (PAUL; PELLNY, 2003).
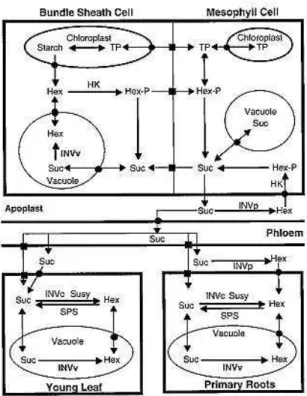
A sacarose é um açúcar não redutor e é usualmente transportada para todos os órgãos não fotossintetizantes da planta, podendo ser conduzida via simplasto, apoplasto ou pelo floema (WARD et al., 1997). No apoplasto este açúcar pode sofrer ação da invertase ácida de parede gerando glicose e frutose. Estas hexoses podem ser acumuladas no apoplasto e aumentar o potencial osmótico, ou entrarem no mesófilo, onde serão fosforiladas para nova síntese de sacarose, resultando em um ciclo fútil (KIM et al., 2000) (Figura 2). A inibição da síntese de sacarose ou o ciclo fútil promovido pelas invertases promovem um aumento de
CO2 CO2 HCO3-
Anidrase carbônica
PEP Oxaloacetato
PEPcase Pi
Malato
Malato desidrogenase
NADPH + H+
NADP+ Malato CO2 Piruvato Piruvato Enz. Málica Piruv. P. diquinase ATP + Pi
AMP + PPi
3-P glicerato Ribulose 1,5-BiP Ciclo de calvin Rubisco Triose P Frut. 6-P
Glic. 6-P Glic. 1-P ADP-Glic. Amido ADP-Glic pirofosforilase Amido sintase Glic. Amilase Amido fosforilase
Transp. de glic
Transp. Triose/Pi Triose P Pi Frut. 1,6-Bisfosfato Frut. 6-P
+ 3-PGA - Pi
Frutose 1,6- Bisfosfatase Sacarose 6-P Sacarose Glic 6-P UDP-Glic SPS Sacarose fosfato fosfatase Pi Mesófilo Bainha vascular Cloroplasto Vacúolo
Sacarose Sac.
Glic. + Frut.
trioseFP no citosol, diminuição do antiporte trioseFP/Pi e de Pi livre no cloroplasto, comprometendo a fotossíntese (PAUL; FOYER, 2001; PAUL; PELLNY, 2003).
Figura 2 – Fluxograma da mobilização de sacarose (Suc) e hexoses em diferentes órgãos e compartimentos celulares em milho. Quadrados pretos representam plasmodesmas e círculos pretos translocação membranar. Hex: hexoses (glicose ou frutose); HexFP: hexose fosfato; TP: triose fosfato; INVv, INVc, INVcw: invertase vacuolar, citosólica e de parede, respectivamente; SPS: sintase de sacarose fosfato (KIM et al., 2000).
Os processos regulatórios da assimilação do carbono pela hexoquinase têm sido propostos por alguns autores, pois acreditamFse que os processos de fosforilação de hexoses mediado por esta enzima envolvam processos de sinalização (SMEEKENS, 2000; MOORE et al., 2003). Entretanto, Dai et al., (1999) demonstraram que o aumento da expressão de hexoquinase reduziu a concentração de amido e hexoses, mas não estimulou a fotossíntese. O aumento da expressão desta enzima esta relacionado também com a aceleração dos processos de senescência (QUIRINO et al., 2000). A hexoquinase parece está envolvida com a sinalização por açúcares (SMEEKENS, 2000), entretanto os mecanismos envolvidos permanecem incertos (SMEEKENS, 1998; MCCORMICK et al., 2006).
carboidratos também é relacionado com a diminuição da quantidade de Rubisco (PAUL; DRISCOLL, 1997; ARAYA et al., 2006). Os efeitos da combinação entre glicose e nitrogênio têm sido recentemente estudados, mas já é conhecido que o estado de ativação da nitrato redutase (NR) está associada com a atividade fotossintética e disponibilidade de açúcares. (PRICE et al., 2004).
A modulação da expressão gênica pela acumulação de açúcares nas folhas envolve principalmente o decréscimo dos transcritos da subunidade menor da Rubisco ( ) (MOORE et al., 1998). Alguns trabalhos presentes na literatura utilizando espécies C3 demonstraram que o acúmulo de açúcares nas folhas decresceu o conteúdo de clorofila, expressão e atividade da Rubisco e todas as taxas fotossintéticas (IGLESIAS et a., 2002; FURBANK et al., 1997). McCormick et al. (2008b) mostraram que o aumento da concentração de carboidratos nas folhas modularam negativamente todos os genes associados com as reações fotossintéticas. As modulações negativas na quantidade de transcritos da rbcS e da Rubisco nem sempre são correlacionadas com o aumento de açúcares (MOORE et al., 1999), tendo em vista que a ciclagem das hexoses são sinalizadores mais importante do que a quantidade de açúcares (PAUL; PELLNY, 2003).
De acordo com Moore et al. (1998), a Rubisco é regulada negativamente por processos de sinalização desencadeado pela hexoquinase ativada na renovação de sacarose e amido e que a indução da invertase ácida de parede reprime os genes fotossintéticos em várias espécies. Apesar do acúmulo de açúcares apresentar vários pontos de regulação da Rubisco, os mecanismos envolvidos nestas respostas ainda são desconhecidos (KRAPP; STITT, 1995).
McCormick et al. (2008a) demonstraram que o aumento da concentração de sacarose e hexose na folha decresceram a assimilação de CO2 e a taxa de transporte de elétrons em canaFdeFaçúcar. Foi observado também uma correlação negativa entre a concentração de hexoses na folha e taxas fotossintéticas, indicando que as hexoses desempenham uma importante função na regulação da demanda de carbono pelo dreno (MCCORMICK et al., 2006). Embora seja provável que a concentração de hexoses na folha desempenha um controle metabólico, a elucidação destes mecanismos tem sido bastante difícil, pois elas podem exercer mudanças no potencial osmótico e atuarem como sinalizadores na célula (GIBSON, 2005). Além disso, como são moléculas que participam constantemente da síntese de sacarose, é difícil atribuir os efeitos diretos das hexoses. Entretanto, alguns autores afirmam que a sacarose e a trealose (trealose 6Ffosfato) são responsáveis por respostas específicas da regulação fotossintética em plantas (ROLLAND et al., 2006).
Com relação à trealose 6Ffosfato (T6P), geralmente o aumento deste açúcar está correlacionado com o aumento das taxas fotossintéticas (PAUL; PELLNY, 2003). Paul et al. (2001) demonstraram que plantas de tabaco “superexpressando” sintase de trealose fosfato (TPS) exibiram um aumento das taxas fotossintéticas, enquanto que as plantas “superexpressando” a trealose fosfato fosfatase (TPP) apresentaram decréscimo das taxas fotossintéticas, indicando que a T6P desempenha um controle na assimilação do carbono e é um componente chave na detecção da sinalização por açúcares (PAUL, 2007). Já para o amido, tem sido proposto que grandes acúmulos de grãos de amido podem gerar deformações no cloroplasto e dificultar a difusão do CO2 (IGLESIAS et al., 2002), porém já se conhece que o amido é um açúcar inerte e não parece está envolvido com os mecanismos de sinalização que inibem a assimilação de carbono nas plantas (IGLESIAS et al., 2002).
Em geral as atividades que ocorrem em folhas fontes, como reações fotossintéticas, mobilização de nutrientes e exportação de fotoassimilados, são estimuladas em condições de baixa concentração de açúcar, enquanto que a atividade do dreno, como crescimento e armazenamento de metabolitos, é estimulada quando as fontes de carbono são abundantemente disponíveis. A atividade fotossintética e a demanda do dreno precisam ser estritamente coordenadas, e essa coordenação envolve tanto regulação metabólica (alostérica) quanto mecanismos específicos de sinalização por açúcares (ROLLAND et al., 2006). O metabolismo de açúcares é um processo muito dinâmico, no qual o fluxo metabólico e a concentração de açúcares mudam constantemente, durante o desenvolvimento do vegetal e em resposta as variações ambientais, que são alteradas sob condições normais ou estressantes (BLÄSING et al., 2005; SMITH et al., 2005).
1.4 Fotossíntese e metabolismo de açúcares em cana de açúcar
A canaFdeFaçúcar possui importância mundialmente por ser capaz de armazenar altas concentrações de sacarose nos entrenós do colmo, cerca de 650 mM (WELBAUM; MEINZER, 1990). Esta cultura possui um sistema fonte/dreno complexo que regula ativamente as taxas fotossintéticas e o entendimento deste mecanismo regulatório é essencial para aumentar o potencial produtivo desta cultura (MCCORMICK et al., 2009).
A sacarose no colmo é completamente compartimentalizada nos vacúolos das células parenquimáticas para favorecer o fluxo de sacarose das folhas para o dreno pelo floema. O particionamento de açúcares em tecidos, células e compartimentos subcelulares determina um ponto de controle nas vias de transporte (RAE et al., 2005). O acúmulo de sacarose no colmo promove uma forte demanda por fotoassimilados (MARCELIS, 1996) e a força do dreno regula ativamente as taxas fotossintéticas (MCCORMICK et al., 2006), tendo em vista que a demanda por fotoassimilados é modificada pelo estágio de desenvolvimento da planta. A regulação da fotossíntese pela força do dreno pode ser visualizada em plantas com idades diferentes, onde plantas jovens com colmos em desenvolvimento apresentam taxas fotossintéticas maiores do que plantas adultas com colmos maduros (ALLISON et al., 1997). Whittaker e Botha (1997) afirmaram que as diferenças na acumulação de sacarose entre colmos novos e velhos são consequências das variações do ciclo da sacarose entre vacúolo, citosol e apoplasto.
pelo consumo de intermediários nos drenos para prevenir a falta ou o acúmulo de metabólitos (HOFMEYR, 1998; HOFMEYR; CORNISHFBOWDEN, 2000). No controle metabólico teórico proposto por estes autores, mostra que o controle do fluxo metabólico não é regulado apenas pela demanda, mas também pela sensibilidade da demanda do dreno. Em plantas de canaFdeFaçúcar, mudanças na atividade do dreno podem promover ajustes nas taxas de carregamento pelo floema (LALONDE et al., 2003) e isto pode promover modificações no pool de sacarose na folha ocasionando sinalização por feedback que irão inibir as taxas fotossintéticas (MCCORMICK et al., 2009) (Figura 3).
Figura 3 – Provável controle da atividade metabólica da fonte, como crescimento, respiração e armazenamento, pela demanda de tecidos drenos em plantas. A inibição da fotossíntese por feedback é realizada pela sensibilidade da concentração do intermediário no floema, neste caso o intermediário seria a sacarose (MCCORMICK et al., 2009). Modelo adaptado de Hofmeyer (1998) para espécies que acumulam altos níveis de fotoassimilados, como a canaFdeFaçúcar.
Algumas pesquisas têm focado nos processos específicos do colmo (CASU et al ., 2003; WALSH et al ., 2005), mas os processos envolvidos na integração fonte/dreno ainda não estão totalmente entendidos (KOCH et al ., 2000). Estudos com plantas C3 indicaram que a regulação da atividade fotossintética por açúcares envolve um mecanismo de sinalização mediado pela concentração de sacarose e/ou suas hexoses constituintes presentes nas folhas (ABDIN et al., 1998; ROLLAND et al., 2002; GIBSON, 2005, FRANCK et al., 2006). Grof e Campbell (2001) afirmaram que para entender os mecanismos envolvidos na regulação fonte/dreno e poder aumentar os níveis de sacarose no colmo é necessário o entendimento dos processos de acumulação de sacarose, como a produção de carboidratos nas folhas (taxas fotossintéticas, enzimas envolvidas na síntese de sacarose e particionamento de carbono dentro da folha), taxa de carregamento e de transporte pelo floema até o colmo; transporte de sacarose para ser estocado nos vacúolos dos tecidos parenquimáticos do colmo e taxa de remobilização de sacarose para o crescimento vegetativo.
cultivares e em diferentes condições ambientais ainda não são conhecidos (INMANF BAMBER, 2009). O entendimento dos mecanismos que governam a regulação por feedback entre fonte e dreno são essenciais para que se consiga manipular o conteúdo de sacarose no colmo e plantas de canaFdeFaçúcar (MCCORMICK et al., 2008a). Estes mecanismos são complexos e provavelmente envolvem a integração de numerosas sinalizações envolvidas com o metabolismo do carbono e do nitrogênio (PAUL; PELLNY, 2003).
1.5 Modulação da fotossíntese por deficiência hídrica em plantas C4
A deficiência hídrica é um dos fatores ambientais que mais limita a produtividade das plantas em todo o mundo, podendo ser causada tanto por falta de água quanto no solo quanto na atmosfera (GHANNOUM, 2009). Pesquisas envolvendo respostas de plantas submetidas ao estresse hídrico têm sido cada vez mais frequentes, tendo em vista que várias regiões no mundo estão se tornando áridas e o entendimento dos mecanismos relacionados com a tolerância à seca é essencial para o cultivo das culturas (PETIT et al., 1999).
A percepção do déficit hídrico pelas plantas ocorre em três fases, onde a primeira fase se caracteriza pela diminuição da disponibilidade de água no solo sem a diminuição das taxas transpiratórias, na segunda fase ocorre diminuição da transpiração e condutância estomática e na terceira os estômatos estão quase que totalmente fechados, ocorrendo perda de água apenas via cutícula (PIMENTEL, 2004). Nas fases moderada e severa do estresse (segunda e terceira fase) também é possível observar um aumento da relação raiz/parte aérea, redução da fotossíntese e assimilação de nitrogênio e aumento de solutos compatíveis, como carboidratos solúveis e prolina (PIMENTEL, 2004).
inicial a redução da gS promove efeitos protetores contra a desidratação por manter o status hídrico e aumentar a eficiência do uso da água pelas plantas (CHAVES et al., 2008).
As limitações das taxas fotossintéticas nas plantas sob seca são controvérsias, alguns autores afirmam que são devidos aos fatores estomáticos (CORNIC, 2000; CHAVES et al., 2002), pois a diminuição da gS acarreta em menor difusão do CO2 para os tecidos foliares e limita a atividade da Rubisco. Já outros autores afirmam que fatores não estomáticos são mais importantes (LAWLOR, 2002), como diminuição de transporte de elétrons, síntese de ATP e da regeneração da ribuloseF1,5Fbisfosfato (RuBP) (FLEXAS; MEDRANO, 2002). Também são aceitas as limitações causadas pelos dois fatores, estomáticos e não estomáticos (LAWLOR; CORNIC, 2002). As respostas fotossintéticas em plantas C3 submetidas ao déficit hídrico são abundantes na literatura (CORNIC; FRESNEAU, 2002; LAWLOR, 2002, FLEXAS et al., 2004), porém os estudos com plantas C4, principalmente envolvendo as respostas bioquímicas, são escassos (DU et al., 1996; GHANNOUM, 2009).
Em geral, a fotossíntese de plantas C3 é negativamente afetada pelo estresse hídrico que promove mudanças no Ψw e CRA da folha. Na fase inicial do estresse, quando o CRA é maior que 70%, ocorre diminuição da assimilação de CO2 que é acompanhado com a diminuição da concentração interna de CO2 (Ci) devido ao decréscimo na gS. Sob essas condições a capacidade fotossintética máxima e o rendimento quântico do fotossistema (PS) II são inalterados quando as plantas são submetidas a concentrações saturantes de CO2 e luz (GHANNOUM, 2009). Além disso, nestas condições as plantas são capazes de recuperarem rapidamente as taxas fotossintéticas quando reidratadas. Quando o CRA fica abaixo de 70%, nos estágios mais avançados do estresse, o decréscimo da fotossíntese é acompanhado pelo aumento de Ci e não se recupera com a retirada do estresse. O entendimento dos efeitos não estomáticos, também conhecido como inibição metabólica ou bioquímica são diversos e pouco entendidos (GHANNOUM, 2009).
(BAKER; ROSENQVIST, 2004) e mecanismos enzimáticos de proteção oxidativa (CHAVES et al., 2003).
Apesar dos mecanismos de assimilação de CO2 em plantas C4 serem diferentes de plantas C3, suas respostas ao déficit hídrico são similares, com redução da gS e das taxas fotossintéticas (MAROCO et al., 2000; GHANNOUM et al., 2003; CARMOFSILVA et al., 2008). Em C4 o decréscimo fotossintético também pode ser causado por limitações estomáticas e não estomáticas. Alguns autores correlacionam as mudanças no Ci para distinguir as limitações estomáticas e não estomáticas na fotossíntese (GHANNOUM, 2009), onde os fatores estomáticos estão presentes na primeira fase do estresse que geralmente apresenta decréscimo de Ci acompanhado pelo decréscimo de gs, e os não estomáticos nas fases mais severas da seca com aumento de Ci e decréscimo contínuo da fotossíntese (DU et al., 1996; KALAPOS et al., 1996; LAL; EDWARDS, 1996).
Em plantas C4 o estresse hídrico também promove uma série de modificações bioquímicas que promovem a redução da assimilação do CO2, como diminuição da atividade das enzimas relacionadas com os processos fotossintéticos: Rubisco, PEPcase, enzima málica e, principalmente, a piruvato fosfato diquinase (PPDK) (DU et al., 1996). Porém alguns autores não observaram decréscimo na atividade de Rubisco e PEPcase sob seca (FOYER et al., 1998; MARQUES DA SILVA; ARRABAÇA, 2004).
De acordo com alguns trabalhos presentes na literatura (SACCARDY et al., 1996; CARMOFSILVA et al., 2007), as enzimas do ciclo C3 parecem ser mais sensíveis ao déficit hídrico do que as do ciclo C4. O decréscimo da relação da atividade enzimática C3/C4 pode ser identificado pelo vazamento de CO2 da bainha para o mesófilo (VON CAEMMERER; FURBANK, 1999; SALIENDRA et al., 1996). O aumento do vazamento de CO2 das células da bainha para o mesófilo é causado principalmente por limitações bioquímicas e o decréscimo da relação Rubisco/PEPcase mostra que a fotossíntese em plantas C4 é limitada pelo ciclo C3 sob estresse hídrico (SALIENDRA et al., 1996).
Nas espécies C4, o déficit hídrico promove, também, decréscimo da atividade de redutase de nitrato (RN), que pode ser correlacionado com a diminuição de clorofila e proteína solúveis (DU et al., 1996; FOYER et al., 1998). Ainda sob estas condições, o conteúdo de carboidratos solúveis totais aumenta, e na maioria dos casos, pode haver a mobilização de outros açúcares para a síntese de sacarose (LEE et al., 2008).
2 REFERÊNCIAS
ABDIN, O. A.; ZHOU, X.; COULMAN, B. E.; CLOUTIER, D.; FARIS, M. A.; SMITH, D. L. Effects of sucrose supplementation by stem injection on the development of soybean plants. Journal of Experimental Botany, v. 49, p. 2013–2018, 1998.
ALBINO, J. C.; CRESTE, S.; FIGUEIRA, A. Mapeamento genético da canaFdeFaçúcar: Uso de marcadores moleculares no mapeamento genético visando o melhoramento da canaFdeF açúcar. Biotecnologia, Ciência e Desenvolvimento, v. 36, p 82–91, 2006.
ALLISON, J. C. S.; WILLIAMS, H. T.; PAMMENTER, N. W. Effect of specific leaf nitrogen on photosynthesis of sugarcane. Annals of Applied Biology, v. 63, p. 135–144, 1997.
ALMEIDA SILVA, M.; JIFON, J. L.; SHARMA, V.; SILVA, J. A. G.; CAPUTO, M. M.; DAMAJ, M. B.; GUIMARÃES, E. R.; FERRO, M. I. T. Use of physiological parameters in screening drought tolerance in sugarcane genotypes. Sugar Tech, v. 13, p. 191–197, 2011. ARAYA, T.; NOGUCHI, K.; TERASHIMA, I. Effects of carbohydrate accumulation on photosynthesis differ between sink and source leaves of L. Plant and Cell Physiology, v. 47, p. 644–652, 2006.
BAKER, N. R.; ROSENQVIST, E. Application of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities. Journal of Experimental Botany, v.55, p. 1607–1621, 2004.
BARRATT, D. H.; DERBYSHIRE, P.; FINDLAY, K.; PIKE, M.; WELLNER, N.; LUNN, J.; FEIL, R.; SIMPSON, C.; MAULE, A. J.; SMITH, A. M.. Normal growth of
requires cytosolic invertase but not sucrose synthase. Proceedings of the National Academy of Sciences, v. 106, p. 13124–13129, 2009.
BLÄSING, O. E.; GIBON, Y.; GÜNTHER, M.; HÖHNE, M.; MORCUENDE, R.;
OSUNAA, D.; THIMMA, O.; USADELA, B.; SCHEIBLEA, W.FR.; STITT, M. Sugars and circadian regulation make major contributions to the global regulation of diurnal gene expression in . Plant Cell, v. 17, p. 3257–3281, 2005.
BRUMBLEY, S. M.; SNYMAN, S. J.; GNANASAMBANDAM, A.; JOYCE, P.;
HERMANN, S. R.; DA SILVA, J. A. G.; MCQUALTER, R. B.; WANG, M.FL.; EGAN, B.; PATTERSON, A. H.; ALBERT, H. H.; MOORE, P. H. Sugarcane. In: KOLE, C.; HALL, T. C., eds. A compendium of transgenic crop plants: sugar, tuber and fiber crops. Blackwell Publishing, 2008, p. 1–58.
BUCHANAN, B. B.; GRUISSEM, W.; JONES, R. L. Biochemistry and molecular biology of plants. Rockville: American Society of Plant Physiologists, 2000, 1367 p.
CARMOFSILVA, A. E.; POWERS, S. J.; KEYS, A. J.; ARRABAÇA, M. C.; PARRY, M. A. J. Photorespiration in C4 grasses remains slow under drought conditions. Plant, Cell and Environment, v. 31, p. 925–940, 2008.
CASU, R. E.; GROF, C. P. L.; RAE, A. L.; LYNNE MCINTYRE, C. L.; DIMMOCK, C. M.; MANNERS, J. M. Identification of a novel sugar transporter homologue strongly expressed in maturing stem vascular tissues of sugarcane by expressed sequence tag and microarray analysis. Plant Molecular Biology, v. 52, p. 371–386, 2003.
CASU, R. E.; JARMEY, J.; BONNETT, G.; MANNERS, J. Identification of transcripts associated with cell wall metabolism and development in the stem of sugarcane by Affymetrix GeneChip Sugarcane Genome Array expression profiling. Function and Integrative
Genomics, v. 7, p. 153–167, 2007.
CHAVES, M. M.; PEREIRA, J. S.; MAROCO, J.; RODRIGUES, M. L.; RICARDO, C. P. P., OSÓRIO, M. L.; CARVALHO, I.; FARIA, T.; PINHEIRO, C. How plants cope with water stress in the field. Photosynthesis and growth. Annals of Botany, v. 89, p. 907–916, 2002. CHAVES, M. M.; MAROCO, J. P.; PEREIRA, J. S. Understanding plant responses to drought — from genes to the whole plant. Functional Plant Biology, v. 30, p. 239–264, 2003.
CHAVES, M. M; FLEXAS, J.; PINHEIRO, C. Photosynthesis under drought and salt stress: Regulation mechanisms from whole plant to cell. Annals of Botany, v. 103, p. 551–560, 2008.
CORNIC, G. Drought stress inhibits photosynthesis by decreasing stomatal aperture – not affecting ATP synthesis. Trends in Plant Science, v. 5, p. 187–188, 2000.
CORNIC, G.; FRESNEAU, C. Photosynthetic carbon reduction and oxidation cycles are the main electron sinks for photosystem II activity during a mild drought. Annals of Botany, v. 89, p. 887–894, 2002.
DAI, N.; SCHAFFER, A.; PETREIKOV, M.; SHAHAK, Y.; GILLER, Y.; RATNER, K.; LEVINE, A.; GRANOT, D. Overexpression of Arabidopsis hexokinase in tomato plants inhibits growth, reduces photosynthesis and induces rapid senescence. The Plant Cell, v. 11, p. 1253–1266, 1999.
DAVIES, W. J.; ZHANG, J. Root signals and the regulation of growth and development of plants in drying soil. Annual Review of Plant Physiology and Plant Molecular Biology, v. 42, p. 55–76, 1991.
DIEESE – Departamento intersindical de estatística e estudos socioeconômicos. Desempenho do setor sucroalcooleiro brasileiro e os trabalhadores, v. 30, 2007, 34p.
EHLERINGER, J. R.; CERLING, T. E.; HELLIKER, B. R. C4 photosynthesis, atmospheric CO2 and climate. Oecologia, v. 112, p. 285–299, 1997.
FLEXAS, J.; MEDRANO, H. DroughtFinhibition of photosynthesis in C3 plants: stomatal and nonFstomatal limitations revisited. Annals of Botany, v. 89, p. 183–189, 2002.
FLEXAS, J.; BOTA, J.; LORETO, F.; CORNIC, G.; SHARKEY, T. D. Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3 plants. Plant Biology, v. 5, p. 1–11, 2004.
FOYER, C. H.; CHAUMONT, M.; MURCHIE, E.; GALTIER, N.; FERRARIO, S. EndF product modulation of carbon partitioning with a view to improved biomass production. In: MADORE, M. A.; LUCAS, W. J., eds. Carbon partitioning and source–sinks interactions in plants. Rockville: American Society of Plant Physiologists, 1995, p. 45–55.
FOYER, C. H.; VALADIER, M. H.; MIGGE, A.; BECKER, T. W. DroughtFinduced effects on nitrate reductase activity and mRNA and on the coordination of nitrogen and carbon metabolism in maize leaves. Plant Physiology, v. 117, p. 283–292, 1998.
FOYER, C. H.; NOCTOR, G. Oxygen processing in photosynthesis: regulation and signaling. New Phytologist, v. 146, p. 359–388, 2000.
FRANCK, N.; VAAST, P.; GÉNARD, M.; DAUZAT, J. Soluble sugars mediate sink feedback downFregulation of leaf photosynthesis in fieldFgrown ! "" . Tree Physiology, v. 26, p. 517–525, 2006.
FURBANK, R. T, PRITCHARD, J.; JENKINS, C. L. D. Effects of endogenous sucrose feeding on photosynthesis in the C3 plant tobacco and the C4 plant # . Australian Journal of Plant Physiology, v. 24, p. 291–299, 1997.
GHANNOUM, O.; CONROY, J. P.; DRISCOLL, S. P.; PAUL, M. J.; FOYER, C. H.; LAWLOR, D. W. NonFstomatal limitations are responsible for droughtFinduced
photosynthetic inhibition in four C4 grasses. New Phytologist, v. 159, p. 835–844, 2003. GHANNOUM, O. C4 photosynthesis and water stress. Annals of botany, v. 103, p. 635–644, 2009.
GIBSON, S. I. Control of plant development and gene expression by sugar signaling. Current Opinion in Plant Biology, v. 8, p. 93–102, 2005.
GROF, C. P. L.; CAMPBELL, J. A. Sugarcane sucrose metabolism: scope for molecular manipulation. Australian Journal of Plant Physiology, v. 28, p. 1–12, 2001.
HARMENS, H.; STIRLING, C. M.; MARSHALL, C.; FARRAR, J. F. Does downFregulation of photosynthetic capacity by elevated CO2 depend on N supply in $ ? Physiologia Plantarum, v. 108, p. 43–50, 2000.
HOFMEYR, J. H. S. Anaerobic energy metabolism in yeast as a supply–demand system. In: CORNISHFBOWDEN, A., ed. New beer in an old bottle. Eduard Buchner and the growth of biochemical knowledge. Universitat de València, 1998, p. 225–242.
HOFMEYR, J. H. S.; CORNISHFBOWDEN, A. Regulating the cellular economy of supply and demand. FEBS Letters, v. 476, p. 47–51, 2000.
HURRY, V. M.; GARDESTROM, P.; OQUIST, G. Reduced sensitivity to photoinhibition following frostFhardening of winter rye is due to increased phosphate availability. Planta, v. 190, p. 484–490, 1993.
IGLESIAS, D. J.; LLISO, I. T.; FRANCISCO, R.; TALON, M. Regulation of photosynthesis through source: sink imbalance in citrus is mediated by carbohydrate content in leaves. Physiologia Plantarum, v. 116, p. 563–572, 2002.
INMANFBAMBER, N. G.; BONNETT, G. D.; SMITH, D. M.; THORBURN, P. J. Sugarcane physiology: Integrating from cell to crop to advance sugarcane production. Field Crops Research, v. 92, p. 115–117, 2005.
INMANFBAMBER, N. G.; SMITH, D. M. Water relations in sugarcane and response to water deficits. Field Crops Research, v. 92, p. 185–202, 2005.
INMANFBAMBER, N. G.; BONNETT, G. D.; SPILLMAN, M. F.; HEWITT, M. L.; JACKSON, J. Increasing sucrose accumulation in sugarcane by manipulating leaf extension and photosynthesis with irrigation. Australian Journal of Agricultural Research, v. 59, p. 13–26, 2008.
INMANFBAMBER, N. G.; BONNETT, G. D.; SPILLMAN, M. F.; HEWITT, M. L.; XU J. Source–sink differences in genotypes and water regimes influencing sucrose accumulation in sugarcane stalks. Crop and Pasture Science, v. 60, p. 316–327, 2009.
JACKSON, P. A. Breeding for improved sugar content in sugarcane. Field Crops Reserch, v. 92, p. 277–90, 2005.
JANG, J. C.; LEON, P.; ZHOU, L.; SHEEN, J. Hexokinase as a sugar sensor in higher plants. The Plant Cell, v. 9, p. 5–19, 1997.
JEANNETTE, E.; REYSS, A.; GREGOERY, N.; GANTET, P.; PRIOUL, J. L. Carbohydrate metabolism in heatFgirdled maize source leaf. Plant, Cell and Environment, v. 23, p. 61–69, 2000.
KALAPOS, T.; VAN DEN BOOGAARD, R.; LAMBERS, H. Effect of soil drying on growth, biomass allocation and leaf gas exchange of two annual grass species. Plant and Soil, v. 185, p. 137–149, 1996.
KOCAL, N.; SONNEWALD, U.; SONNEWALD, S. Cell wallFbound invertase limits sucrose export and is involved in symptom development and inhibition of photosynthesis during compatible interaction between tomato and % pv . Plant Physiology, v. 148, p. 1523–1536, 2008.
KOCH, K. E.; YING, Z.; WU, Y.; AVIGNE, W. T. Multiple paths of sugarFsensing and a sugar/oxygen overlap for genes of sucrose and ethanol metabolism. Journal of Experimental Botany, v. 261, p. 3193–3199, 2000.
KOCH, K. Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development. Current Opinion in Plant Biology, v. 7, p. 235–246, 2004.
KRAPP, A.; STITT, M. An evaluation of direct and indirect mechanisms for the ‘sinkF regulation’ of photosynthesis in spinach: changes in gas exchange, carbohydrates,
metabolites, enzyme activities and steadyFstate transcript levels after coldFgirdling source leaves. Planta, v. 195, p. 313–323, 1995.
LAKSHMANAN, P.; GEIJSKES, R. J.; AITKEN, K. S.; GROF, C. L. P.; BONNETT, G. D.; SMITH, G. R. Sugarcane biotechnology: the challenges and opportunities. In Vitro Cellular and Developmental Biology, v. 41, p. 345–363, 2005.
LAL, A.; EDWARDS, G. E. Analysis of inhibition of photosynthesis under water stress in the C4 species and & $ : electron transport, CO2 fixation and
carboxylation capacity. Functional Plant Biology, v. 23, p. 403–412, 1996.
LALONDE, S.; TEGEDER, M.; THRONEFHOLST, M.; FROMMER, W. B.; PATRICK, J. W. Phloem loading and unloading of sugars and amino acids. Plant, Cell and Environment, v. 26, p. 37–56, 2003.
LAWLOR, D. W. Limitation to photosynthesis in waterFstressed leaves: stomata vs. metabolism and the role of ATP. Annals of Botany, v.89, p. 871–885, 2002. LAWLOR, D. W.; CORNIC, G. Photosynthetic carbon assimilation and associated
metabolism in relation to water deficits in higher plants. Plant, Cell and Environment, v. 25, p.275–294, 2002.
LEE, B. R.; JIN, Y. L.; JUNG, W. J.; AVICE, J. C.; MORVANFBERTRAND, A.; OURRY, A.; PARK, C. W.; KIM, T.H. WaterFdeficit accumulates sugars by starch degradation F not by de novo synthesis – in white clover leaves ( " ). Physiologia Plantarum, v. 134, p. 403–411, 2008.
LEEGOOD, R. C.; WALKER, R. P. Regulation of the C4 pathway. In: SAGE, R. F.; MONSON, R. K., eds. C4 plant biology. San Diego: Academic Press, 1999, p. 89–131. LONG, S. P.; ZHU, X. G.; NAIDU, S. L.; ORT, D. R. Can improvement in photosynthesis increase crop yields? Plant, Cell and Environment, v.29, p. 315–330, 2006.
MAROCO, J. P.; PEREIRA, J. S.; CHAVES, M. M. Growth, photosynthesis and waterFuse efficiency of two C4 Sahelian grasses subjected to water deficits. Journal of Arid
Environments, v. 45, p. 119–137, 2000.
MARQUES DA SILVA, J.; ARRABAÇA, M. C. Photosynthesis in the waterFstressed C4 grass is mainly limited by stomata with both rapidly and slowly imposed water deficits. Physiologia Plantarum, v. 121, p. 409–420, 2004.
MCCORMICK, A. J.; CRAMER, M. D.; WATT, D. A. Sink strength regulates photosynthesis in sugarcane. New Phytologist, v. 171, p.759–770, 2006.
MCCORMICK, A. J.; CRAMER, M. D, WATT, D. A. Regulation of photosynthesis by sugars in sugarcane leaves. Journal of Plant Physiology, v. 165, p. 1817–1829, 2008a. MCCORMICK, A. J.; CRAMER, M. D.; WATT, D. A. Differential expression of genes in the leaves of sugarcane in response to sugar accumulation. Tropical Plant Biology, v. 1, p. 142–158, 2008b.
MCCORMICK, A. J.; WATT, D. A.; CRAMER, M. D. Supply and demand: sink regulation of sugar accumulation in sugarcane. Journal of experimental botany, v. 60, p. 357–364, 2009.
MOORE, P. H.; MARETZKI, A. Sugarcane. In: ZAMSKI, E.; SCHAFFER, A. A. (eds.) Photoassimilate distribution in plants and crops. New York: Marcel Dekker, p. 643–669, 1996.
MOORE, B. D.; CHENG, S.FH.; RICE, J.; SEEMANN, J. R. Sucrose cycling, Rubisco expression and prediction of photosynthetic acclimation to elevated atmospheric CO2. Plant, Cell and Environment, v. 21, p. 905–915, 1998.
MOORE, B. D.; CHENG, S.FH.; SIMS, D.; SEEMANN, J. R. The biochemical and molecular basis for photosynthetic acclimation to elevated atmospheric CO2. Plant, Cell and
Environment, v. 22, p. 567–582, 1999.
MOORE, B.; ZHOU, L.; ROLLAND, F.; HALL, Q.; CHENG, WFH.; LIU, YFX.; HWANG, I.; JONES, T.; SHEEN, J. Role of glucose sensor HXK1 in nutrient, light, and hormonal signaling. Science, v. 300, p. 332–336, 2003.
MOORE, P. H. Integration of sucrose accumulation processes across hierarchical scales: towards developing an understanding of the geneFtoFcrop continuum. Field Crops Research, v.92, p.119–135, 2005.
NEPOMUCENO, A. L.; NEUMAIER, N.; FARIAS, J. R. B.; OYAX, T. Tolerância à seca em plantas. Biotecnologia, Ciência e Desenvolvimento, v. 4, p. 12–18, 2001.
NIELSEN, T. H.; KRAPP, A.; RBPERFSCHWARZ, U.; STITT, M. The sugarFmediated regulation of genes encoding the small subunit of Rubisco and the regulatory subunit of ADP glucose pyrophosphorylase is modified by phosphate and nitrogen. Plant, Cell and
OSMOND, C. B. What is photoinhibition? Some insights from comparisons of shade and sun plants. In:. BAKER, N. R.; BOWYER, J. R., eds. Photoinhibition of photosynthesis: from molecular mechanisms to the field. Oxford: Bios Scientific Publishers, 1994, p. 1–24. PAPINIFTERZI, F. S.; ROCHA, F. R.; VÊNCIO, R. Z. N.; FELIX, J. M.; BRANCO, D. S.; WACLAWOVSKY, A. J.; DEL BEM, L. E. V.; LEMBKE, C. G.; COSTA, M. D. L.; NISHIYAMA, M. Y.; VICENTINI, R.; VINCENTZ, M. G. A.; ULIAN, E. C.; MENOSSI, M.; SOUZA, G. M. Sugarcane genes associated with sucrose content. BMC genomics, v. 10, p. 1–21, 2009.
PARRY, M. A. J.; KEYS, A. J.; MADGWICK, P. J.; CARMOFSILVA, A. E.;
ANDRALOJC, P. J. Rubisco regulation: a role for inhibitors. Journal of Experimental Botany, v. 59, p. 1569–1580, 2008.
PAUL, M. J.; DRISCOLL, S. P. Sugar repression of photosynthesis: the role of carbohydrates in signalling nitrogen deficiency through source:sink imbalance. Plant, Cell and
Environment, v. 20, p. 110–116, 1997.
PAUL, M. J.; FOYER, C. H. Sink regulation of photosynthesis. Journal of Experimental Botany, v. 52, p. 1381–1400, 2001.
PAUL, M. J.; PELLNY, T. K.; GODDIJIN, O. Enhancing photosynthesis with sugar signals. Trends in Plant Science, v. 6, p. 197–200, 2001.
PAUL, M. J.; PELLNY, T. K. Carbon metabolite feedback regulation of leaf photosynthesis and development. Journal of Experimental Botany, v. 54, p. 539–47, 2003.
PAUL, M. J. Trehalose 6Fphosphate. Current Opinion in Plant Biology, v. 10, p. 303–309, 2007.
PEGO, J. V.; KORTSTEE, A. J.; HUIJSER, C.; SMEEKENS, S. Photosynthesis, sugars and the regulation of gene expression. Journal of Experimental Botany, v. 51, p. 407–416, 2000.
PETIT, J. R.; JOUZEL, J.; RAYNAUD, D.; BARKOV, N. I.; BARNOLA, J. M.; BASILE, I.; BENDER, M.; CHAPPELLAZ, J.; DAVIS, M.; DELAYGUE, G.; DELMOTTE, M.;
KOTLYAKOV, V. M.; LEGRAND, M.; LIPENKOV, V. Y.; LORIUS, C.; PEPIN, L.; RITZ, C.; SALTZMAN, E.; STIEVENARD, M. Climate and atmospheric history of the past 420 000 years from the Vostok ice core, Antarctica. Nature, v. 399, p. 429–436, 1999.
PIMENTEL, C. A relação da planta com a água. Rio de Janeiro: Seropédica, Edur, 2004. 191p.
PRICE, J.; LAXMI, A.; ST MARTIN, S. K.; JANG, J. C. Global transcription profiling reveals multiple sugar signal transduction mechanisms in . Plant Cell, v. 16, p. 2128–2150, 2004.