D
EPARTAMENTO DEB
IOLOGIAV
EGETALA
VALIAÇÃO E CARACTERIZAÇÃO DA ATIVIDADE ANTI
-HERPÉTICA DE EXTRATOS AQUOSOS DE PLANTAS DA
FLORA
P
ORTUGUESA
Fernanda Pinto Resende
D
ISSERTAÇÃOM
ESTRADOE
MM
ICROBIOLOGIAA
PLICADAD
EPARTAMENTO DEB
IOLOGIAV
EGETALA
VALIAÇÃO E CARACTERIZAÇÃO DA ATIVIDADE ANTI
-HERPÉTICA DE EXTRATOS AQUOSOS DE PLANTAS DA
FLORA
P
ORTUGUESA
Fernanda Pinto Resende
Dissertação orientada por Prof. Doutora Maria Filomena Caeiro,
Faculdade de Ciências da Universidade de Lisboa
D
ISSERTAÇÃOM
ESTRADOE
MM
ICROBIOLOGIAA
PLICADAA
VALIAÇÃO E CARACTERIZAÇÃO DA ATIVIDADE ANTI
-HERPÉTICA DE EXTRATOS AQUOSOS DE PLANTAS DA
FLORA
P
ORTUGUESA
Fernanda Pinto Resende
T
ESE DEM
ESTRADO2012
Esta dissertação foi realizada no Centro de Estudos do Ambiente e do Mar
(CESAM) da Universidade de Aveiro - polo FCUL e Departamento de Biologia
Vegetal da FCUL, sob a orientação direta da Professora Doutora Maria
Filomena Caeiro, no âmbito do Mestrado em Microbiologia Aplicada da
Faculdade de Ciências da Universidade de Lisboa.
AGRADECIMENTOS
Ao Prof. Doutor Rogério Tenreiro, pelo privilégio que me proporcionou na realização deste mestrado na área da Microbiologia e nomeadamente na FCUL. Por toda a sua compreensão.
À minha orientadora Prof. Doutora Maria Filomena Caeiro, por me ter aceitado no seu laboratório, me proporcionar a realização deste trabalho na área da virologia, vindo enriquecer a minha formação. Pela sua orientação teórica e prática, desde o início até à parte final da elaboração desta tese. Pelo estimável e contínuo apoio, incentivo e força, permanente disponibilidade, por todo o seu tempo, paciência, amizade e compreensão, que constituíram o maior contributo para a realização deste estudo.
À Ana Margarida, pelo seu apoio na leitura do ensaio MTT, bibliografia cedida, pela sua sempre presente disponibilidade em ajudar, boa disposição e bondade, a quem desejo as maiores felicidades profissionais.
À Prof. Doutora Lia Ascensão, pela cedência dos extratos, bibliografia e esclarecimentos adicionais. Ao Pedro Falé, pelos esclarecimentos sobre o ácido rosmarínico e literatura cedida.
À Mariana, pelos esclarecimentos no tratamento estatístico dos dados e ajuda na fotografia dos géis, pela sua disponibilidade amiga.
À D. Lurdes e Dra. Susana, pela ajuda na pesquisa da bibliografia (Centro do Sangue e Transplante de Lisboa).
À Célia, por todo o seu apoio e amizade, logo desde o 1º ano. À Egídia, pelos seus momentos, partilha de sonhos e força de vencer. À Teresa, Granja, inspiradora de força e ânimo, pelo seu apoio e carinho.
À família e a todos os amigos que me incentivaram nesta etapa académica e mais-valia a nível profissional, em especial:
À minha colega de Mestrado, de profissão e amiga de muitos anos, Mafalda, pela sua presença, apoio e ajuda em muitas situações, pelo seu companheirismo e cumplicidade, espero que continuemos sempre unidas nos nossos valores.
Ao meu Paulo, pelo seu esforço na colaboração no tratamento estatístico dos resultados e organização gráfica do trabalho, pela sua infinita paciência…, pelo seu carinho.
Aos meus filhos, Matilde, Luis e Marta e à minha mãe, pelo tempo que lhes retirei de estarmos juntos, pela sua compreensão e constante preocupação.
Sinceramente, a todos vós,
Muito obrigada! Fernanda
RESUMO
Infecções aparentemente inócuas por vírus Herpes simplex podem levar a complicações sérias, como ceratoconjuntivite e encefalites.
O aumento significativo de estirpes resistentes aos atuais antivirais, leva à procura de novas alternativas terapêuticas. A medicina popular, à base de plantas, tem sido assunto de interesse mundial, envolvendo estudos biológicos com avaliação de potencialidades terapêuticas. O presente estudo avaliou a ação anti-herpética de extratos aquosos (através do ensaio de redução de placas), obtidos por decocções de folhas/caules e de flores, de duas espécies de plantas da flora aromática Portuguesa, ambas pertencentes à Familia Astereaceae: Helichrysum
italicum e Solidago virgaurea.
A atividade anti-herpética dos extratos foi estudada em concentrações não tóxicas para células Vero, previamente determinadas pelo ensaio MTT. Fizeram-se ensaios diretamente sobre partículas virais em suspensão de HSV-1 e HSV-2, variando os tempos de contacto e concentrações (estudo do efeito virucida) e ainda visando avaliar os efeitos nos ciclos replicativos destes vírus em células Vero, quando adicionados antes da infecção, durante a adsorção e em diferentes tempos pós infeção. Os extratos revelaram um elevado efeito virucida (inativação direta das partículas virais), sendo mais eficazes contra o HSV-2 (inibições da infecciosidade superiores a 99%), provavelmente interferindo em proteínas estruturais, algumas das quais necessárias à adsorção e penetração nas células hospedeiras. Também exibiram efeitos na produção de novas partículas virais infecciosas em células Vero tratadas durante a adsorção viral, que variaram entre 75% e 99% para o HSV-1 e entre 59% e 97% para o HSV-2; quando presentes durante o período da infecção compreendido entre as 4 e as 18 horas p.i., resultaram inibições de 71 a 99% na produção de HSV-1 infecioso e de 86 a 99% para o HSV-2. Não revelaram efeitos significativos quando estiveram em contacto com as células Vero antes da infecção.
ABSTRACT
Seemingly innocuous infections by herpes simplex virus can lead to serious complications, such as keratoconjunctivitis and encephalitis.
The significant increase of virus strains resistant to commonly used anti-herpes virus drugs, leads to the search for new therapeutic alternatives. Herbal folk medicine has been a subject of global interest, involving biological studies with evaluation of potential therapies. This study evaluated the anti-herpetic activity against HSV-1 and HSV-2 (through the plaque reduction assay) of aqueous extracts obtained by decoctions of leaves / stems and flowers of two species of the Portuguese aromatic flora, both belonging to the Astereaceae Family: Helichrysum
italicum and Solidago virgaurea.
The anti-herpetic activity of the extracts was studied in non-cytotoxic concentrations for Vero cells, which were previously determined by the MTT assay. Tests were performed directly on virus particles from suspension of HSV-1 and HSV-2 (study of virucidal activity), in different concentrations and contact times. Assays to evaluate the effects on the replicative cycle of these viruses in Vero cells were also carried out, when the extracts were added to Vero cells before infection, during adsorption and at different times after infection. The extracts showed a very high virucidal effect (direct inactivation of virus particles), being more effective against HSV-2 (reduced viral infectivity by > 99%) probably by interfering with structural proteins, some of which, necessary to the adsorption and / or entry into host cells. The extracts also exhibited inhibitory effects in the production of new infectious virus particles in Vero cells treated during virus adsorption, ranging between 75% to 99% for HSV-1 and between 59% to 97% for HSV-2; when present between 4 and 18 hours p.i, it resulted in inhibitions from 71 to 99% in the production of infectious HSV-1 and from 86 to 99% for HSV-2. When they were in contact with Vero cells prior the infection period no significant effects were revealed.
ABREVIATURAS E GLOSSÁRIO
ATCC Americam type culture collection
C1 Extrato aquoso de ácido rosmarínico
CC50 Concentração que inibe a viabilidade celular em 50% ou concentração citotoxica para 50% das
células.
Células Vero Linha celular de rim do macaco verde africano (Cercopithecus aethiops)
CMNC Concentração máxima não citotóxica
DBV Departamento de Biologia Vegetal
DMEM Meio de Eagle modificado por Dulbecco (do inglês Dulbecco’s Modified Eagle Medium)
DMEM-FBS10 Meio de Eagle modificado por Dulbecco e suplementado com soro bovino fetal a 10% DMEM-FBS2 Meio de Eagle modificado por Dulbecco e suplementado com soro bovino fetal a 2%
DMSO Dimetilsulfóxido
DNA Ácido Desoxirribonucleico (do inglêsdeoxyribonucleic acid)
E3 Extrato aquoso de flores de Helichrysum italicum
E4 Extrato aquoso de caules/folhas de Helichrysum italicum
E6 Extrato aquoso de caules/folhas de Solidago virgaurea
g Glicoproteína viral (gB, gC, gD, gE, gG, gH, gI, gJ, gl, gM)
p.i. Pós infeção
h.p.i. Horas pós infeção
HIV-1 Vírus da Imunodeficiência Humana tipo1 (do inglês
Human immunodeficiency virus type1)
HSV Vírus Herpes Simples (do inglês Herpes Simplex Virus)
HSV-1 Vírus Herpes Simples tipo 1
HSV-2 Vírus Herpes Simples tipo 2
IC50 Concentração inibitória em 50% (do inglês Inhibitory concentration)
ICP Polipeptídeo expresso na célula infetada (do inglêsinfected cellPolypeptide)
ICTV Comissão Internacional de Taxonomia dos Vírus (do inglês International Committee on
Taxonomy of Virus)
IgG Imunoglobulina G
pb Pares de bases
mg Miligrama
mL Mililitro
MTT Brometo de 3- [4,5-dimetil-tiazol-1-il] -2,5-difenil-tetrazólio (do inglês
3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)
OMS Organização Mundial de Saúde
P6, P12, P24, P48, P96 Placas de cultura de 6, 12, 24, 48 e 96 poços
PBS Tampão PBS (do inglês Phosphate-Buffered Saline)
PFU Unidades formadoras de placas (do inglês plaque-forming units)
PI Primoinfeção
Placa Zona de lise ou destruição celular causada por uma infecção viral
RNAm Ácido ribonucleico mensageiro
FBS Soro bovino fetal (do inglêsFetal bovine serum)
SIDA Síndrome da Imunodeficiência Adquirida
SNC Sistema nervoso central
TA Temperatura ambiente
T25, T75 Frasco de cultura de 25 e 75 cm
2
de área (do inglês T-Flasks)
UL Região do genoma constituída por uma sequência única longa (do inglês unique Long) US Região do genoma constituída por uma sequência única curta (do inglês unique short)
UV Ultra violeta
vhs Proteína responsável pela inibição da síntese de DNA e de proteínas celulares (do inglês Virus
host shut off protein)
Virião Partícula viral infectante completa, forma extracelular do vírus
VP Polipéptideo do virião (Proteínas estruturais) (do inglêsvirion Polypeptide) αTIF Fator indutor da transcrição α (do inglês α-trans-inducing factor)
ÍNDICE
AGRADECIMENTOS ... i
RESUMO ... ii
ABSTRACT ... iii
ABREVIATURAS E GLOSSÁRIO ...iv
ÍNDICE ...vi
I. INTRODUÇÃO ... 1
1.Os vírus Herpes Simplex ...1
1.1 HSV-Histórico e Classificação ...1 1.2 HSV-Patologias...3 2. Enquadramento teórico ...5 2.1 HSV - Morfologia e estrutura ...5 2.2 HSV - Ciclo replicativo ...6 2.3 Terapia atual ...9
2.4 Estudos biológicos de produtos naturais ... 10
2.4.1 Helichrysum italicum (Asteraceae) ... 11
2.4.2 Solidago virgaurea (Asteraceae) ... 12
3. Objetivos... 13
4.Quadro metodológico ... 13
II. PARTE EXPERIMENTAL ... 16
1. Materiais... 16
1.1 Ácido Rosmarínico ... 16
1.2 Helichrysum italicum Miller. ... 16
1.3 Solidago virgaurea L. ... 16
1.4 Linha celular ... 16
1.5 Vírus ... 17
2. Procedimentos/Métodos ... 17
2.1 Preparação de extratos aquosos... 17
2.2 Preparação das soluções stock dos extratos ... 17
2.3 Cultura celular... 17
2.4 Propagação e Manutenção celular ... 18
2.5 Determinação da concentração e da taxa de viabilidade de uma suspensão celular ... 18
2.6 Produção de vírus ... 19
2.7 Titulação de Vírus ... 19
2.8 Determinação da citotoxicidade dos extratos em células Vero... 20
2.8.1 Avaliação morfológica por Microscopia ótica ... 20
2.8.2 Ensaio colorimétrico de redução mitocondrial do sal de tetrazolium (MTT). ... 20
2.9 Estudo do efeito direto dos extratos nos vírus (efeito virucida) ... 21
2.10 Avaliação da atividade antiviral ... 21
2.10.2 Avaliação após tratamento das células com os extratos durante 2 horas antes da infecção. ... 22
2.10.3 Estudo do efeito da adição dos extratos em diferentes tempos do ciclo replicativo... 22
2.11 Análise das Proteínas celulares e virais. ... 23
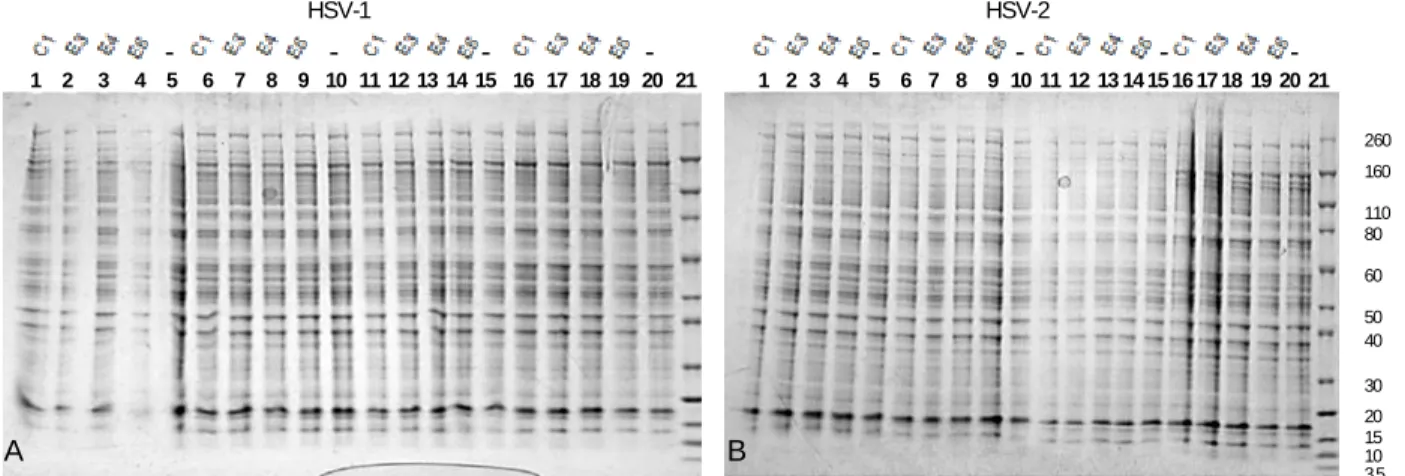
2.11.1 Estudo do efeito dos extratos na síntese de proteínas celulares e virais em células infectadas... 23
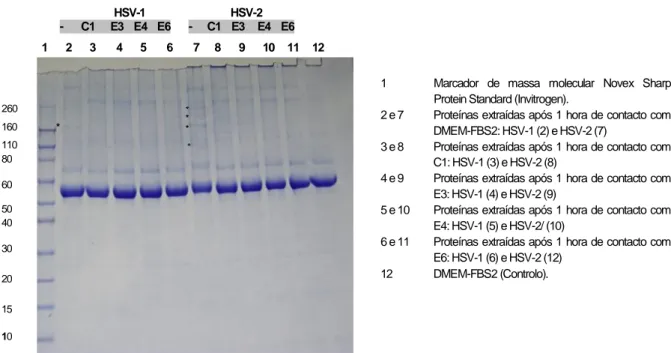
2.11.2 Estudo do efeito direto dos extratos nas proteínas dos viriões. ... 23
III. RESULTADOS ... 24
1. Avaliação da Citotoxicidade ... 24
1.1 Estudo de alterações morfológicas através de Microscopia ótica. ... 24
1.2 Estudo da citotoxicidade através do ensaio MTT. ... 24
1.2.1 Percentagens de viabilidade celular com diferentes concentrações dos extratos. ... 24
1.2.2 Determinação da CMNC e da CC50... 26
2. Atividade Anti-herpética ... 26
2.1. Efeito virucida - efeito direto sobre o vírus. ... 26
2.1.1 Cálculo do IC50... 29
2.1.2 Determinação dos índices de seletividade ... 29
2.2 Avaliação do efeito no ciclo replicativo ... 30
2.3 Estudo do efeito nas proteínas celulares e virais ... 32
IV. DISCUSSÃO DOS RESULTADOS ... 35
1. Citotoxicidade dos extratos ... 35
2. Atividade anti-herpética ... 36
3. Análise das proteinas ... 40
V. CONSIDERAÇÕES FINAIS / CONCLUSÕES ... 41
VI. REFERÊNCIAS BIBLIOGRÁFICAS ... 43
I. INTRODUÇÃO
As infecções em seres humanos provocadas por vírus datam de há milhares de anos, e a infecção pelos vírus Herpes Simples (HSV) tipos 1 e 2 continua a ser uma das mais comuns no homem (Nadal, 2003). Nos últimos anos tem-se verificado o aumento da infecção, nomeadamente do Herpes Simples tipo 2 (HSV-2), especialmente em doentes imunodeprimidos (Fleming et al., 1997). Estes vírus podem causar uma grande variedade de doenças nos seres humanos, cuja severidade pode ir de moderada a debilitante, ou mesmo levar à morte.
Existem diversos fármacos eficazes no tratamento da infecção pelo HSV, sendo o aciclovir o mais utilizado devido à sua baixa toxicidade e grande eficácia (Elion et al., 1977). Ultimamente, tem-se verificado um aumento significativo da resistência a este fármaco, principalmente em indivíduos com infecções virais crónicas e doentes imunodeprimidos (Christophers et al., 1998), o que levou à procura de novos agentes anti-herpéticos que possam substituir ou complementar alguns dos já existentes, pois a resistência ao tratamento mais comum, faz das infecções herpéticas um grave problema de saúde pública mundial.
Têm sido realizadas pesquisas de potenciais propriedades terapêuticas em produtos naturais e respetivos metabolitos, em plantas de várias famílias tais como Asteraceae e Lamiaceae.
Sendo ainda escassos os estudos sobre extratos aquosos destas plantas, usados desde há milhares de anos como chás na medicina popular, e tendo em conta toda a problemática associada à infecção pelo HSV, considerámos de grande interesse o estudo da sua atividade antiviral, no seguimento de outros estudos, que têm vindo a serem realizados nos Departamentos de Biologia Vegetal (DBV) e de Química e Bioquímica (DQB) da Faculdade de Ciências da Universidade de Lisboa (FCUL), (Silva, 2010 2; Rodrigues, 2011).
1.Os vírus Herpes Simplex
O presente trabalho insere-se no contexto de toda a problemática da infecção por HSV, pela constatação crescente de que estes vírus (relacionados com as feridas nos lábios e nos órgãos genitais) serem muito mais nocivos do que se pensava e aparecerem em grande percentagem na população. Os dois vírus fazem parte da Família Herpesviridae, uma das mais importantes em saúde pública, pois as doenças provocadas por estes vírus afetam milhões de pessoas em todo o mundo.
1.1 HSV-Histórico e Classificação
Erupções herpéticas são descritas desde os tempos da Grécia antiga, com inicio em descrições de lesões cutâneas nos escritos de Hipócrates, médico grego (460/377 A.C.). A palavra herpes deriva da palavra grega herpein, que significa rastejar, arrastar, devido ao aspecto das lesões vesiculares no trato bucal e ulcerações nos lábios. Estes sintomas caracterizavam a doença Herpes Febrilis descrita por Heródoto, historiador Grego (484/425 A.C.) (Whitley, 2001). Constata-se que houve uma epidemia tão grave de chagas labiais na Roma antiga que o imperador Tibério (14/26 D.C) proibiu os beijos nas cerimónias públicas (Leo,1982).
No século XVIII, Jean Astruc, relacionou as lesões herpéticas na pele com as infecções genitais e nos princípios do Sec. XIX, a natureza das lesões vesiculares associadas a infecções herpéticas foram caracterizadas, mas só em 1893 foi reconhecida a transmissão humana da infecção por HSV de individuo a individuo. (Whitley, 2001).
Em 1930, foi descrita pela 1ª vez a resposta imunológica do hospedeiro ao HSV. Os primeiros estudos foram realizados por Andrews e Carmichael que identificaram a presença de anticorpos neutralizantes para o HSV no soro, em doentes previamente infectados. Alguns destes doentes desenvolveram lesões labiais recorrentes e a observação destes acontecimentos levou ao reconhecimento de uma propriedade biológica única do HSV, a capacidade que o próprio vírus tem em recorrer mesmo na presença de imunidade humoral – reativação da infecção latente – conduzindo assim, ao conceito de latência vírica (Whitley, 2001).
No entanto, as infecções por herpes eram pouco frequentes e passavam um pouco despercebidas. Só desde o final da década de 60, com a revolução sexual, é que a doença tem tido efeitos devastadores entre pessoas sexualmente ativas (Leo, 1982).
Nos últimos 30 anos, com o desenvolvimento da Biologia molecular e da sua aplicação ao estudo das doenças humanas, ocorreram grandes avanços científicos que permitiram a deteção de diferenças biológicas e antigénicas entre os tipos de HSV, as quais foram demonstradas por Nahmias e Dowdle em 1968. Estes investigadores demonstraram que o HSV-1 estava associado a infecções não genitais enquanto o HSV-2 estava associado a infecções genitais (Whitley, 2001).
O grupo de estudo dos vírus Herpes da Comissão Internacional de Taxonomia dos Vírus (ICTV), classificou o HSV-1 e o HSV-2 como pertencendo à Família Herpesviridae. Os membros desta família foram divididos em 3 subfamílias: Alphaherpesvirinae, Betaherpesvirinae e Gammaherpesvirinae, que se distinguem umas das outras por diferentes características virais (estrutura genómica, tropismo celular, citopatologia e localização da infecção latente) e pelo poder patogénico e quadros clínicos que provocam. Por sua vez, as subfamílias foram divididas em géneros com base nas suas características imunológicas e as especificidades do hospedeiro e de acordo com parâmetros mais objetivos (sequência genómica). Assim, os HSV foram classificados na subfamília Alphaherpesvirinae e género Simplexvirus (Cleator & Klapper, 2004) a
Em 2002, o ICTV acordou que os vírus seriam descritos e identificados por números seriados e pela família ou subfamília na qual o hospedeiro natural do vírus é classificado (ex: herpesvírus humano 1, herpesvírus bovino 1). Os herpes estão altamente disseminados na natureza, encontrando-se em quase todas as espécies e foram até ao momento identificadas cerca de 130 vírus, dos quais nove são patogénicos para o homem (quadro 1)
Quadro 1 Classificação dos Vírus Herpes humanos (Adaptado de Cleator & Klapper, 2004)
Nome Oficial Subfamília Género Nome comum / Abreviatura
Herpesvírus humano 1 Alphaherpesvirinae Simplexvirus Vírus Herpes simples tipo 1 (HSV-1)
Herpesvírus humano 2 Alphaherpesvirinae Simplexvirus Vírus Herpes simples tipo 2 (HSV-2)
Herpes vírus humano 3 Alphaherpesvirinae Varicellovirus Vírus Varicela Zóster (VZV)
Herpesvírus humano 4 Gammaherpesvirinae Lymphocryptovirus Vírus Epstein-Barr (EBV)
Herpesvírus humano 5 Betaherpesvirinae Cytomegalovirus Cytomegalovirus Humano (CMV)
Herpesvírus humano 6A Betaherpesvirinae Roseolovirus HHV-6A
Herpesvírus humano 6B Betaherpesvirinae Roseolovirus HHV-6B
Herpesvírus humano 7 Betaherpesvirinae --- HHV-7
Herpesvírus humano 8 Gammaherpesvirinae Rhadinovirus Sarcoma de Kaposi associado ao vírus herpes
1.2 HSV-Patologias
A história natural e a patogénese da infecção pelo HSV têm sido entendidas paralelamente com as grandes descobertas, nomeadamente com os testes serológicos específicos que distinguem o HSV-1 do HSV-2, com drogas antivirais, já que algumas têm provado ser seletivas e especificas na inibição da replicação viral, e na técnica do PCR (amplificação em cadeia, do ácido desoxirribonucleico (DNA) Viral) que contribuiu para o conhecimento da patogénese e para o diagnóstico desta doença, particularmente no cérebro (Whitley, 2001).
O HSV-1 e o HSV-2 estão distribuídos mundialmente, mas em países subdesenvolvidos, onde as condições de higiene são muito limitadas, a presença de anticorpos HSV-1 é superior a 90% nas crianças com 2 anos de idade (Lourenço, 2002). O homem é o seu único reservatório e podem causar uma grande variedade de doenças. A infecção é caracterizada por fenómenos de latência e recorrência. As suas causas são provavelmente múltiplas e o seu mecanismo preciso está ainda por esclarecer.
A primoinfeção (PI) e a forma recorrente podem ser acompanhadas ou não de manifestações clínicas. A forma recorrente, sintomática ou inaparente ocorre apesar de estarem presentes anticorpos específicos, e constitui a principal fonte de disseminação dos vírus (Lourenço, 2002).
Os HSV 1 e 2 estão geralmente associados ao herpes labial e ao herpes genital, respetivamente. Mas o herpes genital também pode ser consequência de uma infecção por HSV-1 e o herpes labial de uma infecção por HSV-2. As infecções ocorrem após contacto com lesões herpéticas. As partículas virícas transmitem-se por contacto direto entre indivíduos, através da saliva, fluidos vesiculares e secreções genitais. As primeiras células “alvo” são as epiteliais junto à porta de entrada do vírus, que aí inicia a sua multiplicação. A lesão herpética inicia-se com uma pequena mancha pápula-eritematosa que inicia-se torna vesiculosa e cujo líquido é rico em partículas virais infecciosas.
O HSV-1 infecta as células epiteliais principalmente ao redor da boca e dos lábios- herpes labial (“fever blisters” ou “cold sores”) ou ocasionalmente a região ano-genital. Prescott, 2002) a.. É uma doença contraída maioritariamente durante a infância e na maioria
dos casos a PI é inaparente. Em certos indivíduos a severidade da doença pode ir de ligeira, envolvendo a mucosa bucal e gengival (gengivoestomatite), a severa, com dores, ulceração na boca, na língua, nas gengivas e face.
O Herpes ocular geralmente resulta de uma PI ou de uma infecção recorrente geralmente por HSV-1. A complicação mais frequente é a ceratoconjuntivite, úlcera da córnea. Em países desenvolvidos, nomeadamente nos EUA, é a maior causa de cegueira (Prescott, 2002) a.
O HSV-1 também pode originar infecções no sistema nervoso central (SNC), encefalite, que na maior parte das vezes é mortal; os sobreviventes, na maioria dos casos, ficam com graves sequelas neurológicas. (Nazareth et al., 2011).
Estudos também evidenciam a associação entre o HSV-1 e a doença de Alzheimer (Itzhaki & Wozniak, 2008).
A infecção por HSV-2 associa-se principalmente às zonas ano-genitais onde o vírus pode causar dolorosas vesiculas, no pénis do homem, na vulva, vagina, cérvix e períneo na mulher. As lesões podem ser acompanhadas por uretrite, cistite e adenopatias inguinais. Pode haver complicações mais graves como a meningite e
Fig1: Herpes labial. Fonte:
http://jornalvezevoz.blogspot.pt/
2010/05/herpes-verdades-e-mitos-sobre-doenca.html
Fig.2: Herpes genital (Fonte:
retenção urinária. O HSV-2 é principalmente transmitido por contacto sexual, por isso a infecção primária ocorre geralmente após adolescência. As recorrências podem ser silenciosas ou sintomáticas, numa população adulta com seroprevalência de 90 a 95% de pessoas infectadas apenas foram reportadas 38 a 45% de recorrências; por isso é grande a disseminação deste vírus, uma vez que a maioria das pessoas desconhecem estar ou haver sido infetadas (Cleator & Klapper, 2004) b.
A Organização Mundial de Saúde (OMS), estima que 536 milhões de pessoas em todo o mundo sejam portadoras de HSV-2, herpes genital, doença infecciosa, dolorosa e incurável, que pode causar a morte a recém-nascidos e a imunocomprometidos (WHO, 2003).
Recentemente, verificou-se o aumento da sua incidência em indivíduos infetados com o vírus da Imunodeficiência humana tipo 1 (HIV1), onde a presença de HSV-2 aumenta o risco de aquisição e transmissão do HIV1 (Freeman et al., 2006; Reynolds et al., 2001; Fleming et al., 1997), e pode acelerar a progressão da doença causada por este vírus (síndrome da imunodeficiência humana adquirida - SIDA) – considerada a doença emergente mais importante do século XX (Schatzmayr, 2001).
Estudos epidemiológicos mostram uma interação importante entre HSV e vírus do papiloma humano (HPV), sendo a infecção por HSV-2 associada a um aumento de risco para carcinoma cervical invasivo em mulheres positivas para DNA do HPV (Smith et al., 2002).
Em casos de herpes neonatal (por HSV-1 mas predominantemente por HSV-2), a infecção pode ser adquirida no útero, durante o parto, ou logo após o nascimento. A doença é grave, pois os recém- nascidos apresentam baixa imunidade. Pode haver lesão na pele, olhos, boca, encefalite e doença disseminada em múltiplos órgãos. Geralmente leva à morte.
A gravidade e duração das infecções por HSV, depende do estado imunitário do doente. Em doentes imunodeprimidos (doentes com SIDA, doentes com alto deficit de nutrição, doentes submetidos a transplantes e tratamentos neoplásicos), em recém-nascidos, em doentes com distúrbios cutâneos, como eczema ou queimaduras que permitem a extensa replicação e disseminação do vírus, tanto a infecção primária como a recorrente podem ser muito graves e originar complicações resultantes da disseminação visceral do vírus, incluindo no SNC.
Após a PI, o HSV como todos os Herpesvírus permanece no organismo durante toda a vida. Ele difunde-se através dos axónios até aos gânglios nervosos difunde-sensitivos, onde persiste num estado não replicativo, compatível com a sobrevivência celular (estado de latência). Provavelmente o seu genoma integra-se no genoma da célula hospedeira, tornando-se o vírus menos antigénico e por isso menos suscetivel ao ataque da resposta imunitária.
As recidivas (estimativas de 40% Herpes labial e 60% Herpes genital) podem ocorrer devido a situação de stress, febre, fadiga, baixa imunidade, infeção respiratória, exposição a luz ultra violeta (UV); os vírus voltam a migrar pelos axónios dos gânglios até à mucosa onde há produção de novos vírus por infecção celular (Cleator & Klapper, 2004) b.
A grande importância da infecção por HSV em saúde pública baseia-se, como tal, em termos de morbilidade, que pode ser caracterizada por uma longa incidência ou pela sua gravidade. Podem provocar infecções neonatais altamente letais ou diminuições físicas e mentais, malformações mais ou menos graves no feto. Malformações estas, que podem exigir cuidados diferenciados para toda a vida, obrigando a adoção de medidas de carácter social para auxilio daqueles que sofrem e das suas famílias. Estas doenças também podem afetar emocionalmente as pessoas que as padecem, levando a sentimentos de culpabilidade, desespero e
desgosto, provocando distúrbios entre casais e nas pessoas que as rodeiam. Há também a salientar os elevados custos que estas doenças acarretam para a sociedade, não apenas em termos de sofrimentos e perda de vida mas também em custos económicos. Logo se compreende a grande importância do controlo e tratamento das infecções pelo vírus Herpes, incidência do nosso trabalho.
2. Enquadramento teórico
Ao longo destes anos de confronto com o HSV, tem-se evoluído no conhecimento do vírus e do hospedeiro, desde a genética e morfologia do primeiro, à imunologia e fisiopatologia do segundo.
Só os compostos que afetam principalmente as vias especificas da replicação do vírus ou os seus componentes estruturais são uteis para tratar as infecções; por isso durante muito tempo foi difícil encontrar compostos que interferissem especificamente com a atividade viral sem causar prejuízos significativos para a atividade celular. A principal razão para a falta de sucesso no desenvolvimento destes fármacos é devido à própria natureza dos vírus (são parasitas intracelulares obrigatórios), que são totalmente dependentes dos processos metabólicos das células hospedeiras para a sua multiplicação e sobrevivência e muitas vezes os fármacos que os controlam são tóxicos para estas células (Madigan et al., 2002) b.
Por isso é de grande importância o conhecimento da sua estrutura e da interação biológica vírus-célula (mecanismo de infeção), para melhor compreender e ajudar na pesquisa e desenvolvimento de tratamentos eficazes contra estas infecções.
2.1 HSV - Morfologia e estrutura
O vírus Herpes Simples é um vírus de grandes dimensões, a sua morfologia observada ao microscópio eletrónico é similar para todos os membros da família, revelando uma partícula viral esférica, com cerca de 150 a 200 nm de diâmetro. É constituído por quatro elementos estruturais: um core, zona densa de eletrões, que contem o genoma viral; uma cápside icosaédrica com 162 capsómeros rodeando o core (o genoma juntamente com a cápside formam a nucleocápside); um tegumento de constituição amorfa e assimétrica, que envolve a nucleocápside e um invólucro lipídico, elemento externo do vírus
com projeções glicoproteicas na sua superfície (Cleator & Klapper, 2004b; Roizman & Knipe, 2001a; Prescott, 2002
b
; Madigan, et al., 2002 c).
O core contém DNA linear de cadeia dupla com cerca de 150 kpb, que contem pelo menos 50 a 100 genes. Existem sequências para a codificação de pelo menos 80 proteínas diferentes. A sequência completa do genoma do HSV-1 consiste em 152.260 pb e a do HSV-2 em 154.746 pb. O DNA dos viriões contém 68% de G+C no HSV-1 e 69% no HSV-2 (Roizman & Knipe, 2001a; Madigan et al., 2002 a).
O genoma é constituído por 2 segmentos ligados covalentemente, um longo (L) e um Curto (S). Cada um contém sequências únicas e são flanqueados por sequências repetidas invertidas. O DNA está empacotado
Fig 4: Regiões do genoma HSV-1. (Fonte: Carter.& Saunders, 2007)
Fig.3: Imagem da Estrutura do HSV obtida por M.E.
Observa-se a nucleocápide, tegumento e o invólucro com as glicoproteínas. adaptado de : http://Darwin.bio.uci.edu/~faculty/wagner/hsv2f.html
numa forma em que as extremidades do genoma estarão muito próximas pois ele circulariza muito rapidamente após libertação da cápside e entrada no núcleo da célula hospedeira.
A cápside, de natureza proteica, apresenta simetria icosaédrica, medindo cerca de 100 nm de diâmetro. É constituída por 162 capsómeros (150 hexâmeros nas faces e bordos e 12 pentâmeros nos vértices) que envolvem e estabilizam fisicamente o DNA, cada um dos quais compreende várias proteínas. Fazem parte da cápside as proteínas VP5, VP19c, VP21, VP23, VP24 e VP26, denominadas polipétideos do vírião (codificados na região UL) (Roizman & Knipe, 2001)
a
.
O Tegumento é a estrutura amorfa entre o invólucro e a nucleocápside. Está distribuído assimetricamente, dependendo da localização do virus na célula infectada. É constituído também por proteínas: vhs (vírus host shut off), VP16 (-TIF, ICP25), VP11-12, VP13-14, VP1-2. Algumas destas proteínas apresentam funções importantes nas fases iniciais da replicação viral, logo a seguir à penetração do virião na célula. A vhs é responsável pela degradação do RNAm celular e a -TIF é responsável pela formação do complexo pré-inicial, dando origem ao processo de transcrição viral (Roizman & Knipe, 2001) a.
O invólucro, de natureza lipoproteica é a estrutura externa do vírus. Consiste numa bicamada lipídica de natureza celular que contem na sua superfície espiculas (glicoproteínas do vírus), que são mais numerosas e pequenas que aquelas que aparecem na superfície de outros vírus com invólucro (Cleator & Klapper, 2004) a. Estudos de microscopia eletrónica mostram que o invólucro viral tem a típica aparência trilaminar e parece derivar das membranas celulares, modificado pela inserção das glicoproteínas virais. Das cerca de 30 proteínas diferentes, conhecidas do vírião, pelo menos 11 encontram-se na superfície externa do invólucro e pelo menos 10 são glicosiladas, (glicoproteínas, gB, gC, gD, gE, gG, gH, gI, gK, gL, gM), que estão diretamente envolvidas na adsorção e penetração dos vírus à célula hospedeira e resposta imunológica. As maiores diferenças antigénicas entre HSV-1 e HSV-2 encontram-se em algumas destas proteínas de superfície, nos seus epítopes específicos. (Cleator & Klapper, 2004) b. Apresentam diferentes massas moleculares, capazes de conferir identidade antigénica e biológica aos vírus (Lupi, 2003). A gG apresenta diferenças a nível da sequência de aminoácidos suficientes para ser utilizada como marcador na serotipagem do HSV-1 e HSV-2 (Cheshenko & Herold, 2002). As gB, gC e gD apresentam importância crítica em relação à resposta imunológica anti-HSV, sendo indispensáveis para a replicação viral nas células infectadas. As gB e gC participam na adsorção inicial à célula, por ligação com o recetor sulfato de heparina e a gD participa na adsorção logo a seguir, por ligação com outros recetores e na penetração e libertação posterior do virião. As gE e gI são recetores para as IgG, a gH e gC para a fração C3b do complemento. Por isso os anticorpos anti-HSV não protegem uma infeção por estes vírus (Lupi, 2003; Rux, 2002). A gB do HSV-2 e outras glicoproteínas (gD e gH-gL) são alvos importantes no desenvolvimento de terapias, tais como microbicidas tópicos que poderão prevenir a transmissão sexual e perinatal do HSV-2 (Cheshenko & Herold, 2002).
Por outro lado a existência do invólucro confere grande fragilidade às partículas virais e condiciona o seu modo de replicação e propagação (Lourenço, 2002).
2.2 HSV - Ciclo replicativo
Toda a interação do vírus com a célula, nomeadamente a sua ligação, a sua entrada, a desagregação da cápside, transcrição e síntese proteica, replicação do DNA, montagem do vírião e saída da célula são os pontos essenciais na replicação viral e alvos importantes no desenvolvimento de terapias.
Os vírus HSV são caracterizados por apresentarem um ciclo replicativo curto, citolítico (em culturas celulares totalmente permissivas todo o processo leva cerca de 18 a 20 horas (Roizman, & Knipe, 2001) a,b). A infecção começa quando o vírus é introduzido numa lesão da pele ou
membrana mucosa (oral ou genital). A sua entrada nas células envolve várias interações entre as glicoproteínas da superfície externa do invólucro viral e os componentes (recetores) da superfície das células permissíveis. Esta entrada é realizada em três etapas (Carter & Saunders, 2007):
▪ Ligação inicial do virião à superfície celular, mediada pela fixação das glicoproteínas virais gC e gB a proteoglicanos, principalmente moléculas de sulfato de heparina. Estas moléculas são normalmente recetores para a adsorção inicial às células, comum para os dois vírus, existindo diferenças nos diferentes tipos de células e na suscetibilidade. As células epiteliais da zona genital expressam uma sequência de sulfato de heparina que reconhece preferencialmente a gB do HSV-2, por isso, esta glicoproteína é essencial na adsorção inicial à célula, sendo maior a taxa de adsorção com esta proteína que com a proteína gC. Enquanto as
células da mucosa oral expressam uma sequência de sulfato de heparina que reconhece preferencialmente a proteína gC do HSV-1; gB também é importante na adsorção inicial mas a gC é essencial (Cheshenko & Herold, 2002). As células que não têm estes glicosaminoglicanos expressam outros, e também podem ser infectadas mas com menor eficiência.
▪ Interacções específicas da proteína gD com outros recetores celulares (superfamília das imunoglobulinas; família dos fatores de necrose tumoral), logo a seguir à adsorção de gB e gC (Spear & Martinez, 2002).
▪ Fusão do invólucro com a membrana citoplasmática, (Roizman & Knipe, 2001) b
.
Nesta 3ª e última fase, o invólucro viral funde-se com a membrana celular, com libertação da nucleocápside e do tegumento no citoplasma da célula (envolvendo também a ação de algumas glicoproteínas virais (gB, gH/gL) (Carter & Saunders, 2007; Roizman & Knipe, 2001b).
A fase de adsorção e penetração do vírus na célula hospedeira é bastante importante e pode ser alvo de drogas antivirais, pois requerem interações entre estruturas específicas do vírus e recetores da membrana plasmática.
Uma vez no citoplasma, a nucleocápside, juntamente com algumas proteínas do tegumento migram através do citoesqueleto (microtúbulos) para os poros da membrana nuclear. O DNA viral e uma proteína do tegumento, a -TIF, também designada por VP16 ou ICP25 são libertados no núcleo. A VP1-2 (do tegumento) terá um papel importante nesta libertação. Uma outra proteína do tegumento, a vhs permanece no citoplasma onde causa a desagregação dos polirribossomas da célula e do RNA celular, inibindo assim, a síntese de proteínas e o metabolismo celular.
A transcrição do genoma viral, replicação do DNA e montagem das novas cápsides ocorre no núcleo. O DNA ao ser libertado no núcleo circulariza imediatamente e vai ser transcrito pela polimerase celular de RNA tipo II, com participação de fatores virais.
Fig 5: Fases iniciais da infecção: adsorção, fusão e
penetração (Fonte: http://darwin.bio.uci.edu/~faculty/wagner)
A síntese de produtos génicos é altamente regulada numa ordem sequencial em forma de cascata (mais de 80 proteínas são expressas) e pode ser dividida em 3 fases: α ou imediata precoce, β ou precoce e γ ou tardia. Os produtos resultantes de cada fase levam à expressão dos genes da fase seguinte. A expressão dos genes imediatos precoces é ativada pela
α-TIF por ligação a proteínas celulares incluindo a OCT-1 e C1. Formam um complexo ativador transcricional com ligação aos promotores desses genes (Roizman & Knipe, 2001a; Cleator & Klapper, 2004b). A síntese proteica dos produtos imediatos precoces atinge máximos entre as 2 e as 4 horas pós infecção (h.p.i.). Nesta fase são transcritos 5 genes α, os RNAm correspondentes são transportados para o citoplasma onde ocorre tradução das 5 proteínas α, (ICP0, ICP4, ICP22, ICP27 e ICP47), que são transportados para o núcleo onde vão desempenhar funções regulatórias e ativação dos genes β. Da expressão dos genes β (precoces) resulta a síntese de enzimas envolvidas no metabolismo do DNA (redutase de ribonucleótidos, cinase de timidina, desoxirribonuclease (DNase), etc), e na sua própria síntese, (polimerase de DNA e helicase / primase). A cinase de timidina e a polimerase de DNA são os principais alvos terapêuticos atuais, uma vez que são diferentes das enzimas celulares. Esta síntese é observada entre as 4 e as 8 h.p.i iniciando-se então a replicação do DNA e a transcrição dos genes γ (tardios). Estes genes têm a informação para a síntese de proteínas estruturais da cápide, necessárias à sua montagem, e outras, nomeadamente proteínas do tegumento e glicoproteínas (Roizman & Knipe, 2001) a.
A replicação do DNA é realizada através de um mecanismo de círculo rolante. (Cleator & Klapper, 2004b; Roizman & Knipe, 2001a; Carter & Saunder, 2007). É iniciada numa origem de replicação, por interação de proteína UL9, o complexo helicase / primase associa-se para criar a bolha de
iniciação onde depois o complexo polimerase de DNA / UL42 inicia a síntese de DNA.
A redutase de ribonucleótidos reduz ribonucleótidos a desoxirribonucleótidos criando uma pool de substrato para a síntese de DNA. A cinase de timidina fosforila pentosidos de purinas e análogos de nucleósidos. O resultado é a síntese de DNA numa forma longa concatemérica, que vai sendo clivada em monómeros, e estes, são empacotadas em cápsides pré-formadas (montagem das nucleocápsides). Proteínas do tegumento associam-se à nucleocápside na membrana nuclear e por
fusão com a membrana interna adquirem um invólucro temporário. Ao fundirem-se com a membrana nuclear externa perdem este invólucro. No citoplasma as nucleocápsides são reenvelopadas por vesiculas derivadas do complexo de
Golgi, já com as glicoproteínas virais. Os novos viriões são transportados para o exterior da célula infectada. Esta infecção produtiva da célula produz cerca de 50.000 a 200.000 vírus, resultando na sua destruição devido a todas
Fig.6: Ciclo replicativo do HSV. (Adaptado de Carter & Saunders, 2007)
Fig.7: Aquisição, perda, e nova aquisição
do invólucro do vírus através da passagem pelas membranas. (Fonte: Http://darwin.bio.uci.edu/~faculty/wagner) 4 5 6 7 3 1 2 4 4 4
1-Adsorção 2-Penetração 3-Transcrição 4- Tradução 5-Replicação do genoma 6- Montagem 7- Saída da célula
as alterações estruturais e bioquímicas induzidas por esta replicação do vírus. Quando há sintomatologia observam-se feridas labiais, genitais que são o resultado desta lise celular e da resposta inflamatória local, uma vez que o fluido presente nas feridas contém grandes quantidades de vírus, resto de células e células de defesa (Prescott, 2002) a.
2.3 Terapia atual
A terapia antiviral no geral engloba, virucidas, compostos que atuam na partícula viral intacta, antivirais que inibem a replicação do vírus e imunomoduladores que são uma classe de compostos que potencia a resposta imunológica do hospedeiro.
Pretende-se que um antiviral tenha um amplo espectro, uma inibição completa da replicação viral, tenha capacidade de atingir o alvo sem interferir com o sistema imune do hospedeiro, toxicidade mínima e atividade frente a mutantes resistentes.
Desde a descoberta em 1959 do primeiro composto, que análogos de nucleósidos dominam a terapia antiviral. Estes fármacos atuam por competição com nucleósidos naturais pela incorporação no DNA viral tornando-se impossível o alongamento da cadeia, interrompendo o processo da replicação viral. A 1ª geração destes nucleósidos, inicialmente usados no tratamento da infecção por HSV incluindo a iodoxuridina, a trifluorotimidina, a vidarabina e a citarabina, inibem a replicação viral com diferentes graus de eficácia. A sua utilização sistémica é limitada devido à sua alta toxicidade, por isso o seu uso é tópico (De Clercq & Field, 2006).
Os avanços no conhecimento da biologia molecular possibilitaram a identificação de enzimas necessárias à replicação viral conseguindo-se diferenciar as funções celulares do hospedeiro.
O maior avanço na terapêutica foi a síntese do aciclovir (9- (2-hydroxyethoxymethyl) guanine, análogo da desoxiguanosina) por Schaeffer, o primeiro de uma segunda geração de análogos de nucleósidos (Elion et al.,1977). Foi a primeira droga específica e seletiva a ser comercializada, servindo de protótipo para futuras drogas antivirais. Desde então, o aciclovir (nome comercial Zovirax) tem sido utilizado como o agente antiviral mais importante no tratamento da infecção pelo HSV, tanto de forma profilática em doentes com risco de reativação do vírus, quanto no tratamento. Apesar de não erradicar o vírus é seletivo (apresenta alta afinidade seletiva para a cinase de timidina viral) porque a primeira fosforilação que ele sofre é catalisada pela cinase de timidina viral garantindo a sua eficácia e segurança. Seguidamente cinases celulares executam as fosforilações subsequentes produzindo o aciclovir trisfosfatado, a forma biológica ativa que atua como inibidor competitivo da polimerase de DNA, e ao ser incorporado no DNA não permite o seu alongamento (Cleator & Klapper, 2004b; De Clercq, 2001; Lourenço, 2002). Contudo, o aciclovir apresenta baixa solubilidade aquosa e baixa biodisponibilidade por administração oral (De Clercq & Field, 2006).
Com a emergência da SIDA na década de 80, houve grande esforço para encontrar medidas eficazes para o controlo desta doença, e em muito pouco tempo se conseguiu avanços importantes no controlo do vírus, com agentes eficazes (Madigan, et al., 2002) b.
Nos anos 90, novas drogas, análogas dos nucleósidos, relacionadas com o aciclovir foram lançadas no mercado, constituindo até hoje o grupo de compostos mais usados. Vieram solucionar o problema da biodisponibilidade do aciclovir, são bem absorvidas no trato gastrointestinal e rapidamente metabolizadas. (De Clercq & Field, 2006; Cleator & Klapper, 2004b).São eles o ganciclovir, valaviclovir, famciclovir e o penciclovir,
análogos da guanosina como o aciclovir, constituindo juntamente com este, o tratamento de primeira escolha contra a infeção pelo HSV.
Existe um outro fármaco que também inibe a síntese de DNA viral, o foscarnet que é um análogo não nucleósido (análogo do pirofosfato inorgânico) e não precisa de fosforilação. Apresenta toxicidade considerável, o seu uso é somente em casos de infecções por estripes resistentes aos análogos dos nucleósidos – constituindo o tratamento de segunda linha (Swierkosk, 2004; Cleator & Klapper, 2004b).
Apesar do aciclovir e respetivos pró-fármacos serem drogas seletivas tem-se verificado o desenvolvimento de resistência em doentes sujeitos a esta medicação durante longos períodos e em doentes imunodeprimidos, a qual deverá estar ligada ao surgimento de mutações nos genes que codificam as enzimas necessárias à replicação viral (Christophers et al., 1998).
No HSV a resistência aos análogos de nucleósidos está relacionada com mutações nos genes da cinase de timidina viral e / ou da polimerase de DNA viral, (Suzutani et al., 2003; Andrei et al., 2005 a).
Independentemente destes fármacos se tornarem ineficazes quando é estabelecida a resistência aos mesmos, os seus efeitos secundários também devem ser considerados. A Idoxuridina e a trifluorotimidina (usadas na ceratite herpética) possuem grandes efeitos tóxicos. Tanto o ganciclovir (o mais tóxico), o foscarnet e o aciclovir podem levar a alterações renais e consequentemente falha no funcionamento renal e também estão relacionados com neurotoxicidade (Olin & Gugliota, 2003; Smith et al., 2010).
Estes, tal como outros antivirais, não eliminam a infeção viral do organismo, mas atuam reduzindo a virulência ou retardando o seu desenvolvimento ao inibir a produção do vírus (inibindo a síntese de DNA), não tendo também por isso, qualquer ação na fase latente.
Um tratamento antiviral ideal deveria reconhecer e inibir o mais especificamente possível a replicação viral, sem no entanto afetar as células do hospedeiro, atuar na partícula viral e no mecanismo que permite a latência.
O aumento significativo de estirpes resistentes a estes fármacos (principalmente em doentes com infecções virais crónicas), e a toxicidade dos antivirais conhecidos, leva à procura de novos agentes que atuem por outro processo, os substituam ou complementem. É necessário a descoberta de novas alternativas terapêuticas efetivas para a infecção por HSV, à base de substâncias com potente ação antiviral e com um mínimo de efeitos secundários nomeadamente a toxicidade para a célula hospedeira.
Atualmente, são numerosos os estudos nesta área, de novos produtos, principalmente naturais (Kuo et al., 2002; Cheng et al., 2004).
2.4 Estudos biológicos de produtos naturais
Nos últimos anos tem-se verificado um grande avanço científico envolvendo estudos químicos, farmacológicos e avaliação do potencial terapêutico de certas plantas medicinais e de seus constituintes, onde já foram comprovadas ações farmacológicas (Filho & Yunes, 1998).
Apesar da Medicina moderna estar disponível, a medicina tradicional, à base de plantas tem sido assunto de interesse mundial, como alternativa. Os produtos naturais, tanto compostos purificados, quanto os extratos de plantas são uma grande fonte de novas moléculas com possíveis efeitos farmacológicos devido à sua grande diversidade química. Muitos destes produtos já são explorados há milhares de anos, incluindo o seu uso em alimentos, fragâncias, inseticidas, e na medicina popular como analgésicos, antipiréticos, anti-inflamatórios etc.
Para além deste seu uso é importante salientar a sua contribuição ao longo dos anos para a obtenção de vários fármacos utilizados na clinica, como por exemplo a morfina, emetina, colchicina, rutina, etc. Outro aspeto a ressaltar é a quantidade de plantas existente no planeta, sendo a maioria desconhecida sob o ponto de vista científico. Entre 250 a 500 mil espécies conhecidas só 5% têm sido estudadas fitoquimicamente e uma percentagem menor avaliada sob os aspetos biológicos (Filho &Yunes, 1998).
A organização mundial de saúde (OMS) estima que 80% da população asiática e africana dependam deste sistema tradicional de saúde para cuidados de saúde primários, e em países desenvolvidos 70% a 80% da população usam este sistema como alternativa ou complemento da medicina clássica (WHO, 2008). Por isso é de grande importância a validação científica do potencial terapêutico destes remédios tradicionais.
O acesso a uma grande diversidade de compostos antioxidantes e anti-inflamatórios de fontes naturais tornou-se bastante significativo, o seu conhecimento encorajou o estudo na prevenção e tratamento de algumas doenças humanas, nomeadamente infeções. Extratos de plantas e seus componentes, tem sido objeto de estudo com o objetivo de encontrar produtos menos tóxicos e com atividade antiviral. Esta atividade já foi demonstrada em alguns trabalhos: (Appendino et al., 2007; Cheng et al., 2004; Swarup et al., 2007; De Logu et al., 2000). Em Portugal temos os estudos de Batista et al. (1995) e Gaspar-Marques et al. (2008) que estudaram a atividade anti-herpética de duas espécies do género Plectranthus (Família Lamiaceae).
Estudos biológicos com plantas da flora portuguesa são ainda relativamente limitados. Apenas a partir de 1999, com o projeto “Aromátic and / or Medicinal Plants in the National Network of Protected Areas”, desenvolvido pelo Instituto da Conservação da Natureza, se iniciou a investigação etnobotânica de espécies da flora Portuguesa com interesse industrial (Camejo-Rodrigues, 2003; 2007).
A introdução de medicamentos à base de plantas para uso humano está regulamentada na legislação Portuguesa pelo Decreto-Lei nº 176/2006 de 30 Agosto.
É muito comum em Portugal, como no mundo inteiro a utilização de plantas em chás, emplastros e fumigatos, nos tratamentos de diversas doenças. Esta utilização vem por indicação de familiares, vizinhos e amigos, sendo esse conhecimento transmitido de geração em geração. Dados da literatura revelam que é muito mais provável encontrar atividades biológicas em plantas orientadas pelo seu uso na medicina popular do que em plantas escolhidas ao acaso (Filho,V.C. & Yunes, R.A.,1998) e as modernas tecnologias permitem identificar os seus compostos ativos e dar explicações sobre seus efeitos benéficos.
Espécies das Famílias Asteráceae e Lamiaceae são das mais usadas na medicina popular portuguesa, merecendo por isso da parte da ciência, a verificação da sua segurança, eficácia, qualidade e potencialidades terapêuticas, nomeadamente estudos de ação antiviral, objeto de estudo do presente trabalho.
2.4.1 Helichrysum italicum (Asteraceae)
O género Helichrysum Miller pertence à Família Asteraceae, e Subfamília Asteroideae, contém cerca de 500 a 600 espécies, distribuídas pelo sul da Europa, sudoeste da Asia, sul da India, Austrália e Africa (Lourens et al., 2008). O nome Helichrysum deriva das palavras gregas hélios (sol) e chreysos (ouro), devido às suas atrativas flores amarelas. Pertencem a este género espécies aromáticas, ocorrendo em Portugal a subespécie Helichrysum italicum ssp. picardi Boiss & Reuter, conhecida vulgarmente por perpetua-das-areias .
Fig.8: Helichrysum italicum, Dunas da lagoa de
Encontra-se principalmente nas areias da costa do Baixo Alentejo e barlavento Algarvio. Pelo seu aroma intenso a caril os ingleses batizaram-na de Curry plant, sem nada ter relacionado com o caril da cozinha indiana. É uma das plantas medicinais mais conhecidas na zona da bacia mediterrânica, crescendo em solos arenosos nas dunas do litoral. Este género é bastante usado na medicina popular em todo o mundo devido às suas propriedades anti-inflamatórias atribuídas principalmente à presença de flavonoides (Sala et al., 2001, 2003; Appendino et al., 2007).
No sul de África é muito usado na medicina tradicional, datando já de 1727 os primeiros manuscritos onde é referido como tratamento de crises nervosas e histeria. Também é usado no tratamento de distúrbios gastrointestinais, dores abdominais, dores de cabeça e principalmente no tratamento de infeções respiratórias. Toda a parte da planta é usada e pode ser administrada através de chás, inalação e fumigatos (Lourens et al., 2008).
Estas espécies são constituídas de um modo geral por flavonoides, diterpenos, sesquitepernos, acetofenonas, floroglucinol responsáveis pelas suas propriedades medicinais (Lourens et al., 2008). Mas há que ter prudência no seu uso pois estudos realizados por Eroğlu et al. (2009), indicaram efeitos genotóxicos e mutagénicos de algumas espécies de Helichrysum em culturas de linfócitos humanos.
Vários estudos têm sido realizados em várias espécies demonstrando atividades antioxidantes (Tepe et al., 2005; Albayrak et al., 2010) e antibacteriana (Albayrak et al., 2010). Foi demonstrada atividade anti-HSV na espécie Helichrysum aureonitus (Meyer et al., 1996) e na espécie Helichrysum italicum atividades anti-HIV1 (Appendino et al., 2007), atividades anti-inflamatórias (Appendino et al., 2007; Sala et al., 2001, 2003), e atividades antibacterianas (Nostro et al., 2002, 2004). As atividades biológicas de espécies de Helichrysum têm sido estudadas em diferentes países, mas são muito poucos os estudos com plantas da flora Portuguesa. Palmeira-de-Oliveira e colaboradores em 2011, desenvolveram um lápis medicamentoso de Helichrysum italicum para o tratamento do Líquen escleroso. Rodrigues, (2011) realizou um estudo sobre as propriedades biológicas de extratos aquosos desta espécie.
2.4.2 Solidago virgaurea (Asteraceae)
É uma planta elegante com folhas lanceoladas e flores, cresce até 1 m de altura, preferindo os ares da montanha. As suas flores dispostas em espiga, apresentam uma inflorescência de cor amarela intensa. A espécie
Solidago virgaurea é a única espécie nativa da Europa, vulgarmente
conhecida por Vara-de-ouro (Johnson et al., 2007). Floresce de Junho a Setembro. É muito usada na medicina popular, como anti-inflamatório, antimicrobicida,antineoplásica, analgésica e antipirética (Thiem & Goslinska, 2002). Há quase 700 anos que algumas espécies de Solidago na Europa, são usadas na fitoterapia, no tratamento do trato urinário, em nefrites crónicas, cistites, urolitíase e problemas da próstata (Apati et al., 2003; Thiem & Goslinska, 2002). No Brasil, Bagatini et al. (2009) referem o uso de Solidago microglossa, em desordens estomacais. Sung et al. (1999) referem o uso da espécie Solidago virgaurea no tratamento de bronquites, úlceras e laringites.
Plantas do género Solidago contêm saponinas, diterpenos, terpenoides, ácidos fenólicos, óleo essencial e grandes quantidades de flavonóides nomeadamente rutina e quercetina (Tamura et al., 2009).
Fig.9: Solidago Virgaurea. (Fonte:
http://www.pbase.com/ceya/image/136275385
Vários estudos têm sido feitos para validar os seus usos na medicina popular. Apati et al. (2003) demonstraram propriedades antioxidantes deste género. No Brasil Morel et al. (2006), demonstraram a atividade antimicrobiana do extracto metanólico da espécie Solidago microglossa, do seu óleo extraído das partes aéreas e de outros componentes isolados frente a várias estirpes de bactérias e leveduras. Foi também demonstrado o poder cicatrizante de Solidago microglossa por Neto et al. (2004). Foram demonstradas propriedades analgésicas por Silva et al. em 2010 1 no tratamento da dor lombar assim como propriedades anti-inflamatórias por Tamura et al., (2009) em extratos de Solidago chilensis. Também foram realizados estudos de citotoxicidade por Bagatini et al., (2009) em Solidago microglossa e por Sung et al., (1999) em Solidago virgaurea var. gigantea. Thiem & Góslinsk na Polonia, em 2002, evidenciaram a atividade antimicrobiana de extratos etanólicos e metanólicos de culturas in vitro de Solidago virgaurea, também Demir et al., em 2009 demonstraram a mesma atividade juntamente com a antioxidante de extratos de Solidago virgaurea.
3. Objetivos
Tendo em conta o enquadramento teórico atrás referido, o objetivo geral deste trabalho foi:
Avaliar e caracterizar in vitro, a atividade anti-herpética (anti-HSV-1 e anti-HSV-2) de extratos aquosos obtidos por decocções de folhas/caules e flores de duas espécies de Asteraceae da flora Portuguesa:
Helichrysum Italicum L.SSP.Picardi Boiss & Renter Solidago virgáurea L.
Os objetivos específicos na avaliação desses extratos aquosos foram: Estudo da sua citotoxicidade em células Vero.
Estudo do seu efeito virucida (efeito direto na partícula viral). Estudo do seu efeito no ciclo replicativo.
4.Quadro metodológico
A avaliação da atividade anti- herpética dos compostos efetuou-se diretamente sobre suspensões virais e em células infectadas.
A fase inicial de pesquisa de novos antivirais geralmente envolve rastreio relativamente à sua interferência na replicação viral em culturas celulares. Dado que os HSV, como todos os vírus, só se replicam no interior de células vivas, a sua replicação requer o uso de hospedeiros adequados. Apesar do homem ser o seu único reservatório natural, os vírus Herpes simplex são facilmente cultiváveis e propagáveis em laboratório, podendo infetcar culturas celulares permissivas.
As células utilizadas neste trabalho foram células Vero, de linhagem continua. Esta linhagem celular é normalmente utilizada em estudos in vitro de replicação viral e ensaios em placa, pois são sensíveis à infeção por vários vírus, nomeadamente os herpes. Mantêm-se viáveis após sucessivas passagens, crescendo em monocamada a 37ºC, aderentes às paredes de frascos ou placas, em meio líquido que contenha aminoácidos e fatores de crescimento, necessários ao seu metabolismo, e ao qual se adiciona antibióticos para evitar contaminações.
Estes estudos também envolvem a incubação de células não infectadas com os compostos, para análise de danos celulares (morte ou inibição da replicação celular), de modo a evitar escolher compostos e ou
concentrações que inibam a replicação viral devido aos seus efeitos tóxicos nas células. Por outro lado, pretende-se que qualquer candidato a fármaco aprepretende-sente toxicidade mínima ou nenhuma para a célula hospedeira.
A citotoxicidade foi avaliada por observação da morfologia celular até 72 horas de incubação através de um invertoscópio com objectivas de contraste de fase, e através do ensaio quantitativo de redução mitocondrial do sal de tetrazolium (MTT). Este ensaio baseia-se na redução do sal Tetrazólio – MTT (Composto hidrossolúvel que apresenta cor amarelada em solução) por redutases (desidrogenases) mitocondriais de células metabolicamente ativas, formando-se cristais azuis de formazano, insolúveis em água que se depositam no citoplasma celular. Estes cristais são solubilizados através de um solvente orgânico, por exemplo o dimetilsulfóxido (DMSO) e posteriormente analisados por espectrofotometria, com leitura a 570 nm. As desidrogenases mitocondriais são enzimas apenas ativas em células com metabolismo e cadeia respiratória intacta. Deste modo, quanto menor for a viabilidade celular menor será a redução do MTT e menor a coloração (menos cristais de formazano formados), logo menor o sinal espetrofotométrico. O teste MTT foi efetuado de acordo com o descrito por Mosmann (1983), com algumas modificações.
Através deste ensaio determinamos a concentração máxima não citotóxica (CMNC), a que corresponde à quantidade máxima do extrato tolerado pelas células sem lhes provocar a morte, isto é, a que apresenta uma viabilidade perto da do controlo (100%). Foi determinada também a concentração que inibe em 50% a viabilidade celular (CC50). Estas concentrações foram obtidas por regressão linear, relacionando as percentagens de
viabilidade celular em função das concentrações testadas.
O primeiro ensaio para avaliar a atividade anti-herpética dos extratos foi a determinação do efeito virucida, isto é, estudou-se o efeito dos produtos diretamente sobre as partículas virais através de incubações em diferentes tempos, seguindo-se as respetivas titulações.
Quando os compostos apresentam um efeito virucida observa-se um aumento na taxa de inibição da infecciosidade como consequência da diminuição do título do vírus. O título do vírus, isto é, a sua quantificação, foi realizado através do ensaio da redução da infecciosidade em placa. Este, é o ensaio biológico quantitativo mais utilizado para vírus. É um ensaio de infecciosidade em culturas celulares. Foi originalmente desenvolvido para estudo de bacteriófagos por d’Herelle em 1900, e foi adotado para vírus animais por Dulbecco e Vogt em 1953, baseado na capacidade que uma partícula viral infecciosa tem em originar uma área macroscópica de citopatologia numa cultura de células em monocamada (Condit, 2001).
Os vírus Herpes podem ser quantificados através dos seus efeitos nas células hospedeiras que infectam. Neste contexto uma unidade vírica infecciosa é a unidade mais pequena que causa um efeito detetável num hospedeiro suscetivel (Madigan et al., 2002) c. Mediante a detecção do número de unidades infecciosas por volume de amostra pode-se obter uma estimativa da quantidade de vírus. Esse efeito detetável em células que crescem em monocamada, é geralmente uma zona de lise, zona de destruição de células devido à infeção viral, que se traduz no aparecimento de uma área clara chamada placa. Assume-se que cada placa é originada a partir da replicação de um único virião. Para tal acontecer é adicionado, a seguir à infecção um meio tal, em que os vírus libertados de uma só célula apenas se possam propagar às células vizinhas, permitindo conter estes vírus só nas vizinhanças da primeira célula infectada e assim possam formar focos de infecção ou placas. Após um período conveniente de incubação, podem-se contar as placas formadas (zonas claras) depois de coloração das células viáveis. O poder infectante é expresso pelo número de unidades formadoras de placas por mililitro (PFU/ml).
A evidência que o composto interfere com a partícula viral pode ser quantificada através do ensaio de redução de placas ou seja, pela inibição da formação de placas virais devido à redução da sua infecciosidade em consequência da incubação com o agente antiviral. É o ensaio de referência de testes de suscetibilidade do HSV (Swierkosz et al., 2004).
Realizamos também o estudo da atividade anti-herpética utilizando os extratos na sua CMNC nos ciclos replicativos dos vírus em estudo. Estes ensaios foram realizados em diferentes estágios de infecção viral. Esta abordagem permite verificar se a produção de novas partículas virais é afetada quando se adicionam as substancias a estudar a células infectadas ou anteriormente à infecção, e poderá também elucidar sobre a fase do ciclo replicativo do vírus em que os extratos poderão atuar, comparando os resultados com os das células infectadas nas mesmas condições, mas não tratadas com osextratos.
Nos casos em que se verificou um efeito antiviral (houve uma redução significativa dos títulos dos vírus produzidos naquelas condições experimentais) foi avaliada a sua ação na síntese e processamento de proteínas virais por análise eletroforética de proteínas virais e de células infectadas.
Durante os procedimentos realizaram-se vários controlos: células não tratadas com os extratos e não infectadas, células tratadas e não infectadas, células infectadas e não tratadas, células incubadas com DMSO, vírus incubados com DMSO e células infectadas e tratadas com um composto de síntese química (ácido rosmarínico), que foi identificado como sendo o componente principal da atividade anti-herpética de extratos de
Melissa officinalis usados para tratar lesões cutâneas provocadas por infeções por Herpes Simplex (Tóth et al.,
2003, Gaby, 2006; Mazzanti et al., 2008; Sanchez-Medina et al., 2007); está presente na maior parte das espécies da família das Lamiaceae e apresenta interessantes propriedades biológicas: antivírica (Swarup, et al., 2007), antibacteriana, anti-inflamatória e antioxidante (Petersen & Simmonds, 2002; Falé et al., 2009) e ainda antiacetilcolinesterase (Falé et al., 2009).
A B
Fig.10 Placas virais. A - Vírus não
tratado (controlo). B - Vírus tratado. É visível a redução de placas na presença do agente antiviral.
II. PARTE EXPERIMENTAL
Todos os procedimentos que envolveram o manuseamento de culturas celulares e de vírus foram realizados em condições de assepsia e segurança. Trabalhou-se numa câmara de fluxo laminar classe II (Biohazard) mantendo assim o ambiente estéril de modo a evitar qualquer de tipo de contaminação, do produto, do operador e do ambiente. A bancada de trabalho era desinfetada no início e no final do trabalho e irradiada com luz UV durante 15 minutos. O material utilizado (pipetas, microtubos, tubos Falcon, pontas com filtro) era estéril e descartável. O material de vidro era lavado e esterilizado em autoclave (121ºC). Reagentes, armazenados a 4ºC foram pré aquecidos a 37ºC (meios de cultura, PBS, Tripsina), antes de cada utilização.
1. Materiais
Neste trabalho foram estudadas substâncias naturais, extratos aquosos de folhas/caules e de flores, de plantas portuguesas, e uma substância de síntese química.
Estes extratos, na forma liofilizada, foram cedidos pela Professora Doutora Lia Ascensão (DBV- FCUL e Centro de Biotecnologia Vegetal). Estes liofilizados e a substância de síntese química foram denominados de C1, E3, E4 e E6, de modo a permitir uma identificação e designação mais simples nas experiências realizadas.
1.1 Ácido Rosmarínico
C1- Substância de síntese química adquirida à Sigma Aldrich, ref: 536954; PM 360,31 g/mol. Fórmula química: C18H16O8.
1.2 Helichrysum italicum Miller.
E3- Ramos florais
E4- Ramos vegetativos (caules/folhas)
Foram colhidos em populações naturais que crescem em terrenos arenosos entre a Comporta e Melides, em Maio e Junho de 2010 e de 2011, dos quais se prepararam extratos aquosos.
Foi feita um excicata que se encontra depositada no Herbário do Jardim Botânico da Universidade de Lisboa, com o seguinte código: H. italicum (LISU 236684)
1.3 Solidago virgaurea L.
E6- Ramos vegetativos (caules e folhas)
Foram colhidos em populações naturais, em Alcobaça, em Maio e Junho de 2010 e de 2011, a partir dos quais se preparam extratos aquosos.
Foi feita uma excicata que se encontra depositada no Herbário do Jardim Botânico da Universidade de Lisboa, com o seguinte código: S. virgaurea (LISU…,)
1.4 Linha celular
Neste trabalho foram utilizadas células Vero, referência CCL-81 da American Type Culture Collection (ATCC). São fibroblastos de linhagem contínua, com origem em rim de macaco verde africano (Cercopithecus