EFEITOS DO ÓXIDO NÍTRICO NO CRESCIMENTO E NA LIGNIFICAÇÃO DAS RAÍZES DE SOJA
Tese apresentada ao Programa de Pós-graduação em Ciências Biológicas (área de concentração Biologia Celular e Molecular) da Universidade Estadual de Maringá, para obtenção do grau de Doutora em Ciências Biológicas.
FRANCIELE MARA LUCCA ZANARDO BÖHM
EFEITOS DO ÓXIDO NÍTRICO NO CRESCIMENTO E NA LIGNIFICAÇÃO DAS RAÍZES DE SOJA
Prof. Dr. Osvaldo Ferrarese Filho Orientador
Dados Internacionais de Catalogação-na-Publicação (CIP) (Biblioteca Central - UEM, Maringá – PR., Brasil)
Böhm, Franciele Mara Lucca Zanardo
B676e Efeitos do óxido nítrico no crescimento e na lignificação das raízes de soja / Franciele Mara Lucca Zanardo Böhm. -- Maringá : [s.n.], 2008.
60 f. : il., figs.
Orientador : Prof. Dr. Osvaldo Ferrarese Filho. Tese (doutorado) - Universidade Estadual de Maringá,
Programa de Pós-Graduação em Ciências Biológicas (área de concentração Biologia Celular e Molecular), 2008.
1. Óxido nítrico. 2. Soja. 3. Lignificação. 4. Peroxidase. 5. Enzimas oxidativas. 6. Metabolismo secundário em plantas. I. Universidade Estadual de Maringá. Programa de Pós-Graduação em Ciências Biológicas. II. Título.
BIOGRAFIA
Franciele Mara Lucca Zanardo Böhm nasceu em 22/01/1980. Possui graduação em Ciências Biológicas pela Universidade Estadual de Maringá (2001). Tem experiência na área de Botânica e Fisiologia Vegetal. Concluiu o Mestrado no PBC (programa de pós-graduação em Ciências Biológicas), em 2004, desenvolvendo a disssertação “Influências do óxido nítrico na germinação das sementes de canola e no metabolismo de fenilpropanóides em raízes de soja”, sob orientação do professor Dr. Osvaldo Ferrarese Filho. Iniciou o Doutorado em Ciências Biológicas (Biologia Celular e Molecular) em 2004, na Universidade Estadual de Maringá. Atualmente é docente da Fundação Faculdade de Filosofia Ciências e Letras de Mandaguari onde ministra as disciplinas de Anatomia e Fisiologia Vegetal.
AGRADECIMENTOS
Primeiramente a Deus que sempre ilumina meus caminhos e me fortalece para sempre continuar.
A meus pais Ademir e Iraci que sempre me incentivaram em meus estudos.
A minha irmã Daniele também colega de laboratório.
Ao meu marido Paulo Alfredo pelo carinho e compreensão compartilhada em casa e no laboratório.
Ao professores Osvaldo e Maria de Lourdes pela orientação dedicada e pela amizade.
Aos colegas de laboratório que me acompanharam em toda esta trajetória, em especial a Gisele Novakowski, Aparecida Maria Dantas, Gisele Bubna e Flausina Cenerini.
A todos os professores que contribuíram com a minha formação para chegar até aqui.
DEDICATÓRIA
A todos os professores que plantaram a semente de que somos capazes de fazer tudo o que queremos com esforço e dedicação.
APRESENTAÇÃO
Esta tese é composta de uma Revisão e de um Artigo Científico que tratam dos efeitos do óxido nítrico nas raízes de soja.
A Revisão descreve as origens do óxido nítrico e principalmente seus efeitos nas plantas, com ênfase nas peroxidases e na lignificação.
O Artigo descreve os efeitos do óxido nítrico na lignificação das raízes de soja, destacando principalmente suas ações quando aplicado em extremas concentrações na solução nutritiva. O artigo foi redigido de acordo com as normas da revista Journal of Applied Biology.
Franciele M. L. Zanardo Böhm e Osvaldo Ferrarese-Filho. Óxido nítrico nas plantas: origem e funções.
RESUMO GERAL
INTRODUÇÃO E OBJETIVOS – O óxido nítrico (NO) é um radical livre produzido a partir da L-arginina pela óxido nítrico sintase (NOS) em células animais. Oriundo do endotélio, NO foi inicialmente identificado como fator de relaxamento em coelhos, e atualmente é reconhecido como um mediador intracelular e extracelular em várias funções celulares. A princípio, NO foi identificado como tóxico, baseado na sua capacidade de reagir com centros redox em proteínas, inclusive naquelas das membranas. Mais tarde, estudos a respeito do NO em animais revelaram que ele é um componente molecular envolvido em diferentes mecanismos de transdução do sinal. Recentes estudos têm mostrado a existência de NO nas plantas, e um elevado número de experimentos suportam evidências de que NO possui múltiplas funções nas plantas. NO apresenta ampla reatividade química e envolve três formas interconversíveis: cátion nitroso (NO+), óxido nítrico (NO•), e o ânion nitroxil (NO−). NO pode reagir com o ânion superóxido (O2-) levando à formação do ânion peroxinitrito (ONOO-), fortemente oxidante, que reage com
grupos tióis de proteínas e radicais polinsaturados de ácidos graxos das membranas, causando sérios danos à estrutura celular. NO também reage com o oxigênio atmosférico formando outros óxidos como NO2⋅, N2O3, NO-3 and NO-2. Dependendo da concentração e do tecido em que atua,
doador de NO, nitroprussiato de sódio (SNP) foram testados sobre o crescimento radicular, viabilidade celular, atividade da fenilalanina amônia-liase (PAL) e peroxidases (POD), solúvel e ligada à parede celular, peróxido de hidrogênio (H2O2) e conteúdo de lignina em raízes de soja
(Glycine max L. Merr.).
MÉTODOS – Plântulas de três dias foram cultivadas em solução nutritiva, pH 6,0, contendo ou não 5 a 1000 µM de SNP, doador de NO. Os experimentos foram efetuados em câmara de germinação, a 25ºC, em ciclo de 12 h claro/12 h escuro e irradiação de 280 µmol m-2 s-1, por 24
horas. Após a incubação, as raízes foram medidas e preparadas para os ensaios bioquímicos. As atividades das peroxidase, solúveis e ligadas à parede celular, a viabilidade celular e os conteúdos de H2O2, nitrito e de lignina foram determinados espectrofotometricamente, enquanto a
atividade PAL foi determinada por HPLC. A lignificação da raiz também foi avaliada por microscopia óptica. Determinações subseqüentes foram feitas nas raízes com adição de 5 µM de ferrocianeto de potássio, análogo ao SNP, ou 100 µM de 2-fenil-4,4,5,5,-tetrametilimidazoleline-1-oxyl-3-óxido (PTIO), um carredor de NO, que foi adicionado à solução nutritiva ao mesmo tempo que foi adicionado 5 µM SNP. Análise de variância (ANOVA) foi aplicada para verificar a significância das variações observadas. As diferenças entre os parâmetros foram avaliadas pelo teste de Scott-Knott e foram considerados significativos quando apresentaram valor de P≤ 0,05.
RESULTADOS E DISCUSSÃO – O suprimento exógeno de NO pelo doador SNP, em altas concentrações (1000 µM), induziu a redução prematura do crescimento da raiz, associada com significante perda da viabilidade celular. O SNP, doador de NO, diminuiu a atividade da PAL e aumentou as atividades das peroxidases solúvel e ligada à parede celular, associadas com uma diminuição nos conteúdos de H2O2. O conteúdo de lignina foi reduzido após o tratamento com
de SNP reduziu a atividade da PAL e o conteúdo de lignina enquanto aumentou significativamente a perda de viabilidade celular, sugerindo um efeito citotóxico. A morte celular é uma conhecida ação de NO. Aumentos na atividade de peroxidases solúvel e ligada à parede celular devem ser devidos: 1) a função antioxidante destas enzimas para remover o excesso de H2O2; 2) ao possível papel de POD na detoxificação de NO nos tecidos das plantas. 3) ou ao
metabolismo de NO formando o ânion peroxinitrito (ONOO-) ou secundariamente produzindo espécies reativas de nitrogênio como NO2⋅, N2O3, NO-3 e NO-2, com efeitos subseqüentes do
doador de NO sobre as raízes de soja. Efeitos opostos verificados em baixas concentrações (5
µM) de SNP sugerem que NO deve atuar como uma molécula sinalizadora nos mecanismos de
biossíntese de lignina. Assim, o NO induz o aumento da atividade da PAL promovendo aumento de ácidos fenólicos. Por meio de reações subseqüentes, os metabólitos fenilpropanóides são convertidos em seus respectivos álcoois que são polimerizados em lignina pela POD ligada à parede celular. Os resultados obtidos com ferrocianeto de potássio e PTIO fortalecem esta hipótese.
GENERAL ABSTRACT
INTRODUCTION AND AIMS – Nitric oxide (NO) is a labile free radical produced from L-arginine by NO synthase (NOS) in various mammalian cells. Although NO was originally identified as an endothelium-derived relaxing factor in rabbits, it is now recognized to be an intra- and inter-cellular mediator of several animal cell functions. At first, based on its ability to react with redox centers in proteins and membranes NO was found to be toxic. Later, functional studies in animals described NO as a molecular component of different signal transduction pathways. Recent studies have shown the existence of NO in plants, and a number of experiments have provided the evidence that NO has multiple functions in plants. NO’s broader chemistry involves an array of interrelated redox forms: nitrosonium cation (NO+), nitric oxide (NO•), and nitroxyl anion (NO−). In general, NO may react with superoxide anion (O
2-) leading
to the formation of the strong oxidant peroxynitrite anion (ONOO-), which reacts with thiol groups of proteins and polyunsaturated radicals of fatty acid lipids of membrane, causing serious damage to cell structures. NO also reacts with atmospheric oxygen forming other nitric oxides, including NO2⋅, N2O3, NO-3 and NO-2. Depending on the concentration and the tissue of action,
NO may be considered either noxious or protective. Whereas some authors considered it as a stress-inducing agent, others reported its protective role acting as a radical chain reaction breaker under oxidative stress conditions. Exogenous application of NO donors induces different processes in plants, which are related to the growth and developmental, metabolism of cellular compartments, biochemical interactions and abiotic or biotic stresses. Lignification, the process of sealing plant cell due to lignin deposition, is an important step during root growth. Lignin is synthesized by the phenylpropanoid pathway, which is involved in the synthesis of phenolic compounds and a wide range of secondary products in plants. The first rate-limiting enzyme of this pathway is phenylalanine ammonia-lyase (PAL), whereas in the last step of the pathway, peroxidase (POD) catalyzes the monolignol polymerization leading to the lignin synthesis. It is well known that cell walls lignify when cell expansion decreases or when cell is under stress. Owing to the important role of lignification in plant growth, current research investigates how lignification is related to the NO´s action mode. For this, the effects of NO-donor sodium nitroprusside (SNP) were tested on root growth, cell viability, phenylalanine ammonia-lyase (PAL) and soluble and cell wall-bound peroxidase (POD) activities, hydrogen peroxide (H2O2)
METHODS – Three-day-old seedlings were cultivated in nutrient solution, pH 6.0, containing or not 5 to 1000 µM NO-donor SNP. Experiments were carried out in a growth chamber (25°C, 12-h light/12-h dark cycle, irradiance of 280 µmol m-2 s-1) during 24 hours. Roots were then measured and prepared for assays. Soluble and cell wall-bound POD activities, cell viability, H2O2,
nitrite and lignin contents were determined spectrophotometrically, whereas PAL activity was assayed by high performance liquid chromatography (HPLC). Root lignification also was analyzed by light microscopy. Subsequent determinations were made in roots growing in nutrient solution containing 5 µM of potassium ferrocyanide, an analog of SNP, or 100 µM of 2-phenyl-4,4,5,5,-tetramethylimidazoleline-1-oxyl-3-oxide (PTIO), a scavenger of NO, which were added to the nutrient solution at the same time as the addition of 5 µM SNP. ANOVA was applied to test the significance of measured differences. Scott-Knott’s test was applied to evaluate the difference between parameters and P values ≤ 0.05 were considered statistically significant.
RESULTS AND DISCUSSION – Exogenously supplied NO-donor SNP, at high concentration (1000 µM), induced premature cessation of root growth associated with significant loss of cell viability. Moreover, the NO-donor SNP decreased PAL activity and increased the soluble and cell wall-bound POD activities associated with reduction in H2O2 contents. The lignin contents
reduced after NO-donor SNP treatments. On the other hand, exogenously supplied NO-donor SNP, at extremely low concentration (5 µM) caused opposite effects, i.e, an increase in the
lignification associated with similar increases in PAL activity, cell wall-bound POD and root growth, without affecting the cellular viability. At the same concentration, potassium ferrocyanide caused opposite effects to the 5 µM of NO-donor SNP treatments by reducing root length and lignin content. When applied jointly with SNP, PTIO also caused opposite effects to the SNP treatments, by reducing the root length, PAL activity and lignin content. The main fact that may be drawn from the presented data is that the NO-donor SNP has significant and dual effects on soybean root growth and lignification. Under high concentration (1000 µM),
NO-donor SNP reduced PAL activity and lignin contents whereas increased significantly the loss of cell viability, suggesting cytotoxic effect. Cell death is a known finding of the NO action. Increase in the soluble and cell wall-bound POD activities may be due to: 1) the anti-oxidative function of the theses enzymes to remove an excess H2O2; 2) the possible role of POD on NO
detoxification in plant tissues or 3) the metabolism of NO forming peroxynitrite anion (ONOO-) or secondarily produced reactive nitrogen species, such as NO2⋅, N2O3, NO-3 and NO-2 with
concentration (5 µM) of NO-donor SNP suggest that NO may be acting as a signal molecule on
the lignin biosynthetic pathway. In simplest words, NO induces PAL activity followed by increase in the phenolic acids. By subsequent reactions, these phenylpropanoid metabolites are converted in the respective alcohols which are polymerized by POD toward lignin in the cell wall. Results obtained with potassium ferrocyanide and PTIO strengthen this hypothesis.
ÓXIDO NÍTRICO NAS PLANTAS: ORIGEM E FUNÇÕES
Franciele M. L. Zanardo Böhm e Osvaldo Ferrarese-Filho
Aspectos Gerais
O óxido nítrico (NO) foi identificado como uma importante molécula para as células animais, sendo identificado como fator de relaxamento oriundo do endotélio. Estudos descritos por diferentes autores indicam que o NO tem ativa participação na neuro-transmissão, vaso-relaxamento, relaxamento do músculo liso, imuno-regulação de processos fisiológicos, inibição plaquetária, proliferação celular, morte celular programada, nas respostas a infecções e como sistema de defesa contra patógenos e câncer (Bredt e Snyder, 1992; Lancaster Jr., 1992; Mebmer et al., 1994; Anbar, 1995; Kojima et al., 1998; Wink e Mitchell, 1998; Neill, 2003). Radical livre de pequeno tamanho, com tempo de meia-vida de 3 a 6 segundos na presença de oxigênio (Arasimowicz e Floryszak-Wieczorek, 2007) sem carga e instável, o NO se difunde rapidamente através das membranas biológicas, graças à sua natureza lipofílica, e desencadeia diferentes processos em curto espaço de tempo (Stamler, 1994; Leshem, 1996).
A química do NO é complexa e envolve interações entre três espécies que diferem em suas propriedades físicas e reatividade química: o cátion nitroso (NO+), o ânion nitroxil (NO-) e o radical óxido nítrico (NO.). Nos sistemas biológicos, este radical reage rapidamente com oxigênio molecular (O2) que resulta na formação de compostos NOX (incluindo NO2·, N2O3 e
N2O4), que podem reagir com aminas e tióis celulares ou simplesmente hidrolisar formando
nitrato e nitrito. O ânion superóxido (O2-) reage com o NO e forma peroxinitrito (ONOO-). NO
também pode formar complexos com metais de transição em hemeproteínas, sendo que este processo altera a estrutura e a função de proteínas-alvo como, por exemplo, a ativação da guanilato ciclase e a inibição da aconitase (Wendehenne, 2001; Arasimowicz e Floryszak-Wieczorek, 2007).
Fontes de NO
doador de elétrons, e produzindo L-citrulina e NO. Três isoformas desta enzima foram identificadas: duas constitutivas, nNOS neural (160 KDa) e eNOS endotelial (135 KDa), e uma forma induzível, iNOS (130KDa) que tem sua expressão aumentada na presença de lipopolissacarídeos e interferon. Foi identificada e caracterizada uma isoforma (mtNOS) em mitocôndrias de fígado de rato (Tatoyan e Giulivi, 1998). As NOS constitutivas dependem de cálcio, enquanto a induzível não depende (Beligni e Lamartina, 2000). Em baixas concentrações de L-arginina, NOS também pode gerar, simultaneamente, O2- e NO levando à produção de
peroxinitrito (ONOO-), um composto citotóxico principalmente para as células animais (Wendehenne, 2001). Todas as NOS são homodímeros, e apresentam um bidomínio com N-terminal oxigenase, que contém ferro e tetrahidrobiopterina, e C-N-terminal redutase com sítio de ligação para FAD e NADPH. A calmodulina une os dois domínios. O processo de clivagem proteolítica libera duas enzimas distintas (Flora-Filho e Zilberstein, 2000; Crawford, 2005).
Nas plantas, a presença da NOS é vista como enorme dúvida entre os pesquisadores. Estudos utilizando anticorpos marcados (anti-NOS de coelho) revelaram sua presença em ervilha, sendo identificada uma banda com domínio C-terminal semelhante ao da citocromo P450 redutase. Todavia, esta apresenta peso molecular entre 36 e 78 KDa, diferente da NOS em animais (Beligni e Lamartina, 2000). Outro estudo sugere a existência da NOS em plantas já que o marcador radioativo [H3]L-citrulina foi encontrado na leguminosa Mucuna hassjoo, após
incubação com [H3]L-arginina (Ninneman e Maier, 1996). A atividade da NOS foi verificada em peroxissomos e cloroplastos (Barroso et al, 1999). Nos peroxissomos, a atividade é dependente de cálcio e 14 resíduos C-terminais são diferentes do citocromo P450 redutase. Microscopia eletrônica de imunofluorescência localizou NOS no citoplasma de células de milho em divisão e, posteriormente, no núcleo (Wendehenne et al, 2001).
Em Arabidopsis foi isolado um gene AtNOS1 que atua em processos de crescimento e
NO pode ser produzido de forma não enzimática por carotenóides, na presença de luz, ou como resultado de interações entre metabólitos e óxidos de nitrogênio, pela decomposição do óxido nitroso ou ainda na presença de um redutor originando nitrito. Esta reação requer um ácido não-dissociável na forma de HNO2 (pK = 3,2); a produção química de NO é insignificante em
pH fisiológico, mas deve ocorrer em ambientes ácidos, em tecidos ou compartimentos (Wendehenne et al., 2001).
É sabido que plantas fertilizadas com nitrato podem gerar NO por ação da nitrato redutase (NR, EC 1.6.6.1-3), dependente de NAD(P)H, enzima chave do metabolismo de nitrogênio. Nitrato redutase é uma enzima altamente regulada, com tempo de meia-vida de poucas horas e sua indução requer nitrato e luz (Magalhaes et al., 2002). Mutantes de soja deficientes em nitrato redutase não geram NO. Sob baixas tensões de oxigênio, a xantina-oxidase também pode gerar NO (Millar et. al., 1998; Harper, 1986; Magalhaes et al., 2002). Outras fontes endogenas de NO foram recentemente encontradas, como uma proteína ligada a membrana: nitrito NO redutase (Nir-NOR), além de peroxidases, citocromo P450, catalase e hemoglobina (Arasimowicz e Floryszak-Wieczorek, 2007). A utilização de inibidores de NOS e NR impediram respostas como o fechamento dos estômatos, a morte celular programada e o crescimento radicular, sugerindo que as duas enzimas podem ser fontes de NO (Neill et al., 2003).
Efeitos do NO nas plantas
fluorescência, é a mais indicada, até o momento, pois permite visualizar quantidades mínimas de NO nos tecidos (Garcia-Mata e Lamarttina, 2002; Magalhaes et al., 2002).
Estudos recentes foram conduzidos com relação ao papel do NO nas plantas (Takahashi e Yamasaki, 2002; Lum et al., 2002; Zottini et al., 2002; Stohr e Ullrich, 2002). Seu envolvimento na regulação de processos biológicos, tanto como molécula sinalizadora nos mecanismos de defesa (Noritake et al., 1996; Beligni et al., 1997; Gouveia et al., 1997; Laxalt et al., 1997; Magalhães et al., 2002; Modolo et al., 2002; Delledone et al., 2002) como suas propriedades hormonais (Leshem e Haramaty, 1996) têm sido relatadas.
Proposições foram apresentadas sugerindo uma função para NO como molécula sinalizadora de longo espectro, envolvendo expressão e regulação em funções celulares (Wendehenne et al., 2001), sinalizador/mediador da citocinina, genes da nitrato redutase (Tun et al., 2001), e como mensageiro celular numa gama de papéis fisiológicos, principalmente em plantas sob condições de estresses bióticos e abióticos (Corpas et al., 2001), floração, senescência e amadurecimento dos frutos (Arasimowicz e Floryszak-Wieczorek, 2007).
NO é uma molécula mediadora de hormônios, mas sua síntese é restrita à célula-alvo. A citocinina induz a síntese de NO em tabaco (Nicotiana tabacum) e Arabdopsis thaliana, estando
envolvida no processo de morte celular programada com peróxido de hidrogênio ou disparando este processo (Clarck, 2000). Tem sido proposto, também, que o NO atua como fitohormônio na regulação de proteção da planta, bem como em outros processos relacionados ao seu desenvolvimento (Chamberlain et al., 2001) como germinação e fotomorfogênese (Beligni e Lamattina, 2000). Neste aspecto, o NO modula o consumo de oxigênio no eixo embrionário de soja (Glycine max L.), afetando o balanço pró-oxidante/antioxidante, e o rendimento de energia
celular, com efeitos na germinação (Caro e Puntarulo, 1999). Ainda nesta linha, foi divulgado (Zottini et al., 2002) que NO afeta a funcionalidade mitocondrial, reduzindo a respiração celular, em decorrência de inibição da via de citocromos, e acarretando a morte de células de cenoura (Daucus carota L.). NO ainda regula o consumo de oxigênio em sementes de soja. Sob hipóxia,
a concentração de NO dependente de nitrito aumentou nas sementes, o que diminuiu o consumo de oxigênio e os níveis de ATP, reduzindo o metabolismo. Quando a concentração de oxigênio é aumentada nas sementes, os níveis de NO diminuem e os níveis de ATP aumentam (Borisjuk, 2007). No que tange à fotomorfogênese, NO estimula a germinação de sementes de alface (Lactuca sativa L.), na presença de luz e temperatura entre 26ºC e 32o.C. No escuro, e com
participação na presença de luz (Beligni e Lamattina, 2000). Finalmente, Takahashi e Yamasaki (2002) relataram que o NO regula a atividade da fotofosforilação em cloroplastos de espinafre (Spinacea oleraceae L.), atuando como inibidor reversível da síntese fotossintética do ATP.
Leshem e Haramaty (1996) relataram que a aplicação de uma mistura de KNO2 e
KI/H2SO4, usada para a geração não-enzimática de NO, resultou em comportamento dualístico
nas folhas de ervilha (Pisum sativus L.): baixa concentração de NO (5 µM) aumentou a velocidade de expansão foliar, enquanto nenhum efeito foi observado em maior concentração (12,5 µM). A aplicação exógena de NO (na sua forma gasosa), em plantas de trigo (Triticum vulgare L.) sob estresse hídrico, promoveu o fechamento dos estômatos em 60%; diminuiu a
transpiração em 20%; reduziu em 25% a perda de íons e a injúria celular e aumentou a retenção de água em mais de 15%, com relação ao controle (Garcia-Mata e Lamattina, 2001; Beligni e Lamattina, 2000; Beligni e Lamattina, 2001). NO é mediador da ação do ácido absícico (ABA); os movimentos estomáticos são controlados por ABA e dependentes de fluxo osmótico, dirigidos pelo movimento de cloro e potássio através de canais específicos. ABA induz ao aumento da concentração de NO nas células guardas promovendo o fechamento dos estômatos, este processo depende também do aumento nos níveis de H2O2. (Chen et al., 2006; Neill, et al., 2008).
A capacidade de NO atuar em situações de estresse bióticos e abióticos é fator de destaque. Por exemplo, NO protege as folhas de batata (Solanum tuberosum L.) infectadas com o
patógeno Phytophthora infestans (Beligni et al., 1997; Laxalt et al., 1997). Este efeito foi
observado com concentrações de NO entre 10 a 100 µM, sendo que as menores concentrações foram inativas enquanto as mais altas causaram redução dos níveis de clorofila. Como o NO não afetou o crescimento do patógeno, os autores sugeriram que o efeito protetor, nas folhas de batata, está relacionado com mecanismos de defesa da planta. Esta proposição é suportada pela observação de aumento nos níveis de RNAm da fenilalanina amônia liase (PAL) - enzima chave da via dos fenilpropanóides -, da β-1,3-glicanase e da gliceraldeido 3-fosfato desidrogenase.
Um considerável aumento na produção de NO tem sido detectado durante estresses de temperatura e de água em Pisum sativum L. (Leshem e Haramaty, 1996). A liberação de NO pelo
doador nitroprussiato de sódio (SNP) aumentou a fluorescência de clorofila, um fator associado ao estresse causado no transporte de elétrons no fotossistema II (PSII) (Leshem et al., 1998). S-nitroso-N-acetilpenicilamina (SNAP), outro doador de NO, aumentou a tensão superficial de
aspectos, o tratamento de folhas de ervilha (Pisum sativus L.) com SNAP reduziu
significativamente as atividades das lipoxigenases, um complexo enzimático com destacado papel regulador na produção de compostos relacionados com a defesa das plantas.
Ainda no que toca ao papel do NO nas respostas de defesa, mecanismo similar ao existente nas células animais parece ocorrer nos vegetais no que concerne ao ataque de patógenos (Dangl, et. al, 1998; Delledonne et al., 2002). Em resposta a esta invasão, uma bateria de respostas ocorre nas plantas, incluindo aumento de espécies reativas ao oxigênio (ROS), fortalecimento da parede celular e síntese de ácido salicílico. A planta desenvolve, ainda, resposta hipersensível (HR), nos casos de lesões necróticas, ocorrendo rápida morte celular no local da infecção, limitando o crescimento e tornando restrito o local da infecção. Um dos eventos da HR é a rápida acumulação de ROS, constituindo componente central na amplificação do sinal envolvendo o ácido salicílico, cuja acumulação é estimulada por NO (Delledonne et al., 2002).
Condições estressantes como a seca, altas ou baixas temperaturas e o ozônio geram produção de espécies ROS (O2-, H2O2, OH-) que iniciam processos destrutivos e disparam
mecanismos de sinalização. NO interage com ROS exercendo uma função antioxidante durante o estresse. A modulação na formação de superóxido e a diminuição da peroxidação lipídica ilustram o potencial antioxidante de NO. Entretanto, em altas concentrações o NO causa estresse nitrosativo. Diante disso, é importante que seja mantido um balanço entre NO e ROS (Caro e Puntarulo, 1999).
O NO aumenta a tolerância do tomate (Lycopersicum esculentum L.), do milho (Zea mays
L.) e do trigo (Triticum aestivum L.) ao frio. Além disso, sua concentração aumenta em alfafa
submetida ao estresse pelo calor. O melhor desempenho das plantas deve estar relacionado ao efeito antioxidante para neutralizar ROS (Wendehenne et al., 2001). A radiação UV-B induz a expressão gênica de chalcona sintase via NOS. O tratamento de batatas com doadores de NO antes da radiação UV promoveu aumento de 50% em folhas mais saudáveis, comparadas com plantas não-tratadas com doadores (Beligni e Lamarttina, 1999; Neill et. al., 2003).
O tratamento de tabaco (Nicotiniana tabacum L.) com NO aumenta os níveis da
estimulado por NO, também induz a expressão da PAL e da Proteína Relacionada à Patogênese (PR-1), reconhecidamente envolvida na resistência de doenças em plantas. Segundo estes mesmos autores, o NO também induz a acumulação de ácido salicílico, por mecanismos ainda não bem elucidados. O ácido salicílico é estimulador da oxidação, da expressão de genes de defesa e da resposta hipersensível (HR), sendo metabólito da via dos fenilpropanóides (rota do ácido chiquímico). Nesta via metabólica, PAL catalisa a conversão da fenilalanina em ácido
trans-cinâmico, considerado o primeiro precursor importante na biossíntese do ácido salicílico
(Chong et al., 2001), o qual pode ser convertido em ácido benzóico, em reação catalisada por ácido benzóico 2-hidroxilase (BA2H).
Por outro lado, o tratamento de microssomas de milho (Zea mays) com doadores de NO
causa inibição competitiva da cinamato-4-hidroxilase (C4H) - uma monooxigenase dependente de citocromo P450 - que catalisa a conversão do ácido trans-cinâmico em ácido p-cumárico
(Enkhardt e Pommer, 2000). Já, o tratamento de folhas de Arabidopsis thaliana com doadores de
NO aumenta a transcrição de cinamato-4-hidroxilase (C4H). Esta enzima é considerada primordial na síntese de compostos fenólicos como, por exemplo, os ácidos ferúlico, p-cumárico
e caféico, e vários outros derivados que atuam no mecanismo de resistência a doenças com alta atividade antimicrobiana (Delledonne et al., 2002). Além disso, estes derivados fenólicos participam na composição de tecidos suberizados, que podem ser formados ao redor dos sítios de infecção, bem como servem como precursores na síntese de taninos, flavonóides, lignanas e ligninas. Isto explicaria, a priori, que as respostas de defesa, nas plantas, teriam estreita relação
com a via de fenilpropanóides, induzida por NO. Neste aspecto, Modolo et al. (2002) relataram a acumulação de fitoalexinas (daidzeina, genisteina, apigenina e luteolina), mediada pela NOS, em cotilédones de soja (Glycine max L.) em resposta a Diaporthe phaseolorum. Tal fato se coaduna
com observações descritas por Delledone et al. (1998), com relação aos aumentos nos níveis de chalcona sintase (CHS), primeira enzima da via de síntese de flavonóides e isoflavonódes.
Os efeitos de NO sobre células do xilema de Zinnia elegans (L.), observados por Ferrer e
Ros Barceló (1999) e Ros Barceló et al. (2002), mostraram que aplicações de nitroprussiato de sódio, a 5 mM, reduziram a atividade da peroxidase - enzima que contém grupo heme - em 42%, sem afetar, no entanto, a produção de H2O2, o qual é usado por esta enzima durante a produção
localizadas na região da parede celular, como por exemplo, peroxidase NADH-dependente (Chen e Schopfer, 1999) e diamino oxidase (Angelini e Federico, 1989).
Experimentos utilizando tomate e alface mostram que o crescimento é estimulado em baixas concentrações de NO e inibido por altas concentrações (Hufton et al., 1996). Outro aspecto a ser destacado é que, em folhas de ervilha, o NO diminuiu a produção de etileno, hormônio que promove a senescência. Por outro lado, em Arabidopsis, o efeito foi contrário, ou
seja, aumento na produção de etileno. A aplicação de NO aumenta a longevidade das flores (Leshem Wills e Venz-Va Ku, 1998). NO controla a germinação de sementes em várias espécies, Giba et al (1998) demonstrou que doadores de NO podem controlar o fitocromo, pigmento envolvido no controle da germinação. NO estimulou a germinação de arroz promovendo a abertura de canais de água, chamados, aquaporinas. (Liu et al., 2007). A formação de raízes, principalmente adventícias, é estimulada pelo NO. A síntese de NO foi estimulada por auxinas, nas raízes de pepino, sendo requerido para alongação e formação de raízes laterais (Pagnussat et al., 2002).
NO exerce função na tolerância de plantas aos estresses de alta temperatura e de salinidade (Uchida et al., 2002). O tratamento de folhas de feijão com SNP, resultou aumento nas atividades de enzimas anti-oxidativas como catalase, superóxido dismutase e ascorbato peroxidase (Shia, et. al., 2005). NO aumenta a disponibilidade de ferro em condições deficiente deste íon e melhora os efeitos adversos causados pelo excesso de ferro (Abdel- Kader, 2007). Ainda em relação ao estresse, a aplicação exógena de NO reduziu a ação destrutiva de metais pesados, etileno e herbicidas e um aumento da atividade da superóxido dismutase foi observado (Arasimowicz, Floryszak-Wieczorek, 2007).
NO e Leguminosas
As plantas apresentam hemoglobinas, um grupo de proteínas envolvidas no transporte de oxigênio. As mais conhecidas são aquelas do tipo simbióticas, que são encontradas nos nódulos de leguminosas. A principal delas é a leghemoglobina (Lb), capaz de participar na fixação de nitrogênio e de regular o suprimento de oxigênio para as bactérias fixadoras. Estas enzimas ligam reversivelmente o oxigênio, o que define a sua função celular. (Appleby, 1992; Mathieu et al., 1998).
As hemoglobinas de plantas não simbióticas podem ser divididas em duas classes: Hb1 que têm grande afinidade por oxigênio e Hb2 que têm baixa afinidade por oxigênio. Sob condições de falta de oxigênio ocorre indução de Hb1 e aumento da emissão de NO. Foi proposto que Hb1 modula os níveis de NO nas plantas (Dordas et al., 2003). Hb1 de Arabidopsis
reage com NO e produz nitrato e metil-hemoglobina na presença de oxigênio (Crawford e Guo 2005). A Hb1 pode retirar também NO produzindo S-nitrosohemoglobina. A S-nitrosilação tem papel chave em mecanismos de sinalização em animais, mas em plantas sua função não é bem conhecida (Crawford e Guo, 2005).
O NO é uma molécula sinalizadora em leguminosas. Durante a simbiose com Rhizobium.
NO liga-se a Lb por mecanismo parecido com o da hemoglobina formando complexos nitrosil-leghemoglobina (NO-Lb). A função da Lb é a facilitação do transporte de oxigênio para microorganismos. O NO se liga impedindo o transporte por ser mais estável. A oxy-Lb é facilmente auto-oxidada para formar met-Lb O2- e H2O2. Estes radicais iniciam a peroxidação de
lipídios levando a irreversível perda de viabilidade das membranas e, subseqüente perda da capacidade de fixação nos nódulos. Isto é observado também durante o estresse e a senescência natural, ou ainda, quando diminuem os antioxidantes endógenos. O NO-Lb pode reagir com O2
-e/ou H2O2 provavelmente para evitar possíveis danos por ROS nos nódulos (Hérouart et al.,
2002). Em contraste com a proteção do nódulo contra injúrias oxidativas, o NO tem efeito deletério na fixação de nitrogênio. O complexo Lb-NO inibe a nitrogenase, enzima fixadora de nitrogênio, reagindo com seus centros ferro-enxofre (Beligni e Lamartina, 2000).
níveis de ATP, além do devenvolvimento de raízes adventícias e aerênquima (Dordas et al, 2003).
Peroxidases, ROS e Lignificação
O NO pode exercer funções citoprotetoras ou citotóxicas dependendo da concentração aplicada (Beligni e Lamartina, 1999). Uma função importante é a de quebrar reações em cadeia de ROS produzidos de forma acelerada em condições de estresse. ROS também devem ser destruídos por catalase ou peroxidase (Wojtaszek, 2000). ROS podem ser produzidos, enzimaticamente, em tecidos de plantas por dois sistemas que conferem explosão oxidativa: o complexo NADPH oxidase e as peroxidases ligadas à parede celular, dependentes de pH. As plantas contêm duas classes de peroxidases: a classe I, com enzimas de localização intracelular e a classe III, relacionadas a enzimas secretadas para a parede celular ou ao seu redor. Todas apresentam grupo heme e um grupo prostético com dez α–hélices enquanto a classe III contém
três α–hélices extras. Todas elas utilizam peróxido de hidrogênio como co-substrato para
oxidarem uma variedade de compostos orgânicos e inorgânicos. Além disso, as peroxidases podem produzir ROS (Passardi et al., 2004). Duroux e Welinder (2003) sugerem que a classe III é uma família de peroxidases que surgiram para adaptação ao ambiente terrestre com uma concentração maior de oxigênio, e conferindo vantagens funcionais como o metabolismo da parede celular e as respostas de defesa. Análises filogenéticas da classe III de Arabidopsis
thaliana mostram uma família de genes altamente diversificada.
Muitas funções fisiológicas são atribuídas às peroxidases, como o metabolismo do ácido indol-acético (AIA), lignificação, ligação de polímeros na parede celular, elongação celular, formação de suberina e resistência às infecções (Veitch, 2004; Passardi et al., 2004). Elas estão envolvidas no processo de germinação, sendo que sua atividade foi detectada em mucilagem de sementes, antes da germinação, liberando ROS para prevenir o ataque de patógenos, ainda, participando da lignificação de novos vasos do xilema. Peroxidases também protegem sementes contra a peroxidação lipídica (Passardi et al., 2004).
O relaxamento da parede celular se deve a um aumento no volume celular que promove o alongamento da parede. Mudanças na estrutura interna da parede também são obtidas por peroxidases em seu ciclo peroxidativo ou hidroxílico. O conteúdo de H2O2 apoplástico aumenta
hipocótilo mais lignificado (Schopfer, 1994). Por outro lado, as peroxidases controlam o conteúdo de H2O2 na parede celular; um pré-requisito para a ligação de monômeros fenólicos
associada a inibição da elongação celular. Este evento pode ocorrer para formação de suberina ou para promover a oxidação de monolignóis na síntese de lignina na parede secundária (Passardi et al., 2004).
Ligninas são complexos da parede celular formadas por heteropolímeros fenólicos, polissacarídeos e proteínas. Elas impermeabilizam os vasos do xilema para o transporte de água e são encontradas também nas fibras do floema. NO foi encontrado nos vasos de xilema primário, secundário e nas fibras do floema, provavelmente ativando as enzimas responsáveis pela lignificação, já que são hemeproteínas e desta forma são alvos do NO. Foi encontrada diminuição da concentração de NO com o aumento da diferenciação dos tecidos em lignificação (Barceló, 2004).
Os precursores fenólicos para a biossíntese de lignina são originados pela via de fenilpropanóides, a fenilalanina amônia liase (PAL), primeira enzima desta via é ativada por NO (Durner, et al., 1998; Delledonne et al., 1998). NO também ativa a produção de GMPc que é mediador da expressão gênica da PAL. Para lignificação ocorre a ativação de outras enzimas como, por exemplo, p-cumarato-3-hidroxilase e cinamato-4-hidroxilase (Rós Barceló, 2004).
Para lignificação são necessários co-substratos, como a H2O2, cuja produção pode ser
influenciada por NO, já que as enzimas envolvidas no controle desta molécula são moduladas por NO, catalase (EC 1. 11.1.6.) e peroxidases. Estas enzimas podem utilizar NO como substrato para desintoxicação celular ou para lignificação.
O mecanismo da reação das peroxidases basicamente é: H2O2 + 2A H2 2 H2O + 2AH.
A conversão de H2O2 em água para regulação dos níveis de peróxido de hidrogênio nas
plantas é função das peroxidases da classe I, embora para a a classe III esta não é uma função primária.
No processo de lignificação do xilema NO e O2.- podem reagir formando peroxinitrito,
que atua no processo de morte celular programada, além de ser substrato para peroxidase (Rós Barceló, 2004).
As peroxidases podem tanto utilizar NO como substrato como também gerar NO. Intermediários formados pela ação da NOS como N-hidroxiguanidinas podem ser oxidados por
peroxidases e liberar NO, além de outras substâncias como N-nitroxil-N-nitrosaminas que
Considerações Finais
Neste cenário pode-se afirmar que NO é uma molécula com amplo espectro de reação, em várias funções fisiológicas das plantas, Pode atuar como mensageiro celular, de forma dualística dependendo da sua concentração, e exercer efeitos importantes na fisiologia das plantas como a germinação, lignificação, respostas de defesa, floração e controle estomático, ou pode causar estresse nitrosativo e levando à morte celular (Casolo, 2005). Seus efeitos não devem ser apenas devido a sua ampla reatividade química, mas relacionados a uma complexa interação bioquímica do metabolismo celular.
Referências
ABDEL-KADER, D. Role of Nitric Oxide on iron homeostasis, chlorophyll biosynthesis and antioxidants system in two wheat cultivars. American Journal of Plant Physiology. v.2, p. 1-14, 2007.
ANBAR, M. Nitric oxide: a synchronizing chemical messenger. Experientia, v.51, p.545-550, 1995.
ANGELINI, R.; FEDERICO, R. Histochemical evidence of polyamine oxidation and hydrogen peroxide production in the cell wall. Journal of Plant Physiology, v.135, p.212-217, 1989.
APPLEBY, C. A. The origin and functions of hemoglobin in plants. Science in Progress. v.76, 365-398, 1992.
ARASIMOWICZ, M.; FLORYSZAK-WIECZOREK J. Nitric oxide as a bioactive signalling molecule in plant stress responses. Plant Science v.172, p. 876–887, 2007.
BELIGNI, M.V.; LAXALT, A.; LAMATTINA, l. Putative role of nitric oxide in plant-pathogen interactions. In: Moncada, S.; Toda, N.; Higgs, E.A. (eds). The Biology of Nitric Oxide, part 6 (Proc Fifth Int Meeting on the Biology of Nitric Oxide. Kyoto. Japan) Portland Press, p.250, 1997.
BELIGNI MV, LAMATTINA L. Is nitric oxide toxic or protective? Trends in Plant Science v.4, p. 299–306, 1999.
BELIGNI, M.V.; LAMATTINA, L. Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyl elongation, three light-inducible responses in plants. Planta, v.210, p.215-221, 2000.
BELIGNI, M.V.; LAMATTINA, L. Nitric oxide: a non-traditional regulator of plant growth. Trends in Plant Science, v.6, p.508-509, 2001.
BREDT, D.S.; SNYDER, S.H. Nitric oxide a novel neuronal messenger. Neuron, v.8, p.3-11, 1992.
BORISJUK, L.; MACHAREL, D.; BENAMAR, A.; WOBUS, U.; ROLLETSCHEK, H. Low oxygen sensing and balancing in plants seeds: a role for nitric oxide. New Phytologist. v.176: p. 813-823, 2007.
CARO,A.; PUNTARULO, S. Nitric oxide decreases superoxide anion generation by microssomes from soybean embryonic axes. Physiologia Plantarum, v.104, p.357-364, 1999.
CASOLO, V. PETRUSSA E. AKOVA, J. MACRÝ F.VIANELLO, A. Involvement of the mitochondrial K1 ATP channel in H2O2- or NO-induced programmed death of soybean suspension cell cultures. Journal of Experimental Botany, v. 56, p. 997–1006, 2005.
CLARK, A. DESIKAN, R. HURST, R. D. HANCOCK, J. T. NEILL, S. J. NO way back: nitric oxide and programmed cell death in Arabidopsis thaliana suspension cultures. Plant Journal,
v.24, p. 667-776. 2000.
CHEN, S.; SCHOPFER, P. Hydroxyl-radical production in physiological reactions. A novel function of peroxidase. European Journal of Biochemistry, v.260, p.726-735, 1999.
CHEN K, LI J, TANG J, ZHAO FG, LIU X. Involvement of nitric oxide in regulation of salt stress-induced ABA accumulation in maize seedling. Journal of plant physiology and molecular biology. v. 32, p.577-82, 2006.
CHONG, J.; PIERREL, M.A.; ATANASSOVA, R.; WERCK-REICHHART, D.; FRITIG, B.; SAINDRENAN, P. Free and conjugated benzoic acid in tobacco plants and cell cultures. Induced accumulation upon elicitation of defense responses and role as salicylic acid precursors. Plant Physiology, v.125, p.318-328, 2001.
CORPAS, F.J.; BARROSO, J.B.; del RIO, L.A. Peroxisomes as a source of reactive oxygen species and nitric oxide signal molecules in plant cells. Trends in Plant Science, v.6, p.145-150, 2001.
CRAWFORD, N. M. GUO, F. Q. New insights into nitric oxide metabolism and regulatory functions. Plant Science, v. 10, p. 195-200, 2005.
DANGL J. Plants just say NO pathogens. Nature, v.394, p.525-526, 1998.
DELLEDONE, M.; XIA, Y. DIXON, R.A.; LAMB, C. Nitric oxide functions as a signal in plant disease resistance. Nature, v.394, p.585-588, 1998.
DORDAS, C.; RIVOAL, J.; HILL, R. D.;. Plant haemoglobins, nitric oxide and hypoxic stress. Ann. Bot. (Lond.) 91, p. 173-178, 2003.
DURNER, J.; WENDEHENNE, D.; KLESSIG, D.F. Defense gene induction in tobacco by nitric oxide, cyclic GMP, and cyclic ADP-ribose. Proceedings of the National Academy of Sciences USA, v.95, p.10328¯10333, 1998.
DUROUX, L., WELINDER, K. G. The peroxidase gene family in plants: a phylogenetic overview. J. Mol. Evol. v.57, p.397-407, 2003.
ENKHARDT, U.; POMMER, U. Influence of nitric oxide and nitrite on the activity of cinnamic acid 4-hydroxylase of Zea mays in vitro. Journal of Applied Botany, v.74, p.151-154, 2000.
FERRER, M.A.; ROS BARCELÓ, A. Differential effects of nitric oxide on peroxidase and H2O2
production by the xylem of Zinnia elegans. Plant, Cell and Environment, v.22, p.891¯897, 1999.
FLORA-FILHO, R.; ZILBERSTEIN, B. Óxido nítrico: o simples mensageiro percorrendo a complexidade. Metabolismo, síntese e funções.Rev Ass Med Brasil. v.46, p.265-271, 2000.
GARCIA-MATA, C.; LAMATTINA, L. Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress. Plant Physiology, v. 126, p.1196-1204, 2001.
GARCIA-MATA, C.; LAMATTINA, L. Nitric Oxide and Abscisic Acid Cross Talk in Guard Cells Plant Physiology, v.128, p.790-792, 2002.
GIBA, Z.; GRUBISIC, D.; TODOROVIC, S.; SAJC, L.; STOJAKOVIC, D.; KONJEVIC, R. Effect of nitric oxide releasing compounds on phytochrome-controlled germination of Empress tree seeds. Plant Growth Regulation. v.26, p.175-181, 1998.
GUO, F.Q.; OKAMOTO, M.; CRAWFORD, N.M. Identification of a plant nitric oxide synthase gene involved in hormonal signaling. Science. v. 302, p.100–103.2003.
HARPER, J. E. Evolution of nitrogen oxide(s) during in vivo nitrate reductase assay of soybean
leaves. Plant Physiology, v. 68, 1488-1493, 1986.
HÉROUART, D. BAUDOUIN, E. FRENDO, P. HARRISON, J. SANTOS, R. JAMET, A. VAN de SYPE, G. TOUATI, D. PUPPO, A. Reactive oxygen species, nitric oxide and glutathione: a key role in the establishment of the legume- Rhizobium simbiosis? Plant Physiol. Biochem. v.40,
p. 619-624, 2002.
HUFTON, C.A.; BESFORD, R.T.; WELLBURN, A.R. Effects of NO (+NO2) pollution on
growth, nitrate reductase activities and associated protein contents in glasshouse lettuce grown hydroponically in winter CO2 enrichment. New Phytologist v.133, p. 495-501, 1996.
KOJIMA, H., NAKATSUBO, N., KIKUCH, K., KAWAHARA, S., KIRINO, Y., NAGOSHI, H., HIRATA, Y. AND NAGANO, T. Detection and imaging of nitric oxide with novel fluorescent indicators: diaminofluoresceins. Anal. Chem., v.70, p. 2446-2453, 1998.
LANCASTER Jr., J.R. Nitric oxide in cells. American Scientific, v.80, p.248-259, 1992.
LAXALT, A.M.; BELIGNI, M.V.; LAMATTINA, L. Nitric oxide preserves the level of chlorophyll in potato leaves infected by Phytophthora infestans. European Journal of Plant Pathology, v.73, p.643¯651, 1997.
LESHEM, Y.Y. Nitric oxide in biological systems. Plant Growth Regulation, v.18, p.155¯169,
1996.
LESHEM, Y.Y.; WILLS, R.B.H.; KU, V.V.V. Evidence for the function of the free radical gas - nitric oxide (NO) - as an endogenous maturation and senescence regulating factor in higher plants. Plant Physiology and Biochemistry, v.36, p.825¯833, 1998.
LIU. H.Y.; YU, X.; CUI, D.Y.; SUN, M.H.; SUN, W.N.; TANG, Z.C.; KWAK, S.S.; SU, W.A. The role of water channel proteins and nitric oxide signaling in rice seed germination. Cell Research , v.17, p.638-649, 2007.
LUM, H.K.; BUTT, Y.K.C.; LO, S.C.L. Hydrogen peroxide induces a rapid production of nitric oxide in mung bean (Phaseolus aureus). Nitric Oxide: Biology and Chemistry, v.6, p.205-213,
2002.
MAGALHAES, J.R.; SILVA, F.; SALGADO, I.; FERRARESE FILHO, O.; ROCKEL, P.; KAISER, W.M. Nitric oxide and nitrate reductase in higher plants. Physiology and Molecular Biology of Plants, v. 8, p.85-89, 2002.
MATHIEU, C. MOREAU, S. FRENDO, P. PUPPO, A. DAVIES, M. Direct detection of radicals in intact soybean nodules: presence of nitric oxide- leghemoglobin complexes. Free Radical Biology e Medicine, v. 24, p.1242-1249, 1998.
MEBMER, U.K., ANKARCRONA, M., NICOTERA, P. AND BRUNE, B. p53 expression in
nitric oxide induced apoptosis. FEBS Letters, v.355, p.23-26, 1994.
MILLAR, T. M.; STEVENS, C. R.; BENJAMIN, N.; EISENTHAL R.; HARRISON, R. BLAKE, D. R. Xanthine oxidoreductase catalyses the reduction of nitrates and nitrite to nitric oxide under hypoxic conditions. FEBS Letters, v.427, p.225-228, 1998.
MODOLO, L.V.; CUNHA, F.Q.; BRAGA, M.R.; SALGADO, I. Nitric oxide synthase-mediated phytoalexin accumulation in soybean cotyledons in response to the Diaporthe phaseolorum f. sp
NEILL, S. J. DESIKAN, R. HANCOCK, J.T. Nitric oxide signalling in plants. New Phytologist, v. 159, 11-35, 2003.
NEILL S, BARROS R, BRIGHT J, DESIKAN R, HANCOCK J, HARRISON J, MORRIS P, RIBEIRO D, WILSON I. Nitric oxide, stomatal closure, and abiotic stress. J Exp Bot. v. 59(2):165-76, 2008
NINNEMANN, H.; MAIER, J. Indications for the occurrence of nitric oxide synthases in fungi and plants and the involvement in photoconidiation of Neurospora crassa. Photochemistry and Photobiology, v.64, p.393¯398, 1996.
NORITAKI, T.; KAWAKITA, K.; DOKE, N. Nitric oxide induces phytoalexin accumulation in potato tuber tissues. Plant and Cell Physiology, v.37, p.113¯116, 1996.
PAGNUSSAT, G.C.; SIMONTACCHI, M.; PUNTARULO, S.; LAMATTINA, L. Nitric oxide is required for root organogenesis. Plant Physiology 129: 954-956, 2002.
PASSARDI, F. PENEL, C. DUNAND, C. Performing the paradoxical: how plant peroxidases modify the cell wall. Plant Science v.9, p.534-540, 2004.
ROS BARCELÓ, A.; POMAR, F. ; FERRER, M.A.; MARTINEZ , P.; BALLESTA, M.C.; PEDRENO, M.A. In situ characterization of a NO-sensitive peroxidase in the lignifying xylem of Zinnia elegans. Physiologia Plantarum, v.114, p.33-40, 2002.
ROS BARCELÓ, A.; GaABALDÓN, C.; POMAR, F. Nitric oxide, peroxidase and lignification in higher plants In: Magalhaes, J.R.; Singh, R.P.; Passos, L.P. (Eds). Nitric Oxide Signaling in Higher Plants. 1 ed. Houston, USA.: Studium Press, LCC. Houston, USA., v.1, p.277-308, 2004.
SCHOPFER, P. Histochemical demonstration and localization of H2O2 in organs of higher plants
SHI, S.; WANG, G.; WANG, Y.; ZHANG, L.; ZHANG, L. Protective effect of nitric oxide against oxidative stress under ultraviolet-B radiation. Nitric Oxide, v.13, p. 1-9, 2005.
STAMLER, J.S. Redox signaling: nitrosylation and related targets interactions of nitric oxide. Cell, v.78, p.931¯936, 1994.
STOHR, C.; ULLRICH, W.R. Generation and possible roles of NO in plant roots and their apoplastic space. Journal of Experimental Botany, v.53, p.2293-2303, 2002.
TAKAHASHI, S.; YAMASAKI, H. Reversible inhibition of photophosphorylation in chloroplasts by nitric oxide. FEBS Letters, v.512, p.145-148, 2002.
TATOYAN, A.; GIULIVI, C. Purification and characterization of a nitric oxide synthase from rate liver mitochondria. J. Biol. Chem. v. 273 (18), p.11044-11048, 1998.
TUN, N.N., HOLK, A., SCHERER, G.F.E. Rapid increase of NO release in plant cell cultures induced by cytokinin. FEBS Letters, v.509, p.174- 176, 2001.
UCHIDA, A. et al. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant. Sci., v.163, p.515-523, 2002.
VEITCH, N.C. Horseradish peroxidase: a modern view of a classic enzyme. Phytochemistry , v. 65, p.249-259, 2004.
WENDEHENNE, D., PUGIN, A., KLESSIG, D.F.; DURNER, J. Nitric oxide: comparative synthesis and signaling in animal and plant cells. Trends in Plant Science, v.6, p.177-183, 2001.
WINK, D.A.; MITCHELL, J.B. Chemical biology of nitric oxide: Insights into regulatory, cytotoxic, and cytoprotective mechanisms of nitric oxide. Free Radical Biology and Medicine, v.25,p.434¯456, 1998.
ZEMOJTEL, T. FRÖHLICH, A. PALMIERI, M.C. KOLANCZYK, M. MIKULA, I. WYRWICZ, L.S. WANKER, E. MUNDLOS, S. VINGRON, M. MARTASEK, P. DURNER, J. Plant nitric oxide synthase: a never-ending story? Trends Plant Science. v.11, p. 524–525, 2006.
Nitric oxide affecting root growth, lignification and related enzymes in
soybean seedlings
Franciele M. L. Zanardo Böhm and Osvaldo Ferrarese-Filho∗
Laboratory of Plant Biochemistry, Department of Biochemistry,
University of Maringá, Av. Colombo, 5790, 87020-900, Maringá, PR, Brazil
Abstract
The present study investigated whether nitric oxide (NO) is involved in the root lignification of soybean (Glycine max L. Merr.) seedlings. The changes in root cell viability, phenylalanine
ammonia-lyase (PAL), soluble and cell wall bound peroxidases (POD) activities and lignin and hydrogen peroxide (H2O2) contents of soybean roots treated with NO-donor sodium
nitroprusside (SNP), and their relationships with root growth were investigated. For this, soybean seedlings 3-d-old were cultivated in half-strength nutrient solution supplemented with 5 to 1000 µM SNP for 24 hours. At extremely low concentration (5 µM), SNP induced root growth followed by increase in the lignification and related enzymes (PAL and cell wall-bound POD), whereas at high concentration (1000 µM) it reduced root growth followed by decrease in the lignification (PAL activity and H2O2 and lignin contents) and loss of cell viability. Application
of potassium ferrocyanide, an analog of SNP that can not release NO, and of PTIO (2-phenyl-4,4,5,5,-tetramethylimidazoleline-1-oxyl-3-oxide), a specific scavenger of NO, indicated that the inhibitory/stimulatory effects on root lignification may be due to the NO itself. These results suggest that NO may act as a stress factor due to its toxic action or as a signal molecule inducing root growth and lignification, depending of the concentration.
Keywords: Lignin, nitric oxide, peroxidase, phenylalanine ammonia-lyase, phenylpropanoid
pathway, root growth, soybean
1. Introduction
Research on nitric oxide (NO) has recently gained particular attention about the evidence of its role in plants. As a relatively stable free-radical molecule and due to its highly lipophilic nature, NO diffuse through membranes and may act as a synchronizing chemical messenger involved in many plant physiological processes. Moreover, NO is generated in various plant species by potential sources such as nitrate reductase (NR), nitrite:NO-reductase, xanthine oxidoreductase (XOR), Arabidopsis protein AtNOS1, cytochrome P450, plasma
membrane-bound enzyme, nitric oxide synthase (NOS), horseradish peroxidase and nonenzymatic sources. The functions postulated for NO in plants are related to different processes such as growth and developmental (seed germination, root organogenesis, biosynthesis of biologically active substances, leaf expansion, stomatal closure, senescence and programmed cell death), metabolism of cellular compartments (chlorophyll biosynthesis, effects on cytocromo c oxidase, alternative oxidase, catalase and aconitase), biochemical interactions (iron homeostasis, reactive oxygen species, ethylene, abscisic acid and mitogen activated protein kinases), abiotic (drought, oxidative stress, salinity, high or low temperature and heavy metals) or biotic (hypersensitive reaction and systemic-acquired resistance) stresses (Wojtaszek, 2000; Magalhaes et al., 2006; Arasimowicz and Floryszak-Wieczorek, 2007; Neill, 2008).
It is well known that lignification, the process of sealing plant cell due to lignin deposition, is an important step during root growth. Lignin is a complex cell wall phenolic heteropolymers covalently associated with both polysaccharides and proteins. It is mainly localized in the impermeable water transport conduits of the xylem and other supporting tissues (Donaldson, 2001). Lignin is synthesized by the phenylpropanoid pathway, which is involved in the synthesis of phenolic compounds and a wide range of secondary products in plants. The first rate-limiting enzyme of this pathway is phenylalanine ammonia-lyase (PAL), which in association with other enzymes leads to the synthesis of p-coumaral-, coniferal- and sinapaldehydes. In the last step of
Previous reports have suggested a differential effect of NO on lignification of Zinnia elegans
xylem vessels. Sodium nitroprusside (SNP), widely used as NO-generating compound, inhibited POD activity but had no effect on H2O2 production. Since H2O2 is used by POD for lignification,
a possible regulatory role of NO on xylem cell wall lignification has been suggested (Ferrer and Ros Barceló, 1999; Ros Barceló et al., 2002). More recently, Gabaldón et al. (2005) described that the effect of NO on cell wall lignification denotes high complexity by suggesting that it may be a key factor mediating programmed cell death and lignification during xylem formation. Moreover, NO may affect the activity of enzymes related to the lignin biosynthesis as well as to increase the transcription of their genes (Ros Barceló et al., 2004). By taking this into account these raised points, the aim of the present report was to investigate what NO is associated with the lignification process in soybean roots. Determinations of POD and PAL activities, H2O2 level
and lignin content were carried out after treatment of soybean roots with NO-donor SNP. The experimental conditions used in this study were chosen due to root growth is characterized by high metabolic rates and lignification begining during the early stages of seedling growth.
2. Materials and methods
2.1. General procedures
Soybean (Glycine max L. Merrill, cv. BRS-133) seeds, surface-sterilized with 2% sodium
hypochlorite for 2 min and rinsed extensively with deionized water, were dark-germinated (at 25
°C) on two sheets of moistened filter paper. Twenty-five 3-day-old seedlings of uniform size were supported on an adjustable acrylic plate and transferred into a glass container (10 × 16 cm) filled with 200 ml of pH 6.0 half-strength Hoagland’s solution (pH 6.0) with or without NO-donor SNP (5 to 1000 µM). When indicated, 5 µM of potassium ferrocyanide, an analog of SNP, or 100 µM of 2-phenyl-4,4,5,5,-tetramethylimidazoleline-1-oxyl-3-oxide (PTIO), a scavenger of NO, were added to the nutrient solution, at the same time as the addition of 5 µM SNP. The container was kept in a growth chamber (25 °C, 12/12 h light/dark photoperiod, irradiance of 280
µmol m-2 s-1). Roots were measured at the beginning and at the end of experiments. The fresh
chromatographic grade.
2.2. Enzymatic assays
Phenylalanine ammonia-lyase (PAL) was extracted as described by Ferrarese et al. (2000). Fresh roots (2 g) were ground at 4 ºC in 0.1 M sodium borate buffer (pH 8.8). Homogenates were centrifuged (2,200 × g, 15 min) and the supernatant was used as the enzyme preparation.
The reaction mixture (100 µmoles sodium borate buffer pH 8.7 and a suitable amount of enzyme extract in a final volume of 1.5 ml) was incubated at 40 °C for 5 min for the PAL activity assay. Fifteen µmoles of L-phenylalanine were added to start the reaction, which was stopped after 1 h
of incubation by the addition of 50 µl of 5 N HCl. Samples were filtered through a 0.45 µm
disposable syringe filter (Hamilton Co., Nevada, USA) and analyzed (20 µl) with a Shimadzu® Liquid Chromatograph (Tokyo, Japan) equipped with a LC-10AD pump, a Rheodine® injector, a
SPD-10A UV detector, a CBM-101 Communications Bus Module and a Class-CR10
workstation system. A reversed-phase Shimpack® CLC-ODS (M) column (150 × 4.6 mm, 5 µm)
was used at 30 ºC, with an equivalent pre-column (10 × 4.6 mm). The mobile phase was methanol:water (70%:30%) with a flow rate of 0.5 ml min-1 for an isocratic run of 10 min.
Absorption was measured at 275 nm. Data collection and integration were performed with Class-CR10 software (Shimadzu®, Tokyo, Japan). t-Cinnamate, the product of PAL, was identified by
comparing its retention time with standard values. Parallel controls without L-phenylalanine or with t-cinnamate (added as an internal standard in the reaction mixture) were performed as
described elsewhere (Ferrarese et al., 2000). PAL activity was expressed as µmol t-cinnamate h-1
g-1 fresh weight.
Peroxidase (POD) was extracted from fresh roots (0.5 g) with 67 mM phosphate buffer (5 ml, pH 7.0). The extract was centrifuged (2,200 × g, 5 min, 4 °C), and the supernatant was used to
determine the activity of soluble POD. For cell wall-bound POD isolation, the pellet was washed with deionized water until no soluble POD activity was detected in the supernatant. The pellet was then incubated in 1 M NaCl (2 ml, 1 h, 4 °C), and the homogenate was centrifuged (2,200 ×
g, 5 min). The supernatant contained the cell wall-(ionically)-bound POD. Guaiacol-dependent
phosphate buffer. The guaiacol oxidation was followed for 5 min at 470 nm, and enzyme activity was calculated from the extinction coefficient (25.5 mM-1 cm-1) for tetraguaiacol. The blank consisted of a reaction mixture without enzyme extract and its absorbance was subtracted from the mixture with enzyme extract. POD activities were expressed as µmol tetraguaiacol min-1 g-1
fresh weight.
2.3 H2O2 quantification
Fresh roots (1 g) were homogenized in 3 ml of 0.1% trichloroacetic acid (Alexieva et al., 2001). The homogenate was centrifuged at 2,200 × g for 20 min. An aliquot (0.5 ml) of
supernatant was added to 0.5 ml of 10 mM phosphate buffer (pH 7.0) and 0.2 ml of 5 M potassium iodide. Absorbance was followed for 1 min at 390 nm. Whereas the blank consisted of a reaction mixture without potassium iodide, its absorbance was subtracted from the mixture with H2O2 extract. H2O2 content was calculated using a standard curve prepared with known
concentrations of H2O2. Results were expressed as µmol H2O2 g-1 fresh weight.
2.4. Lignin quantification
After the incubation period, dry roots (0.3 g) were homogenized in 50 mM potassium phosphate buffer (7 ml, pH 7.0) with a mortar and pestle and transferred into a centrifuge tube (Ferrarese et al., 2002). The pellet was centrifuged (1,400 ×g, 4 min) and washed by successive
stirring and centrifugation as follows: twice with phosphate buffer pH 7.0 (7 ml); 3 × with 1% (v/v) Triton® X-100 in pH 7.0 buffer (7 ml); 2 × with 1 M NaCl in pH 7.0 buffer (7 ml); 2 × with distilled water (7 ml); and 2 × with acetone (5 ml). The pellet was dried in an oven (60 °C, 24 h) and cooled down in a vacuum desiccator. The dry matter obtained was defined as a protein-free cell wall fraction. Further, all dry protein-free tissue was placed into a screw-cap centrifuge tube containing the reaction mixture (1.2 ml of thioglycolic acid plus 6 ml of 2 M HCl) and heated (95 ºC, 4 h). After cooling at room temperature, the sample was centrifuged (1,400 × g, 5 min)
and the supernatant was discarded. The pellet contained the complex lignin-thioglycolic acid (LTGA). The pellet was washed 3 × with distilled water (7 ml) and the LTGA extracted by shaking (30 ºC, 18 h, 115 oscillations min-1) in 0.5 M NaOH (6 ml). After centrifugation (1,400
and mixed with the supernatant obtained earlier. The combined alkali extracts were acidified with concentrated HCl (1.8 ml). After precipitation (0 °C, 4 h), LTGA was recovered by centrifugation (1,400 ×g, 5 min) and washed 2 × with distilled water (7 ml). The pellet was dried at 60 °C, dissolved in 0.5 M NaOH, and diluted to yield an appropriate absorbance for spectrophotometric determination at 280 nm. Lignin was expressed as mg LTGA g-1 dry weight.
2.5. Determination of cell viability
After incubation, all seedlings were removed to determine the loss of cell viability by using the Evans blue (a nonpermeating dye) staining spectrophotometric assay (Baker and Mock, 1994) with modifications. All freshly harvested roots treated or untreated with SNP were incubated for 15 min with 30 ml of 0.25% Evans blue solution. Then, the roots were washed with distilled water for 30 min to remove excess and unbound dye. Excised root tips (3 cm) were soaked in 3 ml of N,N-dimethylformamide for 50 min at room temperature to solubilize the dye
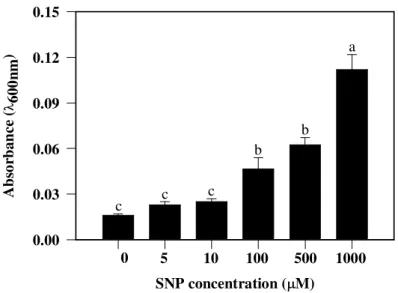
bound to dead cells. The absorbance of released Evans blue was measured spectrophotometrically at 600 nm, using deionized water as a blank. The loss of cell viability was expressed as absorbance at 600 nm of treated roots in relation to untreated roots (control).
2.6. Nitrite quantification
Nitrite contents were colorimetrically measured as described by Ridnour et al. (2000). After different periods (0 to 24 h) of incubation, samples (0.5 ml) of nutrient solution were mixed with 0.3 ml of 1% sulfanilamide, 0.3 ml of 0.1% N-(1-naphtylethylene diamine dihydrochloride, 2.5%
H2SO4) and 0.9 ml of water. Samples were incubated for 30 min in darkness, and the absorbance
was measured at 540 nm, using a blank without nutrient solution. Nitrite was quantified with a calibration curve of 5 to 25 µM sodium nitrite. Results were expressed as µM nitrite in the nutrient solution.
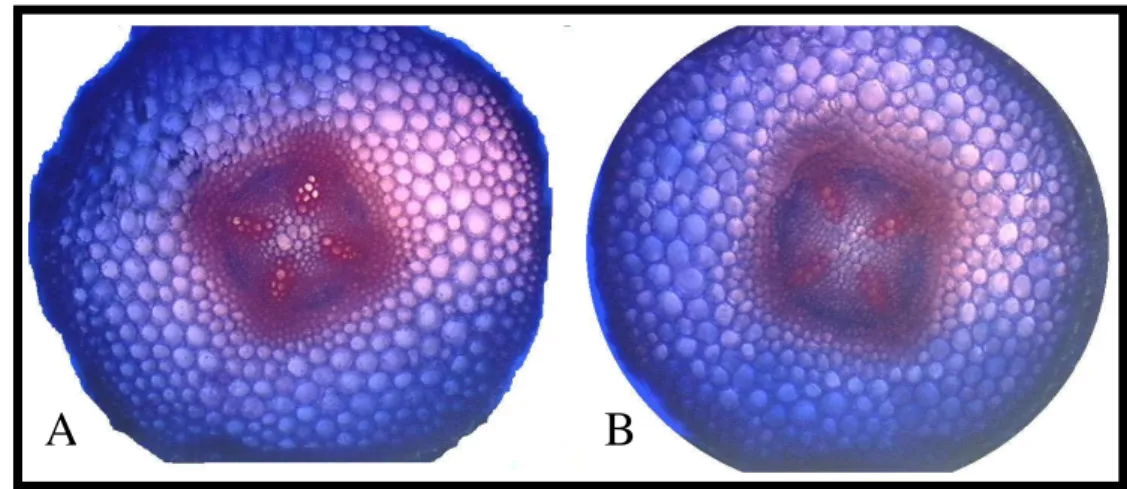
2.7. Light microscopy
hypochlorite for 5 min, rinsed with deionized water, stained with safranine astra blue, and subsequently mounted in 50% glycerin (Sewalt et al., 1997). Micrographs were photographed using an Olympus® photomicroscope. Scales were calculated using a decimal ruler and a micrometer under the same optical conditions used for each case.
2.8. Statistical analysis
The experimental design was completely randomized, and each plot was represented by one glass container with 25 seedlings. Data are expressed as the mean of four to eight independent experiments ± S.E. The one-way variance analysis to test the significance of the observed differences was performed by Sisvar package (Version 4.6, UFLA, Brazil). Differences
between parameters were evaluated by the Scott-Knott (1974) test and P values <0.05 were
considered as statistically significant.
3. Results
3.1. Root growth
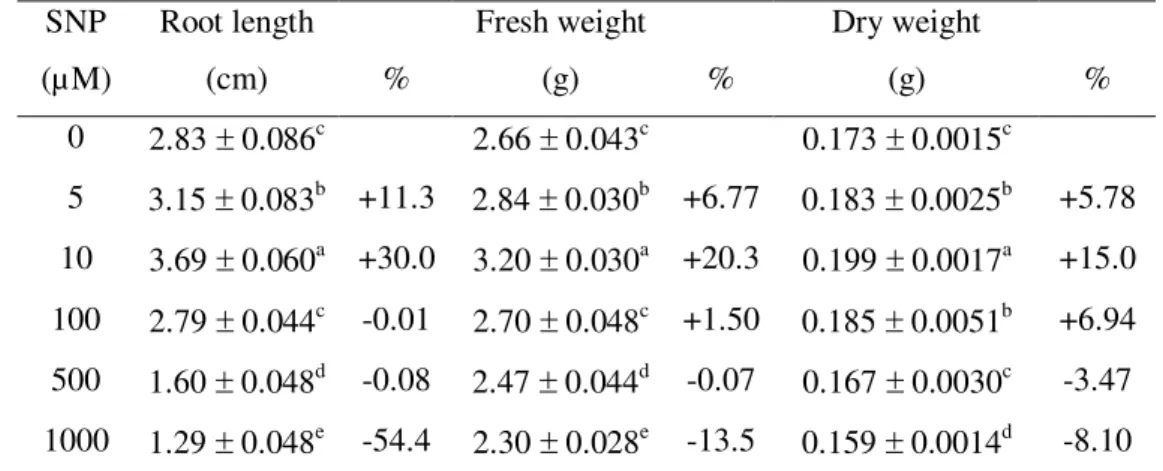
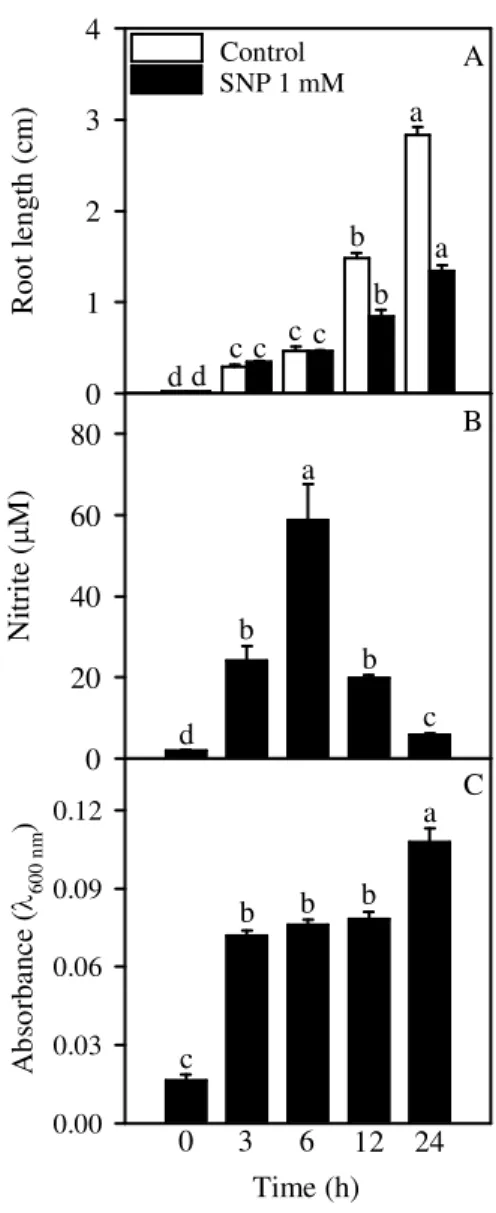
To evaluate the effects of NO on root growth, soybean seedlings were grown during short-term exposure (24 h) in nutrient solution containing 5 to 1000 µM SNP (Table 1). Significant effect on root lengths occurred after SNP treatments (compared to the control) and a dual responses was noted. Low concentrations (5 and 10 µM) enhanced root length significantly, whereas high concentrations (500 and 1000 µM) inhibited it. A similar trend was also evident in fresh roots, which significantly increased after 5 and 10 µM SNP and reduced after 500 and 1000 µM SNP treatments. Dry weights was increased by 5 to 100 µM SNP, and it was reduced after 1000 µM SNP treatment.
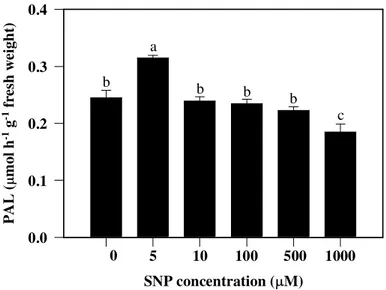
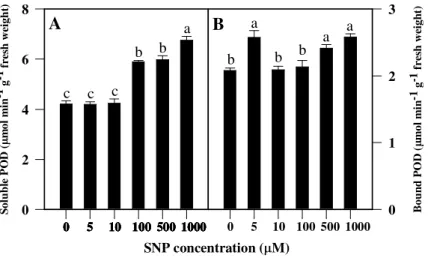
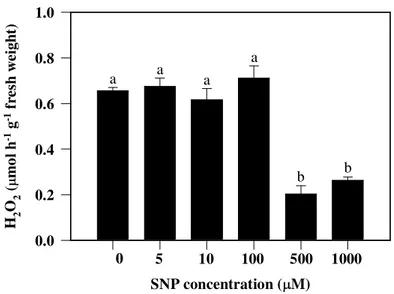
3.2. Enzymatic activities