CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAUDE DEPARTAMENTO DE GENÉTICA E EVOLUÇÃO
KARINA KIRSCHNER LOPES
ANÁLISE DA EXPRESSÃO GÊNICA DAS PEROXIRREDOXINAS EM PACIENTES COM DEFICIÊNCIA DE GLICOSE-6-FOSFATO DESIDROGENASE E DOENÇA
FALCIFORME POR HEMOGLOBINA SC
ANÁLISE DA EXPRESSÃO GÊNICA DAS PEROXIRREDOXINAS EM PACIENTES COM DEFICIÊNCIA DE GLICOSE-6-FOSFATO DESIDROGENASE E DOENÇA
FALCIFORME POR HEMOGLOBINA SC
Dissertação apresentada ao Programa de Pós- Graduação em Genética e Evolução da
Universidade Federal de São Carlos, como requisito parcial para a obtenção do título de
Mestre em Genética Evolutiva e Biologia Molecular.
Orientador: Prof. Dr. Anderson Ferreira da Cunha
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária da UFSCar
L864ae
Lopes, Karina Kirschner.
Análise da expressão gênica das peroxirredoxinas em pacientes com deficiência de glicose-6-fosfato
desidrogenase e doença falciforme por hemoglobina SC / Karina Kirschner Lopes. -- São Carlos : UFSCar, 2014. 77 f.
Dissertação (Mestrado) -- Universidade Federal de São Carlos, 2014.
1. Biologia molecular. 2. Anemia hemolítica. 3. Peroxirredoxinas. 4. Estresse oxidativo. I. Título.
Agradeço primeiramente a Deus, que foi quem permitiu que eu estivesse aqui, que sempre esteve ao meu lado, me amparando nos momentos difíceis e permitiu que eu alcançasse os objetivos, concluindo este trabalho.
Agradeço aos meus pais, familiares e amigos que sempre me apoiaram, que confiaram em mim e mesmo de longe estão sempre perto, dando força, carinho e toda atenção necessária.
Agradeço ao meu noivo Jeferson, por sempre estar ao meu lado em todos os momentos, por todo carinho e dedicação.
Agradeço ao Prof Dr Anderson Ferreira da Cunha por acreditar em mim e por ter sido mais que um orientador e sim um amigo, conselheiro, sempre querendo nosso bem, preocupado com o futuro tanto das pesquisas como nosso futuro profissional.
Agradeço ao Prof Dr Iran Malavazi que contribuiu bastante para o desenvolvimento dessa pesquisa, sendo também um orientador.
Agradeço aos colegas de trabalho do LBGA, a todos que gastaram um pouco do seu tempo me auxiliando, e principalmente, a Karen e a Sheila que me receberam de braços abertos no laboratório, me ensinaram muito e foram grandes companheiras durante tempos bons e ruins que enfrentamos durante essa pesquisa.
Agradeço aos colegas de outros laboratórios que também contribuíram para essa pesquisa.
Agradeço a todos os colaboradores do HEMOPE pelo grande auxílio
Agradeço a todos os pacientes e voluntários que cederam material para essa pesquisa, sem os quais não poderia ter sido realizada.
Agradeço à Universidade Federal de São Carlos e ao Programa de Pós Graduação em Genética e Evolução.
Agradeço aos funcionários do DGE por todo serviço prestado.
Figura 2. Representação da estrutura da molécula de hemoglobina adulta A1...15
Figura 3. Grupamento dos genes de α eβ globina e a produção de diferentes hemoglobinas durante o desenvolvimento humano...16
Figura 4. Via glicolítica ou de Emden-Meyerhoff e via das pentoses...24
Figura 5. Ciclo da glutationa peroxidase...27
Figura 6.Ciclo da tiorredoxina e tiorredoxina redutase...28
Figura 7. Mecanismos de reação das peroxirredoxinas...36
Figura 8. Lâmina de leucócitos e esfregaço de reticulócitos...41
Figura 9. Gel desnaturante de agaroseà 1,2%...42
Figura 10. Teste de cDNA com o primer da beta actina...43
Figura 11. Determinação da concentração ótima dos primers foward e reverse PRDX1...45
Figura 12. Curva de melting PRDX1...46
Figura 13. NTCs (no-template controls) PRDX1...46
Figura 14. Teste de Eficiência da PRDX1 300F/300R...48
Figura 15. Curva de melting da PRDX1...48
Figura 16. Análise da expressão gênica das peroxirredoxinas em reticulócitos de indivíduos sadios e com deficiência de glicose-6-fosfato desidrogenase...52
Figura 17. Análise de western blotting em controles e pacientes com deficiência de glicose-6-fosfato desidrogenase...53
Figura 18. Análise densitométrica das amostras de indivíduos controle e deficientes em G6PD...53
Figura 19. Análise de western blotting não-redutor do estado redox das peroxirredoxinas em controles e pacientes com deficiência de glicose-6-fosfato desidrogenase...54
Figura 20. Análise da expressão gênica da tiorredoxina e tiorredoxina redutase 1 em reticulócitos de indivíduos sadios e com deficiência de glicose-6-fosfato desidrogenase...56
Figura 21. Análise da expressão gênica das peroxirredoxinas em reticulócitos de indivíduos sadios e com hemoglobinopatia SC...57
Figura 22. Análise de western blotting em controles e pacientes com doença falciforme por hemoglobina SC...58
Figura 23. Análise densitométrica das amostras de indivíduos controle e indivíduos com hemoglobinopatia SC...58
Figura 24. Análise de western blotting não-redutor do estado redox das peroxirredoxinas em controles e pacientes com hemoglobinopatia SC...59
LISTA DE TABELAS
Tabela 1. Matriz para Padronização da Concentração Ótima de Primers Foward e Reverse...45
Tabela 2. Sequências e concentrações ótimas dos primers utilizados no qRT-PCR...47
Tabela 3. Parâmetros de importância para os primers caracterizados...49
•OH - radical hidroxila ATP - adenosina trifosfato
BFU- E –burst- forming unit- erythroid CAT – catalase
cDNA – DNA complementar
CFU- E –colony- forming units- erythroid
CuZn-SOD – superóxido dismutase cobre e zinco Cys – cisteína
CysP – cisteína peroxidásica CysR – cisteína de resolução DTPA – ácido dietileno triamina DTT – ditiotreitol
EC-SOD – superóxido dismutase extra celular EDTA - ácido etilenodiaminotetracético EPO- eritropoetina
EROS – Espécies Reativas de Oxigênio G6P - Glicose-6-Fosfato
G-6-PD A- - Variante Africana de deficiência de G6PD G6PD - Glicose-6-fosfato Desidrogenase
GAPDH – gene constitutivo gliceraldeído-3-fosfato-desidrogenase GPx - Glutationa Peroxidase
GR - Glutationa redutase GSH- Glutationa
GSH - Glutationa Reduzida GSSG - Glutationa Oxidada
HbSC - hemoglobina SC K+ - potássio
LOOH - hidroperóxidos lipídicos MCP - morte celular programada MetHb - metahemoglobina
Mn-SOD - superóxido dismutase manganês NADH - nicotinamida adenina dinucleotídio
NADPH - Nicotinamida Adenina Dinucleotídio Fosfato NO - óxido nítrico
NOS - óxido nítrico sintetase O2• - ânion superóxido
OMS - Organização Mundial da Saúde ONOOH- peróxido de nitrito
PRDX - Peroxirredoxina
qRT-PCR - PCR quantitativo em tempo real RE – retículo endoplasmático
RNA – ácido ribonucleic
RNAm – RNA mensageiro
RPM - rotações por minuto SOD - superóxido dismutase TRX - Tiorredoxina
TrxR - Tiorredoxina redutase
α- Alfa
β- Beta
δ- Delta
ε- Épsilon
γ- Gama
δ- Zeta
θ- Teta
α¹- Alfa 1
α²- Alfa 2
γA- Gama Adenina
γG- Gama Glicina O2 - Oxigênio
–CH= - Radicais Metanílicos Fe++ - Ferro Divalente
μg - Micrograma
1.1. O eritrócito ...12
1.2 A hemoglobina ...14
1.3. A célula eritrocitária e EROS ...16
1.3.1. Ânion superóxido...17
1.3.2. Peróxido de hidrogênio...18
1.3.3. Radical Hidroxila ...19
1.3.4. Peroxidação Lipídica e Hidroperóxidos de Lipídeos ...19
1.3.5. Óxido Nítrico e a Formação de Peroxinitrito ...21
1.4. Anemia hemolítica e estresse oxidativo ...22
1.4.1. Deficiência de Glicose-6-fosfato desidrogenase ...23
1.4.2. Hemoglobinopatia SC ...28
1.5. Defesas antioxidantes...30
1.5.1. Superóxido dismutase (SOD) ...30
1.5.2. Catalase ...31
1.5.3. Glutationa Peroxidase...32
1.5.4. Peroxirredoxinas ...33
1.6. Relevância biológica das peroxirredoxinas ...36
2. JUSTIFICATIVA ...38
3. OBJETIVOS ...39
3.1. Objetivo geral ...39
3.2. Objetivos Específicos ...39
4. MATERIAIS E MÉTODOS ...39
4.1. Pacientes e controles...39
4.2. Aspectos éticos da pesquisa ...40
4.3. Separação de Reticulócitos ...40
4.4. Extração de RNA ...41
4.5. Síntese de DNA complementar (cDNA) ...42
4.6. Reação de PCR quantitativo em tempo real (qRT-PCR) ...43
4.7. Padronizações para o PCR quantitativo em tempo real ...44
4.7.1. Concentração de Primer ...44
4.7.2. Eficiência de Reação ...47
4.8. Western blotting ...49
4.8.1. Extração e quantificação de proteínas ...49
4.8.2. Preparo da amostra para western redutor ...50
4.8.3. Preparo da amostra para western não-redutor ...50
5.1. Análise da expressão gênica da família de peroxirredoxinas em reticulócitos de indivíduos
sadios e com Deficiência de Glicose-6-fosfato desidrogenase ...52
5.3. Análise protéica das peroxirredoxinas no lisado celular de indivíduos sadios e com Deficiência de Glicose-6-fosfato desidrogenase ...52
5.4. Análise do estado redox das peroxirredoxinas no lisado celular de indivíduos sadios e pacientes com deficiência de glicose-6-fosfato desidrogenase ...54
5.5. Análise da expressão gênica da Tiorredoxina e Tiorredoxina redutase 1 em reticulócitos de indivíduos sadios e com Deficiência de Glicose-6-fosfato desidrogenase ...55
5.6. Análise da expressão gênica da família de peroxirredoxinas em reticulócitos de indivíduos sadios e com hemoglobinopatia SC ...56
5.7. Análise protéica das peroxirredoxinas no lisado celular de indivíduos sadios e com hemoglobinopatia SC ...57
5.8. Análise do estado redox das peroxirredoxinas no lisado celular de indivíduos sadios e pacientes com hemoglobinopatia SC ...59
5.9. Análise da expressão gênica da Tiorredoxina e Tiorredoxina redutase 1 em reticulócitos de indivíduos sadios e com Doença Falciforme por Hemoglobina SC ...60
6. DISCUSSÃO ...61
7-REFERÊNCIAS BIBLIOGRÁFICAS...65
1. INTRODUÇÃO
1.1. O eritrócito
O sangue periférico é constituído por três diferentes linhagens celulares: glóbulos vermelhos, eritrócitos ou hemácias; glóbulos brancos ou leucócitos; e plaquetas ou trombócitos. As hemácias constituem a maior população de células do sangue. Embora, sejam anucleadas, constituídas apenas por membrana plasmática e citoplasma, são bastante complexas (ZAGO; FALCÃO; PASQUINI, 2001). Todo o processo pelo qual estas células são produzidas na medula óssea é denominado eritropoiese. Sob condições normais, esse processo resulta em uma taxa de produção de hemácias de modo a manter constante a massa eritrocitária do organismo, sugerindo que o processo é finamente regulado, sendo a eritropoetina o principal e mais bem conhecido fator de crescimento envolvido (ZAGO; FALCÃO; PASQUINI, 2001; GREER et al., 2003).
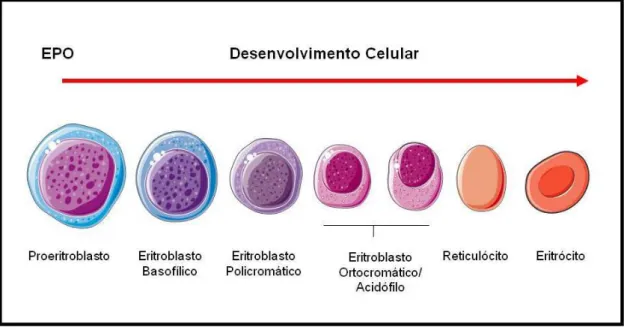
O processo de maturação eritróide envolve uma grande variedade de células em diferentes estágios começando com a primeira geração de ―stem cells‖ comprometidas com a diferenciação eritróide e terminando com células vermelhas maduras circulantes (LICHTMAN et al 1926; ZAGO; FALCÃO; PASQUINI, 2001). Após o estímulo da eritropoetina, as células passam por várias modificações que levam à formação dos eritrócitos. A primeira etapa se inicia quando a unidade formadora de crescimento rápido- eritróide (BFU- E – burst- forming unit- erythroid) dá origem à unidade formadora de colônia- eritróide (CFU- E – colony- forming units – erythroid), que se diferencia na primeira célula morfologicamente identificável como sendo da linhagem eritróide, o proeritroblasto, o qual passará por sucessivas modificações que levam a célula a diferenciar- se em eritroblasto basófilo, eritroblasto policromatófilo e eritroblasto ortocromático (ZAGO; FALCÃO; PASQUINI, 2005; HOFFMAN et al., 2008).
em seguida liberado para circulação. A maturação do reticulócito na circulação requer de um a dois dias, estes então perdem todas as organelas e têm o volume ligeiramente reduzido e a síntese de hemoglobina e a montagem da membrana são completadas. A partir deste ponto cessa a síntese protéica e perdem a capacidade de metabolismo aeróbico, restringindo-se a metabolização da glicose pela via de Emden-Meyerhoff e pela via das pentoses (LICHTMAN et al., 1926; ZAGO; FALCÃO; PASQUINI, 2001).Uma vez amadurecido completamente, o reticulócito transforma-se então em uma hemácia madura cuja vida em circulação é de aproximadamente 120 dias (Figura 1) (ZAGO; FALCÃO; PASQUINI, 2001).
Figura 1. Alterações morfológicas durante a eritropoiese em seres humanos. Após o estímulo da EPO a célula eritróide sofre várias alterações morfológicas que levam à formação de eritrócitos maduros. Para mais detalhes ver o texto. Figura adaptada de DA CUNHA et al., 2012.
As hemácias maduras têm a forma homogênea de corpúsculos circulares, bicôncavos e de tamanho relativamente uniforme, com diâmetro médio de 8µm (ZAGO; FALCÃO; PASQUINI, 2001). A organização estrutural da membrana celular dos eritrócitos permite que eles sofram grandes deformações mantendo sua integridade estrutural durante sua permanência no sistema circulatório (YAWATA, 2003).
Portanto, as células vermelhas possuem uma maquinaria metabólica ativa que fornece energia para bombear íons contra gradientes eletroquímicos e para manter a hemoglobina na forma reduzida. A principal fonte de energia metabólica vem da glicose. A glicose é metabolizada pela via glicolítica e através da via das pentoses (BLEUTER, 2001).
Após o período de 120 dias na circulação, em condições normais, os eritrócitos sofrem várias alterações morfológicas, causadas principalmente pela redução de sua atividade metabólica e pela oxidação da hemoglobina (GHAFFARI, 2008). Estas alterações são reconhecidas pelo sistema mononuclear fagocitário que é constituído por células fagocíticas (macrófagos e monócitos) presentes no fígado e no baço, principais responsáveis pela remoção dos eritrócitos da circulação. O aumento acelerado da destruição dos eritrócitos é a característica mais importante encontrada em várias doenças hemolíticas. (TELEN; KAUFMAN, 1999; HOFFMAN et al., 2008).
1.2 A hemoglobina
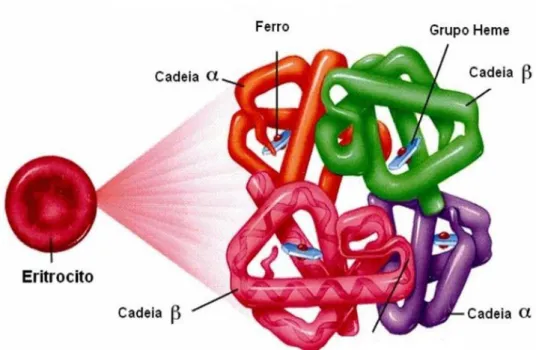
As funções primordiais dos glóbulos vermelhos são a de transportar oxigênio dos pulmões aos tecidos, mantendo a perfusão tissular adequada, e transportando gás carbônico dos tecidos aos pulmões. A hemoglobina, que constitui 95% das proteínas das hemácias, é a responsável por estas funções (ZAGO; FALCÃO; PASQUINI, 2005). O restante inclui enzimas necessárias para a produção de energia e para a manutenção da hemoglobina em seu estado funcional, reduzida (GREER et al. 2003).
Figura 2. Representação da estrutura da molécula de hemoglobina adulta A1. A hemoglobina é formada por quatro cadeias polipeptídicas, duas do tipo alfa e duas do tipo beta, cada uma delas associada a um grupamento heme, contendo um átomo de ferro ao qual se liga o oxigênio de modo reversível. (Disponível em: http://www.kacr.or.kr/img/gene_expression/hemoglobin.jpg)
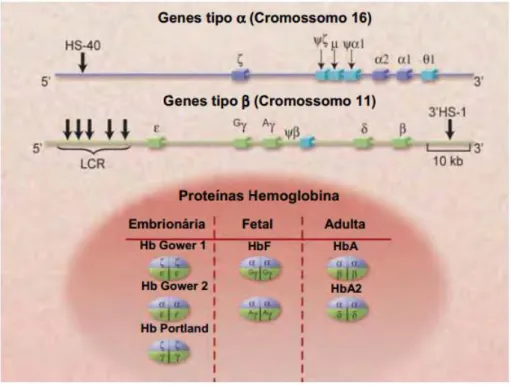
Os genes, que expressam as cadeias protéicas, localizam-se em dois grupamentos cromossômicos diferentes ( e ), localizados nos braços curtos dos cromossomos 16 e 11, respectivamente. No grupamento incluem os genes para as cadeias zeta ( ), alfa ( ) e teta ( ), enquanto que o grupamento é constituído dos genes para as cadeias épsilon ( ), gama ( A e B), delta ( ) e beta ( ). Durante o desenvolvimento ontogenético normal, ocorrem mudanças na expressão desses genes, que são os responsáveis pelos diferentes tipos de hemoglobinas humanas (DZIERZAK, 2001).
A1 (α2β2) que aumenta gradativamente. Há também outra hemoglobina encontrada no adulto normal formada pela combinação das globinas α e δ denominada hemoglobina A2 (α2δ2), representando 2– 3% da hemoglobina total. A síntese de hemoglobina fetal pode não cessar
totalmente e seu nível se mantém entre 0 – 1% (WEATHERALL; CLEGG, 1981;
STEINBERG, 2005). (Figura 3).
Figura 3. Grupamento dos genes de α e β globina e a produção de diferentes hemoglobinas durante o
desenvolvimento humano. Os genes responsáveis pela síntese das cadeias globínicas estão organizados em dois
grupamentos gênicos localizados em cromossomos diferentes. O grupamento α localiza- se no braço curto do cromossomo 16, é constituído pelos genes δ2, α1 e α2. O grupamento β está situado no braço curto do
cromossomo 11, e possui os genes ε, Aγ e Gγ e pelos genes delta δ e β. Durante o desenvolvimento ontogenético, ocorrem mudanças na expressão desses genes, formando os diferentes tipos de hemoglobinas humanas. (Adaptado de SCHECHTER, 2008).
1.3. A célula eritrocitária e EROS
2010) e em grande parte pela mitocôndria durante o metabolismo aeróbico normal (HALLIWELL; GUTTERIDGE, 2007).
Apesar da ausência de mitocôndrias, EROs são continuamente produzidas nas células vermelhas devido à elevada tensão de oxigênio no sangue e a quantidade abundante de ferro do grupamento heme na hemoglobina. Vários fatores levam a geração de radicais oxidantes, tais comoo radical ânion superóxido (O2• -), peróxido de hidrogênio (H2O2) e o radical hidroxila (•OH) nos eritrócitos (ÇIMEN, 2008).
1.3.1. Ânion superóxido
Nos eritrócitos, a fonte primária de EROs é a própria proteína carreadora de O2, ou seja a Hb que sofre auto-oxidação produzindo o O2- (ÇIMEN, 2008). Durante a ligação reversível do oxigênio a hemoglobina, o ferro é mantido em seu estado ferroso (Fe 2+). No entanto, eventuais flutuações conformacionais espontâneas no grupamento heme da oxiHb (oxihemoglobina) permite que água ou um ânion entre, resultando na transferência de um elétron do ferro para o oxigênio para produzir metHb (metahemoglobina) e ânions superóxido (LOW; HAMPTON; WINTERBOURN, 2008).
No caso do transporte de oxigênio, o ferro necessita estar na sua forma reduzida (Fe 2+), caso isto não ocorra este pode se desprender da Hb. A redução do O2 em O2 - é acompanhada da oxidação do átomo de ferro da hemoglobina, formando a metahemoglobina, a qual não é mais capaz de se ligar ou transportar O2. Nos eritrócitos humanos aproximadamente 3% do total das moléculas de Hb se transformam em MetHb diariamente. Esta MetHb pode ser reduzida pela via NADH citocromo ou pela via 5-metHb redutase (metahemoglobina redutase) e metHb redutase dependente de NADPH (KENNETT et al. 2005).
1.3.2. Peróxido de hidrogênio
O ânion superóxido (O2•-) pode ser convertido a peróxido de hidrogênio (H2O2) por dismutação espontânea ou catalisada pela enzima superóxido dismutase (SOD) (HALLIWELL; GUTTERIDGE, 2007). Como indicado na reação abaixo:
SOD
2O2•− + 2H+H2O2 + O2
Uma vez que as hemácias têm altos níveis de superóxido dismutase, o O2- produzido será convertido em H2O2 (JOHNSON et al., 2005), que pode atravessar as membranas celulares quase tão facilmente quanto a água ao contrário do O2•- que necessita de canais aniônicos para sair (HALLIWELL; GUTTERIDGE. 2007).
Por ser um composto de alta permeabilidade em membranas, este também pode vir de fontes extracelulares para o eritrócito. Neste contexto, um fato de grande importância é que o eritrócito é considerado um ―coletor‖ e decompositor universal de H2O2 dos organismos, pois além de desintoxicar oxidantes gerados endogenamente, os eritrócitos são capazes de atuar como um dissipador para o peróxido de hidrogénio extracelular, uma vez que possui acesso a praticamente todos os tecidos do corpo, além do número destas células ser extremamente abundante (BROWN et al., 1989; AOSHIBA et al., 1999; LOW; WINTERBOURN; HAMPTON, 2008).
O peróxido de hidrogênio não é um radical livre em si, mas é geralmente incluído sob o título geral de espécie reativa de oxigênio (ERO). Ele é um fraco agente oxidante que pode danificar diretamente as proteínas e enzimas que contêm grupos tiol reativos. No entanto, como já foi dito, sua propriedade mais importante é a capacidade de atravessar membranas celulares livremente (YOUNG; WOODSIDE, 2001).
1.3.3. Radical Hidroxila
O radical hidroxila (-•OH) é, provavelmente, o mediador final de maior dano tecidual induzido por radicais livres. Todas as espécies reativas de oxigênio descritas acima exercem a maior parte dos seus efeitos patológicos, dando origem à formação de radicais hidroxila. O radical hidroxila reage com constantes extremamente elevadas com quase todo o tipo de molécula encontrada em células, incluindo açúcares, aminoácidos, lipídeos e nucleotídeos (LLOYD; HANNA; MASON, 1997).
Embora a formação de radicais hidroxila possa ocorrer de várias maneiras, o mecanismo in vivo mais importante é a decomposição de superóxido e de peróxido de hidrogênio catalisada por metal de transição. No caso, o ferro e o cobre desempenham um papel-chave na produção de radicais hidroxila in vivo. Isso ocorre devido à reação de Fenton (representada abaixo) onde o H2O2 reage com o ferro (2+) ou cobre gerando o radical •OH (STOHS; BAGCHI, 1995; FIBACH; RACHMILEWITZ, 2008).
Reação de Fenton H2O2 + Fe2+ -•OH + OH-+ Fe3+
Como evidenciado na reação acima, o ferro tem um papel crucial na geração de •OH. De fato, na presença de ferro a toxicidade de H2O2 pode ser potencializada em até 1000 vezes (FIBACH; RACHMILEWITZ, 2008).
1.3.4. Peroxidação Lipídica e Hidroperóxidos de Lipídeos
Os ácidos graxos poliinsaturados da membrana do eritrócito quando em contato com as EROs iniciam o processo de peroxidação lipídica (ou lipoperoxidação), mecanismo pelo qual os lipídios são atacados com energia suficiente para formar radicais orgânicos que reagem com o oxigênio e resultam no radical peroxil (PRATICO; DELANTY, 2000).
LH + OH. (ou LO.) ———> L.+ H2O (ou LOH) Iniciação
L. + O
2———> LOO. Propagação
LH + LOO.———> L.+ LOOH Propagação
LOO. + L.———> LOOL Terminação
LOO. + LOO.———> LOOL + O2 Terminação
A primeira etapa desse processo, denominada iniciação, inicia-se com o sequestro do hidrogênio do ácido graxo polinsaturado (LH) da membrana celular. Tal sequestro pode ser realizado pelo OH. ou pelo LO. (radical alcoxila), com conseqüente formação do L. (radical lipídico).Na primeira equação de propagação, o L. reage rapidamente com o O
2,resultando em LOO. (radical peroxila), o qual é capaz de abstrair um átomo de H de outro lipídeo insaturado resultando em um novo radical lipídico e formando um peróxido de lipídeo (LOOH).O término da lipoperoxidação ocorre quando os radicais (L. e LOO.) produzidos nas etapas anteriores propagam-se até destruirem-se a si próprios (GUTTERIDGE 1995; FERREIRA; MATSUBARA, 1997).
A lipoperoxidação pode ser catalisada por íons ferro, por conversão de hidroperóxidos lipídicos (LOOH) em radicais altamente reativos (alcoxila, LO* e peroxila, LOO*), que, por sua vez, iniciam nova cadeia de reações, denominada ramificação (FERREIRA; MATSUBARA, 1997).As constantes para esta reação são de 1.5 103M-1s-1 na presença Fe2+ e são significativamente maiores que as alcançadas pela reação de Fenton para H2O2 as quais possuem taxas de 76 10M-1s-1 (GUTTERIDGE, 1995; HALLIWELL; GUTTERIDGE. 2007).
Devido à grande intimidade entre os lipídeos presentes na membrana plasmática e as proteínas de membrana, as quais podem chegar até 50% de sua composição, a peroxidação lipídica causa danos substanciais às proteínas constituintes (GUTTERIDGE, 1995). A peroxidação lipídica das membranas biológicas ocasiona perda de fluidez, queda do potencial de membrana, aumento da permeabilidade ao H+ e outros íons que resultam na ruptura e extravasamento do conteúdo celular (GIROTTI, 2008).
Além disso, as reações dos radicais livres resultam em mudanças na estrutura, transporte e antigenicidade nas membranas celulares. Nas hemácias, por exemplo, a peroxidação dos fosfolipídios, causa consequentemente um aumento da rigidez e deformidade das membranas, que por sua vez aumenta a suscetibilidade destes à hemólise (MAFRA et al., 1999). Adicionalmente, alguns produtos da fragmentação lipídica são citotóxicos (ESTERBAUER 1993; CATALA, 2009).
1.3.5. Óxido Nítrico e a Formação de Peroxinitrito
Os peroxinitritos e espécies reativas contendo nitrogênio também apresentam grande relevância para a célula eritrocitária, uma vez que o óxido nítrico (NO) é o terceiro gás mais abundante transportado juntamente com O2 e CO2 pelas células eritrocitárias. O NO é um importante componente em diversos processos/sistemas atuando na resposta imunológica e processos inflamatórios, crescimento e diferenciação celular, e também influenciando de forma bastante relevante no sistema circulatório, uma vez que está relacionado com a inibição de agregação plaquetária e nos processo de vaso-constrição e vaso dilatação (MONCADA; HIGGS, 1991; HAN et al. 2003; GLADWIN; CRAWFORD; PATEL, 2004; ROMERO; DENICOLA; RADI, 2006).
Entretanto, o NO pode reagir com o O2 - para formar um intermediário bastante reativo o peróxido de nitrito (ONOO-), conforme reação abaixo. Esta espécie é um poderoso oxidante capaz de causar danos em diversas biomoléculas e em pHs acídicos pode se
decompor em dióxido de nitrogênio (NO2 ) e •OH (GUTTERIDGE, 1995; SZABÓ;
ISCHIROPOULOS; RADI, 2007), os quais atuarão na peroxidação lipídica e nitrosilação de lipídeos, proteínas e DNA (GOLDSTEIN; CZAPSKI, 2000).
-Na circulação os eritrócitos são os maiores responsáveis pelo seqüestro de NO, justamente por conter altos níveis de Hb, seja através de reações diretas com os grupamentos prostéticos da hemoglobina ou através de resíduos de cisteína das cadeias da molécula (ULKER et al., 2009). A adição de um grupo NO a tióis protéicos (RSNO) forma um nitroso tiól em um processo denominado de S-nitrosilação e já foi demonstrado que a S- nitrosilação da hemoglobina é facilitada pela alteração conformacional da molécula induzida pelo O2. Assim ao reagir com a Hb ligada ao Oxigênio (HbFe+2O2 ) o NO é convertido a nitrato, ao passo que na reação sem o oxigênio (HbFe+2) forma HgbFe+2NO. O gradiente de O2 das arteríolas promove a transição alostérica na Hb o qual libera NO e promove o aumento do fluxo sanguíneo (ZHANG et al., 2005; GRUBINA et al., 2007).
1.4. Anemia hemolítica e estresse oxidativo
O envelhecimento dos eritrócitos parece ser um processo multifatorial sendo que os mecanismos envolvidos ainda não foram totalmente esclarecidos (CAPRARI et al., 1999). Uma das explicações seria a teoria do envelhecimento através de EROs, na qual a degradação destas células viriam como resultado de danos oxidativos acumulados em biomoléculas com o passar do tempo de vida (TANG, 1997; MULLER et al., 2007). Este processo é resultado principalmente da formação de agregados de proteínas de banda 3, que é uma das proteínas mais abundantes na membrana do eritrócito, e que são estabilizados por moléculas de hemoglobina oxidada, conhecida como hemicromo. Isso causaria a perda da assimetria dos lipídeos de membrana através do reconhecimento desses agregados como antígenos por anticorpos IgG e do sistema complemento (ZAGO et al., 2001).
Em situação normal, a destruição dos eritrócitos acontece na mesma razão que a eritropoese de forma a manter o número de eritrócitos circulantes (ZAGO et al., 2005). Um aumento na destruição ou remoção dos eritrócitos da circulação antes da sua duração normal de 120 dias é característica do processo de hemólise. Esta pode ser uma condição assintomática, porém, quando a produção de eritrócitos não pode acompanhar o ritmo de sua destruição, caracteriza um quadro de anemia hemolítica (DHALIWAL; CORNETT; TIERNEY, 2004).
entre a formação das espécies reativas de oxigênio e as defesas antioxidantes o resultado é o estresse oxidativo (YOUNG; WOODSIDE, 2001).
O estresse oxidativo é responsável por agravar os sintomas de muitas doenças, incluindo este tipo de anemias. Embora não seja a etiologia primária destas doenças, o dano oxidativo desempenha para as células eritróides um papel crucial na hemólise levando a eritropoiese ineficaz na medula óssea e a curta sobrevivência das células vermelhas na circulação (FIBACH; RACHMILEWITZ, 2008).
Diversos estudos mostram que eritrócitos humanos expostos a um elevado nível de estresse oxidativo apresentam alterações celulares como denaturação oxidativa da Hb, lipídeos de membrana peroxidados e diversas proteínas de membrana agregadas, formando complexos de alto peso molecular, resultando na diminuição da sobrevida dessas células. Sabe-se que a morte celular programada (MCP) de eritrócitos é bastante aumentada em doenças hematológicas como, por exemplo, na doença falciforme, beta talassemia e deficiência de G6PD (RUSANOVA et al., 2010).
Nestas patologias, o ambiente celular é extremamente pro-oxidante seja por conta da geração ineficiente de NADPH, seja pela formação de MetHb resultando em danos oxidativos e consequente hemólise das células que por sua vez favorecem a formação dessas espécies em outros tipos celulares (FIBACH; RACHMILEWITZ. 2008). Como veremos a seguir:
1.4.1. Deficiência de Glicose-6-fosfato desidrogenase
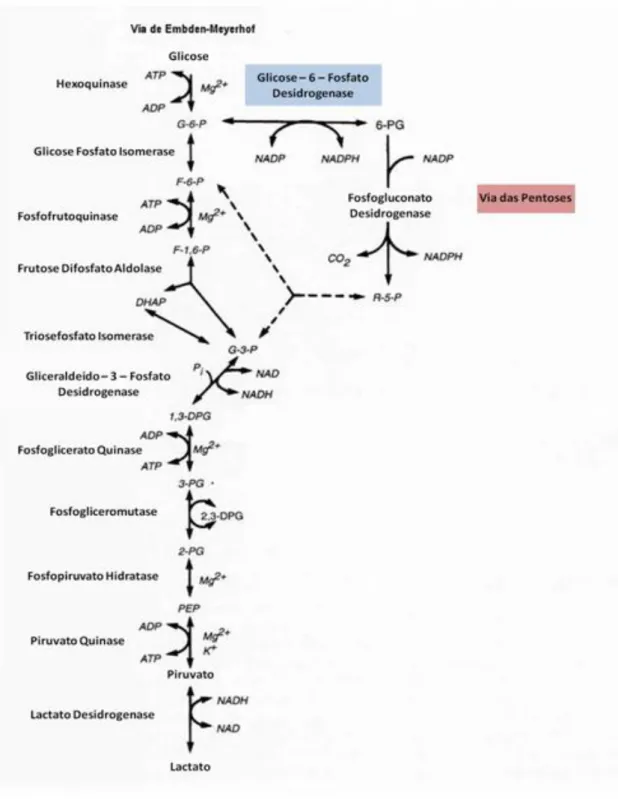
Figura 4. Via glicolítica ou de Emden-Meyerhoff e via das pentoses. A via glicolítica ou via de Emden-Meyerhof é a principal via de consumo da glicose nos eritrócitos para produção de ATP, com desvio para via das pentoses, esta que é ativada em resposta ao estresse oxidativo para produção de NADPH pela ação da glicose-6-fosfato desidrogenase (destacada em azul), enzima que participa da primeira reação desta via. Adaptado de LUKENS, 1998.
vermelhos nos seres humanos. Estima-se que cerca de 400 milhões de pessoas são afetadas por essa deficiência (ELYASSI; ROWSHAN, 2009). A prevalência global desta doença se encontra geograficamente correlacionada às áreas endêmicas em malária, sendo maiores na África Sub-Sahariana, Oriente Médio, Sudeste da Ásia, Europa Mediterrânea e algumas áreas da América Latina (NKHOMA et al., 2009). A deficiência de G6PD parece proteger contra a infecção por Plasmodium falciparum. Glóbulos vermelhos com deficiência de G6PD parasitados são fagocitadas mais facilmente pelos macrófagos que células vermelhas parasitadas que possuem atividade normal de G6PD (LUZATTO; NOTARO, 2001).
É causada por mutações no gene codificante para G6PD localizado no cromossomo X (locus Xq28), e a expressão fenotípica é mais freqüente em homens hemizigotos e mulheres homozigotas, tendo padrão de herança recessivo ligado ao sexo (KATSURAGAWA, 2004).
Estudos realizados na população brasileira revelaram uma prevalência de deficientes de G6PD em torno de 1% a 10%, com os maiores índices sendo encontrados entre os homens de ascendência africana (MAIA et al., 2010).
Mais de 160 mutações diferentes foram determinadas (BEUTLER; VULLIAMY, 2002), sendo a maioria, mutações pontuais e pequenas deleções que causam defeitos estruturais na enzima. Na maioria dos casos, essas mutações causam instabilidade da enzima ou atividade alterada, geralmente por diminuição da afinidade de G6PD para com os seus substratos, NADP+ ou glicose-6-fosfato (G6P) (LUZZATTO, 2006).
Em 1967, a OMS (Organização Mundial da Saúde) fez recomendações iniciais para a caracterização da deficiência de G6PD. Inicialmente, a deficiência G6PD foi caracterizada bioquimicamente, medindo a atividade da enzima residual e mobilidade eletroforética. Utilizando esses critérios, mais de 400 variantes bioquímicas de G6PD foram definidas (CAPELLINI; FIORELLI, 2008).
Das variantes de G-6-PD com atividade deficiente, as de maior importância pela sua freqüência são a variante Africana ou A-, que ocorre comumente em descendentes daquele continente, bem como no sul da Itália, Espanha, Portugal e Península Arábica, a variante Mediterrânea, que é encontrada mais usualmente em italianos, também em gregos, judeus orientais, árabes e persas; a variante Cantão, freqüente no sul da China; a variante Seattle, com alta freqüência na Sardenha, Grécia e sul da Itália, embora tenha sido descrita pela primeira vez nos EUA; e a variante Union, encontrada em chineses e no sul da Itália (VULLIAMY; LUZZATO; MASON, 1992).
As variantes mais encontradas no Brasil foram a africana (G-6-PD A-) e a Mediterrânea, sendo que 95% a 99% dos deficientes de G-6-PD apresentam a variante africana (COMPRI; SAAD; RAMALHO, 2000; GARLIP; RAMALHO, 1988).
Defeitos da classe I, provavelmente, são causadas por mutações na região da enzima onde NADP+ ou G6P se liga. A base genética para as outras classes é desconhecida. Deficiências de Classe I são raras e podem ser graves o suficiente para causar dependência de transfusão. Eritrócitos desses pacientes têm uma vida útil consideravelmente menor que a dos eritrócitos saudáveis, mesmo quando eles não estão expostos ao estresse oxidativo (PETERS; VAN NORDEN, 2009).
Os pacientes com classe II, III, IV são geralmente assintomáticos. Deficiências da classe III são os defeitos mais comuns e a hemólise, que ocorre devido a presença de um agente que leva ao estresse oxidativo é auto-limitante nesta classe, apenas os eritrócitos mais velhos não têm G6PD ativo suficiente para compensar episódios de estresse oxidativo, a variante G-6-PD A- é classificada como do tipo III (BEUTLER; DUPARC 2007). Já a Mediterrânea é classificada como de classe II, estas são geralmente assintomáticas, mas ambos os eritrócitos jovens e velhos são suscetíveis ao estresse oxidativo. Hemólise nesta classe é muito mais grave e não é auto-limitante pois a hemólise cessa somente após a remoção do agente causador de estresse (PETERS; VAN NORDEN 2009).
de numerosos compostos essenciais para sobrevivência da hemácia (como grupamentos tióis de proteínas de membrana), formação de corpos de Heinz, aumento do cálcio intra-eritrocitário e finalmente hemólise da célula (ABBOUD; AL-AWAIDA. 2010).
Isso ocorre pois, como foi dito anteriormente, o NADPH é um modelador crítico do potencial redox intracelular (Paglialunga et al. 2004). Catalase, uma enzima antioxidante que converte o peróxido de hidrogênio a água e oxigênio, é NADPH independente, mas um sítio alostérico essencial de ligação para NADPH mantém catalase na sua conformação mais ativa e a protege contra a toxicidade do peróxido de hidrogênio, inibindo sua inativação (KIRKMAN; GAETANI, 1984; ZHANG et al., 2010).
Também é utilizado pelos sistemas tiorredoxina e glutationa para regenerar as formas reduzidas que então serão utilizadas em funções antioxidantes (ZHANG et al., 2010). A glutationa quando oxidada (GSSG), é convertida de volta para a glutationa reduzida (GSH) pela glutationa redutase (GR), utilizando NADPH (Sobhakumar et al. 2012), como mostrado abaixo (Figura 5). No caso das Prdx 1-cys a glutationa parece ser seu agente redutor (FISHER, 2011).
Figura 5. Ciclo da glutationa peroxidase. NADPH é utilizado pela glutationa redutase (GR) para reduzir glutationa oxidada (GSSG) a glutationa reduzida, esta então será utilizada como substrato pela glutationa peroxidase (GPx) para eliminar o peróxido de hidrogênio (Peter e van Norden, 2009)
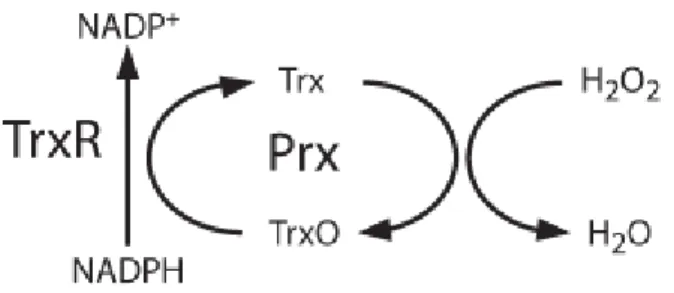
Figura 6. Ciclo da tiorredoxina e tiorredoxina redutase. NADPH é utilizado pela Tiorredoxina redutase (TrxR) para reduzir tiorredoxina oxidada (TrxO) a tiorredoxina (Trx), esta então irá reduzir a peroxirredoxina e esta consumirá o peróxido de hidrogênio (PETER; VAN NORDEN, 2009).
Como visto, o NADPH é essencial no ciclo catalítico das PRDX, entretanto a relação com estas proteínas na deficiência de G6PD ainda não foi explorada.
1.4.2. Hemoglobinopatia SC
Como dito anteriormente, o indivíduo adulto normal apresenta hemoglobina com quatro cadeias polipeptídicas, sendo duas alfa ( ) e duas beta ( ) (ZAGO et al. 2001).
Porém, podem ocorrer algumas alterações que modificam a estrutura da hemoglobina e outras nas quais uma ou mais cadeias globínicas são sintetizadas a uma taxa reduzida. O primeiro grupo é chamado de hemoglobinopatias estruturais e o segundo, de talassemias (WEATHERALL; CLEGG, 1999).
Em função da miscigenação da população brasileira, houve disseminação dos genes que dão origem às hemoglobinas variantes e determinam estas hemoglobinopatias e talassemias. (NAOUM, 1997; ZAGO; PINTO, 2007). Dentre as hemoglobinopatias estruturais, a doença falciforme, grupo de doenças que incluem indivíduos com anemia falciforme (hemoglobina - Hb SS) e distúrbios heterozigotos compostos (Hb SC, Hb SD, etc.) é a patologia hereditária monogênica mais freqüente e a mais impactante no mundo (PEREIRA et al. 2013).
A hemoglobina S (α2/βS2) tem propriedades físico-químicas diferentes da hemoglobina normal devido à perda de duas cargas elétricas por molécula de hemoglobina(em razão da perda do ácido glutâmico). A hemoglobina mutante apresenta diferente estabilidade e solubilidade, quando a Hb S é desoxigenada ocorreuma interação hidrofóbica com outras moléculas de hemoglobina, desencadeando uma agregação em polímerosque resulta em alterações na estrutura da hemácia, levando a deformação, que em última instância desenvolve a forma de foice (do inglês sickle) que é a característica morfológica principal da doença, e o enrijecimento da membrana celular responsáveis pela vaso oclusão e a lesão tecidual que representam os principais eventos fisiológicos ligados a doença (BUNN; FORGET, 1986; ROSSE et al., 2000).
Já a doença da hemoglobina SC (HbSC) é uma condição heterozigótica, na qual um dos alelos possui a mutação descrita acima, responsável pela formação da HbS, e o outro possui uma mutação diferente, porém na mesma posição, e que causa a substituição do ácido glutâmico por uma lisina formando a hemoglobina C (NAOUM, 1997). Os pacientes heterozigotos para HbS e HbC (HbSC) constituem cerca de um terço dos casos de doença falciforme, tornando o genótipo HbSC a segunda forma mais comum de anemia falciforme (DALIBALTA et al. 2010).
Os pacientes com Hb SC são duplos heterozigotos herdando um gene βS-globina de um parental e um gene βC-globina do outro. Os eritrócitos destes indivíduos geralmente contêm cerca de 50% das células falciformes Hb S, 50% de Hb C e nenhuma Hb A (BUNN et al., 1982). Na doença HbSC, onde as concentrações iguais de HbS e HbC coexistem, HbC aumenta as propriedades patogênicas de HbS, resultando em uma desordem clinicamente significativa (NAGEL; FABRY; SETEINBERG, 2003).
Os pacientes com HbSC tem uma anemia hemolítica ao longo da vida de gravidade moderada e podem desenvolver episódios vaso-oclusivos e danos a órgãos similares aos observados na anemia falciforme (BUNN et al., 1982). Osteonecrose do osso é quase tão comum, retinopatia proliferativa falciforme é muito mais prevalente na HbSC doença do que na anemia falciforme. E o tempo de vida de pacientes com doença de HbSC é reduzido quando comparado com as populações de controle (NAGEL; FABRY; SETEINBERG, 2003).
Acredita- se que, no caso da anemia falciforme, os eritrócitos falcizados estejam sob constante estresse oxidativo e, assim liberem produtos de degradação da HbS (complexos Fe 2+ e Fe 3+), que atacam a membrana eritrocitária e catalisam a destruição de hidroperoxidos lipídicos (BECKER et al., 2004). Porém, nada foi descrito sobre o efeito desse estresse e a defesa antioxidante das peroxirredoxinas em pacientes com doença falciforme por hemoglobina SC.
1.5. Defesas antioxidantes
A exposição a radicais livres, a partir de uma variedade de fontes levou os organismos a desenvolver uma série de mecanismos de defesa. Os mecanismos de defesa contra o estresse oxidativo induzido por radical livre envolvem: (i) mecanismos de prevenção, (ii) os mecanismos de reparo, (iii) as defesas físicas, e (iv) as defesas antioxidantes. As defesas antioxidantes podem ser classificadas nas categorias não-enzimáticas e enzimáticas. Defesas antioxidantesnão-enzimáticas são representadas por ácido ascórbico (vitamina C), α-tocoferol (vitamina E), glutationa (GSH),carotenóides, flavonóides, e outros antioxidantes. E as enzimáticas incluem a superóxido dismutase(SOD), glutationa peroxidase (GPx), catalase (CAT). Além de proteínas redox como as tiorredoxinas e peroxirredoxinas. (VALKO et al. 2007; BIRBEN et al. 2012). As defesas enzimáticas estão abaixo descritas:
1.5.1. Superóxido dismutase (SOD)
três formas de SOD: CuZn-SOD que é citosólica, Mn-SOD mitocondrial, e a SOD extracelular (EC-SOD) (MATÉS; PÉREZ-GÓMES; CASTRO, 1999).
Uma vez que é o ânion superóxido é a espécie reativa de oxigênio primária produzida a partir de uma variedade de fontes, a sua dismutação pela SOD é de importância primária para cada célula (BIRBEN et al., 2012). Assim, a SOD constitui o primeiro passo enzimático que desempenha um papel fundamental no controle celular do ânion superóxido, catalisando a dismutação deste a oxigênio e peróxido de hidrogênio (AL-GUBORY; FOWLER; GARREL, 2010). Como mostrado abaixo:
Sod
2 O2•- + 2H+O2 + H2O2
SOD destrói O2•- com taxas de reação extremamente altas, por oxidação e redução sucessiva do íon de metal de transição no sítio ativo em um mecanismo do tipo "ping-pong" (MATÉS; PÉREZ-GÓMES; CASTRO. 1999). A reação química do ânion superóxido com o grupo prostético de SOD começa com a forma oxidada da enzima (Fe3 +, Cu2 + e Mn3 +, respectivamente) ligando ao ânion superóxido, adquirindo um próton e liberando oxigênio molecular. A forma reduzida da enzima (Fe 2 +, Cu + e Mn2 +), em seguida, liga-se a um segundo ânion superóxido e um próton, para libertar H2O2 e retornar ao seu estado oxidado (JOHNSON; GIULIVI, 2005).
O controle da produção de H2O2 é o segundo passo enzimáticoque desempenha um papel vital contra a propagação de ROS (AL-GUBORY; FOWLER; GARREL, 2010).
O peróxido de hidrogênio produzido pode ser decomposto por uma série de enzimas celulares. Entre elas estão a catalase (Cat), as glutationa peroxidases (Gpx) e as peroxirredoxinas (PRDX), as quais atuam em conjunto com as Sod.
1.5.2. Catalase
dos quais contém um grupo heme no local ativo. Também se liga NADPH como um equivalente redutor para evitar a inativação oxidativa da enzima por H2O2 (BIRBEN et al. 2012).
Esta enzima é extremamente eficiente e pode decompor milhões de moléculas de H2O2 por segundo (~107M/Sec). A maior atividade está presente no fígado e eritrócitos, mas pode ser encontrada em todos os tecidos (YOUNG; WOODSIDE, 2001). Nos eritrócitos, a catalase protege a hemoglobina através da remoção de mais da metade do peróxido de hidrogênio gerado em eritrócitos humanos normais, que estão expostos a concentrações de oxigênio substanciais (GAETANI et al., 1989).
A catalase é mais eficaz na presença de concentrações elevadas de H2O2. No entanto, na presença de baixas concentrações quer de H2O2 ou outros peróxidos, o sistema glutationa desempenha um papel crítico (COMHAIR; ERZURUM, 2002), atua conservando os grupos sulfidrilas (SH), necessários à manutenção da integridade da membrana eritrocitária, evitando desta forma a oxidação da hemoglobina, conseqüentemente a formação de corpos de Heinz. A formação de corpos de Heinz no interior do eritrócito promove sequestração esplênica, com encurtamento do tempo de vida do eritrócito podendo levar a uma anemia hemolítica (BEUTLER, 1981).
1.5.3. Glutationa Peroxidase
Conforme representação abaixo:
Gpx
(1) 2GSH + H2O2 GSSG + 2H2O Gpx
(2) 2GSH + ROOH GSSG + ROH + H2O
Como podemos ver a GSH é então oxidada a GSSG (glutationa oxidada). Esta será novamente reduzida a GSH pela glutationa redutase que usa NADPH gerado a partir da via das pentoses fosfato como um doador de elétrons para esta reação, como explicado anteriormente (COMHAIR; ERZURUM, 2002).
A distribuição subcelular predominante está no citosol e mitocôndrias, sugerindo que a glutationa peroxidase é oprincipal limpador de peróxido de hidrogênio nestes compartimentos subcelulares. Como vimos, a atividade da enzima é dependente da constante disponibilidade de glutationa reduzida. Normalmente, a relação glutationa reduzida:glutationa oxidada é normalmente mantida muito elevada como resultado da atividade da enzima glutationa redutase. Logo, qualquer via de competição que utiliza NADPH (tal como a via da aldose-redutase), ou deficiência na produção deste, pode levar a uma deficiência de glutationa reduzida e, portanto, prejudicar a ação da glutationa peroxidase (YOUNG; WOODSIDE, 2001).
1.5.4. Peroxirredoxinas
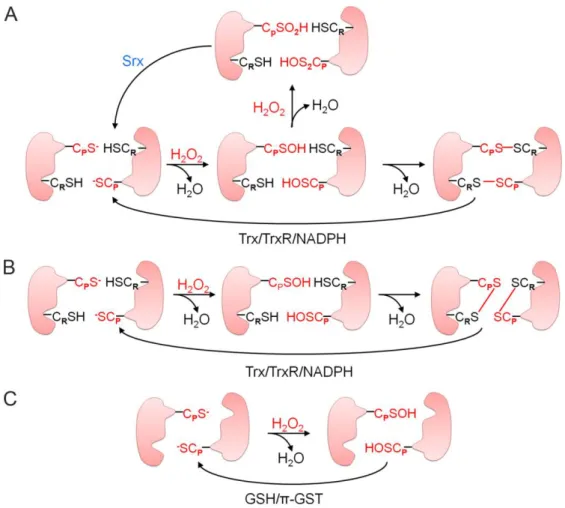
Baseado no mecanismo e do número de cisteínas envolvidas durante a catálise as Prdx podem ser classificadas em 2-Cys típica, 2-Cys atípica, ou 1-Cys Prdx (LOW et al., 2007).Em seres humanos já foram descritas seis isoformas de PRDXs as quais podem ser encontradas em diferentes compartimentos da célula: com PRDX 1, 2 e 6, sendo localizada principalmente no citoplasma; PRDX 3 sendo restrita a mitocôndria; PRDX 4, sendo encontrada predominantemente no retículo endoplasmático (RE) e PRDX 5 estar presente no citosol , mitocôndrias e peroxissomos (RHEE et al., 2012). PRDXs de 1 a 4 são 2- Cys típica, homodiméricas e contém ambos os resíduos de cisteína N- terminal e C- terminal conservados; PRDX 5 é do tipo 2- Cys atípica, funcionalmente monomérica e possui um resíduo de cisteína N-terminal conservado e outro C-terminal não conservado; a PRDX 6 é do tipo 1- Cys, contém apenas um resíduo de cisteína conservado na região N-terminal e não requer nenhuma cisteína adicional para a função catalítica (WOOD et al., 2003; RHEE et al., 2012).
A família das peroxirredoxinas compartilha o mesmo mecanismo catalítico (BELL; HARDINGHAM, 2011), a qual a redução dos peróxidos se inicia pelo ataque da cisteína peroxidásica (CysP-SH), a um átomo de oxigênio do peróxido, que leva à clivagem heterolítica da ligação O-O. É formado, então, um ácido sulfênico na cisteína peroxidásica (CysP-SOH). A etapa subsequente depende do tipo de peroxirredoxina (MONTEIRO et al. 2007).
Para que as PRDXs possam decompor outra molécula de peróxido, precisam ser novamente reduzidas. As PRDXs são então reduzidas pela tiorredoxina (Trx), a qual possui duas cisteínas vicinais localizada em um motivo Cys-X-X-Cys (em que X representa qualquer outro aminoácido). Após a redução das PRDX, as cisteínas de Trx são oxidadas à dissulfeto e são reduzidas pelas tiorredoxinas redutases (TrxRs) utilizando equivalentes redutores provenientes do NADPH. Já a PRDX6, tem como seu redutor fisiológico a glutationa (GSH), na presença da isoforma Pi da GST (Glutationa S transferase) (HOLMGREN; LU, 2010; OLIVEIRA et al., 2010) (Figura 4C)
Quando as PRDXs 2-Cys típicas são expostas a altas concentrações de peróxido, o ataque do ácido sulfênico (CP-SOH) por outras moléculas de peróxido não possibilita a formação do dissulfeto com a CysR. Logo a CysP fica superoxidada, assumindo a forma de cisteína ácido sulfínico (CP-SO2H) ou ácido sulfônico (CP-SO3H). Estas enzimas superoxidadas se oligomerizam e formam decâmeros ou oligômeros de maior massa molecular que podem apresentam atividade de chaperona molecular e ter função de sinalizador celular (JANG et al., 2004; RHEE; CHAE; KIM, 2005; VIVANCOS et al. 2005).
Figura 7. Mecanismos de reação das peroxirredoxinas. Inicialmente, a CysP-SH ataca um átomo de H2O2 formando ácido sulfênico na a CysP (CysP-SOH). (A) PRDXs 2- Cys típicas, o ácido sulfênico formado na CysP reage com a CysR de outra subunidade da enzima formando uma ligação dissulfeto intermolecular que pode ser reduzida pela Trx. Adicionalmente, quando as PRDXs 2-Cys típicas são expostos às elevadas concentrações de peróxido a CysP fica superoxidada e assume a forma de cisteína ácido sulfínico (CP-SO2H) ou ácido sulfônico (CP-SO3H), os quais não são reduzidos pela Trx, necessitando de outro redutor, a sulfirredoxina. Entretanto, esta enzima é capaz de reduzir somente a forma CP-SO2H, não sendo conhecido redutor biológico para CP-SO3H até o momento (B) PRDXs 2-Cys atípicas, a CysR está localizada na mesma cadeia polipeptídica e a reação com a CysP resulta na formação de uma ligação dissulfeto intramolecular, a qual também pode ser reduzida pela Trx. (C) PRDXs 1- Cys, possuem apenas a CysP, o ácido formado durante a oxidação é reduzido por um tiol externo como a GSH. Figura extraída de RHEE et al., 2012.
1.6. Relevância biológica das peroxirredoxinas
incluindo tanto a protozoários e parasitas helmintos, e a maioria, se não todas, eubactérias e archaea (WOOD et al., 2003).
Estão entre as dez proteínas mais abundantes em Escherichia coli, compõem entre 0,1-0,8% das proteínas solúveis em outras células de mamíferos (RINALDUCCI et al., 2011) e estão entre as 10 proteínas mais expressas em determinados tipos celulares (WOOD et al., 2003; RHEE et al., 2005) como por exemplo no eritrócito, onde a peroxirredoxina 2 (PRDX2) é tão abundante que foi identificada nestas células, antes mesmo que a atividade antioxidante desta proteína fosse descrita (HARRIS, 1969). Os eritrócitos também possuem PRDX1 e PRDX6, embora em menor quantidade do que PRDX2. Sendo que, esta última representa a terceira proteína mais encontrada nestas células, após hemoglobina e anidrase carbônica (RINALDUCCI et al., 2011; LOW et al., 2008).
2. JUSTIFICATIVA
Comparado com outras células somáticas, os eritrócitos são expostos ao estresse oxidativo de uma grande variedade de fontes. Além disso, os eritrócitos são incapazes de sintetizar novas proteínas para substituir as danificadas durante a sua vida útil de 120 dias. Por isso, nos eritrócitos existe a produção abundante destas proteínas antioxidantes ao longo de sua maturação (LOW et al., 2007). Durante muito tempo, considerou-se que catalase e glutationa peroxidase (GPx) constituem a defesa do eritrócito contra peróxido de hidrogênio. PRDXs foram descobertos há relativamente pouco tempo, e poucos relatos científicos tem sido descritos referente ao seu papel antioxidante em eritrócitos (LOW et al. 2008).
Os poucos trabalhos existentes na literatura revelam que a importância das PRDXs deve ser acentuada nos eritrócitos. Como exemplos, Neumann e colaboradores (2003) realizaram experimentos diminuindo a expressão de PRDX1 em camundongos, e apesar de serem viáveis e férteis tinham uma reduzida expectativa de vida por apresentarem anemia hemolítica severa e cânceres malignos aos nove meses de vida aproximadamente. A partir desse trabalho foi sugerido que a anemia era causada pelo aumento de EROs nos eritrócitos e a participação de tal gene como supressor de tumor.
Também em 2003, Lee e colaboradores estudaram camundongos com deficiência em PRDX2, que é altamente expressa em todos os tipos celulares normais, e eles apresentaram doença hemolítica. Também foi detectado um aumento no nível de EROs em frações mais densas de glóbulos vermelhos. Nesse estudo identificou-se que a função antioxidante da PRDX2 é um fator crítico para a fisiologia dos glóbulos vermelhos (LEE et al. 2003). Tais resultados sugerem que PRDX2 desempenha um papel importante na proteção das células vermelhas ao estresse oxidativo em camundongos. Em relação a PRDX3, localizada nas mitocôndrias, foi demonstrado por Yang e colaboradores (2007), que a diferenciação de células eritroleucêmicas humanas pode ser regulada por essa proteína.
3. OBJETIVOS 3.1. Objetivo geral
O objetivo central deste trabalho é avaliar a relação entre a expressão das diferentes peroxirredoxinas e os níveis de EROs gerados em reticulócitos e eritrócitos de pacientes portadores de deficiência de glicose-6-fosfato desidrogenase e hemoglobinopatia SC, comparando com indivíduos sadios.
3.2. Objetivos Específicos
1. Avaliar por meio de PCR quantitativo em tempo real (qRT-PCR), o perfil de expressão gênica dos seis membros das peroxirredoxinas em reticulócitos de pacientes com deficiência de glicose-6-fosfato desidrogenase e pacientes com hemoglobinopatia SC, comparando com indivíduos sadios;
3. Verificar a expressão protéica das peroxirredoxinas,através de western blotting em hemácias de pacientes comparando com controles;
4. Estabelecer a provável relação entre a produção destas proteínas e o quadro clínico observado nestes pacientes.
4. MATERIAIS E MÉTODOS
4.1. Pacientes e controles
Foram selecionados pacientes com deficiência de glicose-6-fosfato desidrogenase e pacientes com hemoglobinopatia SC diagnosticados pela Fundação Hemocentro de Pernambuco - HEMOPE. Para a extração de reticulócitos, o sangue foi coletado em tubos contendo anticoagulante EDTA e mantido refrigerado até o momento do processamento. Amostras de sangue periférico de indivíduos saudáveis foram usadas como controles, este grupo foi composto por doadores voluntários.
4.2. Aspectos éticos da pesquisa
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Fundação de Hematologia e Hemoterapia de Pernambuco – Hemope (registro CEP: 028/2011).
Todos os indivíduos somente foram incluídos no estudo após a assinatura do termo de consentimento livre e esclarecido (Anexo 2), aprovado pelo comitê de ética da faculdade de ciências médicas da Fundação HEMOPE.
4.3. Separação de Reticulócitos
Figura 8. Lâmina de leucócitos e esfregaço de reticulócitos. A) Para verificar possíveis contaminações com leucócitos durante a extração de reticulócitos foi preparada uma lâmina com o esfregaço do pellet resultante após
a extração. B) Para efeitos comparativos foi feita uma lâmina contendo leucócitos. As lâminas A e B foram coradas com panótico que permite a diferenciação entre leucócitos e eritrócitos pela coloração diferencial. As lâminas apresentadas nas imagens C e D também foram preparadas com o esfregaço do pellet obtido com a
extração de reticulócitos executada de acordo com o protocolo descrito acima e coradas com azul de cresil brilhante, utilizado para corar reticulócitos. A figura C possibilita a visualização dos resquícios de RNA precipitado que formam grânulos. Estes grânulos desaparecem quando o reticulócito completa a diferenciação para eritrócito maduro (Romanello, K S. 2013). As lâminas A, B e C foram observadas em aumento de 40x e a lãmina D em aumento de 10x.
4.4. Extração de RNA
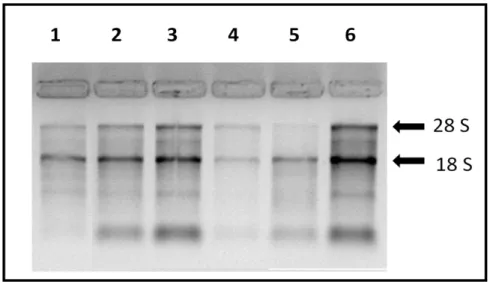
12.000g em temperatura de 4ºC, o sobrenadante foi retirado e acondicionado em outro tubo, procedendo imediatamente para a etapa de precipitação com 500μL de isopropanol gelado.Após homogeneização, foi realizado nova incubação por 10 minutos em temperatura ambiente seguida de centrifugação por 10 minutos a 15.000G à 4ºC. O sobrenadante foi descartado e ao precipitado adicionado 1mL de etanol gelado a 75%, sendo realizada nova centrifugação por 5 minutos a 15.000G à 4ºC. Por fim, o sobrenadante foi descartado e o precipitado de RNA colocado para secar por 10 minutos a temperatura ambiente, sendo então ressuspendido em água livre de RNasee incubado a 55ºC por 10 minutos e posteriormente colocado em gelo para solubilização total do RNA. As amostras foram quantificadas em espectrofotômetro (NanoVue-GE Healthcare) e avaliadas quanto à integridade em gel desnaturante de agarose.As amostras com qualidade adequada de RNA apresentavam íntegras as duas subunidades ribossomais: 18S e 28S (figura 9). Após a eletroforese, as amostras de RNA foram armazenadas em freezer -80ºC.
Figura 9- Gel desnaturante de agaroseà 1,2%. Amostras de RNA de reticulócitos de pacientes com deficiência de glicose-6-fosfato desidrogenase e pacientes com doença falciforme por hemoglobina SC, onde pode-se ver as subunidades 28S e 18S do RNA ribossomal. A visualização das subunidades permite a confirmação de integridade do material. As mesmas análises foram realizadas para todos os RNAs extraídos.
4.5. Síntese de DNA complementar (cDNA)
500mM), num volume final de 10μL. A reação foi incubada por 30 min à temperatura de 37oC e paralisada com a adição de 1,0 μL de EDTA 50mM e incubação por 10 min a 65oC.
A síntese do cDNA foi realizada a partir do RNA tratado com DNAseI, através da reação de transcrição reversa, usando o kit High-Capacity cDNA Reverse Transcription Kits (Applied Biosystems). À amostra de RNA tratada, foi adicionado 2,0 μL de 10X RT Buffer, 0,8 μL de 25X dNTP Mix (100 mM), 2,0 μL de 10X RT Random Primers, 1,0 μL de MultiScribe™ Reverse Transcriptase (50 U/μL), 1,0 μL de RNase Inhibitor, 3,2 μL de Nuclease-free H2O. A síntese de cDNA foi feita a 25oC por 10 minutos, 37oC por 120 minutos. A reação foi paralisada através de incubação a 85oC por 5 minutos. Para verificar a eficiência da reação da transcriptase reversa em sintetizar moléculas de cDNA foi realizada uma amplificação por PCR- RT utilizando iniciadores (primers) para o gene endógeno beta actina. A amplificação adequada deste gene indica uma boa síntese de cDNA como evidenciado na figura 10.
Figura 10. Teste de cDNA com o primer da beta actina. Após a síntese de cDNA as amostras foram testadas por PCR- RT utilizando o primer da beta actina. A amplificação desse gene confirmava a viabilidade da amostra
para análises futuras.
4.6. Reação de PCR quantitativo em tempo real (qRT-PCR)
Biosystems), que emite sinal de fluorescência ao intercalar com DNA dupla- fita. Os primers foram desenhados através do programa "Primer Express" (Applied Biosystems) e analisados no programa Blast (www.ncbi.nlm.nih.gov/blast) para verificação das condições de formação de estruturas como grampos (hairpins) e dímeros (dimers). Como controle foi utilizado primers para amplificação do gene da β-actina. Em todos os casos foram feitos controles negativos, com água estéril substituindo a amostra. As amostras foram amplificadas em duplicatas. As reações foram preparadas em placas de 96 poços com tampas plásticas que permitem a passagem de luz. O programa usado foi: 95ºC por 10 min, seguido de 40 ciclos de 95ºC por 15 s e 60ºC por 1 min. Após a amplificação, a curva de melting foi determinada, através da variação de temperatura de 95°C por 15s, 60°C por 1 min e novamente 95°C por 15s. Os primers utilizados neste estudo estão listados na tabela.
A quantificação dos resultados se baseia na derivação da fórmula 2-ΔΔCT. As amostras estudadas tiveram a expressão relativa determinada. Os dados de Ct foram exportados para uma planilha no programa Excel (Microsoft Corporation) e, então, analisados. O ΔCt foi calculado utilizando as diferenças na média de Ct entre os genes alvos e seus controles endógenos. Após, o ΔΔCt foi calculado em relação a uma situação considerada como referência, que constitui a amostra calibradora. Em seguida, procede- se calculando o 2-ΔΔCT.
4.7. Padronizações para o PCR quantitativo em tempo real 4.7.1. Concentração de Primer
A concentração ótima do primer utilizado na qRT-PCR, deve ser mínima o suficiente para permitir a duplicação de todas as cópias do gene presentes na amostra. Para isso, utilizando a mesma quantidade de amostra, foram feitas reações contendo cada um dos primers (foward e reverse) nas concentrações finais apresentadas na tabela 1.
Tabela 1. Matriz para Padronização da Concentração Ótima de Primers Foward e Reverse
A concentração ideal foi aquela em que o gene de interesse obteve o menor valor de Ct (ciclo threshold), maior ΔRn (variação de fluorescência) e não apresentou formação de dímeros, mesmo nos poços com NTCs (no-template controls). Na tabela 2 estão listadas as sequências e concentrações ótimas dos primers utilizados na amplificação dos genes de estudo. As figuras 11, 12 e 13 mostram o exemplo do primer PRDX1, em que a concentração que apresentou as melhores condições foi 300 Foward / 300 Reverse. O mesmo procedimento foi realizado para todos os primers de PRDXs e para o gene endógeno β-actina.
Figura 11. Determinação da concentração ótima dos primers foward e reverse PRDX1. A) curvas para as diferentes concentrações listadas na Tabela 1. B) duplicata da curva para a concentração escolhida (300F/300R),
Figura 12. Curva de melting PRDX1. O pico único que aparece na figura próximo a 81°C mostra a especificidade da amplificação, em que picos a temperaturas distintas indicariam bandas inespecíficas ou ocorrência de dímeros.
Figura 13. NTCs (no-template controls) PRDX1. A) A ausência de amplificação no controle negativo indica que não há contaminação do primer . B) A Curva de melting não apresenta picos de amplificação confirmando a
Tabela 2. Sequências e concentrações ótimas dos primers utilizados no real-time PCR (qRT-PCR)
Primer Sequência Concentração
PRDX1F
PRDX1R TGTAAATGACCTCCCTGTTGG TATCACTGCCAGGTTTCCAG 300nM 300nM PRDX2F
PRDX2R CTGTTAATGATTTGCCTGTGGG TGGGCTTAATCGTGTCACTG 100nM 300nM PRDX3F
PRDX3R TCCCACTTTAGCCATCTTGC GTAGTCTCGGGAAATCTGCTTAG 100nM 300nM PRDX4F
PRDX4R CGTTTGGTTCAAGCATTCCAG CTTTTGGCGACAGACTTGAAG 300nM 150nM PRDX5F
PRDX5R AGAAGGGTGTGCTGTTTGG TCATTAACACTCAGACAGGCC 100nM 100nM PRDX6F
PRDX6F TGCCACCCCAGTTGATTG TTCACCAAAGAGCTCCCATC 100nM 100nM TRXF TRXR TGGTGAAGCAGATCGAGAGCAAGA ACCACGTGGCTGAGAAGTCAACTA 100nM 150nM TRXR1F TRXR1R ATAGAAGGCAGGCAGCATCACACT TGACAGTTGTTCCATCACGCCCTA 300nM 100nM
β ACTINA - F
β ACTINA - R AGGCCAACCGCGAGAAG ACAGCCTGGATAGCAACGTACA 150nM 150nM
4.7.2. Eficiência de Reação
obtidos e analisados os parâmetros citados é determinado um threshold que será utilizado nas análises posteriores.
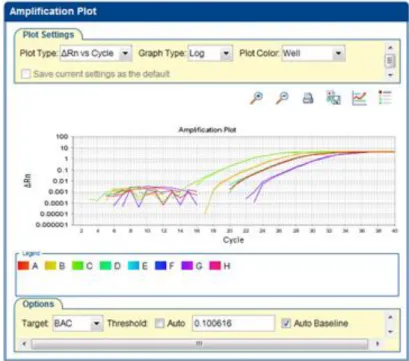
Figura 14. Teste de Eficiência da PRDX1 300F/300R. A partir da análise feita é possível obter a eficiência do
primer, no caso exemplificado de 101,702%, com um R2 de 0,997, em um threshold de 0,082963.
Para todos os primers citados anteriormente foi realizado o mesmo procedimento, e na tabela 3 está identificado os parâmetros de maior importância.
Tabela 3. Parâmetros de importância para os primers caracterizados.
Primer Threshold Eficiência Slope
BAC 0,100616 97,441 -3,385
PRDX1 0,082963 101,702 -3,382
PRDX2 0,068407 98,044 -3,37
PRDX3 0,036544 95,097 -3,445
PRDX4 0,034823 95,112 -3,445
PRDX5 0,103905 98,27 -3,364
PRDX6 0,064225 100,324 -3,314
TRX 0,075392 94,331 -3,466
TRXR1 0,071463 96,362 -3,412
4.8. Western blotting
A análise diferencial da abundância protéica foi avaliada através da técnica de western blotting para verificar se existe correlação entre os níveis de RNA mensageiro e a das proteínas.
4.8.1. Extração e quantificação de proteínas
4.8.2. Preparo da amostra para western redutor
Foi adicionado às amostras tampão desnaturalizante de Laemmli (100mM tris-HCl pH6.8, 4% p/v SDS, 20% v/v glicerol, 0,2% de azul de bromofenol e DTT) e estas foram desnaturadas em banho-maria a 100ºC por 5 min. E então corridas em gel de poliacrilamida SDS.
4.8.3. Preparo da amostra para western não-redutor
Para esta análise foi feito previamente um tratamento das amostras para que não houvesse oxidação das PRDX durante o procedimento de extração e as amostras estivessem em suas condições naturais. Então, foi adicionado ao tampão de lise, o NEM 10mM (agente alquilante de tiol) que se liga as cisteínas não permitindo a ligação dos peróxidos; DTPA100µM (quelante de metal) para impedir a reação de fenton e oxidação da hemoglobina; e azida sódica110µM para promover a inativação da catalase, assim esta não consumiria o peróxido de hidrogênio existente na amostra. Em seguida as proteínas foram extraídas e quantificadas conforme explicação anterior e corridas com tampão de Laemmli sem DTT.
4.8.4. Eletroforese em gel de poliacrilamida SDS e Western Blot
As proteínas foram separadas por SDS-PAGE em condições desnaturantes e redutoras. Os géis de poliacrilamida utilizados na eletroforese possuíam 4 % (gel de entrada) ou 12% (gel de separação), com 1,0 mm de espessura. Foram adicionados 50μg de proteína por poço. A eletroforese foi realizada com o marcador de peso molecular (10 – 170kd) PageRulerTM Prestained Protein Ladder (Thermo Scientific), para possibilitar a identificação por peso molecular das proteínas de interesse. A corrida foi realizada a 150volts, em um tempo de aproximadamente 1 hora e 30 min. (The Mini Trans-Blot cell - Bio- Rad). O tampão de corrida utilizado (750ml) era composto por Trisma base (25 mM), glicina (192 mM) e SDS (0,1 g%). Após a corrida, o gel foi incubado em tampão de transferência (48mM Tris, 39mM glicina, 20% v/v metanol) por 30 minutos, a membrana e os filtros de transferência também foram incubados no tampão citado acima por 5 minutos.
(50mM Tris, 150mM NaCl, pH=8, contendo 0,1% v/v de Tween 20). Ao fim do bloqueio, a membrana foi lavada com TBS-T por 4X de 5 min cada e incubada com anticorpo primário (listados na tabela) por 4 horas em temperatura ambiente sob agitação, a seguir a membrana foi novamente lavada com TBS-T por 4X de 5 min. cada e incubada com anticorpo secundário conjugado com a enzima HRP (listados na tabela 4) por 2 horas em temperatura ambiente sob agitação. Todos os anticorpos foram diluídos em solução tampão TBS-T.
Depois de lavada (TBS-T por 4X de 5 min. cada), a membrana foi incubada com um reagente de detecção da atividade da HRP (AmershamTM ECL TM Prime Western Blotting Detection Reagent - GE Healthcare ) por quimioluminiscência de acordo com as instruções do fabricante. As bandas foram visualizadas e fotografados usando o aparelho ChemiDoc da Bio-Rad por curtos intervalos de tempo para obtenção de uma imagem adequada. A análise densitométrica foi realizada utilizando o programa Image J.
Tabela 4. Anticorpos utilizados na técnica de western blotting
4.9. Análise estatística