CHARLIE BASSET
PESQUISA DE SUBSTÂNCIAS ANTIFÚNGICAS
CO-TUTELA INTERNACIONAL DE TESE DE DOUTORADO
UNIVERSIDADE DE BRASÍLIA
FACULDADE DE MEDICINA
Programa de Pós-Graduação em Ciências Médicas e
UNIVERSITÉ DES ANTILLES ET DE LA GUYANE
FACULTÉ DE SCIENCES, TECHNOLOGIES ET SANTÉ École doctorale Santé, Environnement et Sociétés dans les Amériques
Spécialité Chimie des Substances Naturelles
CHARLIE BASSET
PESQUISA DE SUBSTÂNCIAS ANTIFÚNGICAS
PROVENIENTES DE MADEIRAS DURÁVEIS DA AMAZÔNIA
CHARLIE BASSET
PESQUISA DE SUBSTÂNCIAS ANTIFÚNGICAS
PROVENIENTES DE MADEIRAS DURÁVEIS DA AMAZÔNIA
« Liberdade é o espaço que a felicidade precisa."
Fernando Pessoa
Remerciements
!"#$%&'(&%#)(&*+#,&#%&'&%-(&#.&/%0&1#2311(/4#&4#Vanderlan Da Silva Bolzani#$/*%#35/(%#3--&$46#7894%&#)&1# %3$$/%4&*%1#7&#-&44:;1&#&4#$/*%#35/(%#$3%4(-($6#3*#,*%<=#>&#%&'&%-(ɛ)&'&"4#Christophe Duplais#$/*%# 35/(%#3--&$46#7&#?3(%&#$3%4(*#,*%<#7&#'3#4:;1&=#
>&#%&'&%-(&#)&1#-/));0*&1#7&#)8@"(5&%1(46#7&1#A"4())&1#&4#7&#)3#.*<3"&+#7&#)8@2B#!-/?/0#&4#7*#CD2A+#$/*%#
)&*%1#-/"1&()1#&4#)83'E(3"-&+#)&1#-/'$30"/"1#7&#'3"($*)34(/"1+#7&#%6-/)4&1#&4#3*4%&1#3-4(5(461#&"#7&:/%1#7*#
)3E/%34/(%&F# &"# $&"13"4# $3%4(-*)(;%&'&"4# G# A)(-&# BHIBJ.@!K+# L)/%&"4# BHM!BN+# O(&%%&PA)3("#
MCAQIJQJ!B!K+# Q37("&# A2@KAQN+# R35(&%# S@QJM!BNJ+# 2/*"('# C!MBJQJ+# S:%(14/$:&# BHHK+# .*())3*'&#
HIHQQ!+#I3'(&"#MH@BB!A@+#>&3"P2(-:&)#2ABNJQ+#S:3%)/44&#QJB2A+#B3$:3T))&#BJQACIH#&4#>*)(&#A""&#
2JCC!B=#
A#M%31U)(3+#'&1#%&'&%-(&'&"41#5/"4#G#4/*4&#)86V*($&#&4#)&1#64*7(3"41#7*#C3E/%34/(%&#O:3%'3-/0"/1(&#
)8@"M+#3("1(#V*&#)&1#-/));0*&1#7&#)8@"(5&%1(46+#$/*%#)&*%#3--*&()#-:3)&*%&*W+#)&*%#1<'$34:(&#&4#)&*%#6-/*4&#X#
.3E%(&)3# $/*%# "/*1# 35/(%# :6E&%06# 73"1# 1/"# )3E/%34/(%&+# O:&))($&# NY!HIHBH+# 23%(3"3# CA@QIBZ# I!#
2!K[@JNA+#!5&%4/"#2AS!IH#KJC\A+#S3'()3#2JBAQIA#&4#O/)<3"3#ABA@>H#&"4%*4%&1=#!4#1*%4/*4#N:(30/#
2!JB!CC!K#SAK!CCA+#-/'$30"/"#7:;1ķ(7*=#
>(&"1#G#%&'&%-(&%#Q/%E&%4/#O=#CHO!K#]#M&4^/#_+#7&#)3#?3-*)46#7&1#K-(&"-&1#O:3%'3-&*4(V*&1#7&#B(E&(%^/#
O%&4/# `# KO+# 3("1(# V*&# 1&1# 6);5&1# G# )8:/1$(43)(46# ?/%'(73E)&+# $/*%# 1/"# 3(7&# $%6-(&*1&# &"# -:('(&# )/%1# 7&# -&#
$%/,&4#&4#$/*%#13#-/"5(5(3)(46#-/''*"(-34(5&=#
>(&"1#G#%&'&%-(&%#>3-V*&1#M!A@SYaQ!+#7&#)8@2B#!-/?/0+#$/*%#1&1#E/"1#-/"1&()1#1*%#)&#-:/(W#7&1#3%E%&1#
&4#)&#$3%430
#%(-:&#-/""3(113"-I"1#-/'3("&=#
>&#%&'&%-(&#\6%/"(V*&#!OAB\J!B+#7&#)8J"14(4*4#7&#S:('(&1#K*E143"-&1#Q34*%&))&1+#$/*%#1/"#3(7&#)/%1#7&1#
%6-/)4&1# 7&# $/*# 7830/*4(1+# 1&1# -/"1&()1# &"# -:('(&+# 13# $34(&"-&# &4# )&# $3%430&# 7&# 1&1# -/""3(113"-&1#
1-(&"4(?(V*&1=#
>&# 1/*:3(4&# %&'&%-(&%# -:3)&*%&*1&'&"4# '&1# 7(%&-4&*%1# 7&# 4:;1&+# I(7(&%# KNJ!Q# &4# C3()3# K=# !KOJQIHCA+# V*(#
/"4#1*#'8/%(&"4&%#4/*4#3*#)/"0#7&#-%353()+#'83--/%73"4#)&*%1#-/"1&()1+#)&*%#1/*4(&"#&4#)&*%#3(7&#$%6-(&*1&#
)/%1#7&#-&44&#&W$6%(&"-&#$%/?&11(/""&))&1#$)*1#&"%(-:(113"4&=#
Tome 1 : Thèse (en français)...5
Tome 2 : Résumé détaillé (en portugais)...221
Volume 1 : Tese (em francês)...5
Table des matières
!"#$%&'(#)%"*+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++*,-! ./01!2*,+! 3%"#45#4*&4*678#'&4*+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++*,9! "#"! $%&%'()*+%,!#################################################################################################################################################!"-! "#"#"! .('(/+%'*,+*012,!3%&%'()2,!42,!/5(67*3&8&,!####################################################################!"-!
"#"#"#"! 9(!/2))1)2!:8&3*012!##################################################################################################################################!"-!
"#"#"#;! <842!42!&1+'*+*8&!###################################################################################################################################!;"! "#"#;! 92,!*&:2/+*8&,!:8&3*012,!516(*&2,!########################################################################################!;"! "#"#=! >'(*+262&+!42,!*&:2/+*8&,!:8&3*012,!#####################################################################################!;=!
"#"#=#"! ?*,+8'*012!###################################################################################################################################################!;=! "#"#=#;! 92,!+'(*+262&+,!(/+12),!#########################################################################################################################!;@!
"#"#=#;#"!92,!68)%/1)2,!(&+*:8&3*012,!4A8'*3*&2!&(+1'2))2!##################################################################!;B! "#"#=#;#"#"! 92,!6(/'8)*42,!78)C%&*012,!############################################################################################!;B!
"#"#=#;#"#;! 92,!D2&E8:1'(&2,!#################################################################################################################!;B!
"#"#=#;#"#=! 92,!&*FF86C/*&2,!################################################################################################################!;B!
"#"#=#;#"#@! 9(!,8'4('*&2!###########################################################################################################################!;G!
"#"#=#;#;!92,!68)%/1)2,!(&+*:8&3*012,!,26*H,C&+5%+*012,!##################################################################!;G!
"#"#=#;#;#"! 92,!%01*&8/(&4*&2,!#############################################################################################################!;G! "#"#=#;#=!92,!68)%/1)2,!(&+*:8&3*012,!4A8'*3*&2!,C&+5%+*012!############################################################!;I!
"#"#=#;#=#"! 92,!())C)(6*&2,!######################################################################################################################!;I! "#"#=#;#=#;! 92,!(E8)2,!#################################################################################################################################!;-!
"#"#=#;#=#=! 92,!7C'*6*4*&2,!####################################################################################################################!=J!
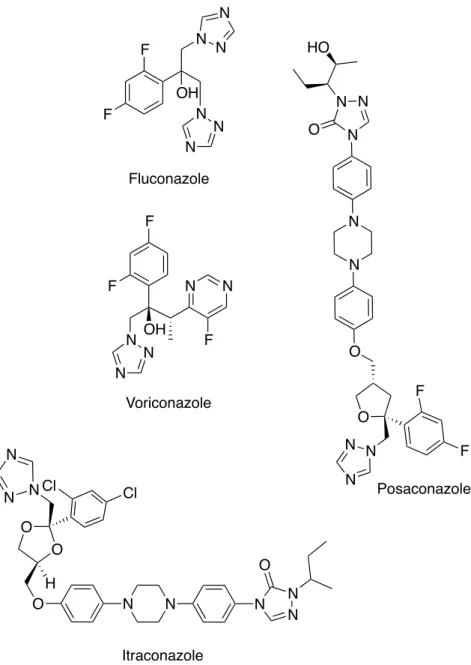
"#"#@! 92,!7'841*+,!&(+1'2),!(&+*:8&3*012,!######################################################################################!="!
"#"#@#"! K)(/2!42,!7'841*+,!&(+1'2),!4(&,!)(!'2/52'/52!75('6(/21+*012!*&41,+'*2))2!##############!="! "#"#@#;! L*+1(+*8&!(/+12))2!42!)(!'2/52'/52!42!7'841*+,!&(+1'2),!(&+*:8&3*012,!###########################!=;!
"#"#@#=! L1D,+(&/2,!&(+1'2))2,!(&+*:8&3*012,!4A8'*3*&2!M%3%+()2!########################################################!=@! "#"#@#=#"!>2'7N&2,!2+!+2'7%&8O42,!#################################################################################################################!=@!
"#"#@#=#;!L(78&*&2,!###############################################################################################################################################!=P!
./01!2*:+! ;864(#)%"*&74<=>(4<*?@?A%")4""4<*<=8()?6)<?"#*'"*B%)<*&'$?B64*++++++++++++++++*C,! ;#"! 9(!$1C(&2!:'(&T(*,2!###############################################################################################################################!@"! ;#;! .'*+N'2,!42!,%)2/+*8&!###############################################################################################################################!@;! ;#=! <8&83'(75*2,!,1//*&/+2,!42,!2,7N/2,!/8))2/+%2,!######################################################################!@@! ;#=#"! U(6*))2!42,!V&&8&(/2(2!##############################################################################################################!@P! ;#=#;! U(6*))2!42,!Q1758'D*(/2(2!########################################################################################################!@B! ;#=#=! U(6*))2!42,!?16*'*(/2(2!#############################################################################################################!@G! ;#=#@! U(6*))2!42,!9(1'(/2(2!##################################################################################################################!@I! ;#=#P! U(6*))2!42,!92316*&8,(2W!+'*D1!42,!.(2,()7*&*8*42(2!###################################################!@-! ;#=#B! U(6*))2!42,!92316*&8,(2W!+'*D1!42,!<*68,8*42(2!##########################################################!PJ! ;#=#G! U(6*))2!42,!92316*&8,(2W!+'*D1!42,!K(7*)*8*42(2!############################################################!P@! ;#=#I! U(6*))2!42,!<8'(/2(2!###################################################################################################################!PB! ;#=#-! U(6*))2!42,!L(78+(/2(2!################################################################################################################!PG! ;#=#"J! U(6*))2!42,!X8/5C,*(/2(2!#########################################################################################################!P-! ;#@! .8&&(*,,(&/2,!75C+8/5*6*012,!,1'!)2,!2,7N/2,!,%)2/+*8&&%2,!###########################################!BJ! ;#@#"! Q,7N/2!42!)(!:(6*))2!42,!V&&8&(/2(2!####################################################################################!BJ! ;#@#;! Q,7N/2!42!)(!:(6*))2!42,!Q1758'D*(/2(2!###############################################################################!BJ! ;#@#=! Q,7N/2!42!)(!:(6*))2!42,!?16*'*(/2(2!###################################################################################!B"! ;#@#@! Q,7N/2!42!)(!:(6*))2!42,!9(1'(/2(2!#########################################################################################!B"! ;#@#P! Q,7N/2!42!)(!:(6*))2!42,!92316*&8,(2W!+'*D1!42,!.(2,()7*&*8*42(2!#########################!B"! ;#@#B! Q,7N/2!42!)(!:(6*))2!42,!92316*&8,(2W!+'*D1!42,!<*68,8*42(2!#################################!B;! ;#@#G! Q,7N/2,!42!)(!:(6*))2!42,!92316*&8,(2W!+'*D1!42,!K(7*)*8*42(2!#################################!B=! ;#@#I! Q,7N/2!42!)(!:(6*))2!42,!<8'(/2(2!##########################################################################################!B@! ;#@#-! Q,7N/2,!42!)(!:(6*))2!42,!L(78+(/2(2!####################################################################################!BP! ;#@#"J! Q,7N/2!42!)(!:(6*))2!42,!X8/5C,*(/2(2!###############################################################################!BB! ;#P! .8&/)1,*8&,!,1'!)2,!2,7N/2,!,%)2/+*8&&%2,!###################################################################################!BB!
./01!2*C+! !<%64@4"#J*(?$?(#8$)<?#)%"*4#*8E?6'?#)%"*B)%6%G)H'4*&4<*(%@=%<8<*+++++++++++*KD! @#"! .8678,%,!*,8)%,!42!!"#$%$&'(&)*&#$+,%&!#####################################################################################!I@! @#"#"! Z8&&%2,!'2)(+*M2,![!)(!D2'3%&*&2!\LMN,]!############################################################################!I@! @#"#;! Z8&&%2,!'2)(+*M2,![!)A(/*42!6(,)*&*012!\LMN:]W![!)A(/*42!4%5C4'8('S1&8)*012!! \LMND]!2+![!)A(/*42!('S1&8)*012!\LMNC]!########################################################################################################!IB!
@#"#=! Q+(+!42!)A('+!'2)(+*:!(1R!/8678,%,!*,8)%,!###############################################################################!-J! @#"#@! V/+*M*+%,!D*8)83*012,!42,!/8678,%,!*,8)%,!##########################################################################!-"! @#;! .8678,%,!*,8)%,!42!-,)./012,!,7#!#####################################################################################################!-=! @#;#"! Z8&&%2,!'2)(+*M2,!(1!\^]H687(&8)!\.N,]!2+!(1!\^]H72)+83C&8)!\.N:]!######################!-=! @#;#;! Q+(+!42!)A('+!'2)(+*:!(1R!/8678,%,!*,8)%,!###############################################################################!-P! @#;#=! V/+*M*+%,!D*8)83*012,!42,!/8678,%,!*,8)%,!##########################################################################!-P! 345! .8678,%,!*,8)%,!42!67$%/.%/7$*')/20$+/)$&!#####################################################################################!-B! @#=#"! Z8&&%2,!'2)(+*M2,![!)(!4(*4E%*&2!\;.N,]W!)(!3%&*,+%*&2!\;.N:]!2+![!)A*,87'1&%+*&2! \;.ND]##############!############################################################################################################################################################!--!
@#=#;! Z8&&%2,!'2)(+*M2,!(1!)17%8)!\;.NC]!######################################################################################!"J"! @#=#=! Z8&&%2,!'2)(+*M2,!(1!7*/%(+(&&8)!\;.NO]W!+'(&,H'2,M%'(+'8)!\;.NI]!2+!+'(&,H 8RC'2,M%'(+'8)!\;.N,P]!#####################################################################################################################################!"J;!
@#=#@! Z8&&%2,!'2)(+*M2,![!)(!3&%+*&2!Z!\;.N-]!#############################################################################!"J@! @#=#P! Z8&&%2,!'2)(+*M2,![!)(!3&%+*&2!Q!\;.NK]!2+!(1!)(+*:8)8)!\;.N9]!##################################!"JB! @#=#B! Z8&&%2,!'2)(+*M2,![!)(!,7*'8+'878&2!\;.N,,]!##################################################################!""J! @#=#G! Z8&&%2,!42!_<`!'2)(+*M2,!(1R!,7*'8+'87*&2,!V!\;.N,:]W!a!\;.N,D]!2+!.!\;.N ,C]##################!############################################################################################################################################################!"";!
P#=#"! Z%+2'6*&(+*8&!42!)AY&4*/2!42!.8&/2&+'(+*8&!Y&5*D*+'*/2!U'(/+*8&&%2!\Y.YU]!######!"="! P#=#;! Q+142!4A1&2!/86D*&(*,8&!*67)*01(&+!)A(/*42!6(,)*&*012!\LMN:]!2+!
)A*+'(/8&(E8)2###!######################################################################################################################################################!"=;! P#=#=! Q+142!4A1&2!/86D*&(*,8&!*67)*01(&+!)(!D2'3%&*&2!\LMN,]!2+!)2!:)1/8&(E8)2!####!"==! P#@! >2,+,!4A*&+2'(/+*8&,!(M2/!)A2'38,+%'8)!###########################################################################################!"=P! P#P! .8&/2&+'(+*8&!:8&3*/*42!6*&*6()2!\.U<]!##################################################################################!"=I! P#B! .8&/)1,*8&,!##############################################################################################################################################!"=-!
3%"(6'<)%"<*4#*=4$<=4(#)E4<*+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++*,C,! ./01!2*I+! R?#8$)46<*4#*@8#S%&4<*+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++*,CD! B#"! .8&+2R+2!2+!)*21R!42,!+'(M(1R!42!'2/52'/52!###############################################################################!"@=! B#;! $%&%'()*+%,!,1'!)2,!6(+%'*2),!2+!6%+5842,!#################################################################################!"@@! B#;#"! <(+%'*2),!D*8)83*012,!#################################################################################################################!"@@! B#;#;! <(+%'*2),!/5*6*012,!####################################################################################################################!"@@! B#;#=! <8C2&,!(&()C+*012,!#####################################################################################################################!"@P! B#;#@! <*/'8,/87*2!#####################################################################################################################################!"@P! B#;#P! >'(*+262&+,!,+(+*,+*012,!###########################################################################################################!"@P! B#;#B! <84%)*,(+*8&,!68)%/1)(*'2,!#####################################################################################################!"@B! B#=! <(+%'*2)!M%3%+()!2+!2R+'(/+*8&!##########################################################################################################!"@B! B#=#"! .8))2/+2!2+!*42&+*:*/(+*8&!42,!7)(&+2,!###################################################################################!"@B! B#=#;! QR+'(/+*8&!########################################################################################################################################!"@G! B#@! QM()1(+*8&!42!)A(/+*M*+%!(&+*:8&3*012!############################################################################################!"@G! B#@#"! .5(67*3&8&,!)*3&*M8'2,!############################################################################################################!"@G! B#@#;! .5(67*3&8&,!7(+583N&2,!516(*&,!#####################################################################################!"@G! B#@#=! >2,+!42!72':8'(+*8&!2&!(3('!#####################################################################################################!"@I! B#@#@! >2,+!42!6*/'84*)1+*8&!#################################################################################################################!"@-! B#P! U'(/+*8&&262&+,!####################################################################################################################################!"PJ! B#P#"! QR+'(*+