UN
PROGRA
USO DA MEFS E H ORGÂNICOS VOLÁT CITOTÓXIC
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
RAMA DE PÓS-GRADUAÇÃO EM QUÍMI
ANDRÉ LUIZ MELO CAMELO
HIDRODESTILAÇÃO NO ESTUDO DOS TEIS DA ESPÉCIE PLECTRANTHUS GRA ICA E VALIDAÇÃO DE MÉTODOS POR C
FORTALEZA 2014
MICA
S COMPOSTOS RANDIS, ANÁLISE
USO DA MEFS E HIDRODESTILAÇÃO NO ESTUDO DOS COMPOSTOS ORGÂNICOS VOLÁTEIS DA ESPÉCIE PLECTRANTHUS GRANDIS, ANÁLISE CITOTÓXICA E
VALIDAÇÃO DE MÉTODOS POR CG-EM.
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Química, do Centro de Ciências da Universidade Federal do Ceará, como requisito parcial do Título de Mestre em Química. Área de concentração: Química Analítica.
Orientadora: Profa. Dra. Elisane Longhinotti.
Coorientador: Prof. Dr. Francisco Geraldo Barbosa.
A Deus, por ter me dado disposição e coragem para lutar e alcançar os objetivos pretendidos na vida. Pelas oportunidades colocadas em meu caminho, por ter me dado forças para seguir em frente e por ter me guiado nos momentos em que mais precisei de orientação nas decisões a serem tomadas.
A minha avó, mãe, pai, e irmãos pelo apoio concedido.
A minha orientadora Elisane, pela oportunidade de ingressar em seu grupo de pesquisa. Por ser uma pessoa amiga, respeitadora e sempre disposta a ouvir as ideias dos alunos. Por ser uma referência para como profissional na pesquisa e no ensino.
Aos professores Jair e Geraldo por terem contribuído no desenvolvimento do meu trabalho. Pela oportunidade que me foi dada em fazer parte do grupo de pesquisa.
Ao Francisco Carlos por ter sido um amigo durante estes dois anos de trabalho. Pelo exemplo de pessoa sempre disposta a ajudar. Pelos momentos de conversas e sugestões que foram valiosos para desenvolvimento do trabalho. Pelo excelente convívio no laboratório.
Ao Francisco Thiago pelo excelente convívio no laboratório. Por ter sido companheiro e amigo durante estes dois anos em que estudamos e desenvolvemos os nossos trabalhos.
Aos amigos que fizeram parte do grupo LABFITO durante este período: Roberta, Diana, Aierta, Reinaldo, Daniele e Vandinha.
Aos amigos que fizeram parte do grupo de BIOINORGÂNICA durante este período: Thiago, Elis, Natana, Gilmara, Michele, Patrícia Gabriela, Patrícia, Jéssica,
Walysson, Dieric, André Florêncio, Florêncio, Samuel, Ricardo, Renato, Priscila, Marquinhos, Amanda, Nathalie, Tércio, Felipe, Mário, Ramon, Ticiano, Aurideia.
geral de conhecimentos e que foram de grande importância para o desenvolvimento deste
trabalho.
Aos funcionários da coordenação da pós-graduação, Célia e Orlando, pela colaboração e por estarem sempre dispostos a ajudar.
Aos funcionários do horto de plantas medicinais da UFC, Sales e Dino, pela colaboração e por estarem sempre dispostos a ajudar na coleta das amostras.
Aos amigos da pós-graduação: Aurelio, Thiago Magalhães, Mário, Moacir, Sebastião, Regis, Daniele, Manu, Regina, Lana, Viviane, Renata, Ari, Diego, Nayane, Rayane, Adriano, Raquel, Jonas, Túlio, Kaline, Wellington Viana, Elane e Irvila, Diones, Ethanielda.
Ao Banco do Brasil e seus funcionários, pela oportunidade concedida, ainda nos meus 14 anos de idade, de ter ingressado como aprendiz na instituição e por ter recebido apoio na qual foi possível investir e despertar em mim o interesse pelos estudos. Pelos ensinamentos éticos e morais aprendidos na qual levarei por toda a vida.
A Universidade Federal do Ceará pela estrutura física disponibilizada.
A Funcap, CNPQ e Capes pela bolsa concedida e pelos auxílios financeiros concedidos para o desenvolvimento deste trabalho.
Porque Eu, o SENHOR, teu Deus, te tomo
Este trabalho utiliza a MEFS como técnica complementar da hidrodestilação na investigação dos compostos orgânicos voláteis provenientes da raiz, caule e folhas da espécie Plectranthus
grandis, onde foi utilizada cromatografia gasosa para análise destas partes da planta. Para
isso, foi realizado um estudo prévio das variáveis que influenciam de forma significativa na extração destes voláteis, de tal forma a utilizar o melhor revestimento de fibra, o melhor tempo de extração, temperatura e quantidade de amostra. Isso de modo a realizar uma análise segura e confiável. Dessa forma, com a utilização da MEFS e da hidrodestilação foi possível identificar por cromatografia gasosa/espectrometria de massas e índice de retenção linear de 75 compostos distribuídos nas três partes da planta. Além disso, o estudo revelou que a MEFS foi eficiente na extração de aproximadamente setenta e cinco por cento do total de compostos que foram identificados tornando esta metodologia eficiente em análises prévias, pois requer uma pequena quantidade de amostra, um curto intervalo de tempo para extrair e não utiliza formas exaustivas para extração dos voláteis. Com esse estudo, ficou constatado, neste estudo, que a MEFS foi eficiente na extração exclusiva de 20 compostos voláteis, levando a crer que estes sofrem degradações no momento da extração por hidrodestilação. Além disso, o estudo revelou que o óleo essencial extraído por hidrodestilação, apresenta percentual de inibição de crescimento de três linhagens de células tumorais humanas. O trans-β-cariofileno foi o
composto majoritário das folhas da espécie em estudo, bem como a constatação deste no caule. Com isso, desenvolveu e validou uma metodologia de análise para o trans-β
-cariofileno, etapa essa, onde foi incluído um estudo da eficiência em termos de altura de
pratos, além da investigação da difusão deste composto na fase estacionária e na fase móvel da coluna capilar.
This work uses the SPME as a complementary technique in the investigation of hydrodistillation of volatile organic compounds from the root, stem and leaves of
Plectranthus grandis species, which was used for analysis of gas chromatography. For this, a
previous study of the variables that significantly influence the extraction of these volatile, so using the best fiber coating, the best extraction time, temperature and amount of sample was performed. That in order to achieve a safe and reliable analysis. Thus, with the use of SPME and hydrodistillation was identified by gas chromatography / mass spectrometry and linear retention index of 76 compounds distributed in the three parts of the plant. Moreover, the study revealed that SPME extraction was efficient to approximately ¾ of the total number of identified compounds that were effective methodology for making this preliminary analysis, it requires a small amount of sample, a short time interval not used to extract and forms exhaustive for extracting volatile. With this study, it was found that SPME can extract only 20 volatile compounds, leading us to believe that they suffer degradations at the extraction by hydrodistillation. Moreover, the study revealed that the essential oil extracted by hydrodistillation shows percentage inhibition of growth of three human tumor cell lines. The trans - β - caryophyllene was the major compound leaves of this species, as well as the discovery of this stem. Thus, developed and validated a methodology for the analysis of trans - β - caryophyllene, this step, which included a study of efficiency in terms of height of dishes as well as investigating the diffusion of this compound in the stationary phase and mobile phase capillary column.
Figura 1 – Espécie Plectranthus grandi ... 20
Figura 2 – Trans-β-cariofileno ... 20
Figura 3 −−−− Representação de uma seringa utilizada para MEFS ... 22
Figura 4 – Sistema CG-EM ... 26
Figura 5 – (A) Planilha eletrônica do Excel e (B) Caixa de texto do Solver... 41
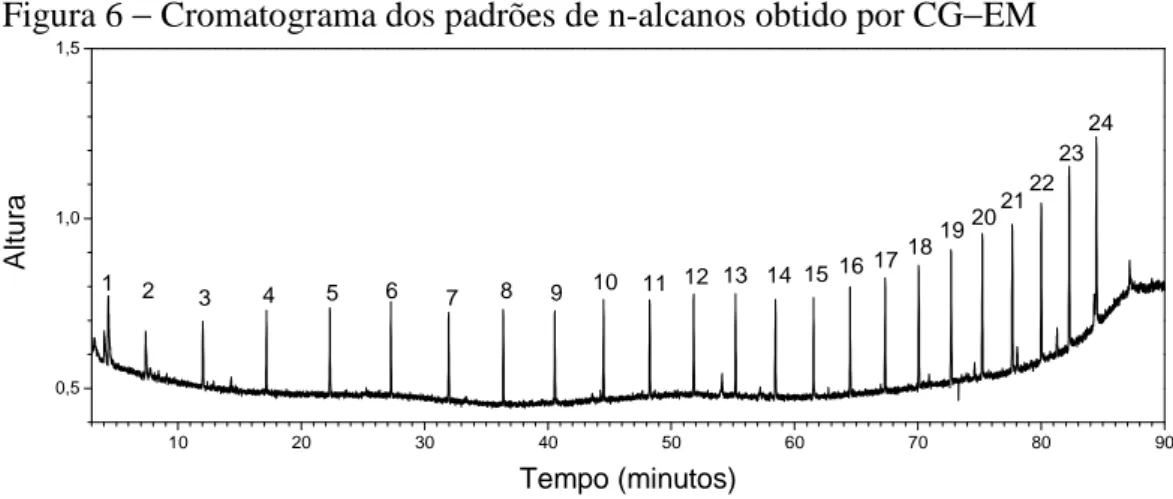
Figura 6 −−−− Cromatograma dos padrões de n-alcanos obtido por CG−−−−EM ... 46
Figura 7 −−−− Cromatograma do óleo essencial proveniente da hidrodestilação da raiz obtido por CG−−−−EM ... 48
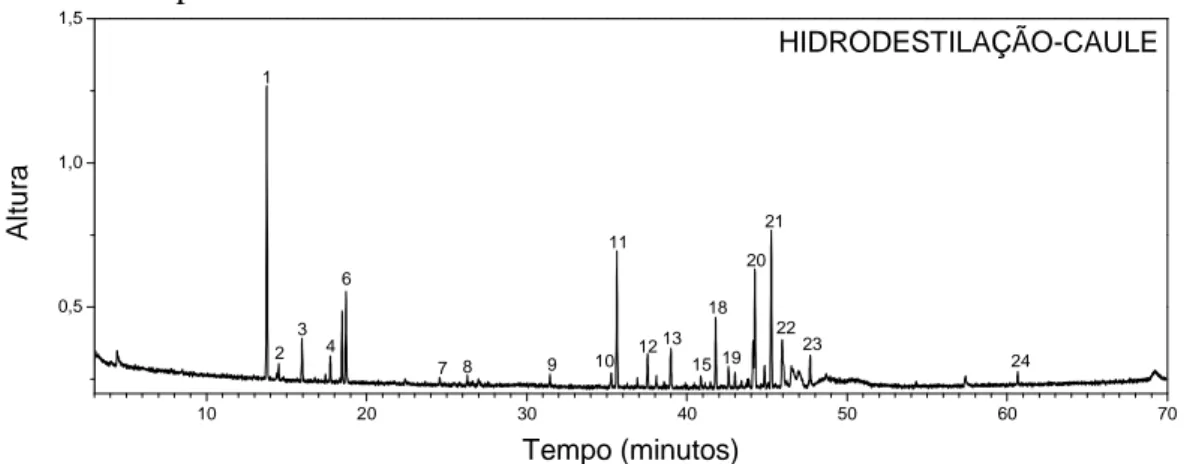
Figura 8 −−−− Cromatograma do óleo essencial proveniente da hidrodestilação do caule obtido por CG−−−−EM ... 49
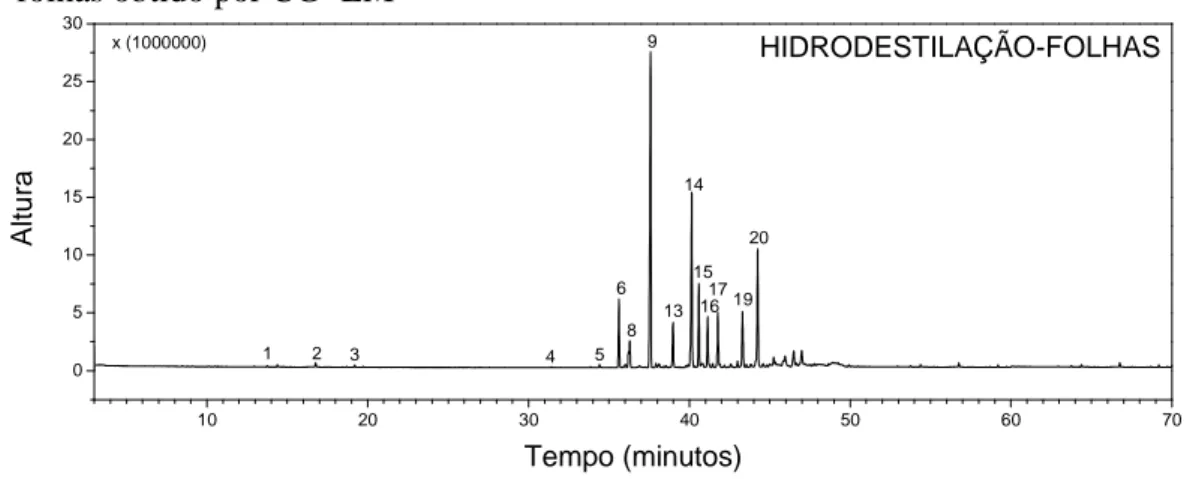
Figura 9 −−−− Cromatograma do óleo essencial proveniente da hidrodestilação das folhas obtido por CG−−−−EM ... 50
Figura 10 −−−− Sobreposição dos cromatogramas dos óleos essenciais obtidos por hidrodestilação ... 52
Figura 11 – Cromatogramas dos COV obtidos por Hidrodestilação e MEFS das folhas ... 54
Figura 12 – Resultados qualitativos (A) e quantitativos (B) dos compostos extraídos por MEFS. ... 55
Figura 13 –Variação da resposta com os níveis dos três fatores na extração dos COV por MEFS-HS da (a) raiz, (b) caule e (c) folhas. ... 55
Figura 14 – Interação das variáveis na extração dos COV por MEFS-HS da espécie. ... 56
Figura 15 – Gráfico de Pareto na otimização da raiz(a), caule(b) e folhas(c). ... 58
Figura 16 −−−− Cromatograma das raízes por MEFS-HS. ... 59
Figura 17 −−−− Cromatograma do caule por MEFS-HS. ... 60
Figura 18 – Cromatograma das folhas por MEFS-HS ... 61
Figura 19 – Sobreposição dos cromatogramas ... 62
Figura 20 −−−− Cromatograma da raiz obtido por MEFS-HS e Hidrodestilação ... 63
Figura 21 −−−− Cromatograma do caule obtido por MEFS-HS e Hidrodestilação... 63
Figura 22 −−−− Cromatograma das folhas obtido por MEFS-HS e Hidrodestilação ... 64
Figura 23 – Distribuição dos compostos identificados na planta. ... 64
Figura 24 −−−− Distribuição dos compostos por hidrodestilação e MEFS ... 65
Figura 25 −−−− Curvas de Van Deemter para análise do dodecano e trans-β-cariofileno. ... 71
Figura 26 −−−− Cromatograma do dodecano e do trans-β-cariofileno. ... 72
Figura 27 −−−− Espectro de massas do dodecano. ... 73
Figura 28 −−−− Espectro de massas do trans-β-cariofileno. ... 73
Figura 29 −−−− Faixa de trabalho pelo método do padrão interno. ... 74
Figura 30 −−−− Curva de calibração pelo método do padrão externo e do padrão interno ... 75
Tabela 1 −−−− Planejamento experimental por MEFS da raiz ... 37
Tabela 2 −−−− Planejamento experimental por MEFS do caule ... 38
Tabela 3 −−−− Planejamento experimental por MEFS das folhas... 39
Tabela 4 −−−− Rendimento percentual de óleo essencial obtido a partir da raiz ... 45
Tabela 5 −−−− Rendimento percentual de óleo essencial obtido a partir do caule ... 45
Tabela 6 −−−− Rendimento percentual de óleo essencial obtido a partir das folhas ... 46
Tabela 7 −−−− Ordem de eluição dos padrões de n-alcanos ... 47
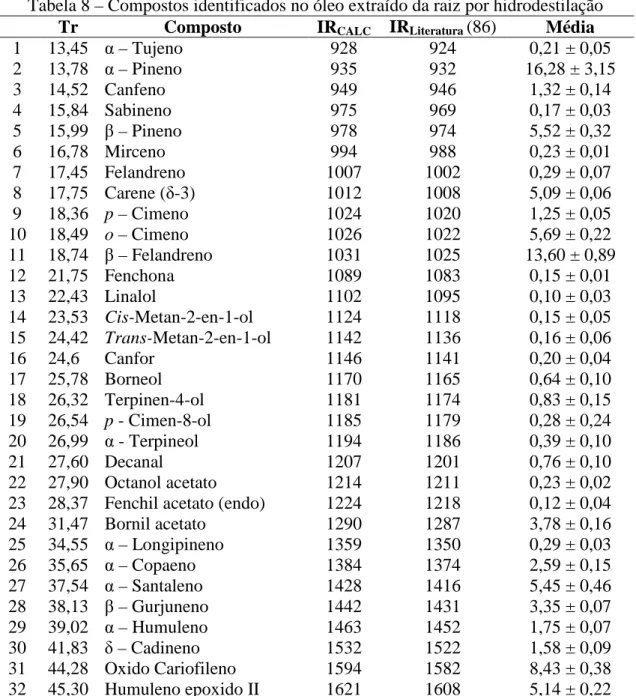
Tabela 8 – Compostos identificados no óleo extraído da raiz por hidrodestilação ... 48
Tabela 9 −−−− Compostos identificados no óleo extraído do caule por hidrodestilação ... 49
Tabela 10 −−−− Compostos identificados no óleo extraído das folhas por hidrodestilação ... 50
Tabela 11 – Percentual de inibição do crescimento celular em células tumorais humanas ... 52
Tabela 12 – Resumo das condições otimizadas de extração por MEFS ... 58
Tabela 13 – Compostos presentes da raiz por MEFS-HS ... 59
Tabela 14 −−−− Compostos provenientes do caule por MEFS-HS ... 60
Tabela 15 −−−− Compostos provenientes das folhas por MEFS-HS ... 61
Tabela 16 −−−− Vantagens e desvantagens da hidrodestilação e MEFS na extração dos COV .... 67
Tabela 17 – Parâmetros cromatográficos para análise do Dodecano ... 69
Tabela 18 – Parâmetros cromatográficos para análise do trans-β-cariofileno ... 70
Tabela 19 −−−− Difusão do dodecano e trans-β-cariofileno nas fases estacionária e móvel da coluna capilar ... 71
Tabela 20 −−−− Precisão intra-corrida... 75
Tabela 21 −−−− Precisão inter-corrida... 76
ANVISA Agência Nacional de Vigilância Sanitária C.V Coeficiente de Variação
CG-DIC Cromatografia Gasosa com Detector por Ionização em Chama CG-EM Cromatografia Gasosa Acoplada a Espectrometria de Massas CLAE Cromatografia líquida de alta eficiência
COV Compostos orgânicos voláteis
DMSO Dimetilsulfóxido
FUNCEME Fundação Cearense de Meteorologia e Recursos Hídricos IEC International electrotechnical commission
IK Índice de Kováts
INMETRO Instituto Nacional de Metrologia, Qualidade e Tecnologia IRL Índice de Retenção Linear
ISO International Organization for Standardization MEFS Micro Extração em Fase Sólida
MEFS-HS Micro Extração em Fase Sólida por Headpace PDMS Polidimetilsiloxano
PEXT. Padrão Externo
PINT. Padrão Interno
SCAN Varredura de íons
α Seletividade
A Múltiplos caminhos do analito na coluna cromatográfica
B Difusão longitudinal do analito na coluna cromatográfica
C Tempo de equilíbrio do analito na coluna cromatográfica
Ce Resistência a transferência de massa na fase estacionária
Cm Resistência a transferência de massa na fase móvel
De Coeficiente de difusão na fase estacionária di Diâmetro interno da coluna cromatografica Dm Coeficiente de difusão na fase móvel
f Espessura do filme da fase estacionaria da coluna cromatografica
H Altura de prato
k Fator de capacidade
L Comprimento da coluna cromatográfica
N Número de pratos
ux Vazão linear da fase móvel em cromatografia gasosa
σ Desvio padrão
1 INTRODUÇÃO ... 17
2 FUNDAMENTAÇÃO TEÓRICA ... 19
2.1. Plantas medicinais ... 19
2.2. Espécie Plectranthus grandi ... 19
2.3. Técnicas de extração e de preparo de amostras... 20
2.3.1. Hidrodestilação ... 21
2.3.2. Microextração em fase sólida ... 22
2.3.2.1. Aplicações da MEFS na análise in vivo e in vitro de plantas. ... 23
2.4. Cromatografia gasosa ... 25
2.4.1. Analise qualitativa e quantitativa ... 26
2.4.2. Eficiência da separação cromatográfica... 28
2.5. Validação de metodologia de análise em cromatografia gasosa ... 29
3 OBJETIVOS ... 31
4 JUSTIFICATIVA ... 32
5 METODOLOGIA ... 33
5.1. Solventes e reagentes ... 33
5.2. Extração do óleo essencial por hidrodestilação ... 33
5.3. Análise dos metabólitos secundários voláteis por CG-EM e CG-DIC. ... 34
5.4. Análise qualitativa dos constituintes voláteis da espécie Plectranthus grandis. ... 35
5.5. Avaliação do potencial atitumoral in vitro. ... 35
5.6. Otimização das condições de extração por MEFS. ... 36
5.7. Planejamento experimental. ... 36
5.8. Validação da metodologia de análise para o trans−−−−β−−−−cariofileno. ... 39
5.8.1. Eficiência da separação. ... 40
5.8.1.1. Determinação do fluxo ideal da fase móvel. ... 40
5.8.1.2. Determinação do coeficiente de difusão do soluto na fase móvel e estacionária. ... 40
5.8.2. Figuras de mérito ... 42
6 RESULTADOS E DISCUSSÕES ... 45
6.1. Extração do óleo essencial por hidrodestilação. ... 45
6.2. Análise da mistura padrão de n-alcanos por CG-EM e CG-DIC. ... 46
6.5. Otimização das condições de extração por MEFS-HS... 53
6.6. Comparação dos COV obtidos por MEFS e Hidrodestilação. ... 62
6.7. Validação de metodologia de análise para o trans−−−−β−−−−cariofileno ... 67
6.7.1. Determinação dos parâmetros cromatográficos ... 67
6.7.2. Figuras de mérito. ... 73
6.7.2.1. Seletividade. ... 73
6.7.2.2. Faixa linear ... 74
6.7.2.3. Linearidade ... 74
6.7.2.4. Precisão ... 75
6.7.2.5. Limite de detecção e limite de quantificação ... 76
6.7.2.6. Análise quantitativa do trans-β-cariofileno ... 77
6.7.2.7. Exatidão ... 77
7 CONSIDERAÇÕES FINAIS ... 79
1 INTRODUÇÃO
Desde a antiguidade, o homem vem desenvolvendo técnicas e mecanismos que possibilitem um melhor conhecimento das plantas medicinais e suas propriedades. As plantas foram por quase toda a história da humanidade a maior e a mais importante fonte de substâncias medicamentosas. (1) Além disso, as plantas medicinais representam na maioria das vezes, a única fonte terapêutica para muitas comunidades, principalmente as distantes das zonas urbanas e que não dispõem de assistência médica e farmacêutica. (2)
As plantas produzem uma grande variedade de compostos orgânicos, como carboidratos, lipídios, proteínas, nucleotídeos e aminoácidos que compõem o grupo dos
metabólitos primários. No grupo dos metabolitos secundários, pode ser citado, principalmente, os alcalóides, terpenóides e os compostos fenólicos. As substâncias do segundo grupo não se distribuem uniformemente na planta, sua produção ocorre tipicamente em um órgão e sua concentração varia ao longo de 24 horas. (3)
A espécie Plectranthus grandis, pertencente ao gênero Plectranthus e conhecido popularmente como boldo grande, se destaca na medicina popular por possuir propriedades analgésicas, antiespasmódica e estimulante digestivo. (4, 5) Alguns pesquisadores já identificaram a composição Química das folhas desta espécie, entretanto não se tem o conhecimento da composição da raiz e do caule bem como o estudo de sua atividade biológica. A identificação e caracterização de compostos voláteis, provenientes de uma variedade de espécies de plantas aromáticas, sempre despertou o interesse de pesquisadores, no entanto, para se chegar próximo ao perfil natural da amostra, é preciso selecionar o método mais adequado de extração dos compostos. (6-8)
A literatura reporta as técnicas de extração por micro-ondas, fluído supercríticos, arraste a vapor e hidrodestilação como as mais usadas na extração de metabólitos secundários voláteis a partir de plantas, sendo a última considerada um dos processos mais antigos para a obtenção de óleos essenciais. (8-10) Outra técnica, que começa a ser utilizada no preparo de amostra para a identificação de compostos voláteis, é a microextração em fase sólida (MEFS). (11-13)
Após o processo de extração, o material obtido é separado e analisado geralmente por cromatografia gasosa, utilizando os detectores de ionização em chama (DIC) e
espectrometria de massas (CG−EM). (14) A cromatografia gasosa acoplada à espectrometria
os espectros de massas de um banco de dados do equipamento, no entanto essa comparação pode não ser muito eficiente para alguns compostos. Este problema acontece, na maioria das vezes quando compostos diferentes apresentam espectros de massas muito semelhantes. (15) Para resolver este problema, a literatura reporta o uso do índices de Kórvats (IK) e do índice de retenção linear (IRL). (13, 16, 17)
Muitos compostos identificados em plantas apresentam importantes propriedades farmacológicas, assim, o acompanhamento sazonal das suas concentrações requer o desenvolvimento de metodologias de quantificação desses metabólitos. Para isso, se faz necessário validar um método de análise, onde vários autores possuem uma definição própria para este termo, entretanto ambos possuem o mesmo significado em comum para esta
2 FUNDAMENTAÇÃO TEÓRICA
2.1. Plantas medicinais
As plantas medicinais têm sido, por muito tempo, um importante recurso terapêutico para o tratamento e cura de enfermidades. (1, 18) Relata-se que Hipócrates, que viveu nos séculos IV e III a.C., recomendava o uso correto das plantas. No mesmo período,
Dioscórides – em seu tratado Matéria Médica – cita mais de 600 plantas medicinais de uso contínuo na época. (2)
Os produtos naturais tem recebido atenção de Químicos orgânicos e suas propriedades vêm sendo investigadas desde 1850. Sendo que, o estudo dos produtos naturais estimulou o desenvolvimento de técnicas de separação e espectroscópicas para a elucidação da estrutura dos compostos químicos. (3)
Os vegetais produzem uma grande variedade de compostos orgânicos, muitos de importância direta para seu próprio desenvolvimento e crescimento. Estes compostos têm sido classificados em metabólitos primários e secundários. Os metabólitos primários, como os açúcares simples, proteínas, lipídios, nucleotídeos e aminoácidos, são moléculas encontradas em todas as células vegetais e executam funções já determinadas para a vida da planta. (3)
Por outro lado, os metabólitos secundários estão distribuídos entre as espécies de plantas e são importantes para sua sobrevivência. Muitos deles funcionam como sinais químicos, que permitem à planta responder a estímulos do ambiente. Outros funcionam como defesa das plantas que os produzem contra herbívoros, patógenos ou competidores. Entretanto, muitas de suas funções ainda permanecem desconhecidas. (3, 19)
Além disso, a produção de metabólito secundário ocorre tipicamente num órgão, tecido ou tipo de célula em um determinado estágio de desenvolvimento, por exemplo, no crescimento das flores ou frutos, e sua concentração na planta varia ao longo do período de 24 h. (4, 19) As principais classes de metabólitos secundários são: alcalóides, terpenóides e compostos fenólicos. (3, 19)
2.2. Espécie Plectranthus grandi
Plectranthus grandi, conhecida popularmente como boldo grande, se destaca na medicina
popular por possuir algumas propriedades medicinais. (21)
Figura 1 – Espécie Plectranthus grandi
Fonte: Elaborado pelo autor.
Dentre os compostos presentes na espécie Plectranthus grandi, está o trans-β
-cariofileno, Figura 2, que é um sesquiterpeno encontrado em diversas plantas. (21-24) Seu percentual de concentração varia de acordo com a parte em que foi extraído. (25) Este composto é um constituinte largamente utilizado para dar aroma aos cosméticos. (26) Amostras de óleo essencial, cujo componente majoritário era o trans-β-cariofileno, apresentou
atividade antibacteriana, antioxidade e antiinflamatório. (27-29) Um Trabalho recente utilizou este composto, de forma isolada, no estudo da atividade antiespasmódica. (26)
Figura 2 – Trans-β-cariofileno
CH3 CH3 CH3
C H2
H H
Fonte: Sigma−Aldrich®
2.3. Técnicas de extração e de preparo de amostras
composicional mais veraz da planta. Desta forma, algumas técnicas foram desenvolvidas e são utilizadas para a extração destes compostos, dentre elas, destaca-se a extração por microondas, fluido supercrítico, arraste a vapor, hidrodestilação e microextração em fase sólida (MEFS). (7-9, 30-32) Dentre estas, um destaque maior será dado às duas últimas.
2.3.1. Hidrodestilação
A hidrodestilação é considerada um dos processos mais antigos para a obtenção de óleos essenciais em laboratórios. Esse processo utiliza um aparato do tipo Clevenger, onde a extração dos compostos voláteis é realizada por destilação em que o óleo é arrastado da
amostra pelo vapor d’água formado. A diferença de densidade água/óleo permite então a separação. (33)
A literatura reporta a utilização da hidrodestilação na extração dos compostos voláteis de muitas espécies de plantas. (4, 21, 34-36) Tankeu (34) empregou a hidrodestilação na extração dos óleos essenciais para identificar diferentes quimiotipos da espécie Tagetes
minuta. Porres-Martínez (35) identificou, com o auxílio da extração por hidrodestilação, a
composição química do óleo essencial de Salvia lavandulifolia, especiaria utilizada para dar sabor, cor e aroma aos alimentos. Outros trabalhos utilizaram mais de uma técnica de extração, na qual, a hidrodestilação está incluída e tem como finalidade a comparação dos constituintes químicos que são removidos nos diferentes procedimentos empregados. (37-44)
No trabalho de Herzi, (44) duas espécies de eucalyptus foram utilizadas na extração de seus respectivos óleos essenciais por hidrodestilação e por fluido supercrítico de CO2, na qual os rendimentos de materiais obtidos foram comparados, bem como a composição química das amostras. Yilmaz (43) utilizou a destilação por forno em microondas e a tradicional técnica de hidrodestilação na extração dos óleos essenciais provenientes das flores, folhas e caule da espécie Astragatus hamzaoglui, bem como a análise qualitativa de cada amostra em seus respectivos procedimentos de extração.
A hidrodestilação possui um baixo custo e praticidade. Por outro lado, por não ser um método de extração sofisticado, pois apresenta algumas desvantagens como, longo tempo de extração, variando de 2 a 3 horas, a depender da natureza do material. (34, 35) Além disso, perdas de compostos voláteis, decomposição e formação de produtos de oxidação são
2.3.2. Microextração em fase sólida
Em muitos trabalhos encontrados na literatura é possível verificar o emprego de um pré-tratamento da amostra antes desta ser analisada diretamente por uma técnica instrumental de análise.(46) O preparo da amostra é requerido, normalmente, porque apenas uma fração do material é objetivo da análise, dessa forma, esta etapa se torna indispensável. (47) Alguns procedimentos de preparo de amostras estão disponíveis, dentre elas, destaca-se a microextração em fase sólida (MEFS).
A MEFS foi desenvolvida por Pawliszyn (14) no início da década de 90, e é uma técnica de extração onde os analitos são adsorvidos por uma fibra de sílica fundida, revestida
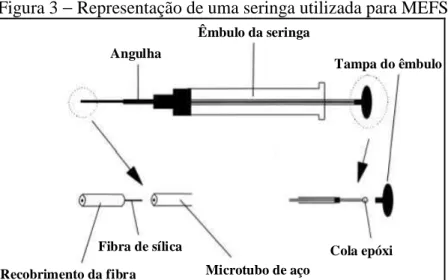
por um filme de material adsorvente, como polidimetilsiloxano (PDMS), poliacrilato (PA) ou carbowax (CAR), na qual, a extração dos analitos se dá pela afinidade destes pela fibra. A Figura 3 apresenta o sistema de disposição da fibra adsorvente utilizado na MEFS.
Figura 3 − Representação de uma seringa utilizada para MEFS
Angulha
Êmbulo da seringa
Recobrimento da fibra Fibra de sílica
Microtubo de aço
Cola epóxi Tampa do êmbulo
Fonte: Evolution of solid-phase microextraction technology (48)
Em estudos de micropoluentes em águas Pawliszyn (14) observou que na MEFS a extração não é exaustiva ocorrendo um equilíbrio entre a matriz e a fase estacionária. Sendo assim, o equilíbrio do analito entre as duas fases podem ser expressas pela constante de distribuição K:
= (1) Em que Cf representa a concentração do analito na fibra e Caq a concentração do analito na
matriz. A razão de partição, k, será dada por:
= = = (2) Em que nf e naq representam o número de mol na fase estacionária e aquosa, respectivamente. Um rearranjo da última equação fornecerá:
= (3)
Substituindo “Caq Vaq” na (Eq.2) por “naq”, obtêm-se:
= = → = . (4) Como na Eq. 2,
= .
Assim,
= . (5)
Fazendo o termo K.Vf igual a uma constante, A, tem-se:
= (6)
A Equação 6 relaciona a quantidade adsorvida na fase estacionária e a
concentração na amostra. Apesar de ter sido desenvolvida inicialmente para análise de micropoluentes em águas, a MEFS encontra emprego em vários campos da ciência, tais como, análise de voláteis em diversas espécies de plantas (13, 50, 51) e frutas (12), voláteis no ar (52), voláteis em bebidas alcoólicas (11), análise biológica (53) dentre outras aplicações.
2.3.2.1. Aplicações da MEFS na análise in vivo e in vitro de plantas.
flores, folhas, raízes, caule e sementes têm sido estudados. (54) A utilização da MEFS na análise desse tipo de amostra se deve principalmente a capacidade de quase todas as plantas em emitir compostos orgânicos voláteis (COV), constituintes de óleos essenciais que requerem um rigoroso controle de qualidade. (55) Trabalhos na literatura têm empregado a MEFS na análise dos constituintes de frutas, (56-63) por exemplo, na análise de Malásia
duriangos 39 COV foram identificados em 30 minutos de headspace (tempo de extração) em CG−EM. (64)
Devido às características físicas das flores, a MEFS se tornou uma ferramenta importante na identificação dos voláteis desta parte da planta. Devido a sua fragilidade, a utilização de extração térmica ou destilada, pode resultar em perdas de analitos de alta
volatilidade. (65) A MEFS foi utilizada para a análise e identificação dos COV emitidos a partir de flores de diferentes plantas, como Patrinia scabiosifolia,(66) Tecucrium massiliense
L,(67) Catharanthis roseus (L.) G. Don,(68) Jasminum sambac (L.) Ait.,(69) Murrarya paniculata (linn.) Jack (70) e Crisântemo.(71)
Além das frutas e flores, a literatura também reporta o emprego da técnica de MEFS na análise dos COV proveniente das folhas. A investigação do potencial neurofarmacológico de voláteis liberados a partir de Cryptomeria japônica é relatado na literatura. (72) Neste caso, os compostos emitidos a partir das folhas frescas foram extraídos
in vitro por revestimentos CAR/PDMS e analisados por CG−EM.
Em contraste às aplicações de flores, frutos e folhas, a utilização da MEFS na análise dos compostos voláteis provenientes de raízes e caule tem sido pouco explorada.
Cinnamomun cássia presl, conhecida popularmente como canela, foi objeto de investigação
dos seus constituintes voláteis, através do emprego da MEFS e da hidrodestilação. (10) De forma semelhante, os compostos voláteis das raízes da Echinops kebericho mesfin foram extraídos por hidrodestilação e MEFS, onde a composição química obtida por ambas às técnicas não apresentou variação significativa. (73)
Compostos voláteis das raízes de Ligusticum chuanxiong Hort, foram analisados por comparação das técnicas de MEFS e destilação a vapor. O estudo demonstrou que a MEFS foi mais eficiente na extração dos voláteis do que a tradicional destilação, sendo que 73 compostos foram identificados por MEFS, enquanto 61 foram detectados quando foi
Assim, a MEFS tem se tornado uma ferramenta auxiliar na investigação de COV, uma vez que, perdas, degradações térmicas ou produtos de oxidação podem ser formados ao se utilizar de técnicas convencionais de extração. (45)
2.4. Cromatografia gasosa
Após o processo de extração do óleo essencial os analitos são separados e analisados por cromatografia gasosa. Que por definição é um método Físico-Químico de separação de uma mistura, realizadas através da distribuição desses componentes em duas fases, que estão em contato direto. Neste caso, a fase móvel pode ser sólida ou líquida e a fase móvel um gás inerte de alta pureza. (75, 76)
Em um sistema de cromatografia gasosa, a amostra, por meio de um sistema de injeção, é introduzida em uma coluna contendo a fase estacionária. O uso de temperaturas convenientes no local de injeção da amostra e na coluna possibilita a vaporização dessas substâncias que, de acordo com suas propriedades e da fase estacionária, são retidas por
tempos determinados e chegam à saída da coluna em tempos diferentes. O uso de um detector adequado na saída da coluna torna possível a detecção e quantificação dessas substâncias.
Um detector ideal depende do tipo de amostra analisada e deve ser seletivo, possuir boa sensibilidade em função da quantidade detectada, apresentar uma faixa linear de resposta, insensível a alterações de vazão e temperatura. (76)
O detector por ionização de chama (DIC) é um dos detectores mais utilizados em cromatografia gasosa. (76-78) O mecanismo de resposta deste detector consiste na combustão, em uma pequena chama de oxigênio e hidrogênio, do eluente da coluna. Neste processo são gerados íons que são recolhidos e formam uma pequena corrente na forma de sinal. (77-79) Este sinal é proporcional à quantidade de carbono gerado na combustão e não responde a presença de água e outros gases, por exemplo, CO2 e NO2. (77)
Outro detector que é bastante utilizado para análise de COV é o detector de
Figura 4 – Sistema CG-EM
FONTE: Skoog, Fundamentos de Química Analítica (80)
O mecanismo de resposta deste detector consiste na produção de íons do analito, em fase gasosa. Estes íons sofrem fragmentações para dar origem a sucessivos fragmentos. Estes são separados de acordo com sua razão massa/carga e atingem o sistema de detecção. Após esse processo, um espectro é apresentado como gráfico de barras, onde o pico de maior intensidade (pico base) e é atribuído arbitrariamente à abundância relativa de 100%. Nas mesmas condições de análise, cada composto possui um padrão de fragmentação que pode ser
comparado com espectros de uma biblioteca do próprio sistema. (81)
2.4.1. Analise qualitativa e quantitativa
A possibilidade do acoplamento de um espectrômetro de massas a um cromatógrafo gasoso permite a identificação de uma variedade de compostos. (81) A análise qualitativa consiste em obter o espectro de massas de um composto investigado e compará-lo com espectros armazenados no banco de dados, do próprio sistema. Em seguida, obtém-se o índice de similaridade que informa, através de um valor numérico, a semelhança do espectro
da amostra com o espectro de referência.
No entanto, os bancos de dados não são completos e muitas vezes possuem baixa eficiência para caracterizar alguns compostos. (17, 82) Este fato pode se tornar um problema, principalmente quando espectros de massas com os mesmos padrões de fragmentação são obtidos para compostos diferentes. Assim, a utilização de padrões conhecidos e o uso dos índices de retenção servem como auxílio, evitando-se uma identificação equivocada. (17) A literatura reporta a utilização do índice de Kovats (IK) e do índice de retenção linear (IRL), obtidos respectivamente através das Equações 7 e 8. (16, 17, 83-85)
= + ( − )Log (Desconhecido) - Log (n)
I = + ( − ) ′
(Desconhecido) - ′ (n) ′
(N) – ′
(n) (8)
Em que, n é o número de átomos de carbono no menor alcano; N é o número de átomos de carbono no maior alcano; t´R(n) é o tempo de retenção ajustado no menor alcano; t´R(N) é o tempo de retenção ajustado no maior alcano.
Estes parâmetros estão relacionados com o tempo de retenção de um composto em estudo com o tempo de retenção de dois padrões de hidrocarbonetos eluídos antes e após o pico do analito. Além disso, estes índices são determinados em condições diferentes de análise, o primeiro, quando a taxa de aquecimento do forno do cromatógrafo está nas condições isotérmicas e o segundo, para com uma programação de temperatura
pré-estabelecida. (77, 86)
A análise quantitativa requer alguns cuidados ao se preparar a amostra, visando
principalmente evitar a perda e contaminação da mesma. (76, 77) Dentre os métodos de quantificação utilizados em cromatografia gasosa, tem-se: normalização da área; normalização da área com fator de resposta; padrão externo; padrão interno e adição de padrão.
A normalização da área consiste em determinar a contribuição percentual, da área de um pico em estudo, com a área de todos os picos identificados no cromatograma.
Á % ( ) = !
Ʃ# ( #) (9)
Em que, Ax representa a área do pico de interesse e o denominador é a soma de todas as áreas. Esse método requer que todos os compostos presentes na amostra sejam eluídos e que o detector forneça uma resposta idêntica para todos os analitos, isto é, que todos os componentes da amostra sejam identificados.
No método do padrão externo, a área de uma substância a ser quantificada na amostra é comparada com as áreas obtidas através da análise da mesma substância em soluções padrões de concentração conhecida, através de curvas analíticas. (87) Esse método é rápido e de baixo custo, porém, é sensível a erros de injeção das soluções padrões e das amostras, bem como a erros relacionados com a preparação dos padrões. (88) Maior precisão na resposta deste método pode ser obtido com a utilização de injetores automáticos. (87)
semelhantes ao analito de interesse, mas que gera uma resposta diferente do composto a ser analisado. Além disso, deve ter tempo de retenção próximo do analito, não reagir com a substância ou outro componente da matriz e não fazer parte da amostra. (89)
A principal função do padrão interno é corrigir as variações ocasionadas pela variabilidade do procedimento experimental e incertezas introduzidas na injeção da amostra ocasionadas pelas pequenas quantidades de volumes injetadas. (87, 90-92)
2.4.2. Eficiência da separação cromatográfica
Diversos fatores podem afetar a eficiência de separação cromatográfica, por exemplo, o comprimento e o diâmetro interno de uma coluna, temperatura, vazão da fase móvel, volume da amostra, técnicas de injeção, características das substâncias, etc. (76) Quando é utilizado colunas de comprimento diferente, a eficiência é avaliada através da altura de prato, H.
$ = (10)
Em que L é o comprimento da coluna cromatográfica e N é o número de pratos teóricos. Um prato corresponde a uma etapa de equilíbrio da substância entre a fase estacionária e a fase móvel; portanto, quanto maior o número de pratos, melhor será a eficiência.
Van Deemter e colaboradores desenvolveram uma expressão, Equação 11, que relaciona três efeitos que contribuem para o alargamento de um pico. (93)
$ ≈ & +('
!+ )*+ (11)
O termo A refere-se ao alargamento do pico devido aos múltiplos caminhos percorrido pelas moléculas da amostra. O termo B está diretamente relacionado com a difusão molecular do soluto na fase móvel, que é proporcional a difusão do soluto no gás de arraste. O termo C é proveniente do tempo finito necessário para o soluto alcançar o equilíbrio entre as
fases móvel e estacionária. E ux é a vazão linear.
Segundo Golay (77), Equação 12, as colunas capilares não exercem uma
influência significativa no termo A.
$ = '
Golay observou também que o termo C, é proveniente da resistência à transferência de massa na fase estacionária Ce adicionado da resistência à transferência de
massa na fase móvel Cm e que, o termo B, na equação de Van Deemter, é o dobro do
coeficiente de difusão do soluto na fase móvel, Equação 13. (77)
' = ./- (13) A utilização das Equações 14 e 15 possibilitam uma melhor compreensão dos
efeitos da espessura da fase estacionária (f), do diâmetro interno da coluna (di), bem como no mecanismo de escolha da fase móvel que permite obter a maior eficiência na separação.
), = .01.
2( 30)./, (14)
)-= 4 3503 0
.678.
.9( 30)./- (15)
K: fator de capaciddade; De: coeficiente de difusão na fase estacionaria; Dm: coeficiente de difusão na
fase móvel.
A contribuição de Ce e Cm para o termo total C depende do fator de capacidade
bem como da espessura da fase estacionária utilizada na análise. Para espessuras menores que 0,2 µm, o termo C é controlado pela transferência de massa na fase móvel; Para filmes de 2 a 5 µm, pela transferência de massa na fase estacionária e para filmes intermediários de 0,2 a 2
µm, ambos os fatores contribuem para o termo C.(77)
A literatura reporta um grande número de trabalhos que utilizam a cromatografia gasosa como técnica para validação de metodologias de análise. (94-96) Entretanto, pouca atenção tem sido dada as condições ideias de eficiência, podendo, neste caso, levar a resultados equivocados.
2.5. Validação de metodologia de análise em cromatografia gasosa
O desenvolvimento de um método analítico envolve um processo de certificação de sua eficiência em uso rotineiro de um laboratório, denominado de validação. Vários autores, nacionais e internacionais, definem o termo validação, porém todos apresentam a
mesma ideia em comum. No Brasil, existem duas autarquias responsáveis para verificar a competência de laboratórios de ensaio, a ANVISA e o INMETRO, que disponibilizam guias
para o procedimento de validação de métodos analíticos.
confiabilidade dos resultados. O INMETRO (98) define validação como sendo a comprovação, através do fornecimento de evidência objetiva, de que os requisitos para uma aplicação ou uso específico foram atendidos.
A Eurachem Working Group (99) afirma que a validação é o processo de definir uma exigência analítica e confirmar que o método sob investigação tem capacidade de desempenho consistente com o que a aplicação requer. Segundo a ISO/IEC 17025, (100) validação é a confirmação por testes e apresentação de evidências objetivas de que determinados requisitos são preenchidos para um dado uso internacional.
Os parâmetros a serem validados diferem de acordo com os detalhes da análise a ser efetuada. (87, 88, 97) Assim, testes quantitativos para a determinação do princípio ativo
em produtos farmacêuticos requerem procedimentos diferentes daqueles empregados, por exemplo, na avaliação quantitativa para a determinação de impurezas em produtos de degradação em gêneros alimentícios.
3 OBJETIVOS
Objetivo Geral
Investigar a composição volátil e o potencial citotóxico da espécie Plectranthus
grandis, cultivado no horto de plantas medicinais Prof. Francisco José de Abreu Matos,
extraído por hidrodestilação e MEFS e validar uma metodologia de análise para o trans-β
-cariofileno por CG−EM.
Objetivos Específicos
Coletar amostras de raízes, caule e folhas da espécie Plectranthus grandis, cultivado no horto de plantas medicinais Prof. Francisco José de Abreu Matos, da UFC;
Extrair por hidrodestilação o óleo essencial das raízes, caule e folhas da espécie
Plectranthus grandis;
Avaliar o potencial antitumoral in vitro do óleo essencial extraído por hidrodestilação;
Otimizar as condições de extração e estudar o efeito das variáveis que influenciam o procedimento de extração dos COV por MEFS;
Utilizar as condições otimizadas da MEFS na investigação da constituição química volátil da espécie Plectranthus grandis;
Ajustar os parâmetros instrumentais e de máxima eficiência para análise dos constituintes voláteis por CG−EM e CG−DIC;
Validar uma metodologia de análise por CG−EM para o trans-β-cariofileno (como
4 JUSTIFICATIVA
Atualmente diversos procedimentos têm sido desenvolvidos para a extração de compostos voláteis de várias partes da planta. Muitos trabalhos encontrados na literatura utilizam diferentes processos de extração de óleos essenciais, tais como, destilação por arraste a vapor, extração com fluido supercrítico (SFE) e hidrodestilação. A técnica de microextração em fase sólida (MEFS) é utilizada em alguns trabalhos, por possuir vantagens em relação a outros procedimentos de extração. (38, 39, 41, 42)
Diante do exposto, resolveu-se investigar a composição química de folhas, raízes e caule da espécie Plectranthus grandis pelas técnicas de hidrodestilação e MEFS. Tendo em vista que a hidrodestilação, técnica tradicional empregada para a remoção dos constituintes voláteis da planta, requer grande quantidade de material, emprega altas temperaturas, além de reagentes específicos para o tratamento do óleo obtido, além disso, alguns constituintes podem ser perdidos durante o processo de extração.
Assim sendo, a MEFS surge como uma ferramenta complementar, para a
investigação de compostos voláteis de plantas. Considerando que a MEFS requer uma quantidade de material inferior ao que é utilizado na técnica de hidrodestilação, permitindo
que outras partes da planta possam ser investigadas, como o caule, raízes e flores, que dependendo do período do ano são encontrados em pequenas quantidades, que é o caso das flores.
Sendo assim, a análise dos voláteis provenientes da raiz, caule e folhas da espécie
Plectranthus grandis se torna de fundamental importância, uma vez que, não se tem registros
científicos da composição das duas primeiras partes. Ademais, quantificar os componentes majoritários por meio de validação de metodologias analíticas são meios eficazes para
determinar a quantidade destes compostos na planta, que é o caso do trans-β-cariofileno, na
5 METODOLOGIA
5.1. Solventes e reagentes
Sulfato de sódio anidro P.A (99,0%), da marca Vetec®; Diclorometano (99,5%),
da marca Synth®; Solução padrão de 1000 µg/mL de n−alcanos C7-C30 (99,9%), da marca
Supelco® e fornecido pela Sigma−Aldrich®; Dodecano (99,9%), da marca Hiedel – De Haën®
e trans-β-cariofileno (98,5%), fornecido pela Sigma−Aldrich®.
5.2. Extração do óleo essencial por hidrodestilação
Foi coletado no dia 22 de agosto de 2013, às 9 h da manhã, no horto de plantas
medicinais da UFC as amostras de raízes, caule e folhas da espécie Plectranthus grandis. Um exemplar desta espécie encontra-se depositado no herbário Prisco Bezerra (UFC) sob o número 28377. Segundo a FUNCEME, as condições climáticas do dia eram de céu nublado a parcialmente nublado, com chuvas isoladas e temperatura mínima de 24 °C e máxima de 32 °C. As raízes e caule foram lavados com água corrente e cortadas em pedaços pequenos, de modo a facilitar o processo de extração.
A extração do óleo essencial foi realizada em um sistema tipo Clevenger. Para isso, 200 g de cada uma das amostras de raízes, caule e folhas foram pesados, adicionado a um balão de 2 L e adicionado um volume suficiente de água destilada para encobrir o material. As amostras foram obtidas em triplicata de modo que nove sistemas de hidrodestilação foram preparados. O tempo estimado para a extração do óleo essencial de cada sistema foi de 2,0 horas.
5.3. Análise dos metabólitos secundários voláteis por CG-EM e CG-DIC.
Após o processo de extração, os óleos essenciais provenientes da raiz, caule e
folhas foram analisados, no menor intervalo de tempo possível, simultaneamente por CG−EM
e CG−DIC. Para isso, preparou-se uma solução contendo 2 µL de óleo essencial em 1 mL de
diclorometano.
Análise em CG-EM
As análises dos óleos essenciais obtidos por hidrodestilação foram realizadas em um cromatógrafo a gás acoplado a um espectrômetro de massas da marca Shimadzu® (modelo
GCMS - QP 2010) utilizando uma coluna capilar DB−5, fase estacionária 5%
difenildimetilsiloxano de 20 m de comprimento, diâmetro interno de 0,18 mm e com
espessura de filme de 0,40 µm (J&W Scientific®). Utilizou-se o programa GC−MS Solution–
versão 2.30 (Shimadzu®) para obtenção e tratamento dos dados cromatográficos.
Para as análises a programação de aquecimento do forno cromatográfico seguiu o procedimento estabelecido pela literatura (86) e iniciou-se em uma temperatura de 40 °C (3 minutos) → 3°C/minuto até 290 °C (4 minutos). Os parâmetros instrumentais utilizados foram: temperatura do injetor de 250 °C; modo de injeção split de 1:10; vazão volumétrica da fase móvel de 0,59 mL/minuto; temperatura da interface de 300 °C; análises realizadas no modo SCAN em uma faixa de 18 a 400 m/z (em intervalos de 0,5s e com energia de ionização de 70 eV); temperatura do detector de 250 °C.
Análise em CG-DIC
As análises foram realizadas em um cromatógrafo a gás com detector de ionização em chama (modelo GC-2010) utilizando uma coluna capilar Rtx-5, fase estacionária 5% difenildimetilsiloxano, de 30 m de comprimento, diâmetro interno de 0,25 mm e espessura do
filme de 0,25 µm (Restek®). Utilizou-se o programa GC Solution–versão 2.30 (Shimadzu®) para obtenção e tratamento dos dados cromatográficos.
Para as análises a programação de aquecimento do forno cromatográfico
instrumentais foram: temperatura do injetor de 250 °C; modo de injeção split de 1:5; vazão volumétrica da fase móvel de 0,59 mL/minuto e temperatura do detector de 220 °C.
5.4. Análise qualitativa dos constituintes voláteis da espécie Plectranthus grandis.
Os constituintes voláteis foram identificados pela comparação dos espectros de massas obtidos, com os espectros de massas do banco de dados do equipamento. Neste caso, o índice de similaridade entre os espectros foi utilizado para avaliar e identificar os compostos na amostra. Além disso, utilizou-se o IRL como parâmetro de identificação dos compostos presentes na amostra. Para isto, uma solução de 100 µg/mL de uma série homóloga de
hidrocarbonetos de C−7 a C−30 foi preparada. 1 µL dessa solução foi injetada, nas mesmas
condições instrumentais de análise do CG−EM e CG−DIC. O IRL de cada composto foi
calculado através da Equação 8 e comparado com valores da literatura.
5.5. Avaliação do potencial atitumoral in vitro.
Os testes de citotoxidade do óleo essencial, extraído por hidrodestilação a partir das raízes e do caule da espécie Plectranthus grandis, foi avaliado em 3 linhagens tumorais
humanas, sendo estas, OVCAR−8 (ovário), SF−295 (glioblastoma) e HCT−116 (colon), que
foram cedidas pelo Instituto Nacional do Câncer (EUA), tendo sido cultivadas em meio de RPMI 1640, suplementados com 10% de soro fetal bovino e 1% de antibióticos, mantidas em estufas a 37 °C e atmosfera contendo 5% de CO2. As amostras de óleo essencial foram diluídas em dimetilsulfoxido (DMSO) puro estéril. Na qual, foram testadas em uma única concentração de 25 µg/mL para avaliar o percentual de inibição do crescimento celular.
As células tumorais foram plaqueadas nas concentrações de 0,1 x 106 cél/mL para
as linhagens OVCAR−8 e SF−295 e 0,7 x 105 cél/mL para a linhagem HCT−116. As placas foram incubadas por 69 h em estufa a 5 % de CO2 a 37 °C. Ao término deste, as mesmas foram centrifugadas e o sobrenadante removido. Em seguida, foram adicionados 150 µL da
5.6. Otimização das condições de extração por MEFS.
Inicialmente, realizou-se uma análise preliminar a fim de identificar o melhor revestimento de fibra para o processo de microextração em fase sólida. Para isso, quatro revestimentos de fibras foram empregados nesta etapa sendo estas: Polidimetilsiloxano 100
µm (PDMS); Poliacrilato 85 µm (PA); Polidimetilsiloxano/divinilbenzeno 65 µm
(PDMS/DVB) e Carbowax/Polidimetilsiloxano 75 µm (CAR/PDMS).
As condições de extração e análise utilizadas na microextração em fase sólida foram fixadas em 30 mg de folhas, temperatura de extração de 45 °C, tempo de extração de 5
min, temperatura e tempo de dessorção de 250 °C e 4 min, respectivamente. Para isso, um vial de 40 mL contendo a quantidade de material foi aquecido, em um béquer com água, com a temperatura determinada para a extração. A fibra foi então exposta ao headspace do frasco pelo tempo estipulado. Na sequência a fibra foi retraída do vial e exposta ao injetor do cromatógrafo.
Todas as análises foram feitas em duplicatas em CG−EM. A programação da
rampa de aquecimento do forno foi: 35 °C (2 minutos) → 20 °C/minuto até 195 °C → 10
°C/minuto até 220 °C→ 20 °C/minuto até 280 °C. Os parâmetros instrumentais foram:
temperatura do injetor de 250 °C; modo de injeção split de 1:5; vazão volumétrica da fase móvel de 0,59 mL/min.; temperatura do detector de 250 °C.
5.7. Planejamento experimental.
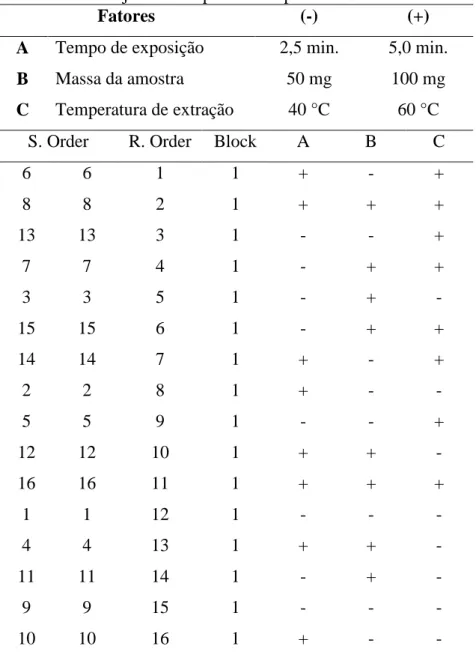
Após determinar o melhor revestimento de fibra para o procedimento de microextração em fase sólida, iniciou-se a etapa de otimização das variáveis que poderiam influenciar na resposta do experimento. Para isto, realizou-se para cada parte da planta um
planejamento fatorial de 23, ou seja, três fatores de dois níveis, totalizando 8 análises que foram realizadas em duplicatas, totalizando 16 análises.
Para o planejamento fatorial foram realizados experimentos em todas as
Tabela 1 − Planejamento experimental por MEFS da raiz
Fatores (-) (+)
A Tempo de exposição 2,5 min. 5,0 min.
B Massa da amostra 50 mg 100 mg
C Temperatura de extração 40 °C 60 °C
S. Order R. Order Block A B C
6 6 1 1 + - +
8 8 2 1 + + +
13 13 3 1 - - +
7 7 4 1 - + +
3 3 5 1 - + -
15 15 6 1 - + +
14 14 7 1 + - +
2 2 8 1 + - -
5 5 9 1 - - +
12 12 10 1 + + -
16 16 11 1 + + +
1 1 12 1 - - -
4 4 13 1 + + -
11 11 14 1 - + -
9 9 15 1 - - -
10 10 16 1 + - -
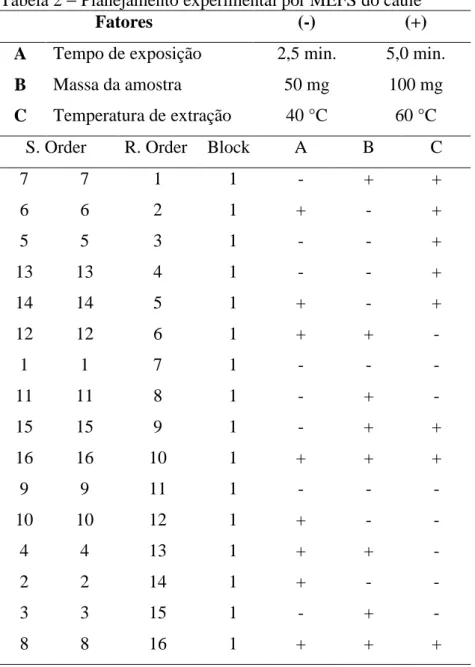
Tabela 2 − Planejamento experimental por MEFS do caule
Fatores (-) (+)
A Tempo de exposição 2,5 min. 5,0 min.
B Massa da amostra 50 mg 100 mg
C Temperatura de extração 40 °C 60 °C
S. Order R. Order Block A B C
7 7 1 1 - + +
6 6 2 1 + - +
5 5 3 1 - - +
13 13 4 1 - - +
14 14 5 1 + - +
12 12 6 1 + + -
1 1 7 1 - - -
11 11 8 1 - + -
15 15 9 1 - + +
16 16 10 1 + + +
9 9 11 1 - - -
10 10 12 1 + - -
4 4 13 1 + + -
2 2 14 1 + - -
3 3 15 1 - + -
8 8 16 1 + + +
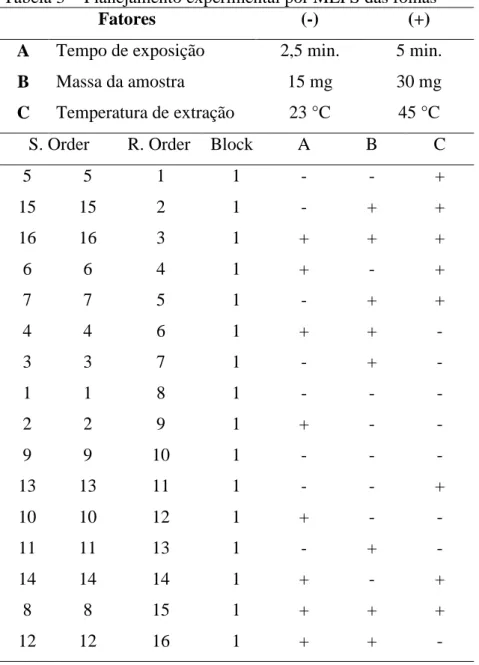
Tabela 3 − Planejamento experimental por MEFS das folhas
Fatores (-) (+)
A Tempo de exposição 2,5 min. 5 min.
B Massa da amostra 15 mg 30 mg
C Temperatura de extração 23 °C 45 °C
S. Order R. Order Block A B C
5 5 1 1 - - +
15 15 2 1 - + +
16 16 3 1 + + +
6 6 4 1 + - +
7 7 5 1 - + +
4 4 6 1 + + -
3 3 7 1 - + -
1 1 8 1 - - -
2 2 9 1 + - -
9 9 10 1 - - -
13 13 11 1 - - +
10 10 12 1 + - -
11 11 13 1 - + -
14 14 14 1 + - +
8 8 15 1 + + +
12 12 16 1 + + -
Fonte: Elaborado pelo autor.
5.8. Validação da metodologia de análise para o trans−β−cariofileno.
A validação de uma metodologia de análise foi desenvolvida para o composto
trans-β-cariofileo, constituinte majoritário nas folhas da planta. Para isso, alguns parâmetros
5.8.1. Eficiência da separação.
5.8.1.1. Determinação do fluxo ideal da fase móvel.
O fluxo ideal da fase móvel foi determinado através da verificação da eficiência em termos de número de pratos teóricos para várias vazões estudadas. Para isso, uma
metodologia de análise foi desenvolvida no CG−EM e empregou-se o dodecano como padrão interno do trans-β-cariofileno. Os parâmetros cromatográficos, para cada análise, foram
determinados através das equações adequadas e já estabelecidas na literatura básica de cromatografia. (76, 77, 101) Estes parâmetros foram: vazão linear; tempo morto; tempo de
retenção ajustado; largura do pico; número e altura de prato; fator de capacidade; seletividade e número de pratos requeridos.
Uma solução mista de 5 mL de dodecano e trans-β-cariofileno ambos na
concentração de 100 µg/mL foi preparada. A programação da rampa de aquecimento da coluna foi: 100 °C (3 minutos)→20 °C/minuto até 240 °C→ 40 °C/minuto até 300 °C (5 minuto). Os parâmetros instrumentais do equipamento foram: temperatura do injetor de 250 °C; modo de injeção split de 1:10; vazão volumétrica da fase móvel de 0,59 mL/minuto; temperatura da interface de 300 °C. As análises foram realizadas no modo SCAN, isto é, varredura completa de íons, onde foi utilizada uma faixa de 18 a 400 m/z (em intervalos de 0,5 s e com energia de ionização de 70 eV); temperatura do detector de 250 °C. Após os ajustes necessários injetou-se 1 µL da solução mista em 14 diferentes vazões volumétricas que contemplasse o intervalo de 0,20 a 1,60 mL/minuto.
5.8.1.2. Determinação do coeficiente de difusão do soluto na fase móvel e estacionária.
O coeficiente de difusão do soluto na fase móvel (Dm) e na fase estacionária (De)
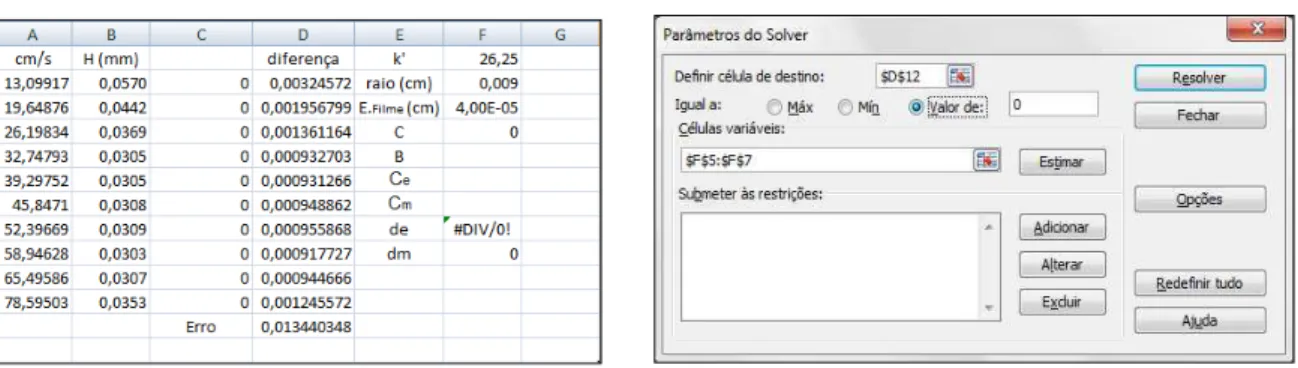
Figura 5 – (A) Planilha eletrônica do Excel e (B) Caixa de texto do Solver
Fonte: Elaborado pelo autor.
Para obtenção dos valores de B e C, da Equação 12, valores aleatórios para B, Ce, Cm foram atribuídos de forma a obter as curvas de Van Deemter e utilizou-se as vazões lineares calculadas no experimento para plotar um novo gráfico que melhor se enquadrasse com o perfil obtido na prática. Sendo assim, digitou-se respectivamente nas células E1:E9 os seguintes termos:
• K’ – Média do fator de capacidade obtido para cada vazão volumétrica;
• Raio (cm) – Raio do diâmetro interno da coluna em centímetro;
• E.filme (cm) – Espessura do filme da fase estacionária em centímetro;
• C – Referente ao tempo de equilíbrio;
• B – Referente a difusão longitudinal, Equação 13;
• Ce – Transferência de massa da fase estacionária, Equação 14;
• Cm – Transferência de massa da fase móvel, Equação 15;
• De – Difusão na fase estacionária, Equação 14;
• Dm – Difusão na fase móvel, Equação 15.
Conforme a Equação 12, na célula C2 digitou-se a fórmula = ($F$5/A2 + $F$4*A2) Conforme a Equação 12, na célula F4 digitou-se a fórmula, = (F6+F7);
Conforme a Equação 13, na célula F9 digitou-se a fórmula, = (F5/2);
Conforme a Equação 14, na célula F8 digitou-se a fórmula, = (2*F1*F3^2)/(3*(F1+1)^2*F6). Verificou-se a variação entre os valores das alturas de prato obtido no experimento e no valor ajustado (células C2:C11) através da Equação 16:
Desta forma, quanto menor o valor do erro, menor a diferença entre os valores obtidos na prática e no ajuste. De acordo com a Equação 16, o erro foi calculado digitando-se na célula D2 a fórmula = (B2-C2)^2 e arrastou-se em seguida até a célula D11, obtendo assim a diferença entre os números de prato. O erro foi calculado digitando-se na célula D12 a seguinte fórmula, = SOMA(D2:D11).
Digitou-se na célula F1 o valor do fator de capacidade médio, na célula F2 o raio da coluna em centímetros e na célula F3 o valor da espessura do filme em centímetros.
Selecionou-se os valores numéricos das colunas A, B e C e em seguida foi plotado um gráfico com esses valores.
Após plotar o gráfico, atribuiu-se valores aleatórios para B, Ce e Cm, onde esses
valores irão ser ajustados pela ferramenta Solver e com isso será possível obter automaticamente o valor da difusão do soluto na fase móvel como também na fase estacionária. Ao abrir a janela correspondente ao Solver, selecionou-se a célula D12 como célula de destino, atribuindo-a como um valor igual a zero e variando-se as células F5:F7. Com isso foi possível estimar os valores mais reais para B, Ce e Cm de acordo com os dados
experimentais.
5.8.2.Figuras de mérito
Seletividade
A seletividade corresponde a capacidade que o método tem de distinguir o analito de interesse dos demais compostos presentes na matriz de análise. (87) Desta forma, procurou-se obter a máxima seletividade ao trabalhar com o sistema de monitoramento de íons (SIM).(81) Desta forma, a maior quantidade de fragmentos dos compostos de interesse foram selecionados para serem utilizados no método (SIM).
Faixa linear
A faixa linear foi verificada após a injeção de várias soluções de concentrações definidas e verificou-se o momento em que o coeficiente de determinação da curva
apresentasse um valor inferior a 0,99. Observou-se o ponto máximo em que a concentração seguia uma linearidade. O estudo da faixa linear foi realizado em conjunto com a
Linearidade
A linearidade foi verificada utilizando-se o método do padrão externo e do padrão interno. O método do padrão interno foi utilizado após a conclusão da etapa descrita no item 5.8.1.1 além de verificar os requisitos necessários para esta metodologia. Soluções estoque do composto padrão e do padrão interno foram preparados na concentração de 8884,7 mg/L e 7500 mg/L respectivamente. Em seguida, preparou-se soluções de trabalho de 5 mL do composto padrão em diclorometano com concentrações 17,77; 39,09; 60,42; 79,96; 99,51; 119,05 e 140,38 µg/mL. Para cada solução de trabalho foi adicionado um volume fixo da solução estoque do padrão interno de modo que sua concentração na solução correspondesse a
150 µg/mL.
Limite de detecção e limite de quantificação
Os limites de detecção e de quantificação foram determinados pelo método visual da diluição sucessiva. Desta forma, utilizou-se a solução de menor concentração do trans-β
-cariofileno, preparada no tópico anterior, a partir desta solução, outras de concentração inferiores foram preparadas. 1 µL de cada solução foi injetada no CG-EM até obter uma razão sinal/ruído de 3 definido como limite de detecção e uma razão sinal/ruído de 10, definido como limite de quantificação. (87)
Precisão
Análise quantitativa do óleo do caule e das folhas
Em um balão volumétrico de 5 mL foram adicionados 10 µL do óleo extraído do caule, 100 µL da solução estoque de padrão interno, completando-se o volume com diclorometano. 1 µL dessa solução foi injetada no CG–EM nas mesmas condições instrumentais para a construção da curva de calibração. Para a quantificação do trans-β
-cariofileno, proveniente no óleo essencial das folhas, a um balão volumétrico de 10 mL foram adicionados 10 µL do óleo, 200 µL da solução estoque de padrão interno, completando-se o volume com diclorometano. 1 µL dessa solução foi injetada no CG-EM.
Exatidão
Os testes de recuperação foram realizados comparando-se os resultados obtidos na análise quantitativa das amostras do óleo do caule com os resultados obtidos da análise das amostras contendo quantidades conhecidas do padrão. Foram realizadas 9 (nove) determinações contemplando o intervalo linear do experimento, em nível de concentração baixo, médio e alto, com três réplicas cada. A Equação utilizada para avaliar o nível de recuperação se encontra abaixo, Equação 17.
6 RESULTADOS E DISCUSSÕES
6.1. Extração do óleo essencial por hidrodestilação.
De acordo com os dados das Tabelas 4, 5 e 6, o maior rendimento de óleo essencial foi obtido a partir das raízes da espécie em estudo. Onde a mesma apresentou um rendimento médio aproximado de 0,05%. Por outro lado, o caule e as folhas apresentaram um rendimento bem abaixo do óleo obtido a partir das raízes. Além disso, a densidade de cada amostra foi de: 0,97 g/mL; 0,95 g/mL e 0,94 g/mL, respectivamente para as raízes, caule e folhas.
Os resultados obtidos para as quantidades de amostras corroboram com os dados da literatura, isto é, a existência de uma variação no rendimento percentual de óleo essencial obtido a partir de diferentes partes da planta. (3) Apesar de não haver referências a respeito do óleo essencial extraído a partir das raízes e do caule, ainda sim, se tornou possível comparar o rendimento percentual de óleo essencial extraído a partir das folhas.
Desta forma, a literatura reporta que as folhas da espécie Plectranthus grandis, cultivadas na Universidade Federal de Pelotas e coletados entre 8 e 9 horas da manhã, sendo o óleo essencial obtido por hidrodestilação, apresentou um rendimento percentual médio de 0,09% de amostra. (21) O rendimento percentual médio de óleo essencial, obtido a partir das
folhas da espécie apresentaram valores inferiores ao reportado pela literatura. Entretanto, outros fatores devem ser considerados ao fazer este tipo de comparação, pois ambas as extrações foram realizadas em períodos e localizações geográficas diferentes. (3, 103)
Tabela 4 − Rendimento percentual de óleo essencial obtido a partir da raiz Quantidade de amostra Quantidade de óleo Rendimento %
Sistema 1 200 g 114 mg 0,057
Sistema 2 200 g 90 mg 0,045
Sistema 3 200 g 115 mg 0,057
Média 106 mg
Fonte: Elaborado pelo autor.
Tabela 5 − Rendimento percentual de óleo essencial obtido a partir do caule Quantidade de amostra Quantidade de óleo Rendimento %
Sistema 1 200 g 6 mg 0,003
Sistema 2 200 g 10 mg 0,005
Sistema 3 200 g 11 mg 0,006
Média 9 mg