“Via de sinalização mTOR no carcinoma urotelial da bexiga”
Universidade Fernando Pessoa
“Via de sinalização mTOR no carcinoma urotelial da bexiga”
Universidade Fernando Pessoa
“Via de sinalização mTOR no carcinoma urotelial da bexiga”
Monografia apresentada à Universidade Fernando Pessoa como parte dos requisitos para a obtenção do Grau de Mestre em Análises Laboratoriais Especializadas.
(Carla Sofia Domingues Pereira)
Mundialmente, o cancro da bexiga (CB) é o 7º tipo de cancro mais frequente em homens e o 17 º mais frequente em mulheres. É uma doença com etiologia multifatorial associada a vários agentes ambientais e genéticos, dos quais o tabagismo é o fator de risco mais importante. Os carcinomas uroteliais da bexiga (CUBs) são geralmente superficiais em 70% a 80% dos pacientes e invasores em 20% a 30%. Os CUBs não-invasores têm uma alta taxa de recorrência e progressão e os não-invasores e metastáticos representam a principal causa de morbidade e mortalidade entre os pacientes com CB. A via fosfatidilinositol-3cinase (PI3K) /AKT (Proteína cinase b) -alvo da rapamicina em mamíferos (m-TOR) é uma importante via envolvida no crescimento celular, tumorogénese, invasão celular e resposta a drogas. Esta via é frequentemente ativada em muitas neoplasias e o descontrolo da sinalização PI3K-AKT-mTOR no CB pode contribuir para o crescimento do tumor, angiogénese e metastização.
Neste trabalho, foram estudados 96 casos de tumores diagnosticados como CUBs de vários graus e estádios e foi avaliada a imunoexpressão do phospho-mTOR (Ser2448) e do phospho-S6 (Ser235/236).
Em relação à expressão do p-mTOR verificou-se que mais de 50% dos casos de CUB não apresentavam ou apresentavam uma baixa expressão desta proteína sendo que não foi encontrada associação deste com estádio ou grau de diferenciação tumoral. Em relação à proteína p-S6 a sua expressão nos CUB foi igualmente nula ou baixa, no entanto encontrou-se uma associação estatisticamente significativa com o estádio e grau de diferenciação, em duas formas de avaliação qualitativa.
Estes dois marcadores imunohistoquímicos, quando analisados em conjunto apresentaram uma correlação positiva moderada nos CUB, no entanto, estudos futuros são necessários para avaliar a sua validade como marcadores biológicos e, eventualmente, alvos terapêuticos.
Worldwide, bladder cancer (BC) is the 7th most frequent type of cancer in men and the 17th most common in women. It is a disease with multifactorial etiology associated with multiple genetic and environmental agents, of which smoking is the most important risk factor. The urothelial carcinomas of the bladder (CUBs) are generally superficial in 70% to 80% of patients and invasive in 20% to 30%. The non-invasive CUBs have a high rate of recurrence and progression, and the metastatic and invaders ones are the leading cause of morbidity and mortality among patients with CB.
The 3 cinase via phosphatidylinositol PI3K/AKT (cinase protein b) target of rapamycin in mammals (m-TOR) is an important pathway involved in cell growth, tumorigenesis, cell invasion and drug response. This pathway is frequently activated in many tumors and uncontrollable signaling PI3K/AKT/mTOR pathway in BC may contribute to tumor growth, angiogenesis and metastasis.
In this study, 96 cases of tumors diagnosed as CUBs of various grades and stages were studied, and it was evaluated the immunoreactivity of phospho-mTOR (Ser2448) and phospho-S6 (Ser235/236).
Concerning the p-mTOR expression, it was observed that more than 50% of CUB didn`t express or had a low expression of this protein, and it wasn`t found any association between this and the state or grade of the tumor. In what concerns the p-S6 protein, it was equally low or absent its expression in the CUB, although it was found a statistical association with the state and grade of the tumor, in two forms of qualitative evaluation. When analyzed, together, these two markers presented a positive moderated correlation in the CUB, however future studies are necessary to access its validity as biological markers and, eventually, therapeutic targets.
A realização desta dissertação foi como subir ao topo de uma montanha, muitas vezes pensei que não seria capaz, várias vezes pensei em desistir mas acreditei ser possível e
consegui….
Esta jornada não a fiz sozinha, e gostaria de deixar aqui um simbólico mas muito sincero apreço a todos aqueles que me ajudaram, direta ou indiretamente.
Sem ordem específica, agradeço:
À minha orientadora Doutora Céu Costa, pelo grande apoio, competência e disponibilidade.
À Professora Doutora Sandra Clara, pela sua opinião construtiva e disponibilidade.
À Doutora Amélia França, por toda a disponibilidade, simpatia e apoio informático. À Sandrinha, por acreditar em mim, pelo apoio incondicional, carinho e amizade.
Ao Daniel por acreditar em mim.
Aos meus pais, irmãos e sobrinhos, pela motivação e força anímica que sempre me transmitiram.
Às minhas irmãs pelo apoio e disponibilidade para com os meus filhos, sem elas não teria conseguido.
Aos meus filhos, simplesmente por existirem.
I – Introdução ... 20
1.1 - Epidemiologia ... 21
1.2 - Fatores de Risco ... 27
1.2.1 -Tabagismo ... 27
1.2.2 - Exposição ocupacional... 27
1.2.3 –Ambientais ... 28
1.2.4 -Fármacos ... 28
1.2.5 -Infeções ... 29
1.2.6 -Genéticos... 29
1.2.7 -Outros ... 29
1.3 -Sintomas/ Diagnóstico... 30
1.3.1 - Sintomas ... 30
1.3.2 - Diagnóstico ... 30
1.4 - Classificação histológica dos tumores da bexiga ... 33
1.5 – Tratamentos ... 38
1.6 - mTOR ... 40
1.6.1 - Via de sinalização mTOR ... 41
1.6.2 - Sinalização a montante do mTOR ... 43
1.6.2.1 - PI3K/AKT ... 43
1.6.2.4 - TSC ... 45
1.6.3 - Sinalização a jusante do mTOR ... 45
1.6.4 - Via mTOR no Cancro ... 46
1.6.5 - Via de sinalização mTOR no CUB ... 48
1.6.6 - Inibidores do mTOR ... 49
II- Objetivos ... 53
III- Material e Métodos ... 54
3.1 - População ... 54
3.2 - Estudo imunohistoquímico ... 54
3.3 - Avaliação e quantificação da imunorreatividade ... 55
3.4 - Análise estatística ... 56
IV – Resultados ... 57
4.1 Características clinico-patológicas ... 57
4.2 Expressão da proteína p-mTOR ... 58
4.2.1 Associação da proteína p-mTOR com o estádio e grau ... 60
4.3 Expressão da proteína p-S6 ... 63
4.3.1 Associação da proteína p-S6 com o estádio e grau de diferenciação ... 65
4.4 Correlação entre o p-mTOR e p-S6 ... 68
V- Discussão e Conclusão ... 69
Fig. 1 – Epitélio da bexiga (adaptada (Puzio-Kuter, et alii. 2009)) ... 33 Fig. 2 – Ilustração da extensão da invasão tumoral (Adaptada - Repositorio.hff.min-saude.pt - Tumor da Bexiga. Visão do urologista. Bruno Graça). ... 35 Fig. 3 – Composição dos complexos mTOR (adaptada (Bhaskar e Hay, 2007)). ... 41
Tabela 1 – Estimativa e previsão da incidência de Cancro da Bexiga na União Europeia
(UE-27) (Adaptada Globocan 2008) ... 24
Tabela 2 – Estimativa e previsão de mortes por Cancro da Bexiga na União Europeia (UE-27) (Adaptada Globocan 2008) ... 24
Tabela 3 – Estimativa e previsão da incidência de Cancro da Bexiga em Portugal (Adaptada Globocan 2008) ... 26
Tabela 4 – Estimativa e previsão de mortes por Cancro da Bexiga em Portugal (UE-27) (Adaptada Globocan 2008) ... 26
Tabela 5 – Classificação do carcinoma vesical TNM de 2009 (Adaptada de Babjuk et alii. 2014, Witjes et alii. 2014). ... 36
Tabela 6 – Classificação da OMS de 1973 e 2004 (Adaptada de Babjuk et alii. 2014, Witjes et alii. 2014). ... 37
Tabela 7 – Recomendações de tratamento em tumores TaT1 de acordo com a estratificação de risco (Adaptada de Babjuk et alii. 2013). ... 39
Tabela 8 – Os proto-oncogenes e genes supressores de tumor ligados ao mTOR (Adaptada (Pópulo, Lopes e soares, 2012)) ... 47
Tabela 9 – Grupos formados para avaliação da positividade das células ... 55
Tabela 10 – Grupos formados para avaliação da intensidade da marcação ... 56
Tabela 11 - Parâmetros clinico-patológicos da amostra estudada (n=96). ... 57
Tabela 12 - Grau de diferenciação e estádios dos CUBs estudados. ... 58
Tabela 13 – Frequência da percentagem de células marcadas da proteína p-mTOR. ... 59
Tabela 14 – Frequência da intensidade de marcação da proteína p-mTOR. ... 59
estádios. ... 61
Tabela 17 - Hscore do marcador p-mTOR em função do estádio ... 61
Tabela 18 - Percentagem de células positivas com o marcador p-mTOR em função do grau de diferenciação. ... 62
Tabela 19 - Intensidade da marcação p-mTOR em função do grau de diferenciação. .. 62
Tabela 20 - Hscore da marcação p-mTOR em função do grau de diferenciação. ... 63
Tabela 21 - Frequência da percentagem de células marcadas da proteína p-S6. ... 63
Tabela 22 - Frequência da intensidade de marcação da proteína p-S6. ... 64
Tabela 23 - Percentagem de célula marcadas com p-S6 nos diferentes estádios. ... 65
Tabela 24 - Intensidade da marcação imunohistoquímica do p-S6 nos diferentes estádios. ... 65
Tabela 25 - Hscore do marcador p-S6 em função do estádio. ... 66
Tabela 26 - Percentagem de células positivas com o marcador p-S6 em função do grau de diferenciação. ... 67
Tabela 27 - Intensidade da marcação p-S6 em função do grau de diferenciação. ... 67
Tabela 28 - Hscore da marcação p-S6 em função do grau de diferenciação. ... 68
Anexo I - Protocolo de Imunohistoquímica ... 81
Anexo II - Imunorreatividade do p-mTOR ... 82
AKT Proteína cinase b
AMPK Proteína cinase ativada por 5' adenosina monofosfato
BTA Antigénio tumoral da bexiga
BCG Bacillus Calmette-Guerin
CB Cancro da bexiga
Cis Carcinoma in situ
CUB Carcinoma urotelial da bexiga
ADN Ácido desoxirribonucleico
4EBP1 Proteína de ligação 1
EGF Fator de crescimento epitelial humano
EIF4E Inibidor do fator de iniciação eucariótica 4E
FGFR Recetor do fator de crescimento fibroblástico
FDP Ensaio do produto de degradação da fibrina
GTPase Guanina trifosfatase
HA- Teste ácido hialurónico
HAase Hialuronidase na urina
IGF Fator de crescimento semelhante à insulina
IH Imunohistoquímica
MAPK Cascata das proteínas cinase ativadas por mitogéno
mSin1 Proteína cinase ativada por mitogéneos associada à proteína 1
mTOR Proteína cinase serina/treonina alvo da rapamicina em mamíferos
NMP Teste de proteína nuclear de matriz
OMS Organização mundial de saúde
PDD Diagnóstico fotodinâmico
PDK1 Proteína 3 – fosfoinositida dependente cinase
PI3K Fosfatidilinositol 3-cinase
PTEN Gene supressor tumoral homólogo da fosfatase e tensina
Raptor Proteína reguladora associada ao mTOR
Ras Proteína de ligação GTP
Rictor Não sensível a rapamicina
Rheb Proteína homóloga de Ras enriquecida no cérebro
RM Ressonância magnética
RNAm Ácido ribonucleico mensageiro
RORENO Registo oncológico regional do Norte
RTUB Ressecção Transuretal da Bexiga
SAPK Proteína cinase induzida por stress
S6K1 Cinase serina/treonina
TC Tomografia computadorizada
TMA Tissue microarrys
USA Estado Unidos da América
20
I
–
Introdução
O cancro da bexiga (CB) é o quinto tipo de cancro mais frequente no mundo, com uma estimativa de 357.000 novos casos e 145.000 mortes em 2010 (Nawroth et alii, 2011). Esta neoplasia maligna é uma das mais comuns na Europa, nos Estados Unidos e nos países do Norte de África (Vishnu, Mathew e Tan, 2011). É o quarto cancro mais frequentemente diagnosticado em homens, com uma taxa de incidência de masculino para feminino de 3:1 (Chen et alii, 2009), surgindo mais comummente na sétima década de vida (Letasiová et alii,2012). Ocorre em várias formas, sendo o carcinoma urotelial da bexiga (CUB), a mais frequente representando mais de 90% de todos os CB (Hansel
et alii, 2010).
A principal causa de CB é o tabagismo, responsável por cerca de 50% dos casos em países desenvolvidos. Existe um vínculo forte entre a quantidade e a duração do hábito de fumar cigarro. O maior risco de CB tem sido observado em trabalhadores expostos a algumas aminas aromáticas. Beber água da torneira com subprodutos de cloro ou arsénico, a exposição a certas drogas, como a ciclofosfamida, utilizada em quimioterapia, o elevado consumo de analgésicos contendo fenacetina, foi demonstrado que provoca CB em seres humanos (Jankovic e Radosavljevic, 2007; Wu et alii., 2008). O risco genético está a crescer de forma constante e é duas vezes maior em parentes de primeiro grau de pacientes com CUB (Burger et alii, 2013).
A histologia do CUB é variável; a maioria dos tumores T1 são papilares, de baixo ou alto grau e os T2-T4 são carcinomas não papilares de alto grau (Eble et alii, 2004). A natureza recidivante do CUB representa um enorme fardo sobre os sistemas de cuidados de saúde. Aproximadamente 75% dos CUBs recém-diagnosticados são não-invasores e têm uma alta taxa de recorrência e progressão, apesar da terapêutica local. Os restantes 25% de CUBs apresentam invasão muscular e precisam de cirurgia radical ou radioterapia, mas ainda têm resultados pobres, mesmo com terapia sistémica (Burger et
21
taxa de sobrevivência de 10 anos em 40% a 50% dos casos (Schultz et alii, 2010). Como se pode constatar, o CB continua a ser um grave problema de saúde pública. Aproximadamente 30 a 50% dos pacientes com CUB invasor desenvolve a doença metastática e morre no prazo de 2 anos após diagnóstico. Além disso, praticamente todos os pacientes com diagnóstico de metástases à distância vão sucumbir à doença. Atualmente, a modalidade padrão de tratamento para CUB invasor é cistectomia radical e a quimioterapia sistémica é geralmente reservada para pacientes com doença metastática, no entanto estes regimes de tratamento fornecem apenas um benefício limitado e são raros os casos de remissão completa. À luz destes resultados clínicos, a identificação de novos alvos terapêuticos é necessária para definir as potenciais vias de tratamento adicional para esses pacientes (Hansel et alii, 2010).
A via PI3K/AKT /mTOR é uma importante via de sinalização envolvida no crescimento celular, tumorogénese, invasão celular e resposta à droga. Esta via é frequentemente ativada em muitas neoplasias e o descontrolo da sinalização PI3K/AKT/mTOR reflete-se num mau prognóstico no cancro do pulmão, colo do útero, ovário e esófago. No CB, foi relatado que esta via pode regular a invasão do tumor, portanto há hipótese de que variações genéticas nesta via podem afetar a sobrevivência dos pacientes. Não há muitos estudos que avaliem a associação entre variações de linha germinativa na via PI3K/AKT/mTOR e os resultados clínicos de CB (Chen et alii, 2010).
1.1 - Epidemiologia
Segundo Nóbrega et alli (2013), o cancro é um problema de saúde pública mundial, que tem vindo a aumentar, em grande parte, devido ao envelhecimento da população, em paralelo com a crescente exposição a alguns fatores de risco, nomeadamente o tabaco. Cerca de 12,7 milhões de casos de cancro e 7,6 milhões de mortes a ele associadas ocorreram em 2008; destes, 56% dos casos e 64% das mortes ocorreram nos países em desenvolvimento económico (Jemal et alii, 2011).
22
prevalência cinco vezes maior entre os homens do que entre as mulheres (Goodison, Rosser e Urquidi, 2013), com taxas mais elevadas em caucasianos do que em não-caucasianos (Cancer Research UK) e a idade média de diagnóstico é 65 anos (Goodison, Rosser, e Urquidi, 2013). Há uma variação da taxa de incidência internacional do CB de 14 vezes. As taxas mais elevadas encontram-se nos países da Europa, América do Norte e Norte de África (Jemal et alii, 2011; Vishnu, Mathew e Tan, 2011). Homens egípcios têm a maior taxa de mortalidade (16,3 por 100.000), que é duas vezes maior do que a taxa mais elevada na Europa (8,3 em Espanha e 8,0 na Polónia) e quatro vezes mais elevada do que nos Estados Unidos da América (USA) - 3,7 (Jemal et alii, 2011; Joshi e Preslan, 2011). As taxas mais baixas são encontradas na Melanésia e África central (Vishnu, Mathew e Tan, 2011).
Mundialmente, o CB é o 7º tipo de cancro mais frequente em homens e o 17 º mais frequente em mulheres (Kakehi et alii, 2010; Burger et alii, 2013). Os carcinomas uroteliais da bexiga (CUBs) são geralmente superficiais em 70% a 80% dos pacientes e invasores em 20% a 30%. Os tumores invasores e metastáticos representam a principal causa de morbidade e mortalidade entre os pacientes com CB (Nóbrega et alii, 2013). Nos USA e na Europa Ocidental, um em cada vinte e cinco homens e uma em cada oitenta mulheres irá desenvolver CB ao longo da vida (Rafnar et alii, 2011). Dados a partir de 2009 indicam que mais de meio milhão de pessoas nos USA vivem com o diagnóstico de CB (Joshi e Preslan, 2011).
23
ocupacionais conhecidas por causar CB (Jemal et alii,2011), mas ainda está a aumentar em alguns países da Europa Oriental (Pelucchi et alii, 2006). Entre 1999-2001 e 2008-2010, as taxas de incidência europeia diminuíram 23% em homens e 21% em mulheres (Cancer Research UK).
24
Tabela 1 – Estimativa e previsão da incidência de Cancro da Bexiga na União Europeia (UE-27) (Adaptada Globocan 2008).
Ano Número estimado de novos cancros
(todas as idades) Masculino Feminino
Ambos os sexos
2008 83876 23543 107419
Idade <65 23267 5463 28730
Idade> = 65 60609 18080 78689
2015 94649 25765 120414
Idade <65 25192 5818 31010
Idade> = 65 69457 19947 89404
As alterações demográficas 10773 2222 12995
Idade <65 1925 355 2280
Idade> = 65 8848 1867 10715
Previsões demográficas extraídas da Nações Unidas, World Population Prospects, revisão de 2008 .
Os números são calculados usando taxas de idade específicas e populações correspondentes por 10 grupos de idade.
Tabela 2 – Estimativa e previsão de mortes por Cancro da Bexiga na União Europeia (UE-27) (Adaptada Globocan 2008).
Ano Número estimado de mortes por
cancro (todas as idades) Masculino Feminino
Ambos os sexos
2008 28665 9976 38641
Idade <65 4523 1118 5641
Idade> = 65 24142 8858 33000
2015 32779 11018 43797
Idade <65 4924 1201 6125
Idade> = 65 27855 9817 37672
As alterações demográficas 4114 1042 5156
Idade <65 401 83 484
Idade> = 65 3713 959 4672
Previsões demográficas extraídas da Nações Unidas, World Population Prospects, revisão de 2008 .
25
No Reino Unido, em 2010 foram diagnosticados 10.324 novos casos de CB, 7.416 em homens e 2.908 em mulheres, refletindo uma relação masculino: feminino de quase 26:10. O CB é o sétimo tipo de cancro mais comum, o que representa 3% de todos os novos casos. Nos homens, é a quarta neoplasia mais frequente e nas mulheres a 11 ª. (Cancer Research UK).
Em Portugal, o Registo oncológico é realizado por três Registos Oncológicos Regionais, Norte, Centro e Sul, criados pela portaria governamental nº 35/88 de 16 de Janeiro e são responsáveis pelo registo de novos casos de cancro diagnosticados em cada ano, de acordo com a residência de cada doente.
Segundo o Registo Oncológico Nacional (Norte, Centro e Sul com exceção do Registo Oncológico da Região Autónoma dos Açores que não dispunha ainda de toda a informação sobre a Região à datada publicação), em 2005, foram diagnosticados em Portugal 38.519 novos casos de cancro. A taxa de incidência total foi de 284,64/100000, sendo no sexo masculino de 342,68/100000 e no sexo feminino de 246,14/100000 Em 2007, foram detetados 170 novos casos de tumores da bexiga, sendo que 56,5% eram tumores uroteliais superficiais, 40,6% uroteliais invasores e apenas 2,9% eram tumores uroteliais (Registo Oncológico, 2007).
Segundo o RORENO do ano de 2007 para 2008, verificou-se um aumento de 6,9% no número de casos registados. O CB ocupa o quinto lugar dos tumores mais frequentes nos homens (572 novos casos) e o décimo nas mulheres (151 novos casos), dos quais 273 são Carcinomas Uroteliais Invasivos, 365 Carcinomas Uroteliais Papilares e 85 Outros Tumores.
26
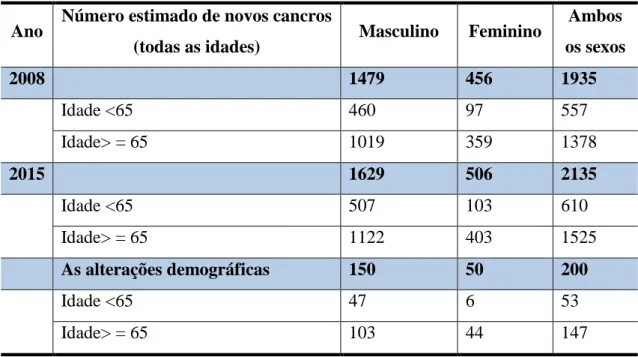
Tabela 3 – Estimativa e previsão da incidência de Cancro da Bexiga em Portugal (Adaptada Globocan 2008).
Ano Número estimado de novos cancros
(todas as idades) Masculino Feminino
Ambos os sexos
2008 1479 456 1935
Idade <65 460 97 557
Idade> = 65 1019 359 1378
2015 1629 506 2135
Idade <65 507 103 610
Idade> = 65 1122 403 1525
As alterações demográficas 150 50 200
Idade <65 47 6 53
Idade> = 65 103 44 147
Previsões demográficas extraídas da Nações Unidas, World Population Prospects, revisão de 2008 .
Os números são calculados usando taxas de idade específicas e populações correspondentes por 10 grupos de idade.
Tabela 4 – Estimativa e previsão de mortes por Cancro da Bexiga em Portugal (Adaptada Globocan 2008).
Ano Número estimado de mortes por
cancro (todas as idades) Masculino Feminino
Ambos os
sexos
2008 530 191 721
Idade <65 73 14 87
Idade> = 65 457 177 634
2015 588 215 803
Idade <65 80 14 94
Idade> = 65 508 201 709
As alterações demográficas 58 24 82
Idade <65 7 - 7
Idade> = 65 51 24 75
Previsões demográficas extraídas da Nações Unidas, World Population Prospects, revisão de 2008 .
27
1.2 - Fatores de Risco
O CB é uma doença com etiologia multifatorial associada a vários fatores ambientais e genéticos, dos quais o tabagismo é o fator de risco mais importante, responsável por aproximadamente metade dos novos casos em homens e um terço dos novos casos em mulheres. Outros fatores de risco estabelecidos incluem a exposição ocupacional a aminas aromáticas e outros produtos químicos, água potável contaminada com altos níveis de carcinogéneos (por exemplo, o arsénio e subprodutos clorados) (Chen et alii.,2009), idade avançada, sexo masculino, caucasianos, infeções da bexiga provocadas por certos parasitas e história familiar ou pessoal de CB (Chou e Dana, 2010). O uso de drogas e consumo de álcool, café e chá também são fatores que podem ser associados com o risco de CB (Chu, Wang e Zhang, 2013).
1.2.1 - Tabagismo
O tabagismo é reconhecido como a principal causa de tumores malignos da bexiga e é responsável por cerca de 50% dos casos em países desenvolvidos (Jankovic e Radosavljevic, 2007; Wu et alii, 2008 e Kakehi et alii, 2010). Os fumadores têm um risco 2 a 5 vezes maior de CB que os não-fumadores e este é diretamente proporcional à quantidade e duração do vício (Ferris et alii., 2013). No entanto, a relação entre fumo passivo e risco de CB permanece discutível (Chu, Wang e Zhang, 2013).
As nitrosaminas, 2 - naftilamina, e 4 - aminobifenilo são conhecidas por estarem presentes no fumo do cigarro e o aumento de metabolitos urinários de triptofano tem sido também detetado nos fumadores de cigarros. O término do hábito de fumar reduz significativamente o risco de CB, no entanto, mesmo depois de 20-25 anos, nunca atinge o nível de risco base de não-fumadores. Outras formas de uso do tabaco são associadas com um risco ligeiramente maior de CB do que a população em geral (Tanaka et alii., 2011).
1.2.2 - Exposição ocupacional
28
benzidina) e 4,4'-metilenobis (2-cloroanilina). Os compostos de 2-naftilamina, 4-aminobifenilo e benzidina podem ser encontrados nos produtos das indústrias de borracha, poluentes emitidos a partir de produtos químicos, corantes, tintas, tintas para o cabelo, fungicidas, fumo do cigarro, plásticos, metal, fumo dos escapes dos carros e em instalações industriais. A 4,4'-metilenobis (2-cloroanilina) (MBOCA) é um produto químico sintético muito utilizado na indústria, principalmente para a produção de peças de poliuretano moldáveis. A benzidina utilizada na produção de corantes e na indústria da borracha, foi identificada como o carcinogénico mais importante das aminas aromáticas (Letasiová et alii, 2012).
1.2.3 – Ambientais
A bexiga humana é um dos principais órgãos alvo para a carcinogénese induzida por arsénico, tendo sido encontrados na urina metabolitos deste suspeito de estarem diretamente envolvidos na carcinogénese (Naranmandura et alii, 2011).
O arsénico é um contaminante ambiental natural para os seres humanos que pode ser encontrado diariamente em alimentos, água, ar e solo (Hughes et alii, 2011). Estudos anteriores demonstraram que a exposição crónica ao arsénico encontrado na água potável podia ser associada com o desenvolvimento de CB (Kakehi et alii, 2010). A Organização Mundial da Saúde (OMS) estima que 200 milhões de pessoas em todo o mundo podem estar cronicamente expostas ao arsénico na água potável em concentrações acima do padrão de segurança de 10 mg / L (OMS 2008) (Naujokas et alii, 2013).
1.2.4 - Fármacos
29
1.2.5 - Infeções
Nos países em desenvolvimento, especialmente no Médio Oriente e partes da África, as infeções com os membros do género Schistosoma são responsáveis por uma alta incidência de CB, 75 % dos quais são carcinomas de células escamosas (Johanson e Cohen, 1997). Também as pedras do trato urinário podem causar irritação crónica do epitélio da bexiga e aumentar o risco de carcinoma de células escamosas (Pelucchi et alii, 2006). As infeções recorrentes em 2 a 10% dos paraplégicos com cateteres de longa permanência também levam ao desenvolvimento de CB, 80% dos quais são carcinomas de células escamosas (Tanaka et alii, 2011).
1.2.6 - Genéticos
Familiares de primeiro grau de pacientes com CB têm um aumento do risco relativo de 50-100% de desenvolver a doença, que pode ser ainda maior se este for diagnosticado em idade precoce (Pelucchi et alii, 2006). O aumento do risco pode ser devido à suscetibilidade de genes de alta penetrância, num pequeno subconjunto de famílias, mas a maior parte deste risco é provavelmente causado por ADN de baixa penetrância, variantes comuns que influenciam o risco de cancro através de um ou mais percursos diferentes (Wu et alii, 2008).
1.2.7 - Outros
O consumo de álcool, de café ou de chá é também apontado como fator de risco no desenvolvimento de CB (Chu, Wang e Zhang, 2013).
30
Apesar da existência de diversos fatores identificáveis que aumentam ou diminuem o risco de CB, muitos pacientes não têm agentes cancerígenos conhecidos ou fatores de risco associados (Cohen, Shirai e Steineck, 2000).
1.3 - Sintomas/ Diagnóstico
1.3.1 - Sintomas
O tipo e a severidade dos sinais clínicos e sintomas do CUB dependem da extensão e localização do tumor, no entanto, a maioria dos pacientes com tumores uroteliais apresenta pelo menos hematúria microscópica. A hematúria indolor, característica do CB, ocorre em 85 % dos pacientes, podendo ocorrer coagulação e provocando micção dolorosa. No caso de grandes tumores, a capacidade da bexiga pode ser reduzida, resultando em micção frequente e pouco abundante. Tumores localizados no colo da bexiga ou cobrindo uma grande área da mesma podem conduzir a sintomas irritativos, isto é, disúria, urgência e frequência em urinar. Sintomas semelhantes podem estar presentes no carcinoma in situ (CIS) (Eble et alii, 2004).
Os tumores que infiltram o orifício ureteral podem levar a hidronefrose, que é considerada um mau prognóstico. Raramente, os pacientes com doença extensa apresentam massa pélvica palpável ou edema de membros inferiores. Em caso de doença avançada, a perda de peso, dor abdominal ou óssea podem estar presentes devido a metástases (Eble et alii, 2004).
1.3.2 - Diagnóstico
31
desenvolvimento de testes invasivos para o rastreio CB. Atualmente, os testes não-invasivos que estão em fase de avaliação ou em utilização na prática clínica como testes de triagem para CB são: citologia urinária, antigénio tumoral da bexiga (BTA), teste de proteína nuclear de matriz (NMP), ensaio do produto de degradação da fibrina (FDP) e teste ácido hialurónico (HA-) hialuronidase (HAase) na urina (Tanaka et alii, 2011). Até ao momento, nenhum marcador ou combinação de marcadores consegue superar a eficiência da cistoscopia ou servir como uma ferramenta de prognóstico confiável (Evelyne, Rosette, Reijke, 2011). A avaliação da doença ainda tem por base parâmetros clínico-patológicos, tais como o tamanho do tumor e aspeto, multifocalidade, presença/ausência de lesões uroteliais planas, tumor residual após ressecção transuretral, e taxa de recorrência. Foram feitas tentativas para substituir cistoscopia por novas modalidades de imagem como a cistoscopia virtual. Esta técnica é baseada na reconstrução digital 3D das imagens da tomografia computadorizada (TC) ou ressonância magnética (RM) com contraste ou bexiga cheia de ar, que poderá, possivelmente, servir como uma técnica não invasiva para avaliar a mucosa da bexiga (Evelyne, Rosette e Reijke, 2011). A cistoscopia virtual oferece muitas vantagens: permite a localização exata da lesão (devido ao seu campo de visão de 360°), medição do tamanho do tumor e representação de marcos anatómicos fora da bexiga. Pode ser realizada quando a cistoscópica convencional não é adequada, em pacientes com estenose uretral grave ou na presença de hemorragia ativa (Kocakoc et alii, 2008). Estudos demonstram que é possível realizar a cistoscopia virtual, mas, atualmente, a sensibilidade não é suficiente para substituir a cistoscopia convencional, devido à incapacidade de deteção de lesões planas ou alterações na cor da mucosa direcionando para uma determinada intervenção terapêutica (Evelyne, Rosette e Reijke, 2011).
32
da Associação de Urologia Europeia (EAU) para a deteção de CIS, esta não foi ainda introduzida na rotina urológica (Jichlinski e Jacqmin, 2008).
O exame citopatológico de urina ou outras amostras citológicas do trato urinário é um procedimento não-invasivo de rotina no diagnóstico de CB, especialmente em pacientes com hematúria indolor. É também usado no controlo dos pacientes previamente tratados de CB, com o objetivo de detetar precocemente recidivas ou tumores primários. Este é um método altamente específico no diagnóstico de tumores invasivos, CIS e carcinoma papilar de alto grau, no entanto, é pouco fiável para a deteção de tumores papilares de baixo grau (Flezar, 2010).
A ressecção transuretral da bexiga (RTUB) é o passo inicial e crítico na gestão de tumores da bexiga. O objetivo do processo é a remoção completa de tumores papilares superficiais não invasores, para estabelecer o diagnóstico histológico e determinar o grau e estádio do tumor. Embora a RTUB seja um procedimento realizado com frequência, os seus resultados são limitados pela alta taxa de recorrência e pelo risco de subestadiamento do tumor (Babjuk, 2009). A avaliação inicial deve incluir uma ressecção transuretral completa com músculo detrusor subjacente. O estádio e o grau histopatológico serão atribuídos se a lâmina própria ou o músculo detrusor estiverem envolvidos (Leung, Griffiths e Neal, 1996).
Uma segunda resseção é recomendada em pacientes com Ta e T1 de alto grau, numa tentativa de evitar o subestadiamento e a progressão para doença metastática (Jacobs, Lee e Montie, 2010).
A TC da pelve e abdómen é realizada em pacientes com tumores invasivos, para definir grau de invasão, linfomegalia local e avaliar a possível ressecabilidade (Leung, Griffiths e Neal, 1996).
33
data, marcadores moleculares urinários não melhoraram a combinação de cistoscopia e citologia (Babjuk et alii. 2013).
1.4 - Classificação histológica dos tumores da bexiga
A bexiga é um órgão oco, cuja parede compreende (do exterior para o interior) serosa, muscularis, submucosa, muscularis mucosa e lâmina própria. A camada de células epiteliais que cobre a lâmina própria e reveste o seu interior é o urotélio - epitélio de transição (Lewis, 2000), que se estende desde a pelve renal até à uretra (Birder, 2005). O urotélio é composto por diferentes tipos de células: células em “guarda-chuva” que revestem o lúmen da bexiga, células intermediárias e células basais, que são adjacentes à lâmina própria (Puzio-Kuter et alii, 2009). (Figura 1)
Fig. 1 – Epitélio da bexiga (adaptada (Puzio-Kuter, et alii. 2009)).
Cerca de 90 % dos tumores da bexiga diagnosticados derivam do epitélio urotelial, ou seja CUBs (Puzio-Kuter et alii, 2009). O carcinoma de células escamosas constitui cerca de 6% a 8 % dos tumores da bexiga e está associado a infeções persistentes ou a irritação crónica do epitélio. Os adenocarcinomas representam cerca de 2% das neoplasias da bexiga (Vishnu, Mathew e Tan, 2011).
Camada Muscular Guarda-chuva
Intermediarias Basais
Lúmen da Bexiga
34
Cerca de 70-80% dos CUBs são carcinomas papilares de baixo grau, superficiais, ou seja, não invasores da camada muscular, enquanto os restantes (20-30%) são carcinomas invasores. O carcinoma não invasor está associado a uma maior sobrevivência em relação a outras doenças malignas, mas 30-50 % dos pacientes acabará por ter recorrência após a ressecção transuretral (RTU) do tumor primário e 10-20% irão progredir para tumor invasor da bexiga (Jin et alii, 2014). As três categorias gerais de CUB - superficial, invasor e metastático – diferem na sua biologia, fenótipo, prognóstico e terapêutica. O CB superficial inclui o Ta, o CIS e o T1. O CUB invasor é um tumor epitelial agressivo com uma alta taxa de disseminação sistémica precoce e uma baixa taxa de sobrevivência a longo prazo. Cerca de 50% desses pacientes desenvolve metástases e, por último, sucumbem à doença. Habitualmente este metastiza para os nódulos linfáticos regionais (78 %), fígado (38 %), pulmão (36 %), osso (27 %), glândula supra-renal (21 %) e intestino (13%) (Vishnu, Mathew e Tan, 2011). (Figura 2)
35
Fig. 2 – Ilustração da extensão da invasão tumoral (Adaptada - Repositorio.hff.min-saude.pt - Tumor da Bexiga. Visão do urologista. Bruno Graça).
Existem diferentes classificações de tumores da bexiga, com base nos achados clínicos ou nos padrões histológicos do tumor ou em ambos (Deeley e Desmet, 1963). Desde 1967 que se utiliza o sistema TNM (Tumor, Nódulo, Metástase) da UICC (União Internacional Contra o Cancro) para a classificação dos tumores de bexiga (Tabela 5) (Vogler, Rothkopf e Mebel, 1975). A classificação histológica de tumores da bexiga, da OMS, foi formulada para promover uma melhor comunicação internacional e comparações estatísticas mais confiáveis. O tipo histológico, grau de anaplasia e crescimento padrão são as bases da classificação (Sobin, 1978). (Tabela 6)
Peritoneu
Subserosa e tecido adiposo perivesical Músculo Submucosa Mucosa Lâmina própria Epitélio Epitélio Lâmina própria Músculo superficial Músculo profundo Próstata (órgãos contíguos) Região afetada: Tecido adiposo perivesical (ou peritoneu)
Invasão da parede pélvica, parede abdominal Invasão microscópica do tecido perivesical Invasão macroscópica do tecido
36
Classificação TNM de 2009
T – Tumor primário
TX Tumor primário não avaliável T0 Sem evidência do tumor primário Ta Carcinoma papilar não invasivo Tis Carcinoma in situ(“tumor plano”)
T1 Tumor que invade o tecido conjuntivo subepitelial T2 Tumor que invade o músculo
T2a Tumor que invade a camada muscular superficial (metade interna) T2b Tumor que invade a camada muscular profunda (metade externa) T3 Tumor que invade o tecido perivesical
T3a Microscopicamente
T3b Macroscopicamente (massa extravesical)
T4 Tumor que invade qualquer uma das seguintes estruturas: próstata, útero, vagina, parede pélvica, parede abdominal
T4a Tumor que invade a próstata, útero ou vagina
T4b Tumor que invade a parede pélvica ou parede abdominal N – Gânglios Linfáticos
NX Gânglios linfáticos não avaliáveis
N0 Sem metástases nos gânglios linfáticos regionais N1 Metástases num único gânglio linfático na pélvis (hipogástrica, obturador, ilíaca externa ou pré-sagrada) N3 Metástases nos gânglios linfático na ilíaca comum M – Metástases distantes
MX Metástases não avaliáveis M0 Sem metástases distantes M1 Metástases distantes
Tabela 5 – Classificação do carcinoma vesical TNM de 2009 (Adaptada de Babjuk et alii.
37
Classificação da OMS de 1973 e 2004
(Usam-se ambas as classificações no presente texto uma vez que a maioria dos estudos retrospetivos são baseados no antigo sistema de classificação da OMS de 1973)
Classificação da OMS de 1973
Além da sua arquitetura, as células individuais apresentam diferentes graus de anaplasia:
Papiloma urotelial
Grau 1: Tumor bem diferenciado
Grau 2: Tumor moderadamente diferenciado Grau 3: Tumor pouco diferenciado
Classificação da OMS de 2004 Lesões planas
Hiperplasia (lesão plana ou papilar sem atipia) Atipia reativa (lesão plana com atipia)
Atipia de significado determinado Displasia urotelial
Carcinoma urotelial in situ (cis) Lesões papilares
Papiloma urotelial (lesão benigna)
Neoplasia papilar urotelial de baixo potencial maligno Carcinoma urotelial papilar de baixo grau
Carcinoma urotelial papilar de alto grau.
38
1.5 – Tratamentos
Cada estado clínico do CB está associado com a biologia do tumor original, prognóstico e abordagem ao tratamento. O objetivo do tratamento em cada estado é prevenir ou retardar a progressão para estados de doença mais avançados ou morte, mantendo a qualidade de vida (Galsky e Hall, 2010). A cirurgia, a quimioterapia, a imunoterapia e a radioterapia são as opções de tratamentos para CB (National Cancer Institute-NCI). A terapêutica habitual para os tumores papilares Ta e T1 da bexiga é a erradicação macroscópica completa por RTU, incluindo parte do músculo subjacente (Babjuk et alii, 2009). A segunda RTU é recomendada 2-6 semanas após a ressecção inicial, nas seguintes situações: RTU inicial incompleto por ausência de músculo na amostra (com exceção dos tumores TaG1 e CIS primários), em todos os tumores T1 e em todos os tumores G3 (exceto CIS primário) (Babjuk et alii, 2013). Uma vez que existe um risco considerável de recorrência e/ou progressão dos tumores após RTU, é recomendada terapêutica adjuvante intravesical para todos os estádios (Ta, T1e CIS). Todos os doentes devem receber uma instilação de quimioterapia intravesical no pós-operatório imediato, no espaço de 6 horas após a RTU; a escolha do fármaco (mitomicina C, epirrubicina ou doxorrubicina) é opcional. A aplicação da terapêutica adjuvante intravesical adicional depende do risco de recorrência e/ou progressão (Babjuk et alii, 2009).
39
Tabela 7 – Recomendações de tratamento em tumores TaT1 de acordo com a estratificação de risco (Adaptada de Babjuk et alii. 2013).
Tipo de Risco Definição Tratamento Recomendado
Tumores de
baixo Primário, único, Ta, G1, <3cm, sem CIS
Uma instilação imediata de
quimioterapia
Tumores de
risco
intermédio
Todos os casos entre o baixo e alto risco
Uma instilação imediata de
quimioterapia seguida de
terapêutica de manutenção
durante 1 ano ou 1 ano de
imunoterapia BCG Tumores de alto risco Tumores T1 Tumores G3 CIS
Múltiplos, recorrentes e grandes (>3cm)
tumores Ta G1G2 (devem estar presentes
todas estas condições)
Instilação intravesical de BCG,
dose completa, durante 1-3 anos
ou cistectomia radical (em
tumores de risco mais elevado)
Subgrupo de
tumores de
risco mais
elevado
T1G3 associado com CIS da bexiga,
múltiplo e/ou grande T1G3 e/ou recorrente
T1G3, CIS com T1G3 na uretra prostática,
variante micropapilar do carcinoma
urotelial
Cistectomia radical deve ser
considerada
40
O tratamento padrão para pacientes com CUB invasivo é cistectomia radical (Witjes et alii, 2014), que exige a remoção da bexiga, órgãos adjacentes e gânglios regionais (Vishnu, Mathew e Tan, 2011). No entanto, a sobrevida a 5 anos é de apenas 50% dos pacientes (Witjes et alii, 2014). Apesar de ser uma cirurgia curativa, cerca de metade desses pacientes desenvolvem a doença metastática no prazo de 2 anos, com uma elevada taxa de mortalidade. A administração de quimioterapia neoadjuvante e adjuvante sistémica baseada em cisplatina poderá, aumentar a probabilidade de erradicar a doença micrometastática e assim, melhorar a sobrevivência neste grupo de pacientes. A quimioterapia neoadjuvante seguida por cistectomia radical é hoje considerada por muitos como o novo padrão de tratamento para esta doença (Vishnu, Mathew e Tan, 2011). Apesar de estudos em grande escala, randomizados, de fase III e evidenciando os benefícios da sua utilização, a quimioterapia neoadjuvante ainda é pouco usada. (Witjes et alii, 2014).
Os tumores invasores e metastáticos representam a principal causa de morbidade e mortalidade entre os pacientes com CUB e os protocolos terapêuticos atualmente disponíveis são ineficazes em fornecer uma resposta efetiva ou resultados positivos. Novas estratégias e novos agentes terapêuticos devem ser testados (Nóbrega et alii, 2013).
1.6 - mTOR
Nos últimos anos, as descobertas no campo da transdução de sinal levaram à identificação de moléculas-chave envolvidas nas vias que regulam a sobrevivência celular, apoptose, proliferação e processos associados a tumores, tais como angiogénese e metastização. Uma molécula de sinalização recentemente estudada para terapêutica e que desempenha um papel crítico na oncogénese é o mTOR (Mansure et alii, 2009). Como referido anteriormente o mTOR é uma proteína serina/treonina cinase de 239 kDa (Ching e Hansel, 2010; Laplante e Sabatini, 2009) a jusante da via PI3K/AKT, (Mansure et alii,2009; Gust e So, 2009).
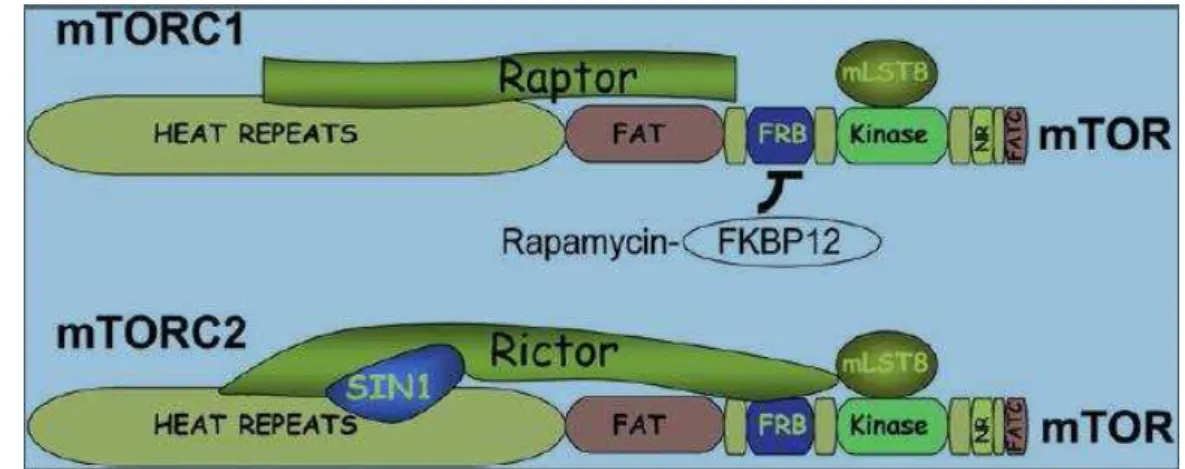
41
mTOR (proteína cinase heterotrimétrica), LST8 (também conhecida por GβL), “Raptor” (proteína reguladora associada ao mTOR) e AKTS1 (também conhecida por Pkb). O mTORC2 é composto por mTOR, LST8, Rictor (não sensível a rapamicina) e mSIN1 (proteína cinase ativada por mitogéneos (MAPK) associada a proteína1) (Gust e So, 2009; Ching e Hansel, 2010).
Fig. 3 – Composição dos complexos mTOR (adaptada (Bhaskar e Hay, 2007)).
O mTORC1 e 2 são ativados de diferentes formas e têm especificidade de substrato diferente. O mTORC1 responde a energia, aminoácidos, fatores de crescimento e níveis de oxigénio, enquanto a ativação mTORC2 não está bem esclarecida, mas parece ser mediada apenas por fatores de crescimento. O mTORC1 fosforila o S6K1 e 4EBP1 que são proteínas envolvidas na regulação da iniciação da tradução, síntese de proteínas e proliferação celular (Efeyan e Sabatini, 2010) e o mTORC2 regula a remodelação do citoesqueleto, dependente da actina (Ching e Hansel, 2010).
1.6.1 - Via de sinalização mTOR
42
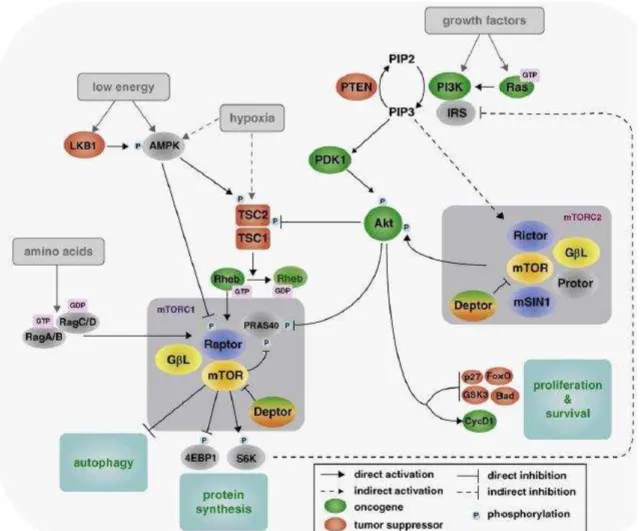
A ativação começa quando fatores de crescimento (insulina e IGFs), mitógenios, hormonas ou nutrientes ativam PI3K (Ching e Hansel, 2010); esta converte fosfatidilinositol-4,5-bifosfato (PIP2) em fosfatidilinositol-3,4,5-trifosfato (PIP3) (Gust e So, 2009) que, por sua vez, se liga à proteína cinase B (Akt 1) (Chen et alii, 2009) e recruta PDK1 (proteína-cinase dependente 1) para a membrana celular onde se liga e fosforila o Akt1. Este é considerado o nó de sinalização mais crítico nesta via regulando diversos substratos, que afetam processos envolvidos no controlo do crescimento e sobrevivência celular (Nawroth et alii, 2011). O Akt1 ativado, por sua vez, inativa o complexo esclerose tuberosa (TSC), composto por TSC1 e TSC2, por fosforilação direta da proteína GTPase ativadora TSC2. TSC2 e TSC1 normalmente atuam como proteínas supressoras tumorais inibindo o crescimento celular, uma vez que regulam negativamente a proteína GTPase ativando a Rheb (homóloga da proteína RAS enriquecida no cérebro). Uma vez libertado da inibição TSC, o Rheb ativa o mTORC1 (Ching e Hansel, 2010).
O mTOR ativado, subsequentemente, fosforila a proteína p70 S6 cinase-1 (S6K p70) e 4E-BP. A primeira fosforila a proteína ribossómica S6 da subunidade 40S, aumentando a tradução do RNAm; por outro lado, também se liga às membranas mitocondriais inativando a molécula pró-apoptótica BAD. A fosforilação de 4E-BP dá início ao processo de tradução com a consequente formação de proteínas necessárias para a progressão do ciclo celular após a fase G1, tal como a ciclina D1 (Ching e Hansel, 2010).
43
Fig. 4 – Via de sinalização do mTOR (adaptada (Efeyan e Sabatini2010)).
1.6.2 - Sinalização a montante do mTOR
1.6.2.1 - PI3K/AKT
44
Por um lado, a subunidade p85 do PI3K/mTOR é necessária para a ativação do S6K, mas, por outro lado, a PI3K pode regular a ativação da mesma por outra via - PDK1 (Proteína 3-fosfoinositida dependente cinase).
O PI3K na sua forma ativa neutraliza a ação do complexo TSC (Carrera, 2004). 1.6.2.2 - PTEN
A PTEN é uma fosfatase multifuncional, encontrada não só na membrana celular e no citoplasma mas também no núcleo, onde se acredita que exerce funções de supressor tumoral. Alterações na PTEN encontram-se em alguns tipos de cancro tais como glioblastoma, próstata, endométrio, melanoma, mama e bexiga. A PTEN atua na regulação da quimiotaxia e migração celular, estes mecanismos podem promover a invasão tumoral.
No citoplasma, PTEN usa a sua atividade de fosfatase lipídica para regular os processos de sinalização celular através da via PI3K/AKT/mTOR, desempenhando um papel importante na apoptose e crescimento celular. Especificamente, PTEN desfoforila PIP3, impedindo a ativação Akt1 (Ching e Hansel, 2010; Knowles et alii, 2009). Em contraste, no núcleo, a PTEN regula o ciclo celular e a sua progressão mantendo a estabilidade cromossómica independentemente do AKT.
Estas diferenças de localização no PTEN poderão ser importantes na progressão tumoral, uma vez que a sua expressão varia entre tecidos normais e tecidos oncológicos (Ching e Hansel, 2010).
1.6.2.3 - AKT1
45
1.6.2.4 - TSC
Um dos fatores mais importantes envolvidos na regulação da atividade mTORC1 é o TSC, que é um heterodímero que compreende TSC1 (também conhecido como hamartina) e TSC2 (também conhecido como tuberina). O complexo TSC1 / 2, como já foi referido anteriormente, regula negativamente a proteína GTPase (GAP) ativando o Rheb. O Rheb, por sua vez, quando libertado, pode ativar mTORC1. (Laplante e Sabatini, 2009).
O TSC1 é um dos dois genes que, quando mutado na linha germinativa, causa o síndrome esclerose tuberosa, um síndrome autossómico dominante, caracterizado pelo desenvolvimento de hamartomas nos rins, coração, cérebro e pele (Knowles et alii, 2009).
1.6.3 - Sinalização a jusante do mTOR
O mTORC1 controla positivamente a síntese proteica, que é necessária para o crescimento celular, através de vários efetores a jusante (Laplante e Sabatini, 2009). Os substratos mais conhecidos de mTORC1 são as cinases p70S6K1 (S6K1) e a eIF4E proteína de ligação 1 (4EBP1), ambas importantes no controlo da iniciação da tradução proteica.
S6K1 pode ser ativada por vias dependentes e independentes do mTOR, tais como PDK1, MAPK e SAPK (proteína cinase induzida por stress). Apesar disso, a fosforilação do S6K1 pode ser bloqueada por inibidores do mTOR. O S6K1 está envolvido na tradução de proteínas ribossomais, fatores de elongamento e IGF2 (Pópulo, Lopes e Soares, 2012; Nawroth et alii, 2011).
46
1.6.4 - Via mTOR no Cancro
As vias de sinalização celular têm um papel crítico na tumorogénese, alterações no gene ou nas proteínas subjacentes a estas vias podem influenciar o controlo do ciclo celular, reparação do ADN e o metabolismo carcinogéneo (Ching e Hansel, 2010); como tal, cada vez mais, a atenção está voltada para investigar a patogénese molecular do CUB, e assim elucidar as vias envolvidas no desenvolvimento e progressão da doença, em particular, a via mTOR (Ching e Hansel, 2010; Makhlin et alii, 2011)
47
Tabela 8 – Os proto-oncogenes e genes supressores de tumor ligados ao mTOR (Adaptada (Pópulo, Lopes e Soares, 2012)).
Proto-oncogene Descrição das alterações
AKT
AKT é amplificada num subconjunto de cancros humanos, tais como, cancro da mama e ovário.
4EBP1
4EBP1 a sua expressão está associada como fator de pior prognóstico em vários cancros humanos, como mama, cólon, ovário e próstata. A fosforilação de 4EBP1 foi encontrada em tumores do ovário quimioresistentes.
eIF4E
Sobre-expressão ectópica de eIF4E pode transformar células ex vivo e in vivo. O eIF4E é sobre-expresso em muitos tumores humanos, tais como, cancro de mama, cólon e cabeça e pescoço, linfomas não-Hodgkin e leucemia mieloide crónica e aguda.
PI3K
Elevada atividade de PI3K está implicada na transformação celular e progressão do tumor, descritos em vários cancros humanos, tais como, cancro do ovário, gastrointestinais, mama e próstata.
Rheb
Sobre-expressão de Rheb é descrita em muitas células tumorais, a sua regulação positiva é crítica para o carcinoma espinocelular e está associada com mau prognóstico no cancro de mama, cabeça e pescoço.
S6K1
S6K1 está sobre-expressa no cancro do pulmão e ovário e a sua expressão correlaciona-se com mau prognóstico na mama, rim e carcinoma hepatocelular.
Genes supressores de tumor
LBK1
Indivíduos com mutações em LKB1 desenvolvem síndroma Peutz-Jeghers, que inclui a ocorrência de hamartomas no trato gastrointestinal.
PTEN
A perda da função de PTEN foi descrita em grande parte dos cancros humanos avançados, como cancro da mama, próstata, rim e melanoma. Indivíduos com mutações hereditárias em PTEN desenvolvem síndromes tumorais (doença Cowden, síndrome de Bannayan-Ruvacaba-Riley, síndrome de Proteus, doença de Lhermitte-Duclos) e estão em maior risco de desenvolver vários tipos de cancro.
TSC1/TSC2
48
1.6.5 - Via de sinalização mTOR no CUB
Como está descrito as alterações observadas no CUB podem surgir através de duas vias divergentes. A primeira via é caracterizada por mutações de ganho de função em oncogenes como o H-ras, recetor de fatores de crescimento fibroblasto (FGFR) e com menos frequência PI3K - esta dá origem a tumores papilares superficiais, que frequentemente recorrem, mas raramente são fatais. A segunda via envolve a inativação, geralmente por via da perda de funções por mutações em genes supressores tumorais,
por exemplo p53, PTEN e retinoblastoma (RB1) - esta leva à formação de tumores
invasores e metastáticos (Korkolopoulou et alii, 2012; Schultz et alii, 2010). Melhorias na compreensão da oncogénese do CUB têm alimentado a atual busca de marcadores biológicos que podem ser direcionados para a terapia ou prognóstico (Schultz et alii. 2010).
A desregulação da via PI3K/Akt/mTOR tem sido implicada no desenvolvimento de carcinoma urotelial (Sun, Chang e Pan, 2011). As alterações moleculares dos efetores da via PI3K/AKT foram relatadas no CUB, incluindo deleções da PTEN (24-58% de CUB invasor T2-T3-T4), mutações inativadoras do TSC1 (10-15% dos CUB), mutações ativadoras de PIK3CA, o gene que codifica a subunidade catalítica de PI3K (20% tumores baixo grau) e AKT (4,8% de CUB). Estudos imunohistoquímicos relataram uma diminuição na expressão de PTEN em cerca de 50% do CUB, e um aumento na expressão da pAKT em cerca de 88% dos casos (Calderaro et alii, 2014).
A sobreativação da via mTOR promove o comportamento mais agressivo da doença em vários tipos de cancro; a atividade do mTOR foi associada com a redução da sobrevida dos pacientes com CUB e aumento do estádio de progressão tumoral (Ching e Hansel, 2010).
49
colaboradores que demonstraram, que o p-mTOR ativo reduz a sobrevivência em pacientes com CUB músculo-invasor (Hansel et alii. 2010)
No que respeita à proteína S6, a jusante do mTOR, estudos in vitro demonstraram uma relação diretamente proporcional de S6 e proliferação tumoral, nomeadamente, apontaram a expressão aumentada de S6 em CUB invasivo da camada muscular (Hansel
et alii, 2010).
Park e colaboradores encontraram igualmente uma expressão elevada de p-S6 relacionada com tumores de alto grau e de estádios avançados, no entanto a expressão do mTOR por si só não estava aumentada (Park et alli, 2011). Em concordância com este trabalho outros estudos demonstraram que a expressão elevada da p-S6 e pAKT eram preditivos da mortalidade em casos de CUB não invasores da camada muscular (Sun, Chang e Pan, 2011).
Em 2013, Fahmy e colaboradores demonstraram em amostras de pacientes com CUB não invasores da camada muscular que a expressão de S6K se relacionava com uma maior probabilidade de recorrência do carcinoma (Fahmy et alii, 2013).
Em oposição outros estudos demonstram que não só a menor expressão de S6K como também a de 4eBP1 se relacionava com a maior recorrência do CUB nomeadamente T1 (Chaux et alli, 2013).
1.6.6 - Inibidores do mTOR
50
Fig. 5 – Via de sinalização mTOR simplificada e a atuação da rapamicina (adaptada (Laplante e Sabatini 2012)).
O mTORC1 é sensível à rapamicina concorrendo entre Raptor e FKBP12-RAP pela ligação ao domínio FRB. O FRB é um local de regulação positiva, ainda que por meios indiretos. O Rheb estimula a função mTORC1, através do bloqueio da inibição de ligação de FKBP38 pelo FRB. O FKBP38 está intimamente relacionado com FKBP12, recetor intracelular da rapamicina. FKBP38 é formado a partir de um domínio do FKBP-C (a sequência consenso mínima FKBP12) e um par de domínios de interação proteína-proteína. FKBP38 por ligação à Rheb-GTP liberta o mTORC1 FRB disponibilizando-o para Raptor (Hoeffer e Klann, 2010).
51
Inibidores do mTOR têm predominantemente efeitos citostáticos e, em ensaios clínicos, estes agentes parecem estabilizar a doença, embora tenham capacidade limitada para induzir a regressão significativa dos tumores (Gust e So, 2009). Curiosamente, a inibição do mTOR tem sido usada para sensibilizar certas células cancerosas à terapia com cisplatina (Makhlin et alii, 2009). Esta inibição seletiva pode ser conseguida usando rapamicina ou análogos (rapalogs) (Hansel et alii, 2010), temsirolimus (CCI-779), everolimus (RAD 001) e deforolimus ou A23573. Estes compostos usam o mesmo mecanismo que a rapamicina e são considerados potentes agentes antitumorais. A principal diferença entre estes compostos é a sua biodisponibilidade e o facto de que o temsirolimus e o deforolimus, sendo solúveis em água, podem ser administrados por via intravenosa, enquanto que a rapamicina e o everolimus têm baixa solubilidade e devem ser administrados por via oral. Os rapalogs (Ching e Hansel, 2010) estão atualmente em uso em numerosos ensaios clínicos de tumores sólidos, com resultados promissores em pacientes com carcinoma avançado de células renais (Hansel et alii, 2010). Como resultado, futuros estudos destas vias no CUB são de todo o interesse, dado o seu potencial de informação prognóstica e terapêutica direcionada (Ching e Hansel, 2010).
Recentemente, foram já desenvolvidos três inibidores químicos distintos do S6, um dos quais uma proteína quimérica e testados em linhas celulares humanas de CB (Couty et alli, 2013).
Neste último ano surgiram igualmente inibidores duplos da PI3K/mTOR acompanhados de estudos em linhas celulares tumorais de bexiga resistentes à cisplatina-NVP-BEZ235 (Moon et alli, 2014).
Sendo assim, é necessário desenvolver biomarcadores que ajudem a prever a mTOR-inibição-sensibilidade/resistência de modo a selecionar melhor os tumores que beneficiem do tratamento com inibidores do mTOR (Gust e So, 2009).
52
via, nomeadamente, o mTOR e o S6K, que permitam, por um lado, conhecer melhor a sua expressão nos vários tipos de CUB, e clarificar a sua importância biológica como marcadores de ativação e possíveis alvos terapêuticos (Park et alli, 2011). Por outro lado a maioria dos estudos descritos na literatura incluem apenas doentes com tumores invasores da camada muscular e concentram-se em resultados obtidos através da técnica
53
II- Objetivos
A presente dissertação de mestrado tem por objetivo estudar se a via de sinalização mTOR está ativa quer nos CUB não invasores da camada muscular quer nos CUB invasores e metastáticos. Através de um estudo imunohistoquímico pretende-se avaliar a imunorreatividade das proteínas p-mTOR e p-S6 através de 3 formas qualitativas numa série de 96 casos de CUB humano:
- Percentagem de células tumorais positivas; - Intensidade de marcação;
- Cálculo da multiplicação da percentagem de células tumorais positivas pela intensidade de marcação (Hscore);
- Avaliação do potencial de utilização do (Hscore) como parâmetro único no estudo da imunorreatividade destes anticorpos.
54
III- Material e Métodos
3.1 - População
Foram estudados 96 casos de tumores registados e diagnosticados como CUB, admitidos e tratados no Instituto Português de Oncologia Francisco Gentil – Centro regional do Norte, entre o ano de 2003 e 2007. A seleção destes casos com CUB foi baseada na existência de dados de follow-up e da disponibilidade do material incluído em parafina.
Nesta série de trabalho, o tratamento cirúrgico com intenção curativa foi a RTU ou cistectomia radical, e os gânglios removidos por linfadenectomia associada à cistectomia radical (quando aconselhável). Assim, dos 96 casos estudados, em 30 foram isolados gânglios linfáticos e 11 deles apresentavam metástases.
As neoplasias foram classificadas histologicamente de acordo com os critérios propostos pela OMS de 2004. A classificação por graus e estádios foi realizada segundo a mesma classificação (Eble et alli, 2004).
3.2 - Estudo imunohistoquímico
Nesta série de trabalho estudou-se a imunoexpressão dos seguintes anticorpos:
Phospho-mTOR (Ser2448) e Phospho-S6 (Ser235/236).
O estudo da imunorreatividade para estes anticorpos foi efetuado pelo método da Streptavidina-Biotina (Ultravision Dectetion Large volume Anti-polyvalent, Thermo Scientific LabVision), em cortes histológicos de tumor com 3 µm estendidos em
55
a incubação com os anticorpos primários durante 18 horas a 4ºC e em câmara húmida: Phospho-mTOR (p-mTOR, Ser2448, 1:100; Cell Signaling Technology) e Phospho-S6 (p-S6, Ser235/236, 1:75; Cell Signaling Technology). A revelação realizou-se com a incubação dos cortes numa solução de Tris/HCl a 0,05M com 0,05% de 3,3-diaminobenzidina tetrahidroclorida e 0,01% de peróxido de hidrogénio. O contraste dos núcleos foi realizado com hematoxilina de Harris. Todas as séries incluíram um controlo negativo, substituindo-se o anticorpo primário por BSA a 2,5% em TBS, e um controlo positivo com imunorreatividade conhecida para o anticorpo monoclonal em estudo.
3.3 - Avaliação e quantificação da imunorreatividade
A imunorreatividade dos anticorpos primários foi avaliada através da visualização dos cortes histológicos por microscopia ótica. Cada corte histológico foi interpretado por dois observadores independentes e quando existiram divergências estas foram ultrapassadas pela observação conjunta.
A avaliação da imunorreatividade foi nuclear e citoplasmática (anexo 2). Para análise estatística somente o padrão predominante foi considerado, isto é, citoplasmática para p-mTOR e p-S6.
Para ambos os marcadores foi realizada uma análise qualitativa, considerando a percentagem de células marcadas e a intensidade da coloração, e estas foram organizadas em categorias como se pode observar nas tabelas 9 e 10.
Tabela 9–Grupos formados para avaliação da positividade das células. Percentagem de células marcadas Categorias
0 ou <5% 0
5-24% 1
25-49% 2
50-74% 3
56
Tabela 10–Grupos formados para avaliação da intensidade da marcação.
Intensidade da Marcação Categorias
Negativa 0
Fraca 1
Intermédia 2
Forte 3
Com base nesta avaliação foi elaborado um Hscore que consistiu na multiplicação da percentagem de células marcadas pela intensidade da marcação (Korkolopoulou, 2012).
3.4 - Análise estatística
57
IV
–
Resultados
4.1 Características clinico-patológicas
Na tabela 11 estão descritos os parâmetros clinico-patológicos dos 96 casos do CUB estudados.
Tabela 11 - Parâmetros clinico-patológicos da amostra estudada (n=96).
Parâmetros Clínico-Patológicos
Idade, anos
Mediana [min – máx] 69,50 [38-92]
Género, (n, %)
Masculino 82(85,4)
Feminino 14(14,6)
Gânglios metastizados, (n, %)
Não 19(19,8)
Sim 11(11,5)
Não isolados 68(68,8)
Estádio tumoral, (n, %)
Ta 27(28,1)
T1 20(20,8)
T2 9(9,4)
T3 20(20,8)
T4 20(20,8)
Grau de diferenciação, (n, %)
Baixo Grau 16(16,7)
Alto Grau 80(83,3)
Tipo de cirurgia, (n, %)
RTU 32(33,3)
Cistectomia 64(66,7)
Tipo de tumor, (n, %)
Primário 54(56,3)
58
A idade dos doentes à data do diagnóstico variou entre os 38 e os 92 anos, com uma mediana de 69,5 anos. Desta amostra, 28 (29,2%) doentes faleceram por cancro e os restantes 68 (70,8%) estão vivos ou perdidos para follow-up ou faleceram por outras causas.
Nos 96 CUB estudados, 47 eram não invasores (27 casos Ta e 20 T1) e 49 eram invasores da camada muscular (19 casos T2, 20 casos T3 e 20 T4). Deste total, 16 eram de baixo grau de diferenciação (15 eram Ta e 1 T1) e 80 de alto grau (12 Ta, 19 T1, 9 T2, 20 T3 e 20 T4). Verificou-se que existe uma correlação estatisticamente significativa entre o grau e o estádio tumoral (p <0,01), uma vez que todos os tumores uroteliais de baixo grau são não invasores (estádios Ta e T1; Tabela 12).
Tabela 12 - Grau de diferenciação e estádios dos CUBs estudados.
Grau de diferenciação
Estádio
(n,%) p
Ta T1 T2 T3 T4
Baixo grau 15(93,8) 1(6,3) 0(0,0) 0(0,0) 0(0,0)
<0,01 Alto grau 12(15,0) 19(23,8) 9(11,3) 20(25,0) 20(25,0)
4.2 Expressão da proteína p-mTOR
59
Tabela 13 – Frequência da percentagem de células marcadas da proteína p-mTOR.
Categoria N %
0(Negativo) 18 18,8
1(5-24%) 32 33,3
2(25-49%) 24 25,0
3(50-74%) 11 11,5
4(75-100%) 11 11,5
Tabela 14 – Frequência da intensidade de marcação da proteína p-mTOR.
Categoria N %
0(Negativo) 18 18,8
1(Fraco) 9 9,4
2(Intermédio) 34 35,4
3(Forte) 35 36,5