Taxonomia das espécies de
Lutosa
Walker, 1869 das
florestas do leste do Estado de São Paulo, Brasil:
taxonomia, morfologia externa e do complexo fálico
(Orthoptera, Stenopelmatoidea, Anostostomatidae).
JOÃO PAULO MORSELLI
ORIENTADOR: Dr. Francisco de Assis Ganeo de Mello
Dissertação apresentada ao curso de Pós-Graduação em Ciências Biológicas - Área de Zoologia - Instituto de Biociências da Universidade Estadual Paulista- UNESP, “Campus” de Botucatu, como parte dos requisitos para a obtenção do título de Mestre em Ciências Biológicas.
FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉCNICA DE AQUISIÇÃO E TRATAMENTO DA INFORMAÇÃO
DIVISÃO TÉCNICA DE BIBLIOTECA E DOCUMENTAÇÃO - CAMPUS DE BOTUCATU - UNESP BIBLIOTECÁRIA RESPONSÁVEL: SELMA MARIA DE JESUS
Morselli, João Paulo.
Taxonomia das espécies de Lutosa Walker, 1869 das florestas do leste do Estado de São Paulo, Brasil: taxonomia, morfologia externa e do complexo fálico (Orthoptera,
Stenopelmatoidea, Anostostomatidae) / João Paulo Morselli. . – 2006.
Dissertação (mestrado) – Universidade Estadual Paulista, Instituto de Biociências de Botucatu, 2006.
Orientador: Francisco de Assis Ganeo de Mello Assunto CAPES: 20400004
1. Orthoptera 2. Inseto - Classificação
CDD 595.726
DEDICATÓRIA
AGRADECIMENTOS
Ao Prof. Dr. Francisco de Assis Ganeo de Mello, por tudo que me ensinou, pelo exemplo de profissionalismo, pela amizade, apoio, dedicação e paciência.
Ao CNPq, Conselho Nacional de Desenvolvimento de Pesquisa e
Tecnologia, pela bolsa de mestrado concedida, o que permitiu a realização dos estudos.
À coordenação do Curso de Pós-graduação em Ciências Biológicas- Área de Zoologia e ao Departamento de Zoologia do Instituto de Biociências- UNESP- Botucatu, por toda a infra-estrutura oferecida.
Ao Museu de Zoologia da Universidade de São Paulo pelo empréstimo de material.
Aos seguintes professores, cujas aulas tive o privilégio de assistir durante o programa de mestrado: Dra. Elisa Ap. Gregório, Dr. Flávio Roberto M. Garcia, Dr. Guaracy Tadeu Rocha, Dr. Jorge Jim, Dr. Luiz Carlos Forti e Dr. Nelson Papavero.
Aos seguintes professores, membros da banca de meu exame de
qualificação: Dra. Ana Catarina Cataneo, Dr. Francisco de A. G. de Mello e Dra. Mirtes Costa.
A Dra. Ana Maria Vieira, pelo carinho, amizade e por acreditar em meu trabalho.
Ao Dr. Hans Scavenius (in memoriam), pela permissão para coletas em sua
Ao meu grande amigo e colega de trabalho, Marcio P. Bolfarini, pelo auxílio nas coletas, conselhos e assistências, que não foram poucas.
Aos estagiários Renato Soares Capellari e Isabela Mateus Martins pelo apoio e incentivo.
Ao estagiário Fernando Campos De Domenico, do Museu de Zoologia da Universidade de São Paulo, pelo auxílio nas coletas.
Aos amigos do Departamento de Zoologia, Luciana, Patrícia, Domingos, Aline, Fabiana, Ludmila, Adriane, Bruna, Fernanda, Mirian, Marina e Augusto, que de várias formas, contribuíram, direta ou indiretamente, com o meu trabalho.
Aos funcionários Juliana Ramos, Flávio da Silva, José Mario Pisani, Hamilton Antônio Rodrigues, Maria, Sérgio e Sônia, pela ajuda durante esses dois anos como mestrando.
À bibliotecária Selma Maria, pela ficha catalográfica.
Aos amigos da "República da Kissassa": Helanderson e José Pedro, além dos freqüentadores Fábio, Castilho, Bruno e Gustavo, por todos os bons
momentos de convivência.
Aos amigos da Universidade do Sagrado Coração de Jesus (USC), Jordana, Felipe, Sérgio, Fábio Maffei, Fábio Gamba, Amilton, Gérson, Thiago Quagio, Fabiane, Aline, Bruna e aqueles que por acaso eu tenha esquecido.
Aos amigos Fábio Inforzato, Danilo, Gustavo Pereira, Alexandre Bueno, Celso, Fernando Tirollo, Cléber, Thiago Perrone e William, este último,
RESUMO
O presente trabalho teve por objetivo estudar, do ponto de vista taxonômico, as espécies de Lutosa Walker, 1869 (Orthoptera, Ensifera, Stenopelmatoidea,
Anostostomatidae) que ocorrem nas florestas do leste do Estado de São Paulo, Brasil, abrangendo análises da morfologia corporal externa, do complexo fálico e espermateca. Além da re-descrição do gênero e de três espécies já conhecidas, treze novas foram descritas e uma chave dicotômica de identificação é proposta para todas as espécies examinadas. Com base na estrutura de certos elementos que compõem o complexo fálico, dois grupos de espécies foram reconhecidos e definidos. Ainda no que concerne à morfologia da genitália masculina, uma proposta de terminologia para as diferentes áreas do apódema epifálico é apresentada. Dados preliminares sobre hábitos, ecologia e comportamento de espécies de Lutosa são fornecidos.
Palavras-chave: Orthoptera, Ensifera, Stenopelmatoidea, Anostostomatidae,
SUMMARY
The aim of the present work was to study, from a taxonomic perspective, the species of Lutosa Walker, 1869 (Orthoptera, Ensifera, Stenopelmatoidea,
Anostostomatidae) from the eastern forests from the State of São Paulo, Brazil, including analyses of external body morphology, phallic complex and spermatheca. Besides re-describing the genus and three of its valid species, thirteen new ones were described, and a dichotomic identification key for all examined species is presented. Based on the structure of certain elements that comprise the phallic complex, two species groups were recognized and defined. Still regarding male genital morphology, a terminological proposal for the different areas of the epiphallic apodeme is presented. Preliminary data on habits, ecology, and behavior ofLutosa species are given.
Key words: Orthoptera, Ensifera, Stenopelmatoidea, Anostostomatidae, Lutosa,
ÍNDICE
I. INTRODUÇÃO ... 01
II. OBJETIVOS ...08
III. MATERIAIS E MÉTODOS...09
III.1. O material de estudo...09
III. 2. A área geográfica...10
III. 3. Métodos de coletas...11
III. 4. Preservação do material...12
III. 5. Manutenção em cativeiro...12
III. 6. Tipos de caracteres estudados...13
III. 7. Método de preparo das genitálias masculinas...14
III. 8. Terminologia das estruturas da genitália masculina...15
III. 9. Elaboração das figuras...15
IV. RESULTADOS...16
IV. 1. Estudo dos apódemas epifálicos...16
IV. 2. Taxonomia...17
IV. 2. 1. Re-descrições e descrições de táxons...17
IV. 2. 2. Classificação das espécies de Lutosa...40
IV. 2. 3. Chave para identificação das espécies...41
IV. 3. Hábitos e comportamentos...48
V. COMENTÁRIOS FINAIS...50
VI. BIBLIOGRAFIA CITADA...51
TABELAS...57
I. INTRODUÇÃO
Originalmente definida por SAUSSURE (1859), Anostostomatidae é uma família da subordem Ensifera (Orthoptera) predominantemente do hemisfério sul, representada, sobretudo, por espécies na Austrália, Nova Zelândia, Nova Guiné, Nova Caledônia, África, Madagascar, e Américas do Sul e Central. Embora sejam insetos, via-de-regra, grandes e conspícuos, são pouco conhecidos do público leigo em qualquer lugar do mundo. O termo "king cricket" é o mais recorrente dentre os nomes populares em paises de língua inglesa, seguido por "giant wetas"
para as formas gigantes da Nova Zelândia e "parktown prawns" para algumas
formas sul-africanas com morfologia cefálica bizarra decorrentes de um hiper-desenvolvimento mandibular nos machos (FIELD, 2001; TOMS, 2001). No Brasil, a exemplo do que ocorre em muitos outros paises, não possuem um nome popular, ao menos entre o povo não nativo. Eventualmente são referidos como “grilos”, embora não se trate de Grylloidea, mas de Stenopelmatoidea.
Membros dessa família gondvânica foram, até recentemente, objeto de pouco entendimento taxonômico, uma vez que muitos dos gêneros haviam sido colocados em Stenopelmatidae, Henicidae e Mimnermidae, não havendo consenso sobre a real situação taxonômica do grupo (JOHNS, 1997).
Após examinar a maioria dos tipos, Johns (op. cit.) redefiniu e revalidou a
família Anostostomatidae, cujo gênero-tipo é Anostostoma Gray, 1837, e propôs
indivisa e restrita à Nova Zelândia, e Anostostomatinae, com quatro tribos, foram as subfamílias reconhecidas pelo autor; esta última com as seguintes tribos: 1-Anostostomatini, com gêneros na África, Madagascar, Austrália, Nova Zelândia e um ainda não descrito (com uma espécie reconhecida) da Venezuela; 2-Glaphyrosomatini, com um gênero da América Central e outro da América do Norte; 3- Anabropsini, com três gêneros, um dos quais no Sudeste da Ásia, China, Japão e India, outro na Austrália, e o gênero-tipo, Anabropsis, com três espécies
na Costa Rica, uma na Guatemala, uma no México e uma no Equador; 4- Lutosini, com gêneros na África, Madagascar, Austrália, Nova Guiné e Américas do Sul, Central- ilhas caribenhas inclusas- e do Norte.
GOROCHOV (1984, 1988a, 1988b, 1995, 2001a, 2001b) trabalhou na classificação de vários grupos de Ensifera. A publicação de 2001a foi dedicada à Stenopelmatoidea e o autor subdividiu este táxon nas famílias Stenopelmatidae, Anostostomatidae e Rhaphidophoridae, tendo subfamílias como táxons terminais. O autor não empregou a metodologia cladística em sua proposta de relacionamento filogenético e nenhuma das subfamílias foi dividida em tribos. No que concerne à Anostostomatidae, ele reconheceu e redefiniu as seguintes subfamílias: Anostostomatinae Saussure, 1859; Cratomelinae Brunner Von Wattenwyl, 1888; Deinacridinae Karny, 1932; Lezininae Karny, 1932; Anabropsinae Rentz & Weissman, 1973; Cooloolinae Rentz, 1980; Lutosinae Gorochov, 1988.
Anostostomatidae sob Stenopelmatoidea da infraordem Tettigoniidea que, além desta superfamília, contém também Hagloidea e Tettigonioidea.
FIELD (2001) editou a primeira grande obra dedicada exclusivamente à Anostostomatidae, abrangendo as contribuições de autores para as seguintes grandes áreas: 1- Sistemática & Biogeografia; 2- Morfologia & Anatomia; 3- Ecologia; 4- Comportamento; 5- Reprodução & Desenvolvimento; 6- Fisiologia; 7- Conservação & Espécies Ameaçadas. O único capítulo da obra a contemplar com exclusividade um táxon sul-americano foi o de ÂNGULO (in Field, 2001), que
tratou da anatomia, desenvolvimento e comportamento de Cratomelus armatus
Blanchard, 1851, do Chile.
Apesar da importância taxonômica dos artigos de JOHNS (1997) e GOROCHOV (2001a), os autores limitaram seus estudos à morfologia corporal externa, sem considerar informações advindas das estruturas que formam o complexo fálico. O artigo de DESUTTER-GRANCOLAS (2003) foi o primeiro a trazer, num estudo de maior escopo, uma abordagem comparada das genitálias masculinas de representantes de toda a subordem Ensifera, com o estabelecimento da homologia das peças e a proposição de uma terminologia para os elementos que compõem o complexo fálico. Para o caso específico do gênero Lutosa, objeto do presente estudo, e afins, a estrutura denominada pela
autora como “apódema epifálico” requer maior atenção, uma vez que a mesma aparenta ser uma fonte rica em informações para o diagnóstico de espécies e estabelecimento de filogenias.
outros ortópteros ensíferos, cinco propostas que não empregaram a metodologia cladística foram publicadas, todas utilizando o nome “Stenopelmatidae”. São elas as de ANDER (1939); ZEUNER (1939); JUDD (1948); RAGGE (1955) e SHAROV (1968), sendo as de Zeuner e Sharov baseadas em fósseis, as demais em material recente.
GWYNNE (1995), ainda utilizando o nome “Stenopelmatidae”, mas fazendo uso da metodologia cladística de reconstrução de filogenias, e basendo-se em caracteres da morfologia externa e interna de táxons recentes, obteve o seguinte padrão de parentesco: [((Gryllidae-Gryllotalpidae) Schizodactylidae) (Rhaphidophoridae (Gryllacrididae (Cooloolidae (Stenopelmatidae (Tettigoniidae- Haglidae)))))] . Esse autor não considerou caracteres da morfologia fálica.
DESUTTER-GRANDCOLAS (2003), utilizando a metodologia cladística e uma matriz com 85 caracteres da morfologia externa e interna dos grandes grupos de Ensifera, obteve duas árvores igualmente parcimoniosas (comprimento= 153, índice de consistência= 63, índice de retenção= 60) com as seguintes topografias: 1- [(Grylloidea - Gryllotalpidae) (Rhaphidophoridae (Schizodactylidae (Gryllacrididae ((Stenopelmatidae – Cooloola) (Anostostomatidae (Prophalangopsis (Cyphoderris (Tettigoniidae – Lezina))))))))]; 2- [(Grylloidea – Gryllotalpidae) (Rhaphidophoridae (Schizodactylidae (Gryllacrididae – Cooloola – (Stenopelmatidae (Anostostomatidae (Prophalangopsis (Cyphoderris (Tettigoniidae – Lezina)))))))].
Segundo GOROCHOV (2001a), na Neotropica ocorrem representantes de
(op. cit.) arrolam, para esta última, o seguinte gêneros: Lutosa Walker, 1869 (com
13 espécies descritas da América do Sul, México, Cuba e Hispaniola); Licodia
Walker, 1869 (com 3 espécies em ilhas do Caribe); Apotetamenus Brunner Von
Wattenwyl, 1888 (com 3 espécies na América do Sul); Hydrolutos Issa & Jaffe,
1999 (com 4 espécies da Venezuela) e Neolutosa Gorochov, 2001 (com 2
espécies no Brasil). Mencione-se que as quatro espécies de Hydrolutos da região
da Gran Sabana venezuelana são os únicos representantes semi-aquáticos de Stenopelmatoidea, apresentando adaptações morfológicas para a vida em ambiente palustre (ISSA & JAFFE, 1999).
Segundo OTTE, EADES & NASKRECKI (sem data), o gênero Lutosa, objeto
do presente estudo, é composto pelas seguintes espécies:
1- L. cubaensis (Haan, 1842), originalmente descrita como Locusta cubaensis e
transferida para Lutosa por KIRBY (1906). Holótipo macho proveniente de
Cuba, depositado no Museu de Leiden [RMNH].
2- L. marginalis F. Walker, 1869, espécie-tipo do gênero. Holótipo fêmea, sem
localidade, mas provavelmente do Brasil, depositado no British Museum of Natural History [BMNH].
3- L. obliqua F. Walker, 1869. Holótipo fêmea proveniente do México, depositado
no British Museum of Natural History [BMNH].
4- L. brasiliensis Brunner von Wattenwyl, 1888. Holótipo fêmea proveniente de
Museu de Viena [NMW] e duas fêmeas no Museu de Stuttgart [SMNS]. A espécie foi posteriormente transferida para Licodia por KIRBY (1906), tal
recombinação sem dúvida errônea, uma vez que as espécies de Licodia restringem-se a Cuba e Hispaniola. JOHNS (1997), apropriadamente, revalidou o nome original de Apotetamenus clipeatus Brunner Von
Wattenwyl, 1888. O catálogo de Otte, Eades & Naskrecki, em consulta realizada em 27. xii. 2005, continha, equivocadamente, o nome Lutosa
clipeata (Brunner von Wattenwil, 1888), sem indicar o autor da recombinação
e também o nome correto, Apotetamenus clipeatus Brunner von Wattenwyl,
1888. A espécie Lutosa clipeata não existe, o nome deve ser suprimido do
catálogo.
6- L. azteca (Saussure & Pictet, 1897). Originalmente descrita como
Glaphyrosoma aztecum Saussure & Pictet, 1897. Tipo não especificado,
proveniente do México. KARNY (1937) sinonimizou-a, erroneamente, com
Licodia pallipes F. Walker, 1869 (espécie restrita à Ilha de Hispaniola). OTTE
(2000), sem justificativa, transferiu o epíteto específico para Lutosa. O
catálogo de Otte, Eades & Naskrecki, em consulta realizada em 27. xii. 2005, trazia o nome proposto por Otte (op. cit.) e não fazia referência a
Glaphyrosoma aztecum.
7- L. goeldianus (Saussure & Pictet, 1897). Originalmente descrita como Pherterus
goeldianus Saussure & Pictet, 1897. Lectótipo macho proveniente do Brasil,
8- L. paranensis Rehn, 1911. Holótipo macho proveniente de Puerto Bertoni,
Paraguai, depositado na Academy of Natural Sciences of Philadelphia [ANSP].
9- L. inermis Salfi, 1925. Holótipo macho proveniente do Chile, depositado no
Museo Zoologico della Reggia Universitá di Napoli [MZFM]. JOHNS (1997) adverte para o fato de que esta espécie pode pertencer ao gênero Dolichochaeta e GOROCHOV (2001) também expressa dúvida quanto à presença de uma espécie de Lutosa no Chile.
10- L. imitata Levada & Diniz-Filho, 1993. Holótipo macho proveniente de
Jacupiranga, São Paulo, Brasil, depositado no Museu Nacional do Rio de Janeiro.
11- L. anomala Gorochov, 2001. Holótipo fêmea proveniente dos arredores de São
Sebastião, São Paulo, Brasil, depositado no Zoological Institute of the Russian Academy of Science , St. Petersburg [ZIN].
12- L. normalis Gorochov, 2001. Holótipo macho proveniente dos arredores de
São Sebastião, São Paulo, Brasil e depositado no Zoological Institute of the Russian Academy of Science , St. Petersburg [ZIN].
13- L. surda Gorochov, 2001. Holótipo fêmea, proveniente de Puerto Bertoni, Alto
Parana, Paraguai e depositado no Zoological Institute of the Russian Academy of Science , St. Petersburg [ZIN].
asterisco indica procedência duvidosa ou imprecisa): L. anomala (Brasil, São
Paulo, São Sebastião); L. brasiliensis (Brasil, RJ, Teresópolis); L. clipeata (Brasil*);
L. goeldianus (Brasil, RJ, Erni*); L. imitata (Brasil, SP, Jacupiranga); L. marginalis
(sem localidade, provavelmente Brasil*); L. normalis (Brasil, SP, São Sebastião).
II. OBJETIVOS
A coleção de Orthoptera do Departamento de Zoologia do Instituto de Biociências da UNESP - Campus de Botucatu conta com vários lotes de espécies de Lutosa da floresta atlântica costeira do Estado de São Paulo que nunca foram
descritas. Desse modo, os objetivos do presente trabalho podem ser arrolados da seguinte forma:
- Estudar, comparativamente, a estrutura do apódema epifálico de espécies de Lutosa e propor uma terminologia para as suas diferentes partes;
- Redescrever o gênero Lutosa, as espécies já conhecidas que ocorrem nas
matas do leste do Estado de São Paulo, Brasil, e descrever novas espécies; - Fornecer uma chave para identificação das espécies;
III. MATERIAIS E MÉTODOS
III. 1. O material de estudo
Espécies de Lutosa e gêneros afins são abundantes e conspícuas no solo e serapilheira as matas do leste do Estado de São Paulo. Facilmente reconhecíveis pelo corpo lustroso e com pilosidade inexpressiva (exceto nos cercos e estilos), mandíbulas fortes e apêndices bucais longos, ausência de asas, pernas alongadas com as tíbias anteriores e medianas possuidoras de fortes esporões, e, sobretudo, pelo grande desenvolvimento do fêmur posterior, tipicamente guarnecido de uma série de linhas oblíquas na sua porção súpero-anterior (figs. 1, 2, 3).
Grande parte dos exemplares estudados já encontrava-se disponível na coleção de insetos da Unesp de Botucatu (UBTU), preservados em álcool 80%. Coletas adicionais foram realizadas nas seguintes localidades: 1- Estação Biológica de Boracéia, Salesópolis; 2- Estação Ecológica de Bananal, Bananal; 3- Cercanias do Distrito de São Francisco Xavier, São José dos Campos.
A espécie-tipo de Lutosa, L. marginalis Walker, 1869, sendo conhecida
apenas por uma fêmea de procedência duvidosa, não foi examinada, posto que seria pouco informativa para a redefinição do gênero. O mesmo se aplica a L.
obliqua F. Walker, 1869, com a agravante de esta ser proveniente do México;
segundo de Mello (informação pessoal), no momento não há base para se supor que Lutosa ocorra nas Américas Central (incluindo-se o Caribe) e do Norte, sendo
membros de outros gêneros. É também o caso, por exemplo, de L. cubensis
(Haan, 1842) e L. azteca (Saussure & Pictet, 1897), do México.
Das espécies que datam do século XIX, L. brasiliensis Brunner Von
Wattenwyl, 1888, embora tendo como holótipo uma fêmea, o macho também foi descrito, ambos provenientes de Teresópolis (RJ). Material obtido por de Mello em coletas prévias na localidade-tipo concordam, sem muita margem para equívoco, com a descrição original. Por essa razão, optou-se pela inclusão dessa espécie no presente estudo, embora não esteja presente no Estado de São Paulo.
III. 2. A área geográfica
Conforme menção acima, à exceção de Lutosa brasiliensis Brunner Von
Wattenwyl, 1888, conhecida da Serra dos Órgãos (Teresópolis, RJ), as espécies aqui tratadas estão representadas por indivíduos provenientes exclusivamente do Estado de São Paulo, com ênfase nas regiões das Serras do Mar e Mantiqueira e os vales do Paraíba e do Ribeira de Iguape. A escolha da área deveu-se a critérios de ordem meramente prática, uma vez que a coleção de insetos do Departamento de Zoologia da Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus de Botucatu, já conta com significativa representação da fauna paulista de Lutosa.
de Botucatu, no mesmo domínio, porém, no Subdomínio dos Chapadões Florestados.
De acordo com a classificação de EITEN (1983), a cobertura vegetal original nas localidades amostradas seria dos seguintes tipos: 1- Floresta Virgem Tropical Perenifólia (encosta marítima da escarpa da Serra do mar e Vale do Ribeira); 2- Floresta Subtropical Mesofítica Latifoliada com Emergentes de Araucária (encosta da escarpa da Serra da Mantiqueira); 3- Floresta Tropical Mesofítica Latifoliada Perenifólia (Vale do Paraíba); 4- Floresta Tropical Mesofítica Latifoliada Semi-decídua (interior do Estado de São Paulo, incluindo-se a região de Botucatu).
III. 3. Métodos de coleta
As coletas consistiram na captura de espécimes à noite, com auxílio de um holofote a gás com iluminador frontal de 500 velas. Os indivíduos encontrados foram capturados com auxílio de um recipiente plástico com cerca de 12cm de altura e 7 cm de diâmetro de boca. Cada espécime coligido foi, então, transferido para um saco plástico (ca. 50cm de altura x 30cm de largura) contendo alguns
ramos com folhas verdes e várias folhas secas grandes, colhidos no local. Esse procedimento permite a manutenção de umidade relativa alta no interior do saco e fornece um substrato para os insetos se fixarem.
microorganismos. Cada armadilha consistia de uma garrafa de plástico de 510ml (altura 21,5 cm X 5,5 cm de diâmetro), com o fundo removido, e enterrada com a tampa para baixo, contendo cerca de 50% de seu volume da referida solução. O emprego de melaço como isca para ensíferos de solo foi sugerido por HUBBELL (1936).
III. 4. Preservação do material
Todos os espécimes coligidos, a exemplo dos já presentes na coleção, foram preservados em álcool 80% e individualizados em tubos de vidro contendo uma etiqueta com os dados de procedência. Genitálias removidas foram acondicionadas em pequenos tubos, também de vidro, e guardadas com o espécime no mesmo fixador.
As seguintes instituições foram escolhidas como repositório de espécimes-tipo: Unesp de Botucatu (UBTU); Museu de Zoologia da Universidade de São Paulo (MZSP); Muséum National d’Histoire Naturelle, Paris (MNHN); The Academy of Natural Sciences of Philadelphia (ANSP).
III. 5. Manutenção em cativeiro
úmida, mas não encharcada, foi colocada nos terrários até uma altura de cerca de 4 cm; uma camada de musgo umedecido (Sphagnum sp, adquirido desidratado
em lojas de jardinagem). Os espécimes receberam água e a mistura alimentar para Orthoptera sugerida por RENTZ (1996) ad libitum.
III. 6. Tipos de caracteres estudados
Os caracteres morfológicos qualitativos foram analisados sob estereomicroscópio e desenhados com o auxílio de câmara clara (vide item III.10.). Os desenhos foram posteriormente repassados para papel vegetal, a lápis, digitalizados em resolução de 300 dpi e trabalhados no programa Adobe Photoshop versão 7.0.1 (não se utilizou tinta Nankin).
Os caracteres quantitativos foram tratados da seguinte forma:
A- Caracteres merísticos
O número de traços oblíquos na face cefálica (externa) do fêmur posterior, tido por GOROCHOV (2001) como um dos caracteres que definem Anostostomatidae e referidos na literatura em língua inglesa como “chevron
ridges”, foram contados sob estereomicroscópio; mesmo os traços pequenos ou
vestigiais foram considerados.
ilustra a posição das linhas convencionadas como DA, DB, VA e VB, ao longo das quais os espinhos e esporões se distribuem.
B- Caracteres morfométricos
Todos os caracteres morfométricos foram mensurados sob estereomicroscópio guarnecido de ocular graduada e posteriormente convertidos a milímetros. São eles (na seqüência em que aparecem na Tabela III, que os quantifica): LC- maior largura da cabeça; DIO- menor distância intra-ocular; CP- comprimento do pronoto ao longo da linha mediano-dorsal; LP- maior largura do pronoto, a nível da margem inferior dos lobos laterais, mensurada do dorso; CFA- comprimento do fêmur anterior; CTA- comprimento da tíbia anterior; CFM- comprimento do fêmur mediano; CTM- comprimento da tíbia mediana; CFP- maior comprimento do fêmur posterior, mensurado pela face cefálica (externa); CTP- comprimento da tíbia posterior; CO- comprimento do ovipositor, mensurado lateralmente, da extremidade da placa subgenital ao ápice da estrutura.
Optou-se, ao longo do texto das descrições, pelos termos “face cefálica” e “face somática” para se referir aos lados normalmente designados como “face interna” e “face externa” dos segmentos das pernas. Como as pernas protorácicas são voltadas para frente e as outras para trás, o lado interno das primeiras corresponde ao externo das demais. Os termos escolhidos eliminam eventuais dúvidas.
As genitálias masculinas, após dissecção, foram tratadas com solução de KOH a 10% em estufa mantida a 40º C por pelo menos 24 horas para a remoção da musculatura. Posteriormente, elas foram lavadas em álcool 80% e acondicionadas em pequenos tubos de vidro tampados com algodão. Todo o material assim preparado foi guardado junto com o espécime do qual foi removido.
III. 8. Terminologia empregada para as estruturas das genitálias
Os termos utilizados por DESUTTER-GRANDCOLAS (2003) foram empregados para os elementos do complexo fálico. No caso específico dos apódemas epifálicos, estruturas não detalhadas por aquela autora, um estudo comparativo acompanhado de uma proposta terminológica para suas diferentes áreas será sugerida no item IV. 1.
III. 9. Elaboração das figuras
IV. RESULTADOS
IV. 1. Estudo dos apódemas epifálicos
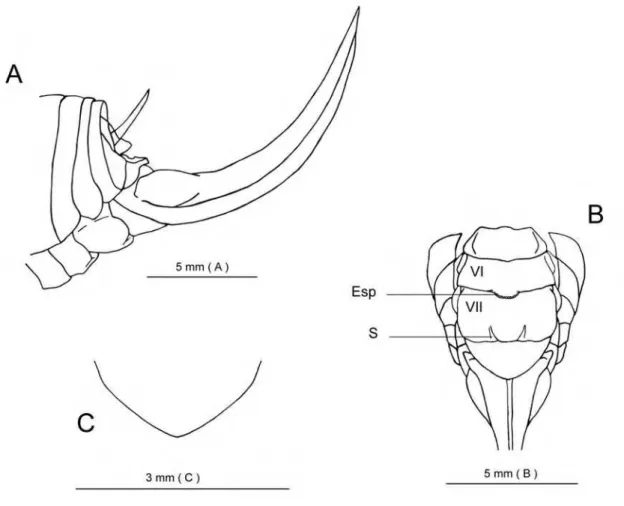
A análise da estrutura dos apódemas epifálicos revelou sua importância para a identificação das espécies e requereu a proposição de uma terminologia e o estabelecimento de certas convenções. Eis os termos propostos, suas formas abreviadas na maneira empregada no presente texto e suas definições (cf. fig. 7):
Área membranófila (A.M)- região do apódema intimamente coberto por uma membrana que tem como limite anterior a linha divisória (vide definição abaixo);
Base da crista (B.Cr)- região sem aspecto raiado situada entre a linha divisória e a área raiada da crista;
Crista (Cr)- refere-se à porção mais marginal da crista, com aspecto raiado;
Linha divisória (L.D)- linha ao longo da qual a membrana que reveste a área membranófila se funde ao corpo do apódema. Nos apódemas do tipo lato (ver definição abaixo), essa linha define o limite entre a região revestida de forma íntima pela membrana (área membranófila) e as regiões livres de membranas (crista e base da crista);
No que concerne à estrutura geral, dois tipos básicos de apódemas epifálicos foram:
1- Tipo bastão (fig. 7A): alongado em maior ou menor grau; área membranófila localizada na região mediana da estrutura e dividindo-a em um pólo interno (base da crista e crista) e um externo, pigmentado, formando uma projeção livre localizada fora dos limites das membranas do complexo fálico. Crista acuminada. Ocorre em L. imitata Levada & Diniz-Filho, 1993; L. normalis
Gorochov, 2001; L. laureae, sp. n. e L. devivoi sp. n.
2- Tipo Semidiscóide (fig. 7B): compleição ampla e não dividida em dois pólos (o apódema todo situa-se no interior do complexo fálico); área membranófila na porção basal da estrutura, delimitada por uma linha divisória nitidamente reentrante; base da crista, e normalmente a crista, ampla, em forma de semidisco. Ocorre em todas as demais espécies examinadas.
IV. 2. Taxonomia
IV. 2. 1. Re-descrições e descrições de novos táxons
LutosaWalker, 1869
= Pherterus Brunner von Wattenwyl, 1888: 282
Espécie-tipo: L. marginalis F. Walker, 1869: 211. Sem localidade de proveniência,
Re-descrição: Coloração predominantemente variando de marrom escuro a avermelhado no dorso; clípeo e labro mais claros, amarelados a quase brancos; palpos e tarsômeros despigmentados; esternitos torácicos e os anteriores do abdome bem mais claros que os tergitos; superfície do corpo lisa, brilhante, quase sem pilosidade. Cabeça: bem mais alta que larga (fig. 2B), lisa, sem regiões com aspecto rugoso; sutura epistomal dividindo a cabeça numa região dorsal e numa ventral de alturas semelhantes; olhos alongados, borda interna sub-reta, externa convexa, região supero-interna totalmente pigmentada ou com uma faixa de omatídeos despigmentados extremamente fina e pouco conspícua; três ocelos grandes e bem definidos; vértice não protuberante (i.e., acompanhando a
distribuição dos esporões ao longo das linhas explicitado na Tabela I; tarsômeros desprovidos de espinhos ou esporões. Perna II: coxa sem espinho; fêmur com o lobo genicular da face cefálica desprovido de espinho, o da face somática com 1 espinho apical; tíbia com o padrão de distribuição de espinhos e esporões ao longo das linhas explicitados na Tabela II; tarsômeros sem espinhos ou esporões. Perna III: coxa sem espinho; fêmur com 9-14 traços oblíquos nos dois terços supero-anteriores da face cefálica (fig. 3E1), lobo genicular da face cefálica com 1 espinho ventral e o da face somática com 1 espinho apical (figs. 3E1,E2), outras áreas do fêmur desarmadas; tíbia com padrão de distribuição de espinhos e esporões como na Tabela II; tarsômeros livres de espinhos ou esporões. Abdome: laterais dos três primeiros tergitos com eventuais granulações esparsas e pouco manifestas, sem semelhança à fileiras ou agrupamentos de dentes associados a qualquer mecanismo abdômino-femoral de estridulação; região médio-dorsal do tergito X do macho com um par de ganchos espiniformes esclerotizados [estrutura chamada de "gin trap" por Brown & Gwynne (1997), Field & Jarman (2001) e
referida como “armadura da placa subgenital”). Complexo fálico (fig. 9): estrutura amplamente membranosa. Pseudo-epifalo ausente. Epifalo restrito à face dorsal, membranoso, desarmado na extremidade posterior e guarnecido de inúmeras pontuações esclerotizadas, todas com base subcircular, mas projetadas na face ventral como pequenos dentes e achatados dorsalmente, face em que servem como pontos para a inserção de feixes musculares; margens laterais do epifalo fundidas com as margens laterais da membrana dorsal do ectofalo formando, com este, uma invaginação epi-ectofálica cuja extremidade anterior é longa e estreita. Membrana dorsal do ectofalo com uma cavidade (invaginação ectofálica) de tamanho variável entre as espécies, guarnecida de dentes ou placas esclerotizadas internamente; região anterior do dorso do ectofalo com inúmeras pontuações semelhantes à do epifalo; extremidade distal da membrana dorsal do ectofalo às vezes projetada para além da margem posterior do epifalo, formando um distinto lobo posterior. Dorso do ducto ejaculatório com ou sem a presença de uma lamela hialina que percorre a estrutura ao longo da linha mediana; vesículas ausentes. Caracteres da fêmea: epiprocto simples, não precedido por área membranosa; paraproctos desarmados; placa subgenital de formato variado e sem armadura; ovipositor globoso na base, em forma de adaga com curvatura variável, fortemente comprimido lateralmente; espermateca com fundo em forma de balão em maior ou menor grau, tal região precedida por um segmento espiralado que varia em número de voltas entre as espécies (i.e. fig. 12G).
Tabelas II, III; Figs. 1 - 3, 8 - 10.
Holótipo fêmea. Brasil, RJ, Teresópolis. Repositório: NMV- Viena. Obs: na descrição original, o autor menciona, erroneamente, o local de proveniência do holótipo como sendo “Theresopolis in província Santa Catharina, Brasiliae”.
Re-descrição. Macho. Coloração geral marrom escura no dorso e laterais do corpo. Cabeça: dorso com uma linha escura curta e pouco nítida saindo de trás de cada olho composto e indo a direção do occipício; contorno do olho composto como na figura 2C; gena mais clara que a região circundante. Pernas: tíbia anterior com tímpano auditivo em ambas as faces. Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior arqueada na metade proximal; esporão superior da linha VA com uma expressiva dilatação na base. Abdome: epiprocto precedido por uma região membranosa pequena e levemente inclinada, sua metade proximal percorrida por um sulco sagital pouco pronunciado (fig. 8B). Paraprocto com armadura bifurcada em "V" fechado; (figs. 8A,B,C). Placa subgenital com região membranosa na base da face ventral (fig. 8E); margem posterior com uma pequena reentrância mediana (fig. 8E); armadura esclerotizada revestida de dentículos, mais robusta e com dentículos maiores na metade externa e mais tênue na interna (figs. 8F,G,H). Complexo fálico (figs. 9A-E): apódema epifálico como na figura 9F; extremidade posterior do dorso do ectofalo medianamente projetada para além da margem distal do epifalo; invaginação ectofálica bem desenvolvida, guarnecida internamente de placas esclerotizadas; ducto ejaculatório sem lamela dorsal.
esclerotizado preto na região central da borda posterior; VII com um par de sulcos paralelos no terço distal; placa subgenital (esternito abdominal VIII) sub-acuminada. Ovipositor como na figura 10A. Base da espermateca grossa e pouco espiralada (fig. 9G).
Material examinado: Brasil, RJ, Teresópolis, Fazenda Vale da Revolta, 21 - 27. ii. 1997, F. A. G. Mello & N. D. Jago leg.: 17 machos, 12 fêmeas, 1 ninfa macho, todos com etiquetas de topotipo. [UBTU]. Repositório: 6 machos, 4 fêmeas [MZSP]; 5 machos, 4 fêmeas [UBTU]; 3 machos, 2 fêmeas [MNHN]; 3 machos, 2 fêmeas [ANSP].
Lutosa tibialisMello & Morselli, sp. n.
Tabelas II, III; Figs. 11 - 13.
Holótipo macho: Brasil, SP, Bananal, Estação Ecológica de Bananal, 22º 48’ 24’ S 44º 22’ 04’’ W, 1.200m de altitude, 13-25. iv. 2004, E. Aguiar leg. [MZSP].
Etimologia: epíteto específico alusivo à tíbia posterior do macho, fortemente arqueada.
porção proximal da face ventral (fig. 11G); margem posterior da placa subgenital, em vista ventral, levemente côncava; armadura esclerotizada com uma pequena reentrância mediana que a divide em dois lotes, as porções voltadas mais ao centro da margem posterior da placa, com um agrupamento de dentículos e na porção mais periférica, com dente único e robusto (figs. 11F,H,I,J). Estilos bem desenvolvidos (figs. 11F,G,H). Complexo fálico: apódema epifálico como na figura 12F; invaginação ectofálica bem desenvolvida, internamente (fig. 12B); ducto ejaculatório com lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos abdominais como na figura 13B; placa subgenital pronunciadamente côncava (fig. 13C). Ovipositor como na figura 13A. Base da espermateca grossa e expressivamente espiralada (fig. 12G).
Material examinado: Brasil, SP, Bananal, Estação Ecológica de Bananal, 13-25. iv. 2004, E. Aguiar
leg., holótipo macho, 19 parátipos machos, 16 parátipos fêmeas, 13 ninfas machos, 5 ninfas
fêmeas. Repositório: Holótipo macho, 6 parátipos machos, 5 parátipos fêmeas [MZSP]; 6 parátipos machos, 5 parátipos fêmeas [UBTU]; 4 parátipos machos, 3 parátipos fêmeas [MNHN]; 3 parátipos machos, 3 parátipos fêmeas [ANSP].
Lutosa eleonoreae Mello & Morselli, sp. n.
Tabelas II, III; Figs. 14 -16.
Holótipo macho: Brasil, SP, Bananal, Estação Ecológica de Bananal, 22º 48’ 24” S 44º 22’ 04” W, 1.200m de altitude, 13-25.iv.2004, E. Aguiar leg. [MZSP].
Etimologia: espécie dedicada à Dra. Eleonora Trajano do Departamento de Zoologia, Instituto de Biociências da Universidade de São Paulo.
olho composto e indo a direção do occipício; região supero-interna da margem do olho composto do macho com curvatura amplamente arredondada (fig. 14A); olho composto totalmente pigmentado; gena mais clara que a região circundante. Pernas: tíbia anterior com tímpano auditivo em ambas as faces. Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior arqueada na metade proximal; esporão superior da linha VA com expressiva dilatação na base. Abdome: epiprocto precedido por uma pequena região membranosa e levemente inclinada (fig. 14C). Paraprocto com armadura bifurcada como nas figuras 14B,C,D. Margem posterior da placa subgenital, quando vista dorsalmente, com concavidade em forma de “V” aberto (fig. 14G); armadura com base larga e pedúnculo curto, formado por dentículos na porção distal (figs. 14E,G,H,I). Estilos desenvolvidos (figs. 14E,F,G,I). Complexo fálico: apódema epifálico como na figura 15F; invaginação ectofálica bem desenvolvida (figs. 15B,D); ducto ejaculatório com lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos abdominais como na figura 16B; borda posterior da placa subgenital da fêmea com distinta concavidade mediana (fig. 16C). Ovipositor como na figura 16 A. Espermateca manifestamente espiralada (fig. 15H).
Material examinado: Brasil, SP, Bananal, Estação Ecológica de Bananal, 13- 25.iv.2004, E. Aguiar
leg., holótipo macho, 10 parátipos machos, 3 parátipos fêmeas. Repositório: Holótipo macho, 4 parátipos machos, 1 parátipo fêmea [MZSP]; 4 parátipos machos, 1 parátipo fêmea [UBTU]; 1parátipo macho, 1 parátipo fêmea [MNHN]; 1 parátipo macho [ANSP].
Lutosa falciformisMello & Morselli, sp.n.
Holótipo macho: Brasil, SP, Bananal, Estação Ecológica de Bananal, 22º 48’ 24” S 44º 22’ 04” W, 1.200m de altitude, 13-25.iv.2004, E. Aguiar leg. [MZSP].
Etimologia: epíteto específico alusivo à armadura da placa subgenital do macho, em forma de foice.
Descrição. Macho. Coloração geral marrom escura no dorso e laterais do corpo. Cabeça: contorno do olho como na figura 17A; olho composto totalmente pigmentado; gena levemente mais clara que a região circundante. Pernas: tíbia anterior com tímpano auditivo em ambas as faces. Tíbia posterior levemente arqueada em sua região proximal. Abdome: epiprocto precedido por uma pequena região membranosa e levemente inclinada (fig. 17C). Armadura do paraprocto em forma de espinhos, voltados para a região dorsal (figs. 17B,C,D). Borda posterior da placa subgenital com pronunciada reentrância em forma de um “V” invertido (figs. 17F,G); ausência de região membranosa na porção proximal da face ventral da placa subgenital; armadura da placa subgenital longa, simples e acentuada (figs. 17E,F,G,H,I). Complexo fálico: apódema epifálico como na figura 18F; invaginação ectofálica bem desenvolvida (figs. 18B,D); ducto ejaculatório sem lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos abdominais como na figura 19B; borda posterior da placa subgenital hiperaguda (fig. 19C). Ovipositor como na figura 19A. Espermateca espiralada (fig. 18G).
Material examinado: Brasil, SP, Bananal, Estação Ecológica de Bananal, 13- 25.iv.2004, E. Aguiar
leg., holótipo macho, 2 parátipos machos, 2 parátipos fêmeas,1 ninfa macho. Repositório: Holótipo
Lutosa carbonelli Mello & Morselli, sp.n.
Tabelas II, III; Figs. 20 - 22.
Holótipo macho: Brasil, SP, Campos do Jordão, Horto Florestal, 05-09.i.199, F.A.G.Mello leg. [MZSP].
Etimologia: espécie dedicada ao ortopterologista uruguaio Carlos Salvador Carbonell.
Descrição.Macho. Coloração geral variando do marrom escuro ao claro, no dorso e laterais do corpo. Cabeça: dorso com uma linha escura e pouco nítida saindo de trás de cada olho composto e indo a direção ao occipício; contorno do olho composto como na figura 20A; gena mais clara que a região circundante. Pernas: tíbia anterior sem tímpano auditivo na face somática (fig. 20B1). Fêmur posterior com espinhos pequenos nos lobos geniculares; tíbia posterior reta. Abdome: epiprocto precedido por uma região membranosa pequena e levemente inclinada. Armadura do paraprocto simples (figs. 20C,D,E). Placa subgenital com região membranosa na porção proximal da face ventral (fig. 20G); borda posterior da placa subgenital com uma pequena projeção ao centro; armaduras da placa subgenital concentradas nas regiões periféricas da margem posterior, e composta por dentículos (figs. 20G,H,I,J). Complexo fálico: apódema epifálico como na figura 21F; invaginação ectofálica bem desenvolvida (figs. 21B,D); ducto ejaculatório com lamela dorsal.
convexa (fig. 22D). Ovipositor como na figura 22A. Espermateca espiralada como na figura 21G.
Material examinado: Brasil, SP, Campos do Jordão, Horto Florestal, 05-09.i.1999, F.A.G. Mello leg.,
holótipo macho, 11 parátipos machos, 13 parátipos fêmeas, 2 ninfas machos,1 ninfa fêmea. Repositório: Holótipo macho, 4 parátipos machos, 5 parátipos fêmeas [MZSP]; 4 parátipos machos, 4 parátipos fêmeas [UBTU]; 2 parátipos machos, 2 parátipos fêmeas [MNHN]; 2 parátipos machos, 2 parátipos fêmeas [ANSP].
Lutosa pseudotibialisMello & Morselli, sp.n.
Tabelas II, III; Figs. 23 - 25.
Holótipo macho: Brasil, SP, São José dos Campos, Distrito de São Francisco Xavier, 1.400m de altitude, 08-12.xii.2004, M.P. Bolfarini leg. [MZSP].
Etimologia: epíteto específico alusivo à semelhança morfológica desta espécie comL. tibialis, n. sp., ambas com a tíbia posterior do macho fortemente arqueada.
mais periférica, com dente único (figs. 23F,H,I,J). Estilos bem desenvolvidos. Complexo fálico: apódema epifálico como na figura 24F; invaginação ectofálica bem desenvolvida (figs. 24B,D); ducto ejaculatório com lamela dorsal.
Fêmea: Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos abdominais como na figura 25B; placa subgenital com pequena concavidade mediana (fig. 25C). Ovipositor como na figura 25A. Espermateca espiralada (fig. 24G).
Material examinado: Brasil, SP, São José dos Campos, Distrito de São Francisco Xavier, 1.400m de altitude, 08-12.xii.2004, M.P. Bolfarini leg., holótipo macho, 188 parátipos machos, 148
parátipos fêmeas, 91 ninfas machos, 65 ninfas fêmeas. Repositório: Holótipo macho, 70 parátipos machos, 60 parátipos fêmeas [MZSP]; 70 parátipos machos, 50 parátipos fêmeas [UBTU]; 30 parátipos machos, 20 parátipos fêmeas [MNHN]; 18 parátipos machos, 18 parátipos fêmeas [ANSP].
Lutosa gorochoviMello & Morselli, sp.n.
Tabelas II, III; Figs. 26 - 28.
Holótipo macho: Brasil, SP, São José dos Campos, Distrito de São Francisco Xavier, 1.400m de altitude, 08-12.xii.2004, M.P. Bolfarini leg. [MZSP].
Etimologia: espécie dedicada ao ortopterologista russo Andrej V. Gorochov.
auditivo. Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior reta. Abdome: epiprocto precedido por uma região membranosa pequena e levemente inclinada (fig. 26D). Paraprocto com armadura trifurcada (figs. 26C,D,E). Placa subgenital com região membranosa pouco nítida na porção proximal da face ventral (fig. 26G); margem posterior da placa subgenital em forma de um “V” aberto e invertido (figs. 26G,H); armadura esclerotizada curta e revestida de dentículos (figs. 26H,J). Estilos bem desenvolvidos (figs. 26F,J). Complexo fálico: apódema epifálico como na figura 27F; invaginação ectofálica bem desenvolvida (figs. 27BD); ducto ejaculatório com lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: Esternitos abdominais como na figura 28B; borda posterior da placa subgenital amplamente arredondada, porém, com um pequeno acume mediano (fig. 28C). Ovipositor como na figura 28A. Base da espermateca espiralada (fig. 27G).
Material examinado: Brasil, SP, São José dos Campos, Distrito de São Francisco Xavier, 1.400m de altitude, 08-12.xii.2004, M.P. Bolfarini leg., holótipo macho, 29 parátipos machos, 16 parátipos fêmeas, 3 ninfas machos, 3 ninfas fêmeas. Repositório: Holótipo macho, 10 parátipos machos, 6 parátipos fêmeas [MZSP]; 10 parátipos machos, 6 parátipos fêmeas [UBTU]; 5 parátipos machos, 2 parátipos fêmeas [MNHN]; 4 parátipos machos, 2 parátipos fêmeas [ANSP].
Lutosa picinguabensisMello & Morselli, sp.n.
Tabelas II, III; Figs. 29 - 31.
Holótipo macho: Brasil, SP, Ubatuba, Picinguaba, 13-16.x.1994, F.A.G. Mello - N. Carneiroleg. [MZSP].
Descrição.Macho. Coloração geral marrom no dorso e laterais do corpo. Cabeça: dorso com uma linha escura curta saindo de trás de cada olho composto e indo a direção do occipício; região supero-interna da margem do olho composto do macho com curvatura mamelonar (fig. 29A); gena mais clara que a região circundante. Pernas: tíbia anterior com tímpano auditivo em ambas as faces. Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior arqueada na metade proximal; esporão superior da linha VA com uma expressiva dilatação na base. Abdome: epiprocto precedido por uma região membranosa pequena e levemente inclinada, sua metade proximal percorrida por um sulco sagital pouco pronunciado (fig. 29C). Paraprocto com armadura bifurcada (figs. 29B,C,D). Margem posterior da placa subgenital do macho, quando vista dorsalmente, com a região mediana sub-reta (fig. 29G); armadura esclerotizada curta, dividida por uma reentrância e formada por dentículos (figs. 29E,G,H,I). Complexo fálico: apódema epifálico como na figura 30F; invaginação ectofálica bem desenvolvida (figs. 30B,D); ducto ejaculatório com lamela dorsal. Fêmea. Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos abdominais como na figura 31B; borda posterior da placa subgenital da fêmea convexa na região mediana (fig. 31C). Ovipositor como na figura 31A. Espermateca pouco espiralada (fig. 30H).
Lutosa scaveniusiMello & Morselli, sp.n.
Tabelas II, III; Figs. 32 - 34.
Holótipo macho: Brasil, SP, São Luiz da Paraitinga, Parque Estadual da Serra do Mar, Núcleo Santa Virgínia, 23º 21’ S // 45º 11’ W, 10-12.x.1996, F.A.G. Mello- A.S. Jim leg. [MZSP].
Etimologia: espécie dedicada ao Dr. Hans Scavenius, proprietário da Fazenda Capricórnio, Ubatuba, SP.
Descrição.Macho. Coloração geral marrom escura, tendendo ao marrom claro no dorso e laterais do corpo. Cabeça: dorso com uma linha escura curta e pouco nítida saindo de trás de cada olho composto e indo a direção do occipício; contorno do olho composto como na figura 32A; gena mais clara que a região circundante. Pernas: tíbia anterior com tímpano auditivo em ambas as faces. Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior levemente arqueada na metade proximal; esporão superior da linha VA com uma expressiva dilatação na base. Abdome: epiprocto precedido por uma região membranosa pequena e levemente inclinada (fig. 32C). Armadura do paraprocto longa e estreita, com polimorfismo intra-populacional, com dois ou três espinhos (figs. 32D1,D2). Placa subgenital com região membranosa na porção proximal da face ventral (fig. 32F); margem posterior da placa subgenital, em vista ventral, semi-reta e levemente convexa no centro, em vista posterior, com acentuada depressão em forma de “U“ (fig. 32H); armadura esclerotizada prolongada revestida de dentículos em sua porção distal (figs. 32E,G,H,I). Complexo fálico: apódema epifálico como na figura 33F; invaginação ectofálica bem desenvolvida (figs. 33BD); ducto ejaculatório com lamela dorsal.
entre levemente côncava (fig. 34C) ou arredondada (fig. 34D). Ovipositor como na figura 34A. Espermateca como na figura 33G.
Material examinado. Brasil, SP: São Luiz da Paraitinga, Parque Estadual da Serra do Mar, Núcleo Santa Virgínia, 23º 21’ S // 45º 11’ W, 10-12.x.1996, F.A.G. Mello - A.S. Jim leg., holótipo macho, 3
parátipos machos, 7 parátipos fêmeas; Ubatuba, Fazenda Capricórnio, 15-21.iv.2004, F.A.G. Mello
leg., 3 parátipos machos, 8 parátipos fêmeas. Repositório: Holótipo macho, 2 parátipos machos, 3 parátipos fêmeas [MZSP]; 2 parátipos machos, 2 parátipos fêmeas [UBTU]; 1 parátipo macho, 1 parátipo fêmea [MNHN]; 1 parátipo macho, 1 parátipo fêmea [ANSP].
Lutosa caraguata Mello & Morselli, sp. n. Tabelas II, III; Figs. 35 - 37.
Holótipo macho: Brasil, SP, Caraguatatuba, Cachoeira do Cantagalo,100m altitude, 13-14.x.2005, M.P. Bolfarini leg. [MZSP].
Etimologia: epíteto específico é corruptela de Caraguatatuba, município de proveniência dos espécimes-tipo; no idioma Tupi-Guarani, caraguatá é um tipo de bromeliácea.
(figs. 35E,G,H,I). Complexo fálico: apódema epifálico como na figura 36F; invaginação ectofálica bem desenvolvida (figs. 36B,D,G); ducto ejaculatório com lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos como na figura 37B; placa subgenital como na figura 37C. Ovipositor como na figura 37A. Espermateca espiralada (fig. 36H).
Material examinado: Brasil, SP, Caraguatatuba, trilha da Cachoeira do Cantagalo,100m altitude, 13-14.x.2005, F.A.G. Mello- M.P. Bolfarini leg., holótipo macho, 12 parátipos machos, 2 parátipos fêmeas. Repositório: Holótipo macho, 4 parátipos machos, 1 parátipo fêmea [MZSP]; 4 parátipos machos, 1 parátipo fêmea [UBTU]; 2 parátipos machos [MNHN]; 2 parátipos machos [ANSP].
Lutosa serramarana Mello & Morselli, sp.n.
Tabelas II, III; Figs. 38 - 40.
Holótipo macho: Brasil, SP, Salesópolis, Estação Biológica de Boracéia, 02-08.iv.2004, F.A.G. Mello - J.P. Morselli leg. [MZSP].
Etimologia: epíteto específico alusivo à Serra do Mar.
subgenital com margem posterior como na figura 38F; armadura esclerotizada prolongada e revestida de dentículos em sua porção distal (figs. 38E,G,H,I). Complexo fálico: apódema epifálico como na figura 39F; invaginação ectofálica bem desenvolvida (figs. 39B,D,G); ducto ejaculatório com lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: tíbia posterior reta. Esternitos abdominais como na figura 40B; placa subgenital com margem posterior arredondada (fig. 40C). Ovipositor como na figura 40A. Espermateca espiralada (fig. 39H).
Material examinado. Brasil, SP: São Sebastião , Barra do Una - v.2000, G. Skuk - D. Pavan leg., 2 parátipos machos, 2 parátipos fêmeas; Salesópolis, Estação Biológica de Boracéia, 02-08.iv.2004, F.A.G. Mello- J.P. Morselli leg., holótipo macho, 42 parátipos machos, 41 parátipos fêmeas, 7
ninfas machos, 11 ninfas fêmeas. Repositório: Holótipo macho, 18 parátipos machos, 18 parátipos fêmeas [MZSP]; 16 parátipos machos, 16 parátipos fêmeas [UBTU]; 5 parátipos machos, 5 parátipos fêmeas [MNHN]; 5 parátipos machos, 4 parátipos fêmeas [ANSP].
Lutosa casariaeMello & Morselli, sp.n.
Tabelas II, III; Figs. 41 - 43.
Holótipo macho: Brasil, SP, Salesópolis, Estação Biológica de Boracéia, 09-16.iv.1999, F.A.G. Mello - J.P. Morselli leg. [MZSP].
Etimologia: espécie dedicada à coleopterologista Sônia A. Casari, do Museu de Zoologia da Universidade de São Paulo.
clara que a região circundante. Pernas: tíbia anterior com tímpano auditivo em ambas as faces. Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior reta. Abdome: epiprocto precedido por uma região membranosa pequena e levemente inclinada, sua metade proximal percorrida por um sulco sagital pouco pronunciado (fig. 41C). Paraprocto com armadura bifurcada (figs. 41B,C,D). Placa subgenital com região membranosa na porção proximal da face ventral; margem posterior da placa subgenital como na figura 41F; armadura da placa subgenital esclerotizada com uma reentrância dividindo-a em dois lotes sub-iguais (figs. 41G,H,I). Estilos desenvolvidos (fig. 41E). Complexo fálico: apódema epifálico como na figura 42F; invaginação ectofálica bem desenvolvida (figs. 42B,D); ducto ejaculatório com lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: Esternitos abdominais como na figura 43B; borda posterior da placa subgenital distintamente acuminada (fig. 43C). Ovipositor em arco fechado como na figura 43A. Espermateca espiralada (fig. 42G).
Material examinado: Brasil, SP, Salesópolis, Estação Biológica de Boracéia, 09-16.iv.1999, F.A.G. Mello- J.P. Morselli leg., holótipo macho, 2 parátipos machos, 6 parátipos fêmeas. Repositório: Holótipo macho, 1 parátipo macho, 2 parátipos fêmeas [MZSP]; 1 parátipo macho, 2 parátipos fêmeas [UBTU]; 1parátipo fêmea [MNHN]; 1 parátipo fêmea [ANSP].
Lutosa devivoi Mello & Morselli, sp.n.
Tabelas II, III; Figs. 44 - 46.
Etimologia: espécie dedicada ao mastozoologista Mario de Vivo, do Museu de Zoologia da Universidade de São Paulo.
Descrição.Macho. Coloração geral marrom escura no dorso e laterais do corpo. Cabeça: dorso com uma linha escura curta e pouco nítida saindo de trás de cada olho composto e indo a direção do occipício; contorno do olho composto como na figura 44A; gena mais clara que a região circundante. Pernas: tíbia anterior sem tímpano auditivo em ambas as faces (figs. 44B). Fêmur posterior com um espinho em apenas um dos lobos geniculares (linha VA). Abdome: epiprocto precedido por uma grande região membranosa (figs. 44C,D). Paraprocto com armadura espiniforme (figs. 44C,D,E). Placa subgenital com borda posterior côncava (figs. 44G,H); armadura pouco esclerotizada formada por um pequena calosidade com dentículos na região superior (figs. 44H,I,J). Estilos pequenos. Complexo fálico: apódema epifálico como na figura 45F; invaginação ectofálica pouco desenvolvida (figs. 45B,D); ducto ejaculatório sem lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: Fêmur posterior com ausência de espinhos em ambos os lobos geniculares. Esternitos abdominais como na figura 46B; placa subgenital (esternito abdominal VIII) pronunciadamente convexa. Ovipositor como na figura 46A. Espermateca grossa e pouco espiralada (fig.45G).
Lutosa normalis Gorochov, 2001.
Tabelas II, III; Figs. 47 - 52.
Holótipo macho: Brasil, SP, Salesópolis, Estação Biológica de Boracéia, 09- 16.i.1999, F.A.G. Mello leg. [MZSP].
margem posterior convexa. Ovipositor como na figura 52A. Espermateca não espiralada (fig. 51G).
Material examinado. Brasil, SP: Caraguatatuba, Hípica do Hotel Tabatinga, viii.1991, F.A.G. Mello
leg., 3 machos, 2 fêmeas; São Sebastião, próximo ao CEBIMAR-USP, vii.1991, F.A.G. Mello, leg.,
7 machos, 7 fêmeas; Salesópolis, Estação Biológica de Boracéia, 09-16.i.1999, F.A.G.Mello leg., macho, 20 machos, 44 fêmeas, 1 ninfa macho, 1 ninfa fêmea; Bertioga, Guaratuba, Costa do Sol, Fazenda Três Marias, 28.ix.1995, F.A.G. Mello leg.; 3 machos, 13 fêmeas.
Os seguintes espécimes foram enviados para as respectivas instituições: 14 machos, 30 fêmeas [MZSP]; 3 machos, 3 fêmeas [MNHN]; 3 machos, 3 fêmeas [ANSP]; 13 machos e 30 fêmeas [UBTU].
Lutosa laureaeMello & Morselli, sp. n.
Tabelas II, III; Figs. 53 - 55.
Holótipo macho: Brasil, SP, Iporanga, 24º 32’ 06”S // 48º 42’09”W, 09 - 21.xi.1995, F.A.G. Mello- N.Carneiro leg. [MZSP].
Etimologia: espécie dedicada à ortopterologista francesa Laure Desutter-Grandcolas.
esclerotizada, ausência de dentículos (figs. 53G,H,I). Estilos pequenos. Complexo fálico: apódema epifálico como na figura 54F; epifalo curto em relação à borda posterior do ectofalo, deixando grande parte do dorso do ectofalo descoberta (fig. 54A); invaginação ectofálica pouco desenvolvida (figs. 54B,D); ducto ejaculatório sem lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: esternitos abdominais como na figura 55B; placa subgenital (esternito abdominal VIII) tendendo à acuminada (fig. 55C). Ovipositor como na figura 55A. Espermateca não espiralada (fig. 54G).
Material examinado. Brasil, SP: Eldorado Paulista, 10-12.xi.1989, F.A.G. Mello, leg., 1 parátipo macho, 3 parátipos fêmeas. Iporanga, 24º 32’ 06” S // 48º 42’ 09” W, 09-21.xi.1995, F.A.G. Mello- N.Carneiro leg., holótipo macho, 7 parátipos machos, 11 parátipos fêmeas, 5 ninfas machos, 5
ninfas fêmeas. Repositório: Holótipo macho, 3 parátipos machos, 5 parátipos fêmeas [MZSP]; 3 parátipos machos, 5 parátipos fêmeas [UBTU]; 1 parátipos machos, 2 parátipos fêmeas [MNHN]; 1 parátipos machos, 2 parátipos fêmeas [ANSP].
Lutosa imitata Levada & Diniz-Filho, 1993
Tabelas II, III; Figs. 56 - 59.
Holótipo macho. Brasil, SP: Cananéia, Bairro Itapitangui, 15-30.vii.1994, F.A.G. Melloleg. [MZSP].
tímpano auditivo em ambas as faces (figs. 56C,D). Fêmur posterior com um espinho em cada um dos lobos geniculares; tíbia posterior reta. Abdome: epiprocto precedido por uma grande região membranosa e vertical (fig. 57B). Paraprocto com armadura curta e espiniforme (figs. 57A.B,C). Placa subgenital com margem posterior sinuosa (fig. 57E); armadura reduzida e pouca esclerotizada, sem dentículos (figs. 57F,G,H). Estilos pequenos. Complexo fálico: apódema epifálico como na figura 58F; invaginação ectofálica pouco desenvolvida (figs. 58B,D); ducto ejaculatório sem lamela dorsal.
Fêmea. Semelhante ao macho, com as seguintes diferenças: esternitos abdominais como na figura 59B; placa subgenital (esternito abdominal VIII) como na figura 59C. Ovipositor como na figura 59A. Espermateca não espiralada (fig. 58G).
Material examinado: Brasil, SP: São Paulo, Parque Estadual da Cantareira, Núcleo Pedra Grande, x.2000, C.C. Aires, leg., 2 machos, 1 fêmea; Itariri, viii.1991, F.A.G. Mello leg., 1 macho, 4 fêmeas;
Peruibe, Estação Ecológica da Juréia - Itatins, Base Perequê, 24º 22' 72" S // 47º 04' 72" W , 9-21.xi.1995, F.A.G. Mello - N. Carneiro, leg., 4 machos e 1 fêmea; Tapiraí, Trilha da Cachoeira do Chá, 28-31.i.1997., F.A.G. Mello, leg., 9 machos, 10 fêmeas; Miracatu, Fazenda Itereí, ix.2001, A.D. Brescovit leg., 1 macho, 3 fêmeas; Cananéia, Bairro Itapitangui,15-30.vii.1994, F.A.G. Mello leg., 9 machos, 9 fêmeas; Ilha de Cananéia, 15-30.vii.1994, F.A.G. Mello, leg. 4 machos, 3 fêmeas;
Botucatu, Fazenda Lageado, 01-xii.1995, F.A.G. Mello, leg., 1 macho, 3 fêmeas; Apiaí, Morro do Ouro, viii.1991, F.A.G. Mello, leg. , 3 machos, 1 fêmea.
Os espécimes foram enviados para as seguintes instituições: 17 machos, 12 fêmeas [MZSP]; 4 machos, 4 fêmeas [MNHN]; 3 machos, 4 fêmeas [ANSP]; 10 machos e 12 fêmeas [UBTU].
IV. 2. 2. Classificação das espécies de Lutosa
Grupo Brasiliensis
Definição: paraprocto do macho precedido por pequena área membranosa; armadura da placa subgenital de forma variada e esclerotizada; apódema epifálico semi-discóide; invaginação ectofálica bem desenvolvida (fig. 9B), internamente guarnecida de placas alongadas fortemente esclerotizadas; base da espermateca manifestamente convoluta.
Elenco: L. brasiliensis Brunner Von Wattenwyl, 1888; L. tibialis, sp.n. ; L.
eleonoreae, sp.n. ; L. falciformis, sp.n. ; L. carbonelli, sp.n. ; L. pseudotibialis, sp.n.
; L. gorochovi, sp.n. ; L. picinguabensis, sp.n. ; L. scaveniusi, sp.n. ; L. caraguata,
sp.n. ; L. serramarana, sp.n. ; L. casariae, sp.n..
Grupo Imitata
Definição: paraprocto do macho precedido por ampla membrana; armadura da placa subgenital na forma de uma pequena calosidade pouco ou não esclerotizada; apódema epifálico alongado; invaginação ectofálica pequena (figs. 45B,F), revestida internamente apenas com pontuações esclerotizadas (sem placas); base da espermateca pouco ou nada espiralada.
Elenco: L. imitata Levada & Diniz-Filho, 1993; L. normalis Gorochov, 2001b; L.
devivoi, sp. n.; L. laureae, sp. n..
1- Armadura da placa subgenital na forma de uma pequena calosidade pouco ou não esclerotizada; apódema epifálico alongado, invaginação ectofálica pequena (figs. 45B,F). Base da espermateca pouco ou nada espiralada (Grupo Imitata) --- 2
1’- Armadura da placa subgenital de forma variada e esclerotizada; apódema epifálico semi-discóide, invaginação ectofálica bem desenvolvida (fig.9B). Base da espermateca manifestamente convoluta (Grupo Brasiliensis)--- 5
2 (1)- Tímpanos auditivos ausentes; borda posterior da placa subgenital do macho côncava --- L. devivoi, sp. n.
2’- Tímpanos auditivos presentes; borda posterior da placa subgenital do macho com diferente conformação --- 3
3 (2’)- Razão do comprimento pela largura do olho composto maior que 1,50; armadura do paraprocto alongada, em forma de gancho (figs. 50B,C) --- 4
3’- Razão do comprimento pela largura do olho composto menor que 1,50; armadura do paraprocto curta, espiniforme, não em forma de gancho (figs. 56C,D) --- L. imitata Levada & Diniz-Filho, 1993
e não esclerotizada; epifalo relativamente longo em relação à borda posterior do ectofalo, deixando pequena parte do dorso do ectofalo descoberta (fig. 51A); ápices dos lobos ventrais do complexo fálico curtos, quase totalmente cobertos pela borda posterior do ectofalo (fig. 51A). Margem posterior da placa subgenital da fêmea amplamente arredondada (fig. 52C); ovipositor em arco fechado (fig. 52A) --- L. normalis Gorochov, 2001
4’- Placa subgenital do macho com margem posterior levemente convexa, com pequena reentrância na região mediana (fig. 53F); armadura na forma de uma pequena calosidade pouco manifesta(fig. 53G,I); epifalo curto em relação à borda posterior do ectofalo, deixando grande parte do dorso do ectofalo descoberta (fig. 54A); ápices dos lobos ventrais do complexo fálico projetando-se para além da borda posterior do ectofalo (fig. 54A). Margem posterior da placa subgenital da fêmea tendendo á acuminada (fig. 55C); ovipositor em arco aberto (fig. 55A) --- L. laureae, sp. n
5 (1’)- Armadura da placa subgenital do macho, em vista lateral, em forma de espinho (fig.11F) ---6
5’- De outra forma --- 8
posterior da placa subgenital da fêmea hiperaguda; ausência de lamela dorsal no ducto ejaculatório; apódema epifálico com forma incomum (fig. 18F)---L. falciformis, sp. n.
6’ (5)- Tíbia da perna posterior manifestamente arqueada (fig. 11B); armadura da placa subgenital do macho curta e com reentrância mediana (figs. 11H,J; 23H,J). Borda posterior da placa subgenital da fêmea côncava; presença de lamela dorsal no ducto ejaculatório; apódema epifálico maior --- 7
7(6)- Armadura do paraprocto bifurcada (fig. 11C,D,E). Placa subgenital da fêmea pronunciadamente côncava --- L. tibialis, sp. n.
7’- Armadura do paraprocto não bifurcada (figs. 23C,D,E). Placa subgenital da fêmea com pequena concavidade mediana --- L. pseudotibialis, sp.n.
8 (5)- Armadura do paraprocto simples (figs. 20D,E) ou bifurcada em "V" fechado (figs. 8B,C) --- 9
8’- Armadura do paraprocto bifurcada em “V” aberto (às vezes com os braços oponíveis) ou trifurcada (figs. 26C,D) --- 10
uma pequena projeção ao centro (fig. 20G); apódema epifálico bem desenvolvido; ducto ejaculatório com lamela dorsal (fig. 21B). Borda posterior da placa subgenital da fêmea sinuosa ou convexa (variação intra-populacional; figs. 22C,D) --- L. carbonelli, sp. n.
9’- Contorno do olho composto do macho conforme ilustrado na figura 2C; tímpano auditivo em ambas as faces da tíbia anterior; armadura do paraprocto bifurcada em "V" fechado; borda posterior da placa subgenital do macho, em vista ventral, com pequena reentrância mediana (fig. 8E); ducto ejaculatório sem lamela dorsal; apódema epifálico pequeno. Borda posterior da placa subgenital da fêmea sub-acuminada (fig. 10C) ---L. brasiliensis Brunner Von Wattenwyl, 1888
10 (8’)- Tíbia posterior do macho reta, com a área que circunda os esporões da linha VA com não dilatada --- 11
10’- Tíbia posterior do macho curva em maior ou menor grau, com a área que circunda os esporões da linha VA dilatada (sobretudo ao redor do esporão superior) --- 12
"V" aberto. Borda posterior da placa subgenital da fêmea amplamente arredondada, porém, com um pequeno acume mediano (fig. 28C); --- L. gorochovi, sp.n.
11’- Armadura do paraprocto bifurcada (figs. 41A,C,D); armadura da placa subgenital do macho com uma reentrância que a divide em dois lotes (fig. 41I); borda posterior da placa, quando em vista ventral, como na figura 41F. Borda posterior da placa subgenital da fêmea distintamente acuminada (fig. 43C) --- L. casariae, sp.n.
12 (10’)- Armadura do paraprocto com base não nitidamente maciça e os espinhos que compõem a bifurcação, não distintamente oponíveis; armadura da placa subgenital do macho, quando vista dorsalmente, com base ampla, não pedunculada (figs. 14G,I) ou como na figura 29G,I --- 13
12’- Armadura do paraprocto com base maciça e os elementos da bifurcação oponíveis (exceto L. scaveniusi); armadura da placa subgenital do macho,
quando vista dorsalmente, com base estreita, pedunculada (figs. 38G,I) ----14
como na figura 30F. Borda posterior da placa subgenital da fêmea convexa na região mediana (fig. 31C) --- L. picinguabensis, sp. n.
13’- Região supero-interna da margem do olho composto do macho com curvatura amplamente arredondada (fig. 14A); borda posterior da placa subgenital do macho, quando vista dorsalmente, com concavidade em forma de “V” aberto (fig. 14G); armadura da placa subgenital sem reentrância (fig. 14I); apódema epifálico como na figura 15F. Borda posterior da placa subgenital da fêmea com distinta concavidade mediana (fig. 16C) --- L. eleonorae, sp. n.
14- Presença de uma área membranosa distinta na região mediano-proximal da placa subgenital do macho (figs. 32F, 35F); razão do comprimento pela altura (externa) do estilo cerca maior que 2,9 --- 15
14’- Placa subgenital do macho sem área membranosa; razão do comprimento pela altura (externa) do estilo cerca de 2,75 --- L. serramarana, sp. n.
15- Armadura do paraprocto longa e estreita, com dois ou três espinhos (polimorfismo intra-populacional; figs. 32 D1, D2); borda superior da placa subgenital, em vista posterior, com acentuada depressão em forma de “U “ (fig. 32H) --- L. scaveniusi, sp. n.