UNIVERSIDADE DE SÃO PAULO INSTITUTO DE GEOCIÊNCIAS
A oRtGEM NATURAL DA
poLutçÃo
poR
cRoMo
No AQUíFERo ADAMANTINA, MUNtcíPto DEunÂnn
1se¡Marta Lúcia Nunes Almodovar
Orientador: Prof. Dr. Ricardo César Aoki Hirata
TESE DE DOUTORAMENTO
DEDALUS-Acervo-IGC
I Iilil |ilil ilill llil llil llil llil llil llil llill llll lil lll
3090001 6321
Programa de Pós-Graduação em Recursos Minerais e Hidrogeologia
São Paulo 2000
ANEXOS FIGURAS TABELAS
LISTA DE ABREVIATURAS E SIGLAS UTILIZADAS NO TEXTO RESUMO
ABSTRACT
AGRADECIMENTOS
1.INTRODUçÃO
1.1. RELEVÂNCIA DO TEMA 1.2. OBJETIVOS
SUMÁRIO
2.
O
CROMO NA NATUREZA
2.1. GENERALIDADES2.2. O CROMO NOS SOLOS 2.2.1. Cromo (lll)
2.2.2. Cromo (Vl)
2.2.3. Oxidação e redução
2.2.4. Ocsrrência e comportamento dos óxidos de manganês no
solo
2.3. OCR0M0
r,¡os MINERAI$2.4. O CROMO NAS ÁGUAS 2.4.1. Geoquímica do cromo
2.4.1 .1 . Solubilidade do cromo como função do pH e Eh
2.4.1 .2. Adsorçäo
2.4.1 .3. Agentes redutores
3.
ÁREA
DE
ESTUDO
3.1. LOCALIZAçÃO E VIAS DE ACESSO 3.2. ASPECTOS FISIOCLIMATOLÓGICOS 3.3. GEOLOGIA
3.3.1. Grupo São Bento
vi
viii
ix
X
xi
xii
1
1
2
J
3
4
5
Ã
6 6
7
I
10
10
12
14
16
16 16
19
3.3.1.1, Formação Serra Geral 3.3.2. Grupo Bauru
3.3.2.1. Formação Adamantina 3.3.3. Goberturas cenozóicas 3.4. HIDROGEOLOGIA
3.4.1. Principais aquíferos da regiãc
3.4.1 .1. Aquífero Serra Geral 3.4.1.2. Sistema Aquífero Bauru
3.4.2. Características hidroquímicas 3.4.2.1. Aquífero Serra Geral
3.4.2.2. Sistema Aquífero Bauru
4
MATERIAL
E MÉTODO
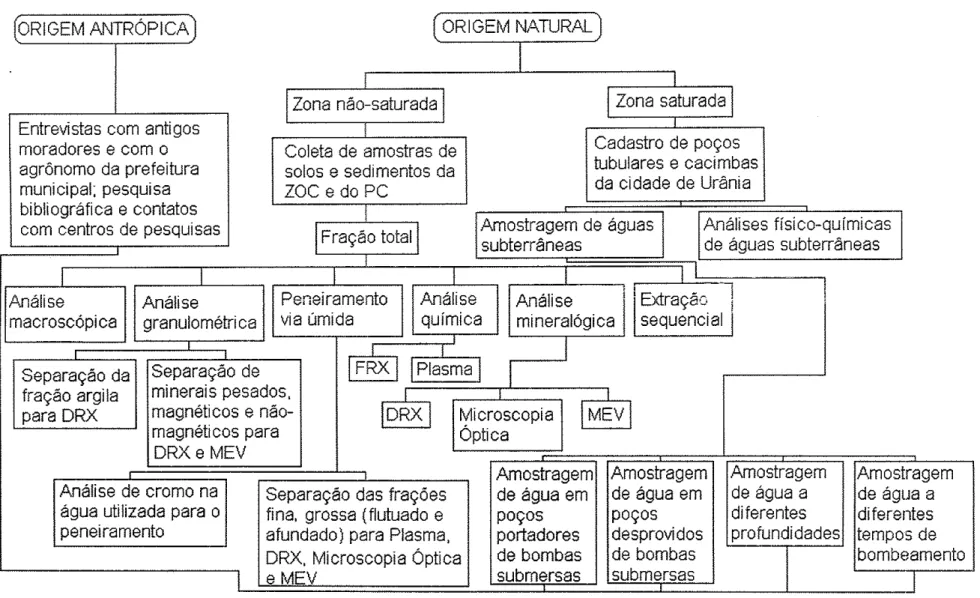
4.1. ORIGEM ANTRÓPICA 4.2. ORIGEM NATURAL
4.2.1. Enriquecimento da água por cromo na zona não-saturada 4.2.1.1.Coleta de amostras de solos e sedimentos da ZOC e do PC
a.
Análise macroscópica b. Análise granulornétricab.1. Separação da fração argila para Difração de Raios X (DRX) b.2. Separação de minerais pesados magnéticos
e
não-magnéticos para DRX e Microscopia Eletrônica de Varredura (MEV)c. Peneiramento via úmida e separação de minerais pesados
c.1. Separação
das
frações fina, grossa (flutuado e afundado) para |CP-AES, DRX, Microscopia Ôptica e MEVd. Análise química d.1. FRX
d.2. tcP-AES
e. Anétlise mineralógica e.1. DRX
e.2. Microscopia Óptica e.3. MEV
f. Extração Sequencial
21
23 24
26 27
27
28
29
30 30
31
33
aa
35
35
36
3B
âo
39
20
40
40
41
42
4.2.2. Enriquecimento da água por cromo na zona saturada
4.2.2.1 . Cadastro de poços tubulares e cacimbas
a. Amostragem de aguas subterrâneas
a.1 . Amostragem de (:gua em poços portadores de bombas submersas
a.2. Amostragem de água em poços desprovidos de bombas submersas a.3. Amostragem de água a diferentes ¡trofundidades
a.4. Amostragem de água a diferentes tempos de bombeamento b. Analises físico-químicas de águas suhterrâneas
c. Análise dos resu/fados obtidos para a zona saturada
5. DISCUSSÃO NOS
RESULTA,ÐÜS
5.1. ORIGEM ANTRÓPICA 5,2. ORIGEM NATURAL
5.2.1. Enriquec¡mento da água por cromo na zona não-saturada a. Análise macroscópica
b. Análise granulométrica
c. Análise de cromo na água utilizada para a peneiramento via Úmida
d. Análise química d.1.ICP-AES
d.1.1. Compoftamento dos e/emenfos maiores, menores e traços ao longo do peñil de alteração do solo (fração total)
d.1 .2. Elementos malores, menores e fraços (frações fina e grossa
-flutuado e afundado)
e. An ál i se Mi neralógica
e.1. DRX
e.2. Microscopia Ôptica e.3. MEV
f. Corretações
entre
composiçãoquímica
do
solo,
sedimento e mineralogiag. Extração Sequencial
h. Sinfese dos resu/fados da zona não-saturada
5"2,2. Enriquecimento da água por cromo na zona saturada a. Cadastro de poços tubulares e cacimbas
b. Modelo Conceituat de Circutação das Aguas Subterrâneas
50
50
51
51
52 52
Êa
53 54
57
57 60 60
60
61
62,
63 63
65
70
IJ
73 76
76
79
BO
82
B5
c. Class¡f¡cação das águas subterrâneas
d. Paràmetros físico-quimicos analisados nas aguas subterråneas e. Distribuição
do
cromo
nas águas subterrâneas em relação ao tempo e espaÇof. Amostragem de étguas a diferentes profundidades
g. Amostragem de águas a diferentes tempos de bombeamento
h. Corre I ação ag u a-roch a
r- Sinfese dos resu/faclos da zona saturada
6. CONCLUSÖES
7. REFERÊi\CIAS BIBLIOGRÁFICAS
89
B9
94
9B
9B
105
110
112
ANEXOS
Anexo
l:
Descrição litológica do materjal coletado durante a perfuração do poço cacimbaAnexo 2: Cadastro de pontos de água da cidade de Urânia
Anexo 3: Descrição da análise macroscó¡rica de amostras de solos e
sedimentos de Urânia
Anexo 4: Resultados das análises granulométricas
Anexo 5: Resultados das análises químicas de solos
e
sedimentos coletados na ZOC e no poço cacimbaAnexo 6: Análise estatística de solos da ZOC, solos e sedimentos do
poço cacimba
e
águas dos poços tubulares da Sabesp, tubulares particulares e cacimbasAnexo 7: Resultados da análise mineralóg¡ca de solos, sedimentos e
rochas por Difração de Raios X e alguns difratogramas Anexo 8: Minerais cromíferos detectados alravés do MEV
Anexo g: lmagens de minerais cromíferos detectadas através do MËV
Anexo 10: Porcentagem de extração de manganês, ferro e cromo em
cada uma das fases, considerando-se como total extraído o valor obtido da somatórìa de todas as extrações
Anexo 'l '1 :Classifìcação hidroquímica das águas dos poços tubulares da
Sabesp, tubulares particulares e cacimbas (Diagrama de Piper)
Anexo 12:Resultados das análises físico-químicas das águas dos poços
tubulares da Sabesp, tubulares particulares e cacimbas
Anexo 13: Resultados
do
modelo conceitualde
equilíbrio químico (Equilibrium Metal Speciation Model-MINTEQ A2-Vesion 4.0)125
t¿o 128
133
lJc
143
149 t:)v 164
169
171
178
FIGURAS
Figura 1: Diagrama de especiação do cromo em relação ao pH e Eh
Figura 2: Localização geográfica da área de pesquisa e vias cje acesso
Figura 3: Distrlbuição do Grupo Bauru no Estado de São paulo
Figura 4: DÌslribuição dos depósitos cle Cobertura Cenozóica no interior
do Estado de São Paulo
Figura 5: Fluxograma
das
etapas metodológicas desenvolvidas napesqu¡sa
Figura 6: Pontos de coleta de amostras de solos da ZOC e localização
do PC
Figura 7: Variação das porcentagens de silte, areia flna, areia média e
areia grossa em relação à profundidade de coleta cle amostras de solos e sedimentos do PC
Figura 8: Correlação entre os teores de Cr e os teores de Al2O3, Fe2O3,
TiO2, V e Zr nas amostras de solos da ZOC e de solos e sedimentos cjo
poço cacimba (PC)
Figura 9: Variação dos teores de SiO2, AlzOs, FezOs, TiOz, KzO, CaO,
MgO, Na2O e MnO em relação à profundidade de coleta de amostras de solos e sedimentos do poço cacimba (PC)
Ëigura 10: Variação dos teores de Ba, Cr, V, Zr, N¡
e
Sr em relação àprofundidade de coleta de amostras de solos e sedimentos do poço cacimba (PC)
Figura 11 : Variação dos teores de SiOz, Al2O3, Fe2O3, MgO, CaO, Na2O e
PzOs nas iraçôes fina (<635 mesh)
e
grossa (>635 mesh-flutuado eafundado)
Figura 12: Variação
dos
teores de MnO, TiOz, Ba, Cr, Ni, Sr, V e Zrnas fraçÕes fina (<635 mesh) e grossa (>635 mesh-flutuado e afundado)
Figura 13: Porcentagem de extração de manganês, ferro
e
cromo emcada unìa das fases, em relaçáo ao total obtido em todas as extrações
Figura -14: Poços cadastrados em Urânia
Figura 15: Traçado das linhas ¡sopotenciométricas da área de estudo
Figura 16: Perfil hiclrodinâmico com classificação hidrogeoquímica para as três zonas do aquífero em Urânia
Figurar '17; Variação dos teores de cromo total em relação ao período de
amostrí,ìgem de águas dos poços tubulares da Sabesp (pp 01, pp 02 e
PP 03)
13
17 20
28
34
ol
trt)
67
68
71
83 86
8B
90
Figura 18: Variação dos teores de cromo total em relação ao período de amostragem de águas dos poços tubulares cia Sabesp (PP 04 e PP 05)
Figura 19: Variação dos teores de cromo total em relação ao período de amostragem de águas dos poços tubulares da Sabesp (PP 06 e PP 0B)
Figura 20: Distribuição das maiores concentraçöes de cromo total em
mg/L, nas águas dos poços PPs, PTs e ltrcs no período de junho de
1998 a junho de '1 999
Figura 2'l : Evolução das concentrações de cromo ao longo do perfil
esquemático do Aquífero Adamantina em tJrània
Figura 22: Varìação dos parâmetros físico-químicos analisados nas
águas do poço tubular da Sabesp (PP 06) ern relação
à
profundidade de amostragem. Coleta realizada 24 horas após a limpeza do poçoFigura 23: Variação dos parâmetros fisico-químicos analisados nas
águas do poço tubular da Sabesp (PP 06) em relação
à
profundidade de amostragem. Coleta realizada 48 horas após a limpeza do poçoFigura 24: Variação dos parâmetros físico-químicos analisados nas
águas do poço tubular da Sabesp (PP 0B) em relação à profundidade de amostragem. Coleta realizada 24 horas após a limpeza do poço
Figura 25: Variação dos parâmetros físico-químiccs analisados nas
águas do poço tubular da Sabesp (PP 08) em relação à profundidade de amostragem. Coleta realizada 48 horas após a limpeza do poço
Figura 26: Variação dos parâmetros físico-químicos analisados nas
águas do poço tubular da Sabesp (PP 02) em relação ao tempo de
bombeamento
Figura 27: Var¡ação dos paråmetros físico-químicos analisados nas
águas
do
poço tubular da Sabesp (PP 04) ern relação ao tempo debombeamento
Figura 28: Var¡ação dos parâmetros físico-quimicos analisados nas
águas
do
poço tubular da Sabesp (PP 05) em relação ao tempo debombeamento
96
97
99
100
101
102
103
104
'106
107
TABETAS
Tabela
l:
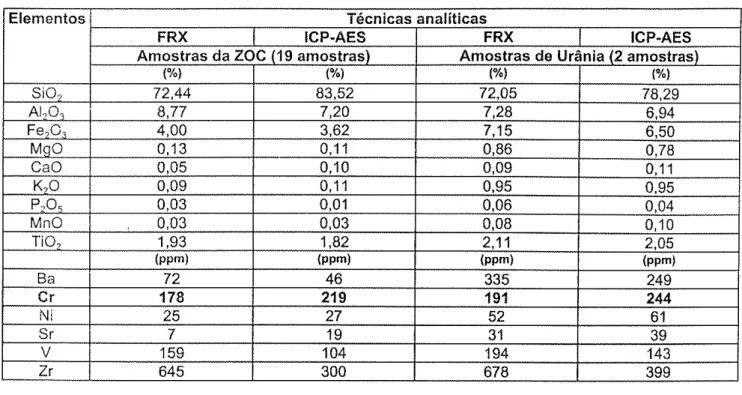
Mineraìs que podem conter cromoTabela 2: Composição química dos basaltos em Urânia
Tabela 3: Composição químtca de solos e sedimentos em Urânia
Tabela 4: Parâmetros físico-químicos das águas de poços tubulares da
Sabesp de Urânia
Tabela 5: Teores de cromo
total
detectadosna
água
deionizada (peneiramento via úmida)Tabela 6: Média dos teores dos elementos analisados por FRX e lCp-AES Tabeia 7: CorrelaçÕes entre
os
parâmetros químicos analisados nasamostras da ZOC e do PC
Tabela 8: Variações dos parâmetros quimicos analisados nas frações
fina (F) e grossa-flutuado (Fl) e afundado (A)
Tabela 9; Análise da fração total do solo por Microscopia óptica
Tabela 10: Extração
de
manganês, ferToe
cromo e a predominância destes metais nas d¡ferentes fasesTabela 11: lVédia dos paråmetros fisico-químicos medidos em campo
nas águas dos diferentes tipos de poços de Urânia
Tabela 12: Média dos parâmetros químicos analisados nas águas dos
diferentes tipos de poços de Urânia
Tabela 13; Correlações entre os parâmetros físico-químicos analisados nas áquas subterrâneas
I
22 25
32
CrJ
64
bb
74
81
v¿
93
LISTA DE ABREVIATURAS E SIGLAS UTILIZADAS NO TEXTO
DRX: Difração de Raios X Eh: Potencial redox
FRX: Fluorescência de Raios X
ICP-AES: Espectrometria de Emissão Atômica com Fonte em Plasma lnduzido lGc-USP: lnstituto de Geociências da Universidade de São Paulo
MEV: Microscópio Eletrônico de Varredura PC: Poço cacimba escavado para a pesquisa PGs: Poços cacimbas
pH: Potencial hidrogeniônico PPs: Poços tubulares da Sabesp PTs: Poços tubulares particulares
Sabesp: Companhia de Saneamento Básico do Estado de São Paulo Zl: Zona hidroqu ímica intermediária
ZOC'. Zona de Captura de Poços
ZP'. Zona hidroquímica profunda
Teores anômalos
de
cromo, algumasvezes
ultrapassandoo
limite
máximopermiiido
para
consumo humano
(0,05
mg/L),
têm
sido
detectadosnas
águassubterrâneas de pelo menos 53 cidades da região noroeste do Estado de Säo Paulo.
Esta pesquisa objetivou definir a origem do cromo nas águas subterrâneas em
Urânia, se antrópica
ou
natural eos
mecanismos hidrogeoqu ímicos que controlam apresença deste elemento no sistema rocha-água.
A
cidadede
Urânia foi selecionada para estudo por apresentar um dos maiores e mais persitentes teores deste elemento na região.Para aiingir estes objetivos foi executado um levantamento de fontes antrópicas potenciais
de
cromo
e
enfatizadaa
hidrogeoquímicadas zonas
não-saturada esaturada com deialhe. Os ensaios na zona não-saturada basearam-se na coleta de
amostras de solo
e
sedimento para análises macroscópica, granulométrica, química, mineralógicae
extração
sequencial.Para
o
estudo
na
zona
saturada
foram cadastrados poços tubularese
cacimbas cle Urânia, definidoo
modelo conceitual de circulação das águas subterrâneas, amostradas e analisadas as águas destes poços.Através dos resultados obtidos pode-se comprovar que a origem do cromo nas
águas
subterrâneasde
Urâniaé
natural, provenienteda
dissoluçãode
minerais cromíferos (cromita, espinélio, hematita, ilmenita, magnetita, rutilo e ulvoespinélio) dossolos
e
sedimentosda
Formação Adamantina. Estes minerais estão associados àfração grossa (> 635 mesh), na qual foram detectados teores de cromo variando de
1.475
a
7.704 ppm.A
extração sequencial comprovou queo
cromoé
proveniente deminerais prìmários, sendo
que
nos solosda
áreade
pesquisa está associado aos materiais residuais e minerais silicáticos. A baixa capacidade de adsorção de cromo nafase
sólida, permiteque
o
íonse
mantenha na fase líquida.O
modelode
equíbrio químico utilizado-MINTEQA2
(Versão 4.0) mostrou que os ambientes hidroquímicos mais alcalinos da área de estudo são propícios à dissolução de minerais portadores decromo,
As
elevadas concentraçõesde
cromonos
poços tubulares (profundos) em relação aos cacimbas (rasos) são decorrentes do maior tempo de contato água-rocha, oferecendo melhores condiçÕes para o equilíbrio químico entre os minerais e a solução percolante e permitindo sua passagem para o meio líquido.X
Anomalous chromium contents, sometimes
exceedingthe
maximum
limit permitted for human consumption (0.05 mg/L) have been detected in groundwaters of at least 53 cities of northwestern São Paulo State.This research aimed at defining if the origin of chromium in Urânia groundwaters
was
anthropicor
natural,and
the
hydrogeochemical mechanismsthat
control thepresence of the element in the rock-water system. Urânia city was selected for the study due to its highest and most persistent contents of chromium in the region.
To
achieve these objectivesa
suryeyof
potential anthropicCr
sources was carried out and the hydrogeochemistry of the non-saturated and saturated zones was studied in detail. The tests in the non-saturated zone were based on soil and sedimentsample collecting
for
macroscopic, granulometric,chemical,
mineralogical andsequential extraction analyses. To investigate the saturated zone Urânia tubular wells and shallow dug wells were catalogued,
a
conceptual groundwater circulation modelwas defined and the water from these wells sampled and analysed'
The data show that the origin
of
chromiumin
Urânia groundwatersis
natural,resulting from dissolution
of
Cr-bear¡ng minerals (chromite, spinel, hematite, ilmenite, magnetite, rutile and ülvospinel) in soils and sediments of the Adamantina Formation. These minerals are found in the coarse fraction (> 635 mesh), where Cr contents from 1,475to
7,705
ppmwere
detected.The
sequential extraction analysis proved that chromium came from primary minerals and it is associated with residual materials andsilicatic minerals in soils of the study area. The low Cr absorption capacity of the solid phase maintains
the
ionin
the liquid phase. The chemical equilibrium model used -MINTEQ A2 (4.0 version) showed that the more alkaline hydrochemical environments of the study area are favourable for the dissolutionof
Cr-bearing minerals. The high Cr concentrationsin
(deep) tubular wellsin
relationto
shallow dug wells result from agreater water-rock interaction time, allowing better conditions
of
chemical equilibrium between minerals and percolating solutions and its exchange with the liquid medium.Ësta tese é o resultado da ajuda valiosa de entidades e pessoas às quais desejo manifestar minha profunda gratidão.
Ao Instituto de Geociências da Universidade de São Paulo (lGc-USP) pelo apoio
no
decorrerdo
trabalho.Aos
departamentosde
Geologia Sedimentare
Ambiental (GSA)e
lVineralogiae
Geotectônica (GMG)e
ao
Centrode
Pesquisasde
Aguas Subterrâneas (Cepas).Ao Prof. Dr Ricardo C. A. Hirata por sua orientação, estímulo e toda assistência prestada.
Aos professores doutores
do
lGc-USP pelas discussões relevantes ao tema econtribuição durante os estudos: Armando M. Coimbra (in memorian), Ciro T. Correa (GMG), Gianna M. Garda (GSA) , João B. Moreshi (GSA), Joet B. Sígoto (GSA), Jorge
S.
Bettencourt(GMc),
José MiltonB.
Mendes (in memorian), Lilia M. Sant'Agostino (GSA), PauloC.
F.
Giannini (GSA), Silvio R. F. Vlach(cMG),
Uriet Duarte (GSA) eValdecir A. Janasi (GMG).
Aos
funcionáriosdo
lGc-USP
pelo
auxílio prestado:
Ana
Paula
Cabanal(secreiaria
da
Pós-graduação), ElaineA.
sinfrônio (Laboratóriode
sedimentologia-GSA), FlávioM. S.
Carvalho (Laboratóriode
Difratometriade
Raios X-GMG), lsaacJamil
Sayeg
(Laboratóriode
Microscopia Eletrônicade
Varredura-GSA), Janaina (Laboratório de Hidrogeoquímica lll-Cepas) João Victor Mashi (Apoioà
projeto-GSA),José
Paulo Sertek (Laboratóriode
Tratamentode
Amostras-GMG), JulianaM.
p. Palmeira (Laboratóriode
Químicae
ICP-AES-GMG), Lourdes Marques (Secretaria-Cepas), Lúcia Helena da Silva (Laboratório de Hidrogeoquímica ll-(Secretaria-Cepas), Magali P. F.Rizzo (Secretaria
da
Pós-graduação), Maristela Prestes Severino (Biblioteca), lVlauroMarcos Lopes (Seção de transportes-motorista), Paulo Ernesto Mori (Laboratório de Fluorescência
de
Raios-X-Gl\4G), Pedrocarlos
Pocciotti (Laboratóriode
lnformática Geológica-LlG-GSA), Sandra Andrade (Laboratóriode
Químicae
ICP-AES-GMG), Sérgio Ataíde Martins (Laboratório de Atividades de Campo-Cepas), Valter Conêa Leite(Assessoria Técnica-Cepas), Verônica Gabriel Santos (Laboratório de lmpregnação de
Amostras-GSA), funcionários do Laboratório de Laminação e da Gráfica.
Aos
companheirosde
trabalho por toda cooperação: AfonsoC. R.
Nogueira,Aless¿incìro Cesarino,
Ana
LúciaO.
Berreta, AngélicaS.
Gutierrez, CarbenyR.
M.Capoie. Célia
A
Surita, Cláudia L. Varnier, Cláudio P. Florêncio, Douglas Bastianon,xii
Fabíola
M.
Rossato, lraldo Braggion Junior, Jamile Dehaini, Jeane Gláucia Santos, Lucy Gomes Sant'Anna, LuizC.
Ferrari, ManoelC.
T.
Ë.
Godoy, Maria Anísia C.Pereira, Murilo A. Valle, Nilson P. Teixeira, Reginaldo
A.
Bertolo, SôniaA.
Nogueira eValquíria de Campos.
À
Companhiade
Saneamento t]ásico <jo Estadode
São Paulo (Sabesp) quecolaborou para a obtenção de dados e desenvolvimento dos trabalhos de campo. Em
especial a Antonio Rodrigues da Grella Filho, da Lua (Jales), Sérgio Donizete Giovanini
e funcionários (Urânia).
Aos órgãos que contr¡buíram através de financiamentos e fornecimento de bolsa
de
estudo: Fundaçãode
Amparoà
Pesquisado
Estadode
São
Paulo (FAPESP-processo 97/13879-6)e
Coordenaçäode
Aperfeiçoamentode
Pessoalde
NívelSuperior (CAPES).
Ao
Prof.Dr.
Henrique Kahne
funcionáriosdo
Laboratóriode
Caracterização Tecnológica do Depariamento de Engenharia de Minas da Escola Politécnica da USP.Ao Pedro Orange pela ded¡caçäo, paciência e sugestões durante
a
redação datese.
I.
INTRODUçÃO
I.1.
REI-EVANCI,A DO TËMAA
ocorrênciade
cromo nas águas subterrâneasdo
noroeste paul¡sta tem setornado uma grande preocupação
à
saúde pública, umavez
que
B0a
90
%
dascidades são abastecidas total
ou
parcialmente pelos recursos hídricos subterrâneos, atendendo a uma ampla demanda, como o uso urbano, rural e industrial.A
anomalia de cromo tem sido detectada desde 1977 na água subterrânea domunicípio de Urânia. Atualmente sabe-se que estes teores anômalos são encontrados em águas de poços de outras cidades da região, algumas vezes, ultrapassando o valor máximo permissível para
o
consumo humano, queé
de 0,05 mg/L como cromo total(Portaria 36, do Ministério da Saúde, de 19-01-1990 e Organização Mundial da Saúde).
Os teores anômalos de cromo encontrados
em
Urânia, apesarde
não serem atarmantes, podem comprometer a saúde da população. Como solução, a Companhiade
SaneamentoBásico
do
Estado
de
São
Paulo
(Sabesp),
responsável peloabastecimento de água da cidade, desativou todos os seus poços tubulares profundos, que serviam ao abastecimento da zona urbana e passou a utilizar a água do Sistema
Aquífero Guarani (Botucatu), aduzida do município de Jales.
Alguns autores advogam que
a
origemdo
cromo nas águas subterrâneas donoroeste paulista pocle ser natural. HIRATA & RODOLFI (1993) definiram que o Cr (Vl) ocorre clistribuÍdo de forma ampla nos municípios de Urânia, Santa Salete e Aspásia.
As
maiores concentraçöes deste elemento foram encontradasem
águasde
poços tubulares cie ma¡or profundidade e não foram detectados em águas de poços cacimbas. Os autores, através de entrevistas e visitas expeditas à área, não encontraram indícios de atividades potencialmente contaminantes.Outro
fato
notávelé
que teores anômalosde
cromo nas águas subterrâneas ocorremem
uma ampla áreada
região noroestedo
Estadode
São Paulo, não se restringindoa
zonas preferenciais. Pesquisas realizadas por ALMODOVAR (1995) eALI\4ODOVAR
&
PACHECO (1995) caracterizaram que a anomal¡a de cromo total naágua
subterrånea estendia-sepor
pelo
menos53
cidadese
determinaram altas concentrações do elemento nos sedimentos de Urânia. Tais pesquisas não indicaram, enlretanto, a origem exata do problema.A
partir deste quadro se evidencia a necessidade de definir a origem do cromonas
águas
subterrâneas. Agrega-sea
isso
o
faio de
que
a
origemé
de
grande interesse acadêmico, poiso
cromo, apesar de frequente nas rochase
solos, ocorre raras vezes de forma não antrópica na iägua subterrânea (HEM, 1985).1.2. OBJETTVOS
o Definir a origem do cromo nas águas subterrâneas na cidade de Urânia; São objetivos básicos desta pesquisa:
.
Estabelecer os mecanismos hidrogeoquímicos que controlam a presença de cromo,2. O CROMO NA NATUREZA
2.1. GE¡!ER.ALIDADES
O
cromoé
um metal de transiçãodo
Grupo VIB da Tabela Periódica. Possuinúmero atômico 24 e peso atômico 51,996. Dos cinco radioisótopos conhecidos, o 51Cr (meia vida 27,8 dias) é mais comumente usado em trabalhos experimentais.
O elemento ocorre no meio ambiente nos estados de oxidação +3 e +6, sendo o
Cr3* mais estável. O raio iônico do Cr6* varia de 0,052-0,053 nm e o valor para o Cr3* é
de 0,064 nm. O Cr3* pode ser substituído pelo ferro, que tem raio iônico de 0,067 nm.
O
cromoé
de
grande importância econômica,devido
ao
seu
múltiplo usoindustrial, destacadamente na metalúrgica (cromagem de meta¡s, fabricação de aço),
na fabricação de produtos refratários (tijolos para revestimento de fornos metalúrgicos) e na indústria química (curtimento de couros, manufaturas de tintas e corantes),
O
cromo
não
é
oxidado
pelo
ar,
mesmoem
presençade
alta
umidade. Apresenia moderada expansão térmica e estabilidade de estrutrura cristalina.Este
metal podeser
encontradono
meio amb¡entede
forma amplae
comconcentrações irregulares no ar, material biológico, água, rocha e solo.
O
cromo, devidoa
sua
especiação, mostra diferentes compodamentos emorganismos vivos.
A
forma trivalente tem baixa toxicidade, apesar de não terem sido estabelecidasdoses
limites.Já
o
cromo hexavalenteé
muito mais
tóxicoe
nãoapresenta valor nutricional. Este pode ser absorvido por ingestão, inalaçäo e através da
pele, podendo causar ulcerações e eczemas (AMARAL, 1985).
I\4uitos metais pesados
têm
valores nutricional, enzimáticoe
terapêutico empequenas
concentrações;são
germicidas, fungicidase
antissépticosem
nÍveis intermediários,mas
tornam-setóxicos
em
concentraçöesmais altas.
O
cromo biologicamenle ativoé
importante parao
homemno
fatorde
tolerânciada
glicose (GODGUL & SAHU, 1995).O
cåncerde
pulmãotem sido
reportadocomo
resultadoda
respiração emambientes com altos níveis
de
cromo hexavalente. Esta espéciena
água em altas concentrações produz doenças gastro-¡ntestinale
no fígado (VENITT&
LEVY, 1974;NlEtsoER & JUSYS, 19BB apud ARMTENTA & OUÉRÉ, 199s).
O
cromo éo
sétimo elemento mais comum na Terra, mas o vigésimo primeiroem abundância nas rochas da crosta, com uma concentração média de 100 mg/kg de
rocha. Rochas máficas e ultramáficas são ricas em cromo, contendo até 3.400 mg/kg.
Os basaltos apresentam uma média de cromo de 200 mg/kg, os granitos 20 mgikg, os
folhelhos e argilas '120 mg/kg, os follrelhos negros 100 mgikg, os calcários 10 mg/kg e
os arenitos 35 mg/kg (McGRATH, 1995).
A
adição deste meialao
solose faz
atravésde
vários veículos, comoo
ar atmosférico (emissöes de forno elétricr¡ na siderurgia), a água (polimento de metais), diretamente (cinzas de combustão rJo carvão, adubos fosfatadose
calcários, lodo deesgoto), entre outros.
A
concentraçåode
cromo no solo pode ser determinada pelomaterial de origem. Solos derivados cle rochas básicas, ultrabásicas e folhelhos podem conter teores elevados deste elemenio.
2"2. O CROMO NOS SOLOS
O
cromo pode ocorrer naturalmente nos solose
suas maiores concentraçöes são encontradas naqueles originários de basaltos e serpentinitos. Na maioria dos solos o teor total de cromo está situado entre 5 e 1.000 mg/kg, sendo, geralmente, menor doque 100 mg/kg. O teor médio mundial é considerado como sendo 50 mg/kg.
TEIXË|RA (1981),
em
sua
revisão bibl¡ográfica, descreveque
os
teores decromo nos solos
não-contaminaclossão
mu¡io variáveis.Em
solosdos
E.U.A. foi encontradoo
valor de 37 mg/kg como a moda de 863 amostras. Em New Jersey, os teores de cromo nos solos variaram de 20 a 75 mg/kg; no Canadá de 20 a 125 mg/kg; na Escócia de 300 a 3.500 mg/kg e na lnglaterra, na região de Lancashire,de32a76
mg/kg.Na faixa de pH e Eh normalmente observada em solos agricolas, o cromo pode
ser
enconiradclnos
estadosde
oxidaçãolll
(Cr3*, CrOz-)e
Vl
(Cr2O72-e
CrO¿2-)(BARTLETT & KIMBLE, 1976a).
O
solo
é
um
sistema heterogêneoe
quimicamente complexo, onde grande número de reações ocorrem simultaneamente, podendo ser concorrentes ou aditivas àreação de oxidação de Cr (lll) a Cr (Vl). Säo exemplos de reações concorrentes com a
oxidação
de Cr
(lll): a
dissolução redutiva de óxidosde
manganês por oxidação de compostos orgânicos (poluentes fenólicos),a
formaçãode
complexos orgânicos estáveis como
Cr(lll)
adicionado ao solo (indisponível como doador de elétrons) e aa dissolução redutiva de óxidos de manganês facilmente reduzíveis) (TREBIEN, 1994)
2.2.1. Cromo (lll)
Na maioria dos solos aráveis, a presença de Cr (lll) é mais favorável do que a de
Cr (Vl) e o cátion Cr3* é a forma de Cr
(lll)
predominante nos solos.BARTLETT
&
KIMBLE (1976a) observaramque
com
o
aumentodo
pH,
asolubilidade do Cr
(lll)
no solo aumenta e, em valores próximos a 5,5, ocorre completa precipitação. Como exemplos de ligantes que podem reter o Cr(lll)
na solução em pHacima
de 5,5
podem-se citar:o
ácido cítrico,o
ácido dietilenotriamina pentaacético (DTPA),o
ácido
fúlvicoe a
matéria orgânica solúvelde solo
seco
ao
ar.
Estescomplexos orgânicos estão presentes
de
forma
naturalno
solo
e
também podemocorrer
em
lodode
esgoto, esterco animale
água residuária industrial (JAMES &BARTLETT, 1983).
A adsorção de Cr3* aumenta com a adição de fosfatos e com a elevação do pH e os complexos de Cr (lll) caracterizam-se por sua baixa velocidade de troca de ligantes,
sendo considerados cineticamente ineries.
?.2.2.
tromo
(VI)O
Cr
(Vl)
é
muito instávelnos
solos
e
é
facilmente mobilizado,tanto
emcondições alcalinas como em ácidas. Os ânions de Or (Vl) competem com os demais ânions da solução do solo por locais de troca na superfície de óxidos ou outros colóides
de
carga
superficial positiva.O
CrO+2-e
HPOa2-possuem
comportamento s¡milarquanto
a
adsorção.O
HCrO¿-e o
HzPO¿- também são adsorvidos de forma similar,porém
são
reiidos com
nlerror iniensidade.Os
íons
Cr (Vi)
também podem ser adsorvidos em superfícies de óxidosde
Fe(lll)
eAl
(lll)
por mecanismo de lroca deligantes.
No
subsolo,
o
Cr
(Vl)
é
reduzido
pelo
Fe
(ll)
contido
nos
minerais; posterjormente é hidrolizado e precipitado na forma de hidróxido.TEIXEIRA (1981)
observouque
a
adsorçãodo
Cr
(Vl) em
caulinita emontmorillonita diminui Çom o aumento do pH, sendo nula em valores próximos a 8,5.
ConclLriu que
a
montmorillonita adsorve2 a
3 vezes mais quea
caulinitae
que este mecanismo, nos dois casos, é dependente da concentração de HCrO¿- em solução. Nomesmo trabalho, ficou evidenciado que a adsorção de Cr (Vl) em relação a Cr (lll) foi relaiivamente baixa, mesmo em condiçÕes ácidas onde a adsorção de Cr (Vl) se torna mais efetiva.
2.2.3. Oxidação e redução
BARTLETT & JAMES (1979) mostraram que em muitas amostras de solo úmido recém coletadas,
a
oxidação de Cr(lll)
a Cr (Vl) ocone facilmente nas condiçöes deumidade predominante no campo. Também confirmaram que a oxidação de Cr (lll) está intimamente correlacionada com
a
reduÇão de óxidos de Mn(lll
/
lV), que atuam nareação como receptores de elétrons. Ëstes autores afirmaram que a oxidação do cromo não foi detectada anteriormente devido ao uso de amostras de solo previamente secas, peneiradas e rehidratadas por ocasião da instalação dos experimentos. A secagem do solo,
por
promovera
redução dos óxidosde
Mn facilmente reduzíveis, neutraliza acapacidade
do
solo de
oxidaro
Cr (lll).
Em solos com elevado teorde
óxidos de manganês, foi constatadaa
possibilidade do Cr(lll),
forma relativamente estável, ser oxidada à forma de Cr (Vl), de grande mobilidade no solo. Porém, a redução de Cr (Vl) no solo pode ser aumentada com a presença de matéria orgânica (CARRY et a|.,1977', BARTLETT & KtMBLE, 1976b).2.2.4" Ocorrência e comportamento dos óxidos de manganês no solo
Os óxidos de manganês geralmente constituem menos
de
1% dos minerais do solo e, devido à sua superfície muiio reat¡va, possuem alta capacidade de adsorção de metais pesados.^- ^l^^-.^- ^:¡i^-^ l^ *^¡^;^
/!\ gf ic
ue e ulg
uta uus u)(tuubue
tdf tgdfiEbcÍr
duþur vnrldrlull5
uE r¡rË(d¡õpesados é atribuída à sua elevada área superficial específica (280 a 530 m2 por grama) e ao baixo ponto de carga zero (PCZ).
McKENZIE (1989) afirma que
a
afinidade de adsorçãode
metais pesados emóxidos
de
manganês,em
geral, seguea
seguinte ordem: Pb>Cu>Mn>Co>Zn>Ni. Entretanto, o cromo não consta nesta relação de afìnidade de adsorção de cátions pela superfície de óxidos de manganês, mas pode ser encontrado em misturas com óxidosde
Fe(lll).
lsto pode ser explicado pela rápida oxidação do cromo quando adsorvido em óxidosde
manganês. Neste processo,o
Mn (lll/lV)é
reduzidoe
liberado para asolução do solo, assim como o Cr (Vl)
A solubilização, mobilização e precipitação dos óxidos de manganês dependem
das
condiçÕes redutorasou
oxidantesdo
ambiente.A
redução
dos
óxidos
demanganês é mais comum em condiçöes anaeróbias, como ocorre em solos alagados,
onde
é
calalizada
por
microorganismos anaeróbiosque
utilizam
os
óxidos
demanganês como receptores
de
elétronsna
presençade
compostos orgânicos. Noentanto,
a
reduçãodos
óxidos
de
manganês tambémé
possívelem
condições oxidantes,por
oxidação químicade
compostos orgânicos duranteo
processo desecagem de amostras de solo, por exemplo.
FËRDORF
et
al.
(1994) propuseram investigaro
mecanismode
sorção doalumÍnio
na
superfíciedo
manganêse
seus efeitos sobrea
oxidaçãodo Cr
(lll). concluíram que o alumínio não influencia a oxidação docr
(lll), somente em valores depH
< 4,0,
e
que, reagindo alumínio com manganês antesda
introdução do Cr (lll),resultou
em
menor
oxidaçãodo
que
quandoambos,
alumÍnioe
Cr
(lll),
foram adicionados simultaneamente para reagir com manganês.A
reaçãode
oxidação doCr
(lll)
no solo ocorre na interface do sólido com asoh]ção,
de
acordo
com
o
seguinte mecanismo:(a)
formaçãode
um
complexo precursor caracterizado pela adsorção de Cr(lll)
à superfície de óxidos de Mn (lll/l\,i); (b) transferência de elétrons do Cr (lll) para Mn(lll/lV), formador do complexo sucessor, com Mn (ll) e Cr (Vl) e (c) ruptura do complexo sucessor, com liberação de Cr (Vl) e Mn(ll) para a solução do solo (TREBIEN, 1994).
2.3. O CROMO NOS tVilNERA|S
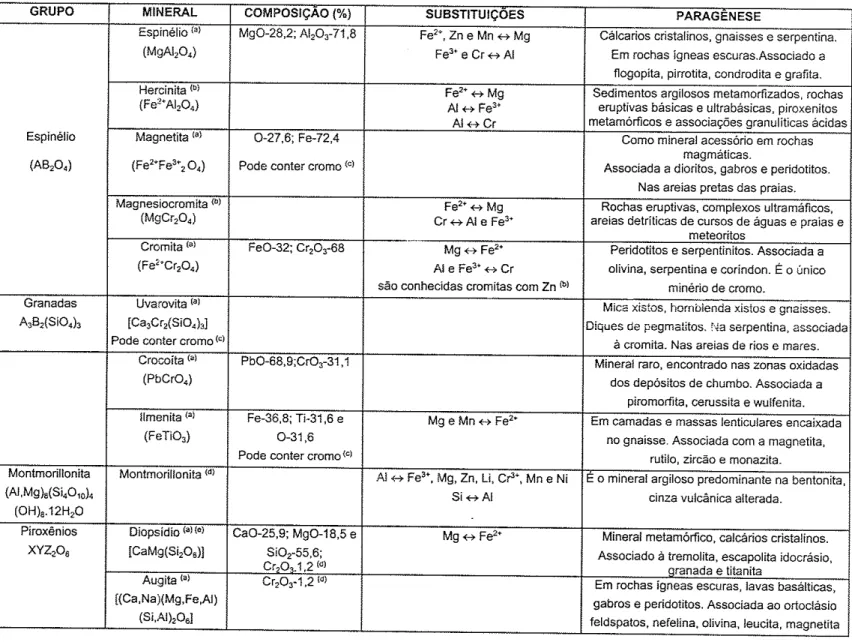
Os minerais mais conhecidos que podem conter cromo, encontram-se na Tabela
McGRATH (1995) descreve que o cromo
(lll)
pode substituir o Fe3* e o Al3' emUKUT/(J M INEFIAL
Espinélio (AB?O4)
Èsprne o r
(MgAlrO.)
Tabela I : Minerais que podem conter cromo
Herc¡n¡ta L',
(Fe?'Al?O4)
coMPosrçAo (%)
Magnelta F,
(Fe'?-Fe3.rOo)
Mgu-zð,z; At2ur-/1,ð
Magnesiocromjtâ {ù)
(MelCÞO¡)
uranaoas
A3B'(SiO.)3
v-¿t ,o, re-t 2,4
Pode cooter crÕmo (')
uromla.", (Fe2'Ct?O4)
lCa3Cr,(SiO<)31 Pode conter cromo('l
sUBSTITUIçOES
Fe'7', Zn e À,4n <+ Mg
Fe3* e Cr <-) AI
Montmorillon¡1a (Al,Ms)s(S¡4o10)4
(oH)s.12HrO
relJ-J¿; (,12u3-oö
r?focotla " (PbCro.)
Fe" <+ Mg
Al e Fe3'
llmenita (¿)
(FeTiO3)
¡roxentos XYZ,O6
MOnlmonllonlta I
ou-bö,v;uru3-3
Mg <J Fe,'
Al e Fe3* .e> Cr
são conhecidas cromilas com Zn þ)
ualcanos cnstaltnos, gna¡sses e serpentina
Em rochas ígneas escuras.Associêdo a
flogopita, pirrotita, condrodita e graflta.
l-e'- o Mg Cr <+ Al e Fe3'
Referências (") DANA (1986)
(b)
DEER ef a/. (1966)
þ) ALLOWAY (199s)
r-e-3b,4; tl-31,6 e
o-31,6
Pode conter cromo (")
uropsrolo F, Fi
ICalvlg(SirOJl
Sed¡mentos argilosos metamorfizados, rochas e.uptivas básicas e ultrabásic¿s, piroxenitos metamórficos e associaÇões qranulíticas ác¡dâs
PAI(AGhNESE
[(Ca,Na)(Mg,Fe,Al) (s¡,Ar)r06l
Uomo m¡neral acessório em rochas
magmátic¿s_
Associada a dioritos, gabros e peddotitos-Nas areias pretas dâs praias.
rr'a(J-¿3,v; Mgu-lú,c e
síor-55,6;
cr"o" I 2 u)
Rochas eruptivês, complexos ulkamáfìcos, areias delríticas de cursos de águas e praias e
mêtañr¡t^c
ct,oÌ1 ,2
MgeMn<)Fe"
Al {+ Fer', Mg, Zn, Lì, C¡¡t, Mn e Ni Si <+ AI
Pendot¡tos e serpentinitos. Associada a ol¡vina, serpentina e coríndon. É o único
minéio de cromo_
Mice x¡sios, hcrnblenda risios e gneisses.
Diqìres de pegmâiìtos. i.ia sèrpentina, asscciâda
à cromita, Nas areias de rios e mares.
(dr MASON &
MOORE (1982) þ) KLErN & HURLBUT (1993)
Mrnefal r¿¡ro, encont€do nas zonas oxídadas
dos depósitos de chumbo. Assocrada a
piromorflta, ce¡ussita e wu¡fenitê.
lvlg ê Fe/'
Em camadas e rnassas lenticulares encaixada
no gnaisse. Associada com a magnetìta, rutilo, z¡rcão e monazita.
o mrneral argrloso predominante na bentoníta
cìnza vulcâníca alteradâ.
Mrnerat metamontco, câlcários cristalinos. Associado á rremolita. escapolita idoc¡ásio,
oranadâ e tifanita
e o vermelho do rubi (óxido crômico)
De
acordo
com
DEUTSCH (1997), mineraisde Cr
(Vl)
são
relativamente solúveis e podem ser encontrados em locais com alta contaminação por eromato. Sob estas condições, é possível se formar a hashemita (BaCrOa).A
substituiçãoAl
<_>Cr
é
contínua, havendo uma série completade
soluçãosólida
entre
a
hercinitae a
cromita.A
designaçãopicotita
é
utilizada para umavariedade
de
hercinitacom
quantidade apreciávelde
cromo, com Al>Cre
com arelação Fe:Mg entre 3 e 1 (DEER ef a/., 1966).
MATZAT
&
SHIRAKI (1970) separamos
mineraisde
cromo
hexavalente etrivaiente da seguinte forma:
-
m¡neraiscom cromo
hexavalente: crocoíta Pb[CrO¿], cromat¡ta Ca[CrOa], tarapacaÍtaKK[Crod,
foenicocroíta
PbrO[CrOa],vauquelinita
CuPbz(OH)[CrO¿][PO¡], fornacita(Cu,Fe)PbPb(OHXCTO¿l[(Pb,As)Oa] e hemihedr¡ta ZnPb6Pb2Pb2F2[CrOa]6[SiOa]2.
-
minerais
com
cromo trivalente:
eskolaÍta Cr2O3, grimaldiita CTOOH, mcconnellitaCuCrOz, cromita FeCr2Oa, ureyita NaCr[SizOo], daubréelita FeCrzS¿ e brezinaíta Cr3Sa.
2.4. O CROMO NAS ÁGUAS
A
presença de cromo nas águas subterrâneas está normalmente associada àcontaminação
cle
origem
antrópica.
A
ocorrência natural
do
elemento
emconcentrações acima
das
normasde
potabilidadeda
águaé
bastante rara. Raras também, são as referências bibliográficas especializadas sobre o assunto, necessáriaspara uma
melhor avaliação comparativa comesta
pesquisa.A
seguirsão
citados alguns exemplos de origem natural de cromo: ROBERTSON (1975) descreve o casodo
Paradise Valley (Arizona, E.U.A.), onde as concentrações de cromo em águas deum aquífero livre variam de 0,1 a 2,0 mg/L. Embora o autor não tenha estabelecido a
origem
primáriado
cromo, entende-seque este
elementoesteja
associado aos minerais de argila, cuja área-fonte nâo é reconhecida.SZIKSZAY (1981), no estudo das fontes
de
Aguasda
Prata (SP), encontrou teores de cromo total de 0,014 a 0,3 mg/L em águas provenientes de rochas vulcânicas e ultrabásicas, e valores de 0,019 a 0,3 mg/L, nas águas provenientes de arenitos.ARMIENTA & QUERÉ (1995) estudaram
a
contaminação da água subterrânea por cromo, no Leon Valley, México Central, detectada em 1975. A poluição do aquíferoé
devido principalmentea
três fontes, duas antropogênicase
uma natural.A
origem naturalestá
associadaa
um
importante complexode
rochas
ultramáficas, onde ocorrem processos de intemperismo dos piroxenitos.HEM
(1985)
cita
que
concentraçõesde
cromo
em
águas
de
rios
não-contaminados
são
normalmente menoresdo
que 0,01
mg/1. DURFOR&
BECKER(1964)
reportam
concentraçõesmenores
do
que
0,00043
mg/L
nas
águas
de abastecimento públicoe
de 0,0058 mg/L nos r¡os dos E.U.A. Segundo LOVE (1967), poucas águas de fontes naturais contêm cromo. Estas águas podem provavelmente contê-lo somente como elemento traço.Nas
águas subterrâneaso
cromopode estar
presenteem
dois
estados deoxidação, trivalente
e
hexavalente. Por possuir propriedades tóxicas,a
concentração máxima de cromo nas águas utilizadas para consumo humano é 0,05 mg/L para cromo total. Este valor está de acordo com os padrões de potabilidade brasileiros (Portaria 36,do Ministério da Saúde, de 19-01-90). O Decreto Estadual 12.486 de 20-10-78 coloca que
o
valor máximo de cromo hexavalente nas águas subterrâneas, também deveráser 0,05
mg/L.A
Organização Mundialda
Saúde (OMS)e
os
principais países do mundo, como os da Comunidade Econômica Européia, o Canadá e os Estados Unidos da América também adotam este valor (CETESB, 1994).2"4.1 . Geoquímica do cromo
Um dos
aspectos ¡mportantesdo
cromo
refere-sea
sua
mobilidade emsubsuperfície
que
é
função
dos tipos
de
complexos formadosem
solução, da solubilidade de suas espécies, da capacidade de adsorção do cromo pelo material do aquífero e da zona näo-saturada.2.4.1.1 . Solubilidade do cromo como função do pH e Eh
A
solubilidade de um elemento ou mineral na águaé
controlada em parte porfatores como
temperatura, pressão, concentraçãodo
íon
hidrogênio(pH)
e
pelo potencial redox (potencial de oxi-redução ou Eh). A tempertura e pressão têm somenteum
pequeno efeito
na
solubilidademineral
sob
muitas
condições
de
águas subterrâneas (HEM, 1970 apud ROBERTSON, 1975).O
pH, porém, tem um grande efeitona
presençae
mobilidade dos elementos.A
solubilidade de alguns elementostambém depende de seu estado de oxidaçåo, que é determ¡nado pelo Eh do ambiente, uma medida
da
intensidadedas
condiçöesde
oxidaçãoou
redução.O
cromo, por exemplo,é
pouco solúvele
pouco móvel no esiado trivalente, mas torna-se solúvelquando oxidado
ao
estado
hexavalente.A
ocorrência
de
cromo
nas
águas subterrâneas pode ser melhor entendida através da interpretação do diagrama deEh-pH.
Estes
diagramas
são
construídoscom base
em
equações químicas
epropriedades termodinâmicas. Dada uma reação na qual
a
substânciaA
é convertidana
subsiânciaB,
e
que
pode
ser
escritade tal
forma
que
íons
hidrogênio (H-), moiéculas de água e elétrons (e-) estejam envolvidos, as leis de equilíbrio podem ser aplicaclas para expressara
reação com duas variáveis independentes (GARRELS' 1960): pH, que determinaa
influência dos íonsde
hidrogênioe
Eh,a
influência deelétrons.
Tal reação pode ser escrita da seguinte forma:
aA+wHzO =
b9+m(tf)
+ne-onde A é o reagente,
Bo
produto, n"- o número de elétrons cedidos, e a, w, b e rn são as concentraçÕes em moles ou íons-grama.A equação de Nernst define a relação fundamental entre Eh e pH:
Eh = Eo + RT/nf ln
tBf
If f
/Øf
tHr)f
ondeEh = potencial redox
R = constante universal dos gases
f
= temperatura absolutan = número de elétrons cedidos f = constante de Faraday
Ee = potencial padrão dos reagentes, definido por E0 =
lGn/nf
onde .ulGo = energia livre padrão da reação.
Relembrando que o pH é o logarítmo negativo da atividade do íon hidrogênio, e que a atividade da água e sólidos tem valor um, as variáveis significantes passam a ser Eh, pH
e
as atividades dos íons que estão sendo considerados. Devidoa
diferença entrea
atìvidade (concentração termodinâmica)e
concentração molar (concentração1l
(1)
real), os campos de estabilidade calculados representam
a
solubilidade mínima. Estadlscrepância não é usualmente um problema sério quando se trata de águas com baixa
concentração de elementos.
Os
camposde
estabilidade d{'l várias espéciesde
cromo predominantes naságuas subterrâneas encontram-se na Figura 1. Nos sistemas naturais,
o
cromo pode ser encontrado nas formas trivalente e/ou hexavalente. Em condições de redução (Eh baixo) predominam espécies de Cr(lll):
Cr3n, Cr oH2*, Cr (oH)z-, Cr (oH)30, Cr (oH)4-.Sob condiçöes oxidantes
(Eh
alto)as
espéciesde Cr (Vl)
que
podem existir são: HCrO¿-e CrO¿2-.A
concentraçäoe
a
mob¡lid,?dedo
cromo nas
águas
subterrâneas estão diretamente relacionadasao
esiado Cr.'valência dominante, queé
controlado pelas características químicas e físicas das águas.O
cromo(lll)
geralmente nãoé
transportadoa
grandes distâncias pela águasubterrânea devido
à
sua baixa soltlbilidade. Porém ele poderia ser convertido paracromo (Vl) se o estado de oxidação píilra um lugar particular for mudando com o tempo,
de
redutorpara
oxidante (BARTLETT&
JAMES,
1979). Quandoo
cromo(Vl)
étransportado pela água subterrânea, pode ser transformado e precipitado como cromo (lll), se a água entrar numa zona de baixo potencial redox.
2.4.1 .2. Adsorção
A
adsorção ocorre porque as espécies iÖnicas dissolvidas na água subterrânea são atraídas pelas superfícies dos minerais que constituem o aquífero, por possuirem uma rede de carga elétrica própria para substituições (FREËZE & CHERRY, 1979)' A carga elétricada
superfície de um mineral varia como
pH.A
carga de superfície éneutra
para um
ponto
zero
de
carga
(pH.o").Acima
de
ÞH,p"â
superfície está negativamente carregadae
ocorre adsorção de cátion. Abaixo de PH.p",â
superfÍcie está positivamente carregada e ocorre adsorção de ânion.20
'15
10
0
.10
Figura 1: Diagrama de especiação do cromo em relação ao pH e Eh (CALDER, 'l9BB).
pode
ser
descritapelo
coeficientede
partição(K),
que
relacionao
equilíbrio daconcentração
de
cromo
adsorvidapelos
sedimentosdo
aquífero
(C")
sobre
aconcentração de cromo dissolvida na água subterrânea (C'):
A
partìção do cromo entre a água subterrânea e o material do aquífero retarda amigração do íon em relação ao fluxo da água subterrânea. A reiardaçäo de substâncias
em
sistemasde
água subterrâneaé
descrito pelo fatorde
retardação (R¡) que diz respeito à velocidade de fluxo da água subterrånea (V*) sob a velocidade de migração da substância (V".):K¿ = (C")/(C*)
Este fator de retardação pode ser descrito pelo coeficiente de partição através
l3
(3)
da riensidade (¡a) e porosidade (n) do material do aquífero:
Segundo STUMM & MORGAI'I (1981), ions positivamente carregados (tais como Cr3* que
é a
espécie dominante de cromo(lll)
abaixode
um pH4)
são geralmente adsorvidos por argilominerais, que tipicamente têm alta capacidade de troca de cátion ebaixo pH,o", na ordem de 2 a 2,5. A ¿ldjìorção de Cr3* por solos e argilas é geralmente muito alta, aumentando com o pH.
O
cromo
(lll)
é
relativamente irnóvelpara
um pH
próximode
4,
devido àaclsorção. Acima deste
pH ele
é
também relativamente imóvel devidoa
sua
baixa solubilidade.Na forma aniônica (HCrO+-
e
CrOa2-)o
cromo(Vl)
é
atraído pelas superfícies carregadas positivamente tais como: ferro, manganês, óxidos e hidróxidos de alumínio. Estas substâncias comumente cobrern os materiais do aquífero e têm um alto pHzpc de6,7 a 8,5.
CALDER (1988) reportou que a adsorção de Cr (Vl) por argilas, solos e materiais do aquífero é baixa a moderada sob pH próximo ao neutro, comumente encontrado nas
águas subterrâneas. A adsorção do cromo (Vl) decresce com o aumento do pH. Pouca ou nenhuma adsorção ocorre acima de um pH 8,5.
2.4.1 .3. Agentes redutores
Rr=1+(pr/n)
K¿ (5)HENDERSON (1994), em sua revisão de literatura, indica os agentes redutores do Cr (Vl) para Cr
(lll)
no meio ambiente. A redução de Cr (Vl) através do Fe (ll) tem sido simulada no laboratór¡o onde são respeitadas as condições ambientais das águas subterråneas.SCHROEDER & LEE (1975) demonstram que
o
Cr (Vl) foi reduzido através do Fe (ll) entre 5 e 30 minutos no laboratório, em um pH aproximadamente neutro e com concentraçöes representativas dos sistemas naturais. Os experimentos sugerem que ocorreu a seguinte reação:3Fe2* + CrOa2- + 7H2O -+ 3Fe(OH)3 1am¡ + Cr(OH)2+ + 3¡1+
Eles
postularamque
a
reaçãodo Cr
(lll)
e
hidróxidoférrico
precipitado[3Fe(OH)¡r"n11] pocleria induzir
a
imobilizaçãoe
acumulaçãodo
cromo
dentro dossedimentos.
HEM (1977), revisando
a
termodinâmicadas
reaÇõesdas
superfícies de oxi-hidróxidos de Fe, conclui que as concentraÇões de cromo nas águas naturais podem ser diminuídas através de reaçÕes químicas que envolvem processos de redução Fe(ll)-Fe(OH)s. Ferro dissolvido em equilíbrio com hidróxido férrico amorfo [Fe (OH)3 1".¡;
produto rje solubilidade
=
10-38'21 pode existir em ambos estados na solução, Fe (ll) e Fe (lll), como representado pela seguinte equação:Fe2* + 3Hzo -+ +Fe (oH)¡ rum) + 3 H* +
e-Ele concluiu que nos sistemas de águas subterrâneas, onde
o
ferroé
abundante, ocromo tende a ser imóvel.
STOLLENWERK & GROVE (1985) realizaram simulações no laboratório sobre a
adsorção e desorção de Cr (Vl) em aquíferos sedimentares aluviais. Evidências visual e quírnica indicaram que Fe (ll) que cobria com oxihidróxidos os grãos do aquífero foi
responsável pela adsorção de Cr (Vl). Eles observaram que sendo suficiente o tempo de contato, o Cr (Vl) adsorvido tornava-se fixo no material aluvionar. A redução de Cr
(Vl)
paraCr (lll),
seguida pela precip¡taçãode
Cr
(OH)¡lu.l,
foi
sugerida como umposs ivel mecanismo de reação.
FARY
&
RAI
(1989)
reportaramque
quantidades residuaisde
Fe
(ll)
nointemperismo cla hematita ou biotita podem atuar como agentes redutores de Cr (Vl) na
solução. A recluÇåo de Cr (Vl) ocorreu na solução, resultando na precipitação de (Cr,
Fe) (Oi-i)3
e
limitandoa
concentração de Cr dissolvido para menos de 0,05 mg/L' AredLrç5o de Cr (Vl) ocorreu frequentemente na presença de oxigênio.
IIA¡ìTLETT & KIMBLE (1976 b) observaram a redução de Cr (Vl) sob condiçÕes
aeróbi<;as
e
pH
neutro, pela matéria orgânica, dentro de várias semanas. Nenhuma3.
AREA ÞE
ESTUDO
3.1.
LOCALIZAçÃo
EvlAs
DE ACESSO^ *..^i^í^¡^ ¡^
rrFâñi.
/.,.\rì'ì ii¡.êâ torritnrialde
anroximadamente400
km2, \-,, I I lUl llull./lv \rtt vr c¡r rrq'localiza-se
na
região noroestedo
Ei;iadode
são
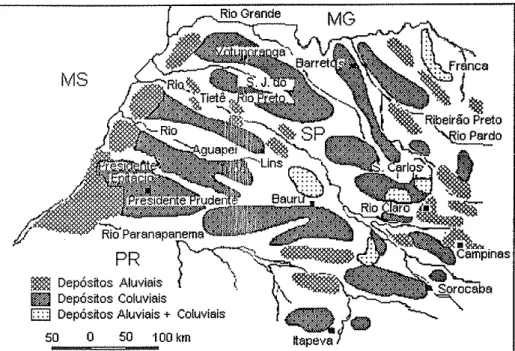
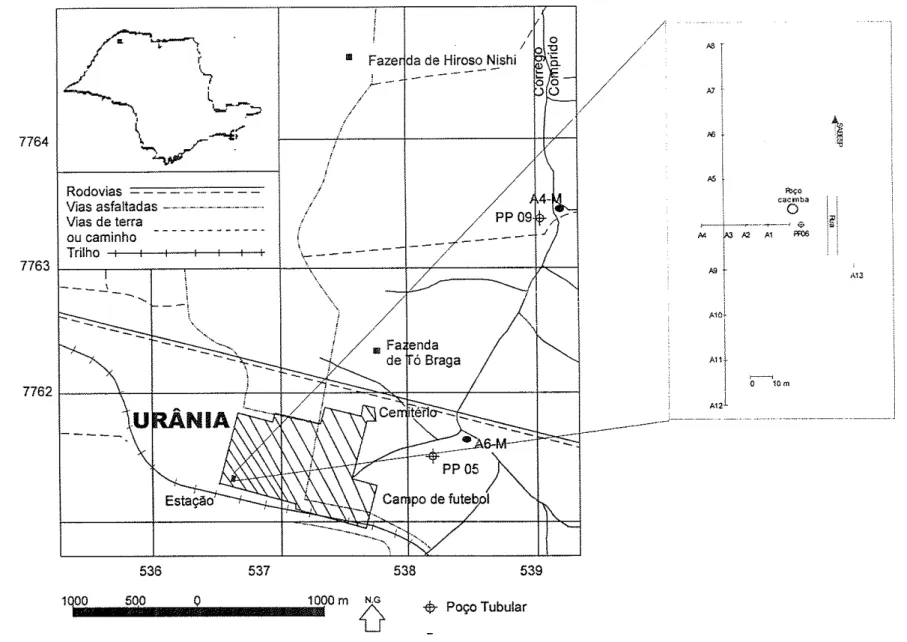
Paulo. Foi selecionado para esta pesquisa por apresentar uma das maiÙres e mais persistentes concentraçöes de cromo nas águas subterrâneas.o
estudofoi
restritoao
perímetro urbano, que apresentou umaquantidadesignificativadepoços,nãoenfocandoasáreasrurais.A
cidade |imita-secom
Jales, Santa Albertina,santana
da
Ponte Pensa e Palmeira D'Oeste. Urânia dista 595 knr fle Säo Paulo, sendo que o acesso à área pode ser feito a partir da capital, pelas Rodovias Anhanguera(sP
330) até Limeira (ou pela Bandeirantes até Campinas), seguindo pela Washington Luiz (SP 310) até Mirassol e' continuando pela Euclides da Cunha (rsP 320) (Figura 2)'3.2. ASPECTOS FISIOCLIMATOLÓGICOS
Segundo
IPT
(1981ae
1997),a
regiãode
pesquisaestá
inseridana
Bacia vulcano-sedimentardo
Paraná, representadapor uma
complexafossa
tectônicaencravada
no
escudo
pré-cambriano.Esta
bacia
encontra-se
preenchida porsedimentos continentais, alguns marinhos e lavas basáliicas'
o
municípiode
urânia esiá
localizadono
Planaltoocidental
Paulista. Esteabrange
uma área
de
aproximadarnente50%
do
Estado
de são
Paulo.
Maisespecificamente,
urânia
situa-se dentrnda
unidade geomorfológica denominada de Planalto Centro Ocidental.oplanaltoécomposioporrochasdoGrupoBauru,queéconstituídopor
formações predominantemente areníticas, sendo que em algumas regiões encontram-se cimentadas por carbonato de cálcio. Os basaltos afloram nos vales dos principais rios em ocorrências descontínuas, exceto no Paranapanema e no Pardo'
parte por rios consequentes, que apresentam cursos paralelos e seguem o sentido de mergulho das camadas. Êste traçado é seguido pelos rios Turvo, Preto, São José dos Dourados e Tietê. Os afluentes mantênl traçados perpendiculares aos primeiros, isto é, subsequentes.
Esta rede de drenagem mos[r¿ì ttm acentuado paralelismo de eixos alinhados para noroeste. Os rios foram condiciernados em grande parte por estruturas presenies
no
substrato basáltico
e
por
Seu$ reflexos
na
cobertura
sedimentar. Outras característicasda
drenagem são corredeirase
cachoeiras,nos
riosde
maior porte' formadosa
partir de soleirasde
rochas basálticas. Algumas destas quedasd'
águaforam aproveitadas para a implantaçi':o de usinas hidrelétricas.
O relevo regional é constituÍdo por colinas amplas e ba¡xas. As altimetrias variam de 400 a 700 metros e as declividades médias das veftentes estão entre 2
e
10%. Os solos da região são classifìcados como argilossolos vermelho-amarelos (ou podzólicos vermelho-amarelos). São superficialmente arenosos com nítida diferenciação textural entre os horizontes A e B, apresentandcl sub-horizonte A2 e transição abrupta a clara entre os horizontes (EMBRAPA & lAC, 1999).A cidade de urânia possui uma altitude que varia entre 430 e 470 metros acima do nível do mar. A drenagem é representada pelos córregos comprido e do Matadouro.
Segundo CRUZ
&
FERREIRA (1993),a
região de estudoé
recoberta por umespesso manto de solos transporiados do retrabalhamento do Grupo Bauru. São solos bastante arenosos, com elevadas resistência ao cisalhamento, baixa deformabilidade e
permeabilidade. Estes solos não ocupam toda a região, sendo que nas calhas dos rios normalmente afloram solos residuais de arenito, basalto e diabásio.
o
DAEE (1976) descreve que o clima da área de estudo pode ser definido como tropical úmido até sub-tropical úmido, Aw até Cwa segundo a classificação de Köppen.Na regiäo de pesquisa a temperatufa segue um ritmo normal de clima tropical, com duas estações bem definidas: uma quente, com méd¡as mensais ac¡ma de 20oC
(outubro/março)
e
outra com
temperaturas aba¡xode
19oC (abril/setembro). A percentagemde
umidade relativa regionalé
maiornos
meses de janeiroa
mar\ìo,atingindo
o
valorde
70%. Nesta região, dominaa
massa equatorial cont¡nentale
acontinental trop¡cal e, em segundo plano, as massas polares. Os índices pluviométr¡cos anuais variam
em
tornode
1.100a
1.250 mm.A
distribuiçãodas
chuvasnão
é homogênea, concentrando-se no período de ouiubro a março, sendo que o período de abril a setembro apresenta acentuada escassez.O posto pluviométrico de Urânia (87-006 do Departamento de Águas e Energia
Elétrica-DAEE), registrou
no
período cle 1959a
1999que
os
mesesde
dezembro, janeiro e fevereiro apresentaram as maiores alturas médias de chuvas (196,234 e 179mm, respectivamente). Nos meses cle julho, agosto e setembro ocorreram as menores
médias (30. 16 e 17mm, resoectivamente). A pluviometria média anual no município de
Urânia foi de 1.271 mm.
3.3. GEOLOGIA
A
área de estudo está situad;:¡ na Bacia Vulcano-Sedimentardo
Paraná- Estabacia localiza-se
na
reglão mais desenvolvidado
Brasile
a
água contida em seusaquíferos do Mesozóico é considerada um recurso estratégico.
No domínìo regional afloram as rochas sedimentares da Formação Adamantina,
do
Grupo Bauru (Cretáceo Superior). Sob elas, ocorremos
basaltosda
Formação Serra Geral, do Grupo São Bento (Juro-Cretáceo). Essa sequência pode ser observada nos perfis Iitológicos dos poços tubulares perfurados na região. No topo da sequência, de forma localizada, ocorrem as coberturas cenczóicas.A
Figura3
ilustraa
distribuição das formações do Grupo Bauru no Estado deSão Paulo. Em trabalhos mais recentes (FERNANDES, 1998), o Grupo Bauru recebeu
uma nova proposta de divisão estratigráfica. No entanto, a maior parte da bibliografia referente
ao
assunto utilizaa
denominaçãomais
antiga,que será
respeitada napresente pesquisa.
3.3.1. Grupo São Bento
li.i!:l
F.-¡
Lr il
m
LIìffi
E
E
GrupB Bauru
Cobeduras Cenozóicas
Formaçgo |iaqueri e correletas
Formeção Meriìiâ Formûção Adanaîtina Forr¡ação Sarìio Anaståcio Fonîação Caiuá
SedÌr¡er¡tos e elusivas da BacìÉ do Parená
Enbassíìento Cr¡stalino
bp
Figura 3: Disiribuição do Grupo Bauru no Estado de São paulo (lpT, 1981b)
Û 10 æ ìærn I ^-o
-;"; t oc€aoo Attântrco
3.3.1 .1 . Formação Serra Geral
Esta
formaçãoé
representadapor um
conjuntode
derramesde
basaltos anteriormente acreditados como de n¿rl.ureza toleítica e atualmente reconhecido como uma cobertura basáltica cie natureza vitriada de termos ácidose
básicos (RAPOSO, 1s92).O
IPT
(1994) afirmaque na
regiãode
São Josédo
Rio
Pretoos
derrames basálticos apresentam espessuras muito variáveis.A
seção típica de um derrame delava
basáltica compreende uma zoní;lde
disjunção horizontalna
base, uma zona intermediária com fraturamento predolnnnantemente vertical, uma zonade
disjunção horizontal super¡or e uma zona vesículc-anrigdaloidal no topo.Segundo
o
IPT (1981b), as amígdälas podem estar preenchidas por calcedônia, quartzo, calcita, zeólitase
nontronlta, mineralque
lhes imprime cor verde. Grandes geodos de quartzo e calcedônia podem existir na zona superior amigdalóide.A
Formação Serra Geralé
recotlerta em discordância angular pelas formações do Grupo Bauru ou depósitos cenozóicos. Os derrames são formados por rochas de cor cinza escura a negra, afaníticas.Os basaltos são constituídos essencialmente de labradorita zonada associada a
clinopiroxênios
(augita
e
as
vezes
pigeonita).Como
acessórios,têm-se
titano-magnetita, apatita, quartzoe
raramente olivinae
seus produtosde
transformação. Matéria vítrea,ou
produtos de desvitrificação, podem ser abundantes, sobretudo àsbordas dos derrames.
Uma indicação de que os basaltos se originaram do extravasamento rápido de lava muito fluida através de geoclases e falhas menores é dada pela uniformidade dos derrames, sua vasta extensão, associação com diques contemporâneos, preservação local de morfologia das dunas e raridade de produtos piroclásticos" A persistência das
condições
desérticasdurante
o
vulcanismoé
comprovadapela
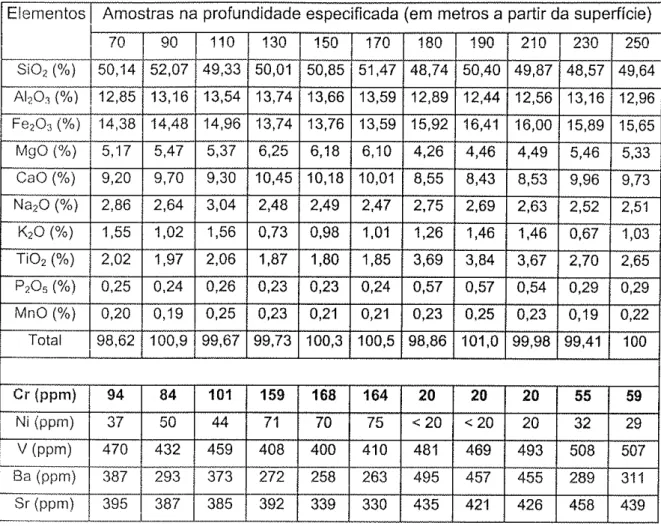
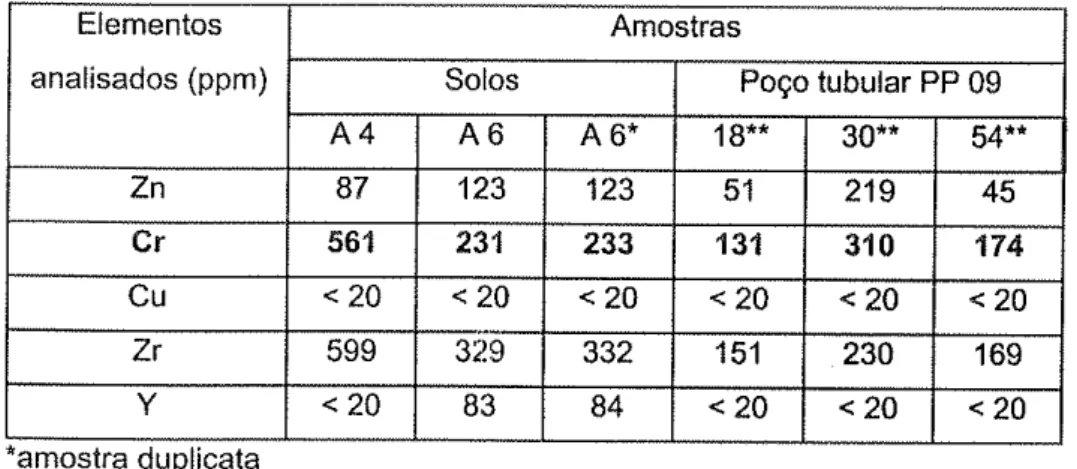
ex¡stência das intercalações eólicas.ALMODOVAR (1995) descreveu e analisou onze amostras de calha de rochas basálticas de um poço tubular perfurado em Urânia (PP09). A descrição mostrou que a
maioria destas amostras