Universidade Estadual Paulista – UNESP
Faculdade de Medicina de Botucatu –
Divisão Hemocentro
CARLA WOELKE CABESTRÉ
Avaliação da correlação entre Aloimunização à
Antígenos Eritrocitários e Sistema de
Histocompatibilidade (HLA) em pacientes com
Doença Falciforme
CARLA WOELKE CABESTRÉ
Avaliação da correlação entre Aloimunização à
Antígenos Eritrocitários e Sistema de
Histocompatibilidade (HLA) em pacientes com
Doença Falciforme
Dissertação apresentada à Faculdade de Medicina, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus de Botucatu, como parte dos requisitos para obtenção do título de Mestre em Pesquisa e Desenvolvimento: Biotecnologia Médica.
Orientadora: Prof. Dra. Valéria Nogueira Dias Paes Secco Co-orientador: Prof. Dr. Antônio Fabron Júnior
Dedico este trabalho e esta conquista aos meus Pais, que tanto me apoiaram e que me deram o suporte que precisava para chegar até aqui. Agradeço a eles pela compreensão nas escolhas feitas por mim e pela formação humana e intelectual. Devo tudo a eles.
AGRADECIMENTOS
Agradeço, primeiramente, a Deus, pela presença em minha vida, pela capacidade a mim conferida e por ter me iluminado e inspirado durante todo este trabalho.
À Dra. Valéria pela orientação e por todo conhecimento transmitido a mim durante este estudo. Por ter confiado em meu potencial e por todo apoio e compreensão que me dedicou.
Ao “Dr. Fabron” por ter confiado a mim seus conhecimentos e acreditado em meu trabalho. Agradeço a sua disponibilidade, dedicação em ensinar e pelas oportunidades dadas a mim.
Às amizades eternas que realizei na cidade de Botucatu: Juliane, Luciana e Aline. Sem o apoio e a ajuda dessas grandes amigas não poderia ter chegado até aqui.
À Adaíze e Denise, pessoas maravilhosas, um exemplo de carinho e companheirismo que me ajudaram muito. Nunca irei esquecer tudo o que fizeram por mim.
À Dra. Patrícia e toda a equipe da Agência Transfusional do Hemocentro de Botucatu pelo apoio na realização deste trabalho.
À equipe do Laboratório de Imunohematologia do Hemocentro de Marília pelo grande apoio e por ter permitido parte da realização técnica deste trabalho.
Aos diretores e à equipe do Laboratório de Imunologia de Marília (LIM), pela prestatividade e por terem me acompanhado na realização da parte técnica deste trabalho. Todos me deram total apoio para o término deste projeto.
À minha tia Sonia Cabestré, pelas dicas, correções e pela força que me dedicou na realização da dissertação. Obrigada pelo carinho e pela dedicação.
Ao Marcelo Ruiz, diretor do Laboratório de Imunologia de Marília, que disponibilizou o Laboratório para a realização desta pesquisa.
À Sheila, minha companheira de trabalho, que me deu muito apoio e muita força nos momentos em que “bateu” o desespero no término do mestrado. Sempre será uma grande amiga!
“Embora ninguém possa voltar atrás e fazer um novo começo, qualquer um pode começar agora e fazer um novo fim”.
Doença falciforme (DF) é a denominação usada para caracterizar uma doença causada pela presença de hemoglobina S (HbS) nas hemácias, ocorrido pela troca do aminoácido Valina pelo aminoácido Ácido Glutâmico na estrutura da cadeia β da Hb, originando uma Hb anormal, denominada HbS. Os indivíduos heterozigotos (que possuem uma cópia da HbS e outra HbA normal), geralmente, são assintomáticos. As formas sintomáticas da doença ocorrem em indivíduos homozigotos para a HbS (chamada de Anemia Falciforme) ou em casos de combinação da HbS com anormalidades hereditárias: hemoglobinopatia SC, hemoblobinopatia SD, S/beta-talassemia (Sβ). A transfusão é um componente vital no tratamento de algumas complicações agudas e crônicas da doença falciforme. No entanto, o uso crônico de transfusões de hemácias pode levar à aloimunização eritrocitária, o que pode dificultar o encontro de hemácias para novas transfusões e aumentar o risco de reações hemolíticas. Situados no braço curto do cromossomo 6, o Complexo Principal de Histocompatibilidade (MHC) compreende uma região de genes altamente polimórficos. As proteínas resultantes destes loci formam as moléculas do complexo HLA que são responsáveis pela apresentação de antígenos aos receptores de linfócitos T e B. Isto posto, o objetivo do estudo foi relacionar o perfil genotípico do sistema HLA de classe II (HLA-DRB1 e HLA-DQB1) com a aloimunização eritrocitária em pacientes com Doença Falciforme. Foram coletadas amostras de 47 pacientes com Doença Falciforme (18 adultos e 29 crianças), com faixa etária entre 1 a 58 anos, que apresentavam, ou não, anticorpos eritrocitários, e que são acompanhados no Hemocentro da Faculdade de Medicina de Marília (FAMEMA). Os exames imunohematológicos foram realizados no Laboratório de Imunohematologia do Hemocentro da FAMEMA, através das seguintes técnicas: Tipagem Sanguínea ABO/RhD, Pesquisa de Anticorpos Irregulares (PAI), Identificação de Anticorpos Irregulares (IAI), Fenotipagem eritrocitária e Teste Direto da Antiglobulina. Os procedimentos para a genotipagem HLA Classe II foram realizados no Laboratório de Imunologia de Marília – LIM, utilizando as seguintes técnicas: Extração do DNA, Reação em Cadeia da Polimerase (PCR) – SSP: Micro SSP (Single Specific Primer) Generic HLA Class II (DR/DQ), Eletroforese em gel de agarose. Os testes imunohematológicos mostraram uma taxa de aloimunização eritrocitária de 31,91 % (15/47). Vinte e quatro aloanticorpos eritrocitários foram identificados com 12 diferentes especificidades. Anticorpos dirigidos contra antígenos do sistema Rh representaram 54,17 % (13/24). Os resultados observados na genotipagem HLA-DRB1 mostraram que nos pacientes aloimunizados, os alelos mais frequentes (20%) foram DRB1*07 (p= 0,235) e DRB1*11 (p= 0,464). Nos pacientes não-aloimunizados, os alelos mais frequentes (14,06%) foram DRB1*03 (p= 0,298) e DRB1*11 (p= 0,464). Em relação à genotipagem HLA-DQB1, o alelo DQB1*03 foi o mais frequentemente encontrado, tanto nos pacientes aloimunizados (36,66%, p= 0,318) quanto nos pacientes não-aloimunizados (26,56%, p= 0,318). Pacientes aloimunizados apresentaram uma maior frequência (70%) do genótipo HLA-DQB1*03/02 (p= 0,024); já entre os pacientes não-aloimunizados o genótipo HLA-DQB1*03/05 apresentou maior frequência (31,25%). Embora não podemos concluir que haja uma relação do sistema HLA com a aloimunização eritrocitária, considerando a população estudada, o alelo DRB1*07 pode estar associado a uma predisposição à imunização em pacientes com doença falciforme.
Sickle Cell Disease (SCD) is the denomination used to characterize a disease caused by the presence of hemoglobin S (HbS) in erythrocyte occurred by the exchange of the valine amino acid to acid glutamic amino acid in the structure of chain B of the Hb, originating a diferent Hb, denominade HbS. Heterozygous people (having a HbS copy and other normal HsA) usually are asymptomatic. The symptomatic forms of the disease occur in homozygous individuals for HbS (called Sickle Cell Anemia) or in cases of conjuction of HbS with hereditary abnormalities: SC hemoglobinopathy, SD hemoglobinopathy, Sβ-thalassemia. The transfusion is a vital component in the treatment of some acute and chronic complications of sickle cell disease. However, the chronic use of red blood cell (RBC) transfusions may lead to RBC alloimmunization, which can impede the meeting of the RBCs for new blood transfusions and increase the risk of hemolytic reactions. Situated in the short arm of chromosome 6, the genes of Major Histocompatibility Complex (MHC) comprises a region of genes highly polymorphic. The proteins resulting from these loci form the HLA complex molecules of which are responsible for presentation of antigens to T and B lymphocyte receptors. The objective of this study was to relate the profile system genotypic of HLA class II (HLA-DRB1 and HLA-DQB1) with RBC alloimmunization in patients with SCD. Samples were collected from 47 patients with sickle cell disease (18 adults and 29 children), with ages between 1 to 58 years, which presented, or not, erythrocyte antibodies, and which are accompanied by the hemocenter of “Faculdade de Medicina de Marília” (FAMEMA). Immunohematological testes were performed in the immunohematology laboratory of FAMEMA’s hemocenter, through the following techniques: ABO/RhD blood typing, irregular antibodies search, identification of the irregular antibodies, RBC phenotyping and antiglobulin direct test. The procedures for HLA typing class II were performed in “Laboratório de Imunologia de Marília – LIM”, using the following techniques: DNA extraction, polymerase chain reaction (PCR) - SSP: micro SSP (single especific primer) generic HLA class II (DR/DQ), electrophoresis on agarose gel. Immunohematological testes showed a RBC alloimmunization rate of 31.91% (15/47). Twenty four RBC alloantibodies were identified with 12 different specificities. Antibodies directed against antigens of Rh system represented 54.17% (13/24). The results observed in genotyping HLA-DRB1 showed that in alloimmunized patients, alleles more frequent (20%) were DRB1*07 (p= 0.235) and DRB1*11 (p= 0.464). In non-alloimmunized patients, the most frequent alleles (14.06%) were DRB1*03 (p= 0.298) and DRB1*11 (p= 0,464). For genotyping HLA-DQB1, the allele DQB1*03 was the most frequently found, both in alloimmunized patients (36.66%, p= 0.318) as in non-alloimmunized patients (26.56%, p= 0.318). Alloimmunized patients presented higher frequency (70%) of genotype HLA-DQB1*03/02 (p= 0.024); while among non-alloimmunized patients, the genotype HLA-DQB1*03/05 presented higher frequency (31.25%). Although we cannot conclude that there is a relationship between the HLA system with RBC alloimmunization, whereas the population studied, the allele DRB1*07 may be associated with a predisposition to immunization in patients with SCD.
FIGURAS
Figura 1 - Mapa da região HLA ... 24
Figura 2 - O complexo HLA e a estrutura das moléculas do HLA ... 25
Figura 3 - Ativação dos linfócitos T e diferenciação dos linfócitos B em plasmócitos 26 Figura 4 - Perfil de Imunoglobulinas ... 39
Figura 5 – Kit illustra blood genomicPrep Mini Spin ... 41
Figura 6 - Microplaca PCR-SSP ... 43
Figura 7 - Cuba para Eletroforese ... 44
Figura 8 - Transiluminador ... 45
Figura 9 - Ilustração para interpretação dos resultados obtidos após a eletroforese em gel de agarose ... 46
Figura 10 - Foto do gel após visualização no transiluminador ... 47
QUADRO Quadro 1 - Termociclagem: PCR-SSP ... 43
GRÁFICOS Gráfico 1 - Alelos HLA-DRB1 mais frequentes em uma população sadia ... 54
Gráfico 2 - Alelos HLA-DQB1 mais frequentes em uma população sadia ... 57
Tabela 1 - Composição normal da Hemoglobina em adultos ... 20
Tabela 2 – Especificidade, número e frequência dos aloanticorpos eritrocitários
identificados em 15 pacientes com Doença Falciforme ... 50
Tabela 3 - Resultados da genotipagem HLA-DRB1 em 47 pacientes com Doença
Falciforme: aloimunizados e não-aloimunizados para antígenos
eritrocitários ... 53
Tabela 4 - Resultados da genotipagem HLA-DQB1 em 47 pacientes com Doença
Falciforme: aloimunizados e não-aloimunizados para antígenos
eritrocitários ... 55
Tabela 5 - Genótipos HLA-DQB1 mais frequentes em pacientes com Doença
Falciforme: aloimunizados e não-aloimunizados a antígenos
Resumo
Abstract
Lista de Ilustrações
Lista de Tabelas
1 Introdução ... 19
2 Objetivos ... 29
2.1 Gerais ... 30
2.2 Específicos ... 30
3 Casuística e Método ... 31
3.1 Comitê de Ética em Pesquisa ... 32
3.2 Amostragem ... 32
3.3 Análise Estatística ... 32
3.4 Metodologia ... 33
3.4.1 Técnicas Imunohematológicas ... 33
3.4.2 Técnicas para genotipagem HLA, Classe II ... 40
4 Resultados e Discussão ... 48
5 Conclusões ... 58
Referências ... 60
Anexos ... 65
Anexo A – Parecer do Comitê de Ética em Pesquisa ... 66
Doença falciforme (DF) é a denominação usada para caracterizar um grupo de doenças em cujas hemácias há pelo menos uma molécuLa de hemoglobina S (HbS) (ANVISA, 2002; CANÇADO, 2007). A hemoglobina (Hb) é constituída de ferro (heme) e quatro cadeias protéicas (globinas). Os tipos de cadeias de globinas determinam os tipos de hemoglobinas (Tabela 1) (ELGHETANY e BANKI, 2007 apud ROSEFF, 2009). A HbS ocorre devido a uma mutação de ponto (GAG->GTG) no gene da globina beta da Hb originando uma hemoglobina anormal, denominada HbS, ao invés da hemoglobina normal denominada hemoglobina A (HbA) (ANVISA, 2002; CANÇADO, 2007).
Tabela 1 - Composição normal da Hemoglobina em adultos – 2009*
Hemoglobina Composição Percentual (%)
Hgb A α2β2 96–98
Hgb A2 α2δ2 1.5–3.5
Hgb F α2γ2 <1
Fonte: Roseff, 2009 * Adaptado pela autora.
A Anemia Falciforme (AF), denominação reservada para a forma da doença que ocorre em homozigotos para a hemoglobina S (Hb SS), é descrita como a primeira “Doença” molecular identificada a partir da troca do aminoácido valina pelo ácido glutâmico na estrutura da cadeia β da hemoglobina (FRENETTE E ATWEH, 2007 apud ROSEFF, 2009) com consequente modificação físico-química na molécula (ANVISA, 2002). Como resultado desta mudança, num ambiente de baixa oxigenação, as hemácias se polimerizam e assumem a forma de "foice". A alteração que ocorre na estrutura das hemácias pode levar à oclusão crônica de vasos sanguíneos, fenômeno conhecido como vaso-oclusão, à redução do fluxo sanguíneo para os órgãos vitais, gerando isquemia e alterações no sistema imunológico. Além disso, as células anormais falciformes são prematuramente retiradas da circulação resultando em anemia hemolítica (VICHINSKY et al., 1990 apud ROSEFF, 2009).
hemoglobina normal, Hb A, do pai, é então designado Hb AS, ou heterozigoto (portador). Os indivíduos heterozigotos, geralmente, são assintomáticos e apenas desenvolvem manifestações clínicas em circunstâncias raras, como hipóxia em altas altitudes (OGEDEGBE, 2002 apud ROSEFF, 2009).
Além disso, o gene da HbS pode combinar-se com outras anormalidades hereditárias das hemoglobinas, como hemoglobina C (HbC), hemoglobina D (HbD), beta-talassemia, entre outras, gerando combinações que também são sintomáticas, denominadas, respectivamente, hemoglobinopatia SC, hemoblobinopatia SD, S/beta-talassemia (Sβ). No conjunto, todas essas formas sintomáticas do gene da HbS, em homozigose ou em combinação, são conhecidas como doenças falciformes. Apesar das particularidades que diferenciam uma das outras e dos diferentes graus de gravidade, todas estas doenças têm um grande significado clínico, hematológico e epidemiológico (ANVISA, 2002; CANÇADO, 2007).
A AF teve sua origem na África e foi trazida às Américas pela imigração forçada dos escravos. No Brasil, sua distribuição abrange quase todos os estados, sendo mais frequente em locais cuja população de descendentes negros é maior (nordeste). Além da África e Américas, é hoje encontrada em toda a Europa e em grandes regiões da Ásia. No Brasil, a doença ocorre predominantemente entre negros e pardos, porém pode também ser encontrada entre os brancos. No sudeste do Brasil, a prevalência média de heterozigotos é de 2%, valor que atinge 6-10% entre os negros. Estimativas, com base na prevalência, permitem estimar a existência de mais de 2 milhões de portadores do gene da HbS no Brasil; mais de 8.000 são afetados com a forma sintomática da doença (HbSS). Estima-se o nascimento de 700 a 1.000 novos casos anuais de anemia falciforme no país, sendo considerada, portanto, um problema de saúde pública no Brasil (ANVISA, 2002; CANÇADO, 2007).
alogênicas (OLIVEIRA e SELL, 2002). Tais anticorpos são chamados de irregulares porque apenas 0,3% a 2,0% da população geral têm testes de triagem positivos em sua detecção (GIRELLO, 2007).
A taxa de aloimunização eritrocitária em pacientes transfundidos cronicamente pode atingir 50%, entretanto, a incidência de anticorpos clinicamente relevantes em pacientes transfundidos, ocasionalmente, não é perfeitamente conhecida. Estima-se que cerca de 1% dos pacientes são sensibilizados a cada unidade de hemácias transfundida (BORDIN, 2007). É importante lembrar que a taxa de aloimunização eritrocitária pode diferir entre regiões ou países, devido as diferenças entre o padrão fenotípico eritrocitário da população de doadores e dos receptores. O risco de aloimunização depende do número (volume) e frequência de transfusões, imunogenicidade do antígeno e da resposta imune do receptor (VICHINSKY et al., 1990, MOREIRA et al., 1996, CAMPBELL-LEE, 2007 apud BORDIN, 2007).
A taxa de aloimunização contra hemácias em pacientes com DF varia entre 3% a 50% e a maioria dos aloanticorpos está relacionada com os sistemas Rh, Kell, Duffy ou Kidd (WAYNE et al., 1993, VICHINSKY, 2001 apud FABRON et al., 2004). No Brasil, dois estudos mostraram uma taxa de aloimunização que variou de 12,9% a 20,8%, sendo a maioria dos aloanticorpos de especificidade Rh e anti-Kell (MOREIRA et al., 1996; FABRON et al., 2004). Quando a fenotipagem eritrocitária não é realizada, a taxa de aloimunização varia entre adultos e crianças, sendo 29 % em crianças e 47 % em adultos com doença falciforme (AYGUN et al., 2002 apud FABRON et al., 2004).
Segundo Moreira et al. (1996), o risco de aloimunização por unidade de hemácias transfundida é de 1,15% em pacientes com DF no Brasil. Além disso, essa taxa é similar ou menor do que em outros grupos de pacientes com doenças hematológicas, ou não, que necessitam de múltiplas transfusões sanguíneas (LOSTUMBO, 1966, FLUIT, 1990, MERIANOU, 1987 apud MOREIRA, 1996).
Os tipos sanguíneos são determinados pela presença, ou não, na superfície das hemácias, de antígenos que podem ser de natureza bioquímica variada, como: carboidratos, lipídeos, proteínas ou uma mistura destes compostos. Estes antígenos eritrocitários são independentes dos antígenos do Complexo Principal de Histocompatibilidade (MHC), o qual determina a histocompatibilidade humana, ou a identidade imunológica do indivíduo. O MHC é expresso por um conjunto de proteínas de superfície celular e também pode ser denominado de antígenos leucocitários humanos (HLA). O HLA, juntamente com o complexo de histocompatibilidade secundário, estão diretamente relacionados à resposta imunológica, garantindo a manutenção da integridade dos tecidos. Quando um organismo é exposto a antígenos estranhos ocorre a interação destes com as proteínas do sistema HLA das células apresentadoras de antígenos (CAA). O produto desta interação permite o reconhecimento do antígeno pelos linfócitos T, CD4 ou CD8 com consequente ativação e produção de mediadores celulares capazes de iniciar toda a resposta imunológica (REISER, 1996 apud LANDI, 1999).
Então, a função básica do sistema HLA na resposta imunológica é promover o reconhecimento dos antígenos pelos linfócitos T (FRAGA e NEUMANN, 1998 apud OLIVEIRA e SELL, 2002).
Situados no braço curto do cromossomo 6, o Complexo Principal de Histocompatibilidade (MHC) compreende uma região de genes altamente polimórficos que desempenham um papel de grande importância no sistema imunológico humano. As proteínas resultantes destes loci são responsáveis pela apresentação de antígenos aos receptores de linfócitos T e B e estão situadas na membrana celular de quase todas as células do sistema imune. Elas formam as moléculas do complexo HLA, que é um dos principais determinantes da histocompatibilidade em transplantes, incluindo os de medula óssea (Centro de Diagnóstico do GACC; OLIVEIRA e SELL, 2002).
Figura 1 - Mapa da região HLA (banda 6p21.3 do cromossomo 6) Obs.: Os genes e pseudogenes não clássicos classe I estão representados por retângulos não preenchidos
Fonte: site da Universidade da Madeira, Campus da Penteada, Funchal, Portugal.
Figura 2 - O complexo HLA e a estrutura das moléculas do HLA, a) Representação da localização dos genes no complexo HLA; b) Diagramas esquemáticos e estruturas cristalinas de molécuLas do HLA da classe I e da classe II
Fonte: Robbins & Cotran, Patologia - Bases Patológicas das Doenças. Ed.7, 2005.
Uma vez que os alelos de classe II apresentam polimorfismo nas cadeias α e β, foram acrescentadas as letras A e B na denominação do alelo. Assim, o gene que codifica a molécula HLA-DR1 (definido pela sorologia) passou a ser denominado genericamente de HLA-DRB1*01, sendo a letra B representativa da cadeia β, altamente polimórfica nos genes HLA-DR (MARSH, 2002 apud ALVES et al., 2005; DONADI, 2000). O HLA classe II constitui no seu conjunto 1198 alelos diferentes já nomeados. O locus HLA-DRB1 possui 368 alelos, já o HLA-DQB1 possui 45 alelos (MARSH et al., 2010).
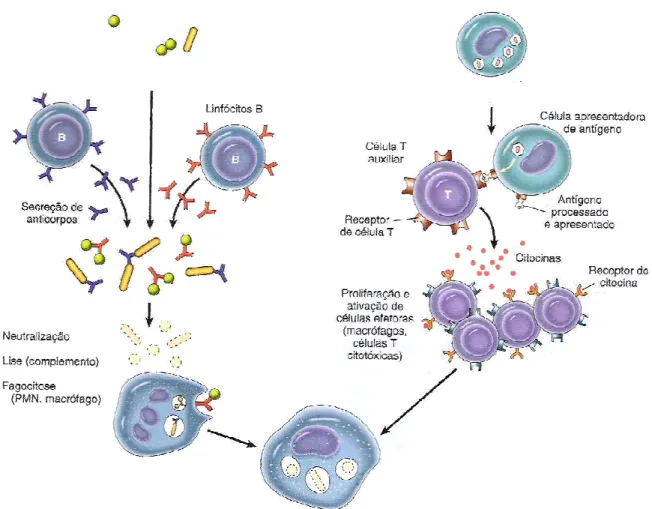
Nas transfusões sanguíneas, as células alogênicas do doador são responsáveis pela sensibilização do receptor. Os linfócitos T CD4 específicos recebem o primeiro sinal de ativação (via receptores de membrana) e outros estímulos complementares que levam à proliferação e à produção de citocinas. As citocinas induzem a expansão de clones de linfócitos T CD8 alorreativos e/ou a diferenciação de linfócitos B em plasmócitos. Os plasmócitos secretam anticorpos específicos para os determinantes antigênicos (Figura 3). Enquanto isso, células de memória, responsáveis pelas respostas anamnásticas, estão sendo formadas (TRINDADE e CAETANO, 2000 apud OLIVEIRA e SELL, 2002).
Figura 3 - Ativação dos linfócitos T e diferenciação dos linfócitos B em plasmócitos (secretam anticorpos específicos aos determinantes antigênicos)
Estudos têm demonstrado que o sistema de histocompatibilidade humano tem importância para a DF devido a sua relação com a predisposição à doenças secundárias (ALVES et al., 2005; HOPPE et al., 2003; STYLES et al., 2000). Segundo Alarif et al. (1986), pacientes com AF e com o genótipo classe I HLA-B35 possuem 6 vezes mais chances de formar aloanticorpos eritrocitários após transfusões sanguíneas do que pacientes sem este genótipo HLA.
O sistema Kidd (Jk) é um dos mais importantes sistemas de grupos sanguíneos na medicina transfusional. O fato de que a imunização não é sempre desenvolvida nos pacientes Jk(a-), que receberam pelo menos uma unidade de hemácia Jk(a+), sugere que a resposta ao antígeno Jka pode ser determinada por fatores genéticos individuais. Segundo Reviron et al. (2005), os alelos HLA-DRB1 podem influenciar o processo imunológico através da apresentação de peptídeos selecionados em sua molécuLa DR. Nesse estudo, o autor observou que a frequência do alelo HLA-DRB1*01 foi significativamente alta nos pacientes com anti-Jka, comparado com o grupo controle.
Um estudo comparando a predisposição genética HLA em pacientes imunizados com anti-K, mostrou uma alta frequência do DRB1*11 e HLA-DRB1*13 nos pacientes imunizados em relação ao grupo controle (CHIARONI et al., 2005).
Em um estudo realizado em 2006, Noizat-Pirenne et al. encontraram uma forte correlação entre o alelo HLA-DRB1*04 e a aloimunização ao antígeno Fya. Recentemente, Chu et al. (2009) demonstraram uma frequência significativamente alta do HLA-DRB1*0901 empacientes com anti-Mia.
No Brasil, em um estudo realizado com pacientes aloimunizados com o anticorpo anti-Dia, os autores encontraram uma frequência alta do alelo HLA-DRB1*07, sugerindo que pode haver uma associação do HLA-DRB1*07 à imunização ao antígeno Dia (BALEOTTI JR. et al., 2010).
2.1. OBJETIVOS GERAIS
Relacionar o perfil genotípico do sistema HLA de classe II (HLA-DRB1 e HLA-DQB1) com a aloimunização eritrocitária em pacientes com Doença Falciforme.
2.2. OBJETIVOS ESPECÍFICOS
•••• Selecionar os pacientes com Doença Falciforme que são atendidos no ambulatório do Hemocentro da Faculdade de Medicina de Marília (FAMEMA);
•••• Verificar a presença de aloanticorpos eritrocitários no soro desses pacientes, através da Pesquisa de Anticorpos Irregulares (P.A.I.);
•••• Identificar as especificidades dos anticorpos eritrocitários detectados, através da Identificação de Anticorpos Irregulares (I.A.I.);
•••• Verificar a taxa de aloimunização em adultos e crianças com Doença Falciforme;
•••• Verificar a imunogenicidade dos anticorpos eritrocitários detectados
nesses pacientes;
•••• Realizar a genotipagem HLA-DRB1 e HLA-DQB1 dos pacientes com
Doença Falciforme;
•••• Comparar as frequências dos alelos HLA encontrados com os da
3.1. COMITÊ DE ÉTICA EM PESQUISA
O presente trabalho foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de Marília – FAMEMA (protocolo de estudo nº 285/10 – Anexo A). Todos os pacientes assinaram o Termo de Consentimento Livre e Esclarecido (TCLE) para esta pesquisa (Anexo B).
3.2. AMOSTRAGEM
Em vista da dificuldade de abordagem dos pacientes, da aceitação dos mesmos na participação da pesquisa, e do tempo para a realização deste estudo, a dimensão da amostra possível foi de 47 pacientes.
Foram, então, coletadas amostras de 47 pacientes com diagnóstico de Doença Falciforme (18 adultos e 29 crianças), com faixa etária entre 1 a 58 anos e que apresentavam, ou não, anticorpos eritrocitários.
Os pacientes selecionados são tratados no Hemocentro da Faculdade de Medicina de Marília e a abordagem deu-se nas datas agendadas como retorno para consulta. É importante deixar claro que não houve necessidade de convocar a presença de qualquer paciente: realizou-se a coleta com aqueles que estavam disponíveis no hemocentro e que concordaram em participar da pesquisa.
3.3. ANÁLISE ESTATÍSTICA
3.4. METODOLOGIA
Na data do retorno agendada dos pacientes participantes da pesquisa foram coletadas amostras de sangue venoso em 3 tubos de 5mL: 2 tubos com anticoagulante EDTA (ácido etileno diamino tetra acético), e 1 tubo sem adição de anticoagulante, o qual foi centrifugado a 3400rpm por 5 minutos para a separação do soro.
Na sequência estão demonstrados os procedimentos e as técnicas utilizadas.
3.4.1. Técnicas Imunohematológicas
Os exames imunohematológicos foram realizados no Laboratório de Imunohematologia do Hemocentro da Faculdade de Medicina de Marília, através das seguintes técnicas:
A. Tipagem Sanguínea ABO/Rh:
A tipagem sanguínea ABO/RhD foi realizada em todas as 47 amostras através da técnica de hemaglutinação em tubo.
• TIPAGEM DIRETA (reagentes DiaMed): Anti-A - DiaClon Anti-A
Anti-B - DiaClon Anti-B Anti-AB – DiaClon Anti-AB Anti-D - DiaClon Anti-D
CRH - DiaClon Rhesus Control
Anti-D (policlonal) - para amostras com resultado negativo com o reagente Anti-D – DiaClon Anti-D.
500µL de papa de hemácias. Foi realizada centrifugação a 3400rpm durante 30 segundos, em seguida o sobrenadante foi desprezado e procedeu-se uma leve homogeneização do material que ficou no tubo. Todo esse processo foi realizado por três sucessivas vezes. Após a última lavagem, fez-se uma suspensão 5% das hemácias lavadas com solução fisiológica 9% (1 mL de solução fisiológica 9% e 50 uL da papa de hemácias lavadas). Os tubos foram identificados para os reagentes Anti-A, Anti-B, Anti-AB, Anti-D, e CRH. Foram pipetados 50µL de cada reagente em seu respectivo tubo; em seguida adicionou-se 50µL da suspensão de hemácias 5% em todos os tubos. Os tubos foram centrifugados por 15 segundos a 3400rpm para que fosse realizada a leitura. A interpretação dos resultados se dá pela presença ou não de aglutinação das hemácias (grumos).
• TIPAGEM REVERSA: foi realizada com o reagente Revercel (Hemácia A e Hemácia B) – Fresenius Kabi.
Identificou-se dois tubos para os reagentes Revercel A e Revercel B. Foram colocados 100µL do soro do paciente em cada tubo. Adicionou-se 50µL de cada reagente em seu respectivo tubo. Em seguida, os tubos foram centrifugados por 15 segundos a 3400rpm para que fosse realizada a leitura. A interpretação dos resultados se dá pela presença ou não de aglutinação das hemácias (grumos).
B. Pesquisa de Anticorpos Irregulares (PAI):
A PAI foi realizada em todas as 47 amostras, através da técnica de hemaglutinação em tubo com um reagente potencializador: BioPeg (polietileno glicol + LISS) – Fresenius Kabi. As hemácias utilizadas na técnica foram: Triacel I e II (Fresenius Kabi).
por 15 segundos a 3400rpm para a leitura. Após a centrifugação, foram adicionados 100µL do reagente BioPeg em cada tubo; posteriormente, os tubos foram colocados em banho-maria 37°C por 15 minutos. A reação foi la vada 3 vezes com solução fisiológica 9%: com o auxílio de uma pipeta acrescentou-se solução fisiológica 9% nos dois tubos. Foi realizada centrifugação a 3400rpm durante 30 segundos, em seguida o sobrenadante foi desprezado e procedeu-se uma leve homogeneização do material decantado. Todo esse processo foi realizado por três sucessivas vezes.
Por último, foram acrescentados 100µL do reagente Coombs Direto soro anti-humano: soro anti-gama e não gama globulinas humanas (Fresenius Kabi). Novamente os tubos foram centrifugados por 15 segundos a 3400rpm para que fosse realizada a leitura. A interpretação dos resultados se dá pela presença ou não de aglutinação das hemácias (grumos).
C. Identificação de Anticorpos Irregulares (IAI):
Amostras com resultados positivos na pesquisa de anticorpos irregulares (presença de aglutinação das hemácias) foram processadas para a identificação dos anticorpos irregulares. Foram utilizadas técnicas de gel-centrifugação: ID-DiaPanel (cartão LISS/Coombs) e ID-DiaPanel-P (cartão NaCl, teste enzimático e aglutininas frias) – DiaMed-ID; e em alguns casos o Painel de Hemácias – Fresenius Kabi para a técnica de hemaglutinação em tubo.
• TÉCNICA DE GEL-CENTRIFUGAÇÃO EM MEIO ENZIMÁTICO (ID-DIAPANEL-P):
do ID Diluente – 1 DiaMed (Bromelina) e 50µL de sangue total ou 25µL de concentrado de hemácias do paciente, seguida da homogeneização. A suspensão de hemácias do paciente também poderia ter sido realizada com 1mL de ID Diluente – 2 DiaMed (LISS) e 10µL de concentrado de hemácias, adicionando depois ao microtubo 25µL de ID-Papain (DiaMed). Com o próprio conta-gotas do reagente foi colocada 1 gota das hemácias-testes do ID-DiaPanel-P (DiaMed) nos microtubos identificados como 1 a 11, observando a identificação destas hemácias com a numeração do microtubo correspondente. Após a homogeneização, foi pipetado 50µL da suspensão de hemácias do paciente no microtubo identificado como AC. Foi, então, adicionado 25µl do soro ou plasma do paciente em todos os microtubos, e, em seguida, a reações foram incubadas por 15 minutos em Banho-Maria seco a 37°C (Incubator 37 SI DiaMed). Os cartões foram centrifugados na centrífuga ID-Centrifuge 24 S (DiaMed) para que fosse realizada a leitura.
Interpretação dos resultados: POSITIVO = células aglutinadas formando uma linha vermelha na superfície do gel ou dispersas ao longo do gel; NEGATIVO = botão compacto de células no fundo do poço.
• TÉCNICA DE GEL-CENTRIFUGAÇÃO EM LISS/AGH (ID-DIAPANEL):
microtubos e, em seguida, a reações foram incubadas por 15 minutos em Banho-Maria seco a 37°C (ID-Incubator 37 SI DiaMed). Os c artões foram centrifugados na centrífuga ID-Centrifuge 24 S (DiaMed) para que fosse realizada a leitura.
Interpretação dos resultados: POSITIVO = células aglutinadas formando uma linha vermelha na superfície do gel ou dispersas ao longo do gel; NEGATIVO = botão compacto de células no fundo do poço.
• TÉCNICA DE HEMAGLUTINAÇÃO EM TUBO:
D. Fenotipagem Eritrocitária:
A fenotipagem do sistema Rh e do antígeno Kell foi realizada em todas as amostras, utilizando a técnica de Gel centrifugação: cartão Rh-subgrupos+Cw+K (anticorpos humanos) C,Cw,c,E,e,K – DiaMed.
Inicialmente, os reagentes foram deixados à temperatura ambiente por 10 minutos. O cartão ID-Subgrupos Rh + CW + Kell foi identificado com o nome/número do paciente. Um tubo de hemólise foi separado e identificado com nome/número do paciente; nele foi colocado 0,5mL de ID-Diluente 1 DiaMed (Bromelina) e 25µl da papa de hemácias do paciente. Retirou-se a fita selante do ID cartão, seguiu-se com a pipetagem de 10µl da suspensão de hemácias preparada do paciente em cada microtubo do cartão. O cartão foi deixado 10 minutos à temperatura ambiente para que ocorresse a ação enzimática do ID-Diluente. Posteriormente, o cartão foi centrifugado por 10 minutos na centrífuga ID-Centrifuge 24S (DiaMed) para que fosse realizada a leitura.
Interpretação dos resultados: POSITIVO = células aglutinadas formando uma linha vermelha na superfície do gel ou dispersas ao longo do gel; NEGATIVO = botão compacto de células no fundo do poço.
As amostras nas quais foram realizadas a IAI foram fenotipadas para o antígeno contra o qual foi produzido o anticorpo.
E. Teste Direto da Antiglobulina (Coombs Direto):
Em todas as amostras foi realizado o teste de Coombs Direto (CD) com a técnica de hemaglutinação em tubo. Utilizou-se o Coombs Direto soro anti-humano: soro anti-gama e não gama globulinas humanas (Fresenius Kabi). Para controle do teste foi utilizada a hemácia Controcel (Fresenius Kabi).
3400rpm durante 30 segundos, em seguida o sobrenadante foi desprezado e procedeu-se uma leve homogeneização do material que ficou no tubo. Todo esse processo foi realizado por três sucessivas vezes. Após a última lavagem, fez-se uma suspensão 5% das hemácias lavadas com solução fisiológica 9% (1mL de solução fisiológica 9% e 50µL da papa de hemácias lavadas). Um tubo de hemólise foi identificado com nome/número do paciente, e nele foram colocados 100µL do reagente Coombs Direto soro anti-humano: soro anti-gama e não gama globulinas humanas (Fresenius Kabi) e 50µL da suspensão de hemácias já preparada do paciente. Por último o tubo foi centrifugado por 15 segundos a 3400rpm para que fosse realizada a leitura.
Interpretação dos resultados: POSITIVO = células aglutinadas formando uma linha vermelha na superfície do gel ou dispersas ao longo do gel; NEGATIVO = botão compacto de células no fundo do poço.
Em casos de teste CD positivo, foi utilizado o cartão de Gel centrifugação com um perfil de imunoglobulinas: DC-Screening I (IgG,IgA,IgM,C3c,C3d,ctl) – DiaMed, conforme demonstrado na Figura 4. A técnica para o preparo das reações foi a mesma.
3.4.2. Técnicas para genotipagem HLA, Classe II
Os procedimentos para a genotipagem HLA - Classe II - dos 47 pacientes foram realizados no Laboratório de Imunologia de Marília – LIM, utilizando as seguintes técnicas:
A. Extração de DNA:
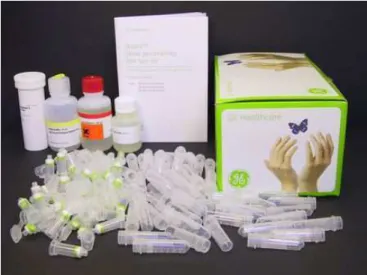
Utilizando o kit illustra blood genomicPrep Mini Spin Kit (Figura 5), a extração de DNA, no método de coluna, foi realizada da seguinte maneira:
• Em um microtubo 1,5mL foram colocados 30µL de proteinase K, 250µL do creme leucocitário da amostra do paciente, e 400µL de tampão de Lise (Lysis Buffer). A reação ficou 10 minutos à temperatura ambiente, em seguida toda a reação foi transferida para a coluna. As células do sangue foram lisadas por um sal caotrópico em tampão de Lise na presença de proteinase K.
• O sal caotrópico em tampão de Lise promoveu uma seleção do DNA genômico que ficou retido na membrana de sílica da coluna. As proteínas desnaturadas foram coletadas, passando pela coluna durante a centrifugação (14000rpm por 1 minuto).
• Mais uma lavagem foi realizada com o tampão de Lise (500µL do tampão foi adicionado na coluna); as proteínas, juntamente com outros contaminantes, que estavam ligados à membrana do DNA genômico, foram removidos durante a centrifugação (14000rpm por 1 minuto).
• O tampão de lavagem (Wash Buffer), contendo etanol, foi adicionado na coluna (500µL); os resíduos de sal e de outros contaminantes foram removidos durante a centrifugação (14000rpm por 3 minutos). • Água para injeção à 70°C foi adicionada na coluna, e após a
Figura 5 – Kit illustra blood genomicPrep Mini Spin Fonte: site da empresa GE Healthcare.
B. Reação de PCR (Reação em Cadeia da Polimerase):
A metodologia da PCR-SSP está baseada no princípio em que oligonucleotídeos completamente pareados, são eficientemente utilizados na amplificação da sequência alvo com auxílio da enzima Taq polimerase. Pares de
primers são desenhados para apresentar perfeito pareamento somente com a
sequência de um alelo ou de um grupo de alelos. Sob condições de PCR estritamente controladas, os pares de primers perfeitamente pareados amplificam a sequência alvo (isto é, resultado positivo); enquanto que pares de primers que não apresentam perfeito pareamento, não amplificam a sequência alvo (isto é, resultado negativo). Após o processo de PCR, os fragmentos de DNA amplificados são separados por eletroforese em gel de agarose e visualizados pela intercalação do brometo de etídeo e, então, expostos à luz ultravioleta.
Antes da realização da técnica de PCR-SSP, a luz ultra Violeta (UV) da cabine de trabalho foi ligada por 15 minutos. Materiais e reagentes que foram separados para a realização da técnica: tampas seladoras para microplaca, “worksheet” (planilha de trabalho) SSP referente aos loci testados, enzima Taq
Polimerase Platinum (Invitrogen), D-mix para PCR-SSP (One-Lambda), microplacas
ambiente por 10 minutos, a Taq Polimerase foi mantida no gelo e a microplaca SSP no freezer -20°C. A worksheet foi preenchida com o nome e número da amostra do paciente, tipo de extração de DNA, posição da amostra na microplaca SSP, lote da
Taq Polimerase, data e responsável pelo PCR-SSP. A película adesiva ou tampa seladora para microplaca PCR-SSP foi identificada com o número da amostra.
Em cada microplaca SSP foi possível realizar 3 PCR de 3 pacientes, conforme demonstrado na Figura 6. A tampa adesiva da microplaca SSP foi retirada e colada na respectiva worksheet o pedaço correspondente. A microplaca foi dividida com uma caneta retroprojetor de ponta grossa para 3 amostras (32 poços para cada amostra, com um controle negativo para cada amostra). Na alíquota de D-mix do kit foi adicionado 19,8µL de água para injeção e 2µL de Taq Polimerase (Mix PCR). Em seguida, foi pipetado 10µL do Mix-PCR na posição do Controle Negativo (poço marcado com um ponto vermelho na microplaca). Foi então adicionado 19,8µL de cada amostra de DNA no seu respectivo Mix-PCR (Mix-PCR-Amostra). Posteriormente, foi pipetado 10µL deste Mix-PCR-Amostra nas laterais dos poços da microplaca de PCR, exceto no Controle Negativo. A microplaca de PCR-SSP foi selada com a película adesiva identificada e encaminhada para o Termociclador (seguindo a termociclagem demonstrada no Quadro 1).
Figura 6 - Microplaca PCR-SSP
TERMOCICLAGEM FIM
1 ciclo 1 ciclo 9 ciclos 20 ciclos
96 ºC 63 ºC 96 ºC 63 ºC 96 ºC 59 ºC 72 ºC 4 ºC
2,10 min 1 min 10 s 1 min 10 s 50 s 30 s ∞
Quadro 1 - Termociclagem: PCR-SSP
Fonte: Folheto Informativo do Produto – One Lambda. Revisão 16, 07/2009.
C. Eletroforese em gel de Agarose:
transparente). Em um becker de 50mL, foi adicionado 3 gotas de água corrente. Foi pipetado 1 a 1,3µL de Brometo de Etídio e colocado no fundo do becker com água para homogeneizar. Adicionou-se 40mL do gel líquido no becker com Brometo de Etídio; a solução foi homogeneizada, sem formar bolhas, até esfriar o gel para colocá-lo na cuba de eletroforese.
• Para moldar o gel com 96 poços: foram utilizados 12 pentes na cuba de eletroforese, dispostos em sequência.
• Eletroforese: depois de pronto, o gel contendo 96 poços foi colocado na cuba de eletroforese. Foi adicionado tampão TBE 1X até cobrir o gel. A microplaca contendo o produto de PCR foi separado e o volume total das amostras foi pipetado nos respectivos poços. A tampa que está conectada na fonte de eletroforese foi encaixada na cuba (Figura 7). Depois de verificada a voltagem (150 V) e ajustado o tempo de corrida (5 minutos) a eletroforese foi iniciada.
Figura 7 - Cuba para Eletroforese
também as posições onde não houve presença de banda e as posições que apresentaram duas bandas.
Figura 8 - Transiluminador
D. Interpretação dos resultados:
A interpretação dos resultados do PCR-SSP foi baseada na presença ou na ausência de um fragmento de DNA amplificado específico. Um par de primer, para controle interno estava incluído em cada reação de PCR. Este amplifica uma região conservada do gene da beta globina humana, o qual está presente em todas as amostras de DNA e é utilizado para verificar a integridade da reação de PCR. Na presença de uma banda positiva (amplificação específica do alelo HLA), o produto do par de primer do controle interno pode estar fraco ou ausente devido às diferenças na concentração e temperatura de ligação entre o par de primer
Deste modo, a reação positiva para o alelo ou grupo de alelos específicos foi visualizado no gel como um fragmento amplificado de DNA entre a banda do controle interno e a banda do primer não incorporado (Figuras 9 e 10).
Reação Pos. Reação Neg. Não amplificado
Poço
Banda Controle Interno Banda de tipagem positiva Banda do primer
Figura 9 - Ilustração para interpretação dos resultados obtidos após a eletroforese em gel de agarose; Obs.: A banda de controle interno e a banda do primer atuam como marcadores de tamanho, qualquer banda visível entre os dois marcadores de tamanho deverá ser considerada como banda de tipagem positiva
Fonte: Folheto Informativo do Produto – One Lambda. Revisão 16, 07/2009.
E. Análise dos resultados no software HLA Fusion:
Possible Allele Code. Todas as informações foram anotadas, a foto foi impressa e colada na worksheet.
Foram estudados 47 pacientes com Doença Falciforme cujo diagnóstico foi baseado na eletroforese de Hb dos pacientes e genitores, e que estão em tratamento no Hemocentro da Faculdade de Medicina de Marília. Pretendeu-se verificar uma possível relação do sistema de histocompatibilidade (HLA) com a formação de aloanticorpos eritrocitários.
Os testes imunohematológicos realizados nas amostras de sangue de 47 pacientes com DF mostraram uma taxa de aloimunização eritrocitária de 31,91 % (15/47). A taxa de aloimunização encontrada em nosso estudo está dentro do esperado para pacientes com DF, como mostrado em uma coletânea de estudos norte-americanos, onde a taxa de aloimunização eritrocitária variou entre 3 e 50% em pacientes com DF (COLES, 1981, ORLINA, 1978, DAVIES, 1986, COX, 1988 apud MOREIRA, 1996; WAYNE, 1993, VICHINSKY, 2001 apud FABRON et al., 2004).
Mais recentemente, no Brasil, Fabron et al. (2004), encontraram uma taxa de aloimunização eritrocitária de 20,8% em pacientes com Anemia Falciforme. É importante salientar que a taxa de aloimunização pode diferir entre determinadas regiões ou países e é influenciada pelo tempo, número de transfusões e, principalmente, pelo perfil fenotípico eritrocitário de pacientes e doadores (VICHINSKY, 1990 apud BORDIN, 2007; MOREIRA et al., 1996).
Quando analisamos a taxa de aloimunização por faixa etária, verificamos que 20,7% dos pacientes pediátricos e 50% dos adultos eram aloimunizados para algum antígeno eritrocitário. Em 2002, Aygun et al. (apud FABRON et al., 2004), estudando retrospectivamente a aloimunização na DF, apresentaram uma taxa de aloimunização semelhante a encontrada em nosso estudo, que foi de 29% em pacientes pediátricos e 47% em adultos.
Fabron et al. (2004), em um estudo realizado com pacientes falciformes, relatou que 65,8% dos anticorpos detectados eram do sistema Rh, principalmente com especificidade anti-E, o que vem ao encontro dos resultados do nosso estudo.
No artigo publicado por Moreira et al. (1996), 66,66% dos anticorpos detectados eram do sistema Rh; e 80% eram do sistema Rh e Kell.
Wayne,1993; Vichinsky 2001 (apud FABRON et al., 2004), reportaram uma taxa de aloimunização eritrocitária em pacientes com DF entre 3 a 50% destacando que a maioria dos aloanticorpos estavam relacionados com os sistemas Rh, Kell, Duffy ou Kidd.
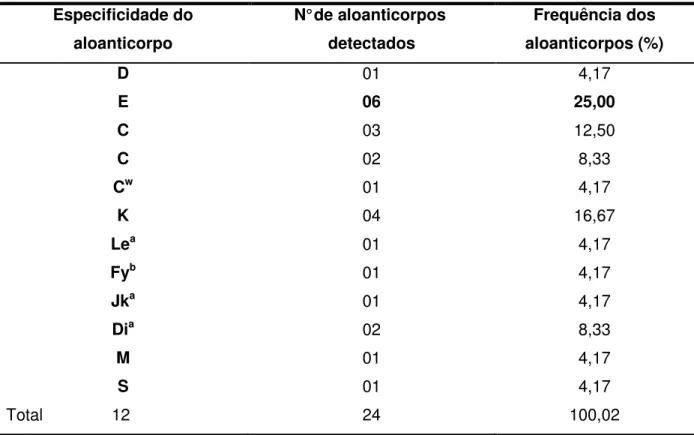
Tabela 2 - Especificidade, número e frequência dos aloanticorpos eritrocitários identificados em 15 pacientes com Doença Falciforme
Especificidade do aloanticorpo
N° de aloanticorpos detectados
Frequência dos aloanticorpos (%)
D 01 4,17
E 06 25,00
C 03 12,50
C 02 8,33
Cw 01 4,17
K 04 16,67
Lea 01 4,17
Fyb 01 4,17
Jka 01 4,17
Dia 02 8,33
M 01 4,17
S 01 4,17
Total 12 24 100,02
sanguíneo mais importante, depois do grupo ABO (GIRELLO, 2007). A imunogenicidade dos antígenos do sistema Rh mais frequentemente encontrados é assim descrita: D > c > E > C > e (HARMENING, 2006).
Quando da avaliação da aloimunização eritrocitária, também foram observados alguns pacientes com auto-anticorpos. Dos quinze pacientes em que foram identificados aloanticorpos, 7 apresentavam também auto-anticorpos: 2 anti-e, 3 anti-I, 2 anti-IH. É importante enfatizar que auto-anticorpos podem mascarar a presença de aloanticorpos em pacientes com DF, dificultando a identificação destes. Isso pode, como consequência, provocar reações hemolíticas em uma transfusão.
Existem relatos na Literatura sugerindo uma associação da aloimunização eritrocitária à antígenos específicos e o sistema de histocompatibilidade (HLA), como visto por Reviron et al. (2005), que mostraram a relação dos alelos HLA-DRB1 e a imunização ao antígeno Jka, onde a frequência do HLA-DRB1*01 foi mais alta em pacientes (55%) do que no grupo controle (17%). Já Chiaroni et al. (2005) apontaram uma frequência do HLA-DRB1*11 significativamente alta em pacientes (57%), quando comparado com o grupo controle (28%). Os autores também sugerem que os alelos HLA-DRB1 podem influenciar no processo imunológico de apresentação do antígeno na molécula DR. Para Noizat-Pirenne et al. (2006) 58,62% dos pacientes que tinham o anticorpo anti-Fya apresentaram o alelo HLA-DRB1*04. Picard et al. (2009) concluíram que os alelos HLA-DRB1*04 e DRB1*1501 estão representados em pacientes imunizados com anti-Fya.
No Brasil, em um recente estudo, os autores sugerem uma possível associação do HLA-DRB1*07 com a imunização ao antígeno Dia (BALEOTTI JR. et al., 2010).
Como descrito acima, embora haja relatos sugerindo a associação do sistema HLA com a aloimunização a alguns antígenos específicos de glóbulos vermelhos, não há relatos na literatura que relacionam a predisposição à formação de aloanticorpos em pacientes com DF e o sistema HLA.
Para estudar as possíveis relações de pré-disposição à formação de anticorpos, os pacientes diagnosticados com DF foram divididos em dois grupos: aloimunizados e não-aloimunizados, para estudo comparativo de frequência do HLA Classe II.
Os resultados da genotipagem HLA-DRB1 foram analisados levando em consideração o alelo mais frequente no grupo de pacientes aloimunizados e não-aloimunizados (Tabela 3). Nos pacientes não-aloimunizados, os alelos mais frequentes foram DRB1*07 e DRB1*11, representando, cada um, 20% (6/30) dos alelos observados. Nos pacientes não-aloimunizados, os alelos DRB1*03 e DRB1*11 foram os mais frequentes, representando, cada um, 14,06 % (9/64).
Tabela 3 - Resultados da genotipagem HLA-DRB1 em 47 pacientes com Doença Falciforme: aloimunizados e não-aloimunizados para antígenos eritrocitários
Alelo HLA-DRB1
Aloimunizados (n = 15) Não-aloimunizados (n = 32)
Número de alelos Frequência do alelo (%) Número de alelos Frequência do alelo (%)
01 2 6,66 5 7,81
03 2 6,66 9 14,06
04 5 16,66 3 4,68
07 6 20 7 10,94
08 2 6,66 7 10,94
09 0 0 2 3,12
10 1 3,33 2 3,12
11 6 20 9 14,06
12 0 0 3 4,68
13 1 3,33 8 12,5
14 0 0 3 4,68
15 4 13,33 5 7,81
16 1 3,33 1 1,56
Total 30 99,96 64 99,96
Para o grupo controle selecionou-se 1000 indivíduos sadios, da raça negra, da população de Doadores Voluntários de Medula Óssea (DVMO) da região centro-oeste do estado de São Paulo (dados do Laboratório de Imunologia de Marília (LIM); resultados não publicados).
Os alelos mais frequentes encontrados foram DRB1*03 e DRB1*13 (cerca de 13%), como demonstrado no Gráfico 1.
Nos pacientes não-aloimunizados, o alelo mais presente foi o DRB1*03, encontrado muito frequentemente na população controle. O mesmo ocorre com o alelo DRB1*11, encontrado nos dois grupos de pacientes.
9,45%
13,15%
8,40%
9,95%
6,70%
12,40%
13,15%
12,15%
14,65%
0,00% 2,00% 4,00% 6,00% 8,00% 10,00% 12,00% 14,00% 16,00%
01 03 04 07 08 11 13 15 Outros Alelos
Gráfico 1: Alelos HLA-DRB1 mais frequentes em uma população sadia
Fonte: Banco de dados do Laboratório de Imunologia de Marília - LIM
Tabela 4 - Resultados da genotipagem HLA-DQB1 em 47 pacientes com Doença Falciforme: aloimunizados e não-aloimunizados para antígenos eritrocitários
Alelo HLA-DQB1
Aloimunizados (n = 15) Não-aloimunizados (n = 32)
Número de alelos
Frequência do alelo (%)
Número de alelos
Frequência do alelo (%)
02 8 26,66 15 23,44
03 11 36,66 17 26,56
04 1 3,33 5 7,81
05 4 13,33 14 21,87
06 6 20 13 20,31
Total 30 99,98 64 99,99
Os alelos DQB1*03 foram encontrados em 10 pacientes aloimunizados (somando 11 alelos) e 16 pacientes não-aloimunizados (somando 17 alelos). Sabendo-se que cada indivíduo possui 2 alelos de cada gene, separamos esses 10 pacientes para que fosse verificada a frequência dos genótipos DQB1*03.
A Tabela 5 mostra a associação do HLA-DQB1*03 com outros alelos. O genótipo HLA-DQB1*03/02 apareceu com maior frequência nos pacientes aloimunizados (7/10), sendo este resultado significante do ponto de vista estatístico, em relação ao grupo de pacientes não-aloimunizados (p= 0,024). Sendo assim, é possível sugerir que haja uma relação do genótipo DQB1*03/02 com a aloimunização eritrocitária.
Tabela 5 – Genótipos HLA-DQB1 mais frequentes em pacientes com Doença Falciforme: aloimunizados e não-aloimunizados a antígenos eritrocitários
Associação do DQB1*03 com outros alelos
Aloimunizados (n = 10) Não-aloimunizados (n = 16)
Número de genótipos Frequência do genótipo (%) Número de genótipos Frequência do genótipo (%)
03/02 7 70 4 25
03/03 1 10 1 6,25
03/04 0 0 2 12,5
03/05 1 10 5 31,25
03/06 1 10 4 25
Para o grupo controle HLA-DQB1 foram selecionados 95 indivíduos sadios, da raça negra, DVMO, da região centro-oeste do estado de São Paulo (dados do LIM; resultados não publicados).
O Gráfico 2 mostra as frequências alélicas HLA-DQB1 obtidas da população controle, sendo os alelos mais frequentes DQB1*06 (30%) e DQB1*03 (cerca de 27%).
Comparando os resultados das 3 populações, pode ser observado que o alelo DQB1*03 é encontrado com frequência nos dois grupos de pacientes e na população controle (p>0,05).
O Gráfico 3 mostra a associação do HLA-DQB1*03 com outros alelos de 44 indivíduos do grupo controle. Comparando o resultado do grupo de pacientes aloimunizados com a população controle, pode ser observado que a frequência do genótipo HLA-DQB1*03/02 é maior nos pacientes, indicando novamente que pode haver uma correlação com a aloimunização eritrocitária.
17,37%
26,84%
5,79%
20,00%
30,00%
0,00% 5,00% 10,00% 15,00% 20,00% 25,00% 30,00% 35,00%
02 03 04 05 06 Alelos
Gráfico 2 - Alelos HLA-DQB1 mais frequentes em uma população sadia
Fonte: Banco de dados do Laboratório de Imunologia de Marília - LIM
20,45%
15,90%
4,55%
27,30%
31,81%
0,00% 5,00% 10,00% 15,00% 20,00% 25,00% 30,00% 35,00%
03/02 03/03 03/04 03/05 03/06 Genótipos
Gráfico 3 - Genótipos HLA-DQB1 de 44 indivíduos em uma população sadia
Com base nos resultados obtidos no presente estudo, bem como nas informações oriundas da literatura, foi possível propor as conclusões abaixo:
Quanto às especificidades dos aloanticorpos eritrocitários, os que apresentaram uma maior frequência foram: Anti-E (25 %) e Anti-K (16,67 %). Anticorpos do sistema Rh representaram 54,17% (13/24) dos anticorpos identificados, sendo esses os mais imunogênicos.
A taxa de aloimunização foi de 31,91%, e se mostrou maior em adultos (50%) do que em crianças (20,7%).
A alta frequência dos alelos DRB1*11 e DRB1*03 coincidem com a encontrada na população controle (raça negra), ou seja, os dois alelos citados também são frequentes na população sadia.
A frequência do alelo DRB1*07, observado nos pacientes aloimunizados, foi maior do que a encontrada na população sadia da raça negra, podendo estar relacionado com a predisposição à aloimunização eritrocitária nos pacientes com DF.
O alelo HLA-DQB1*03 foi o mais frequente nos dois grupos de pacientes estudados. Quando associado a outros alelos, observamos que o genótipo DQB1*03/02 é muito frequente nos pacientes aloimunizados, indicando uma possível associação com a formação de anticorpos eritrocitários.
No grupo dos pacientes não-aloimunizados, o HLA-DQB1*03/05 foi o genótipo mais frequente (31,25%; p= 0,211), podendo estar relacionado com uma proteção para a formação de aloanticorpos em pacientes com DF.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Manual de diagnóstico e tratamento de doenças falciformes. Brasília: ANVISA, 2002.
ALARIF, L. et al. HLA-B35 is associated with red cell alloimmunization in sickle cell disease. Clin. Immunol. Immunopathol., v.38, n.2, p.178-183, 1986.
ALVES, C. et al. Importância do sistema de histocompatibilidade humano (HLA) em Pediatria. Pediatria, v.27, n.4, p. 274-286, 2005.
BALEOTTI JR., W. et al. Association of HLA DRB1*07 Allele with Dia Alloimmunization in a Brazilian Population. Transfusion, v.50, p.17A, 2010. (Abstract Supplement).
BORDIN, J.O. Aloimunização após transfusão de concentrado de hemácias em pacientes atendidos em um serviço de emergência. Rev. Bras. Hematol. Hemoter., v.29, n.4, p.1-3, 2007. Disponível em: http://www.scielo.br/scielo.php?pid=S1516-84842007000400001&script=sci_arttext. Acesso em: 15 out. 2010.
CANÇADO, R.D. Doenças Falciformes. Prát. Hosp., v.9, n.50, p.61-64, 2007. Disponível em: http://www.praticahospitalar.com.br/pratica%2050/pdfs/mat%2008-50.pdf. Acesso em: 25 out. 2010.
CENTRO DE DIAGNÓSTICO DO GACC. Laboratório de Imunogenética e Transplantes (HISTOCOMPATIBILIDADE). Disponível em: <http://www.cdg.org.br/site_CDG/lab_imunologia.asp>. Acesso em: 24 jul. 2010.
CHIARONI, J. et al. HLA-DRB1 polymorphism is associated with Kell immunization. B. J. Haematol., v.132, p.374-378, 2005.
DIAMED: A DIVISION OF BIO-RAD. Teste de Coombs Direto (AGH), ID-DC Screening I (IgG-IgA-IgM-C3c-C3d-ctl). Disponível em: http://www.diamed.com.br/cmi/Pagina.aspx?265. Acesso em: 25 nov. 2010.
DONADI, E.A. Como entender a nomenclatura e os mecanismos de associação entre os antígenos e os alelos de histocompatibildade com as doenças. Medicina (Ribeirão Preto), v.33, p.7-18, 2000.
FABRON JR., A. et al. Application of noninvasive phagocytic cellular assays using autologous monocytes to assess red cell alloantibodies in sickle cell patients. Transf. Apher. Sci., v.31, n.1, p.29-35, 2004.
FERNANDES, A.P.M. et al. Como entender a associação entre o sistema HLA e as doenças auto-imunes endócrinas. Arq. Bras. Endocrinol. Metab., v.47, n.5, p.601-611, 2003.
GE HEALTHCARE. illustra blood genomicPrep Mini Spin Kit. Disponível em: http://www.gelifesciences.com/aptrix/upp01077.nsf/Content/sample_preparation~pro duct_selection_category~genomic_dna_purification~blood_genomicprep_mini_spin_ kit?OpenDocument&moduleid=166870. Acesso em: 28 nov. 2010.
GIRELLO, A.L.; KUHN, T.I.B.B. Fundamentos da imuno-hematologia eritrocitária. 2.ed. São Paulo: Senac, 2007. 253p.
HARMENING, D.M. Técnicas Modernas em Banco de Sangue e Transfusão. 4.ed. Rio de Janeiro: Revinter, 2006. 594p.
HOPPE, C. et al. Distinct HLA associations by stroke subtype in children with sickle cell anemia. Blood, v.101, n.7, p.2865-2869, 2003.
LABORATÓRIO DE IMUNOLOGIA DE MARÍLIA – LIM. Banco de dados da genotipagem HLA-DRB1 e HLA-DQB1. Marília: [s.n.], 2010.
LANDI, E.P.; OLIVEIRA, J.S.R. Doença do enxerto contra hospedeiro pós-transfusional - guia para irradiação gama de hemocomponentes. Rev. Assoc. Med. Bras., v.45, n.3, p.261-272, 1999.
MARSH, S.G.E. et al. Nomenclature for factors of the HLA system, 2010. Tissue Antigens, v.75, p.291-455, 2010.
MOREIRA JR., G. et al. Red Blood Cell Alloimmunization in Sickle Cell Disease: The influence of Racial and Antigenic Pattern Differences Between Donors and Recipients in Brazil. Am. J. Hematol., v.52, p.197-200, 1996.
NOIZAT-PIRENNE, F. et al. Relative immunogenicity of Fya and K antigens in a Caucasian population, based on HLA class II restriction analysis. Transfusion, v.46, p. 1328-1333, 2006.
OLIVEIRA, E.A.; SELL, A.M. Os antígenos HLA e a hemoterapia. Acta Sci, v.24, n.3, p.731-736, 2002.
ONE LAMBDA: ADVANCING TRANSPLANT DIAGNOSTICS. Folheto Informativo do Produto. Disponível em: http://216.65.66.131/product-attachment.aspx?c1=molecular&c2=micro-ssp-&c3=generic-tray&c4=6&c6=20, “Product Insert”. Acesso em: 21 nov. 2010.
PICARD, C. et al. Positive association of DRB1 04 e DRB1 15 alleles with Fya immunization in a Southern European population. Transfusion, v.49, n.11, p.2412-2417, 2009.
ROSEFF, S.D. Sickle cell disease: a review. Immunohematology, v.25, n.2, p.67-74, 2009.
SAMPAIO-BARROS, P.D. et al. Consenso Brasileiro de Espondiloartropatias: Espondilite Anquilosante e Artrite Psoriásica: Diagnóstico e Tratamento – Primeira Revisão. Rev. Bras. Reumatol., v. 47, n.4, p. 233-242, 2007.
STYLES, L.A. et al. Evidence for HLA-related susceptibility for stroke in children with sickle cell disease. Blood, v.95, n.11, p.3562-3567, 2000.
ANEXO B – Termo de Consentimento Livre e Esclarecido
(Modelo)
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO – TCLE
Título da Pesquisa: Avaliação da correlação entre Aloimunização à Antígenos Eritrocitários e Sistema de Histocompatibilidade (HLA) em pacientes com Doença Falciforme.
Pesquisador Responsável: Carla Woelke Cabestré
A pesquisa a que se refere irá estudar os pacientes com Doença Falciforme e avaliar a correlação entre a Aloimunização à Antígenos Eritrocitários, o que acontece após o recebimento de transfusões sanguíneas, e o Sistema de Histocompatibilidade (HLA), que possui uma grande importância no sistema imunológico. O principal objetivo deste trabalho é comparar os resultados obtidos com a tipagem HLA e a identificação dos anticorpos irregulares nestes pacientes, observando a relação de algum antígeno HLA com os anticorpos eritrocitários identificados. O estudo da correlação entre o sistema HLA e a aloimunização eritrocitária poderá contribuir para uma maior segurança, quando da transfusão de hemácias em pacientes portadores de doença falciforme, prevenindo reações transfusionais.
Para a realização deste trabalho, precisamos coletar um tubo de sangue de cada paciente, para a realizações de exames, como consta do projeto, no momento em que este paciente estiver no Hemocentro de Marília para o acompanhamento ambulatorial.
Durante o curso da pesquisa, os pacientes poderão entrar em contato conosco para o esclarecimento de quaisquer dúvidas que venham a ter. Todos os envolvidos têm a garantia do sigilo que assegura a privacidade quanto aos dados confidenciais envolvidos na pesquisa.
O paciente tem a liberdade de se recusar a participar desta pesquisa, assim como retirar o seu consentimento em qualquer fase da pesquisa, sem penalização alguma e sem prejuízo ao seu cuidado.
Marília, ____ de ___________________ de 20___.
Assinatura do Participante Carla Woelke Cabestré – CRBM 13159 ou responsável legal carlacabestre@gmail.com