UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Efeito pró-inflamatório de uma lectina
purificada da esponja marinha
Cliona varians
ALEXANDRE FLÁVIO SILVA DE QUEIROZ
Natal / RN
ALEXANDRE FLÁVIO SILVA DE QUEIROZ
Efeito pró-inflamatório de CVL, uma lectina
purificada da esponja marinha
Cliona varians
Tese a ser apresentada ao Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte como requisito para obtenção do título de Doutor em Ciências da Saúde.
Orientador: Prof. Dr. Maurício Pereira de Sales
Natal / RN
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Efeito pró-inflamatório de uma lectina
purificada da esponja marinha
Cliona varians
ALEXANDRE FLÁVIO SILVA DE QUEIROZ
Coordenador do Programa de Pós-Graduação em Ciências da Saúde
Prof. Dr. Aldo da Cunha Medeiros
Natal / RN
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Efeito pró-inflamatório de uma lectina
purificada da esponja marinha
Cliona varians
Presidente da Banca: Prof. Dr. Maurício Pereira de Sales (UFRN)
Banca Examinadora: Prof. Dr. Maurício Pereira de Sales (UFRN) Profª. Dra. Edda Lisboa Leite (UFRN) Prof. Dr. Elizeu Antunes dos Santos (UFRN) Profª. Dra. Patrícia Maria Guedes Paiva (UFPE) Proª Dra. Sumika Kiyota (USP)
Natal / RN
AGRADECIMENTOS
Meu agradecimento inicial vai ao Prof. Dr. Maurício Pereira de Sales, meu orientador e amigo. Agradeço pela determinação com que conduz suas pesquisas, pela amizade, pelos ensinamentos e pelo exemplo de competência e visão institucional na sua atuação como docente da UFRN;
Aos amigos do Laboratório e membros da confraria, Raniere Moura, Fabiano Teixeira, Carlos Gomes e Ivan Rui, agradeço a amizade e cumplicidade em todos os momentos em que convivemos;
Agradeço a Raniere Moura por ter iniciado os estudos com a Cliona varians o que me permitiu dar continuidade aos estudos e resultando na presente tese;
Agradeço as Professoras Carmem Veríssima e Gizele Zenker pela oportunidade que me deram em trabalhar ao lado de tão competentes e simpáticas pessoas na Universidade de Campinas;
Ao Prof. Elizeu Santos agradeço o apoio, colaboração e tão preciosas sugestões para esse trabalho;
Ao Prof. Ronaldo Amaral, pelo apoio junto à chefia do Departamento de Biofísica e Farmacologia;
Aos alunos de Biomedicina Renato Cesar, Cristina e Juliana pela ajuda nos ensaios iniciais como alunos de iniciação científica;
Aos alunos de Biomedicina, Ibson e Jannison pela ajuda com os ensaios de inflamação em camundongo;
Aos demais componentes e amigos do LQFPB: Adeliana, Kátia Anaya, Ticiane, Gioconda, Norberto, Ana Celi e Cleysyvan pela amizade e boa convivência;
Ao Departamento de Bioquímica na pessoa do seu Chefe, Prof. Luiz Abreu por permitir a realização desse trabalho utilizando toda a infra-estrutura do departamento.
RESUMO
SUMÁRIO
ȱ
AGRADECIMENTOS... VII
RESUMO... VIII
LISTA DE ABREVIATURAS...X
LISTA DE FIGURAS... XI
1. INTRODUÇÃO...1
2. REVISÃO DA LITERATURA...3
3. MATERIAL E MÉTODOS...17
4. RESULTADOS...23
5. DISCUSSÃO...30
6. CONCLUSÕES...34
7. BIBLIOGRAFIA CONSULTADA...35
LISTA DE ABREVIATURAS
Con A - Concanavalina A CRP - Proteína C Reativa CvL - Cliona varians Lectin
DRC - Dominio de reconhecimento a carboidratos EDTA - Ácido etileno diamino tetra acético
fMLP - formil-Metil-Leuil-fenilalanina
IL - Interleucina
kDa - Kilodalton
LsL - - Litopenaeus setiferus Lectin
M - Molar
mM - Milimolar
nM - Nanomolar
p/v - Peso / volume
SAP - componentes P amilóide do soro
SDS-PAGE - - Eletroforese em Gel de poliacrilamida com dodecil sulfato de sódio
tg - Tioglicolato
TNF-α - Fator de necrose tumoral
LISTA DE FIGURAS
FIGURA 1: Tipos de galectinas FIGURA 2: Estrutura das esponjas FIGURA 3: Imagem de Cliona varians
FIGURA 4: Edema de pata em camundongo induzido por CvL
FIGURA 5: Efeito da CvL na migração de células para a cavidade peritoneal de camundongos
FIGURA 6: Efeito inibitório de carboidratos na migração neutrofílica induzida por CvL na cavidade peritoneal de camundongos
FIGURA 7: Análise da participação de macrófagos na migração neutrofílica induzida por CvL FIGURA 8: Efeito de drogas antiinflamatórias na migração de neutrófilos para a cavidade
1. INTRODUÇÃO
A esponja Cliona varians (Demospongiae: Spirastrellidae) foi identificada inicialmente na costa atlântica do Caribe e classificada por Duchassaing e Michelotti no ano de 1864. Está distribuída de forma endêmica em toda costa americana tropical Atlântica (1). Sua cor externa é marrom e a interna entre o cinza e o amarelo. Pode exibir três formas distintas, a forma varians que se apresenta ramificada e é tipicamente encontrada em lagunas rasas, recobrindo pequenas áreas de substrato com alguns ramos atingindo aproximadamente 40 cm na coluna d’água (2). As formas rigida e incrustans ocorrem simultaneamente, apresentam-se irregularmente espalhadas e penetrando o substrato (2). As formas rígida e incrustans ocorrem sempre em áreas com abundância de predadores e/ou correntes intensas como as zonas de arrebentação e entre marés (3). Estas duas formas conferem proteção contra os predadores e resistência às correntes e movimentos de marés (4). Na forma incrustans a Cliona varians geralmente recobre vários metros do substrato rochoso formando uma camada superficial que pode variar de 0,5 a 10 cm de espessura, mas penetra apenas cerca de 1,5 a 2 cm abaixo da superfície, escavando câmaras e galerias que são completamente preenchidas com tecido amarelo escuro (5).
Recentemente, nosso grupo de pesquisa purificou e caracterizou uma lectina da esponja marinha Cliona varians, denominada CvL. Esta apresentou dependência pelo íon cálcio, especificidade pelos carboidratos galactose e sacarose, efeito tóxico contra bactérias Gram positivas, como Bacillus subtilis e Staphylococcus aureus e a capacidade de aglutinar formas promastigotas de Leishmania chagasi (6).
intergrifolia, Artocarpus incisa e Talisia esculenta foram hábeis em induzir a migração de
neutrófilos e células mononucleares in vivo e in vitro em modelos de inflamação usando camundongos e ratos (7-14).
No presente trabalho, nós relatamos, pela primeira vez na literatura, o efeito pró-inflamatório de uma lectina inibida por D-galactose/sacarose purificada da esponja marinha Cliona varians (CvL). O objetivo do presente trabalho foi purificar a CvL e investigar o efeito
2. REVISÃO DA LITERATURA
2.1 Considerações Gerais sobre Lectinas
As lectinas foram descobertas por S. Weir Mitchell, em 1860, no veneno da cascavel Crotalus durissus e por Hermann Stillmark, em 1888, quando observou que extratos das sementes de Ricinus comunis, , possuíam um fator proteináceo denominado por ele de ricina, que aglutinavam eritrócitos de diferentes animais, de forma seletiva (15). Este fato tem sido considerado o marco inicial da pesquisa de lectinas (16). Posteriormente verificou-se atividade hemaglutinante em extratos de plantas não tóxicas como o feijão (Phaseolus vulgaris), as lentilhas Pisum sativum e Lens culinaris (17).
Em 1936, Sumner e Howell (18) conseguiram inibir a hemaglutinação produzida pela Concanavalina A (Con A) da Canavalia ensiformis através da adição de glicose. Este estudo foi de fundamental importância para o estudo das lectinas, pois possibilitou aos autores sugerirem que a Con A interagia com carboidratos presentes na superfície dos eritrócitos, revelando assim a principal característica das lectinas, ou seja, a afinidade por carboidratos.
Embora muitas lectinas reconheçam e se liguem a açúcares simples, tais como, glicose, manose, galactose, N-acetilgalactosamina, N-acetilglucosamina ou fucose, algumas mostram afinidade muito maior para com os constituintes de glicoproteínas encontradas apenas em animais que contém cadeias de glicanos como ácido siálico e N-acetilgalactosamina,. (19, 20).
Até 1935 não se sabia que as lectinas poderiam apresentar especificidades para diferentes grupos sanguíneos do sistema ABO. Foi então que se observou que a lectina da enguia Anguilla japonica, aglutinava preferencialmente eritrócitos do grupo O. Extratos de Vicia cracca e as lectinas de Phaseolus limensis possuíam seletividade pelo grupo A (21,
Somente em 1954, Boyd e Shapleigh (23) utilizaram pela primeira vez o termo lectina (do latim “legere” que significa selecionar, escolher) para enfatizar a habilidade de algumas hemaglutininas em diferenciar as células sanguíneas do sistema ABO. Em 1980, Goldstein (24) definiu as lectinas como proteínas de origem não imune, capazes de se ligar reversivelmente a carboidratos e de aglutinar células ou precipitar polissacarídeos e glicoconjugados. Em 1998, Lis e Sharon (25) definiram lectinas como proteínas ou glicoproteínas de origem não-imune, com um ou mais sítios por subunidade, que podem ligar-se reversivelmente a segmentos glicídicos específicos através de pontes de hidrogênio e interações de Van Der Waals. Atualmente, o termo lectina é superior ao de hemaglutininas e é amplamente empregado para designar todas as proteínas que possuem ao menos um domínio não-catalítico, que se liga reversivelmente e especificamente a mono ou oligossacarídeos ou a glicoconjugados (26, 27).
2.2 Classificação das Lectinas Animais
Segundo KILPATRICK (2002) (28), as lectinas animais são classificadas de acordo com a homologia de suas estruturas primárias em diversos grupos e famílias. Dessa forma, já foram mencionadas cerca de pelo menos 10 famílias de lectinas pertencentes ao reino animal: Tipo-S, Tipo-I, Tipo-P, Tipo-L, Anexinas, Calreticulinas/Calnexinas, Discoidinas, Eglectinas, Eel aglutininas, Tipo fibrinogênio, Pentraxinas, além das galectinas e lectinas do Tipo-C, que compreendem as duas maiores famílias de lectinas do referido reino.
2.2.1 Tipo C
A família das lectinas do tipo C é constituída por lectinas dependentes de Ca2+ (28).
depois, interações mais fortes são estabelecidas pela E-selectina, o que proporciona a diapedese dos leucócitos para o tecido linfóide e sítios inflamatórios subjacentes.
2.2.2 Galectinas
As galectinas formam uma família altamente conservada de lectinas animais que se ligam a ß-galactosídeos (30). Sua atividade independe de íons metálicos, não apresentam
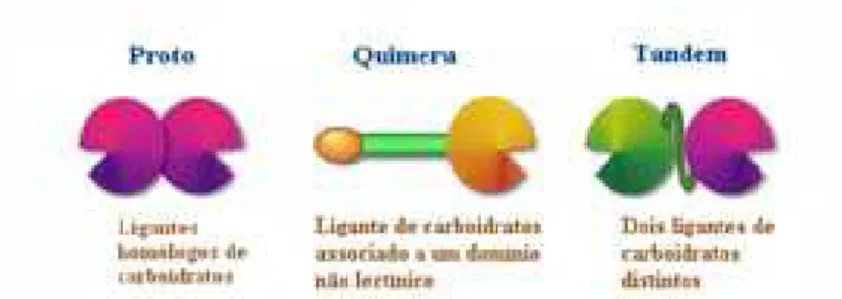
pontes dissulfeto e glicosilações. As galectinas têm sido mencionadas em várias funções essenciais, entre elas, desenvolvimento, diferenciação, adesão célula-célula, interação célula matriz, regulação do crescimento, apoptose e metástase tumoral. Elas podem ser encontradas no núcleo ou acumuladas em sítios citosólicos (31). Cada membro da família de galectinas contém no mínimo um domínio com cerca de 130 aminoácidos, que é responsável pela ligação com o carboidrato (DRC). De acordo com sua estrutura, as galectinas foram classificadas em proto (domínios idênticos), quimera (um domínio de galectina e um domínio não lectínico) e tandem (dois domínios distintos) (figura 1) (32).
Figura 1 Tipos de Galectinas
2.2.3 Tipo I
As lectinas do tipo I formam um grupo de moléculas protéicas, proposto por POWELL & VARKI, em 1995 (33), pertencentes à superfamília das imunoglobulinas devido à sua similaridade estrutural com as imunoglobulinas. Dentre as lectinas do tipo I, destacam-se as Siglecs que reconhecem especificamente o ácido siálico, derivado de monossacarídeo encontrado em abundância na superfície das células (34).
2.2.4 Tipo P
As lectinas do tipo P caracterizam-se por possuírem DRCs com afinidade para 6-fosfato. Dois tipos de receptores intracelulares reconhecem resíduos de manose-6-fosfato em oligossacarídeos de hidrolases, direcionando-os do complexo de Golgi para os lisossomos (35).
2.2.5 Eglectinas
2.2.6 Discoidinas
As Discoidinas foram isoladas do muco celular da ameba Dictyostelium discoideum e apresentaram afinidade para oligossacarídeos com resíduos de galactose. Duas espécies de discoidinas I e II são potentes hemaglutininas com composição aminoacídica similar e, com subunidades de massas moleculares relativas variando entre 26-36,5 kDa e 24-27 kDa para as discoidinas I e II, respectivamente. Além disso, essas subunidades apresentam afinidade por carboidratos distintos. Embora sua função fisiológica ainda não seja totalmente esclarecida, há indicações de sua participação nos processos de adesão celular e ao substrato (38, 39).
2.2.7 Pentraxinas
As Pentraxinas são um grupo de lectinas plasmáticas que incluem a proteína C reativa (CRP) e componentes P amilóide do soro (SAP) (40). Elas são moléculas compostas por subunidades protéicas, arranjadas em ciclo e em uma simetria pentamérica (41) que se ligam a múltiplos ligantes de forma cálcio dependentes (42). As pentraxinas possuem múltiplas funções biológicas, incluindo ativação do sistema complemento e estimulação da fagocitose pelos macrófagos (43).
2.2.8 Anexinas
A primeira evidência de atividade lectínica foi observada na anexina IV, que apresenta um motivo de ligação para sialoglicoproteínas e glicosaminoglicanos (45).
Há ainda, muitas lectinas que não se encontram agrupadas dentro das várias famílias de lectinas já estabelecidas, por não possuírem homologia em suas seqüências, por exemplo: interleucinas, citocinas, dentre outras. Futuros conhecimentos acerca de suas estruturas e propriedades bioquímicas, possivelmente, permitirão o enquadramento dessas lectinas em famílias preestabelecidas, ou formarão novas famílias de lectinas (28, 37).
2.3 Distribuição nos organismos
Abundantes na natureza, as lectinas são encontradas em quase todos os organismos, sendo amplamente distribuídas entre vegetais, vírus, bactérias, mamíferos e vários grupos de invertebrados (28, 46). Em 1998, PEUMANS e VAN DAMME (47) estudaram os relatos de ocorrência de lectinas em plantas superiores e observaram que estas proteínas já haviam sido detectadas em cerca de 500 espécies. Muitas das lectinas vegetais são encontradas nas sementes, embora sua presença já tenha sido observada em todos os tipos de tecidos vegetativos, como casca, folhas, caule, frutos e raízes. As lectinas de sementes de leguminosas representam o grupo destas proteínas vegetais mais bem estudados, com mais de 100 representantes isolados e caracterizados (48).
Em bactérias, protozoários e vírus, a ocorrência de lectinas parece desempenhar o papel de auxiliar e/ou promover a adesão destes microorganismos às estruturas celulares onde são encontrados (25). Em um trabalho desenvolvido em 1992, por GLICK e colaboradores (49) na infecção causada pelo vírus da influenza, foi constatado que o processo de adesão viral à célula alvo era mediado por uma lectina que se liga a resíduos de ácido siálico presente na face externa da superfície celular. Na bactéria da espécie Pseudomonas aeruginosa foi isolada uma lectina que se liga à superfície das células do
Nos animais vertebrados distinguem-se duas categorias de lectinas: as citoplasmáticas, que são extraídas com soluções aquosas e salinas e as lectinas de membrana que requerem o uso de detergentes para sua solubilização (51). Dessa forma, já foram detectadas lectinas do cordão umbilical humano (52), em veneno de cobras (53), em ovos de peixes teleósteos (54) e em soro do peixe Salmo salar (55). No ano de 1974, STOCKERT e colaboradores (56) descreveram uma aglutinina do fígado de coelho, que aglutinava eritrócitos humanos. Essa lectina ficou conhecida como a primeira lectina isolada de mamífero. Embora as lectinas presentes nos animais apresentem uma incontestável variedade de funções, a maioria delas pode ser considerada, em termos gerais, como moléculas de reconhecimento, uma vez que agem no processo de defesa contra patógenos e participam do tráfico celular (28). Além disso, as lectinas podem promover estimulação mitogênica de linfócitos e aglutinação de células neoplásicas (57, 58).
2.4 Lectinas de invertebrados: Distribuição e Funções
Os invertebrados não possuem um sistema imune adaptativo baseado na magnitude de anticorpos altamente específicos e receptores de antígenos como aqueles que ocorrem nos vertebrados (59). A hemolinfa circulante em invertebrados marinhos contém substâncias biologicamente ativas como lectinas, fatores de coagulação e peptídeos antimicrobianos (60). Todos esses fatores contribuem para o sistema de auto defesa em invertebrados marinhos contra a invasão de microorganismos que podem chegar a um número acima de 106 bactérias/mL e 109 vírus/mL na água do mar. A sobrevivência dos invertebrados marinhos nesse ambiente sugere que seus sistemas imunes inatos são efetivos e robustos (61).
efetor na eliminação potencial de patógenos (28, 62, 63). Devido ao fato das lectinas terem a habilidade de se ligar a carboidratos e promover a aglutinação de diferentes células, tais como bactérias invasoras, uma das funções mais prováveis em invertebrados marinhos seria de atuar como fator humoral, assim como as imunoglobulinas em vertebrados. É razoável assumir que essas moléculas possuem um considerável papel nas reações de reconhecimento do não-próprio nos invertebrados. Assim como as imunoglobulinas dos vertebrados, as lectinas dos invertebrados podem aglutinar microrganismos e favorecer sua fagocitose, por mediar a ligação entre a superfície do hemócito e o corpo estranho (papel de opsonização). Contudo em contraste com as imunoglobulinas, a especificidade das aglutininas desses organismos é restrita somente para os resíduos de açúcares(59). Essa proposição é fundamentada em algumas observações, tais como, a ativação de fagócitos pela ligação das lectinas em células e o aumento da expressão de lectinas nos fluidos após a injeção de substâncias estranhas (64).
Existem três diferentes rotas para o reconhecimento de partículas estranhas, nas quais as lectinas podem interagir: a primeira é através da interação célula do invertebrado com o carboidrato da membrana do microorganismo; a segunda ocorre pela ligação entre a lectina do patógeno e o açúcar presente na membrana de células de invertebrados; e a terceira rota, através da ligação de aglutininas humorais a superfície de glicoconjugados presentes em microorganismos, formando um complexo que se une ao receptor de opsonina da célula de defesa dos invertebrados (65).
Nos invertebrados, já foram detectadas e estudadas lectinas nos diversos filos. Entre os cnidários, a anêmona Bunodeopsis antilliensis apresenta duas aglutininas que se ligam a eritrócitos humanos com características bem distintas (66). Na espécie de anelídeo marinho Chaetopterus variopedatus, pertencente à classe poliqueta, foi isolada uma lectina
No filo molusca, lectinas isoladas do bivalve Ruditapes philippinarum, popularmente conhecido como mexilhão, exibiu forte atividade anti-bacteriana, indicando que lectinas desencadeiam o papel de eliminação de bactérias, participando desse mecanismo de defesa (69). Na hemolinfa da espécie Belamya bengalensis, pertencente à classe gastropoda, foi purificada uma lectina com forte ligação para a glicoproteína mucina. A proteína isolada apresentou uma potente atividade mitogênica, uma vez que estimulou a proliferação dos linfócitos T, especificamente do tipo Th1 (70). Aplysia dactylomela é uma espécie de molusco que contém em sua glândula púrpura uma lectina com atividade hemaglutinante para eritrócitos de coelhos, a qual é inibida pela glicoproteína fetuína (71). Nos ovos e na hemolinfa do molusco do gênero Aplysia também foram encontradas aglutininas que foram inibidas por D-galacturônico (72).
Uma lectina com atividades biológicas como mitogenicidade e quimiotaxia foi encontrada no veneno das pedicelarias do ouriço-do-mar Toxopneustes pileolus, sugerindo seu envolvimento como agente tóxico (64). Outras funções para as lectinas de invertebrados marinhos têm sido sugeridas para lectinas do tipo C: como a cristalização do carbonato de cálcio nas cracas da espécie Megabalanus rosa, morfogênese no tunicado Polyandrocarpa misakiensis, e lise da membrana vitelínica do mexilhão azul Mytilus edulis. Estes exemplos
indicam a existência de várias lectinas envolvidas em diferentes funções fisiológicas de invertebrados marinhos (73-75)
Com relação às lectinas de crustáceos, alguns estudos relatando a purificação e caracterização dessas moléculas vêm sendo realizados. Nesse filo, lectinas já foram detectadas nas seguintes espécies: Penaeus indicus (76), Penaeus japonicus (77) e Penaeus paulensis (59). Na hemolinfa da espécie Litopenaeus schimitti foi detectada a
de 200 kDa e, em SDS-PAGE, sob condições redutoras, foram detectadas subunidades de 27 kDa. Além disso, a lectina reconheceu grupos acetilados e sua atividade foi independente de íons bivalentes. No ano de 2005, Alpuche e colaboradores (80) isolaram da hemolinfa do camarão Litopenaeus setiferus uma lectina com capacidade de aglutinar eritrócitos de coelhos, porquinhos da índia e ovelhas, no entanto, a mesma não aglutinou eritrócitos de humanos, galinha e cavalo, dentre outros. A lectina purificada foi denominada de LsL e se apresentou como uma proteína heterotetrâmera, com duas subunidades de 80 kDa e duas de 52 kDa.
2.5 Lectinas em Esponjas
A parede do seu corpo é formada pela epiderme, pelo mesênquima e pelo revestimento interno de células flageladas chamadas coanócitos, que realizam a digestão do alimento que chega ao interior do animal. No mesênquima, encontram-se os amebócitos que distribuem o alimento pelas diversas células do corpo. Existem poros inalantes (óstios) por onde a água entra no porífero; e um poro exalante (ósculo) por onde a água sai do porífero. A cavidade central, forrada de coanócitos, é o átrio. No mesênquima, podem ser encontradas espículas calcárias ou silicosas que fazem parte da sustentação do corpo do animal (figura 2). Há, contudo, esponjas sem espículas (esponjas córneas), com esqueleto de fibras de espongina (81). As esponjas, em sua maioria, são hermafroditas e sua reprodução pode ser assexuada (por brotamento) ou sexuada (por meio de fecundação cruzada e interna). No segundo caso, do ovo resulta uma larva que é eliminada pelo ósculo, nada e se fixa às rochas, originando outras esponjas (82).
Esponjas marinhas se apresentam como um reservatório biológico de lectinas e outras moléculas bioativas ainda pouco estudadas. Possivelmente, esse fato decorre do
Figura 2 Estrutura das Esponjas. Imagem demonstrando os principais tipos celulares das esponjas e sua forma geral.
longo período evolucionário que esses animais sofreram, ao longo de seus 800 milhões de anos de existência, convivendo com uma ampla diversidade de ambientes e outros seres vivos, numa luta incessante pela conquista do ambiente. As esponjas produzem uma ampla variedade de toxinas e outros componentes moleculares com o objetivo de repelir predadores (83), competir por espaço com outros organismos sésseis e para a comunicação e proteção contra infecções (84). O interesse em estudar esponjas marinhas foi intensificado após o isolamento e caracterização de uma lectina anti-HIV chamada niphatevirin presente na esponja Niphates erecta (85).
Historicamente, o primeiro registro de lectinas isoladas de esponja foi feita por Dood e colaboradores em 1968 (86), embora não tenha sido caracterizada. No ano de 2000, Miarons e Fresno (87) investigaram 21 espécies de 12 famílias de espojas tropicais. Dentre elas, 10 apresentaram atividades hemaglutinantes com destaque para as lectinas das esponjas do gênero Aplysina, que apresentaram atividade aglutinante para eritrócitos de vários animais, inclusive quando esses foram submetidos a vários tratamentos enzimáticos. Das três espécies do gênero Aplysina, duas espécies tiveram suas lectinas purificadas: A. lawnosa e A. archeri, ambas as proteínas exibiram uma massa molecular de 63 kDa (em sua
forma nativa) e quando submetidas a condições redutoras apresentaram massa molecular em torno de 16 kDa, sugerindo serem homotetrâmeras. Elas apresentaram dependência de cátions bivalentes e afinidade para galactosídeos. De outra esponja, Haliclona cratera, foi isolada uma lectina de 29 kDa, dependente de íons metálicos sem pontes dissulfeto e com afinidade para galactose. Essa lectina apresentou atividade citotóxica sobre células tumorais HeLa (câncer cervical) e FemX (melanoma), e atividade mitogênica em linfócitos (88). Efeitos mitogênicos em leucócitos também foram observados para lectinas de esponjas de várias espécies como Pellina semitubulosa (89), Cinachyrella alloclada (90) e Geodia cydonium (91).
IV) (92). Posteriormente Buck e colaboradores (93), observaram que as lectinas I e II dessa espécie apresentavam 65% de homologia em sua região N-terminal, massa molecular muito similar, pontes dissulfeto entre os resíduos de aminoácidos 4 e 46 e ausência de glicosilações.
3.
MATERIAL E MÉTODOS
3.1
Material Biológico3.1.1 Esponja Marinha
Espécimes adultos da esponja marinha Cliona varians (Figura 3) foram coletados sobre rochas situadas na zona de arrebentação da praia de Santa Rita, localizada no município de Extremoz, no Estado do Rio Grande do Norte, Brasil (5°4’36.42’’ latitude sul e 35º11’44.99’’ longitude oeste). O material foi lavado em água do mar e mantido sob refrigeração em gelo até a chegada ao laboratório, onde foi armazenado a -20 ºC.
Classificação Filogenética:
Filo Porifera
Classe Demospongiae Ordem Hadromerida
Família Clionidae Gênero Cliona
Espécie Cliona varians
3.1.2 Camundongos
Os Camundongos Swiss foram gentilmente fornecidos pelo Biotério Central da Universidade Federal do Ceará, Fortaleza, Ceará, Brasil. Os animais pesavam entre 25 a 35g e foram mantidos em biotério com acesso livre a alimento e água, em temperatura ambiente e ciclo de 12/12 horas de claro e escuro.
3.2 Drogas
Os antiinflamatórios Dexametasona (9-fluoro-11β,17,21-triidroxi-16α- metilpregna-1,4-dieno-3,20-diona), Celecoxibe (4-[5-(4-methylphenyl)-3-(trifluoromethyl) pyrazol-1-yl]benzenesulfonamide) e diclofenaco (2-(2-(2,6-dichlorophenylamino) phenyl) acetic acid) foram adquiridos no comércio local. A dose de cada droga utilizada foi a recomendada pelo fabricante.
3.3 Purificação da lectina da esponja marinha Cliona varians (CvL)
Os espécimes coletados foram divididos em pequenos fragmentos com auxílio de bisturis. Posteriormente, estes pedaços foram triturados em um liquidificador, e submetidos ao processo de extração em tampão TRIS-HCl 50 mM pH 7,5 (1:2, p/v) em temperatura ambiente. As partículas insolúveis foram retiradas com o uso de uma peneira comum. Após tal procedimento, o material foi centrifugado a 10.000 g durante 30 minutos e a uma temperatura de 4 oC. O material precipitado foi desprezado, sendo o sobrenadante recolhido
e designado extrato bruto. O extrato bruto foi fracionado em três etapas de precipitação com acetona utilizando 0,5; 1,0; e 2,0 volumes de acetona em relação ao volume do extrato bruto. Em cada etapa, após a adição da acetona, a solução foi deixada em repouso por no mínimo quatro horas e refrigerada a 4 oC. Após esse período, a fração com 1 volume de acetona foi centrifugada a 8000 g na temperatura de 4 oC. O precipitado foi recolhido,
secado a vácuo e, então, ressuspenso em tampão TrisHCl 50 mM pH 7,5 e armazenado a -20 oC. A fração obtida foi denominada de F1.
A concentração protéica da amostra foi determinada pelo método colorimétrico de Bradford (1976) (98), utilizando albumina sérica bovina como padrão.
com uma solução de HCl 0,1M, com o objetivo de romper o polímero e expor um maior número de resíduos de galactose. A coluna foi equilibrada em tampão Tris-HCl 50 mM, CaCl2 20 mM, pH 7,5. Um volume de 8 ml (0,2 mg/ml) da fração F1 foi aplicada na coluna. O
pico não retido foi eluído com tampão Tris-HCl 50 mM pH 7,5, contendo 20 mM de CaCl2. O
pico retido foi eluído com tampão Tris-HCl 50 mM, pH 7,5 contendo 20 mM de EDTA. O pico retido foi coletado em tubos de hemólise (1,5 ml/tubo) e monitorados por espectrofotometria a 280 ηm.
A atividade hemaglutinante durante o processo de purificação foi feita em placas de microtitulação com poços em V (Nunc Brand products, Dinamarca) utilizando o procedimento de diluição seriada. Foram utilizados eritrócitos humanos do tipo A tratados com papaína de acordo com Benevides et al (1998), (99).
3.4 Avaliação da ação de CvL sobre o edema de pata em camundongos
3.5 Avaliação do efeito de CvL in vivo na migração de leucócitos através do
modelo experimental de peritonite
Para avaliar o efeito indutor da CvL em atrair leucócitos para a cavidade peritoneal, 50
µg da lectina foi solubilizada em solução salina estéril (NaCl 0,15 M) e injetada na cavidade peritoneal dos camundongos. Um grupo controle negativo recebeu o mesmo volume de solução salina apenas e um grupo controle positivo recebeu 100ng de fMLP diluído em salina estéril em substituição a solução de lectina. Cada um dos três grupos era formado por subgrupos contendo seis animais para cada tempo de leitura. Os tempos determinados foram: 4, 12, 24, 48, 72 e 96 horas. Depois de transcorridos os tempos referidos, os animais foram mortos e as células presentes na cavidade peritoneal foram coletadas através da injeção de 3 mL de solução salina contendo 5 UI/mL de heparina em cada peritônio. O líquido injetado foi coletado e o número total de células presentes foi estabelecido por microscopia óptica. A contagem foi realizada em câmara de Newbauer utilizando-se os quadrantes externos para a contagem de leucócitos (100). Os resultados foram descritos como sendo a média mais o desvio padrão do número de células por mililitro do lavado peritoneal.
3.6 Efeito dos carboidratos D-galactose, D-frutose e sacarose na migração
leucocitária induzida por CvL
soluções de carboidratos. O resultado do efeito de cada carboidrato foi avaliado 24 horas após a injeção através da contagem do número de leucócitos que migraram para o peritônio e comparado com os grupos controle que receberam apenas solução salina estéril ou apenas uma das soluções de carboidratos. O procedimento de contagem dos leucócitos utilizado foi o mesmo do ensaio anterior.
3.7 Relação entre o aumento da população de macrófagos residentes no
peritônio de camundongos e a migração de neutrófilos induzida por CvL
Para verificar o envolvimento de macrófagos como indutores da migração de neutrófilos foi injetado na cavidade peritoneal dos camundongos 100µL de tioglicolato na concentração de 3% peso/volume. Quatro dias após a injeção as células presentes na cavidade peritoneal foram coletadas e os macrófagos contados por microscopia óptica em câmara de Newbauer. Um grupo que recebeu apenas solução salina estéril foi estabelecido como grupo controle para efeito de comparação (101). Após 4 dias, tanto os animais do grupo tratado com tioglicolato como nos animais que receberam apenas solução salina, foram injetados com 50µg de CvL dissolvidos em 100µL de salina ou com 100µL de solução salina apenas por peritônio. Além disso, dois grupos adicionais tratados previamente (4 dias) com tioglicolato ou com salina receberem 100 µL de fMLP (um conhecido quimioatrativo para neutrófilos) na concentração de 10-10M. Após 24 horas da administração de CvL, os
3.8 Efeito de drogas antiinflamatórias na migração de neutrófilos induzida por
CvL
Para a determinação das possíveis vias envolvidas na migração de neutrófilos induzida por CvL foi planejado um ensaio em que foram utilizados os seguintes compostos antiinflamatórios: um antagonista de citocinas, a dexametasona (0,5mg/kg); Um inibidor específico de ciclooxigenase, o celecoxibe (2,8mg/kg); e um inibidor inespecífico de ciclooxigenase, o diclofenaco (1mg/kg). Cada droga foi administrada, seguido instruções dos fabricantes, em grupos de seis animais. Um grupo de 6 animais foi usado como controle e neste foi administrado 100µL de solução salina estéril. A lectina CvL (50µg) foi injetada nos peritônios dos animais tratados com salina e com os antiinflamatórios após 30 minutos. Após 4 horas, os animais foram mortos, o líquido peritoneal recolhido e os neutrófilos que migraram para a cavidade peritoneal de cada animal foram contados.
3.9 Análises estatísticas
4.
RESULTADOS
4.1 Purificação de CvL
A cromatografia de afinidade em Sepharose CL 4B apresentou um pico protéico retido (Figura 3A) que foi reunido e dialisado contra Tris-HCl 50mM, CaCl2 20mM, pH 7,5, para a
B
1 2 3
A 0 0,5 1 1,5 2 2,5 3 3,5
1 11 21 31 41 51 61 71 81 91
volume O. D . 280 n m 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 HUx 10 3
Figura 3 (A). Cromatografia de afinidade em Sepharose CL 4B. O matéria retido foi eluído com tampão Tris-HCl 50mM, EDTA 20mM, pH 7,5. Frações de 1,5 ml foram coletadas e lidas a 280 nm (--). Atividade hemaglutinante
(●). (B) Análise por eletroforese em gel de poliacrilamida.(1) Marcadores de Peso molecular, (2) CvL e em
condições desnaturantes e (3) CvL na presença de beta-mercaptoetanol. 114 kDa
4.2 Indução do Edema de Pata pela CvL
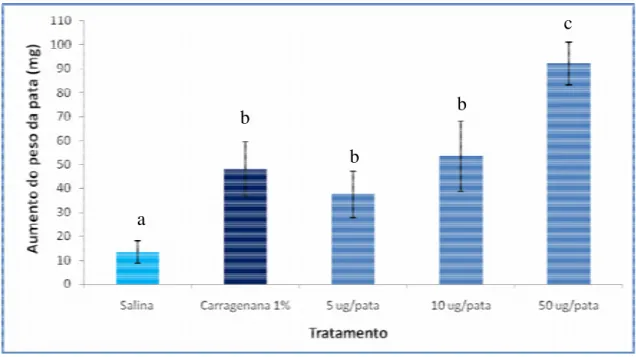
Após aplicação de CvL nas patas dos camundongos nas concentrações de 5, 10 e 50 µg, foi observada uma indução de edema de dose-dependente, quando os pesos das patas foi comparado com os daqueles que apresentaram edemas formados pela ação das doses de 5, 10 e 50 µg. Na dose de 50 µg por pata foi observado que as patas tiveram um maior peso do que aquele observado quando a pata dos animais foram injetadas com uma solução de carragenana a 1%. Este maior valor mostrou então que CvL tem um grande potencial pró-inflamatório (Figura 4) significativamente maior do que o da carragenana, um conhecido potente agente pró-inflamatório. Esta dose foi utilizada para a realização dos demais ensaios.
Figura 4. Edema de pata em camundongo induzido por CvL em concentrações variando de 5 a 50 µg por pata. As análises foram feitas 4 horas após a injeção. Os resultados referem-se às médias mais desvio padrão dos valores obtidos a partir de 6 camundongos. Letras iguais indicam que não existe diferença estatisticamente significante. Os testes foram estatisticamente significantes quando comparados com o
controle com salina. p<0,01 (ANOVA-Bonferroni)
a
b
b
b
4.3 Ensaio de migração leucocitária para a cavidade peritoneal induzida por
CvL
O modelo de peritonite induzido em camundongos foi testado quando CvL na dose de 50 µg foi injetada no peritônio dos animais. Após 4 horas, a presença de CvL no peritônio promoveu um aumento de 400% na migração de leucócitos para a cavidade peritoneal, na fase aguda da inflamação, quando comparado com solução salina, usada como controle negativo. A migração de leucócitos promovida por CvL foi semelhante àquela promovida por fMLP (potente atractante de neutrófilos) a 0,05 µg por dose por animal. Após 24 horas da injeção da CvL, na fase crônica da peritonite, foi observado a máxima migração leucocitária que foi reduzido a 48 horas, mantendo-se estável até 72 horas e caindo novamente até 96 horas após a injeção da lectina. Mesmo assim, os níveis de migração leucocitária foram cerca de 10 vezes maiores quando comparados com o controle negativo (solução salina) (Figura 5).
Figura 5: Efeito da CvL na migração de células para a cavidade peritoneal. Utilizou-s 50 ug por cavidade e as células foram contadas em 4, 12, 24, 48, 72 e 96 horas após a injeção
intraperitoneal de CvL (—) fMLP (0,05ug/cavidade —) e Salina (—). Os resultados referem-se
às médias mais desvio padrão dos valores obtidos a partir de 6 camundongos. (p<0,01),
4.4 Efeito de carboidratos na migração leucocitária induzida por CvL
O efeito a CvL após incubação com os açúcares D-galacotse, sacarose e D-Frutose foi avaliado no modelo de peritonite em camundongos. Após 24 horas de injeção da mistura (lectina+açúcar) foi observado que, em comparação ao grupo tratado apenas com CvL, a D-galactose reduziu 2/3 da quantidade de leucócitos que migraram para o peritônio, enquanto que a sacarose reduziu aproximadamente 1/3. Por outro lado, a D-frutose não apresentou efeito significativamente diferente da CvL isoladamente. A injeção dos carboidratos isoladamente na cavidade peritoneal também não apresentou efeito significativo no número de leucócitos migrantes quando comparado com o grupo que recebeu apenas a solução salina estéril (Figura 6). Esse resultado mostrou que o efeito na migração de leucócitos para a cavidade peritoneal era causado pela presença da lectina na cavidade peritoneal dos camundongos, visto que os açúcares ligantes inibiram a migração.
Figura 6: Efeito inibitório de carboidratos na migração neutrofílica induzida por CvL na cavidade peritoneal de
camundongos. A migração dos neutrófilos foi avaliada 24 horas após a injeção de CvL (50 ug/cavidade (█) ou
após a incubação com 0,1M de carboidratos específicos(D-galactose, sacarose) ou não específico (frutose) (█).
As demais barras (█) representam a migração neutrofílica induzida pela injeção de solução salina ou dos
carboidratos isoladamente. Os resultados referem-se às médias mais desvio padrão dos valores obtidos a partir
de 6 camundongos. Letras iguais indicam que não existe diferença estatisticamente significante. (p<0,01),
4.5 Envolvimento de macrófagos na migração de neutrófilos induzidos pela CvL
O envolvimento de macrófagos na indução da migração de neutrofilos produzida pela lectina foi investigado através da alteração in vivo no número da população dos macrófagos residentes no peritônio dos camundongos. A injeção intra-periotoneal de tioglicolato a 3% foi feita 72 horas antes da administração de CvL. Após esse período, macrófagos foram contados e foi observado um aumento em 2,3 vezes na população de macrófagos residentes no peritônio. O efeito da injeção de CvL, após 24 horas, em animais previamente tratados com tioglicolato produziu uma ampliação de 77% na migração de neutrófilos para a cavidade peritoneal (Figura 7) quando comparado com àqueles animais que não foram sensibilizados previamente por tioglicolato. Nenhum efeito significativo da migração de neutrófilos induzido por fMLP foi observado no grupo previamente tratado com tioglicolato, indicando que a atração dos neutrófilos foi um efeito único do atractante de neutrófilo.
Figura 7: Análise da participação de macrófagos na migração neutrofílica induzida por CvL (50 ug/cavidade). (A) População normal de macrófagos em animais não tratados (salina) e em animais tratados com solução de tioglicolato a 3% (Tg) após injeção de 100 uL de salina. (B) Migração de neutrófilos induzida por 100 uL de salina (sal), CvL (50 ug por cavidade) e fMLP (0,05 ug por cavidade em animais não tratados (salina) ou pré-tratados
com tioglicolato a 3% (Tg). Os resultados referem-se às médias mas desvio padrão (n=6). Letras iguais indicam
4.6 Ensaio de Inibição da migração de neutrófilos induzida pela CvL através do
uso de antiinflamatórios
Uma hora antes da indução da migração de neutrófilos por CvL, os camundongos foram tratados com Celecoxibe, um anti inflamatório não esteróide seletivo, com diclofenaco, um antiinflamatório não esteróidal não seletivo e a dexametasona, um antiinflamatório com efeito antagonista de citocinas. Os antiinflamatórios não esteroidais, Diclofenaco e a dexametasona, ambos inibidores inibiram a migração induzida por CvL e o efeito de dexametasona foi 66% mais efetivo, indicando uma inibição da liberação de citocinas. Também foi observada uma diminuição da migração devido ao efeito do Diclofenaco, um inibidor não seletivo de ciclooxigenases. O inibidor específico para ciclooxigenases, Celecoxib não afetou a indução de migração de neutrófilo por Cvl. Os dados obtidos são indicativos da participação de macrófagos na indução de migração de neutrófilo para a cavidade peritoneal de camundongos, uma vez que citocinas liberadas por macrófagos, especialmente IL8, são potentes quimioatractantes de neutrófilos (figura 8).
5.
DISCUSSÃO
Várias lectinas, especialmente as de origem vegetal demonstraram habilidade em ativar células do sistema imune de mamíferos, especialmente aquelas com especificidade para monossacarídeos como a D-galactose e a D-manose (7-9). No presente trabalho, nós investigamos o efeito da CvL, lectina D-galactose específica, sobre a migração de leucócitos in vivo, um importante evento celular que ocorre no processo inflamatório em mamíferos. De
acordo com os resultados obtidos, a CvL causou edema nas patas dos camundongos tratados com CvL em todas as concentrações testadas de uma forma dose-dependente. Sendo que na dose de 50 µg/pata a CvL foi significativamente superior a solução de carragenana a 1%. Respostas semelhantes foram relatadas para lectinas de origem vegetal como as lectinas da Artocarpus integrifólia (14), da Erythrina veluntina (107) e da Talisia esculenta (11) que induziram edemas de patas em animais tratados com estas lectinas.
A CvL também foi avaliada quanto a sua capacidade de induzir in vivo a migração de leucócitos e foi observado que após 4 horas (fase aguda da inflamação) da injeção intraperitoneal de CvL (50 µg/cavidade peritonial) em camundongos ocorreu uma significativa migração de leucócitos, quando comparado com o grupo que recebeu apenas solução salina e foi semelhante ao grupo tratado com fMLP (formyl-Met-Leu-Phe) (0,05 µg/cavidade), um tripeptídeo sintético de ação quimiotáctica que mimetiza a ação de peptídeos bacterianos, sendo um potente indutor da migração leucocitária. A migração leucocitária máxima foi observada após 24 horas do contato com CvL. A migração foi significantemente reduzida quando a CvL foi previamente incubada com D-galatose e injetada na cavidade peritoneal, indicando que a atividade indutora da migração leucocitária causada pela CvL foi decorrente da sua habilidade em se ligar a sítios contendo D-galactose e que estes sítios podem mediar essa atividade pró-inflamatória. Resultados semelhantes foram obtidos para a lectina de Artocarpus integrifolia (14), e para a lectina purificada de Erythrina veluntina (107), em modelos de peritonite em ratos.
da participação destas células ou de compostos liberados pelos macrófagos na indução da migração de neutrófilos para a cavidade peritoneal. O tratamento com tioglicolato elevou a população de macrófagos em 2,3 vezes, o que acarretou o aumento da migração de neutrófilos induzida por CvL em 77%. Estes resultados mostraram que os invertebrados marinhos também possuem lectinas com a habilidade de modular o recrutamento de neutrófilos por um mecanismo indireto, como ocorre em outras lectinas de origem vegetal, especialmente aquelas purificadas das sementes de E. veluntina (107), de Glycine max (8), da T. esculenta (11), de Vatarea macrocarpa (7), de Lonchocarpus sericeus (111), e de Pisum arvense (112). Para corroborar este resultado, os animais tratados com tioglicolato e
posteriormente injetados com fMLP, um típico quimioatractante de neutrófilo, não tiveram aumento significativo da migração de neutrófilos quando comparados com os grupos controles.
Conseqüentemente, podemos postular que esses resultados favorecem a hipótese de que a migração de neutrófilos induzida pela CvL poderia, possivelmente, ser mediada através da liberação de citocinas pelos macrófagos residentes na cavidade peritoneal, uma vez que estas células representam uma importante fonte de citocinas. Os resultados relatados neste trabalho demonstram que a lectina galactose específica obtida da esponja marinha Cliona varians possui atividade pró-inflamatória, que induz a migração neutrofílica provavelmente
via liberação de citocinas a partir de macrófagos. Estas descobertas indicam que estas lectinas podem ser utilizadas como ferramentas para melhor compreender os mecanismos envolvidos nas respostas inflamatórias e nos eventos celulares da inflamação.
6. CONCLUSÕES
• A lectina, denominada de CvL, purificada da esponja Cliona varians apresentou atividade pró-inflamatória, sendo capaz de induzir a formação de edema de pata dose dependente em camundongos.
• CvL aumentou em 400% a migração leucocitária no modelo experimental de peritonite na fase aguda (4h) quando comparado com o controle mantendo-se estável até 72h;
• A habilidade da CvL em induzir a migração leucocitária foi inibida significantemente com a adição de D-galactose, indicando ser a ligação dessa proteína com carboidratos o agente pró-inflamatório;
• Tioglicolato potencializou a migração de leucócitos induzida por CvL através da estimulação dos macrófagos.
• A dexametasona, reduziu significativamente migração leucocitária induzida por CvL.
7. BIBLIOGRAFIA CONSULTADA
1. Hechtel GJ. Zoogeography of Brazilian Demospongiae. In: HARRISON FW, COWDEN RR, editors. Aspects of Sponge Biology. 1 ed: Academic Press. ; 1976. vol 1 p. 237-60. 2. Hill MS. Morphological and genetic examination of phenotypic variability plasticity in the tropical sponge Anthosigmella varians. In: Hooper JNA, editor. Proceedings of the 5th International Sponge Symposium “Origin & Outlook.” Mem. Queens. Mus. ; 1999. vol 4 p. 239–48.
3. Vicente VP. An ecological evaluation of the West Indian demosponge Anthosigmella varians (Hadromerida: Spirastrellidae). Bulletin of Mariner Science 1978;28:771–7.
4. Hill MS, Hill AL. Morphological plasticity in the tropical sponge Anthosigmella varians: Responses to predators and wave energy. Biological Bulletin 2002;202(1):86-95.
5. Zea S, Weil E. Taxonomy of the Caribbean excavating sponge species complex Cliona caribbaea – C. aprica – C. langae (Porifera, Hadromerida, Clionaidae). Caribbean
Journal of Science 2003;39(3):348-70.
6. Moura RM, Queiroz AFS, Fook JMSLL, Dias ASF, Monteiro NKV, Ribeiro JKC, et al. CvL a lectin from the marine sponge Cliona varians: Isolation, characterization and its effects on pathogenic bacteria and Leishmania promastigotes. Comparative Biochemistry and Physiology a-Molecular & Integrative Physiology 2006;145(4):517-23.
7. Alencar NMN, Assreuy AMS, Alencar VBM, Melo SC, Ramos MV, Cavada BS, et al. The galactose-binding lectin from Vatairea macrocarpa seeds induces in vivo neutrophil migration by indirect mechanism. International Journal of Biochemistry & Cell Biology 2003;35(12):1674-81.
9. Bento CAM, Cavada BS, Oliveira JTA, Moreira RA, Barjafidalgo C. Rat Paw Edema and Leukocyte Immigration Induced by Plant-Lectins. Agents and Actions 1993;38(1-2):48-54.
10. Brando-Lima AC, Saldanha-Gama RF, Henriques MDMO, Monteiro-Moreira ACO, Moreira RA, Barja-Fidalgo C. Frutalin, a galactose-binding lectin, induces chemotaxis and rearrangement of actin cytoskeleton in human neutrophils: Involvement of tyrosine kinase and phosphoinositide 3-kinase. Toxicology and Applied Pharmacology 2005;208(2):145-54. 11. Freire MGM, Desouza IA, Silva ACM, Macedo MLR, Lima MS, Tamashiro WMSC, et al. Inflammatory responses induced in mice by lectin from Talisia esculenta seeds. Toxicon 2003;42(3):275-80.
12. Lima JE, Sampaio ALF, Henriques MDMO, Barja-Fidalgo C. Lymphocyte activation and cytokine production by Pisum sativum agglutinin (PSA) in vivo and in vitro. Immunopharmacology 1999;41(2):147-55.
13. Moreira RA, Barros ACH, Stewart JC, Pusztai A. Isolation and Characterization of a Lectin from the Seeds of Dioclea-Grandiflora (Mart.). Planta 1983;158(1):63-9.
14. Santosdeoliveira R, Diasbaruffi M, Thomaz SMO, Beltramini LM, Roquebarreira MC. Neutrophil Migration-Inducing Lectin from Artocarpus integrifolia. Journal of Immunology 1994;153(4):1798-807.
15. Rogers DJ, Swain L, Carpenter BG, Critchley AT. Binding of N-acetyl-a-D-galactosamine by lectins from species of green marine alga genus Codium. In Lectins: Biology, Biochemistry, Clinical Biochemistry (Van Driessche, E.;Fisher,J.;Beeckmans, S. & Bog Hansen, T.C. eds). . T.C. eds 1994;10162-165, .
18. Sumner JB, Howell SF. Identification of Hemagglutinin of Jack Bean with Concanavalin A. J Bacteriol 1936;32(2):227-37.
19. Nicolson GL. The interactions of lectins with animal cell surfaces. Int Rev Cytol 1974;39:89-190.
20. Peumans WJ, VanDamme EJM. Prevalence, biological activity and genetic manipulation of lectins in foods. Trends in Food Science & Technology 1996;7(4):132-8.
21. Boyd WC, Reguera RM. Hemagglutinating substances for human cells in various plants. J Immunol 1949;62(3):333-9.
22. Renkonen KO. Studies on Hemagglutinins Present in Seeds of Some Representatives of the Family of Leguminoseae. Annales Medicinae Experimentalis Et Biologiae Fenniae 1948;26(1):66-72.
23. Boyd WC, Shapleigh E. Separation of Individuals of Any Blood Group into Secretors and Non-Secretors by Use of a Plant Agglutinin (Lectin). Blood 1954;9(12):1195-8.
24. Goldstein IJ, Hughes RC, Monsigny M, Osawa T, Sharon N. What Should Be Called a Lectin. Nature 1980;285(5760):66-.
25. Lis H, Sharon N. Lectins: Carbohydrate-Specific Proteins That Mediate Cellular Recognition. Chem Rev 1998;98(2):637-74.
26. Peumans WJ, Van Damme EJ. Lectins as plant defense proteins. Plant Physiol 1995;109(2):347-52.
27. Vaijayan M, Chandra N. Lectins. . Current Opinion of Structural Biology 1999;9:707– 14.
28. Kilpatrick DC. Animal lectins: a historical introduction and overview. Biochimica Et Biophysica Acta-General Subjects 2002;1572(2-3):187-97.
29. Drickamer K. 2 Distinct Classes of Carbohydrate Recognition Domains in Animal Lectins. Journal of Biological Chemistry 1988;263(20):9557-60.
31. Danguy A, Camby I, Kiss R. Galectins and cancer. Biochimica Et Biophysica Acta-General Subjects 2002;1572(2-3):285-93.
32. Liu FT, Patterson RJ, Wang JL. Intracellular functions of galectins. Biochimica Et Biophysica Acta-General Subjects 2002;1572(2-3):263-73.
33. Powell LD, Varki A. I-type lectins. J Biol Chem 1995;270(24):14243-6.
34. Angata T, Brinkman-Van der Linden ECM. I-type lectins. Biochimica Et Biophysica Acta-General Subjects 2002;1572(2-3):294-316.
35. Dahms NM, Hancock MK. P-type lectins. Biochimica Et Biophysica Acta-General Subjects 2002;1572(2-3):317-40.
36. Chang BY, Peavy TR, Wardrip NJ, Hedrick JL. The Xenopus laevis cortical granule lectin: cDNA cloning, developmental expression, and identification of the eglectin family of lectins. Comp Biochem Physiol A Mol Integr Physiol 2004;137(1):115-29.
37. Varki A. Essentials of Glycobiology The “I-type” Lectins and the Siglecs. Lecture 23 2004 [cited 2007 20/10/2007]; Available from: http://grtc.ucsd.edu/lecture23.pdf.
38. Berger EA, Armant DR. Discoidins I and II: common and unique regions on two lectins implicated in cell--cell cohesion in Dictyostelium discoideum. Proc Natl Acad Sci U S A 1982;79(7):2162-6.
39. Curat CA, Vogel WF. Discoidin domain receptor 1 controls growth and adhesion of mesangial cells. Journal of the American Society of Nephrology 2002;13(11):2648-56.
40. Steel DM, Whitehead AS. The major acute phase reactants: C-reactive protein, serum amyloid P component and serum amyloid A protein. Immunol Today 1994;15(2):81-8.
41. Emsley J, White HE, Ohara BP, Oliva G, Srinivasan N, Tickle IJ, et al. Structure of Pentameric Human Serum Amyloid-P Component. Nature 1994;367(6461):338-45.
42. Tennent GA, Pepys MB. Glycobiology of the pentraxins. Biochem Soc Trans 1994;22(1):74-9.
44. Gerke V, Moss SE. Annexins: from structure to function. Physiol Rev 2002;82(2):331-71.
45. Kojima K, Yamamoto K, Irimura T, Osawa T, Ogawa H, Matsumoto I. Characterization of carbohydrate-binding protein p33/41: relation with annexin IV, molecular basis of the doublet forms (p33 and p41), and modulation of the carbohydrate binding activity by phospholipids. J Biol Chem 1996;271(13):7679-85.
46. Gerlach D, Schlott B, Zahringer U, Schmidt KH. N-acetyl-D-galactosamine/N-acetyl-D-glucosamine-recognizing lectin from the snail Cepaea hortensis: purification, chemical characterization, cloning and expression in E. coli. FEMS Immunol Med Microbiol 2005;43(2):223-32.
47. Peumans WJ, Van Damme EJM. Plant lectins: Specific tools for the identification, isolation, and characterization of O-linked glycans. Critical Reviews in Biochemistry and Molecular Biology 1998;33(3):209-58.
48. Sharon N, Lis H. The structural basis for carbohydrate recognition by lectins. Adv Exp Med Biol 2001;491:1-16.
49. Glick GD, Toogood PL, Wiley DC, Skehel JJ, Knowles JR. Ligand recognition by influenza virus. The binding of bivalent sialosides. J Biol Chem 1991;266(35):23660-9.
50. Gilboa-Garber N, Sudakevitz D. The hemagglutinating activities of Pseudomonas aeruginosa lectins PA-IL and PA-IIL exhibit opposite temperature profiles due to different
receptor types. FEMS Immunol Med Microbiol 1999;25(4):365-9.
51. Liener IE, Sharon N, Goldstein IJ. Lectins: Properties, Functions and Aplications in Biology and Medicine: Academic Press; 1986.
53. Gartner TK, Ogilvie ML. Isolation and characterization of three Ca2+-dependent beta-galactoside-specific lectins from snake venoms. Biochem J 1984;224(1):301-7.
54. Krajhanzl A, Kocourek J, Pancoska P, Nosek J. Studies on lectins LXIV. Fish oocyte lectins: further physicochemical characterization of lectins from oocytes of the bream, Abramis brama., and the pech, Perca fluviatilis L. Interation of the perch lectin I with components of the mature egg jelly envelope. In: Bog-Hansen TC, Breborowicz J, editors. Lectins: Biology, Biochemistry, Clinical Biochemistry. : Proceedings of the 6th Lectin Meeting; 1985. vol 4 p. 377–96.
55. Stratton L, Wu S, Richards RC, Ewart KV. Oligomerisation and carbohydrate binding in an Atlantic salmon serum C-type lectin consistent with non-self recognition. Fish & Shellfish Immunology 2004;17(4):315-23.
56. Stockert RJ, Morell AG, Scheinbe.Ih. Mammalian Hepatic Lectin. Science 1974;186(4161):365-6.
57. Liener IE. The nutritional significance of the plant lectin. In: ORY RI, editor. Antinutrients and natural toxicants in foods. Westport: Food & Nutrition Press; 1981. p. 143-57.
58. Lis H, Sharon N. The biochemistry of plant lectins (phytohemagglutinins). Annu Rev Biochem 1973;42(0):541-74.
59. Marques MRF, Barracco MA. Lectins, as non-self-recognition factors, in crustaceans. Aquaculture 2000;191(1-3):23-44.
60. Miyata T, Tokunaga F, Yoneya T, Yoshikawa K, Iwanaga S, Niwa M, et al. Antimicrobial Peptides, Isolated from Horseshoe-Crab Hemocytes, Tachyplesin-Ii, and Polyphemusin-I and Polyphemusin-Ii - Chemical Structures and Biological-Activity. Journal of Biochemistry 1989;106(4):663-8.
62. Bayne CJ, Boswell CA, Loker ES, Yui MA. Plasma Components Which Mediate Cellular Defenses in the Gastropod Mollusk Biomphalaria glabrata. Developmental and Comparative Immunology 1985;9(3):523-30.
63. Yang R, Yoshino TP. Immunorecognition in the Fresh-Water Bivalve, Corbicula-Fluminea .2. Isolation and Characterization of a Plasma Opsonin with Hemagglutinating Activity. Developmental and Comparative Immunology 1990;14(4):397-404.
64. Hatakeyama T. Lectins in marine invertebrates. Glycoforum http://www.glycoforum.gr.jp/science/word/lectin/LEA07upE.html; 2007 [cited 2008 01/03/2008].
65. Rewrants L. Involvement of Agglutinins (Lectins) in Invertebrate Defense Reactions: The Immunological Importance of Carbohydrate-specific Binding Molecules. . Developmental and Comparative Immunology 1983;7(4):603-8.
66. Fenton-Navarro B, Garcia-Hernandez E, Heimer E, Aguilar MB, Rodriguez AC, Arreguin-Espinosa R, et al. Purification and structural characterization of lectins from the cnidarian Bunodeopsis antilliensis [corrected]. Toxicon 2003;42(5):525-32.
67. Wang JH, Jing K, Wei L, Molchanova V, Chikalovets I, Belogortseva N, et al. A beta-galactose-specific lectin isolated from the marine worm Chaetopterus variopedatus possesses anti-HIV-1 activity. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 2006;142(1-2):111-7.
68. Ozeki Y, Tazawa E, Matsui T. D-galactoside-specific lectins from the body wall of an echiuroid (Urechis unicinctus) and two annelids (Neanthes japonica and Marphysa sanguinea). Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology
1997;118(1):1-6.
70. Banerjee S, Chaki S, Bhowal J, Chatterjee BP. Mucin binding mitogenic lectin from freshwater Indian gastropod Belamyia bengalensis: purification and molecular characterization. Archives of Biochemistry and Biophysics 2004;421(1):125-34.
71. Melo VMM, Duarte ABG, Carvalho AFFU, Siebra EA, Vasconcelos IM. Purification of a novel antibacterial and haemagglutinating protein from the purple gland of the sea hare, Aplysia dactylomela Rang, 1828. Toxicon 2000;38(10):1415-27.
72. Kamiya H, Shimizu Y. A Natural Agglutinin Inhibitable by D-Galacturonic Acid in the Sea Hare Aplysia Eggs - Characterization and Purification. Bulletin of the Japanese Society of Scientific Fisheries 1981;47(2):255-9.
73. Hatakeyama T, Ohuchi K, Kuroki M, Yamasaki N. Amino-Acid-Sequence of a C-Type Lectin Cel-Iv from the Marine Invertebrate Cucumaria echinata. Bioscience Biotechnology and Biochemistry 1995;59(7):1314-7.
74. Muta T, Miyata T, Misumi Y, Tokunaga F, Nakamura T, Toh Y, et al. Limulus Factor-C - an Endotoxin-Sensitive Serine Protease Zymogen with a Mosaic Structure of Complement-Like, Epidermal Growth Factor-Complement-Like, and Lectin-Like Domains. Journal of Biological Chemistry 1991;266(10):6554-61.
75. Takagi T, Nakamura A, Deguchi R, Kyozuka K. Isolation, Characterization, and Primary Structure of 3 Major Proteins Obtained from Mytilus edulis Sperm. Journal of Biochemistry 1994;116(3):598-605.
76. Maheswari R, Mullainadhan P, Arumugam M. Characterisation of a natural haemagglutinin with affinity for acetylated aminosugars in the serum of the marine prawn, Penaeus indicus (H. Milne Edwards). Fish & Shellfish Immunology 1997;7(1):17-28.
77. Kondo M, Itami T, Takahashi Y. Preliminary characterization of lectins in the hemolymph of kuruma prawn. Fish Pathology 1998;33(4):429-35.
79. Maheswari R, Mullainadhan P, Arumugam M. Isolation and characterization of an acetyl group-recognizing agglutinin from the serum of the Indian white shrimp Fenneropenaeus indicus. Archives of Biochemistry and Biophysics 2002;402(1):65-76.
80. Alpuche J, Pereyra A, Agundis C, Rosas C, Pascual C, Slomianny MC, et al. Purification and characterization of a lectin from the white shrimp Litopenaeus setiferus (Crustacea decapoda) hemolymph. Biochimica Et Biophysica Acta-General Subjects 2005;1724(1-2):86-93.
81. Sethmann I, Worheide G. Structure and composition of calcareous sponge spicules: A review and comparison to structurally related biominerals. Micron 2008;39(3):209-28.
82. Farabee MJ. Biological Diversity: Animals I. http://www.emc.maricopa.edu/faculty/farabee/BIOBK/biobookdiversity_7.html#Sponges:%20
The%20Phylum%20Porifera. Estrella Mountain Community College; 2001 [cited 2007.
83. Pawlik JR, McFall G, Zea S. Does the odor from sponges of the genus Ircinia protect them from fish predators? Journal of Chemical Ecology 2002;28(6):1103-15.
84. Becerro MA, Turon X, Uriz MJ. Multiple functions for secondary metabolites in encrusting marine invertebrates. Journal of Chemical Ecology 1997;23(6):1527-47.
85. OKeefe BR, Beutler JA, Cardellina JH, Gulakowski RJ, Krepps BL, McMahon JB, et al. Isolation and characterization of niphatevirin, a human-immunodeficiency-virus-inhibitory glycoprotein from the marine sponge Niphates erecta. European Journal of Biochemistry 1997;245(1):47-53.
86. Dodd RY, Maclenna.Ap, Hawkins DC. Haemagglutinins from Marine Sponges. Vox Sanguinis 1968;15(5):386-&.
88. Pajic I, Kljajic Z, Dogovic N, Sladic D, Juranic Z, Gasic MJ. A novel lectin from the sponge Haliclona cratera: isolation, characterization and biological activity. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 2002;132(2):213-21.
89. Engel M, Bachmann M, Schroder HC, Rinkevich B, Kljajic Z, Uhlenbruck G, et al. A Novel Galactose-Specific and Arabinose specific Lectin from the Sponge Pellina semitubulosa - Isolation, Characterization and Immunobiological Properties. Biochimie
1992;74(6):527-37.
90. Atta AM, Barralnetto M, Peixinho S, Sousaatta MLB. Isolation and Functional-Characterization of a Mitogenic Lectin from the Marine Sponge Cinachyrella alloclada. Brazilian Journal of Medical and Biological Research 1989;22(3):379-85.
91. Opric MM, Poznanovic S, Kljajic Z, Sladic D, Pupic G, Perunovic B, et al. Labelling of breast carcinoma, thyroid carcinoma and melanoma with manno- and galacto-specific lectins from marine invertebrates. Eur J Histochem 1996;40(3):211-8.
92. Buck F, Luth C, Strupat K, Bretting H. Comparative Investigations on the Amino-Acid-Sequences of Different Isolectins from the Sponge Axinella polypoides (Schmidt). Biochimica Et Biophysica Acta 1992;1159(1):1-8.
93. Buck F, Schulze C, Breloer M, Strupat K, Bretting H. Amino acid sequence of the D-galactose binding lectin II from the sponge Axinella polypoides (Schmidt) and identification of the carbohydrate binding site in lectin II and related lectin I. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology 1998;121(2):153-60.
94. Bretting H, Kabat EA, Liao J, Pereira MEA. Purification and Characterization of Agglutinins from Sponge Aaptos papillata and a Study of Their Combining Sites. Biochemistry 1976;15(23):5029-38.
96. Gundacker D, Leys SP, Schroder HC, Muller IM, Muller WEG. Isolation and cloning of a C-type lectin from the hexactinellid sponge Aphrocallistes vastus: a putative aggregation factor. Glycobiology 2001;11(1):21-9.
97. Xiong CN, Li W, Liu H, Zhang W, Dou JL, Bai XF, et al. A normal mucin-binding lectin from the sponge Craniella australiensis. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 2006;143(1):9-16.
98. Bradford MM. Rapid and Sensitive Method for Quantitation of Microgram Quantities of Protein Utilizing Principle of Protein-Dye Binding. Analytical Biochemistry 1976;72(1-2):248-54.
99. Benevides NMB, Holanda ML, Melo FR, Freitas ALP, Sampaio AH. Purification and partial characterisation of the lectin from the marine red alga Enantiocladia duperreyi (C. Agardh) Falkenberg. Botanica Marina 1998;41(5):521-5.
100. Desouza GEP, Ferreira SH. Blockade by Antimacrophage Serum of the Migration of PMN Neutrophils into the Inflamed Peritoneal Cavity. Agents and Actions 1985;17(1):97-103. 101. Ribeiro RA, Flores CA, Cunha FQ, Ferreira SH. Il-8 Causes In vivo Neutrophil Migration by a Cell-Dependent Mechanism. Immunology 1991;73(4):472-7.
102. Bretting H, Phillips SG, Klumpart HJ, Kabat EA. A Mitogenic Lactose-Binding Lectin from the Sponge Geodia cydonium. Journal of Immunology 1981;127(4):1652-8.
103. Schroder HC, Kljajic Z, Wegner R, Reuter P, Gasic M, Uhlenbruck G, et al. The galactose-specific lectin from the sponge Chondrilla nucula displays anti-human immunodeficiency virus activity in vitro via stimulation of the (2’-5’) oligoadenylate metabolism. Antiviral Chemistry & Chemotherapy 1990;1(2):99-105.
104. Kurata O, Hatai K. Activation of carp leukocytes by a galactose binding protein from Aphanomyces piscicida. Developmental and Comparative Immunology 2002;26(5):461-9.
106. Yousif AN, Albright LJ, Evelyn TPT. Purification and Characterization of a Galactose-Specific Lectin from the Eggs of Coho Salmon Oncorhynchus kisutch and Its Interaction with Bacterial Fish Pathogens. Diseases of Aquatic Organisms 1994;20(2):127-36.
107. Moraes SMD, Cavada BS, Moreira RA, RoqueBarreira MC, SantosdeOliveira R, Pinto VPT, et al. Purification, physicochemical characterization and biological properties of a lectin from Erythrina velutina forma aurantiaca seeds. Brazilian Journal of Medical and Biological Research 1996;29(8):977-85.
108. Denotter W, Degroot JW, Vanbasten CDH, Rademakers LHPM, Deweger RA, Pels E. Brewer Thioglycollate Medium Induces Different Exudates in Guinea-Pigs and Mice. Experimental and Molecular Pathology 1982;36(3):403-13.
109. Eichner RD, Smeaton TC. Agar Accumulates in Rat Peritoneal-Macrophages Elicited with Thioglycollate Broth. Scandinavian Journal of Immunology 1983;18(3):259-63.
110. Spitalny GL. Dissociation of Bactericidal Activity from Other Functions of Activated Macrophages in Exudates Induced by Thioglycolate Medium. Infection and Immunity 1981;34(1):274-84.
111. Alencar NMN, Cavalcante CF, Vasconcelos MP, Leite KB, Aragao KS, Assreuy AMS, et al. Anti-inflammatory and antimicrobial effect of lectin from Lonchocarpus sericeus seeds in an experimental rat model of infectious peritonitis. Journal of Pharmacy and Pharmacology 2005;57(7):919-22.
112. Alencar VBM, Assreuy AMS, Alencar NMN, Meireles AVP, Mota MRL, Aragao KS, et al. Lectin of Pisum arvense seeds induces in-vivo and in-vitro neutrophil migration. Journal of Pharmacy and Pharmacology 2005;57(3):375-81.
114. Whaley K, Ferguson A. Molecular Aspects of Complement Activation. Molecular Aspects of Medicine 1981;4(3-4):209-73.
115. Cunha FQ, Ferreira SH. The Release of a Neutrophil Chemotactic Factor from Peritoneal-Macrophages by Endotoxin - Inhibition by Glucocorticoids. European Journal of Pharmacology 1986;129(1-2):65-76.
116. Staruch MJ, Wood DD. Reduction of Serum Interleukin-1-Like Activity after Treatment with Dexamethasone. Journal of Leukocyte Biology 1985;37(2):193-207.