Ângela Maria Fagundes da Cruz
Utilização de sílica gel organofuncionalizada
para adsorção de íons metálicos em solução aquosa
_______________________________________
Dissertação de Mestrado
Natal/RN, agosto de 2009
ÂNGELA MARIA FAGUNDES DA CRUZ
UTILIZAÇÃO DE SÍLICA-GEL ORGANOFUNCIONALIZADA PARA
ADSORÇÃO DE ÍONS METÁLICOS EM SOLUÇÃO AQUOSA
NATAL-RN 2009
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Central Zila Mamede
Cruz, Ângela Maria Fagundes da.
Utilização de sílica gel organofuncionalizada para adsorção de íons metálicos em solução aquosa / Ângela Maria Fagundes da Cruz. – Natal, RN, 2009.
100 f.: il.
Orientadora: Maria de Fátima Vitória de Moura
Dissertação (mestrado) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Sílica gel – Dissertação. 2. Íons metálicos – Dissertação. 3. Adsorção – Dissertação. I. Moura, Maria de Fátima Vitória de. II. Universidade Federal do Rio Grande do Norte. III. Título.
Aos meus pais, João e Aldenora,
pelo amor incomensurável, confiança, dedicação, paciência, carinho e por terem sido a verdadeira fonte de inspiração e força para prosseguir nesta
AGRADECIMENTOS
À Deus por continuar me guiando, por atender as minhas preces; por ter colocado e deixado permanecer em minha vida pessoas especiais como os meus familiares, e aos meus amigos. Pela saúde, amor e carinho da minha família e dos meus amigos.
Ao Professor Paulo Roberto Paiva Campos, obrigada por tudo, pois, serei eternamente grata especialmente: pelos conselhos, pelo carinho, pela confiança, pela amizade e pela experiência profissional.
À orientadora Profª DrªMaria de Fátima Vitória de Moura, química de coração e excelente profissional. A quem tenho profundo respeito, carinho e admiração. Obrigada pelo apoio, orientação, confiança, dedicação, etc.
Ao Prof. Dr. Robson Fernandes de Farias pelo apoio, orientação, confiança, dedicação, etc.
Aos colegas do curso e do laboratório: Antônio Marcos, Daniel Freire, Denise Emerenciano, Eliane Gonçalves, Fátima Vieira, George Queiroz, Francidarly Kelly, Geovane Chacon, Heloiza Fernanda, Janaina Monteiro, Jeane Monick, Karen Milena, Luciane Teixeira, Maria Raquel, Pablo Renoir, Roberta da Silva, Rosemeire Maria e Yohana Souza.
Ao Departamento de Química, nas pessoas dos professores: Dr. Ótom Anselmo de Oliveira e Dra. Zelma Rocha da Silva, e os funcionários: Gisele,Jussara Gondim, Maurício (grande amigo), Sônia Libório, Sônia Soares, William.
Ao NEPEG I e II, por conceder a leitura das amostras, através do Prof. Dr. Afonso Avelino, do Professor Dr. Djalma Ribeiro, do Prof. Dr. Eduardo Lins e da Profª Drª Tereza Neuma.
Aos meus professores.
À UFRN pela oportunidade e qualidade de ensino, pesquisa e extensão.
RESUMO
No presente trabalho, cinco matrizes de sílica organofuncionalizadas foram sintetizadas com os agentes sililantes aminopropiltrietoxisilano, 3-mercaptopropiltrietoxissilano e n[-3-(trimetoxissilil)propil]etilenotriamina. As matrizes híbridas foram sintetizadas e caracterizadas por análise elementar, por análise térmica e espectroscopia na região do infravermelho. Após sua caracterização as matrizes foram utilizadas como adsorventes para as espécies químicas Cd2+, Pb2+, Ni2+ e Zn2+ em solução aquosa. Para os testes utilizou-se 50 mg de cada matriz híbrada de sílica-gel organofuncionalizada para adsorção dos íons em solução aquosa com concentrações de 10, 20, 40, 60 e 80 mg L-1. Os tempos de contato foram de 30, 60, 90 e 120 min, nos quais as misturas eram mantidas sob agitação. Decorrido cada tempo, as concentrações de equilíbrio eram determinadas a partir de medidas de espectrometria de absorção atômica. A partir dessas medidas foi possível determinar a quantidade de íons adsorvidos para cada um dos elementos em estudo e relacionar essas quantidades em relação ao tempo de contato e ao tipo de matriz. Para todas as matrizes investigadas seguiu-se a ordem de adsorção: Ni2+ > Zn2+ > Cd2+ > Pb2+. A sequência de adsorção ocorre de acordo com o raio e dureza do cátion.
ABSTRACT
In this work the organosilanes aminopropyltriethoxysilane, 3-mercaptopropyltryethoxisilane and n[-3-(trimetoxisilyl)propyl]ethylenetriamine, as well as tetraethylortosilicate (TEOS), were employed to produce, by sol-gel method, organofuncionalized silicon samples. The prepared samples were characterized by elementar analys by thermogravimetry and infrared spectroscopy. Those samples were employed to adsorb Cd2+, Pb2+, Ni2+ and Zn2+ from aqueous solutions (10, 20, 40, 60 and 80 mg L-1). In typical experiments, 50 mg of the organometrix was suspended in 20 mL of metal cation solutions at four different contact times: 30, 60, 90 and 120 minutes. The total amount of adsorbed cations were measured by atomic absorption spectrometry. To all investigated matrices, the following adsorption capacity was observed: Ni2+ > Zn2+ > Cd2+ > Pb2+. Such sequence is closely related with the cation radius, as well as the cation hardness.
LISTA DE ILUSTRAÇÕES
Figura 1 − Distribuição de grupos silanóis na superfície de 1nm2 de sílica... 24
Figura 2 − Distribuição dos grupos silanóis na superfície da sílica. O círculo (a) destaca um grupo silanol isolado (Si−OH), (b) destaca um grupo siloxano (Si−O−Si), (c) destaca grupos silanóis vicinais (SiOH−SiOH) atraídos por pontes de hidrogênio, (d) destaca os grupos silanóis geminais(HO−Si−OH)... 25
Figura 3 − Mecanismo para catálise ácida... 26
Figura 4 − Mecanismo para catálise básica... 26
Figura 5 − Superfície da sílica gel ancorada com o agente sililante... 27
Figura 6 − Representação esquemática da interação existente entre a molécula de aminopropiltrietoxissilano e a superfície da sílica-gel após a ancoragem. 28 Figura 7 − Etapas da síntese da matriz S1... 34
Figura 8 − Etapas da síntese da matriz S2... 35
Figura 9 − Etapas da síntese da matriz S3... 36
Figura 10 − Etapas da síntese da matriz S4... 36
Figura 11 − Etapas da síntese da matriz S5... 37
Figura 12 − Solução de íons metálicos... 38
Figura 13 − Resumo das atividades desenvolvidas... 40
Figura 14 − Curvas termogravimétricas para as matrizes... 44
Figura 15 − 1as derivadas das curvas termogravimétricas para as matrizes... 44
Figura 16 − Curvas de análise térmica diferencial para as matrizes... 44
Figura 17 − Espectro na região de infravermelho para a matriz S1 (aminopropiltrietoxissilano) e S2 (aminopropiltrietoxissilano + 3-mercaptopropiltrietoxissilano)... 46
Figura 18 − Espectros de infravemelho para as matrizes contendo N-[3-(trimetoxissilil)propil)etilenotriamina, S3, S4 e S5... 47
Figura 20 − Percentuais de adsorção de Cd2+ na matriz S1... 50
Figura 21 − Número de mols fixados de Cd2+ por grama da matriz S2... 51
Figura 22 − Percentuais de adsorção de Cd2+ por grama de matriz S2... 52
Figura 23 − Número de mols fixados de Cd2+ por grama da matriz S3... 53
Figura 24 − Percentuais de adsorção de Cd2+ por grama da matriz S3... 54
Figura 25 − Número de mols fixados de Cd2+ por grama de matriz S4... 55
Figura 26 − Percentuais de adsorção de Cd2+ por grama da matriz S4... 56
Figura 27 − Número de mols fixados de Cd2+ por grama de matriz S5... 57
Figura 28 − Percentuais de adsorção de Cd2+ por grama da matriz S5... 58
Figura 29 − Número de mols fixados de Pb2+ por grama da matriz S1... 59
Figura 30 − Percentuais de adsorção de Pb2+ por grama de matriz S1... 60
Figura 31 − Número de mols de Pb2+ fixados por grama da matriz S2... 61
Figura 32 − Percentuais de adsorção de Pb2+ por grama da matriz S2... 62
Figura 33 − Número de mols fixados de Pb2+ por grama da matriz S3... 63
Figura 34 − Percentuais de adsorção de Pb2+ por grama da matriz S3... 64
Figura 35 − Número de mols fixados de Pb2+ por grama da matriz S4... 65
Figura 36 − Percentuais de adsorção de Pb2+ por grama da matriz S4... 66
Figura 37 − Número de mols fixados de Pb2+ por grama da matriz S5... 67
Figura 38 − Percentuais de adsorção de Pb2+ por grama da matriz S5... 68
Figura 39 − Número de mols fixados de Ni2+ por grama da matriz S1... 69
Figura 40 − Percentuais de adsorção de Ni2+ por grama da matriz S1... 70
Figura 41 − Número de mols fixados de Ni2+ por grama da matriz S2... 71
Figura 42 − Percentuais de adsorção de Ni2+ por grama da matriz S2... 72
Figura 44 − Percentuais de adsorção de Ni2+ por grama de matriz S3... 74
Figura 45 − Número de mols fixados de Ni2+ por grama da matriz S4... 75
Figura 46 − Percentuais de adsorção de Ni2+ por grama da matriz S4... 76
Figura 47 − Número de mols fixados de Ni2+ por grama da matriz S5... 77
Figura 48 − Percentuais de adsorção de Ni2+ por grama da matriz S5... 78
Figura 49 − Número de mols fixados de Zn2+ por grama da matriz S1... 79
Figura 50 − Percentuais de adsorção de Zn2+ por grama da matriz S1... 80
Figura 51 − Número de mols fixados de Zn2+ por grama da matriz S2... 81
Figura 52 − Percentuais de adsorção de Zn2+ por grama da matriz S2... 82
Figura 53 − Número de mols fixados de Zn2+ por grama da matriz S3... 83
Figura 54 − Percentuais de adsorção de Zn2+ por grama da matriz S3... 84
Figura 55 − Número de mols fixados de Zn2+ por grama matriz S4... 85
Figura 56 − Percentuais de adsorção de Zn2+ por grama da matriz S4... 86
Figura 57 − Número de mols fixados de Zn2+ por grama da matriz S5... 87
Figura 58 − Percentuais de adsorção de Zn2+ por grama da matriz S5... 88
LISTA DE TABELAS
Tabela 1− Reagentes utilizados nas análises... 31
Tabela 2 − Equipamentos utilizados neste trabalho... 31
Tabela 3 − Resultado da análise de C, H, N nas matrizes sintetizadas... 39
Tabela 4 − Determinação do grau de saturação para as matrizes... 40
Tabela 5 − Resultados da análise térmica para as matrizes... 42
Tabela 6 − Concentrações iniciais para os ensaios de adsorção de íons metálicos... 45
Tabela 7 − Número de mols fixados de Cd2+ por grama da matriz S1... 46
Tabela 8 − Percentuais de adsorção do Cd2+ por grama da matriz S1... 47
Tabela 9 − Número de mols fixados de Cd2+ por grama da matriz S2... 48
Tabela 10 − Percentuais de adsorção do Cd2+ por grama da matriz S2... 49
Tabela 11 − Número de mols fixados de Cd2+ por grama da matriz S3... 50
Tabela 12 − Percentuais de adsorção do Cd2+ por grama da matriz S3... 51
Tabela 13 − Número de mols fixados de Cd2+ por grama da matriz S4... 52
Tabela 14 − Percentuais de adsorção do Cd2+ por grama da matriz S4... 53
Tabela 15 − Número de mols fixados de Cd2+ por grama da matriz S5... 54
Tabela 16 − Porcentagens de adsorção do Cd2+ por grama da matriz S5... 55
Tabela 17 − Número de mols fixados de Pb2+ por grama da matriz S1... 56
Tabela 18 − Porcentagens de adsorção do Pb2+ por grama da matriz S1... 57
Tabela 19 − Número de mols fixados de Pb2+ por grama da matriz S2... 58
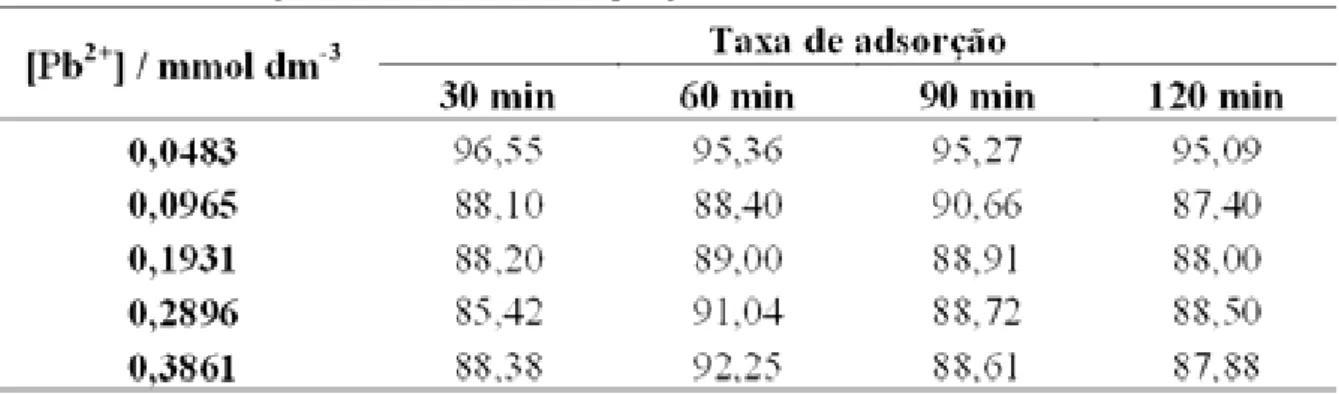
Tabela 20 − Taxa de adsorção do Pb2+ por grama da matriz S2... 59
Tabela 21 − Número de mols fixados de Pb2+ por grama da matriz S3... 60
Tabela 23 − Número de mols fixados de Pb2+ por grama da matriz S4... 62
Tabela 24 − Percentuais de adsorção do Pb2+ por grama da matriz S4... 63
Tabela 25 − Número de mols fixados de Pb2+ por grama da matriz S5... 64
Tabela 26 − Percentuais de adsorção do Pb2+ por grama da matriz S5... 65
Tabela 27 − Número de mols fixados de Ni2+ por grama da matriz S1... 66
Tabela 28 − Percentuais de adsorção do Ni2+ por grama da matriz S1... 67
Tabela 29 − Número de mols fixados de Ni2+ por grama da matriz S2... 68
Tabela 30 − Percentuais de adsorção do Ni2+ por grama da matriz S2... 69
Tabela 31 − Número de mols fixados de Ni2+ por grama da matriz S3... 70
Tabela 32 − Percentuais de adsorção do Ni2+ por grama da matriz S3... 71
Tabela 33 − Número de mols fixados de Ni2+ por grama da matriz S4... 72
Tabela 34 − Percentuais de adsorção do Ni2+ por grama da matriz S4... 73
Tabela 35 − Número de mols fixados de Ni2+ por grama da matriz S5... 74
Tabela 36 − Percentuais de adsorção do Ni2+ por grama da matriz S5... 74
Tabela 37 − Número de mols fixados de Zn2+ por grama da matriz S1... 76
Tabela 38 − Percentuais de adsorção do Zn2+ por grama da matriz S1... 77
Tabela 39 − Número de mols fixados de Zn2+ por grama da matriz S2... 78
Tabela 40 − Percentuais de adsorção do Zn2+ por grama da matriz S2... 79
Tabela 41 − Número de mols fixados de Zn2+ por grama da matriz S3... 80
Tabela 42 − Percentuais de adsorção do Zn2+ por grama da matriz S3... 81
Tabela 43 − Número de mols fixados de Zn2+ por grama da matriz S4... 82
Tabela 44 − Percentuais de adsorção do Zn2+ por grama da matriz S4... 83
Tabela 45 − Número de mols fixados de Zn2+ por grama da matriz S5... 84
LISTA DE ABREVIATURA E SIGLAS
αOH − grau de sítios ativos
Ag+ − Íon prata
AMP − 3-aminopropiltrietoxissilano
APEN − 3-propiletilenodiaminotrimetoxissilano C-C − Interação carbono-carbono
Cd2+ − Íon cádmio
Cf − Concentração dos íons metálicos no filtrado
-CH2 − Grupo metileno
Ci − Concentração inicial dos íons metálicos
Cl − Elemento Cloro
cm-1 − Unidade de número de onda C-N − Interação carbono-nitrogênio Co2+ − Íon cobalto
C-S-H − Interação carbono-enxofre-hidrogênio DTA − Análise Térmica Diferencial
DTG − 1ª derivada da curva termogravimétrica EAA − Espectroscopia de Absorção Atômica Fe3+ − Íon ferro
FT-IR − Espectrometria no infravermelho com Transformada de Fourier Hg2+ − Íon mercúrio
mg − miligramas
mg L-1 − miligramas por litro mmol − milimol
N. D. − Não Detectado
nf − − números de mols fixos
NH(CH2)2NH2 − Grupo etilenodiamina
NH2 − Grupo amino
Ni2+ − Íon níquel ºC − Grau centrígrado -OH- − Grupo hidroxila Pb2+ − Íon chumbo
pKa − Constante de equilíbrio de ácido fraco
S1 − Matriz híbrida S1 S2 − Matriz híbrida S2 S3 − Matriz híbrida S3 S4 − Matriz híbrida S4 S5 − Matriz híbrida S5 -SH − Grupo mercapto ou tiol Si − Silício
Sil-AMPTG − sílica gel modificada SiO2 − Sílica
Tf − Temperatura final
TG − Termogravimetria TGA − ácido tioglicólico Ti − Temperatura inicial
Tp − Temperatura do pico
SUMÁRIO
1 INTRODUÇÃO... 18
1.1 OBJETIVOS... 21
1.1.1 Geral... 21
1.1.2 Específicos... 21
2 REVISÃO DA LITERATURA... 23
2.1 SILÍCIO... 23
2.1.2 Variedades do Silício... 23
2.1.3 Propriedades da Superfície... 24
2.1.4 Reatividade da Superfície... 24
2.2 ORGANOFUNCIONALIZAÇÃO DA SUPERFÍCIE... 25
2.3 APLICAÇÃO... 29
2.4 ADSORÇÃO... 29
3 PARTE EXPERIMENTAL... 32
3.1 MATERIAIS... 32
3.1.2 Instrumentação... 33
3.1.3 Limpeza do material... 33
3.2 MÉTODOS... 34
3.2.1 Condições de síntese das sílicas... 34
3.2.1.1 Sínteses das matrizes de sílica organofuncionalizadas... 34
3.2.1.2.1 Síntese da matriz S1... 34
3.2.1.2.2 Síntese da matriz S2... 35
3.2.1.2.3 Síntese da matriz S3... 35
3.2.1.2.4 Síntese da matriz S4... 36
3.2.1.2.5 Síntese da matriz S5... 37
3.3.1 Preparação das soluções de estudo... 37
3.3.2 Reatividade da sílica frente aos metais... 38
3.4 CARACTERIZAÇÕES DAS MATRIZES ORGANOFUNCIONALIZADAS.. 38
3.4.1 Análise elementar de CHN... 38
3.4.2 Termogravimétrica... 39
3.4.3 Espectroscopia de absorção na região do infravermelho... 39
3.4.4 Espectroscopia de absorção atômica... 39
3.4.4.1 Construção das curvas analíticas... 40
3.4.5 Resumo de atividades desenvolvidas... 40
4 RESULTADOS E DISCUSSÃO... 42
4.1 CARACTERIZAÇÕES DAS MATRIZES ORGANOFUNCIONALIZADAS.. 42
4.1.1 Análise elementar CHN... 42
4.1.2 Termogravimetria... 42
4. 1.3 Espectroscopia de absorção na região do infravermelho... 45
4. 1.4 Testes de adsorção para as matrizes de sílica gel organofuncionalizadas.... 47
4.1.4.1 Ensaio de adsorção para o cádmio... 49
4.1.4.2 Ensaio de adsorção para o chumbo... 59
4.1.4.3 Ensaio de adsorção para o níquel... 69
4.1.4.4 Ensaio de adsorção para o zinco... 79
4.2.1 Influência do raio iônico sobre a adsorção de íons metálicos nas matrizes híbridas ... 89
5 CONCLUSÃO... 91
6 SUGESTÕES PARA TRABALHOS FUTUROS... 94
CAPÍTULO 1
1 INTRODUÇÃO
A água é um dos recursos naturais mais intensamente utilizados. É fundamental para a existência e manutenção da vida e, para isso, deve estar presente no ambiente em quantidade e qualidade adequadas. O homem tem usado a água não só para suprir suas necessidades metabólicas, mas também para outros fins, como abastecimento industrial, irrigação, geração de energia, navegação, diluição de despejos além de exploração e produção de petróleo (EL-GEUNDI, 1997, apud SANTOS; ALSINA; SILVA, 2007).
As propriedades químicas e físico-químicas da água a fazem um solvente com qualidades excepcionais, além de ser a substância em maior quantidade na crosta terrestre. De maneira que numerosas substâncias orgânicas e inorgânicas são solúveis na água o que a torna o solvente universal. Muitos desses solutos são indesejáveis, pois são capazes de intereferir em diversos processos naturais ou não-naturais.
A Química tem uma grande participação nos dias atuais com os inúmeros produtos fundamentais à humanidade, pois a sua presença pode ser destacada desde diversos combustíveis aos mais complexos medicamentos. Porém, a produção química também gera inúmeros inconvenientes, como a formação de subprodutos tóxicos e a contaminação do ambiente e do próprio homem. Nos últimos anos, cresce continuamente a pressão sobre as indústrias químicas, tanto através da sociedade civil, como das autoridades governamentais, no sentido de aprimorar o desenvolvimento de processos, que sejam cada vez menos prejudiciais ao meio ambiente.
Dentre as principais espécies químicas lançandas nos cursos de água estão o cádmio, chumbo, cromo, níquel e zinco, estão o que mais preocupam em virtude da ampla utilização desses elementos em diversas linhas de produção, como por exemplo as indústrias mineradoras, metalúrgicas, e de produção de tintas. Em muitos casos, mesmo em pequenas quantidades há provas abundantes dos efeitos nocivos, à saúde ou ao ambiente, causadas por diversas formas de íons livres ou complexadas, dos vários elementos químicos dissolvidos na água. Este material quando transferido para solos cultiváveis, provoca elevação significativa dos níveis de metais nos vegetais produzidos e consumidos pela população (SALGADO, 2003).
à toxidade desses elementos é recente, são poucas as pessoas que sabem que os metais causam câncer, afetam o sistema nervoso, a medula óssea, provocam dores lombares e nas pernas que persistem durante anos.
Apesar de existirem provas abundantes dos efeitos nocivos que quantidades muito pequenas dessas espécies podem causar danos à saúde, as normas legais não são suficientes para assegurar o uso adequado da água, sem que haja contaminação de rios, lagos e mares, tanto pelo lançamento de resíduos industriais e/ou dométicos.
O comércio entre as nações exige adequação das respectivas legislações, tornando necessário que os produtos estejam isentos dos contaminantes mencionados nas normas dos países importadores. Quando tal não ocorre, os produtos exportados são passíveis de serem rejeitados ou considerados de nível inferior, sendo muitas vezes adquiridos por preços muito abaixo do mercado. Por essa razão, faz-se necessário à detecção de contaminações, tomando-se as medidas corretivas para prevení-las na origem (MÍDIO, 2000).
Existem diversos grupos de pesquisa em todo o mundo têm tido interese em desenvolver pesquisas com o objetivo de criar produtos ou procedimentos voltados para o tratamento da água a fim de minimizar os efeitos ou a emissão de resíduos orgânicos e/ou inorgânicos em corpos d´água naturais. É importante incentivar pesquisas que sejam direcionadas à síntese de materiais para a adsorção seletiva de substâncias tóxicas.
Dentro da problemática industrial vigente, um dos principais problemas que se destaca é o grande volume de efluentes tóxicos produzidos por vários processos químicos. A emissão de contaminantes pode ser minimizada através de diversos caminhos, tais como o emprego de reagentes alternativos apropriados, o aumento da seletividade para maximizar o uso dos materiais de partida, a utilização de catalisadores para facilitar a separação do produto final da mistura, bem como a reciclagem dos reagentes e catalisadores empregados no processo (CLARK; MACQUARRIE, 1998, 1996; PRICE; CLARK; MACQUARRIE, 2000, apud PRADO, 2003).
Dentre as áreas de pesquisa enfocadas para estas finalidades, têm-se destacado muito nos últimos anos a preparação de catalisadores sólidos, com o firme propósito da remoção de contaminantes dispersos em efluentes, bem como na catálise de reações químicas com o objetivo da maximização das reações e redução da formação de subprodutos indesejáveis durante o processo reacional (BRESSON et al. 2000, apud PRADO, 2003; STEIN; MELDE; SCHODEN, 2000).
O desenvolvimento de removedores de íons metálicos é também de interesse ambiental e tecnológico. Do ponto de vista ambiental, por exemplo, a presença de íons metálicos em ambientes aquáticos representa potencial risco à sustentabilidade do sistema. O conhecimento da capacidade adsortiva dos solos e das substâncias húmicas ali presentes têm permitido prever a carga que o ambiente consegue suportar e riscos de contaminação para as comunidades circunjacentes. Uma das formas de remoção desses íons é através da inclusão de adsorventes ao meio, os quais geralmente são materiais sintéticos, funcionalizados e de alta capacidade adsortiva. Nesse contexto, matrizes de sílicas organofuncionalizadas que são materiais estruturalmente organizados têm sido um tipo de material proposto com a finalidade de adsorver diversas substâncias com os mais diversos interesses.
Dentre esses materiais, a sílica tem despontado como excelente matriz, não apenas pelo seu baixo custo, mas também pela facilidade com que é funcionalizada. Diversos grupos de pesquisas desenvolvem novos materiais baseados em sílicas modificadas e estudam, por exemplo, sua capacidade adsortiva frente a diversos adsorvatos, em diversas condições, estabilidade térmica e mecânica, ancoramento de compostos de coordenação, regeneração e potencialidades analíticas (CANTANHEDE, et al. 2005).
Devido à necessidade da união de constituintes inorgânicos e orgânico para a obtenção de novos compostos que possam uma aplicação diversificada, surgiram os compostos de materiais híbridos orgânico-inorgânicos. Devido a esta aplicabilidade, do potencial e caráter multidisciplinar, pesquisadas voltadas para esta área vêm aumentando nos últimos anos e atraindo a atenção, tanto de pesquisadores acadêmicos, de diferentes áreas, como despertando o interesse para uso industrial (JOSÉ; PRADO, 2005).
As sílicas organofuncionalizadas apresentam uma vasta quantidade de aplicações, devido às suas vantagens em relação a suportes orgânicos (AIROLDI, 2000, LYGIN, 1994, ILER, 1979). Podem-se destacar alguns aspectos, como: a imobilização em sílica pode ser feita por uma variedade enorme de agentes sililantes, o que proporciona uma quantidade considerável de grupos funcionais pendentes; a matriz apresenta um alto grau de ligações cruzadas, o que a torna muito estável; a sílica não sofre inchamento em solventes orgânicos; grande resistência a solventes orgânicos; alta estabilidade térmica. Essas propriedades são importantes para a aplicação específica do material para fins analíticos, como a sorção de metais, cromatografia, troca iônica, entre outros (SPLENDORE et al. 2005, MAGOSSO et al. 2006, MARANGONI, 2005).
O presente trabalho abordará sobre a síntese e reatividade de sílicas géis organofuncionalizadas para serem testadas como agente sequestrante de íons metálicos em solução aquosa sob condições variadas de concentração inicial de íons metálicos e tempo de contato.
1.1 OBJETIVOS
1.1.1 Geral
Testar a reatividade de cinco diferentes matrizes de sílica-gel organofuncionalizada como agente sequestrante para íons metálicos em solução aquosa.
1.1.2 Específicos
Sintetizar e caracterizar cinco diferentes tipos de sílicas com agentes sililantes diferentes.
Avaliar a influência da concentração dos íons metálicos sobre a adsorção das matrizes sintetizadas.
Avaliar a influência do tempo de agitação sobre a adsorção das matrizes sintetizadas. Avaliar o percentual de adsorção sobre cada matriz em relação aos íons Cd2+, Pb2+,
CAPÍTULO 2
2 REVISÃO DA LITERATURA
2.1SILÍCIO
O silício não é encontrado livre na natureza, mas corresponde a 14,53% da crosta terrestre quando combinado com outros elementos. O seu principal composto é o anidrido silícico, dióxido de silício, quartzo sendo também chamado de sílica (SiO2), em que o átomo
de silício é coordenado tetraedricamente por quatro átomos de oxigênio.
Na forma elementar o silício possui ponto de fusão de 1420οC, e ponto de ebulição de
2600οC, tem densidade de 2,2 ou 2,9 dependendo do seu estado alotrópico. Pode ser encontrado na forma cristalina ou amorfo. Quando cristalizado o silício é um sólido cinza escuro, pode riscar o vidro. Porém, diferentes fases podem ser formadas de acordo com as condições do meio, sendo dependentes da temperatura, pressão e grau de hidratação. Em altas temperaturas oxida-se superficialmente, é atacado pelo cloro à quente. É um pó escuro quando amorfo, é atacado pelo ácido fluorídrico, pelo hidróxido de potássio e hidróxido de sódio.
2.1.2 Variedades do Silício
O silício forma composto com muito elementos, gerando silicatos com quase todos os metais, principalmente potássio, sódio, cálcio, magnésio, alumínio e ferro. É encontrado nos feldspatos, nas micas, nas serpentinas, nas argilas, nas turmalinas, no topázio etc. Cristal de rocha, quartzo, cristobalita, calcedônia, moscovita, actinota, jaspe, tridimita, estaurolita, opala, biotita, flogopita, diatomito, olivina, paragonita, safirina, lazurita, vermiculita, granada, titanita, benitoíta, turmalina, fuchsita, labradorita, oligoglásio, cordierita, vesuvianita, prehnita, sodalita e glauconita são exemplos de minerais que contém este elemento. Sua abundância natural alcança os 60%.
inúmeros tipos de grupos coordenantes, grupos esses que irão determinar a sua aplicabilidade em diversos setores da economia.
2.1.3 Propriedades da Superfície
A sílica possui uma ótima estabilidade térmica, mecânica e química, mantendo sua estrutura mesmo quando submetida a altas condições de temperatura e pressão. Apresenta grande resistência ao meio reacional, podendo ser regenerada para uso posterior, tornando-se amplamente aplicada à Química de superfície (PRADO, 2005, DELLA, 2006; GERMANO 2008).
A sílica gel é um típico exemplo de polímero inorgânico que apresenta em sua composição grupos siloxanos, Si-O-Si, em seu interior e tem vasta população de grupos silanóis, Si-OH, cobrindo a sua superfície (ILER, apud AIROLDI; FARIAS, 2000).
2.1.4 Reatividade da Superfície
É a presença dos grupos hidroxilas (silanóis) que irá determinar a reatividade da superfície da sílica. Estes grupos encontram-se de forma aleatória como mostrado na Figura 01, gerando uma irregularidade na densidade eletrônica, gerando um comportamento ácido conhecido como ácido de Brφnsted, cujo pKa se aproxima de 7.
Figura 1 – Distribuição de grupos silanóis na superfície de 1nm2 de sílica. Adaptada de Sousa, 2005.
gel, representado por uma constante físico-química da sílica, αOH
,
que é 5,0 OH/nm2; estevalor independe da origem do material, características estruturais, área superficial, tamanhos de poros, empacotamento das partículas e tamanho de poros, sendo confirmados por diversas técnicas (AIROLDI; FARIAS 2000).
Os grupos silanóis são classificados em: silanóis livres (ou isolados), e os ligados por pontes de hidrogênios que são os silanóis geminais e vicinais, conforme pode ser visualizado na Figura 02:
Figura 2 – Distribuição dos grupos silanóis na superfície da sílica. O círculo (a) destaca um grupo silanol isolado (Si−OH), (b) destaca um grupo siloxano (Si−O−Si), (c) destaca grupos silanóis vicinais (SiOH−SiOH) atraídos por pontes de hidrogênio, (d) destaca os grupos silanóis geminais(HO−Si−OH); adaptado de COSTA, 2007.
2.2ORGANOFUNCIONALIZAÇÃO DA SUPERFÍCIE
Devido à necessidade da união de constituintes inorgânicos e orgânicos para a obtenção de novos compostos que possuam aplicação diversificada, surgiram os compostos de materiais híbridos orgânico-inorgânicos. Devido a esta aplicabilidade, do potencial e caráter multidisciplinar, pesquisas voltadas para esta área vêm aumentando nos últimos anos e atraindo a atenção, tanto de pesquisadores acadêmicos de diferentes áreas, como despertando o interesse para uso industrial (JOSÉ, 2005).
imobilizam a fase líquida nos seus interstícios (BRINKER; SHERRER, 1990, HIRATSUKA, 1995, JOSÉ, 2005).
O produto da sílica gel organofuncionalizada pelo processo sol-gel depende da temperatura, do tempo de reação, da natureza do catalisador, da concentração de reagentes. Determinando as características finais do produto como a porcentagem de hidrólise e condensação dos grupos reativos, densidade de reticulação, homogeneidade do produto .
Quanto à natureza do catalisador, o mesmo influencia na cinética da reação e na estrutura final do gel. Quando o catalisador é ácido, ocorrendo reação eletrofílica, e a velocidade da condensação será maior que a hidrólise, levando à formação de cadeias lineares mais longas e menos ramificadas no início do processo. Na catálise básica a substituição é nucleofílica, e a velocidade de hidrólise é maior que a de condensação levando a formação de cadeias mais ramificadas. Nas Figuras 03 e 04 estão apresentados os mecanismos para as reações de catálise ácida e básica (NASSAR et al., 2002).
Figura 4 – Mecanismo para catálise básica (Adaptado de NASSAR et al., 2002).
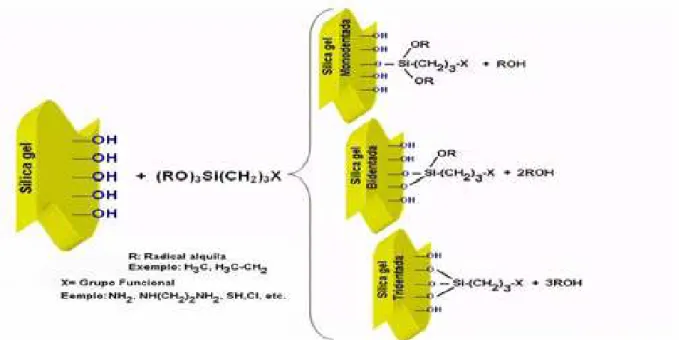
Nessas reações, o agente sililante (ARAKAKI; AIROLDI, 1998) pode ser o (RO)3Si(CH2)3-X, onde R é um radical alquila e X é um grupo funcional alcóxido ou
halogênio (Cl, SH, NH2, NH(CH2)2NH2) e os produtos das reações assumem formas como as
que são mostradas na Figura 05, com agente sililante. Podendo ser visualizado na Figura 05 uma representação esquemática da superfície da sílica ancorada com agente sililante, podendo assumir a forma mono, di e tridentada.
Figura 5 – Superfície da sílica gel ancorada com o agente sililante
cuja nova molécula passa a ser ancorada na superfície do substrato inorgânico, caracterizando o método homogêneo. As moléculas mais comumente ancoradas apresentam oxigênio ou nitrogênio, ou mesmo ambos como centros de coordenação, além de enxofre, fósforo, etc., sendo que, dependendo da rota de síntese, estas espécies químicas podem comportar-se como mono ou polidentadas.
A adsorção de metais pelas sílicas modificadas pode ser efetuada em meio aquoso ou em solventes não aquosos, destacando-se principalmente o etanol e a acetona.
A sílica gel organofuncionalizada em destaque na Figura 06 é uma matriz que possui estrutura hexagonal contendo como agente sililante aminopropiltrietoxilsilano com o objetivo de adsorver ions metálicos.
Figura 6 – Representação esquemática da interação existente entre a molécula de aminopropiltrietoxissilano e a superfície da sílica-gel após a ancoragem. Fonte: (FARIAS, 2001).
As sílicas compostas com o cloropropil e o aminopropil são amplamente utilizadas pelas facilidades em ampliar não só a cadeia orgânica, como também em aumentar o número de centros básicos na mesma, através de reações.
A sílica organofuncionalizada com o grupo mercaptopropil mostra-se capaz de adsorver Cd2+, Pb2+, Ag+, Co2+, Co3+, Cu2+, Ni2+, Zn2+, Hg2+ e Fe3+ (FARIAS, 2001).
A grande vantagem da utilização da sílica organofuncionalizada contendo o agente sequestrante advém da possibilidade de reciclagem do substrato adsorvente, além de apresentar propriedades relacionadas à insolubilidade em meios orgânicos e ainda, não apresentar inchamento em solventes orgânicos (FARIAS, 2009).
ácido tioglicólico (TGA) para a obtenção de sílica gel modificada (Sil-AMPTG) e duas sílicas mesoporosas pela reação de TEOS e dodecilamina como direcionador. Com o objetivo de serem utilizados para adsorção de cátions divalentes de cobre, níquel e cobalto em solução aquosa, constatou que os números de mols fixados (nf), adsorvidos na Sil-AMPTG foram: 2,26, 1,50 e 0,89 mmol por grama de sílica para os metais cobre, níquel e cobalto e para as sílicas mesoporosas testou o níquel e o cobalto sendo observado para ambos os sólidos que o níquel superou o cobalto.
2.3 APLICAÇÃO
A sílica quimicamente modificda é um dos materiais inorgânicos mais utilizados como suporte em diversas aplicações devido ao fato de apresentar uma grande área superficial mostrando ótimas propriedades de adsorção. Sendo que a sua principal aplicabilidade deve-se a sua capacidade de formar complexos com cátions metálicos e, consequentemente, conseguir extraí-los, mesmo quando se encontram em baixas concentrações, apresentando a vantagem de poder ser reutilizada, uma vez que os processos de retenção por adsorção e quelação serem reversíveis. É altamente estável termicamente, e os processos de separação e pré-concentração de cátions metálicos usando sílicas modificadas podem ser efetuados em meio aquoso ou em solventes não aquosos, destacando-se principalmente o etanol e acetona (FARIAS, 2009).
2.4 ADSORÇÃO
CAPÍTULO 3
3 PARTE EXPERIMENTAL
Neste capítulo são apresentados os materiais, os reagentes e os equipamentos utilizados, além dos procedimentos empregados para realização da síntese, preparo das soluções em estudo, obtenção das soluções de leitura, obtenção das medidas, construção de curvas de analíticas encerrando-se com diagrama das atividades.
3.1 MATERIAIS
Os reagentes utilizados nesta pesquisa foram do tipo grau analítico e encontram-se relacionados na Tabela 1.
Tabela 1 – Reagentes utilizados nas análises
Item Discriminação Procedência
01 Acido clorídrico P.A. Vetec
02 Ácido fórmico Vetec
03 3-Aminopropiltrietoxissilano Aldrich 04 Brometo de Potássio Vetec
05 Hidróxido de amônio P.A. Quimex
06 3-Mercaptopropiltrietoxissilano Aldrich 07 Tetrabutóxido de titânio Aldrich
08 Tetraetilotossilicato Aldrich 09 N-[3-(Trimetoxisilil)propil]etilenotriamina Aldrich 10 Padrão Para E.A.A. de Cádmio (1000 mg L-1) J. T. Baker 11 Padrão para E.A.A. de Chumbo (1000 mg L-1) J. T. Baker
12 Padrão para E.A.A. de Níquel (1000 mg L-1) J. T. Baker 13 Padrão para E.A.A. de Zinco (1000 mg L-1) J. T. Baker
3.1.2 Instrumentação
Na Tabela 2 é apresentada a relação dos instrumentos utilizados.
Tabela 2 – Equipamentos utilizados neste trabalho
Fonte: A autora.
3.1.3 Limpeza do material
Todas as soluções foram estocadas em frascos de polietileno, previamente lavados e descontaminados. Realizou-se a descontaminação dos frascos e vidrarias em geral, através de lavagem com solução de ácido nítrico a 10% (v/v), em seguida enxaguando-se três vezes com água destilada e secando-se posteriormente a temperatura ambiente (frascos de polietileno) ou em estufa com circulação de ar (vidrarias de laboratório).
Item Discriminação Marca/modelo
01 Elementar analyser Perkin Elmer 2400 série 2
02 Balança analítica Tecnal Mark 210 A
03 Bomba à vácuo Tecnal
04 Estufa de secagem com ventilação forçada Quimis,
05 Agitador magnético Modelo Ética, RPM 2000 06 Espectrofotômetro de Absorção Atômica Varian /Espectr AA 240 PLUS 07 Espectrofotômetro de Absorção FT-IR Thermo Nicolet/Nexus 470
08 Mesa agitadora Tecnal/TE-420
3.2 MÉTODOS
3.2.1 Condições de síntese das sílicas
3.2.1.1 Sínteses das matrizes de sílica organofuncionalizada
As sínteses das matrizes foram realizadas em sistema aberto, a temperatura e pressão ambiente. Ao final da síntese os sólidos resultantes foram separados por filtração à vácuo com funil de Buchner, e lavados com água destilada.
3.2.1.2.1 Síntese da matriz S1
Na síntese da matriz S1, 300 mL de tetrabutóxido de titânio foram adicionados a 150 mL de 3-amipropiltrietoxissilano. Posteriormente foram adicionadas 10 mL de ácido clorídrico concentrado e finalizou-se com a adição de 500 mL de água destilada. Na adição de cada reagente, a solução era agitada vigorosamente com um bastão de vidro. A matriz híbrida sintetizada recebeu a codificação S1. A Figura 7 apresenta o resumo destas atividades.
3.2.1.2.2 Síntese da matriz S2
A síntese da matriz S2, pela mistura de 70 mL de 3-mercaptopropiltrietoxissilano com 105 mL de 3-amipropiltrietoxissilano, após a mistura adicionou-se 400 mL de tetraetilortosilicato - TEOS, posteriormente foram adicionados à esta mistura 50 mL de ácido fórmico concentrado e por último foram adicionados 200 mL de água destilada. Tomando o cuidado de a cada adição de reagente, a mistura ser agitada vigorosamente com um bastão de vidro. A matriz híbrida sintetizada recebeu a codificação S2. Figura 8.
Figura 8 – Etapas da síntese da matriz S2.
3.2.1.2.3 Síntese da matriz S3
Figura 9 – Etapas da síntese da matriz S3.
3.2.1.2.4 Síntese da matriz S4
Na síntese de matriz S4, misturou-se 60 mL de N-[3-(trimetoxisilil)propil]etilenotriamina com 150 mL de tetraetilortosilicato, logo após, foram adicionados à mistura 50 mL de hidróxido de amônio a 29%. Tendo o devido cuidado de a cada adição de um novo reagente, a mistura ser agitada vigorosamente com um bastão de vidro. Adicionou 100 mL de água destilada, homogeneizou, ficou em repouso e filtrado à vácuo, seco em estufa. A matriz híbrida sintetizada recebeu a codificação S4. Figura 10.
3.2.1.2.5 Síntese da matriz S5
Para a síntese da matriz S5 misturou-se 47 mL de N-[3-(trimetoxisilil)propil]etilenotriamina com 425 mL de tetraetilortosilicato, posteriormente foram adicionados à mistura 25 mL de ácido clorídrico concentrado e por último foram adicionados 275 mL de água destilada. Tendo o devido cuidado de a cada adição de um novo reagente, a solução ser agitada vigorosamente com um bastão de vidro. A matriz híbrida sintetizada recebeu a codificação S5. Figura 11.
Figura 11 – Etapas da síntese da matriz S5.
3.3 PREPARAÇÃO DA SÍLICA PARA TESTE DE REATIVIDADE COM OS METAIS
A sílica organofuncionalizada para ficar isenta de umidade foi submetida a uma temperatura de 60ºC por 3 horas em uma estufa com ventilação forçada, depois de atingir a temperatura ambiente no dessecador, foi acondicionada em frasco de polietileno e mantida em dessecador.
3.3.1 Preparação das soluções de estudo
3.3.2 Reatividade da sílica frente aos metais
Para o teste de adsorção de íons metálicos, com 50 mg da sílica organofuncionalizada, foram suspensos sequencialmente em forma de soluções de dos sais de nitrato de Cd2+, Pb2+, Ni2+ e Zn2+ individualmente, nas concentrações de 10, 20, 40, 60 e 80 mg L-1.
Uma vez suspensas nas respectivas soluções, as amostras foram agitadas durante 30, 60, 90 e 120 min. Findo o período de agitação, as amostras eram filtradas a fim de obter-se uma alíquota isenta de material particulado, a qual seria então analisada. Sempre que necessário, as soluções foram diluídas a fim de obterem-se concentrações finais dentro dos limites das curvas analíticas. Na Figura 12 apresenta-se esquema para obtenção das soluções para as análises por EAA.
Figura 12 – Solução de íons metálicos.
3.4 CARACTERIZAÇÕES DAS MATRIZES ORGANOFUNCIONALIZADAS
3.4.1 Análise elementar de CHN
3.4.2 Termogravimetria
Essas análises foram realizadas no equipamento do tipo DTG-60H da Shimadzu, que consiste de um analisador térmico diferencial acoplado a uma termobalança. Para realização das análises foram utilizados cadinhos de platina, massa de amostra de aproximadamente 4,0 mg, razão de aquecimento de 10 °C/mim em atmosfera de nitrogênio com vazão de 50mL/mim. As amostras foram aquecidas da temperatura ambiente 25ºC até 1000°C.
3.4.3 Espectroscopia de absorção na região do infravermelho
Os espectros de absorção de todas as matrizes na região do infravermelho foram obtidos na faixa espectral de 4000 a 400 cm-1 em um espectrofotômetro Thermo Nicolet/Nexus 470 FT-IR, com resolução de 4,0 cm-1, com 32 varreduras. Foi empregada para análise, a metodologia das pastilhas de brometo de potássio, na qual cada matriz foi pulverizada com brometo de potássio em um almofariz de ágata e prensadas, resultando em pastilhas que foram inseridas no aparelho para a obtenção de espectros.
3.4.4 Espectroscopia de absorção atômica – EAA
As medidas das concentrações de íons metálicos foram obtidas por espectroscopia de absorção atômica utilizando–se um espectrofotômetro da Varian, modelo SpectrAA – 240 PLUS. As condições de análise foram seguidas conforme o manual (FLAME ATOMIC ABSORPTION SPECTROMETRY, 1989) de instruções do fabricante, especificadas para cada íon como descrita na Tabela 3.
As amostras consistiram dos filtrados obtidos por filtração após decorridos os tempos de contato da solução, nas concentrações de 10, 20, 40, 60 e 80 mg L-1, dos íons em estudo
3.4.4.1 Construção das curvas analíticas
As curvas analíticas foram obtidas para cada espécie utilizando-se os valores das concentrações e leituras de absorbância de soluções padrão nas faixas de concentração utilizadas nesse estudo. Para isto foram obtidas as absorbâncias que foram utilizadas para construir as curvas analíticas contra as concentrações e então, após regressão obtidas as equações das curvas analíticas. Estas equações foram utilizadas para os cálculos das respectivas concentrações dos íons nos filtrados.
3.4.5 Resumo das atividades desenvolvidas
A Figura 13 apresenta umesquema que resume todas as atividades desenvolvidas no presente trabalho.
Figura 13 – Resumo das atividades desenvolvidas SÍNTESE
S1 S2 S3 S4 S5
CARACTERIZAÇÃO
CHN TG FT-IR
ENSAIO DE ADSORÇÃO
ÍONS METÁLICOS
Cd2+ Pb2+
Ni2+ Zn2+
CONCENTRAÇÃO (mgL-1)
10 20 40 60 80
TEMPO DE CONTATO (min)
30 60 90 120
CAPÍTULO 4
4 RESULTADOS E DISCUSSÃO
Neste capítulo serão apresentados, os resultados das caracterizações por análise elementar, espectroscopia de absorção na região do infravermelho, por análise termogravimétrica e por último os resultados de espectroscopia de absorção atômica de chama, utilizados para os estudos de adsorção.
4.1 CARACTERIZAÇÕES DAS MATRIZES ORGANOFUNCIONALIZADAS
4.1.1 Análise elementar CHN
Com a Análise Elementar de CHN determinou-se o grau de funcionalização da matriz, através da porcentagem de C(carbono), H(hidrogênio) e N(nitrogênio) presente na matriz organofuncionalizada de sílica gel. Através desta análise também é possível sugerir a fórmula estrutural para as matrizes sintetizadas, conforme é apresentado na Tabela 3 abaixo.
Tabela 3 – Resultado da análise de C, H, N nas matrizes sintetizadas:
4.1.2 Termogravimetria
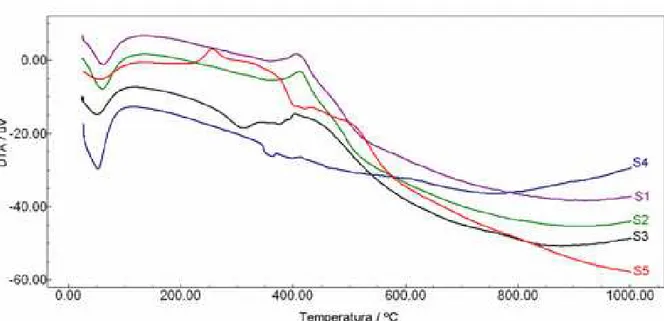
objetivo de estudas as diversas etapas de termodecomposição e também a sua estabilidade térmica.
Através da termogravimetria, Tabela 4, foi possível obter dados referentes à estabilidade térmica das matrizes sintetizadas, da temperatura de degradação dos grupos ligados às estruturas e, também, da quantidade de moléculas imobilizadas, observando assim o grau de saturação do grupo coordenante (FARIAS, 2001).
De acordo com o grau de saturação fornecido pela termogravimetria é de se esperar que as matrizes que apresentam maior quantidade de matéria orgânica possam adsorver maior quantidade de mmol de íon metálico da solução por grama de matriz. A ordem obtida para o maior número de grau de saturação foi S2>S1>S3>S5>S4.
Figura 14 – Curvas termogravimétricas para as matrizes.
Figura 15 – Primeira derivada das curvas termogravimétricas para as matrizes
Na Tabela 5 são apresentados os resultados obtidos a partir das curvas de análise térmica, termogravimetria e análise térmica diferencial.
Observa-se que a matriz S3 cujo grupo funcional o N-[3-(trimetoxisilil)propil]etilenotriamina que possui maior massa foi o que apresentou maior porcentagem de perda de massa.
4.1.3 Espectroscopia de absorção na região do infravermelho
A caracterização por espectroscopia na região do infravermelho é utilizada para identificar as vibrações características dos ligantes, detectando o sucesso da imobilização das moléculas orgânicas na superfície da sílica e confirmar se a estrutura da molécula orgânica é mantida sob as condições de síntese. Na figura 17 se apresenta o espectro de absorção na região do infravermelho para as matrizes S1 e S2.
0 25 50 75 100 450 950 1450 1950 2450 2950 3450 3950
Número de ondas (cm-1)
% T ran s m it ân ci a S1 S2
Figura 17 – Espectro na região de infravermelho para a matriz S1 (3-aminopro-piltrietoxissilano) e S2 (3-aminopropiltrietoxissilano + 3-mercaptopropiltrietoxis-silano).
As bandas de absorção na Figura 17, na região entre 2500 e 3600 cm-1 são muito intensas e largas devido as vibrações de estiramento do grupo -OH das moléculas de água e do -OH do grupo silanol (Si-OH). Esta região encontra-se também o dubleto da amina primária (NAKAMOTO, 1986; SILVERSTEIN et al., 2007). As absorções referentes aos grupos funcionais ancorados na matriz, são encontrados na região entre 1215 a 1650 cm-1. Em 1330 cm-1 observa-se absorção referente à deformação axial das interações de C-N na região de 1625 cm-1 encontram-se as bandas de absorção das aminas primárias. Na região de 1625 cm-1 ocorre a deformação angular simétrica no plano de N-H, tesoura. A deformação angular simétrica no plano, tesoura, para o grupo metileno (-CH2) em 1420 cm-1. A deformação axial
de C-N apresenta-se em 1215 cm-1 enquanto que a deformação angular simétrica fora do plano de N-H entre 830 e 1000 cm-1. Para a matriz S2 a presença da banda na região de 2500 cm-1 referente a -SH, foi sobreposta pelo grupo silanol, uma banda fraca à deformação para C-S-H no plano aparece em 898 cm-1 (NAKAMOTO, 1986; SILVERSTEIN et al., 2007).
Figura 18 – Espectros de infravermelho para as matrizes contendo N-[3-(trimetoxis-silil)propil]etilenotriamina, S3, S4 e S5.
Observou-se banda em 3428 cm-1 referente à absorção de aminas primárias, deformação axial assimétrica e simétrica do N-H. As absorções para as aminas secundárias encontram-se na região de absorção de 3013 cm-1. Em 1628 cm-1 encontra-se a deformação angular simétrica no plano para as interações de N-H. No intervalo de absorção de 1200 a 1000 cm-1 apresenta-se um sinal de absorção largo e intenso devido a presença de aminas primárias e secundárias com deformação angular simétrica fora do plano. Na região de 700 a 500 cm-1 ocorre deformação angular das interações de C-C (NAKAMOTO, 1986; SILVERSTEIN et al., 2007).
4.1.4 Testes de adsorção para as matrizes de sílica gel organofuncionalizadas
O teor do íon metálico adsorvido nas matrizes híbridas foi determinado no filtrado obtido após contato da matriz com a solução dos íons metálicos, e foram medidos por espectroscopia de absorção atômica de chama, conforme descrito na parte experimental.
Foi determinada a quantidade de número de mols dos íons metálicos, nf, fixado nas
e 80 mg L-1. Realizaram-se estudos de adsorção, e utilizaram-se soluções com quantidades conhecidas dos íons metálicos individualmente.
O volume da solução utilizado nos testes de adsorção foi 2,0x10-2 L. Para o cálculo dos números adsorvidos foram utilizadas as massas atômicas relativas, em g.mol-1: Cd=112,41; Pb=207,2; Ni=58,69 e para o Zn=65,39.
As amostras dos íons testados encontravam-se na concentração(C) de ppm (mg L-1), fez necessário a conversão para mmol dm-3. Foram realizados as conversões de acordo com a equação: ) ( 1000 ] 1000 )] ( [
[ ÷ = −3
= C ppm Massa Atômica x C mmol dm
Conversão Equação 01
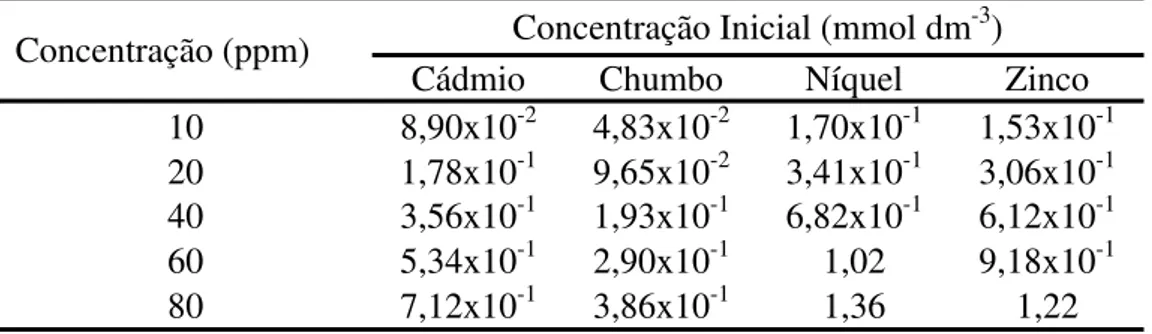
A tabela 6 apresenta o resultado da conversão de ppm para mmol dm-3 dos respectivos íons trabalhados.
Tabela 6: Concentrações iniciais para os ensaios de adsorção de íons metálicos
Concentração (ppm) Concentração Inicial (mmol dm
-3)
Cádmio Chumbo Níquel Zinco 10 8,90x10-2 4,83x10-2 1,70x10-1 1,53x10-1 20 1,78x10-1 9,65x10-2 3,41x10-1 3,06x10-1 40 3,56x10-1 1,93x10-1 6,82x10-1 6,12x10-1 60 5,34x10-1 2,90x10-1 1,02 9,18x10-1
80 7,12x10-1 3,86x10-1 1,36 1,22
Para a determinação da quantidade de íons metálicos adsorvidos utilizou-se a equação 02. 1 3 3 3
)
(
)
(
)]
(
)
(
[
− − − −=
−
=
V
dm
mmol
g
g
m
dm
mmol
C
dm
mmol
C
n
f i f Equação 02Sendo:
nf= número de mols fixados na matriz;
Ci = Concentração inicial dos íons metálicos;
Cf = Concentração dos íons metálicos no filtrado;
M = massa da matriz utilizada no experimento;
4.1.4.1 Ensaio de adsorção do cádmio
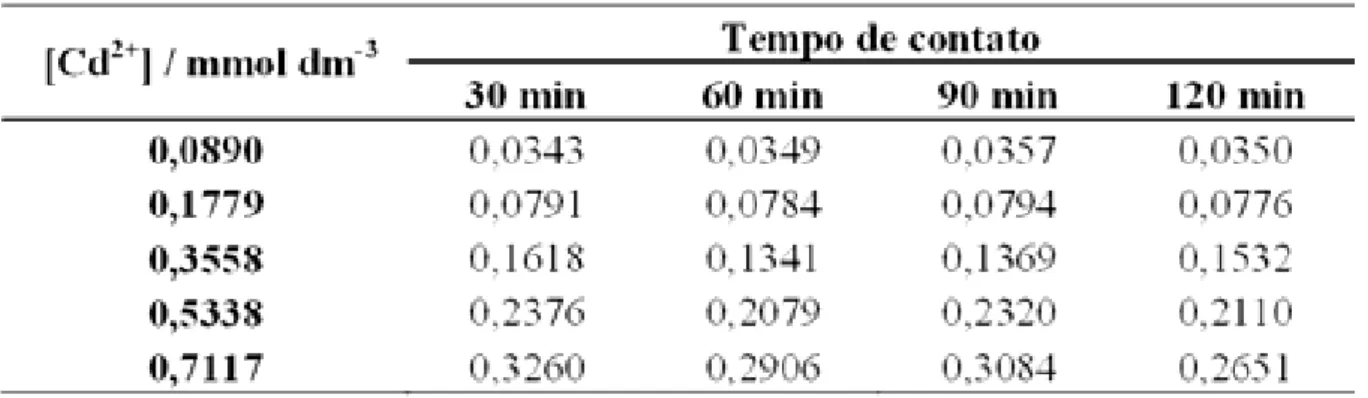
A Tabela 7 apresenta os resultados obtidos para o número de mols fixados na matriz S1 para Cd2+, considerando os respectivos tempos de contato.
Da observação da Tabela 7 e Figura 19 o melhor tempo de contato foi o de 30 min já que para os demais praticamente não houve alteração, quando se considera a concentração de 0,0890 mmol dm-3. Para a concentração de 0,1779 mmol dm-3 obteve-se um maior número de mols fixados para o tempo de 60 min, considerando que a diferença para o tempo de 30 min foi muito pequena, pode-se afirmar que o tempo de 30 min também foi o melhor tempo. Para a concentração de 0,3558 mmol dm-3 o maior número de mols fixados por grama de matriz foi obtido para o tempo de 90 min. Para a concentração de 0,7117 mmol dm-3 o melhor valor obtido foi para o tempo de 90 min. Para a concentração de 0,5338 mmol dm-3 o melhor tempo obtido foi de 120 min. De uma maneira geral para esse íon na matriz S1 o tempo de escolha para uma aplicação dessa matriz como adsorvente para esse já que no tempo de 30 min se observa uma excelente taxa adsorção.
Figura 19 – Número de mols fixados de Cd2+ por grama da matriz S1.
A Tabela 8 apresenta os resultados obtidos para as taxas da adsorção do Cd2+ na matriz S1, considerando os respectivos tempos de contato.
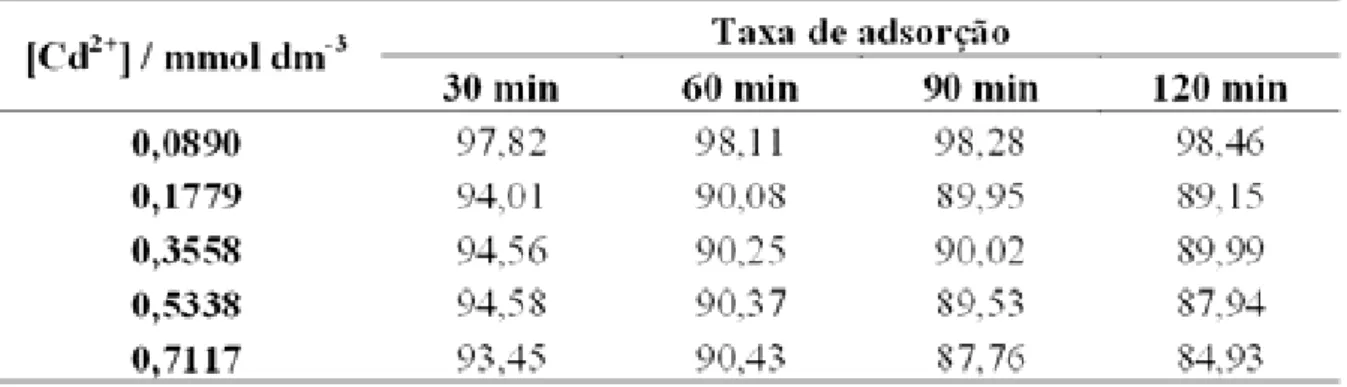
Tabela 8– Percentuais de adsorção do Cd2+ por grama da matriz S1.
A melhor taxa de adsorção (99,91 %) para Cd2+ retido na matriz S1 foi para o tempo de 30 min, partindo de uma concentração inicial de 0,0890 mmol dm-3. Para uma concentração inicial de 0,1779 mmol dm-3 obteve-se uma maior taxa também a 30 min. Para a concentração de 0,3558 mmol dm-3 o melhor resultado foi para o tempo de 90 min, 99,03%. Para a concentração inicial de 0,5338 mmol dm-3, o melhor tempo foi de 90 min, 90,39%. Para a concentração de 0,7117 mmol dm-3, o melhor tempo foi de 90 min, obtendo-se de 90,44%, de taxa de adsorção. Estes resultados estão apresentados na Figura 20.
A Tabela 9 apresenta os resultados obtidos para as taxas da adsorção do Cd2+ na matriz S2, considerando os respectivos tempos de contato.
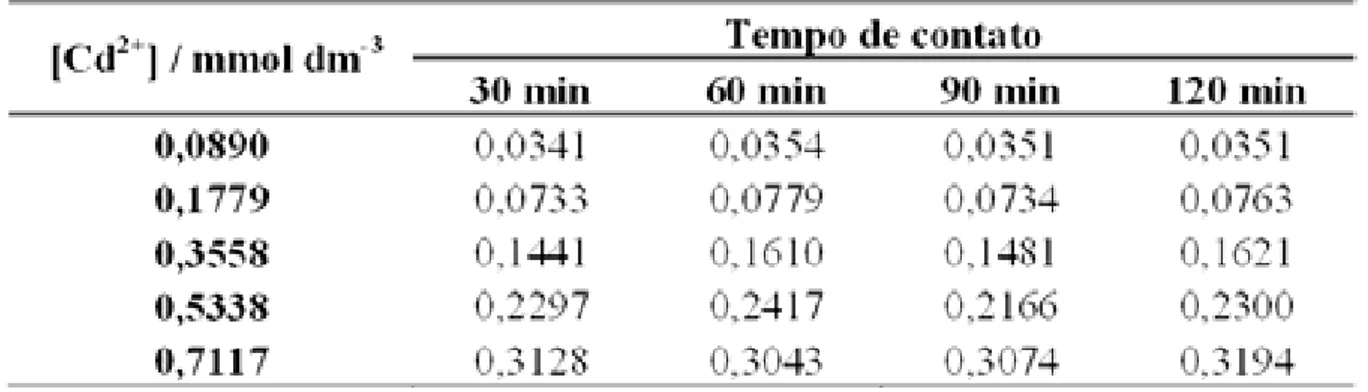
Tabela 9– Número de mols fixados de Cd2+ por grama da matriz S2.
Para os testes de adsorção do Cd2+ com a matriz S2 observa-se que o tempo de 60 min apresentou maior valor de número de mols fixados por grama dessa matriz quando se utilizou uma concentração de 0,0890 mmol dm-3. Já para a concentração de 0,1779 mmol dm-3 o melhor tempo foi o de 30 min. Na concentração de 0,3558 mmol dm-3 o melhor tempo de contato foi o de 60 min. Para a concentração de 0,5338 mmol dm-3 a maior quantidade de íons adsorvidos por grama de matriz foi no tempo de 60 min. Para a concentração 0,7117 mmol dm-3 o melhor tempo de contato foi de 90 min. Figura 21.
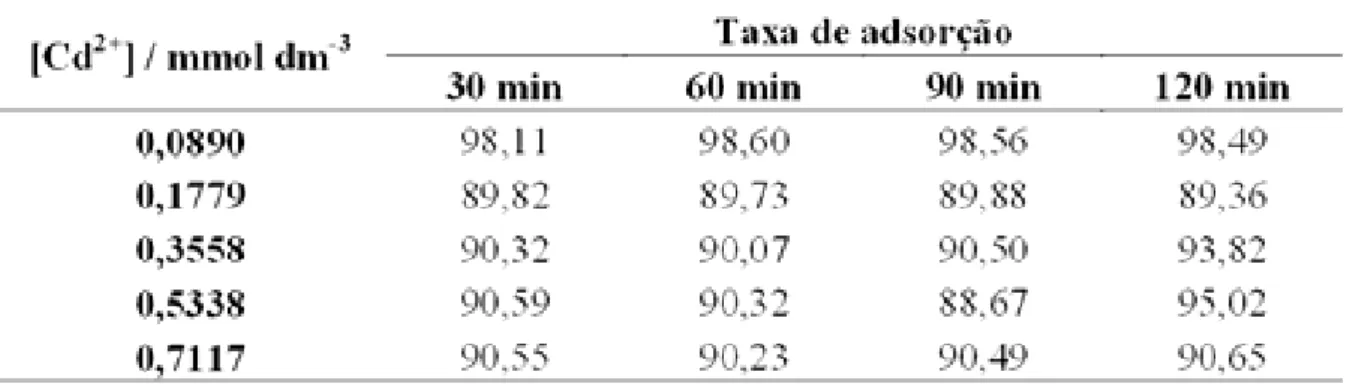
A Tabela 10 apresenta os resultados obtidos para os percentuais de adsorção do Cd2+ na matriz S2,
Tabela 10 – Percentuais de adsorção do Cd2+ por grama da matriz S2.
Para uma concentração inicial de 0,0890 mmol dm-3, praticamente não houve diferença para todos os tempos estudados, dessa maneira pode-se dizer que o melhor tempo foi o de 30 min. Para as concentrações de 0,1779 mmol dm-3, 0,3558 mmol dm-3, 0,5338 mmol dm-3 e 7,1x10-1 mmol dm-3 as variações foram muito pequenas, obtendo-se um valor médio de 90% dos números de mols fixados em relação aos números de mols iniciais. A diferença aconteceu mais em relação essas concentrações e a de 0,0890 mmol dm-3. Na Figura
22 apresenta-se na forma de gráfico esses resultados.
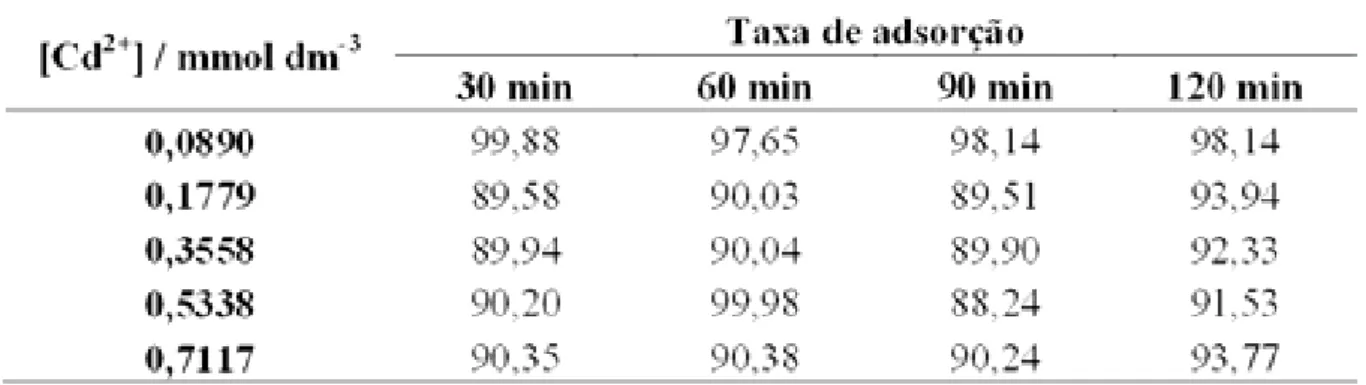
A Tabela 11 apresenta os resultados obtidos para as taxas da adsorção do Cd2+ na matriz S3, considerando os respectivos tempos de contato.
Tabela 11 – Número de mols fixados de Cd2+ por grama da matriz S3.
De acordo com o número de mols do íon cádmio adsorvidos por grama da matriz S3, a concentração de 0,0890 mmol dm-3 e de 0,1779 mmol dm-3 apresentaram melhor tempo de contato em 90 min. E para as concentrações de 0,3558 mmol dm-3, 0,5338 mmol dm-3, 0,7117 mmol dm-3 o tempo de contato mais favorável foi o de 30 min. Na Figura 23 apresenta-se o gráfico obtido para esses resultados, observa-se que para concentrações menores os resultados são muito próximos, já para as concentrações maiores um tempo maior de contato leva a uma diminuição dos valores obtido; o que leva deduzir que começa a haver uma dessorção do material previamente adsorvido.
A Tabela 12 apresenta os resultados obtidos para as taxas da adsorção do Cd2+ na matriz S3, considerando os respectivos tempos de contato.
Tabela 12– Percentuais de adsorção do Cd2+ por grama da matriz S3.
A maior taxa de adsorção foi verificada para a concentração de 0,0890 mmol dm-3 no tempo de contato de 120 min. A menor taxa adsorção obteve-se para a concentração inicial de 0,7117 mmol dm-3 no tempo de 120 min. É interessante observar que somente para a menor
concentração houve um aumento da adsorção aumentando-se o tempo de contato. Para os demais experimentos verificou-se o inverso. A Figura 24 apresenta esses resultados na forma de gráfico.
A Tabela 13 apresenta os resultados obtidos para o número de mols fixados na matriz S4 para Cd2+, considerando os respectivos tempos de contato.
Tabela 13 – Número de mols fixados de Cd2+ por grama da matriz S4.
Para essa matriz praticamente não houve grande mudanças para a variação da taxa de adsorção em relação ao tempo de contato. A Figura 25 apresenta os resultados na forma gráfica.
A Tabela 14 apresenta os resultados obtidos para as taxas da adsorção para Cd2+ na matriz S4, considerando os respectivos tempos de contato.
Tabela 14 – Percentuais de adsorção do Cd2+ por grama da matriz S4.
A taxa de adsorção do Cd2+ na matriz S4 apresentou valores maiores para os menores
valores de concentração, não sendo observado uma grande variação ao longo do tempo, dois experimentos apresentaram valores fora dessa tendência. A Figura 26 apresenta esses resultados na forma de gráfico.
A Tabela 15 apresenta os resultados obtidos para o número de mols fixados na matriz S5 para Cd2+, considerando os respectivos tempos de contato.
Tabela 15 – Número de mols fixados de Cd2+ por grama da matriz S5.
A adsorção do íon cádmio na matriz S5 apresentou uma tendência de aumento no número de mols adsorvidos com o aumento do tempo de contato. Foram observados um experimento fora dessa tendência, que foi para o tempo de 60 min para a concentração de 0,5338 mmol dm-3. A Figura 26 apresenta estes resultados na forma gráfica.
A Tabela 16 apresenta os resultados obtidos para as taxas da adsorção para Cd2+ na matriz S5, considerando os respectivos tempos de contato.
Tabela 16– Porcentagens de adsorção do Cd2+ por grama da matriz S5.
Observa-se que houve um aumento dos percentuais de adsorção com o aumento do tempo de contato, exceção foi para o experimento com concentração mais baixa e no menor tempo. A Figura 52 apresenta esses resultados na forma gráfica.
4.1.4.2 Ensaio de adsorção do chumbo
A Tabela 17 apresenta os resultados obtidos para o número de mols fixados na matriz S1 para o Pb2+, considerando os respectivos tempos de contato.
Tabela 17 – Número de mols fixados de Pb2+ por grama da matriz S1.
Conforme mostrado na Tabela 16 houve um aumento no número de mols de Pb2+ por grama de matriz para a concentração de 0,0483 mmol dm-3, em relação ao tempo de contato de 60 para 90 min. Para as concentrações de 0,0965 e 0,2896 mmol dm-3 a maior taxa de adsorção foi verificada no tempo de 30 min. Para as concentrações de 0,1931 e 0,3861 mmol dm-3 houve uma tendência para aumentar a taxa de adsorção até 90 min caindo quando atingiu os 120 min. A Figura 29 apresenta esses resultados de forma gráfica.
A Tabela 18 apresenta os resultados obtidos para as taxas da adsorção para Pb2+ na matriz S1, considerando os respectivos tempos de contato.
Tabela 18 – Porcentagens de adsorção do Pb2+ por grama da matriz S1.
Na Tabela 18 e na Figura 30 observa-se que as taxas de adsorção do Pb2+ por grama da matriz S1 manteve-se constante para a concentração de 0,0483 mmol dm-3 em todos os tempos estudados. Para as demais concentrações e tempos de adsorção essas taxas diminuíram em cerca de 5% e se mantiveram muito próximas.
A Tabela 19 apresenta os resultados obtidos para o número de mols fixados na matriz S2 para Pb2+, considerando os respectivos tempos de contato.
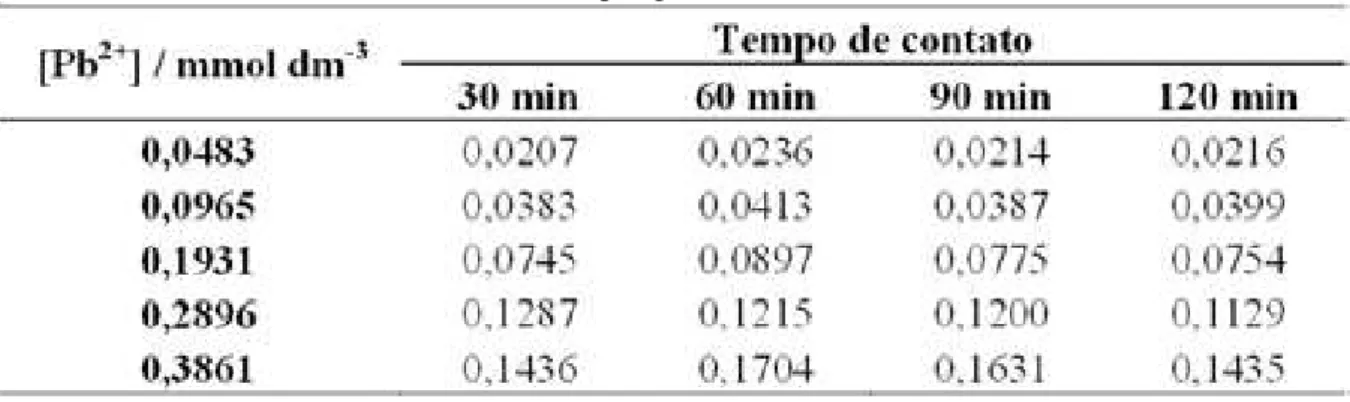
Tabela 19 – Número de mols fixados de Pb2+ por grama da matriz S2.
Os números de mols fixados para Pb2+ por grama da matriz S2 na concentração de 0,0483 mmol dm-3 aumentou de 30 para 60 min e manteve-se constante nos demais tempos. Este comportamento também foi verificado para as demais concentrações e respectivos tempos de contato. A Figura 31apresenta de modo gráfico este comportamento..
A Tabela 20 apresenta os resultados obtidos para as taxas da adsorção do Pb2+ na matriz S2, considerando os respectivos tempos de contato.
Tabela 20 – Taxa de adsorção do Pb2+ por grama da matriz S2.
A Tabela 20 com as taxas de adsorção reafirma este comportamento e a Figura 32 apresenta esses valores de maneira gráfica.
A Tabela 21 apresenta os resultados obtidos para o número de mols fixados na matriz S3 para o Pb2+, considerando os respectivos tempos de contato.
Tabela 21 – Número de mols fixados de Pb2+ por grama da matriz S3.
Na Tabela 21 verifica-se o número de mols Pb2+ fixados por grama da matriz S3, verifica-se um aumento da adsorção até o tempo de 120 min para a concentração mais baixa. Este comportamento não foi verificado nas demais concentrações, onde é aumentado até o tempo de 60 min a partir do qual começa a diminuir, verificando-se uma diminuição de até 15%. Para as demais concentrações houve um aumento até o tempo de 60 min e após este diminuição. A Figura 33 refere-se a estes experimentos.
A Tabela 22 apresenta os resultados obtidos para as taxas da adsorção para Pb2+ na matriz S3, considerando os respectivos tempos de contato.
Tabela 22 – Percentuais de adsorção do Pb2+ por grama da matriz S3.
Na Figura 34 observa-se esse comportamento para esse conjunto de experimentos.
A Tabela 23 apresenta os resultados obtidos para o número de mols fixados na matriz S4 para o Pb2+, considerando os respectivos tempos de contato.
Tabela 23 – Número de mols fixados de Pb2+ por grama da matriz S4.
Na Tabela 23 observa-se um comportamento semelhante do íon Pb2+ com S3. Não se observam muitas variações para as medidas obtidas nessa série de experimentos. A Figura 35 apresenta os respectivos dados na forma gráfica.
A Tabela 24 apresenta os resultados obtidos para as taxas da adsorção para Pb2+ na matriz S4, considerando os respectivos tempos de contato.
Tabela 24 – Percentuais de adsorção do Pb2+ por grama da matriz S4.
As taxas de adsorção do Pb2+ em contato com a matriz S4 foram semelhante para os experimentos concentração mais baixa, diminuindo em cerca de 6% para os experimentos nas demais concentrações. Exceção foi obtida para a medida na concentração maior no tempo de 90 min. A Figura 36 apresenta esse comportamento na forma gráfica.
A Tabela 25 apresenta os resultados obtidos para o número de mols fixados na matriz S5 para o Pb2+, considerando os respectivos tempos de contato.
Tabela 25 – Número de mols fixados de Pb2+ por grama da matriz S5.
Os resultados obtidos para o Pb2+ frente a matriz S5 também não apresentou diferenças mantendo quase constante em todos os tempo trabalhados. A Figura 37 refere-se a esses resultados.
A Tabela 26 apresenta os resultados obtidos para as taxas da adsorção para Pb2+ na matriz S5, considerando os respectivos tempos de contato.
Tabela 26 – Percentuais de adsorção do Pb2+ por grama da matriz S5.
As taxas de adsorção para Pb2+ matriz S5 foram bastante interessantes já que obteve-se o máximo de adsorção para a matriz em contato com a menor concentração desobteve-se íon e o tempo de 30 min, tendo esta diminuído com o aumento dos tempos de 60, 90 e 120 min. Para as demais concentrações os resultados foram bastante semelhantes. Exceção para a concentração de 0,2896 mmol dm-3, que apresentou a menor taxa de adsorção no tempo de 60 min. A Figura 39 apresenta a representação gráfica para esse conjunto de experimentos.
4.1.4.3 Ensaio de adsorção para o níquel
A Tabela 27 apresenta os resultados obtidos para o número de mols fixados na matriz S1 para o Ni2+, considerando os respectivos tempos de contato.
Tabela 27 – Número de mols fixados de Ni2+ por grama da matriz S1.
Os dados para o Ni2+ apresentaram-se sem uma ordem sendo os melhores resultados obtidos para os tempos de 30 e 120 min para as concentrações de 0,3408; 0,6815 e 1,3631 mmol dm-3. A Figura 39 apresenta de forma gráfica estes resultados.
A Tabela 28 apresenta os resultados obtidos para as taxas da adsorção para Ni2+ na matriz S1, considerando os respectivos tempos de contato.
Tabela 28 – Percentuais de adsorção do Ni2+ por grama da matriz S1.
As taxas de adsorção também apresentam uma tendência de serem maiores nos tempo de 30 e 120 min, sendo menor para a maior concentração no tempo de 90 min. A Figura 40 apresenta de forma gráfica desses resultados.
A Tabela 29 apresenta os resultados obtidos para o número de mols fixados na matriz S2 para o Ni2+, considerando os respectivos tempos de contato.
Tabela 29 – Número de mols fixados de Ni2+ por grama da matriz S2.
Os resultados para o Ni2+ frente a matriz S2 também não apresentaram uma ordem. Sendo para a maioria dos experimentos o tempo de 30 min foi o que apresentou melhores resultados. A Figura 41 apresenta os resultados na forma gráfica.
A Tabela 30 apresenta os resultados obtidos para as taxas da adsorção para Ni2+ na matriz S2, considerando os respectivos tempos de contato.
Tabela 30 – Percentuais de adsorção do Ni2+ por grama da matriz S2.
As taxas de adsorção também apresentam-se melhores para o tempo de 30 min. A Figura 42 apresenta os resultados respectivos na forma gráfica.
A Tabela 31 apresenta os resultados obtidos para o número de mols fixados na matriz S3 para o Ni2+, considerando os respectivos tempos de contato.
Tabela 31 – Número de mols fixados de Ni2+ por grama da matriz S3.
Os dados da Tabela 31 apontam que os melhores resultados, em todas as concentrações, foram para os tempos de 30 min. A Figura 43 apresenta esses resultados na forma gráfica.