CENTRO DE AQUICULTURA DA UNESP
SUBSTRATOS ARTIFICIAIS MELHORAM A
QUALIDADE DA ÁGUA EM SISTEMA DE
CULTIVO MULTITRÓFICOS E
MULTIESPACIAIS?
Bruno Cardoso Andrion
UNIVERSIDADE ESTADUAL PAULISTA - UNESP
CENTRO DE AQUICULTURA DA UNESP
SUBSTRATOS ARTIFICIAIS MELHORAM A
QUALIDADE DA ÁGUA EM SISTEMA DE
CULTIVO MULTITRÓFICOS E
MULTIESPACIAIS?
Bruno Cardoso Andrion
Orientador: Dr. Antônio Fernando Monteiro Camargo
Dissertação apresentada ao Programa de
Pós-graduação em Aquicultura do Centro
de Aquicultura da UNESP – CAUNESP,
como parte dos requisitos para a
obtenção do título de Mestre.
Andrion, Bruno Cardoso A573
s sistemas de cultivo multitróficos e multiespaciais ? / Bruno Substratos artificiais melhoram a qualidade da água em Cardoso Andrion. – – Jaboticabal, 2014
x, 67 p. : il. ; 28 cm
Dissertação (mestrado) - Universidade Estadual Paulista, Centro de Aquicultura, 2014
Orientador: Antônio Fernando Monteiro Camargo
Banca examinadora: Marcello Villar Boock, Patricia Maria Contente Moraes-Valenti
Bibliografia
1. Perifíton. 2. Qualidade da água. 3. Policultivo. I. Título. II. Jaboticabal-Centro de Aquicultura.
CDU 628.161.2
LISTA DE FIGURAS
Figura 1: Varais de substratos artificiais feito de Manta geotêxtil e Bambu(A), para
fixação de perifíton e disposição no interior dos viveiros(manta B) (bambu C)...14
Figura 2: Substratos e suporte para a análise de Perifíton(A), flutuador (B) e disposição dentro dos cercados no viveiro(C)...16
Figura 3: Representação esquemática dos tanques de cultivo (A) e dos suportes
com suportes para crescimento do perifíton(B)...20
Figura 4: Valores de temperatura distribuídos nos 3 tratamentos ao longo do
cultivo...24
Figura 5: Valores de oxigênio dissolvido distribuídos nos 3 tratamentos ao longo
do cultivo...24
Figura 6: Valores de transparência (barra) e sólidos em suspensão (linhas)
durante o cultivo de tilápias e camarão-da-amazônia nos 3 tratamentos...25
Figura 7: Concentração de clorofila_a durante o cultivo de tilápias e camarão-da-
amazônia, nos 3 tratamentos...25
Figura 8: Concentrações de nitrogênio inorgânico total(A), fósforo dissolvido(B) e
P-ortofósfato (C), da água, durante o cultivo nos 3 tratamentos...26
Figura 9: Médias e desvios padrão da concentração de fósforo total da água,
para cada tratamento durante o tempo de cultivo...28
Figura 10: Médias e desvios padrão da concentração de nitrogênio kjedahl total
Figura 11: Dendograma dos tratamentos no tempo com base nos valores nominais de todas as variáveis físicas e químicas avaliadas Obs: números representam os dias de cultivo e as letras (B)bambu, (M) manta e (C) controle, representam os tratamentos...29
Figura 12: Médias e desvio padrão da massa seca (barras) e clorofila_a (linhas)
no tratamento bambu (B) e no tratamento manta (M), presentes no perifíton...30
Figura 13: Médias e desvios padrão (barras) dos teores de PT no perifíton, para
os diferentes tratamentos, durante o tempo de cultivo...32
Figura 14: Médias e desvios padrão (barras) dos teores de NKT no perifíton, para
cada tratamento, durante o tempo de cultivo...32
Figura 15: Dendograma dos tratamentos no tempo com base nos valores
LISTA DE TABELAS
Tabela 1: Temperatura atmosférica, umidade relativa, pluviosidade, radiação
solar e insolação, obtidos da estação agroclimatológicas da UNESP...12
Tabela 2: Produtividade das tilapias e camarões-da-amazônia nos diferentes
tratamentos...18
Tabela 3: Análise de variância (ANOVA-com medidas repetidas) para quantidade
de NKT (Nitrogênio Kjeldahl total) (mg/L-1), PT (Fósforo total) (mg/L-1), encontradas na água dos tanques de cultivo, durante o experimento...27
Tabela 4: Correlação das variáveis com os dois primeiros eixos da Análise dos
Componentes Principais (PCA)...29
Tabela 5: Média e desvio padrão dos valores de massa seca (MS) e
clorofila_a...30
Tabela 6: Análise de variância (ANOVA-com medidas repetidas) para quantidade
de NKT (Nitrogênio Kjeldahl total) (mg.m-2), PT (Fósforo total) (mg.m-2), encontradas no perifíton durante o experimento...31
Sumário
DEDICATÓRIA ... ix
AGRADECIMENTOS ... 1
APOIO FINANCEIRO ... 2
RESUMO ... 3
ABSTRACT ... 4
INTRODUÇÃO ... 5
1. Objetivo geral ... 11
2. Objetivos específicos ... 11
MATERIAL E MÉTODOS ... 12
1. Delineamento experimental ... 12
2. Confecção dos substratos... 13
3. Povoamento dos viveiros ... 16
4. Alimentação ... 17
5. Variáveis limnológicas dos viveiros ... 19
6. Análise do perifiton ... 20
ANÁLISE ESTATÍSTICA ... 22
RESULTADOS ... 23
1. Variáveis limnológicas dos cultivos ... 23
2. Efeitos dos substratos no crescimento do perifiton ... 30
DISCUSSÃO ... 34
CONCLUSÃO ... 39
REFERÊNCIAS ... 40
ANEXO 1 ... 52
ANEXO 2 ... 55
DEDICATÓRIA
AGRADECIMENTOS
Agradeço, primeiramente, ao meu orientador Prof. Dr. Antônio Fernando Monteiro Camargo, pela paciência, dedicação, incentivo e orientação.
Ao Programa de Pós-graduação em Aquicultura do CAUNESP e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico-CNPq, pelo apoio durante os meus estudos.
À banca examinadora do exame de qualificação: Prof. Dr. Matheus Nicolino Peixoto Henares e Prof. Dr. Irineu Bianchini Jr., pelas contribuições e orientações para tornar este trabalho melhor.
À banca do exame de defesa: Profa. Patricia Maria Contente Moraes-Valenti e Prof. Dr. Marcello Villar Boock, que aceitaram o convite e contribuíram para a melhoria e finalização desse trabalho.
A todos os funcionários do CAUNESP, pelo auxílio na montagem e na finalização do experimento e pela convivência harmoniosa e respeito.
Aos amigos do setor de Carcinicultura, que contribuíram desde o inicio do processo até as redações finais da confecção deste estudo, em especial ao Rafael, Caio, Baltazar, Michelle e Roberto Pollachini.
Aos meus amigos de longa data, que me acompanharam e me proporcionaram muitos momentos de alegria.
Agradeço à minha noiva Patrícia Rossi, pela paciência, auxílio, companheirismo, amor e pelo incentivo dedicado a minha pessoa.
À minha família, pelo apoio incondicional, dedicação, amor e carinho.
APOIO FINANCEIRO
RESUMO
Na aquicultura a utilização de sistemas de cultivo sem renovação de água, o uso de substratos artificiais com a fixação de perifíton e os sistemas integrados podem ser formas alternativas para aperfeiçoar os atuais sistemas de produção, gerando maior lucro e menor impacto ambiental. O objetivo deste trabalho foi analisar a qualidade da água em sistemas de policultivo com a inserção de substratos artificiais, feitos de bambu e manta geotêxtil, na produção de tilápias (Oreochromis niloticus) e camarões-da-amazônia (Macrobrachium. amazonicum), identificou-se também o substrato com maior crescimento de perifíton. O experimento teve duração de seis meses, sendo composto por 12 viveiros retangulares de fundo natural, povoados com 22 camarões. m-2 e 1,1 tilápias. m-2, com alimento ofertado apenas às tilápias. O delineamento experimental foi inteiramente casualizado, com três tratamentos (controle, bambu e manta) e quatro repetições. Foram analisadas as amostras de água e de perifíton raspados dos substratos. Os resultados apontam que não houve diferença significativa na qualidade da água, provavelmente, devido à alta concentração de sólidos em suspensão que reduz a atividade da comunidade perifítica e devido à baixa biomassa de animais produzidos, não influenciando as concentrações de nitrogênio e fósforo na água. O substrato que proporcionou o maior crescimento da comunidade perifítica foi o tratamento manta geotêxtil.
ABSTRACT
In aquaculture the use of farming systems without water renewal, the use of artificial substrates with fixing periphyton and integrated systems may be alternative ways to improve the current production systems, generating higher profits and lower environmental impact. The aim of this study was to analyze the water quality in polyculture systems with insertion of artificial substrates, made of bamboo and geotextile blanket, in a production of nile tilapias (Oreochromis niloticus) and amazon river prawns (Macrobrachium amazonicum), also identified the substrate with higher growth of periphyton . The experiment lasted six months, being composed of 12 rectangular ponds natural background , populated with 22 prawns.m-2 and 1,1 tilapias.m-2, with food offer only the tilapia . The experimental design was completely randomized with three treatments (control, bamboo and blanket) and four replications. Water samples and periphyton scraped from the substrates were analyzed. The results indicate no significant difference in water quality, probably due to the large amount of suspended solids, which prevented the development of periphyton and due to the low biomass of animals produced, not influencing the concentrations of nitrogen and phosphorus in the water The substrate resulted in the highest growth of periphyton was treating geotextile.
INTRODUÇÃO
A aquicultura é uma atividade em contínua expansão que apresentou um crescimento anual de 3,2% entre os anos de 1961 e 2009, superando a produção mundial de alimentos que cresceu aproximadamente 1,7% no mesmo período. Em 2011 a produção aquícola alcançou cerca de 64 milhões de toneladas, que somados à pesca, atingiram um total de 154 milhões de toneladas de animais aquáticos (FAO, 2012). Embora essa atividade seja uma realidade na produção de alimentos e uma importante fonte econômica, ela tem levantado cada vez mais preocupações ambientais devido a sua expansão (Pruder, 1992; Phillips et al., 1993; Briggs e Funge-Smith, 1994; Goldburg e Triplett, 1997; Boyd e Clay, 1998; Lin, 2000; Ballester, 2004; Sampaio e Braga, 2005; Agostinho et. al, 2007). Essa expansão resulta na falta de tratamento adequado dos efluentes e no acúmulo de nutrientes nos sistemas de cultivo e no corpo receptor, provocando também impactos ambientais desde a implantação dos sistemas aquícolas até o final do cultivo de engorda. Dentre os impactos provocados pela aqüicultura pode-se destacar a redução de áreas naturais, para construção de viveiros, o escape de espécies exóticas cultivadas no ambiente natural, a disseminação de patógenos pelos organismos cultivados aos organismos nativos e a descarga de efluentes não tratados, que além de ser uma das principais preocupações, representa uma perda econômica de nutrientes (Fast e Menasveta, 2000; Burford et al., 2001; Valenti, 2002; Jackson et al., 2003).
desses, também podem ocorrer um crescimento indesejado de alguns vegetais aquáticos, aumento da incidência de doenças hidricamente transmissíveis, águas turvas, odores fétidos e mortalidade da biota local (Tundisi, 2003; Esteves e Meirelles-Pereira, 2011). Esses efluentes possuem composição semelhante aos efluentes domésticos embora em menores concentrações. Todavia, algumas variáveis possam ter concentrações acima das permitidas por lei, constituindo riscos potenciais para a saúde pública (Donini et al., 1993; Boyd e Queiroz, 1997; Avnimelech, 1999; Cristodifis, 2002).
A produção de organismos aquáticos, utilizados na alimentação humana deve ser realizada em águas enquadradas nas classes 1 e 2 (águas, salinas e salobras classe 1, doces classe 2) e, após o uso, a água liberada para o ambiente deve apresentar características similares a água que foi captada, conforme determina a resolução CONAMA nº 357(Brasil, 2005).Apesar das altas cargas geradas por esses empreendimentos, eles possuem um ponto de lançamento específico, constituindo-se uma fonte de poluição pontual, o que facilita seus processos de tratamento (Boyd e Schimittou, 1999; Sindilariu et al., 2009).
O lançamento de efluentes de aqüicultura promove a eutrofização dos corpos receptores o que eleva os custos referentes ao tratamento da água para o consumo humano, pois há necessidade da intensificação da tecnologia utilizada nas remoções de nutrientes, organismos patogênicos e matéria orgânica da água (Tundisi, 2005). Outra preocupação relacionada à produção aquícola é a intensificação da atividade, exigindo grandes densidades de estocagem, afetando diretamente a produção e os corpos de água receptores. O manejo inadequado deteriora a qualidade da água, principalmente pela administração de grandes quantidades de ração e pela fertilização orgânica ou inorgânica (Lin e Yang, 2003). A maioria dos nutrientes contidos nesses produtos não é incorporada à biomassa dos animais (Boyd, 2003), ficando retida no sedimento dos viveiros ou sendo eliminada pelo efluente (Casillas-Hernández et al., 2006). Esses nutrientes desperdiçados são constituídos por resíduos metabólicos, alimentos não ingeridos e fezes, sendo esta uma das principais fontes de resíduos orgânicos em sistemas aquaculturais (Talbot e Hole, 1994).
reciclados por ação microbiológica à custa de consumo de oxigênio (Kubitza, 1998), liberando os nutrientes na água. Além disso, a excreção liberada pelos organismos cultivados (amônia, nitrito e gás carbônico), quando em excesso, se tornam toxicas (Kubitza, 2003).
Devido às características impactantes da aquicultura, torna-se necessário o investimento em novos modelos de produção que sejam mais eficientes e que aproveitem melhor os nutrientes incorporados ao sistema, essenciais para uma aquicultura sustentável. Algumas alternativas para estes problemas decorrentes da atividade estão relacionadas às boas práticas de manejo. Entre essas, as que estão ligadas à qualidade da água, manutenção de parâmetros ideais para a produção e otimização do alimento. Quanto às praticas de manejo, as mais importantes são aquelas que reduzem a quantidade de material particulado e nutriente dos efluentes, tais como: a) realizar um arraçoamento mais eficiente com rações de alta qualidade (rações de alta digestibilidade e aceitabilidade) que reduzem os resíduos, b) utilizar sistemas de aeração adequados ao cultivo, c) reduzir o uso da água e se possível reutilizá-la, d) armazenar a água da chuva para o abastecimento dos tanques, e) reutilizar os efluentes no próprio sistema, em irrigações ou tratá-los antes de destinar ao corpo receptor e f) utilizar espécies adaptadas ao local de produção com a finalidade de evitar o uso de medicamentos e insumos que podem se tornar poluentes para as espécies locais (SRAC, 1998).
primeira espécie cultivada pode servir como alimento para outra espécie (Valenti, 2002).
A aplicação desses sistemas, unidos à utilização de substratos(qualquer anteparo, de origem natural ou artificial, inserido ou presente dentro dos viveiros), pode auxiliar à redução de poluentes presentes nos efluentes da aquicultura, pois serve de substrato para a fixação e crescimento do perifíton dentro dos tanques. O perifíton é definido como uma complexa comunidade de microorganismos vivos e/ou mortos (algas, bactérias, fungos, animais, detritos orgânicos e inorgânicos) que estão aderidos a um substrato, orgânico ou inorgânico, vivo ou morto (Wetzel, 2001).
utilizado como alimento por muitas espécies de herbívoros e onívoros aquáticos (Uddin et al., 2008), pois fornece nutrientes essenciais como ácidos graxos poliinsaturados (AGP), esteróis, aminoácidos, vitaminas e pigmentos que são necessários ao bom desenvolvimento desses organismos (Thompson et al., 2002). Além disso, sua matriz orgânica pode representar uma fonte de polissacarídeos, proteínas, ácidos nucléicos e outros polímeros, que o tornam especialmente importante na alimentação da fauna bentônica, como os quironomídeos, (Davey e O’toole, 2000)
Além da fauna bentônica são importantes na alimentação de alguns peixes de importância econômica, como o Phaloceros reticulatos magdalenae
(bocachio), que raspa as superfícies das plantas onde o perifíton cresce, o
Pseudoancistrus sp e o Ancistrus sp, que raspam os substratos rochosos, a tainha (Mugil sp), a tilápia (Oreochrorus sp) e o acará (Geophagus sp), que alimentam-se do biofilme aderido aos substratos artificias (Pérez, 1992).
Em geral, a maior parte dos componentes do perifíton são as algas, que representam a base produtiva dessa comunidade e apresentam seu crescimento e sua composição relacionados às condições hidrológicas e ao estado trófico da água (Moschini-Carlos, 2000). A quantidade de nutrientes, como nitrogênio, fósforo e clorofila-a que estão associados diretamente à biomassa da comunidade de algas e à natureza e qualidade do substrato (composição química, rugosidade, etc) (Moschini-Carlos, 2000). A utilização de substratos com a incorporação do perifíton também promove o desenvolvimento da comunidade microbiana autóctone com ação probiótica sobre os organismos cultivados (Azim et al., 2001a) e a diminuição do risco de doenças através da exclusão competitiva de patógenos (Abreu et al., 1988; Domingos e Vinatea, 2008). A utilização de substratos também promove a geração de novos postos de trabalhos que necessitam de mão-de-obra para a confecção, instalação e manutenção dos mesmos e a concepção de produtos de interesse para o setor (Aquamats) (Domingos e Vinatea, 2002, Otoshi et al., 2006).
fósforo (33% a menos) e aumentou a produção de nitrito e nitrato ao invés de amônio (Thompson, et. al, 2002). Esses estudos comprovaram a eficiência desses substratos na remoção de nutrientes dos efluentes de aquicultura.
Quanto ao policultivo, à adição de substratos feitos de bambu demonstrou um aumento na produtividade de Macrobrachium rosenbergii e de Oreochromis niloticus (Uddin et. al., 2007). Esse mesmo efeito também pôde ser observado em monocultivos de M. rosenbergii (Karplus et al., 2000; Tidwell e D`abramo, 2000). Thompson, et. al, (2002) demonstraram na produção de Farfantepenaeus paulensis, ser uma importante fonte de alimento para camarões, aumentando seu crescimento.
OBJETIVOS
1. Objetivo geral
Verificar se os substratos artificiais melhoram a qualidade da água em sistemas multitróficos e multiespaciais com a inserção de substratos artificiais feitos de bambu e manta geotêxtil na produção de tilápia e camarão-da-amazônia.
2. Objetivos específicos
Determinar o efeito do perifíton sobre as variáveis da água dos viveiros;
MATERIAL E MÉTODOS
1. Delineamento experimental
Para atingir aos objetivos do trabalho foi realizado um experimento de cultivo multitrófico e multiespacial com tilápia e camarão-da-amazônia sem renovação de água.
O delineamento experimental foi inteiramente casualizado (DIC), com três tratamentos e quatro repetições. Os tratamentos utilizados foram: cultivo controle (sem substrato - C); cultivo com o uso de substrato feito de Bambu (Bambusa tuldoides Munro) (B); cultivo com o uso de substrato feito de Manta Geotêxtil (M).
O trabalho foi realizado no Setor de Carcinicultura, localizado no Centro de Aquicultura da Universidade Estadual Paulista Julio de Mesquita Filho (CAUNESP), campus de Jaboticabal/SP (21o 18' S e 48o 18' W). O experimento teve duração de seis meses (dezembro 2011 a maio de 2012), compreendendo o verão e início do outono. Este período do ano possui altas temperaturas e condições que favorecem a produção da tilápia e de camarão da Amazônia.
Os dados meteorológicos foram obtidos junto ao Departamento de Ciências Exatas na Estação Agroclimatológica da UNESP, campus de Jaboticabal (tabela 1).
Tabela 1: Temperatura atmosférica, umidade relativa, pluviosidade, radiação solar e insolação,
obtidos da estação agroclimatológicas da UNESP.
A área experimental foi constituída de 12 viveiros retangulares de fundo natural, com dimensão de 0,01 ha-1 e profundidade média de 1 m. Inicialmente os viveiros foram drenados e secos ao ar, em seguida foram raspados com enxada,
Máxima Mínima Média Máxima Mínima Média
DEZEMBRO 30,24 18,84 23,79 91,41 42,17 71,93 5,96 21,62 8,42
JANEIRO 28,51 18,70 22,39 93,53 50,39 79,79 6,03 18,62 5,59
FEVEREIRO 31,27 19,27 24,72 90,10 39,76 68,99 4,10 20,36 8,31
MARÇO 30,77 18,70 23,98 90,25 40,32 69,72 1,00 19,44 7,92
ABRIL 29,70 17,97 23,06 91,58 43,97 71,78 3,26 15,65 7,01
MAIO 26,14 13,17 19,02 87,61 34,83 66,46 0,00 15,50 9,32
Temperatura (ºC) UR(%) Pluviosidade
(mm)
Radiação Solar Global
(MJ m-2)
MÉDIAS
para retirada de sedimento e material orgânico da produção anterior e finalmente receberam calagem com calcário agrícola (1000 kg.ha-1) para a desinfecção.
Antes do abastecimento foi instalada uma plataforma para facilitar a coleta de dados e a alimentação dos animais. Durante o abastecimento dos viveiros com água proveniente de uma represa localizada a montante do Setor de Carcinicultura, foi realizada uma fertilização química com uréia (4 Kg N ha-1) e superfosfato triplo 8 (kg de P2O5.ha-1), de modo a disponibilizar mais nutrientes para o crescimento de fitoplâncton e perifíton.
2. Confecção dos substratos
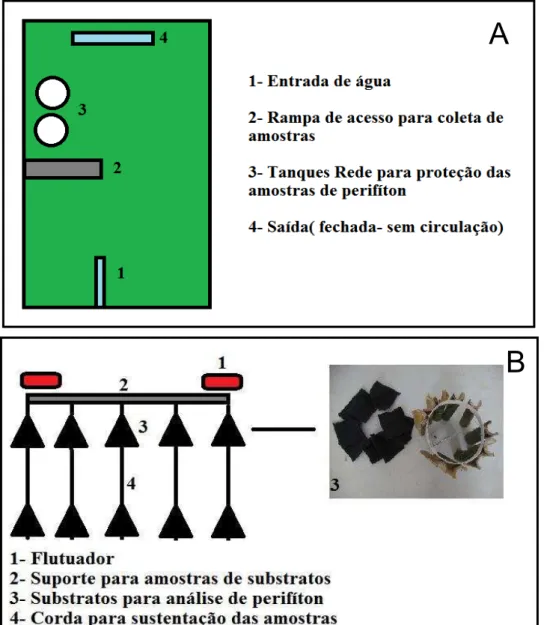
Figura 1: Varais de substratos artificiais feito de Manta geotêxtil e Bambu (A), para fixação de perifíton e disposição no interior dos viveiros (manta B) (bambu C).
A
B
A escolha dos substratos foi baseada na origem do material, custo, facilidade de aquisição, facilidade de manuseio e superfície para o desenvolvimento do perifíton.
A manta geotêxtil é um material industrializado, fabricado com fibras de polipropileno, resistente a raios UV, de fácil aquisição no comércio, muito utilizado na construção civil. Este material possui grande área para fixação do perifíton e custo elevado.
O bambu é uma espécie invasora (Bambusa tulboides Munro) de fácil aquisição, encontrado e retirado diretamente do campo, diminuindo assim o impacto sobre o ambiente, e por fim apresenta grande área para a fixação do perifíton, porém com textura mais lisa que a manta.
Figura 2: Substratos e suporte para a análise de Perifíton (A), flutuador (B) e disposição dentro dos cercados no viveiro(C).
3. Povoamento dos viveiros
Inicialmente o povoamento foi realizado com os camarões, obtidos de uma larvicultura realizada no setor de Carcinicultura. As pós-larvas recém-metamorfoseadas foram mantidas em sistema de berçário 1, na densidade de 10 PLs.L-1, por 15 dias e alimentadas 2 vezes/dia com ração 35 % de Proteína Bruta. O povoamento dos viveiros foi realizado na densidade de 22 PLs. m-2, com peso médio de 0,03g.
B
A
Inicialmente os juvenis de tilápias, obtidos de uma piscicultura, apresentaram peso médio de 6 a 10 gramas, as quais, ficaram em observação no berçário do setor de Carcinicultura, na densidade de 1tilápia.L-1, alimentadas com ração extrusada com 40% Proteína bruta- PB, até o peso médio de 30g. Este manejo é considerado usual em policultivos, pois, a tilápia (8 meses) apresenta ciclo de produção mais longo que o camarão (6 meses), então é necessário sincronizar os ciclos, povoando os viveiros com juvenis de maior peso, para que o peso de abate das tilápias e dos camarões sejam alcançados no mesmo período, para que seja realizado apenas uma despesca.
O povoamento das tilápias(O. niloticus variedade gift), foi realizado após uma semana do povoamento dos camarões, na densidade de 1,1 tilápias.m-2 , revertida para machos,compeso médio de 30g.
Juntamente ao povoamento das tilápias foi introduzido os aeradores de emergência (Aquahobby Bernauer 0,5 hp), os quais foram utilizados após o primeiro mês de cultivo, devido a queda no oxigênio dissolvido. Estes aeradores foram acionados por 3 horas por dia, em períodos de 30 minutos começando às 11 horas da manhã e finalizando a meia noite, obedecendo a um intervalo de 2 horas para cada inicio.
4. Alimentação
O alimento foi ofertado somente às Tilápias, duas vezes ao dia, 11h00min e 17h00min, com dieta comercial extrusada (40% de proteína bruta) na taxa de 5% da biomassa contida nos tanques, até atingirem 100 g. Após atingirem esse peso a ração foi substituída por outra com 28% de proteína bruta. Esta alimentação foi realizada de acordo com biometrias mensais, para a correção do calculo da ração, considerando 1% de mortalidade e 20% de ganho de peso por semana.
perifíton apresentar-se como uma alternativa alimentar. Não foi verificada diferença significativa entre as sobras nos tratamentos Bambu (0,2 Kg + 0,3), Manta (0,4 Kg + 0,5), Controle (3,5 Kg + 2,8).
O único alimento disponível para os camarões foi o natural, presente no fundo dos viveiros, nas fezes das Tilápias, no restante de ração que afundava e nos substratos para aqueles tratamentos com a presença de bambu ou manta geotêxtil.
Não foi observada diferença significativa na produção de Tilápia-do-nilo nos e camarão-da-amazônia nos diferentes tratamentos (Rodrigues, 2013) (tabela 2).
Tabela 2: Produtividade das tilápias e camarões-da-amazônia nos diferentes tratamentos.
Tratamento Produtividade (Kg.ha
-1)
O. niloticus M. amazonicum
Manta 4988 + 404 435 + 15
Bambu 4853 + 461 489 + 29
Controle 4794 + 96 483 + 115
5. Variáveis limnológicas dos viveiros
Para análise da qualidade da água foram monitorados diariamente, entre 8h e 9h, os parâmetros oxigênio dissolvido (mg.L-1), temperatura (ºC), potencial hidrogeniônico (pH), por meio de sonda multiparâmetros Bernauer Proplus20, e nos dias de coleta foi verificada a transparência com o uso do disco de Secchi.
Mensalmente no mesmo horário, foi realizada a coleta de amostras de água (1L) dos viveiros e da água de abastecimento, Aproximadamente 0,3 L de água foram filtrados em membrana de fibra de vidro (Whatman GF 52-C) de 47 ± 0,5 mm de diâmetro e 0,6-0,7 µm de porosidade para a determinação da concentração de material particulado em suspensão (MPS) e clorofila_a. (APHA, 2005), N- amoniacal (N-NH3) segundo método Koroleff (1978), o Nitrito (N-NO2) e o Nitrato (N-NO3), segundo método descrito por Mackereth et. al. (1978), e o P-ortofosfato (P-PO4) e o fósforo dissolvido (PD) por Golterman et al. (1978).
As concentrações de N-Amoniacal, N-Nitrito, N-Nitrato, foram somados e apresentados como Nitrogênio Inorgânico Total (NIT),
6. Análise do perifiton
Dentro de cada viveiro foram colocados 2 tanques redes com 24 suportes em cada tanque, sendo que cada suporte continha 10 amostras de substrato (Figura 3).
Figura 3: Representação esquemática dos tanques de cultivo (A) e dos suportes com suportes
para crescimento do perifíton (B).
Para a análise do perifíton foram retiradas amostras do primeiro e último mês de experimento.
A
7. Análise Estatística
Os dados obtidos foram tabulados, em seguido foi realizado o calculo das médias e os desvios padrão, e submetidos a estatísticas descritivas.
Todos os testes estatísticos foram realizados utilizando-se o programa Statistica 7.1 (STATSOFT, 2005). Os dados de fósforo total e nitrogênio total, referentes à qualidade da água, foram submetidos a ANOVA com medidas repetidas, para tratamento e tempo de cultivo. As diferenças encontradas foram comparadas pelo teste de Tukey ao nível de 5 % de probabilidade. Em seguida todos os dados de limnologia referentes a qualidade da água foram submetidas a uma Análise de Componentes Principais (ACP) (Bouroche e Saporta, 1982), com o objetivo de agrupar e diferenciar os estoques no tempo e em cada tratamento.
RESULTADOS
1. Variáveis limnológicas dos cultivos
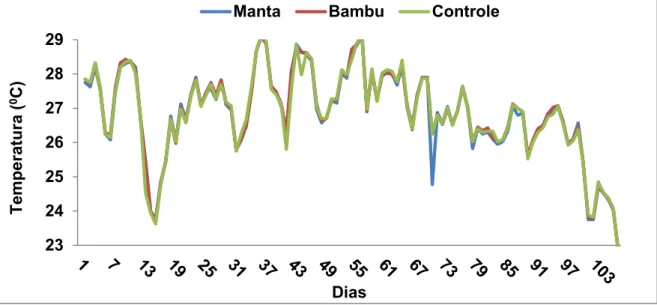
Figura 4: Valores de temperatura distribuídos nos 3 tratamentos ao longo do cultivo.
Figura 5: Valores de oxigênio dissolvido, distribuídos nos 3 tratamentos ao longo do cultivo.
A partir do 26o dia, a concentração de OD chegou a níveis críticos para a produção dos organismos utilizados e foi necessária a utilização de aerador para elevar a concentração. Foi observada outra queda de OD a partir do 69o dia e aumento das concentrações a partir do 100o dia.
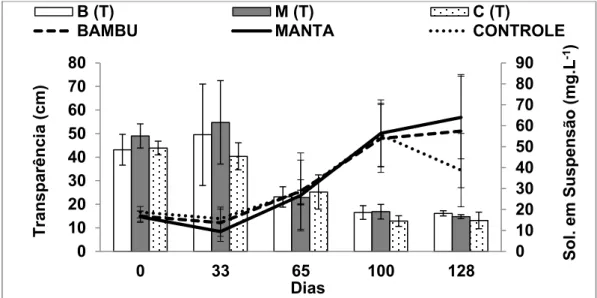
Para as variáveis sólidos totais em suspensão (Sol. T.), clorofila_a (Cloro_a), e transparência (Transp.) pudemos observar uma diminuição de transparência dentro dos tanques está relacionada diretamente ao aumento de sólidos em suspensão e clorofila-a (Figura 6 e 7).
23 24 25 26 27 28 29 Tempe rat ura ( 0C) Dias
Manta Bambu Controle
1 2 3 4 5 6 7 8 9 O xigên io disso lv ido (mg. L -1) Dias
Obs: (T) indica a variável transparência.
Figura 6: Valores de transparência (barra) e sólidos em suspensão (linhas) durante o cultivo de
tilápias e camarão-da-amazônia nos 3 tratamentos.
Figura 7: Concentração de clorofila_a durante o cultivo de tilápias e camarão-da-amazônia, nos 3
tratamentos.
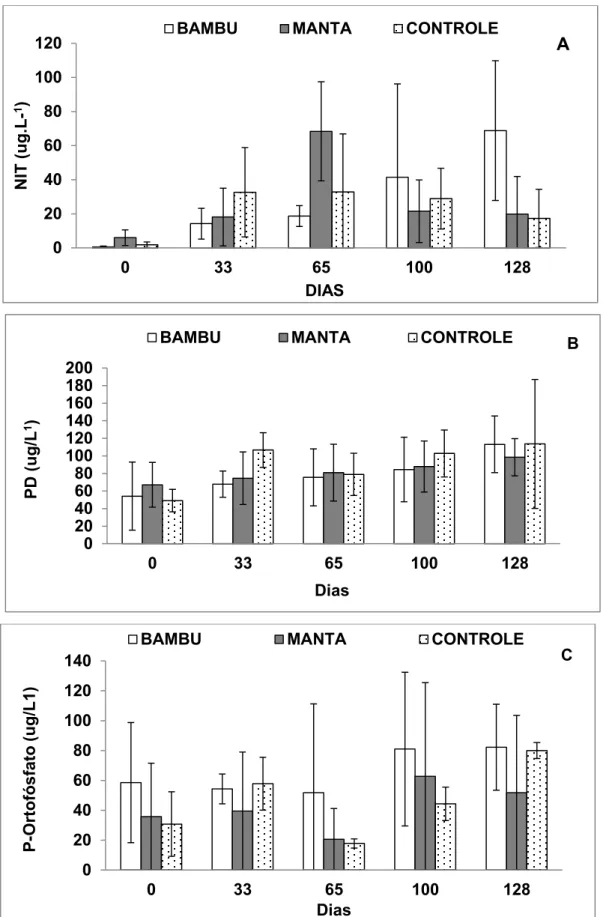
As formas inorgânicas e dissolvidas de nitrogênio e fósforo na água apresentaram-se muito variáveis durante todo o experimento, mas apresentando uma tendência de elevação de NIT ao longo tempo no tratamento bambu (Figura 8). A concentração de ortofosfato apresentou-se bastante variável ao longo do tempo em todos os tratamentos. Por outro lado a concentração de fósforo dissolvido apresentou um aumento constante em todos os tratamentos (figura 8).
0 10 20 30 40 50 60 70 80 90 0 10 20 30 40 50 60 70 80
0 33 65 100 128 Sol.
em Sus pe ns ão (mg. L -1) Trans pa rênc ia (cm) Dias
B (T) M (T) C (T)
BAMBU MANTA CONTROLE
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 33 65 100 128
C lorofi la_ a (mg. L -1) Dias
Figura 8: Concentrações de nitrogênio inorgânico total (A), fósforo dissolvido (B) e P-ortofosfato
(C), da água durante o cultivo nos 3 tratamentos.
0 20 40 60 80 100 120
0 33 65 100 128
N IT (ug .L -1) DIAS
BAMBU MANTA CONTROLE
A 0 20 40 60 80 100 120 140 160 180 200
0 33 65 100 128
PD
(ug
/L
1)
Dias
BAMBU MANTA CONTROLE B
0 20 40 60 80 100 120 140
0 33 65 100 128
P-O rt ofósfat o (ug /L1 ) Dias
BAMBU MANTA CONTROLE
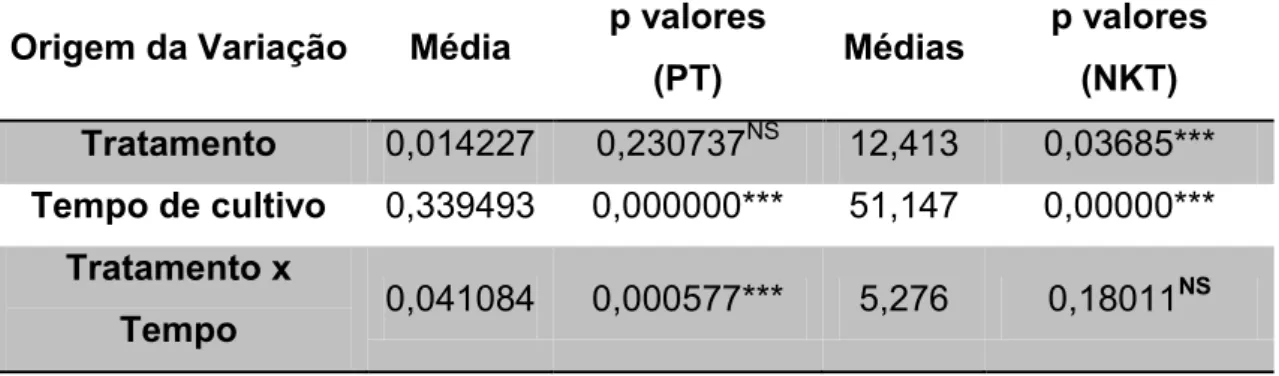
Em relação à concentração de P-total observaram-se diferenças significativas em relação ao tempo e a interação, no entanto, para NKT foi possível observar diferenças significativas entre os tratamentos, o tempo de cultivo e a interação tratamento X tempo de cultivo (Tabela 3).
Tabela 3: Análise de variância (ANOVA-com medidas repetidas) para quantidade de PT (Fósforo
total) (mg.L-1) e NKT (Nitrogênio Kjeldahl total) (mg.L-1) encontradas na água dos tanques de
cultivo, durante o experimento.
Origem da Variação Média p valores
(PT) Médias
p valores (NKT)
Tratamento 0,014227 0,230737NS 12,413 0,03685***
Tempo de cultivo 0,339493 0,000000*** 51,147 0,00000***
Tratamento x
Tempo 0,041084 0,000577*** 5,276 0,18011
NS
Nota: Ns = não significativo; ** = p<0,05; *** = p < 0,001.
Figura 9: Médias e desvios padrão da concentração de fósforo total da água, para cada tratamento durante o tempo de cultivo.
Figura 10: Médias e desvios padrão da concentração de nitrogênio kjedahl total da água, para
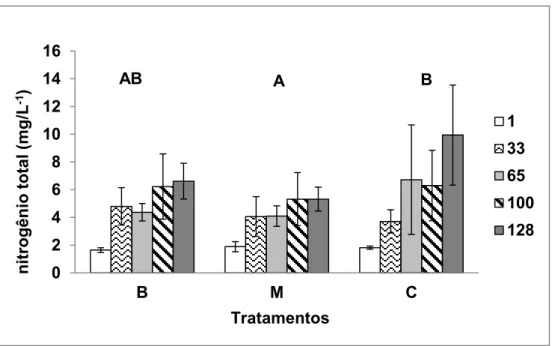
cada tratamento durante o tempo de cultivo. Obs: letras diferentes indicam diferença estatística.
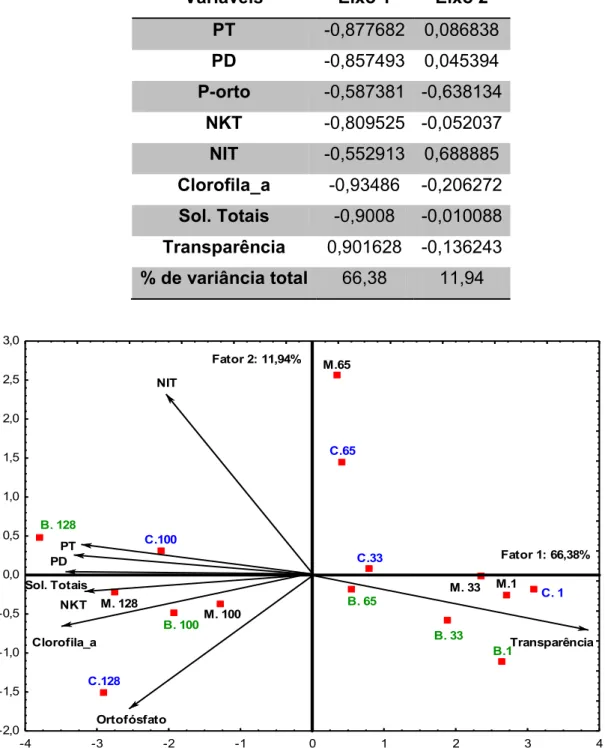
A aplicação da Análise de componentes principais explicou 78,32% da variabilidade dos dados quando considerados os dois primeiros eixos (tabela 4). A transparência apresentou correlação positiva com o eixo 1, enquanto as variáveis PT, PD, NKT, clorofila e sólidos totais estiveram negativamente relacionadas a este eixo. Observa-se uma separação bastante nítida entre o tempo de cultivo e
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1
B M C
fós foro total (ug .L -1) Tratamento 1 33 65 100 128 0 2 4 6 8 10 12 14 16
B M C
nit rogê nio total (mg/ L -1) Tratamentos 1 33 65 100 128
um aumento da concentração de nutrientes e sólidos em suspensão com consequentemente diminuição da transparência dos tanques (Figura 11).
Tabela 4: Correlação das variáveis com os dois primeiros eixos da Análise dos Componentes
Principais (PCA).
Variáveis Eixo 1 Eixo 2
PT -0,877682 0,086838
PD -0,857493 0,045394
P-orto -0,587381 -0,638134
NKT -0,809525 -0,052037
NIT -0,552913 0,688885
Clorofila_a -0,93486 -0,206272
Sol. Totais -0,9008 -0,010088
Transparência 0,901628 -0,136243
% de variância total 66,38 11,94
Figura 11: Dendograma dos tratamentos no tempo com base nos valores nominais de todas as
variáveis físicas e químicas avaliadas. Obs: números representam os dias de cultivo e as letras (B)bambu, (M) manta e (C) controle, representam os tratamentos.
B.1 M.1 C.33 M.65 C.65 C.100 C.128
-4 -3 -2 -1 0 1 2 3 4
-2,0 -1,5 -1,0 -0,5 0,0 0,5 1,0 1,5 2,0 2,5 3,0 B. 128
B. 65 C. 1
Fator 1: 66,38%
M. 33 Fator 2: 11,94%
B. 33 Transparência NIT
Ortofósfato Clorofila_a
B. 100M. 100 M. 128
PT PD
2. Efeitos dos substratos no crescimento do perifiton
Para a análise do crescimento do perifíton verificamos inicialmente o crescimento através da massa seca (M.S g.m-2) e da clorofila_a, (cloro_a mg.m-2) (tabela 5).
Tabela 5: Média e desvio padrão dos valores de massa seca (MS) e clorofila_a presentes no
perifíton.
A massa seca apresenta sua maior diferenciação entre tratamentos no 1o, 23o e após 121 dias de cultivo, nota-se também que as concentrações de clorofila_a são maiores no tratamento manta após o 72o dia.
Figura 12: Médias e desvio padrão da massa seca (barras) e clorofila_a (linhas) no tratamento
bambu (B) e no tratamento manta(M), presentes no perifíton.
0 10 20 30 40 50 60 0 5000 10000 15000 20000 25000 30000 35000 40000 45000
1 23 72 93 121 127
C lorofi la_ a (mg. m -2) M as sa S ec a (mg/ m -2) Dias
M- Massa seca B- Massa seca
M-clorofila B clorofila_a
Tratamentos MS (g.m-2) Clorofila_a (mg. m-2)
Dias Manta Média Bambu Manta Média Bambu
1 3,136 + 0,60 6,621 + 1,80 2,650 + 0,62 2,101 + 0,42
23 19,965 + 5,94 9,410 + 4,19 11,947 + 1,51 9,130 + 4,11
72 25,397 + 14,03 21,072 + 11,55 33,315 + 19,95 10,328 + 9,64
93 11,509 + 2,47 7,081 + 2,80 5,680 + 0,50 1,739 + 0,61
121 27,823 + 10,80 1,043 + 0,46 23,815 + 13,60 7,316 + 5,34
Para as variáveis PT e NKT foram observadas diferenças significativas entre os tratamentos, tempo de cultivo e a interação tratamento X tempo de cultivo (Tabela 6).
Os teores de PT não apresentaram diferença significativa entre os tratamentos, porém apresentaram diferença no tempo, demonstrando que para o tratamento manta, o 1o dia (manta= 150,839 mg.m-2) se diferenciou de todos os outros dentro do tratamento (dia 23o = 351,392; 72o =240,109; 93o = 291,727; 121o = 273,481; 127o = 481,479 mg.m-2), já para o tratamento bambu o 93o dia (160,737 mg.m-2) se diferenciou dos demais (1 o = 446,556; 72o = 440,497; 121o = 463,975 ; 127o = 479,339 mg.m-2) menos do 23o (230,949 mg.m-2)dia.
Para a variável NKT houve diferença significativa entre os tratamentos, no qual o tratamento manta (média= 665,44 mg.m-2) possui as maiores concentrações de nitrogênio total do que o tratamento bambu (média=413,00 mg.m-2). Neste mesmo tratamento é possível observar que os dias 0 (manta=191,625 mg.m-2) e 93o (manta=352,625 mg.m-2) apresentam-se diferentes dos demais (23o =868,875; 72o =994,975; 121 o =743,750; 127 o =840,875 mg.m -2), o que não ocorreu no substrato bambu (0=285,600; 23o =526,400; 72o
=530,600; 93o =182,000 121o =547,400; 127o =406,000 mg.m-2) (Figuras 13 e 14).
Tabela 6: Análise de variância (ANOVA-com medidas repetidas) para quantidade de PT (Fósforo
total) (mg.m-2), NKT (Nitrogênio Kjeldahl total) (mg.m-2) encontradas no perifíton durante o
experimento.
Origem da
Variação Média
p valores
(PT) Médias
p valores (NKT)
Tratamento 62504 0,09904NS 764696 0,00000***
Dias 59801 0,03365*** 412414 0,00000***
Tratamento x Dias 65724 0,02252*** 86442 0,00940***
Figura 13: Médias e desvios padrão (barras) dos teores de PT no perifíton, para os diferentes tratamentos, durante o tempo de cultivo.
Obs: letras diferentes indicam diferença significativa.
Figura 14: Médias e desvios padrão (barras) dos teores de NKT no perifíton, para cada
tratamento, durante o tempo de cultivo.
A Análise de Componentes Principais aplicada aos resultados do perifíton verificamos que os dois primeiros componentes explicaram 92,51% da variabilidade dos dados. Para o eixo 1 observa-se uma correlação negativa com as variáveis NKT, MS e clorofila. O P-total apresentou correlação negativa com o eixo 2 (Tabela 7).
0 100 200 300 400 500 600 700 800 M B Fó sforo T otal (mg/ m2) Tratamento 0 23 72 93 121 127 0 200 400 600 800 1000 1200 M B N itrog ên io T ot al (mg /m -2) Tratamento 0 23 72 93 121 127
Tabela 7: Correlação das variáveis do perifíton com os dois primeiros eixos da Análise dos Componentes Principais (PCA).
Variáveis Eixo 1 Eixo 2
NKT -0,948604 -0,128366
PT -0,149134 -0,986041
MS -0,924801 0,059768
Clorofila-a -0,937678 0,227740
% de variância total 66,41 26,10
Através da PCA é possível notar uma diferenciação quanto a todas as variáveis estudadas para o perifíton, diferenciando os tratamentos manta com maiores valores destas variáveis do que o tratamento bambu encontrado mais a direita do dendograma da PCA (Figura 15).
M.1 B.1 M.23 B.23 M.72 B.72 M.93 B.93 M.121 B.121 M.127
-4 -3 -2 -1 0 1 2 3
-1,5 -1,0 -0,5 0,0 0,5 1,0 1,5 2,0
Fator 1: 66,41% Fator 2: 26,10%
PT NKT
M.S. Clorofila_a
B.127
Figura 15: Dendograma dos tratamentos no tempo com base nos valores nominais de todas as
variáveis físicas e químicas do perifíton avaliadas.Obs: números representam os dias de cultivo e
DISCUSSÃO
O uso de substratos para fixação de perifíton em sistemas de cultivo traz benefícios à qualidade da água e melhoria na produtividade dos sistemas aquícolas (Ramesh et al., 1999; Azim et al., 2001a; Thompson et al., 2002; Azim et al, 2003; Azim et al., 2004; Tidwell et al., 2000; Tidwell e Bratvold, 2005), principalmente, devido a incorporação e ciclagem de nutrientes para o crescimento da comunidade perifítica e a utilização desta como fonte de alimento por diversos organismos (Azim et al., 2001b; Tidwell et al., 1999 e 2001; Thompson et al., 2002). Todavia, no presente, estudo não houve resultado significativo em relação às variáveis: transparência, sólidos em suspensão, clorofila_a, nitrogênio inorgânico total, fósforo dissolvido, ortofosfato e fósforo total. Provavelmente esse resultado ocorreu pelo não desenvolvimento ou redução do crescimento da comunidade perifítica, devido aos processos de sedimentação e ressuspensão do material particulado dentro dos tanques, que se depositam sobre as algas da comunidade ou sobre os substratos. O material particulado pode impedir as trocas de substâncias com a água, promovendo a diminuição da biomassa fotossintética e a diminuição da riqueza e densidade de organismos (Oliveira e Rodrigues, 2002; Rodrigues et al., 2005). Durante a realização do estudo, foi possível observar grande quantidade de material particulado em suspensão aderido aos substratos, principalmente siltes e argila. A quantidade de material em suspensão pode ter sido provocada principalmente pelos aeradores e pelos movimentos de bioturbação, dos camarões (Kimpara et al, 2010) e Tilápias cultivados juntamente a dieta ofertada (Ritvo et al., 1997; Lowe-McConnell, 2000) .
ocorreu neste experimento, provavelmente devido a ação da tilápia e o uso de grandes quantidades de ração.
A colonização e desenvolvimento da comunidade perifítica nos substratos é facilmente alterada pela qualidade da água e pela hidrodinâmica dos ecossistemas nos quais se insere e necessitam da combinação de variáveis bióticas e abióticas, como: predação, competição, temperatura, luminosidade, nutrientes, entre outros (Peterson, 1996; Moschini-Carlos et al., 2000).
Para a variável clorofila_a, presente na água, a uniformidade encontrada entre os tratamentos, pode estar relacionada à dificuldade de crescimento do perifíton, que contribui para o desenvolvimento do fitoplâncton, já que não há competição na utilização de nutrientes presentes na água (Azim et. al, 2001a).
Em um estudo semelhante, utilizando substrato em mono e policultivos, não foi verificada diferença entre os cultivos e entre a utilização ou não do substrato (Udim, 2007), este estudo assim como o apresentado por Milstein (2009) (266 ug.L-1), na produção de tilápia, apresentou valores semelhantes aos encontrados no presente estudo. Já nos policultivos de carpas com o uso de substratos (Controle=56 + 11; Palha de arroz=48 + 20; Kanchi= 61 + 23 ug.L-1), os valores apresentaram-se muito menores que o presente estudo (Rai, et al., 2008)
Em relação ao nitrogênio total da água observamos que o tratamento manta possui menores valores do que os outros tratamentos (16% menor que o controle). Os menores valores de N-total na água tem relação inversa com o teor de N-total na manta que também apresenta maior valor de clorofila_a e massa seca que o substrato bambu. Provavelmente, os maiores valores de N-total e clorofila a na manta estão relacionados à maior área de fixação deste substrato (Rai et al., 2008), pois apresenta regiões porosas e de fácil fixação do perifíton. No experimento de Azim (2001a) foram encontradas menores quantidades de nitrogênio no fitoplâncton, nos tratamentos bambu e kanchi (Brotos de bambu dispostos lado a lado, na forma vertical), do que no tratamento controle, indicando o efeito negativo na qualidade nutricional do fitoplâncton causada pela retirada deste nutriente da água, pelo perifíton ou pela adsorção do material aos substratos.
e Fernandes, 2011). Em experimento semelhante, utilizando substratos e aeradores, os valores foram muito superiores (9547, 7 + 2069, 5) aos encontrados no presente estudo (Henares et al., 2013). Em policultivos de carpa com a presença de substratos feitos de bambu e palha de arroz, não houve diferença entre as quantidades de NT e PT em relação ao controle, e os valores de fósforo total (mg.L-1) (Controle=2,30 + 0,78; Palha de arroz=1,03 + 0,21; Kanchi= 1,53 + 0,91) e nitrogênio total (mg.L-1) (Controle=1,43 + 0,45; Palha de arroz=1,53 + 0,59; Kanchi=1,60 + 0,17), apresentara-se superiores e inferiores, respectivamente, aos encontrados no presente estudo.
Os nutrientes PT e NT são considerados importantes na produção aquícola, pois, promovem a eutrofização (Esteves, 1998) e limitam a produção do perifíton e do fitoplâncton nos ecossistemas aquáticos com pequenas concentrações (Brezonik, Pollman, 1999; Francoeur, 2001).
Os valores de PT presente na água, em nosso estudo, são semelhantes ao encontrados por Henares et al. (2013), que possuem sistema semelhante de produção. Porém em sistemas naturais, comparando um ambiente não degradado (média= 13, 2 + 4 ug.L-1) com um ambiente influenciado por efluente domestico (média= 26,4 + 11,6 ug.L-1), os valores apresentam-se muito acima dos encontrados no presente estudo (Martins e Fernandes, 2011). Talvez isso signifique uma insuficiência deste nutriente no fitoplâncton, pois, este provavelmente fica retido nos substratos ou não disponível em sua forma iônica, devido a baixas concentrações de oxigênio e pH (Doods, 2003).
Os principais processos envolvidos na remoção de nitrogênio e fósforo da água em sistemas de aquicultura são os processos de sedimentação, adsorção de material particulado, ação microbiólogica e transformações químicas (nitrato-nitrito) (Lin et al, 2002; USEPA, 2000).
apresentados por Henares et al. (2013) (Tratamento com substrato e aeração = 9547.7 + 2069.5 e tratamento com substrato e sem aeração= 5179.7 + 1356.1).
Os valores médios da temperatura da água dos tanques (aproximadamente 27 oC para cada tratamento) permaneceram dentro dos níveis aceitáveis para a aquicultura (Boyd,1990), provavelmente devido a época do ano em que os animais foram cultivados (dezembro a maio), quando, as horas de insolação e os valores de temperatura atmosférica apresentam-se altos. Essas altas temperaturas, a presença de matéria orgânica, a respiração de animais ou plantas, quando não há atividade de fotossíntese, e a decomposição aeróbia, são os principais responsáveis pela redução do oxigênio dissolvido na coluna d´água (Baldisserotto, 2002). Apesar da observação de baixos valores de oxigênio dissolvido terem ocorrido neste estudo, eles permaneceram dentro dos padrões para a produção de Macrobrachium (3 a 7 mg.L-1) (Boyd & Zimmermann, 2010) e não apresentaram relação evidente com a água hipereutrófica, pois os valores dos nutrientes e dos sólidos em suspensão aumentaram com o tempo e o oxigênio não sofreu depleção evidente com este aumento. Os valores de oxigênio também sofreram influência dos aeradores instalados após o 26o dia, porém a aeração foi aplicada a todos os tratamentos, sofrendo a mesma influência
Em relação à produção, não houve diferença significativa no cultivo de camarões e tilápias, porém, apresentou valores de produtividade superiores a monocultivos de tilápia.
O uso de substratos dentro de policultivos pode propiciar um novo ambiente para pelo menos uma das espécies cultivadas, podendo otimizar sua produção. Em relação à qualidade da água não foi possível observar grandes diferenças, talvez pelo número de réplicas e os altos desvios apresentados, porém apresentam um padrão no qual é possível observar maior acumulação de partículas e crescimento de algas em substratos com maior superfície e rugosidade.
presentes na água. Possivelmente o sistema mais pressionado pela biomassa, resultaria em diferenças tanto na produção como nas variáveis limnológicas.
CONCLUSÃO
Não foi possível relacionar qualquer efeito de melhora na qualidade da água com o uso de substratos, pois, a biomassa de organismos cultivados foi pequena, com isso o a comunidade perifítica não sofria grandes transformações, com isso as possíveis respostas nas variáveis limnológicas foram silênciadas
O uso de aeradores juntamente com fatores que elevam a concentração de sólidos em suspensão também prejudica o desenvolvimento do perifíton e diminui sua atividade de ciclagem de nutrientes. Talvez o uso de outros sistemas de aeração (ar difuso, bomba aspersora, ou bombas verticais) possa diminuir a concentração de sólidos em suspensão e possam aumentar a eficiência dos substratos, tanto na produção quanto na qualidade da água.
O uso de substratos promoveu o crescimento de perifíton e a adsorção de partículas, porém a quantidade de biomassa não foi eficiente na remoção de nutrientes da água. No presente estudo o substrato mais eficiente neste processo foi a manta, provavelmente pela sua rugosidade, porosidade e maior área de fixação.
REFERÊNCIAS
Abreu P.C., Thompson F.L., Wasielesky Jr W., Cavalli R.O., 1998. New perspectives in the use of microorganisms in shrimp culture: food source, water quality and diseases control. Anais do Aquicultura Brasil’98. Recife, Pernambuco, Nov. 2-6, 703-709.
Agostinho, A. A.; Gomes, L. C.; Pelicice, F. M. 2007. Ecologia e manejo de recursos pesqueiros em reservatórios do Brasil. Maringá: Eduem,. 501p.
American Public Health Association (APHA) 2005. Standart methods for the examination of water and wastewater. 20th edn. APHA, Washington, DC, USA.
Asaduzzaman, M., Wahab, A., Verdegem, M.C.J., Huque, S., Salam, M.A., Azim, M.E. 2008. C/N ratio control and substrate addition for periphyton
development jointly enhance freshwater prawn Macrobrachium rosenbergii
production in ponds. Aquaculture. 280,117–123.
Avnimelech, Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture, 176: 227-235.
Azim, M.E., Wahab, M.A., Biswas, P.K., Asaeda, T., Fujino, T., Verdegem M.C.J. 2004. The effect of periphyton substrate density on production in freshwater polyculture ponds. Aquaculture. 232, p 441-453.
Azim, M. E., Verdegem, M. C.J., Singh, M., Van Dam, A. A., Beveridge, M. C. M. 2003. The effects of periphyton substrate and fish stocking density on water quality, phytoplankton, periphyton and fish growth. Aquaculture research. 34. P. 685-695
periphyton production on artificial substrates and the implications for periphyton-based aquaculture. Aquaculture Research, 32, 749-760.
Azim, M.E., Verdegem, M.C.J., Wahab, M.A., van Dam, A.A.,Beveridge,M.C.M., 2001b. Periphyton boosts production inpond aquaculture systems. World Aquaculture. 32, 57-61
Baldisserotto, B., 2002. Fisiologia de peixes aplicada à piscicultura. Ed. UFSM, Santa Maria, Brasil
Ballester, E.L.C. 2004. Utilização do biofilme como fonte alimentar durante o cultivo do camarão-rosa Farfantepenaeus paulensis em estruturas alternativas de baixo custo. Menção Honrosa - Prêmio Jovem Cientista, Cnpq - Grupo Gerdau – Fundação Roberto Marinho. 82p.
Bouroche J.M. & Saporta G. 1982. Análise de dados. Zahar, Rio de Janeiro. 116 p.
Boyd, C.E.; Zimmermann, S., 2010. Grow-out system – water quality and soil management. In: Freshwater Prawns: Biology and Farming (ed. by New M.B., Valenti W.C., Tidwell J.H., D’Abramo L.R. &. Kutty M.N.), Wiley-Blackwell, Oxford, UK. pp. 239-255.
Boyd, C.E., 1990. Water quality in ponds for aquaculture. London: Birmingham.
Boyd, C.E., 2003. Guidelines for aquaculture effluent management at the farm-level. Aquaculture, 226, 101-102.
Boyd, C.E., Schimittou, H.R., 1999. Achievement of sustainable aquaculture
through environmental management. Aquaculture Economics &
Management, (3):1, 59-69.
Boyd, C.E., Queiroz, J., 1997. Manejo do solo e da qualidade da água em viveiro para aquicultura. Campinas: ASA.
Brasil, 2005. Ministério do Meio Ambiente. Conselho Nacional do Meio Ambiente. Resolução CONAMA N°357, Diário da União, Brasília.
Bratvold, D., Browdy, C.L., 2001. Effects of sand sediment and vertical surfaces (AquaMatsTM) on production, water quality and microbial ecology in an intensive Litopenaeus Õannamei culture system. Aquaculture, 195(2001): 81-94.
Brezonik, P.L.; Pollman, C.D.. 1999. Phosphorus chemistry and cyccling in Florida Lakes: global issues and local perspectives. In Phosphorus Biogeochemistry in subtropical ecosystems. (K.R. Reddy, G.A. O’Connor & C.L. Schelske, eds.). Lewis Publishers, Boca Raton, Florida, p.69-110.
Briggs, M.R.P., Funge-Smith, S.J., 1994. A nutrient budget of some intensive marine shrimp ponds in Thailand. Aquaculture and Fisheries Management, 25, 789–811.
Burford, M.A., Jackson, C.J.; Preston, N.P., 2001. Reducing Nwaste from shrimp farming: an integrated approach, in: Browdy, C.L., Jory, D.E. (Eds.), The new wave: proceedings of the special session on sustainable shrimp culture.
Baton Rouge, LA, USA: World Aquaculture Society, pp. 35–43.
Casillas-Hernández, R., Magallón-Barajas, F., Portillo-Clarck, G., Paez-Osuna, F., 2006. Nutrient mass balances in semiintensive shrimp ponds from Sonora, Mexico, using two feeding strategies: trays and mechanical dispersal.
Aquaculture, 258, 289-298.
Chamixaes, C.B.C.B., 1991. Variação temporal e espacial da biomassa das algas perifiticas relacionadas com as condições ambientais de pequenos rios da bacia hidrográfica do Ribeirão do Lobo (Itirapina-SP). Tese (Doutorado), Universidade Federal de São Carlos, São Carlos.
Christofidis, D., 2002. Considerações sobre conflitos e uso sustentável em recursos hídricos, in: Theodoro, S.H. (Eds.), Conflitos e uso sustentável dos recursos naturais. Rio de Janeiro: Garamond.
Davey, M.E., O’toole, G.A., 2000. Microbial films: from ecology to molecular genetics. Microbiol Mol Biol Rev., 64(4): 847–867.
Dodds, W. K., 2003. The role of periphyton in phosphorus retention in shallow freshwater aquatic systems. Minireview. J. Phycol.39, p 840–849.
Domingos, J.A.S., Vinatea, L., 2002. Perspectivas do uso de substratos artificiais, in: Anais do XII simpósio brasileiro de aquicultura, 12, Goiânia: UFG.
Domingos, J.A.S, Vinatea, L., 2008. Efeito do uso de diferentes quantidades de substratos artificiais na engorda do camarão marinho Litopenaeus vannamei
(Boone,1931), em sistemas de cultivo semi-intensivo. Boletim do Instituto de Pesca, 34, 143-152.
Donini, C.A., Germano, M.I.S., MIGUEL, O., GERMANO, P.M.L., 1993. Pescado, cólera e saúde pública. Comun. Cient. Fac. Med. Vet. Zootec, São Paulo, 17, 25-32.
Esteves, F. A, Amado, A. M. 2011. Nitrogênio. In: Esteves, F.A. (Eds.),
Fundamentos da limnologia, 3ª. ed, Interciência: Rio de Janeiro.. 239-258p.
Esteves, F.A., Meirelles-Pereira, F., 2011. Eutrofização ambiental, in: Esteves, F.A. (Eds.), Fundamentos da limnologia, 3ª. ed, Interciência: Rio de Janeiro. pp. 625-655.
Esteves, F. de A. Fundamentos de Limnologia. 2. ed. Rio de Janeiro: Interciência, 1998. 602 p.
FAO. 2012. Fisheries and Aquaculture Department.
www.fao.orgfisherysofiaen.pdf.
Fast, A.W., Menasveta, P., 2000. Some recent issues and innovations in marine shrimp pond culture. Reviews in Fisheries Science, 8(3):151–233.
Francoeur, S. N. 2001. Meta-analysis of lotic nutrient amendment experiments: detecting and quantifying subtle responses. Journal of the North American Benthological Society 20:358–368.
Goldburg, R., Triplett, T., 1997. Murky waters: environmental effects of Aquaculture in the United States. Washington, DC: The Environmental Defense Fund, EDF Publications.
Golterman H.L., Clyno R.S., Ohsntad M.A.M. 1978. Methods for physical and chemical analysis of fresh water. 2nd ed. Blackwell, Oxford. 315 p.
Henares, M.N.P., Preto, B.L., Rosa, F.R.T., Valenti, W.C., Camargo, A.F.M., 2013. Effectsof artificial substrate and night-time aeratio on the water quality in
Macrobrachium amazonicum (Heller 1862) pond culture. Aquaculture Research, p. 1-8.
Henry-Silva G.G., Camargo A.F.M., 2008. Impacto das atividades de aqüicultura e sistemas de tratamento de efluentes com macrófitas aquáticas – relato de caso. B. Inst. Pesca, São Paulo, 34(1): 163-173.
Jackson, C., Preston, N.P., Thompson, J., Burford, M., 2003. Nitrogen budget and efluente nitrogen components at an intensive shrimp farm. Aquaculture, 218, 397–411.
Karplus, I., Malecha, S., Sagi, A., 2000. The biology and management of size Variation, in: New, M.B., Valenti, W.C. Freshwater prawn farming: the farming of Macrobrachium rosenbergii. Oxford: Blackwell Science. pp. 259-289.
Kimpara, J.M., Rosa F.R.T., Preto B.L., Valenti W.C. 2010 Limnology of Macrobrachium amazonicum grow-out ponds subjected to high inflow of nutrientrich water and different stocking and harvest management.
Aquaculture Research 42, 1–9. doi: 10. 1111/j.1365-2109.2010.02717.x
Kimpara, J.M., 2011 Sustentabilidade, manejo da água e da aeração no cultivo semi-intensivo do camarão-da-amazônia Macrobrachium amazonicum em água hipereutrófica. Tese (Doutorado em Aquicultura), UNESP, Jaboticabal.
Kubitza, F., 1998. Qualidade da água na produção de peixes: parte II. Revista Panorama da Aquicultura. Rio de Janeiro, 46(8): 35-41.
Kubitza, F., 2003. Qualidade da água no cultivo de peixes e camarões. 3.ed. Jundiaí: ESALQ/USP.
Lin, C.K., Yang, Y., 2003. Minimizing environmental impacts of freshwater aquaculture and reuse of pond effluents and mud. Aquaculture, 226, 57–68.
Lin, C.K., 2000. Development of shrimp farming and environmental sustainability in Thailand. Susansoshoku,48(2): 267–272.
Lowe-McConnell, R.H., 2000. The roles of tilapias in ecosystems. in: Tilapias: Biology and Exploitation, Beveridge, M.C.M.; McAndrew, B.J. Kluwer Academic Publishers pp. 129-162. Braz. J. Aquat. Sci. Technol. Vol 15(1). p 11-18.
Martins, F. C. O., Fernandes, V. O. 2011. Biomassa e Composição Elementar (C, N e P) da Comunidade Perifítica no Alto Rio Santa Maria da Vitória, Espírito Santo, Brasil.
Marcarelli, A. M.; Bechtold, H. A.; Rugenski, A. T., 2009. Inouye, R. S. Nutrient limitation of biofilm biomass and metabolism in the Upper Snake River basin, southeast Idaho, USA. Hydrobiologia, v. 620, p. 63–76.
Mackereth F.I.F., Heron J., Talling J.F. (1978) Water analysis: some revised methods for limnologist. Freshwater Biological Association, Ambleside, 121 p.
Milstein, A., Peretz, Y.; Harpaz, S. 2009. Culture of organic tilapia to market size in periphyton based ponds with reduced feed inputs. Aquaculture Research, 40, p 55-59.
Moschini-Carlos, V. 2000. Importância, estrutura e dinâmica da comunidade perifítica nos ecossistemas aquáticos continentais, in: Pompêo, M.L.M. (Eds.), Perspectivas na limnologia brasileira.São Luis: União, pp. 91-103.
Oliveira, M.D.; Rodrigues, L. 2002. Impacto do sedimento sobre o desenvolvimento do perifíton no Rio Taquari, Pantanal, MS. Boletim de pesquisa e desenvolvimento.Embrapa Pantanal .Corumbá, MS. 1-22
Otoshi, C., Montgomery, A., Matsuda, E., Moss, S., 2006. Effects of artificial substrate and water source on growth of juvenile Pacific white shrimp,
Litopenaeus vannamei. Journal of the World Aquaculture Society, 37(2): 210-213.
Pawar N.A., Jena P.C., Das Bhatnagar D.D. 2009. Influence of duration of aeration on growth and survival of carp fingerlings during high density seed rearing. Aquaculture 290, 263–268.
Pérez, G.R., 1992. Fundamentos de limnologia neotropical. Colombia: Universidad de Antioquia.
Peterson, C. G. 1996. Response of benthic algal communities to natural physical disturbance. In: Stevenson, R. J.; Bothwell, M. L. & Lowe, R. L., (eds). Algal ecology: freshwater benthic ecosystems. Academic Press, San Diego, 375 – 402 pp.
Phillips, M.J., Lin, C.K., Beveridge, M.C., 1993. Shrimp culture and the environment: lessons from the world's most rapidly expanding warmwater aquaculture sector, in: Pullin, R.S.V., Rosenthal, H., Maclean, J.L. (Eds.),
Environment and aquaculture in developing countries. Philippines: Manila, pp. 179–191.
Pruder, G.D., 1992. Marine shrimp pond effluent: characterization and environmental impact. in: Wyban, J. (Eds.). Proceedings of special session on shrimp farming, Los Angeles: World Aquaculture Society, pp. 187–190.
Rai, S. ; Yi, Y.; Wahab, M. D. A.; Bart, A. N.; Diana, J. S. 2008. "Comparison of rice straw and bamboo stick substrates in periphyton-based carp polyculture systems. Aquaculture Research. 39(5): p 464-473.
Ramesh, M.R., Shankar, K.M., Mohan, C.V., Varghese, T.J., 1999. Comparison of three plant substrates for enhancing carp growth through bacterial biofilm. Aquacult. Eng. 19, 119– 131.
Rodrigues, L. et al. 2005. Distribuição espacial da biomassa perifítica em reservatórios e relação com o tipo de substrato. In: Rodrigues, L; Thomaz, S. M.; Agostinho, A. A. & Gomes, L. C., (eds). Biocenoses em reservatórios: padrões espaciais e temporais. Editora Rima. São Carlos, São Paulo, pp. 87 – 96.
Rodrigues, G. C. 2013. Cultivo multitrófico e multiespacial do camarão-da-amazônia e tilápia-do-nilo, com e sem o uso de substratos. Dissertação ( Aquicultura) Centro de Aquicultura da UNESP –CAUNESP- Jaboticabal, pp 75.
Rosa, R.T.R., 2011. Balanço de Nitrogênio em Viveiros de Crescimento Final de
Macrobrachium amazonicum com Uso de Aeração Noturna e Substratos Artificiais. Dissertação (Mestrado em Aquicultura), UNESP, Jaboticabal.
Ritvo G., Neill W.H., Lawrence A.L., Samocha T.M. 1997. Turbidity related to shrimp size in tanks with soil substrate. Aquacultural Engineering, Essex, 16, 221-225.
SRAC. 1998 Characterization and management of effluents from aquaculture ponds in the southeastern United States. New York: Pub.
Sindilariu, P.D., Reiter, R.E., Wedekind, H., 2009. Impact of trout aquaculture on water quality and farm effluent treatment options. Aquatic Living Resourse,
22, 93-103.
Sipaúba-Tavares, L. H., 1994. Limnologia aplicada à aquicultura. Jaboticabal: Funesp, p.70.
Talbot, C., Hole, R., 1994. Fish diets and the control of eutrophication resulting from aquaculture. Journal of Applied Ichthyology, 10, 258-270.
Thompson, F.B., Abreu, P.C., Wasielesky, W., 2002. Importance of biofilm for water quality and nourishment in intensive shrimp culture. Aquaculture, 203, 263– 278.
Tidwell, J.H., Coyle, S.D., Weibel, C., Evans, J., 1999. Effects and interactions of stocking density and added substrate on production and population structure of freshwater prawn Macrobrachium rosenbergii. Journal of the World Aquaculture Society, 30(2): 174-179.
Tidwell, J. H., D'abramo, L.R., 2000. Grow-out systems - culture in temperate zones, in: New, M.B., Valenti, W.C. (Eds.), Freshwater prawn farming: the farming of Macrobrachium rosenbergii. Oxford: Blackwell Science, pp. 177-186.
Tidwell, J.H., Coyle, S. D., Vanarnum, A., Weibel, C., D’abramo, L., 2001. Use of artificial substrates to maximize production of freshwater prawns in temperate climates. World Aquaculture Magazine, 32(3): 40-42.