0
EFEITO INIBITÓRIO DE COMPOSTOS FENÓLICOS NA
AÇÃO DA ACETILCOLINESTERASE,
BUTIRILCOLINESTERASE E TIROSINASE.
Humberto Melo Salustiano
Dissertação para obtenção do grau de Mestre em Ciências Farmacêuticas
Trabalho efetuado sob orientação de:
Dra. Luísa Custódio, Investigadora no Centro de Ciências do Mar (CCMar), Universidade do Algarve
1
Efeito inibitório de compostos fenólicos na ação da acetilcolinesterase,
butirilcolinesterase e tirosinase
Declaro ser o autor deste trabalho que é original e inédito. Autores e trabalhos consultados estão devidamente citados no texto e constam da listagem de referências incluída.
Copyright em nome de Humberto Melo Salustiano. A universidade do Algarve tem o direito, perpétuo e sem limites geográficos, de arquivar e publicitar este trabalho através de exemplares impressos reproduzidos em papel ou de forma digital, ou por qualquer outro meio conhecido ou que venha a ser inventado, de o divulgar através de repositórios científicos e de admitir a sua cópia e distribuição com objetivos educacionais ou de investigação, não comerciais, desde que seja dado crédito ao autor e editor.
2
“ Faças o que fizeres, segue sempre o teu eixo”
3 Agradecimentos,
É uma honra poder iniciar a apresentação desta dissertação de mestrado da forma mais justa possível, agradecendo a todos os que de alguma forma contribuíram para que este dia chegasse.
Em primeiro lugar, gostaria de agradecer à minha orientadora, Dr.ª Luísa Custódio pelo apoio que me deu na revisão deste documento, bem como na realização do trabalho prático no laboratório. Estendo este agradecimento a todo o grupo de investigação do Centro de Ciências do Mar (CCMar), liderado pelo Professor Doutor João Varela, que me acolheu como membro da equipa, auxiliou e aconselhou durante a realização do presente trabalho.
A todos os colegas que fizeram parte do meu percurso académico, pela partilha de informação, pela camaradagem e pelos momentos lúdicos por eles proporcionados. Destes, destaco o meu colega João Neto por toda a amizade e bons momentos vividos durante estes cinco anos.
Ao colega de curso Mestre David Estevão, pelo auxílio prestado na revisão e correção desta dissertação.
Aos amigos mais próximos Daniela Duarte, Wilson Faria, Rita Ricardo, Joana Santos, Inês Rita, Priscila Santos e Guida Miguel pelo apoio prestado e pela amizade incondicional, pois sem eles tudo teria sido mais difícil.
Aos meus avós paternos, que sempre demonstraram o desejo de ver o neto a concluir o ensino superior. Saibam que o vosso desejo foi cumprido com sucesso.
À restante família, primos, tios e bisavós pelo amor, carinho e respeito.
Por fim, agradeço à mulher que tornou tudo isto possível. Dedico esta dissertação, à minha mãe. Mãe que foi mãe, pai, amiga, companheira e confidente. Agradeço-lhe por todos os valores e lições de vida que me transmitiu, bem como por todos os sacrifícios realizados para que este momento fosse possível.
4
Índice de Matérias
Índice de Matérias ... 4 Índice de Figuras ... 5 Índice de Quadros ... 5 Índice de Tabelas ... 6 Índice de Gráficos ... 6 Resumo ... 7 Abstract ... 8Lista de Siglas e Abreviaturas... 9
Lista de Símbolos ... 11
1 Capítulo 1 ... 12
1.1 Enquadramento Teórico e Justificação do Estudo ... 13
1.2 Objetivos ... 14
1.3 Organização da Dissertação ... 15
2 Capítulo 2 ... 16
2.1 Acetilcolinesterase (AChE) e Butirilcolinesterase (BChE) ... 17
2.1.1 Classificação e Caracterização ... 17
2.1.2 Função Biológica ... 19
2.1.3 Inibidores da Atividade Enzimática ... 21
3 Capítulo 3 ... 31
3.1. Tirosinase (TYRO) ... 32
3.1.1. Análise Estrutural e Localização Celular ... 32
3.1.2. Mecanismo de Catálise ... 33
3.1.3. Papel da Tirosinase na Produção das Melaninas ... 34
3.1.4. Inibidores da TYRO ... 37
3.2. Neuromelanina e Tirosinase: Papel na Doença de Parkinson (DP) ... 41
4 Capítulo 4 ... 43
4.1. Compostos Fenólicos como Inibidores da AChE, BChE e TYRO ... 44
4.1.1. Caracterização dos Compostos Fenólicos ... 44
4.2. Interesse Clínico dos Compostos Fenólicos ... 50
4.2.1. Efeito Inibitório de Compostos Fenólicos sobre a AChE e a BChE ... 51
5 5 Capítulo 5 ... 56 5.1 Trabalho Experimental ... 57 5.1.1 Materiais e Métodos ... 57 5.1.2 Resultados e Discussão ... 62 6 Capítulo 6 ... 81 6.1 Conclusões e Perspetivas ... 82 6.2 Referências Bibliográficas ... 83
Índice de Figuras
Figura 2.1 - Representação do sítio ativo da acetilcolinesterase. ... 18Figura 2.2 - Mecanismo da hidrólise da acetilcolina mediado pela acetilcolinesterase 21 Figura 3.1- Ciclo reativo catalisado pela tirosinase... 34
Figura 3.2 - Estrutura química da L-Tirosina. ... 35
Figura 3.3 - Via biossintética de formação da melanina, com destaque para os passos catalisados pela tirosinase. ... 36
Figura 3.4 - Estruturas químicas da hidroquinona, arbutin e ácido Kójico. ... 38
Figura 3.5 - Fotografias ilustrativas das principais manifestações da acumulação excessiva de melanina. ... 40
Figura 3.6 - Classes de compostos utilizados no tratamento e prevenção da hiperpigmentação... 41
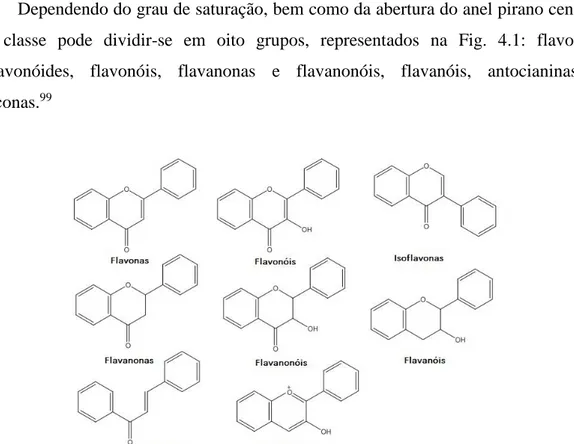
Figura 4.1- Estrutura química dos principais grupos de flavonóides. ... 44
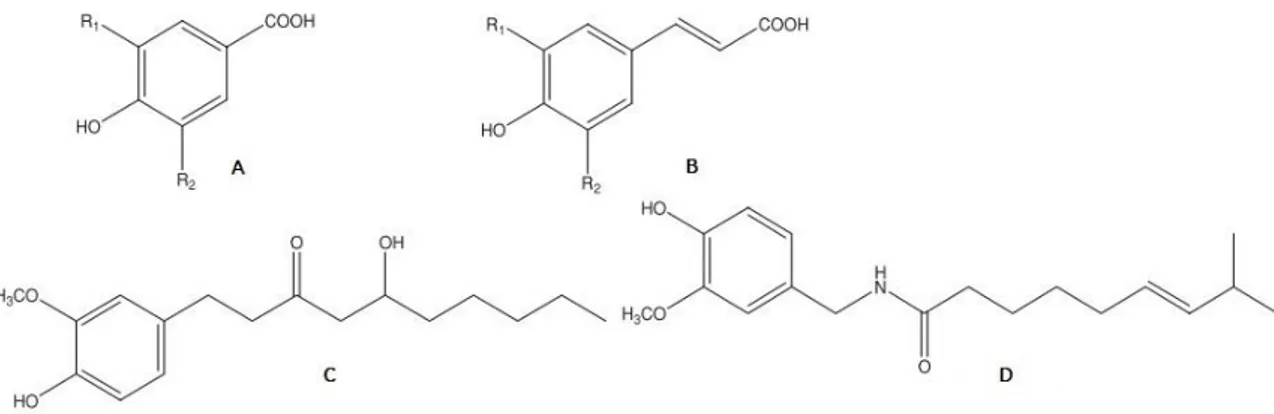
Figura 4.2 - Estrutura química dos ácidos fenólicos. ... 47
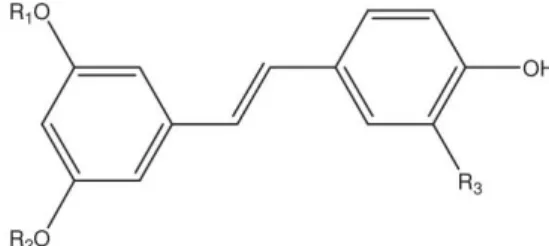
Figura 4.3 - Estrutura química base dos estilbenos. ... 48
Figura 4.4 - Estrutura química base dos curcuminóides... 49
Figura 4.5 - Exemplo de estrutura dos lignanos, secoisolariciresinol. ... 49
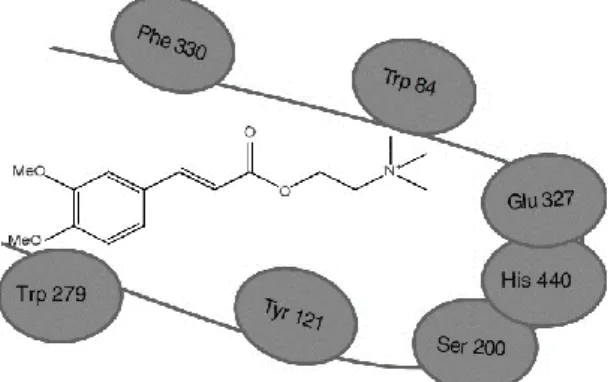
Figura 4.6 - Interação do grupo aromático do ácido cafeico com a região aniónica periférica (Trp 279) da acetilcoliesterase. ... 52
Figura 5.1 - Exemplo representativo do preenchimento da placa de 96 poços. ... 60
Índice de Quadros
Quadro 2.1 Efeito da acetilcolina nos diferentes órgãos/sistemas. ... 206 Quadro 2.2 Classes de inibidores das colinesterases e exemplos de compostos com e sem autorização de introdução no mercado em Portugal. ... 23 Quadro 2.3 Efeitos farmacológicos dos inibidores das colinesterases. ... 25 Quadro 4.1 Principais compostos de cada um dos grupos que constituem os flavonóides, bem como as suas principais fontes biológicas. ... 45 Quadro 4.2 Exemplos de alcalóides e terpenos fenólicos e respetivas fontes biológicas. ... 50 Quadro 4.3 Compostos fenólicos com atividade inibitória comprovada da acetilcolinesterase e suas fontes biológicas. ... 53 Quadro 5.1 Compostos analisados, fornecedor e respetivo número de registro CAS. . 57
Índice de Tabelas
Tabela 5.1 - Efeito dos flavonóides sobre a atividade enzimática da acetilcolinesterase e butirilcolinesterase. ... 63 Tabela 5.2 - Efeito dos ácidos hidroxicinâmicos sobre a atividade enzimática da acetilcolinesterase e butirilcolinesterase. ... 65 Tabela 5.3 - Efeito dos ácidos hidroxibenzóicos sobre a atividade enzimática da acetilcolinesterase e butirilcolinesterase. ... 67 Tabela 5.4 - Efeito dos ácidos hidroxibenzóicos sobre a atividade enzimática da acetilcolinesterase e butirilcolinesterase. ... 68 Tabela 5.5 - Efeito dos flavonóides sobre a atividade enzimática da tirosinase... 70 Tabela 5.6 - Efeito dos ácidos hidroxicinâmicos sobre a atividade enzimática da tirosinase. ... 72 Tabela 5.7 - Efeito dos ácidos hidroxibenzóicos sobre a atividade enzimática da tirosinase. ... 74 Tabela 5.8 - Efeito dos ácidos hidroxibenzóicos sobre a atividade enzimática da tirosinase. ... 76
Índice de Gráficos
Gráfico 5.1 -. Estimulação da atividade enzimática da tirosinase pelo ácido cafeico (ACA), ácido clorogénico (AC) e hidrato de catequina (CH). ... 79
7
Resumo
Os compostos fenólicos, devido às suas propriedades, são compostos de interesse no desenvolvimento de investigações de diversos âmbitos, com particular relevância no âmbito da medicina. Atualmente verifica-se um aumento da prevalência de patologias neurodegenerativas, como a Doença de Alzheimer e Doença de Parkinson. Diversos estudos citam as enzimas acetilcolinesterase (AChE), butirilcolinesterase (BChE) e tirosinase (TYRO), como determinantes no desenvolvimento destas patologias. A inibição da sua atividade enzimática promove um aumento dos níveis de neurotransmissores no cérebro, com a consequente diminuição da sintomatologia associada. Inibidores da TYRO, podem constituir-se também como alternativa terapêutica de problemas do foro dermatológico, ou ainda, como aditivo na indústria alimentar. Neste contexto, torna-se fundamental a identificação de compostos com propriedades inibitórias na atividade da TYRO. Pretendeu-se com a elaboração da presente dissertação identificar compostos fenólicos detentores de atividade inibitória sobre as enzimas supracitadas. Esta determinação foi realizada em placas de 96 poços, com base em métodos colorimétricos descritos na literatura. Dos vinte e três compostos analisados, a rutina foi o composto que demonstrou maior capacidade inibitória sobre a atividade de todas as enzimas em estudo. Para uma concentração de 250µM de rutina, a AChE teve a sua atividade diminuída para 68,47±3,03%, a BChE para 83,29±8,91% e a TYRO para 25,27±4,64%.Por outro lado, as catequinas: epigalocatequina galato, epicatequina e a epigalocatequina, para uma concentração de 300µM, reduziram a atividade enzimática da TYRO para 49,84±11,03%, 65,40±3,70% e 75,64±2,81%, respetivamente. Inibição, essa, superior à originada pelo composto de referência, o arbutin. Apesar de resultados promissores para alguns compostos, estes são limitativos, na medida em que apenas se reportam a uma análise in vitro, sem considerar a complexidade de processos que os compostos podem sofrer num organismo até atingir as enzimas alvo. Sugere-se em futuras investigações uma análise in vivo desses compostos.
Palavras-chave: Compostos fenólicos; Patologias neurodegenerativas; Acetilcolinesterase; Butirilcolinesterase; Tirosinase.
8
Abstract
Phenolic compounds, due to its properties, are compounds of interest in the development of various fields of investigations, with particular relevance for medicine. Currently there is an increased prevalence of neurodegenerative diseases such as Alzheimer's disease and Parkinson's disease. Several studies indicate the enzymes acetylcholinesterase (AChE), butyrylcholinesterase (BChE), and tyrosinase (TYRO), as determinants in the development of these disorders. The inhibition of its enzymatic activity promotes an increase in the levels of neurotransmitters in the brain, with the consequent decrease in symptoms. Inhibitors of TYRO can also be used as an alternative therapeutic treatment of dermatological disorders, or as an additive in the food industry. In this context, the identification of compounds with inhibitory properties on its enzymatic activity becomes essential. The aim of this dissertation was to identify phenolic compounds holders of inhibitory activity on the above enzymes. This determination was performed in 96 well plates using colorimetric methods described in the literature. Of the twenty-three compounds studied, rutin was the one showing the highest inhibitory effect on the activity of all enzymes studied. At a concentration of 250μM, the activity of AChE was reduced to 68,47±3,03%, BChE to 83,29±8,91%, and TYRO to 25,27±4,64%. On the other hand, catechins: epigallocatechin gallate, epicatechin and epigallocatechin, at a concentration of 300μM, resulted in a reduction of the enzymatic activity of TYRO to 49,84±11,03%, 65,40±3,70% and 75,64±2,81%, respectively. The inhibition was higher than the one obtained with the standard use, arbutin. Despite promising results for some compounds, they are limited as they relate only to an in vitro analysis, without considering the complexity of processes that compounds may undergo in the body, until they reach the target enzymes. An analysis of these compounds in vivo is suggested for future research.
Key-words: Phenolic compounds, Neurodegenerative diseases, Acetylcholinesterase, Butyrylcholinesterase, Tyrosinase
9 Lista de Siglas e Abreviaturas
4HBZ 4-Hidroxibenzaldeído
A Absorvência
AC Ácido Clorogénico
ACA Ácido Cafeico
ACh Acetilcolina
AChE Acetilcolinesterase
AChEI Inibidor da Acetilcolinesterase
ACU Ácido Cumarínico
AF Ácido Ferúlico
AG Ácido Gálico
AGE Ácido Gentísico
AIM Autorização de Introdução no Mercado
AMHB Ácido m-hidroxibenzóico AP Apigenina
APHB Ácido p-hidroxibenzóico
AR Ácido Rosmarínico
AS Ácido Salicílico
ASI Ácido Siríngico
ATC Ácido trans-Cinâmico
AV Ácido Vanílico BChE Butirilcolinesterase BHT Butil-hidroxitolueno CH Hidrato de catequina ChE Colinesterase ChEs Colinesterases
ChEI Inibidor das colinesterases
ChEIs Inibidores das colinesterases
DA Doença de Alzheimer
DCL Demência de Corpos de Lewy
DHICA Ácido 5,6-dihidroxiindole-2-carboxílico DMSO Dimetilsulfóxido
10
DTNB Ácido 5,5’-Ditio-bis-(2-nitrobenzóico)
EC Epicatequina
EG Epigalocatequina
EGG Epigalocatequina galato
EX Exemplo
FDA Food and Drug Administration
Fig Figura
FL Flavona
IC50 Concentração de composto que inibe em 50% a atividade da enzima.1
IM Intramuscular
IV Intravenoso
mg Miligrama, unidade de massa que se relaciona com o grama pela
relação: 1 mg = 10-3 g.1
ml Mililitro, unidade de volume que se relaciona com o Litro pela relação: 1 mL = 10-3 L.2
mM Milimolar, unidade de concentração que se relaciona com o Molar pela relação: 1 mM = 10-3 M.2
nm Unidade de medida de comprimento que se relaciona com o metro pela relação: 1 nm = 10-9 m.2
PCHC Produtos de cosmética e de higiene corporal
PIO Pressão intraocular
QC Quercetina
ROS Espécies reativas de oxigénio
RU Rutina
SC Subcutânea
Ser Serina
SN Sistema Nervoso
SNA Sistema Nervoso Autónomo
SNC Sistema Nervoso Central
SNP Sistema Nervoso Periférico
SNS Sistema Nervoso Somático
TYRO Tirosinase UV Ultravioleta
11
µL Microlitro, unidade de volume que se relaciona com o Litro pela
relação: 1 µL = 10-6 L. 1
µM Micromolar, unidade de concentração que se relaciona com o Molar pela relação: 1 µM = 10-6 M.2
Lista de Símbolos
Å Angström, unidade de medida de comprimento que se relaciona com o metro pela relação: 1 Å = 10-10 m.2
% Percentagem
12
13
1.1 Enquadramento Teórico e Justificação do Estudo
Os compostos fenólicos são conhecidos por exibirem, em geral, uma elevada atividade antioxidante, tendo por isso o potencial de atenuar o stress oxidativo e reduzir o risco associado a patologias neurodegenerativas como a doença de Alzheimer (AD) e doença de Parkinson (DP). 3,4
Recentemente, estes compostos têm sido alvo de estudos relativos à sua capacidade inibitória de enzimas relacionadas com o desenvolvimento destas patologias, nomeadamente as colinesterases (ChEs) acetilcolinesterase (AChE) e butirilcolinesterase (BuChE), e a tirosinase (TYRO).5,6
Com o envelhecimento tendencial da população mundial, a incidência de patologias neurodegenerativas tem vindo a aumentar com grande impacto para a saúde pública. 7,8 O seu impacto é tão elevado que em 2050 prevê-se que 115 milhões de pessoas viverão com demência, comparativamente com os atuais 35 milhões. A memória, o pensamento, a compreensão, o cálculo, a fala e a capacidade de aprendizagem constituem-se como as principais capacidades afetadas pela demência, geralmente acompanhadas de deterioração do controlo emocional, do comportamento social e da motivação.9,10
A DA é o principal tipo de demência (60-70% dos casos). Esta patologia atinge, principalmente, indivíduos com mais de 65 anos e caracteriza-se por uma redução acentuada e repentina da capacidade cognitiva, da qual resulta uma significativa incapacidade dos doentes. 10,11
Atualmente existem quatro fármacos disponíveis na Europa para o tratamento da DA. Três deles são inibidores das ChEs (galantamina, rivastigmina e donepezilo), sendo o quarto, a memantina, um antagonista dos recetores NMDA, apenas indicado para o tratamento da DA nas fases moderada e severa 12–14.
A administração de inibidores das colinesterases (ChEIs) promove um aumento dos níveis de acetilcolina no cérebro, que resulta numa atenuação dos sintomas cognitivos da AD 11,15. A utilização destes compostos, apesar de aprovada pelo INFARMED, está associada a efeitos adversos como náuseas, vómitos, perda de apetite e hepatotoxicidade
12,14,16.
Neste contexto, devido à elevada prevalência da AD e à falta de terapêuticas eficazes a longo termo, existe uma necessidade premente de pesquisa e desenvolvimento de novos ChEIs, mais eficazes e seguros.17
14 Apesar de a AChE ser a enzima responsável pela maior parte da atividade colinesterásica no cérebro, novas investigações sugerem que a BChE deve ser também considerada um alvo terapêutico em patologias como a AD. 15,18
A TYRO, por sua vez, é uma enzima encontrada numa grande variedade de organismos, responsável pela síntese da melanina.19,20 Compostos com atividade inibitória da TYRO, tais como o ácido kójico, hidroquinona e o arbutin são atualmente utilizados no tratamento da hiperpigmentação cutânea, bem como aditivos na indústria alimentar de forma a prevenir o escurecimento característico de alguns alimentos. 6,20 Diversos estudos sugerem o possível papel desta enzima na DP, bem como os benefícios terapêuticos que podem advir da sua inibição 21,22.
Neste trabalho pretende-se avaliar a atividade inibitória dos compostos fenólicos sobre as enzimas AChE, BChE e TYRO, tendo em vista a sua potencial aplicação a nível farmacêutico.
1.2 Objetivos
A elaboração da presente dissertação tem como objetivo geral a identificação de compostos fenólicos com elevada atividade inibitória das ChEs, AChE e BChE, e da TYRO. Pretende-se identificar compostos que possam contribuir para o desenvolvimento de potenciais fármacos com ação terapêutica em patologias onde estas enzimas desempenham um papel fulcral.
Constituem-se como objetivos específicos:
- Caracterizar as enzimas e elucidar, sucintamente, sobre os processos biológicos em que estão envolvidas;
- Identificar patologias em que estas enzimas desempenhem um papel fulcral, e onde se podem constituir alvos terapêuticos;
- Identificar e caracterizar os compostos descritos na literatura como possíveis inibidores destas enzimas;
- Elucidar, sucintamente, sobre a possível utilização destes compostos noutras áreas fora do âmbito da medicina;
- Enaltecer os efeitos terapêuticos de compostos naturais, com particular destaque para os compostos fenólicos, descritos na literatura;
15 - Abordar brevemente a utilização dos compostos fenólicos como inibidores destas enzimas e o possível benefício da sua integração na terapêutica das patologias supracitadas;
- Avaliar a atividade inibitória de vinte e três compostos fenólicos previamente estudados pelo grupo de investigação do CCMar, em laboratório;
- Analisar os resultados obtidos e inferir sobre a possível utilização de compostos fenólicos como inibidores das enzimas em estudo.
1.3 Organização da Dissertação
A presente dissertação consiste numa revisão bibliográfica que serve, neste caso, de suporte à realização de um trabalho prático em que se procedeu à determinação da atividade inibitória dos compostos fenólicos sobre a atividade das enzimas em estudo. No entanto, e devido à sua estrutura, facilmente pode ser aplicada a investigações posteriores que visem identificar inibidores das enzimas supracitadas. De forma a simplificar a compreensão e leitura da presente dissertação, optou-se pela apresentação de forma separada da informação referente às ChEs e à TYRO. No que respeita às enzimas, discute-se sucintamente a sua estrutura, funções biológicas, o discute-seu envolvimento em patologias, bem como os benefícios da sua inibição. Posteriormente, procede-se à classificação e caracterização dos compostos fenólicos, com descrição dos efeitos benéficos da sua utilização e apresentação dos compostos identificados na literatura como detentores de atividade inibitória sobre estas enzimas. Após a revisão bibliográfica, procede-se à apresentação do trabalho experimental, onde se descrevem os métodos e materiais utilizados, bem como os resultados obtidos e a discussão dos mesmos. Por último, serão efetuadas algumas considerações finais sobre os resultados obtidos.
16
17
2.1 Acetilcolinesterase (AChE) e Butirilcolinesterase (BChE)
2.1.1 Classificação e Caracterização
A AChE e a BChE são enzimas serina-hidrolases pertencentes à classe das ChEs, que catalisam a hidrólise dos ésteres de colina.15,23
A AChE (EC 3.1.1.7) é também designada por colinesterase verdadeira, acetilcolina hidrolase ou acetiltiocolinesterase. Esta enzima encontra-se presente no tecido nervoso de todos os animais e junções neuromusculares da maior parte deles. 24,25 No homem, a enzima é codificada pelo gene ACHE que se encontra no braço longo do cromossoma 7, posição 22. 26,27 Após ser sintetizada, a AChE é exportada para a superfície da membrana celular onde pode ficar ancorada à membrana plasmática (formas globulares), ancorada à lamina basal (formas assimétricas com cauda de colagénio) ou ser secretada sob a forma de moléculas solúveis (formas globulares).28
Apesar da atividade catalítica da enzima ser bem conhecida, a sua estrutura quaternária é altamente complexa e não se encontra totalmente elucidada. A grande variedade de formas da AChE é resultado de processos como o splicing alternativoI do gene, a oligomerização com subunidades catalíticas e a associação com subunidades não catalíticas.25
Até à presente data, foram identificadas e classificadas várias isoformas da enzima resultantes da presença de diferentes subunidades catalíticas: isoforma/subunidade T ou AChE-S (sináptica), isoforma/subunidade H ou AChE-E (eritrocitica); isoforma/subunidade R ou AChE-R, entre outras. As mais relevantes e melhor estudadas são as isoformas/subunidades T e H. 25,26
Em mamíferos adultos a subunidade H é expressa, principalmente, na superfície de células hematopoiéticas. A função fisiológica da enzima nestas células não se encontra bem estudada, mas alguns investigadores sugerem o seu envolvimento na diferenciação dos megacariócitos. 25,29 A subunidade T, por sua vez, é expressa predominantemente no sistema nervoso colinérgico e no músculo-esquelético, onde desempenha um papel crucial na regulação da transmissão do impulso nervoso.24,25
A BChE (EC 3.1.1.8) é uma serina-hidrolase com funções diversas no organismo humano. Esta é sintetizada maioritariamente no fígado e distribuída pela mucosa
I Splicing alternativo – processo regulatório que ocorre durante a expressão genética e permite a obtenção de diferentes proteínas a partir de um só gene.179
18 intestinal, plasma sanguíneo e matéria branca do sistema nervoso central (SNC). No SNC é secretada pelas células gliaisII encontrando-se associada a estas. 15,30
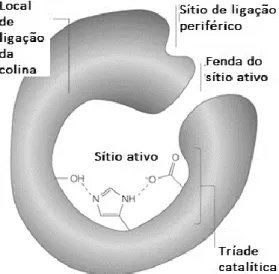
A análise por cristalografia raio-X destas enzimas demonstrou que a sua atividade catalítica se deve a uma tríade de aminoácidos, serina, histidina e glutamato localizados no fundo de uma fenda de 20 Å, conforme se pode verificar na Fig 2.1. 31
Apesar de codificadas por genes diferentes, as enzimas possuem 65% de homologia estrutural, diferindo na sua afinidade para os substratos e sensibilidade a inibidores. Esta diversidade entre as enzimas resulta da variação de aminoácidos na sequência que determina o tamanho e forma do sítio ativo. 15,32
A hidrólise catalisada pelas ChEs é afetada, maioritariamente, por duas regiões: a região esteárica, onde se encontra a tríade catalítica e a região periférica. Nesta última, encontram-se vários aminoácidos aromáticos e um resíduo de aspartato, que são capazes de interagir com substratos catiónicos e conduzi-los até à tríade catalítica.31,33
Figura 2.1 - Representação do sítio ativo da acetilcolinesterase. Adaptado de Soreq et al., 2001. 34
Ambas as enzimas são capazes de promover a hidrólise da ACh, mas a AChE fá-lo com 1013 maior atividade catalítica que a BChE, nas mesmas condições. No córtex temporal de um cérebro humano saudável, a BChE representa cerca de 10% da atividade colinesterásica. 35,36
II Células gliais – Células não-neuronais que mantêm um ambiente químico adequado para que ocorra a neurotransmissão. Estas estão também envolvidas na formação da mielina e fornecem suporte e proteção aos neurónios, no cérebro e no sistema nervoso periférico.180
19 As diferenças nas propriedades cinéticas e localização cerebral destas enzimas indicam que, num cérebro saudável, a AChE seja a enzima maioritariamente responsável pela hidrólise da ACh enquanto a BChE desempenha um papel funcional de suporte. 15,36
2.1.2 Função Biológica
De forma a compreender a importância biológica destas enzimas, bem como dos efeitos resultantes da sua inibição, importa conhecer a função e mecanismo de ação da ACh nos diversos órgãos.
A ACh foi o primeiro neurotransmissor descoberto. Esta desempenha funções tanto no Sistema Nervoso Periférico (SNP) como no SNC, mediando a transmissão de informação neurónio – célula efetora ou neurónio – neurónio.37
O SNP engloba o Sistema Nervoso Autónomo (SNA) e o Sistema Nervoso Somático (SNS). O primeiro é detentor de uma atividade intrínseca, ou seja, não está sob controlo consciente e regula principalmente funções viscerais como a circulação sanguínea e a digestão. Por sua vez, o SNS depende de controlo consciente e regula funções como o movimento, a respiração e a postura. 37
No SNC, a ACh desempenha um papel crucial no que respeita às funções cognitivas, principalmente, funções como a aprendizagem e a memória. Recentemente, este neurotransmissor tem sido também relacionado com a atenção, orientação e com a deteção de estímulos. 38
A ACh nas junções neuromusculares é responsável pela contração muscular. O processo de contração inicia-se com a transmissão do impulso nervoso aos neurónios motores que libertam ACh. Após ser libertada, a ACh difunde ao longo da sinapse ligando-se aos recetores nicotínicos da membrana plasmática das fibras musculares. Desta ligação resultam sucessivas despolarizações que culminam em contração muscular.39
No SNA, a ACh libertada pelas fibras colinérgicas promove efeitos em praticamente todos os órgãos inervados pelo SNA. Estes efeitos encontram-se discriminados no quadro 2.1.37
20 Quadro 2.1 Efeito da acetilcolina nos diferentes órgãos/sistemas. Adaptado de Katzung et al., 2012.37
Órgãos/ Sistemas Acetilcolina (ACh)
Olhos
Contração do esfíncter muscular
Contração do músculo ciliar (visão ao perto) Aumento da secreção pelas glândulas lacrimais Coração Diminuição do ritmo cardíaco
Diminuição da contractilidade
Pulmões Contração dos músculos da traqueia e dos brônquios Aumento da secreção pelas glândulas brônquicas Sistema
gastrointestinal
Aumento do tónus e da motilidade Relaxamento dos esfíncteres
Aumento da secreção pelas glândulas digestivas Sistema urinário Contração dos músculos da parede da bexiga
Relaxamento do esfíncter muscular
Pele Aumento da secreção pelas glândulas sudoríparas
Devido aos seus diversos efeitos, a regulação da atividade deste neurotransmissor tem sido alvo de desenvolvimento de fármacos utilizados na terapêutica de patologias como a DA. Neste sentido, cinco processos podem ser alvo de terapêutica farmacológica: a síntese, o armazenamento, a libertação, a terminação da ação no recetor e o seu efeito no recetor. 37
A utilização de ChEIs tem como objetivo regular o processo de terminação da ação da ACh juntos dos seus recetores. 15,40 Na transmissão colinérgica, um impulso nervoso é transmitido quando um potencial de ação chega à região terminal de um nervo e promove a fusão da vesicula que armazena a ACh com a membrana plasmática do nervo, que culmina na libertação de ACh na fenda sináptica. Após secretadas pelo nervo pré-sináptico, as moléculas de ACh ativam os recetores de ACh no neurónio seguinte ou célula alvo pós-sináptica. 15,37
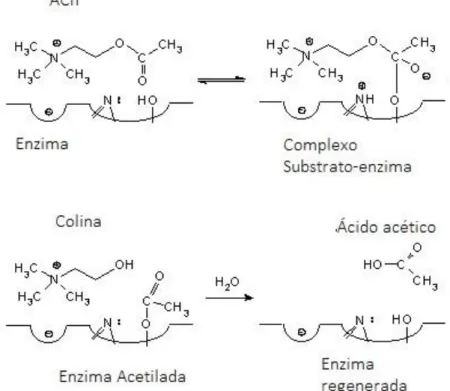
No término do sinal, as moléculas de ACh são hidrolisadas pela AChE e/ou BChE em colina e ácido acético.35,37 O mecanismo de hidrólise da ACh encontra-se representado na Fig. 2.2. Este inicia-se por um ataque do grupo nucleófilo Ser-CH2-OH ao carbonilo
21 colapsa. Desta forma, a enzima é acetilada e ocorre libertação de colina. Por fim, uma molécula de água medeia a hidrólise que regenera a enzima e liberta ácido acético. 41
Figura 2.2 - Mecanismo da hidrólise da acetilcolina mediado pela acetilcolinesterase. Adaptado de Hexum, 2006. 42 ACh – acetilcolina.
As ChEs encontram-se presentes em todas as junções colinérgicas, normalmente, ligadas à membrana basal de células na fenda sináptica.40 Estas enzimas são responsáveis pela terminação efetiva da transmissão sináptica, através de uma rápida hidrólise do neurotransmissor ACh. 43 Caso a ACh não fosse hidrolisada o nervo pós-sináptico permaneceria eletricamente carregado e novos impulsos não seriam transmitidos.34 A inibição destas enzimas pelos ChEIs diminui a hidrólise da ACh, resultando num aumento da sua concentração e duração de ação na fenda sináptica. 15
2.1.3 Inibidores da Atividade Enzimática
22 A Fisostigmina foi o primeiro ChEI a ser utilizado com fins terapêuticos. Esta era utilizada no tratamento do glaucomaIII em 1876 apesar de ser desconhecido o seu
mecanismo de ação.7 Mais tarde, em 1890, este alcaloide natural isolado da espécie
Physostigma venenosum, foi utilizado pioneiramente no tratamento da DA. No entanto, teve resultados contraditórios nos ensaios clínicos devido aos efeitos secundários periféricos e pelo seu curto tempo de meia-vida. Devido a estas limitações este composto deixou de ser utilizado clinicamente. 13
Posteriormente, os ChEIs começaram a ser utilizados como pesticidas e a investigação focou-se na descoberta de agentes mais potentes, seletivos e seguros. 7 Com o início da primeira guerra mundial, a seletividade destes compostos foi manipulada de forma incorreta, desenvolvendo-se o sarin, que consiste num gás neurotóxico utilizado como arma química. Por esta altura, a investigação direcionava-se exclusivamente para o desenvolvimento de gases neurotóxicos e seus antídotos, surgindo novos gases organofosforadosbem como os seus antídotos, as oximas. 44
O período pós-guerra caracterizou-se por um cenário de população jovem e de escassez de alimentos. Neste contexto, o financiamento foi direcionado para o desenvolvimento agrícola e para a sua proteção, investindo novamente no desenvolvimento de ChEIs como pesticidas. Foi também neste período que se desenvolveram os primeiros fármacos biológicos e alguns sintéticos, que aliados a uma melhoria das condições sanitárias promoveram um aumento da esperança média de vida.
7,13
Com o envelhecimento tendencial da população, tem aumentado a prevalência de doenças crónicas. Neste contexto, o financiamento dirigiu-se para o desenvolvimento de ChEIs como terapêutica de patologias neurodegenerativas como a DA.7,8,11 Deste crescente interesse na terapêutica da DA, foi isolado da espécie Galanthus woronowii Losinsk., em 1950, a galantamina, um inibidor não competitivo da AChE que expressa uma afinidade reduzida para a BChE. 7,45
Numerosos análogos da fisostigmina têm sido sintetizados, sendo o mais eficaz a rivastigmina, um derivado carbamato que inibe reversivelmente a AChE e a BChE. Atualmente, este fármaco é utilizado no tratamento da demência suave a moderada na DA e na demência ligeira a moderada em doentes com DP idiopática.17,46
III Glaucoma – neuropatia ótica associada a danos estruturais no nervo ótico e a disfunção visual provocada por vários processos patológicos.47
23 Entre os fármacos descobertos, alguns foram retirados do mercado devido a efeitos adversos exacerbados como diarreia, náuseas e hepatotoxicidade. Entres estes, encontram-se a tacrina e o metrifonato. 15 Nos últimos anos, muitos esforços têm sido
efetuados com o objetivo de sintetizar compostos mais eficazes do ponto de vista terapêutico e com melhor perfil de segurança. A maioria das investigações utiliza como ponto de partida a fisostigmina e outros compostos naturais similares, no entanto, apesar dos esforços evidenciados poucos foram os fármacos que atingiram estadios avançados de ensaios clínicos.13,17
2.1.3.2 Propriedades Farmacológicas
As principais diferenças entre os ChEIs são químicas e farmacocinéticas, sendo a sua farmacodinâmica semelhante. Ao nível da sua química e farmacocinética, os parâmetros que os distinguem são a estrutura, a absorção e metabolismo.37
Estruturalmente, estes compostos podem ser divididos em três classes: [i] álcoois simples com um grupo amónia quaternário; [ii] ésteres carbâmicos de álcoois com um grupo amónia terciário ou quaternário (carbamatos); e [iii] derivados orgânicos do ácido fosfórico (organofosforados). No quadro 2.2, encontram-se exemplificados ChEIs destas classes e a respetiva indicação da existência ou não de Autorização de Introdução no Mercado (AIM)IV em Portugal. 13,14,37
Quadro 2.2 Classes de inibidores das colinesterases e exemplos de compostos com e sem autorização de introdução no mercado em Portugal. Adaptado de Ali et al., 2012; Infarmed, 2014; Katzung et al., 2012. 13,14,37 [i] Álcoois simples com um grupo amónia quaternário, [ii] carbamatos, [iii] organofosfatos, AIM – Autorização de introdução no mercado.
Classe [i] [ii] [iii]
Com AIM Neostigmina Piridostigmina Rivastigmina Galantamina Donepezilo
IV AIM – Para que um medicamento seja colocado no mercado, é necessária uma Autorização de Introdução no Mercado (AIM), concedida pelo INFARMED, I.P. 181
24 Sem AIM Edrofónio Fisostigmina
Soman Paraoxão Malaoxão
Paratião Malatião
O edrofónio, neostigmina e a piridostigmina são compostos de amónia quaternária sintéticos atualmente utilizados em medicina. O soman é um potente gás neurotóxico, o paratião e o malatião são pró-fármacos tiofosfatos (inativos) que são convertidos aos derivados fosfatos (ativos) em animais e plantas, sendo por isso utilizados como pesticidas. 7
Todos os ChEIs aumentam a concentração de ACh nos recetores colinérgicos por inibirem a ação das colinesterases, no entanto, os detalhes moleculares da interação destes compostos com as enzimas variam de acordo com os grupos descritos.33,37 O primeiro grupo, constituído pelos álcoois simples com um grupo amónia quaternário, interage com o sítio ativo das enzimas por ligações electroestáticas reversíveis impedindo a ligação da ACh. O complexo enzima-inibidor não envolve uma ligação covalente e portanto a duração da ação é curta, cerca de 2 a 10 minutos. 37,40
A interação entre as enzimas e o segundo grupo, ésteres carbâmicos de álcoois com um grupo amónia terciário ou quaternário (carbamatos), envolve uma hidrólise sequencial, com duas etapas, semelhante à que ocorre com a ACh. Neste caso, o intermediário que se forma é mais resistente ao processo de hidratação que o intermediário acetilado, atrasando a regeneração da enzima livre em 30 minutos a 6 horas. Durante este período a enzima não consegue hidrolisar a ACh. 37,40
No caso particular dos organofosforados, estes sofrem uma hidrólise que resulta em fosforilação do sítio ativo da enzima. A ligação covalente fósforo-enzima é extremamente estável e sofre hidratação a um ritmo muito lento, como consequência o efeito é muito prolongado. 13,40
Diversos autores classificam os grupos supracitados com base na duração da ação provocada, em inibidores “irreversíveis” ou reversíveis das ChEs como os organofosfatos ou o Edrofónio e os carbamatos, respetivamente. 7
25 Os efeitos farmacológicos mais proeminentes dos ChEIs ocorrem a nível do sistema cardiovascular e gastrointestinal, dos olhos, da junção neuromuscular e da estimulação dos recetores colinérgicos no SNC. Como a ação destes fármacos passa por amplificar os efeitos da ACh, os efeitos observados são muito semelhantes aos da administração de agonistas colinomiméticos. 40 No quadro 2.3 que se segue, apresentam-se os efeitos desta clasapresentam-se de compostos nos diferentes órgãos.37,40
Quadro 2.3 Efeitos farmacológicos dos inibidores das colinesterases. Adaptado de Katzung et al., 2012; Nair, 2004 37,40 SNC – Sistema Nervoso Central.
Efeitos Farmacológicos dos Inibidores das Colinesterases
SNC
Em doses baixas promovem um aumento da atividade neurológica Em doses elevadas provocam convulsões generalizadas que podem ser precedidas de coma e paragem respiratória
Junção Neuromuscular
Em doses baixas (terapêuticas) aumenta a força da contração muscular.
Em doses elevadas podem provocar fibrilação das fibras musculares, fasciculações e bloqueio neuromuscular
Sistema Cardiovascular
Diminuição do ritmo cardíaco e força de contração Diminuição do débito cardíaco
Aumento da resistência vascular periférica com aumento da pressão arterial
Sistema respiratório
Contração do músculo liso brônquico podendo provocar broncospasmo e hipóxia, com possível paragem respiratória Estimulação das glândulas brônquicas
Sistema Urinário
Aumento da atividade motora da bexiga e relaxamento do esfíncter Risco de incontinência
Sistema Gastrointestinal
Em doses baixas: Aumento da motilidade esofágica e gástrica, aumento da produção de secreções e relaxamento dos esfíncteres Em doses elevadas: vómitos e diarreia
Olho (Por aplicação
local)
Constrição do esfíncter pupilar e dos músculos ciliares que culmina em contração da pupila e bloqueio do reflexo de acomodação. Se a pressão intraocular (PIO) estiver elevada, geralmente esta baixa por ocorrer um maior extravasamento do humor aquoso
26 Glândulas
secretoras
Aumento da atividade de todas as glândulas secretoras inervadas por fibras pós ganglionares colinérgicas: brônquicas, salivares, sudoríparas, lacrimais, gástricas, intestinais e pancreáticas
2.1.3.4 Utilizações Clínicas
Os ChEIs são utilizados no tratamento de patologias ou distúrbios do olho (ex. glaucoma), do trato gastrointestinal e urinário, das junções neuromusculares (ex. Miastenia gravis e outros tipos paralisias neuromusculares), bem como no tratamento da DA e de outras doenças neurodegenerativas.37
O glaucoma é uma patologia caracterizada pelo aumento da pressão intraocular. Os ChEIs diminuem esta pressão por provocarem constrição do corpo ciliar facilitando o extravasamento do humor aquoso. Atualmente, os ChEIs têm vindo a substituídos por bloqueadores β e derivados de prostaglandinas, aplicados topicamente.37,47
Ao nível do trato urinário e do trato gastrointestinal, os ChEIs podem ser utilizados em situações de carácter não obstrutivo que envolvam depressão da atividade do músculo liso, como o íleo pós-operatórioV e o megacólon congénitoVI. Estes fármacos constituem,
também, uma alternativa terapêutica no tratamento do refluxo esofágico por aumentarem o tónus do esfíncter esofágico.37 Dos ChEIs, a Neostigmina é a mais utilizada nestas situações podendo ser administrada por via subcutânea (SC), intramuscular (IM) ou intravenosa (IV)14. A administração de ChEIs na presença de obstrução mecânica origina um agravamento dos sintomas com possível perfuração do intestino como resultado do aumento da pressão, pelo que é contraindicada a utilização desta classe de fármacos em patologias de carácter obstrutivo.37,40
A Miastenia gravis é uma doença autoimune que afeta as junções neuromusculares do músculo-esquelético, caracterizada por períodos alternados de exacerbação e de remissão dos sintomas. Nesta patologia, o organismo produz anticorpos contra a principal região imunogénica das subunidades α1 dos recetores nicotínicos. Estes anticorpos diminuem a função dos recetores e são detetados em cerca de 85% dos doentes que sofrem desta patologia. 48
A sintomatologia mais frequente inclui ptose (queda da pálpebra superior), diplopia (visão dupla), afonia, disfagia, e fadiga extrema. Nos casos mais severos a
V Íleo pós - operatório -atonia ou paralisia do estômago ou bexiga após uma intervenção cirúrgica.37
27 Miastenia gravis pode afetar todos os músculos, incluindo os implicados nos processos da respiração.48 Os ChEIs utilizados no tratamento de longa duração desta patologia são:
a Piridostigmina e a Neostigmina.40,49 Os ChEIs são também utilizados no diagnóstico
desta patologia, utilizando-se para este fim o Edrofónio, devido ao seu rápido início de ação. Considera-se que o indivíduo sofre de Miastenia gravis se se observar uma melhoria significativa da força muscular, após administração de Edrofónio, que dure aproximadamente cinco minutos. 37,40
Os ChEIs apresentam, como foi referido, diversas indicações terapêuticas, no entanto nenhuma foi tão explorada como a sua utilização na terapêutica de patologias neurodegenerativas, principalmente na terapêutica da DA. Novos estudos têm sugerido um efeito benéfico da utilização destes compostos noutras doenças neurodegenerativas como a DP e demência por corpos de LewyVII (DCL).50,51
2.1.3.4.1 Doença de Alzheimer (DA)
A DA é o principal tipo de demência, representando 60 a 70% dos casos. Esta patologia caracteriza-se por uma perda progressiva das capacidades cognitivas e memória que podem culminar num estado vegetativo completo. 37,52 A DA atinge principalmente
indivíduos com mais de 65 anos e caracteriza-se por uma redução acentuada e repentina da capacidade cognitiva, da qual resulta uma significativa incapacidade dos doentes. 11
Segundo o relatório elaborado em 2013 pela associação Alzheimer’s Disease International, a prevalência desta e de outros tipos de demência têm vindo a aumentar.8 Também o número de mortes relacionadas com a DA tem aumentado nos últimos anos, sendo que atualmente esta patologia constitui a sexta principal causa de morte, por doença, nos Estados Unidos da América. 53 Em Portugal, estima-se que 153 000 pessoas vivam, atualmente, com esta demência. 54
A etiologia da DA é complexa, estando envolvidos tanto fatores genéticos como fatores ambientais.17 A nível fisiopatológico caracteriza-se por um aumento dos depósitos do péptido β-amilóide (Aβ) e emaranhados neurofibrilares de proteína TauVIII no córtex cerebral, que conduzem à formação de placas extracelulares e lesões vasculares. Ocorre
VII Demência por corpos de Lewy – Demência caracterizada por flutuação cognitiva, alucinações visuais e parkinsonismo espontâneo.182
VIII Proteína Tau – Proteína presente no sistema nervoso central que tem como função estabilizar os microtúbulos. Uma deficiência na proteína Tau resulta na destabilização dos microtúbulos e consequente formação de emaranhados neurofibrilares neurotóxicos.61
28 uma perda progressiva de neurónios, especialmente dos neurónios colinérgicos com afinamento do córtex cerebral. 37
Baseadas nesses marcadores neuropatológicos, duas hipóteses principais foram propostas, com a finalidade de identificar a sua etiologia. De acordo com a hipótese da cascata amilóide, a neurodegeneração na DA inicia-se com a clivagem proteolítica da proteína precursora amilóide e resulta da produção, agregação e deposição do péptido Aβ. De acordo com a hipótese colinérgica, a disfunção do sistema colinérgico é suficiente para produzir o défice de função cognitiva apresentado pelos doentes com DA. 55
Recentemente, fatores como o excesso de metais e o stress oxidativo têm sido, também eles, relacionados com a destruição dos neurónios colinérgicos e consequente degradação da transmissão colinérgica.56,57
Tem sido proposto que a transmissão colinérgica no SNC está envolvida no processamento cognitivo da memória, na atenção/concentração e na capacidade de detetar e selecionar estímulos relevantes. 15,58 O défice de transmissão colinérgica induz no doente estados de inquietação, ansiedade, confusão e em alguns casos alucinações.55 Sendo a DA uma doença multifatorial em que ocorre a degeneração de múltiplas vias de neurotransmissores torna-se difícil identificar de forma isolada a sintomatologia do défice de transmissão colinérgica.55
Diversas abordagens terapêuticas têm sido exploradas na DA, no entanto, apenas existem quatro fármacos aprovados para o tratamento da patologia nos Estados Unidos da América e na Europa. Estes constituem, apenas, tratamentos sintomáticos que não evitam ou revertem a progressão da doença. Três desses fármacos são ChEIs (galantamina, donepezilo e rivastigmina), enquanto o quarto fármaco, a memantina, modula por sua vez, os recetores N-metilo-D-ácido aspártico (NMDA).10
A inibição da AChE e da BChE, pelos ChEIs, aumenta a concentração de ACh na fenda sináptica permitindo uma maior interação desta com o recetor. De forma direta, estes fármacos reduzem os sintomas supracitados, associados à deficiente neurotransmissão colinérgica.15
O benefício clínico dos ChEs é modesto. Este fator aliado à ocorrência de efeitos adversos consideráveis e à ausência de mecanismos modificadores da patogénese da DA tem direcionado a investigação no sentido da descoberta de novas abordagens terapêuticas. 10,16,59
29 As recentes abordagens descritas na literatura ao desenvolvimento de novos fármacos incidem na utilização de anticorpos, inibidores da secretaseIX, moduladores do
cobre e do zinco, inibidores da agregação da proteína Tau e em produtos naturais e vitaminas. 10 Apesar dos esforços evidenciados, a maior parte dos compostos estudados não chegam a ser comercializados por não demostrarem superioridade terapêutica face às alternativas existentes. 60
Atualmente, tem sido também estudado o possível papel dos ChEIs não só no tratamento da sintomatologia, mas também na patogénese da DA. Neste contexto, foi demonstrado que os ChEIs interferem com a produção do péptido Aβ, reduzindo a sua toxicidade e, consequente, a progressão da doença. 58
A evidência de que os ChEIs interferem com a patogénese da DA e o facto de os ChEIs continuarem a ser a terapêutica de eleição numa patologia tão prevalente e debilitante como a DA, suportam a investigação que vem sendo realizada nesta área. Os compostos naturais, como os compostos fenólicos, têm merecido um papel de destaque nesta vertente pelo facto da maior parte dos ChEIs existentes ser de origem natural (ex. galantamina) ou sintetizados com base em compostos naturais (ex. rivastigmina). 17 2.1.3.4.2 Outras Doenças Neurodegenerativas
A utilização de ChEIs noutras doenças neurodegenerativas está relacionada com o aumento dos níveis de ACh, no sistema nervoso, promovido por estes compostos.50,61
A DP, outrora considerada uma desordem motora, é atualmente reconhecida como uma patologia que envolve uma série de sintomas não-motores como défice cognitivo, depressão, psicose e disfunção do SNA. Tendo presente a influência da neurotransmissão colinérgica nos sintomas cognitivos, foi testada a utilização de ChEIs nestes doentes, e hoje em dia, a rivastigmina encontra-se aprovada para o tratamento de demência ligeira a moderadamente grave em doentes com DP idiopática.46,51
Um estudo desenvolvido por Cardoso & Teixeira em 2005 indica que os ChEIs são seguros e eficazes no tratamento dos sintomas cognitivos e psiquiátricos, como alucinações, delírios, apatia e ansiedade, em doentes com DCL.50
30 Os ChEIs têm ainda sido utilizados off-labelX no tratamento dos sintomas
cognitivos e comportamentais em taupatiasXI, um conjunto bastante heterogéneo de
desordens neuropsiquiátricas que frequentemente são diagnosticadas como Síndrome de Parkinson Atípico.61 A crescente utilização destes fármacos noutras patologias que não a DA revela-se também um estímulo importante para a investigação nesta área.
X Off-label – Utilização de um medicamento para uma indicação/doença/doente diferente das indicações aprovadas ou em populações não estudadas (ex. pediátricas) ou, ainda, utilizando vias de administração e dosagens não aprovadas.183
XI Taupatias – Classe de doenças neurodegenerativas caracterizadas pela agregação patológica da proteína Tau. 61
31
32
3.1. Tirosinase (TYRO)
A TYRO (EC.1.14.18.1) também denominada de fenolase, difenol oxidase, catecolase, orto-difenol oxidase, monofenol oxidase, cresolase entre outros, foi descoberta em cogumelos por Schoenbein em 1856. 62 Esta é uma proteína de cobre do tipo III, encontrada numa grande variedade de organismos, bactérias, fungos, plantas, insetos, crustáceos e mamíferos, estando envolvida na síntese da melanina. 19.
De acordo com as reações que catalisam, as enzimas pertencentes à família das tirosinases classificam-se em tirosinases (cresolases ou monofenolase/monofenol oxidase) ou em catecolases (catecol oxidases ou difenolase/difenol oxidase). As primeiras catalisam a o-hidroxilação de monofenóis e a oxidação dos o-difenóis resultantes, enquanto as segundas apenas realizam o segundo passo, a oxidação de o-difenóis. 62,63
A nomenclatura da TYRO torna-se bastante complexa devido ao facto desta enzima poder atuar das duas formas, dependendo da estrutura do substrato.
3.1.1. Análise Estrutural e Localização Celular
A TYRO humana é codificada pelo gene tirosinase, TYR, localizado no braço-longo do cromossoma 11 na posição 14.3. É constituída por uma sequência de 529 aminoácidos que sofre posteriormente um processo de maturação. 64 Esta enzima pertence à família das tirosinases, tal como as catecol oxidases e as hemocianinas.63 As proteínas desta família têm em comum um sítio ativo altamente conservado constituído por dois iões de cobre, cada um coordenado com três histidinas. 65 Apesar do sítio ativo altamente conservado e partilhado pelos diferentes membros da família, tem sido proposto que não existe uma TYRO comum, sendo que as tirosinases isoladas de animais, plantas e fungos diferem no tamanho, nas sequências de aminoácidos, no grau de glicolisação, na ativação e na localização celular.63,65
A enzima no organismo humano encontra-se localizada na membrana dos melanócitos presentes na pele, olhos e folículos capilares. Ao nível intracelular a TYRO localiza-se maioritariamente na membrana dos melanossomasXII. No entanto, já foi também isolada das frações solúveis do reticulo endoplasmático, dos ribossomas e do aparelho de Golgi. 66
33 Esta é uma enzima multifuncional envolvida nos primeiros dois passos na melanogénese dos mamíferos e na oxidação enzimática que se verifica nos frutos e outros alimentos.6
3.1.2. Mecanismo de Catálise
A TYRO catalisa tanto a reação de hidroxilação de monofenóis a o-difenóis como a sua posterior oxidação a o-quinonas, utilizando neste processo oxigénio molecular. 62
Durante o processo de catálise, ao centro ativo da TYRO liga-se oxigénio molecular formando-se oxi-TYRO (Composto 1, Fig. 2.1). 67 Posteriormente, a oxi-TYRO catalisa a formação de o-quinonas por dois mecanismos (Fig. 3.1): pela oxidação de catecóis (atividade de difenolase) ou pela o-hidroxilação de fenóis (atividade de monofenolase) com posterior oxidação dos o-difenóis resultantes. Fenóis como a tirosina são primeiro hidroxilados a o-difenóis que são posteriormente oxidados a o-quinonas com a formação de desoxi-tirosinase (Composto 2, Fig. 3.1), que se liga a oxigénio molecular para formar novamente oxi-TYRO (via A, Fig. 3.1). Por sua vez, a oxidação de catecóis (via B, Fig. 3.1) conduz à formação de o-quinonas e meta-TYRO (Composto 3, Fig. 2.1). A redução da m-TYRO por uma segunda molécula de catecol dá origem a desoxi-TYRO, que por ligação a oxigénio molecular produz oxi-TYRO completando o ciclo. 19,68.
Recentemente propôs-se que, para além dos catecóis servirem de substratos de oxidação para a oxi-TYRO, estes podem também servir de substratos para a monoxigenação (via B, Fig. 3.1). Neste caso o substituinte hidróxilo do substrato pode desprotonar resultando numa eliminação redutiva do cobre, com formação irreversível de TYRO inativa (composto 4, Fig. 3.1). 68
34 Figura 3.1- Ciclo reativo catalisado pela tirosinase. Adaptado de Ramsden et al., 2009 68
3.1.3. Papel da Tirosinase na Produção das Melaninas
As melaninas constituem um grupo bastante heterogéneo de polímeros. Estas derivam da oxidação de fenóis e da posterior polimerização destes últimos, bem como das quinonas resultantes do processo de oxidação. As melaninas estão presentes em diferentes composições, cores, tamanhos e funções em todos os seres vivos. Desta forma, as melaninas podem ser classificadas, de acordo com a sua origem, em: melanina dos animais, melanina das plantas, melanina dos fungos, melanina das bactérias e melanina sintética. As unidades fenólicas dos polímeros, bem como as propriedades das enzimas oxidases necessárias para a produção do polímero são bastante diferentes.69,70
Existem dois tipos de melanina animal, a eumelanina e a feomelanina, ambas produzidas a partir da L-Tirosina (Fig. 3.2) pela ação da TYRO. A eumelanina confere cores escuras, do castanho ao preto. Pequenas quantidades desta melanina concedem a cor cinzenta característica dos cabelos dos idosos. A feomelanina, por sua vez, é responsável pela coloração de amarelo a vermelho.71,72
35 Figura 3.2 - Estrutura química da L-Tirosina.73
Destas melaninas, a eumelanina é a mais abundante em humanos, principalmente em indivíduos de tez escura. Para além da pele e dos pêlos, estas melaninas também fazem parte dos tecidos da íris e da estria vascular do ouvido interno.69 A concentração e distribuição destes dois pigmentos determinam a cor dos pêlos, olhos e pele. 74
A neuromelanina é um pigmento de coloração escura que pode ser encontrado em certas regiões do cérebro e da glândula adrenal de alguns mamíferos. Presume-se que este pigmento desempenhe um papel chave na regulação da apoptoseXIII, na neurodegeneração e na DP. 72
Nas plantas, os percursores mais comuns da melanina são catecóis. Na biossíntese deste tipo de melanina estão envolvidas as catecol oxidases e a TYRO, as oxidases de fenóis mais frequentes no reino das plantas.20,69 A melanina presente nas plantas é denominada de alomelanina e a sua cor alterna de acordo com a natureza do substrato. Esta melanina é o pigmento responsável pelo escurecimento não-enzimático que ocorre nos frutos e plantas após a sua colheita.6
A melanina, pela sua localização e função nos seres vivos, desempenha uma enorme diversidade de funções. No entanto, a mais relevante prende-se com a proteção conferida às células contra “danos exteriores” de natureza diversa. 69 Neste contexto, a
melanina tem um elevado interesse biomédico devido às suas propriedades fotoprotetoras. A eumelanina, em particular, apresenta um amplo espectro de absorção-UV sendo capaz de dissipar 90% da energia proveniente da radiação solar sob a forma de calor. Desta forma, a melanina protege as células dos efeitos nefastos da exposição solar.75
A exposição da epiderme à radiação solar conduz a uma acrescida produção de melanina que promove um aumento da fotoproteção acompanhado do efeito bronzeado
36 (escurecimento da pele). 75 Para além do papel fotoprotetor, as melaninas atuam como
sequestradores de ROS e quelantes de iões, protegendo as células do stress oxidativo e da acumulação de iões metálicos citotóxicos. 69 Alterações na produção de melanina
conduzem a desordens denominadas de híper ou hipopigmentação. 66,69 Devido ao seu envolvimento na síntese da melanina, a inibição da atividade da TYRO tem sido um dos principais alvos na terapêutica ou profilaxia de condições de hiperpigmentação como as manchas resultantes da idade. 70
A TYRO é uma enzima chave no que diz respeito à biossíntese das melaninas superficiais (eumelanina e feomelanina), nos animais. 66 Diversos estudos indicam que a TYRO poderá também estar envolvida na síntese de neuromelanina, uma melanina associada a neurónios vulneráveis e mais suscetíveis ao desenvolvimento de patologias neurológicas. 22,72
Após ser sintetizada, a TYRO sofre um primeiro processo de maturação no reticulo endoplasmático e um segundo no complexo de Golgi. Posteriormente, é transportada para organelos específicos, os melanossomas, onde a melanina é sintetizada e armazenada. Na pele e nos pêlos, os melanossomas são transferidos para células vizinhas, os queratinócitos, pelas quais se distribuem conferindo-lhes cor.70
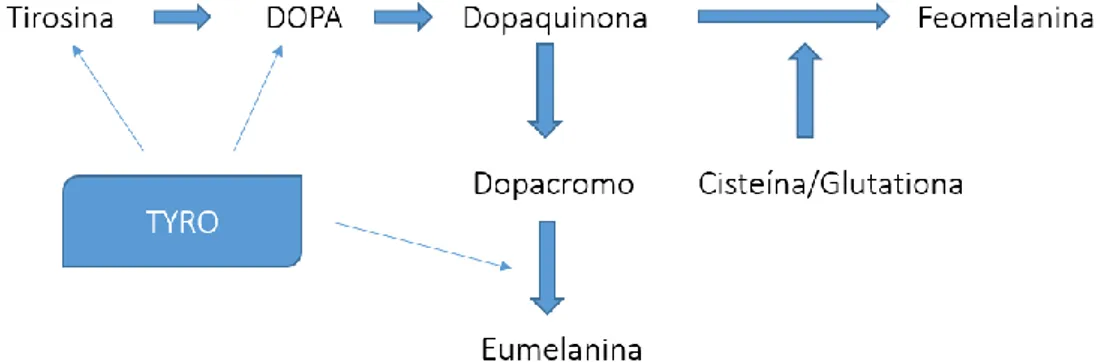
A biossíntese da melanina, representada na Fig. 3.3, ocorre no interior dos melanossomas. A TYRO catalisa as primeiras reações, nomeadamente, a oxidação de L-tirosina a dihidroxifenilamina (L-DOPA) e desta última a dopaquinona. 70 A partir da
dopaquinona formam-se a feomelanina ou eumelanina de acordo com a presença ou ausência de cisteína e/ou glutationa, respetivamente. 76,77
Figura 3.3 - Via biossintética de formação da melanina, com destaque para os passos catalisados pela tirosinase. Adaptado de Kobayashi et al., 1995 76 TYRO – Tirosinase.
37 Por catalisar a etapa limitante desta via biossintética, a TYRO tem sido o alvo do desenvolvimento de abordagens terapêuticas e profiláticas com o objetivo de tratar ou prevenir problemas associados a desordens na pigmentação da pele. 70,78
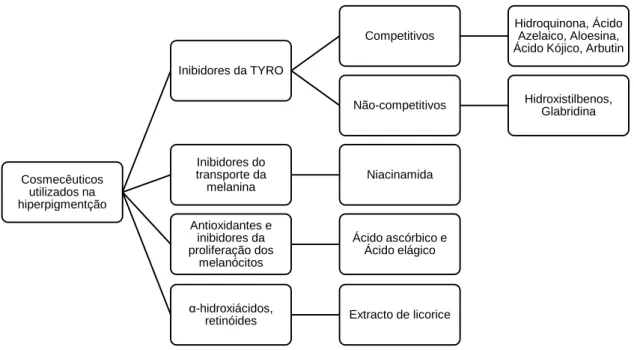
3.1.4. Inibidores da TYRO
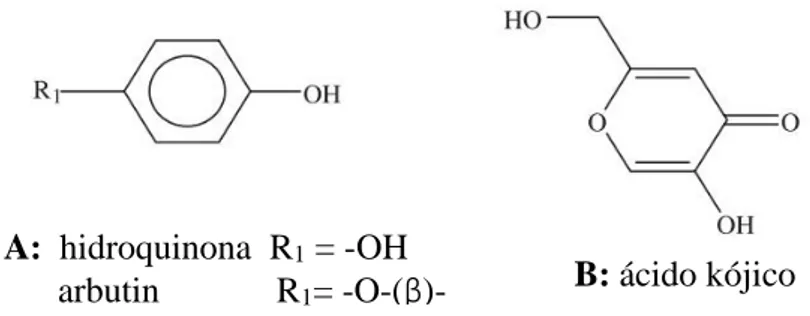
Diversos inibidores da TYRO encontram-se descritos na literatura. No entanto, os mais utilizados em formulações farmacêuticas ou em produtos de cosmética e de higiene corporal (PCHC) são o ácido kójico, a hidroquinona, o arbutin, aloesina e o 4-n-butil-resorcinol. 6,71
A hidroquinona (A, Fig. 3.4.) é um composto fenólico inibidor da TYRO bastante conhecido e muito utilizado na prática clínica. O efeito despigmentante deste composto deve-se, não só, à forte inibição da TYRO, mas também a alterações provocadas nos melanossomas, à depleção de glutationa e à produção de espécies reativas de oxigénio (ROS) que, em última instância, promovem degradação oxidativa da célula. 71,79
Aquando da sua descoberta e devido à sua eficácia, a utilização deste composto como despigmentante aumentou de forma brusca. Apesar dos benefícios relacionados com a redução da hiperpigmentação, efeitos adversos como a hipomelanose permanente (ausência parcial de melanina) ou a amelanose (ausência total de melanina) foram relatados. Por estes motivos, a concentração máxima em PCHC’s permitida passou a ser de 2%. 74
Apesar de a hidroquinona continuar a ser o despigmentante de referência no tratamento da hiperpigmentação, atualmente, por motivos de segurança, a dispensa deste fármaco só é realizada mediante apresentação de receita médica.74 Em Portugal, a hidroquinona é comercializada sob a forma de gel e creme 40mg/mL, Hidrospot80 e
Pigmentasa81, respetivamente.14
O 4-resorcinol é um composto difenólico inibidor da TYRO que após metabolização origina quinonas reativas. O seu efeito despigmentante é então resultado da inibição da síntese da melanina, bem como da destruição dos melanócitos provocada pelas quinonas reativas formadas. Diversos estudos referem que a aplicação tópica deste composto em formulações a 0,3% tem efeitos benéficos no tratamento do melasma e na redução da hiperpigmentação inflamatória verificada após terapia com laser. 74,82
38 Atualmente, a aloesina e o arbutin (A, Fig. 3.4), um β-glicósido natural da hidroquinona, são utilizados na indústria cosmética pelo seu poder despigmentante via inibição da TYRO71. Estes foram isolados das folhas da Gvae grsi e da Aloe vera,
respetivamente.77
O ácido kójico (B, Fig. 3.4) é um forte inibidor da TYRO, mas apresenta alguns efeitos adversos sendo o mais relevante o desenvolvimento de alergias. A monoterapia com este fármaco revelou benefícios modestos pelo que têm sido sintetizados derivados com maior estabilidade, bem como uma penetração cutânea mais eficiente. 6,83
Figura 3.4 - Estruturas químicas da hidroquinona, arbutin e ácido Kójico. Adaptado de Solano et al., 2006. 74
3.1.4.1. Utilizações Alimentares e Clínicas
A aparência é um dos atributos que é tido em consideração pelos consumidores quando pretendem adquirir um produto alimentar, principalmente, no que se refere às frutas, vegetais e marisco. Entre os diversos aspetos que influenciam a aparência, a cor é um dos que mais determinam a decisão dos consumidores. O escurecimento deste tipo de alimentos torna-os menos apetecíveis e geralmente está associado a uma alteração do sabor e/ou amolecimento do produto em questão. 20,84
O escurecimento pode ocorrer por dois processos distintos: oxidação não-enzimática e oxidação não-enzimática. Inibidores da TYRO têm especial interesse na inibição do escurecimento enzimático. 71
Quando as frutas e vegetais são descascados, cortados, ou sofrem outro tipo de agressão física ocorre rutura da estrutura celular. Esta rutura coloca em contato a TYRO com os seus substratos fenólicos, que na presença de oxigénio, reúne as condições necessárias para o início do processo de oxidação enzimática. O grau de escurecimento depende da concentração e atividade da TYRO, da concentração dos compostos fenólicos, do oxigénio disponível, do pH, da temperatura, entre outros fatores. 6,71,84
A: hidroquinona R1 = -OH
arbutin R1=
-O-(β)-Glucose
39 A oxidação enzimática dos alimentos pode ser diminuída através da aditivação de agentes redutores ou de inibidores enzimáticos. No entanto, poucos são os inibidores enzimáticos utilizados devido a possíveis alterações no sabor, a questões de segurança alimentar ou mesmo por inviabilidade financeira. 20
Anteriormente, a indústria alimentar recorria a compostos contendo sulfitos para prevenir o processo de escurecimento referido. Estes compostos, para além de conferirem um paladar desagradável aos alimentos, foram associados ao desenvolvimento de alergias, pelo que a entidade reguladora dos Estados Unidos da América, a Food and Drug Administration (FDA) proibiu a sua utilização em géneros alimentícios. 20,77 Em resposta, a indústria alimentar investiu na utilização de compostos redutores, como o ácido ascórbico ou o ácido cítrico, utilizados como antioxidantes. Estes compostos reduzem as o-dopaquinonas formadas pela TYRO, diminuindo, consequentemente a formação do pigmento responsável pelo escurecimento dos alimentos. No processo de redução, estes ácidos vão sendo consumidos pelo que o efeito antioxidante é mais modesto comparativamente ao dos compostos à base de sulfitos.84
Recentemente, o 4-hexilresorcinol, um forte inibidor da TYRO, foi introduzido para prevenir a melanogénese em camarões, bem como a oxidação enzimático em frutas cortadas, frescas ou secas.77 No entanto, e sem alternativas viáveis disponíveis o ácido
ascórbico e cítrico continuam a ser os compostos mais utilizados atualmente. 84
Sendo a segurança um aspeto fundamental, quando se trata de géneros alimentares, a investigação de novos inibidores da oxidação enzimática, mais efetivos e seguros, tem sido uma área de destaque. A investigação tem incidido principalmente nos compostos de origem natural presentes na dieta humana, por se encontrarem, associados a poucos efeitos adversos. 77
Apesar da crescente utilização dos inibidores da tirosinase na indústria alimentar, a indústria cosmética continua a ser a área que mais investiga, desenvolve e aplica este tipo de compostos. 6
Conforme supracitado, a melanina desempenha um papel crucial na proteção da pele contra os efeitos da exposição nociva aos raios UV, assim como na destoxificação de fármacos e de ROS.74
Apesar do seu efeito benéfico, a acumulação anormal de melanina em localizações específicas do corpo constitui um problema do foro estético. Esta acumulação pode culminar no desenvolvimento de sardas, cicatrizes de acne pigmentadas e de outras
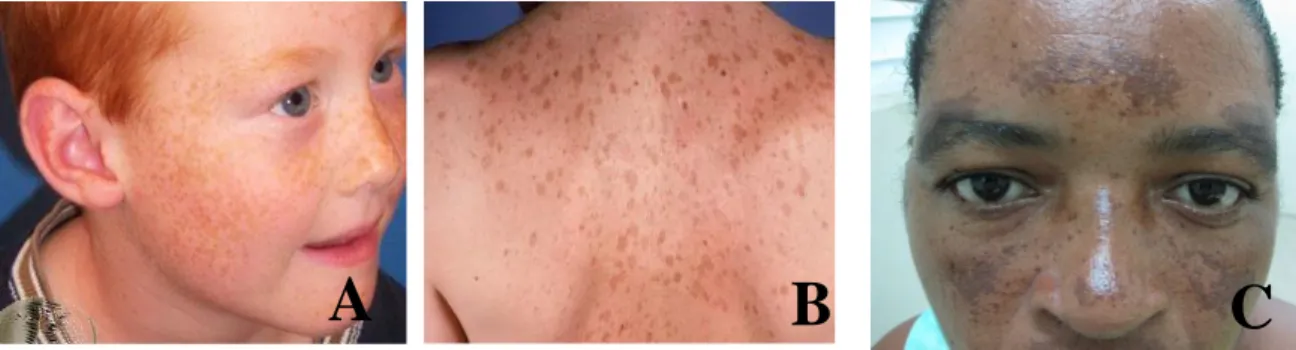
40 patologias como o Melasma e o Lentigo.79,85 A Fig. 3.5 ilustra alguns exemplos de
situações provocadas pela acumulação excessiva de melanina. 86–88
Figura 3.5 - Fotografias ilustrativas das principais manifestações da acumulação excessiva de melanina. Adaptado de Eastern et al., 2014; Logical Images Inc., 2008; The DermNet New Zealand Trust, 2014. 86–88 A- Sardas, B- Lentigo, C-Melasma.
Segundo Solano et al. 2006, as patologias relacionadas com a pigmentação representam a terceira causa mais comum de patologias dermatológicas e infligem nos doentes acentuados problemas psicossociais.74
As sardas consistem em manchas planas de cor acastanhada que se manifestam, principalmente, na face, mas também podem surgir noutras zonas do corpo, frequentemente expostas à radiação solar. Este problema dermatológico tem origem hereditária, manifesta-se com maior prevalência em indivíduos de tez clara, especialmente ruivos, no entanto, pode também afetar indivíduos de tez escura.86,89
O melasma, por sua vez, caracteriza-se por uma coloração castanha ou castanha-acinzentada da pele como resultado da acumulação anormal de melanina. Geralmente afeta indivíduos do sexo feminino, especialmente com residência em regiões de elevada exposição à radiação UV intensa. As causas subjacentes ao desenvolvimento desta patologia encontram-se por elucidar, no entanto, supõe-se que esta seja de etiologia multifatorial. Trata-se de uma patologia de difícil tratamento devido à sua natureza refratária e recorrente. 82,90
O lentigo caracteriza-se pela presença de lentigens (máculasXIV hiperpigmentadas). As lentigens podem ocorrer em qualquer parte do corpo, sendo particularmente comuns em indivíduos ruivos e de tez clara. Quanto à sua etiologia, destaca-se a exposição excessiva aos raios UV como principal responsável pela maior
XIV Máculas – Manchas ou alterações circunscritas da cor da pele, detetáveis apenas, através da visão, uma vez que não apresentam relevo.