Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
Evolução do Nicho Climático como Modelador do Padrão de Distribuição das
Espécies de Formicivora, Swainson, 1824
Evolution of the Climate Nich as Modeler of the Distribution Pattern of the
Species of Formicivora, Swainson, 1824
DOI:10.34117/bjdv6n8-183
Recebimento dos originais: 08/07/2020 Aceitação para publicação: 13/08/2020
Viviane Micaela Canuto Medeiros
Mestre em Ciências Florestais, área de concentração Ecologia e manejo dos recursos florestais- Universidade Federal de Campina Grande/ CSTR
Endereço: Laboratório de Pesquisa em Ensino, Zoologia e Conservação/ UACB/ CSTR/ UFCG E-mail: vivianecanuto54@gmail.com
Erich de Freitas Mariano
Doutor em Ciências Biológicas, área de concentração Zoologia, pela Universidade Federal da Paraíba
Instituição: Universidade Federal de Campina Grande
Endereço: Laboratório de Pesquisa em Ensino, Zoologia e Conservação/ UACB/ CSTR/ UFCG E-mail: efmariano.ufcg@gmail.com
RESUMO
A associação entre informações históricas (filogenéticas) e ecológicas (análises de nicho) fornece uma referência completa sobre os fatores que atuam como determinantes no que se refere à distribuição dos organismos. Nesse estudo verificamos através de uma abordagem macroecológica (conservadorismo de nicho) o padrão de ocupação de nicho climático das espécies do gênero Formicivora. Para tanto utilizamos variáveis climáticas a partir do Wordclim e registros de ocorrência georreferenciados do Xenocanto, Wikiaves e revisão de literatura. As análises de nicho foram conduzidas no software R 3.0.3. As condições climáticas foram investigadas utilizando a técnica do PCA (Análises dos Componentes Principais), o qual indicou as variáveis que tem maior influência na distribuição do gênero são Bio2 (média mensal, temperatura máxima e mínima) e Bio12 (precipitação anual). Testes de equivalência e similaridade de nicho (D Schoener) foram computados e mostraram que as espécies de Formicivora ocupam nichos diferentes e apresentam baixa similaridade (o valor máximo obtido a partir do teste D foi 0,41). Utilizando uma árvore gerada por inferência bayesiana foi calculado o estado ancestral para todas as variáveis climáticas utilizadas nas comparações supracitadas. De acordo com os resultados, é possível que durante a diversificação do gênero, as espécies tenham experimentado diferenciação no nicho, até estabelecer o nicho atual.
Palavras-chave: Conservadorismo de nicho, WorldClim, Biogeografia de aves. ABSTRACT
The association of historical (phylogenetic) and ecological (niche analysis) information provides a complete reference concerning factors that are determinant referring to the organisms distribution. In this study, we verified through a macroecological (niche conservatism) approach the occupation pattern of a climatic niche of species from the Formicivora genus. For this purpose, we used climatic
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
variables from Worldclim and georeferenced occurrence registers from Xenocanto, Wikiaves, besides a review of literature. The niche analysis were conducted in the software R 3.0.3. The climate conditions were examined using the PCA technique (Principal Component Analysis), which indicated that the variables which mostly influence the genus distribution are Bio2 (monthly rate, maximum and minimum temperature) and Bio12 (annual precipitation). Equivalence and similarity niche tests were calculated and showed that species from Formicivora use different niches and have low similarity (the maximum value for the D test was of 0,41). Using a tree generated by bayesian inference, we calculated the ancestor state for all the climate variables used for the comparisons previously mentioned. According to the results, it is possible that during the diversification process of the genus, the species might have experienced differentiation in the niche, until establishing the current niche.
Keywords: Niche conservatism, WorldClim, Bird biogeography.
1 INTRODUÇÃO
Os fatores e processos que levam aos padrões de distribuição das espécies correspondem a uma das questões mais intrigantes que os ecólogos e biogeógrafos objetivam responder (BROWN et al., 1996). No entanto, tornou-se aparente que os processos biogeográficos ocorrem em uma
conjuntura ecológica (WIENS & DONOGHUE, 2004, RICKLEFS, 2007), evidenciando a importância
do nicho e dos fatores históricos na determinação desses processos (MEDEIROS et al., 2015; Padisák
et al., 2016). Nesse contexto, é possível obter uma associação de informações históricas (filogenéticas) e ecológicas (análises de nicho), adquirindo assim uma referência completa sobre os fatores que atuam como determinantes no que se refere à distribuição dos organismos (WIENS & DONOGHUE, 2004, Kozak & Wiens, 2010; Seeholzer et al., 2017).
Cada espécie apresenta necessidades e suporta condições ecológicas específicas (HUTCHINSON, 1957) e a compreensão de seu padrão de distribuição está intimamente ligada aos diferentes graus de tolerância que cada espécie apresenta. Desta forma, o nicho é o parâmetro ecológico que caracteriza o ambiente favorável para o crescimento e desenvolvimento de uma espécie, considerando as condições que estejam dentro do seu limite de tolerância (RICKLEFS, 2007). Entender os modelos de distribuição dos organismos é um trabalho complexo e o conservadorismo de nicho é um dos processos macroecológicos que facilita essa compreensão (WIENS & DONOGHUE, 2004; Peixoto, Villalobos & Cianciaruso,2017). O conservadorismo de
nicho reflete a incapacidade adaptativa de uma população em expandir a área de distribuição a novas condições climáticas (WIENS, 2004). Esse processo determina as condições ambientais que um
grupo monofilético pode suportar, existindo a possibilidade de prever como as mudanças climáticas afetam esses táxons e suas respectivas distribuições (WIENS, 2011).
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
Estudos sobre evolução de nicho trabalham com a hipótese de conservadorismo, ou seja, a retenção de caracteres ao longo da evolução do grupo, tornando o nicho similar entre as espécies e consideram o nicho fundamental (PETERSON, 2011). Este compreende uma faixa ampla de condições que as espécies podem persistir e fornece informações sobre a distribuição potencial dos táxons (MEDEIROS et al., 2015; Sóberon & Arroyo-Peña, 2017).
Esses estudos são baseados em aspectos filogenéticos, dessa forma podem-se obter dados confiáveis sobre os fatores que moldam a distribuição, porém isso não implica dizer que existe uma relação direta entre similaridade filogenética e similaridade de nicho. Espécies que são próximas filogeneticamente podem ou não ter o nicho similar (KNOUFT et al., 2006). Com a atribuição de
referências filogenéticas numa análise macroecológica é possível identificar os processos evolutivos e os fatores ambientais que influenciaram no processo de distribuição espacial e diversificação do nicho (Wiens, 2011; Peixoto, Villalobos & Cianciaruso, 2017). Ao utilizarmos essas informações para a reconstrução do estado ancestral do nicho, conseguimos analisar se o conservadorismo ocorre ou não (MEDEIROS et al., 2015).
Alguns estudos têm encontrado resultados que contestam a ocorrência do conservadorismo do nicho, demonstrando que o nicho fundamental é evolutivamente lábil e susceptível a expansão ou à especialização a novas condições ambientais (LOSOS et al., 2003, GRAHAM et al., 2004). Nesse
contexto, concordamos com LOSOS (2008) quando é citado que pesquisas dessa natureza irão
contribuir diretamente para uma melhor compreensão a respeito da influência dos fatores ecológicos e evolutivos no padrão de distribuição geográfica das espécies.
O gênero Formicivora Swainson 1824, ave pertencente à família Thamnophilidae, é composto por 10 espécies de pequeno porte, evidente dimorfismo sexual, baixa capacidade de dispersão e apresenta ampla distribuição no Neotrópico. Os Thamnophilidae evoluíram no Neotrópico, em um período no qual ocorreram várias mudanças na geologia e no clima, e a América do Sul encontrava-se isolada de outros continentes. Essa instabilidade ambiental teve grande influência na distribuição desse grupo, principalmente devido aos eventos de transição que ocorreram entre o Mioceno e Plioceno tardio (BELMONT-LOPES, 2013).
O presente estudo verifica a sobreposição do nicho climáticos entre as espécies atuais do gênero Formicivora e avalia quanto o conservadorismo de nicho exerceu de influência na história do táxon através da reconstrução do estado ancestral de sua linhagem.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761 2 MATERIAL E MÉTODOS
Distribuição dos dados climáticos
As localidades de registros das espécies de Formicivora foram obtidas a partir de informações disponíveis em literatura, Xenocanto (http://www.xeno-canto.org/) e no Wikiaves (http://www.wikiaves.com.br/). Para as análises foram considerados apenas os registros georreferenciados – informações presentes no registro da base de dados ou informadas pelos autores. Todas as coordenadas foram verificadas e um mapa de distribuição foi confeccionado no QGIS 2.0.1 (QGIS Development Team, disponível em http://qgis.osgeo.org/)
De posse do mapa de distribuição das espécies, foram obtidos dados referentes à altitude e outras 19 variáveis bioclimáticas a partir do WorldClim em uma resolução de 2,5 arc-min, o que corresponde a aproximadamente 5km² (HIJMANS et al., 2005). Os valores referentes a essas variáveis
foram extraídos de toda a área de estudo, determinada pelo mínimo polígono convexo no qual estão inseridos todos os registros compilados.
Modelos de nicho ecológico foram construídos a partir dos pontos de ocorrência das espécies e seus respectivos dados climáticos. Todas as análises foram realizadas no software R 3.0.3 (R Core Team; available at http://www.r-project.org/) e os pacotes utilizados são descritos abaixo.
Todas as variáveis passaram por um teste de correlação e os cálculos foram conduzidos a partir dos valores extraídos dos pontos de registros ao longo da área de estudo, determinada pelo mínimo polígono convexo que engloba todos os registros das espécies. Essa análise levou a seleção de oito variáveis não correlacionadas (correlação de Sperman < 0.8) que melhor refletem as tolerâncias climáticas das espécies de Formicivora. São elas: Altitude (Alt), Temperatura média mensal (Bio2), Isotermalidade (Bio3), Precipitação anual (Bio12), Precipitação do mês mais seco (Bio14), Precipitação sazonal (Bio15), Precipitação do trimestre mais quente (Bio18) e Precipitação do trimestre mais frio (Bio19).
Formicivora paludicola, (Buzzetti, Belmonte-Lopes, Reinert, Silveira & Bornschein, 2014)
foi excluída das análises de comparação de nicho por apresentar baixo número de registros de ocorrência (somente três), o que poderia influenciar os resultados. Apesar de ter participado das comparações de nicho, Formicivora erythronotos (Hartlaub, 1852) foi excluída da reconstrução do estado ancestral por não apresentar sequência de DNA disponível no banco de dados do Genbank.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761 Quantificação e comparação do nicho
Comparações entre nove espécies de Formicivora foram realizadas para cada uma das oito variáveis climáticas selecionadas. Nesta análise comparativa, os valores das variáveis climáticas de todas as localidades de registro foram extraídos utilizando o QGIS.
Inicialmente as comparações foram feitas utilizando os testes de Kruskall-Wallis e Dunn. Utilizando o pacote sm 5.4 (BOWNMAN & AZZALINI, 2018) foi possível obter o “Species density plots”, no qual observamos a distribuição individual de cada uma das variáveis climáticas para cada uma das espécies, ou seja, as variáveis que tem maior influência na densidade populacional das espécies Em seguida, realizaram-se comparações multivariadas com todos os pares de espécies. Nessas comparações, a sobreposição de nicho entre os taxóns foi quantificada usando a função PCA-env do pacote ecospat (BROENNIMANN et al., 2012). Os dois primeiros eixos do PCA foram utilizados para calibrar o espaço climático que inclui todas ocorrências do gênero. O índice D de Schoener para estimar a sobreposição de nicho também foi calculado (SCHOENER, 1970, BROENNIMANN et al., 2012). Testes estatísticos para estimar a equivalência e similaridade de nicho foram realizados utilizando 100 repetições par a par (ver WARREN et al., 2008 para detalhes), também através do pacote ecospat.
Relação entre a distância filogenética e a sobreposição de nicho
O teste de Mantel foi utilizado para verificar se existe correlação entre sobreposição de nicho e a distância filogenética do gênero Formicivora. Essa análise foi conduzida pelo pacote vegan 2.5-4 (OKSANEN et al., 2019) e utilizou a matriz com os valores do teste D Schoener nas comparações par a par entre as espécies.
Reconstrução do estado ancestral das variáveis climáticas
Foi utilizado o pacote phytools 0.3-93 (REVELL, 2012) para a reconstrução do estado ancestral de cada uma das variáveis do nicho climático e verificação da sua evolução em cada uma das espécies estudadas. Nós utilizamos uma árvore bayesiana de Formicivora derivada do gene mitocondrial NADH Desidrogenase subunidade 2 (ND2). A hipótese filogenética utilizada consistiu em um cronograma consenso que inclui um indivíduo de oito das 10 espécies do gênero. Os parâmetros para as estimativas filogenéticas seguiram IRESTEDT et al. (2004). A partir da hipótese filogenética construída, valores médios para cada uma das variáveis climáticas foram estimados e representados por um gradiente de cor.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761 3 RESULTADOS
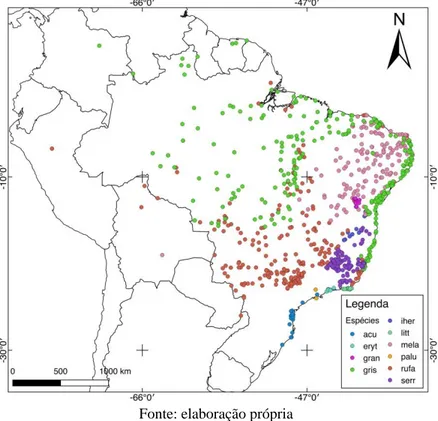
Foram compilados 830 registros das espécies do gênero Formicivora a partir dos diferentes bancos de dados analisados (Fig. 1). A ampla distribuição de Formicivora grisea (Boddaert, 1783),
Formicivora melanogaster (Pelzeln, 1868) e Formicivora rufa (Wied, 1831) fazem com que o
gênero ocorra em diferentes paisagens, desde áreas secas até florestas úmidas, tanto em áreas litorâneas, quanto em formações florestais de montanha.
Figura 1: Mapa de distribuição de Formicivora, indicando as localidades de ocorrência compiladas para cada uma das 10 espécies do gênero. Os nomes das espécies de Formicivora foram abreviados utilizando as quatro primeiras letras do epíteto específico.
Fonte: elaboração própria
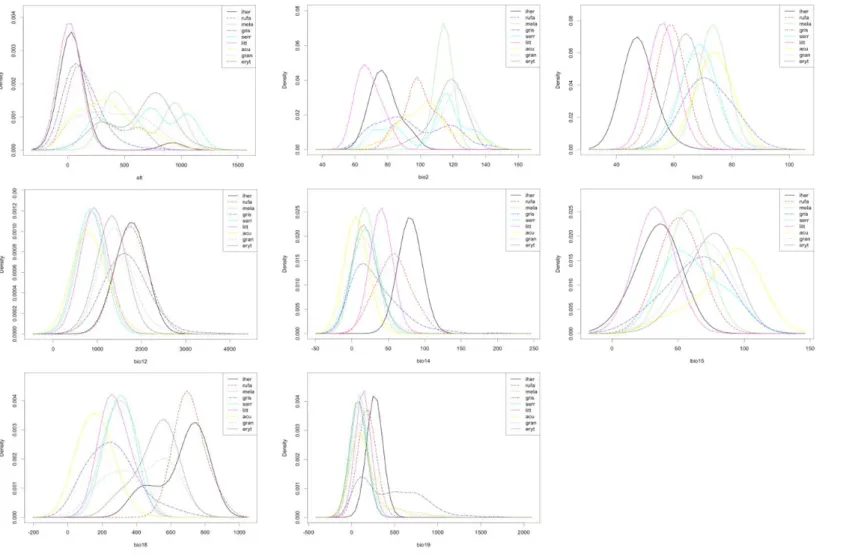
Essa variedade de paisagens proporciona um diferente uso do ambiente por cada uma das espécies estudadas. O teste de Kruskal-Wallis indica diferenças significativas entre todas as espécies avaliadas (P<0,0001), levando em consideração as oito variáveis analisadas. Posteriormente, o teste de Dunn determinou que todas as variáveis apresentaram mais resultados significativos (P<0,05) nas comparações entre os pares de espécies. Esse resultado indica que todas as variáveis climáticas analisadas são importantes na diferenciação climática do gênero.
Os resultados destes testes são ilustrados através dos “Species density plots” (Fig. 2). Por exemplo, ao observarmos a variável Altitude (Alt) é possível perceber que Formicivora littoralis (Gonzaga & Pacheco, 1990) e Formicivora serrana (Hellmayr, 1929) ocorrem em áreas com valores de altitude divergentes, sendo F. serrana restrita a áreas com altitudes inferiores a 500m. Da mesma
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
forma, Formicivora melanogaster (Pelzeln, 1868) e Formicivora rufa (Wied, 1831) ocorrem em áreas com diferentes níveis de precipitação anual.
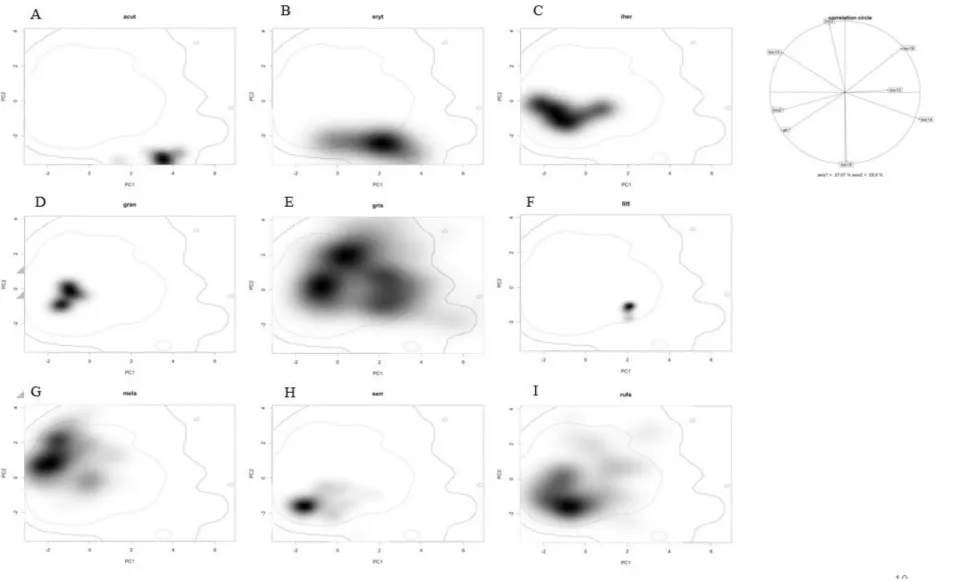
A Análise dos Componentes Principais (PCA) baseado no espaço climático estudado demonstrou que os dois eixos combinados explicam 65,87% da variação total (PC1=37,07% e PC2=28,8%) (Fig. 3 A). A influência dos dois eixos na distribuição do nicho das espécies estudadas é muito próxima permitindo uma grande amplitude no nicho do gênero. Contudo, as variáveis climáticas marcadas pelos density plots como as mais importantes se mostraram associadas ao PC2 (Isotermalidade – Bio3 e Precipitação do trimestre mais quente - Bio18). A representação bidimensional do nicho de cada uma das espécies analisadas é apresentada na Figura 3, de B a I.
As comparações pareadas da sobreposição de nicho apresentaram valores relativamente baixos (D=0 a D=0,41) (Tab. I). A sobreposição se mostrou muito baixa (D<0,1) em 68,9% dos casos. Os cinco maiores valores (D>0,3) ocorreram entre espécies que compartilham total ou parcialmente suas áreas de ocorrência ou distribuem-se em áreas adjacentes (ex. F. grisea e F. rufa (D=0,37); F. rufa e F. serrana (D=0,42)). A distância filogenética entre as espécies não apresentou correlação significativa com os valores de sobreposição de nicho (r = -0,2; P = 0,7).
A equivalência de nicho foi rejeitada em todas as comparações par-a-par (P < 0,02), indicando que nenhuma das espécies encontram-se em ambientes climaticamente idênticos. O teste de similaridade de nicho demonstrou que a maioria das comparações pareadas entre as espécies encontram-se dentro do esperado com um intervalo de confiança de 95%. Em apenas seis (Formicivora acutirostris (Bornschein, Reinert & Teixeira, 1995) - F. serrana; F. acutirostris - F.
erythronotos; F. rufa – F. serrana; F. erythronotos – F. serrana; F. acutirostris – F. littoralis; F. littoralis – F. serrana) das 36 comparações possíveis, obtivemos valores significativos, que indicam
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
Figura 2: Plotagem da densidade das espécies do gênero Formicivora para as oito variáveis climáticas separadamente. O nome das espécies é abreviação do epíteto específico
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
Figura 3. Nicho do gênero Formicivora no espaço climático delimitado pelos dois primeiros eixos dos componentes principais. O sombreamento representa a tendência de ocorrência de cada espécie, as linhas de contorno cheio e o tracejado mostram 100% e 50% do ambiente disponível respectivamente. O círculo de correlação mostra a contribuição de cada variável climática para os dois eixos principais
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
Reconstrução do nicho ancestral
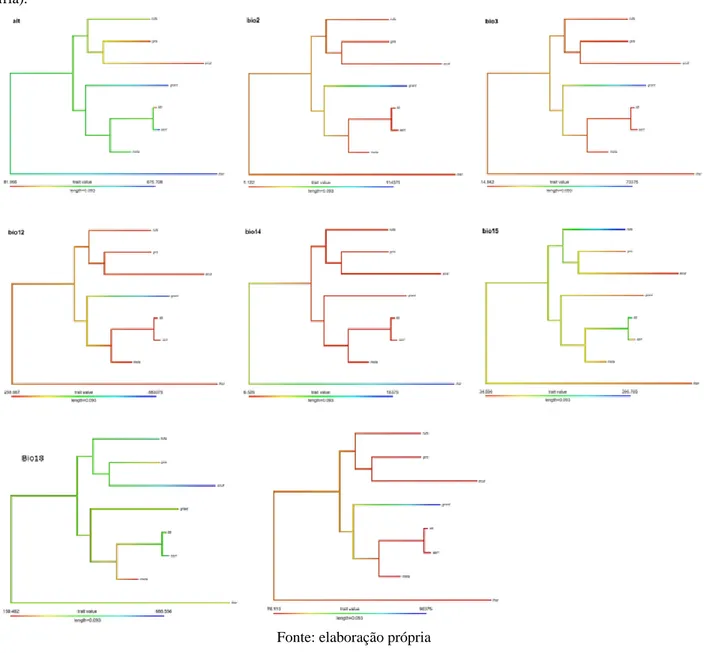
O estado ancestral de cada uma das variáveis climáticas trabalhadas e sua respectiva evolução ao longo das linhagens de Formicivora pode ser observado na Fig. 4.
Dentre as variáveis analisadas, percebemos mudanças no estado de Bio12 (Precipitação anual) ao longo do processo de diversificação de Formicivora. Essa condição, no mais recente ancestral comum (MRAC) apresenta valores baixos e que no processo de diversificação atinge valores ainda menores para quase todas as espécies analisadas, exceto Formicivora grantsaui Gonzaga, Carvalhaes & Buzzetti, 2007. A precipitação do trimestre mais quente (Bio18) também não manteve seus valores conservados. Seus valores no MRAC são intermediários e apresentam valores bem distintos na linhagem de F. melanogaster e F. acutirostris. Nas demais linhagens as mudanças são menos marcantes, mas ainda podem ser percebidas. A precipitação média mensal (Bio2) não apresentou mudanças tão marcantes.
No processo de diversificação do gênero, conseguimos perceber que o MRAC utilizava altitudes (Alt) intermediárias e seus descentes passaram a colonizar porções mais baixas do território, como zonas litorâneas (F. littoralis, F. acutirostris, F. grisea), e também áreas de florestas montanas como a Chapada da Diamantina e as Serras da Mantiqueira e do Mar (Formicivora
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
Figura 4: Reconstrução de caracteres ancestrais do valor médio para as oito variáveis climáticas utilizadas na quantificação e comparação do nicho. As variáveis são: Altitude, Bio12 (precipitação anual), Bio2 (média mensal, temperatura máxima e mínima), Bio3 (Isotermalidade %), Bio14(precipitação do mês mais seco), Bio15 (precipitação sazonalidade, coeficiente de variação), Bio18 (Precipitação da estação mais quente) Bio19 (Precipitação da estação mais fria).
Fonte: elaboração própria
4 DISCUSSÃO
A ampla distribuição no Neotrópico que as espécies de Formicivora apresentam apontam uma ocupação de diferentes nichos climáticos pelo táxon, o que denotam um processo de evolução do nicho ocupado pelas espécies durante seu processo de diversificação. Essa relação entre os processos de diversificação e as taxas de evolução do nicho climático tem se mostrado positivas e dominantes em escala global, estando famílias e gêneros de aves com elevados índices de riqueza associadas a nichos climáticos lábeis (COONEY et al., 2016).
A família Thamnophilidae é uma das linhagens de Tyranii endêmica da América do Sul e uma das primeiras a se diferenciar, tendo seu processo de diversificação iniciado por volta dos
54-Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
31 milhões de anos, no Eoceno, (IRESTEDT et al., 2004, Cracraft & Barker, 2009). As datações
obtidas e observadas na literatura (BRAVO, 2012) apontam a origem da diversificação de
Formicivora iniciando entre 14 - 16 milhões de anos, no Mioceno médio.
Durante esse período, existiu uma extensa área coberta de formações alagadas e florestas deciduais (MARIANO, 2014) e é nesse contexto ambiental que observamos a diversificação da linhagem de F. iheringi. Como pode ser visto em relação as variáveis altitude e Bio12 (Precipitação anual), essa linhagem coloniza e se diferencia em áreas com precipitação mais baixa e com maiores altitudes, quando comparada com seu ancestral.
A segunda linhagem do gênero inicia sua diversificação no Mioceno superior (8-5 milhões de anos) (BRAVO, 2012). Os modelos de reconstrução da paisagem desse período apontam uma
grande expansão das florestas úmidas, proporcionando um aumento na heterogeneidade espacial (MARIANO, 2014), o que permite um aumento potencial no processo de diversificação (SCHLUTER,
2001, TEWS et al., 2004, Hua & Wiens, 2013). Além da heterogeneidade, a evolução de nicho
favorece a expansão da distribuição em grandes áreas, deixando essas populações mais favoráveis a processos vicariantes (PIGOT et al., 2010).
Ao relacionarmos as variáveis ambientais selecionadas com o padrão de distribuição das espécies estudadas observamos que a Isotermalidade (Bio3), Altitude (Alt), Precipitação sazonal (Bio15) e a Precipitação do trimestre mais quente (Bio18) foram as que melhor explicam as diferenças ecológicas dentro de Formicivora. Isso pode ser observado através da segregação altitudinal das espécies e na sua distribuição espacial ao longo de áreas de mata secas e florestas úmidas litorâneas (SIGRIST, 2009). Apesar das variáveis supracitadas apresentarem maior significância, as outras variáveis analisadas também apresentam bastante informação a respeito das diferenças entre as espécies analisadas. Isso ocorre devido os valores médios dessas variáveis apresentarem significante variação nas áreas de distribuição (PEEL et al., 2007, GARREAUD et al., 2009).
O padrão de ocupação de nicho é influenciado pela equivalência e similaridade ecológica das espécies e somente os indivíduos que possuem diferenças suficientes, em relação ao nicho, coabitam a mesma área (FERREIRA et al., 2011). No entanto, ambientes similares podem apresentar
diferentes padrões de ocupação, isso ocorre em função da distribuição heterogênea das variáveis ambientais (MATHIAS & COELHO, 2013).
Os resultados apresentados para equivalência e similaridade indicam que nenhum par de espécies é equivalente ou similar. Para a equivalência todos os pares de espécies apresentaram o mesmo valor (p<0,02), isso indica que nenhuma espécie tem nicho idêntico, e a similaridade com
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
95% no intervalo de confiança, explica que a ocorrência de nenhuma espécie prediz a ocorrência da outra (FERREIRA et al., 2011; Peixoto, Villalobos & Cianciaruso, 2017).
Apesar de nenhuma espécie ser climaticamente idêntica ou ter um nicho similar, algumas espécies do gênero Formicivora, são relacionadas filogeneticamente e tem distribuições em áreas próximas, porém, não apresentam uma relação ecológica significativa. Através do teste de Mantel, é possível identificar que não existe relação significativa entre sobreposição de nicho e distância filogenética, com isso é possível dizer que ser filogeneticamente próximo não implica ser ecologicamente semelhante (MEDEIROS et al., 2015; Peixoto, Villalobos & Cianciaruso, 2017).
De acordo com as comparações multivariadas, a sobreposição de nicho entre as espécies é baixa (com o valor máximo entre F. rufa e F. serrana - D=0,41), demonstrando uma ampla afinidade climática entre as espécies de Formicivora.
O teste de similaridade de nicho também demonstra essa afinidade entre os nichos climáticos das espécies estudadas, tendo em vista que quase todos os testes não apresentaram resultados significantes, principalmente entre aquelas que estão em áreas geográficas distinta (e.g. F.
acutirostris-F. erythronotos, D=0,27, p1,2=0,02, p2,1=0,06; F. acutirostris-F. littoralis, D=0,
p1,2=0.04, p1,2=0,29). Espécies que compartilham a mesma área apresentam resultados opostos (e.g.
F. grantsaui-F. melanogaster, D=0,95, p1,2= 0,71, p1,2= 0,33; F. grisea-F. melanogaster, D=0,02
p1,2=0,38, p1,2=0,91).
A hipótese de conservadorismo de nicho assume o conceito de nicho fundamental de HUTCHINSON (1957), no qual características desses podem ser conservadas durante a evolução de determinado clado. De certa forma, as espécies tendem a habitar ambientes semelhantes aos de seus parentes próximos e para um nicho ser considerado conservado, depende da similaridade entre as espécies (WIENS & GRAHAM, 2005).
WIENS & GRAHAM (2005) afirmam que um dos efeitos do conservadorismo de nicho é a especialização climática, que influencia na explicação do padrão de distribuição dos organismos. De acordo com os resultados, é possível que durante a diversificação do gênero, as espécies tenham experimentado diferenciação no nicho até o estabelecimento do nicho atual.
5 CONCLUSÃO
Neste estudo pudemos observar que o padrão atual de distribuição das espécies do gênero
Formicivora está ligado a variáveis climáticas e aos nichos climáticos que elas proporcionam,
tendo o processo de diversificação e ocupação territorial sido influenciado pela evolução desse nicho climático.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
As análises sobre evolução de nicho indicam que no gênero Formicivora as espécies ocupam áreas com diferenças climáticas, até mesmo entre espécies estritamente relacionadas, rejeitando a priori a hipótese de conservadorismo de nicho. Ao se reconstruir o estado ancestral de cada variável analisada é possível observar que o nicho climático do gênero Formicivora é evolutivamente lábil e não conservado. Esses fatores influenciam no padrão de ocupação em áreas biogeográficas.
Apesar da família Thamnophilidae apresentar baixa capacidade de dispersão (ISLER et al.,
1997) devido a dependência de ambientes florestais de suas espécies (STOTZ et al., 1996), seus
gêneros apresentam ampla distribuição no Neotrópico. Essa ampla distribuição de Formicivora se dá pela história de diversificação dessas linhagens, tendo em vista sua história antiga, que remete ao Mioceno médio e de sua presença ao longo das flutuações climáticas e dos processos de expansão e retração florestais decorrentes.
AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Tecnológico e Científico – CNPQ pela bolsa de iniciação científica concedida a este trabalho.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761 REFERÊNCIAS
BELMONT-LOPES, R. 2013. Investigando o isolamento esplêndido da América do Sul: Filogenia e biogeografia histórica dos Thamnophilidae (Aves: Passeriformes: Tyranni). Universidade Federal
do Paraná, 199 pp. Disponível em:
<https://acervodigital.ufpr.br/bitstream/handle/1884/30601/R%20-%20T%20-%20RICARDO%20BELMONTE%20LOPES.pdf?sequence=1&isAllowed=y> Acesso em: 20 Jun. 2020.
BOWNMAN, A.W. & AZZALINI, A. 2018. R package “sm”: nonparametric smoothing methods (version 2.2-5.6).
BRAVO, G.A. 2012. Phenotypic and niche evolution in the antbirds (Aves, Thamnophilidae).
Louisiana State University, 169 pp. Disponível em: <
https://pdfs.semanticscholar.org/1a4a/c100b8dec45cbad7c5a86d3ecf904982296c.pdf?_ga=2.1554 09407.537704556.1595870799-953385602.1580433897> Acesso em: 17 Jun.2020.
BROENNIMANN, O.; FITZPATRICK, M.C.; PEARMAN, P.B.; PETITPIERRE, B.; PELLISSIER, L.; YOCCOZ, N.G.; THUILLER, W.; FORTIN, M.-J.; RANDIN, C.; ZIMMERMANN, N.E.; GRAHAM, C.H. & GUISAN, A. 2012. Measuring ecological niche overlap from occurrence and spatial environmental data. Global Ecology and Biogeography, 21, 481–497. Disponível em: < https://core.ac.uk/download/pdf/18153293.pdf> Acesso em: 20 Jun. 2020.
BROWN, J.H.; STEVENS, G.C. & KAUFMAN, D.M. 1996. The geographic range: Size, Shape, Boundaries, and Internal Structure. Annual Review of Ecology and Systematics, 27, 597–623. https://doi.org/10.1146/annurev.ecolsys.27.1.597
BUENO, A.A.B. 2012. Modelagem de nicho ecológico aplicada á conservação do Pato mergulhão (Mergus octosetaceus, VIEILLOT, 1817) no Brasil. Universidade Federal de Uberlândia, 113 pp. Disponível em: < https://repositorio.ufu.br/bitstream/123456789/13360/1/d.pdf> Acesso em: 20 Jun. 2020.
COONEY, C.R.; SEDDON, N. & TOBIAS, J.A. 2016. Widespread correlations between climatic niche evolution and species diversification in birds. Journal of Animal Ecology, 85, 869–878. https://doi.org/10.1111/1365-2656.12530
CRACRAFT, J. & BARKER, F.K. 2009. Passerine birds (Passeriformes). In Hedges, S.B. & Kumar, S., eds. The Timetree of life. Oxford University Press, 423–431.
FERREIRA, L. V.; SALOMÃO, R.P.; MATOS, D.C.L. & PEREIRA, J.L.G. 2011. Similaridade de espécies arbóreas em função da distância em uma floresta ombrófila na Floresta Nacional de Saracá-Taquera, Pará Similarity of tree species in relation to distance in a rain forest in the National Forest Saracá-Taquera, Pará. Bol. Mus. Para. Emílio Goeldi. Cienc. Nat, 6, 295–306.Disponível em: < http://scielo.iec.gov.br/pdf/bmpegcn/v6n3/v6n3a05.pdf> Acesso em: 20 Jun.2020.
GARREAUD, R.D.; VUILLE, M.; COMPAGNUCCI, R. & MARENGO, J. 2009. Present-day South American climate. Palaeogeography, Palaeoclimatology, Palaeoecology, 281, 180–195. http://dx.doi.org/10.1016/j.palaeo.2007.10.032
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
GRAHAM, C.H.; RON, S.R.; SANTOS, J.C.; SCHNEIDER, C.J. & MORITZ, C. 2004. INTEGRATING PHYLOGENETICS AND ENVIRONMENTAL NICHE MODELS TO EXPLORE SPECIATION MECHANISMS IN DENDROBATID FROGS. Evolution, 58, 1781– 1793. https://doi.org/10.1111/j.0014-3820.2004.tb00461.x
HIJMANS, R.J.; CAMERON, S. & PARRA, J. 2005. WorldClim, Version 1.3. Berkeley: University of California.
HUA, X. & WIENS, J.J. 2013. How does climate influence speciation? The American naturalist, 182, 1–12. Disponível em: < http://www.jstor.org/stable/10.1086/670690?origin=JSTOR-pdf> Acesso em: 20 Jun.2020.
HUTCHINSON, G.E. 1957. Concluding remarks. In Cold Sprig Harbor Symposia on Quantitative Biology. New Haven: Yale University, 66–77.
IRESTEDT, M.; FJELDSÅ, J.; NYLANDER, J.A. & ERICSON, P.G. 2004. Phylogenetic relationships of typical antbirds (Thamnophilidae) and test of incongruence based on Bayes factors.
BMC Evolutionary Biology, 4, 23–38. Disponível em: <
https://bmcevolbiol.biomedcentral.com/articles/10.1186/1471-2148-4-23> Acesso em: 20 Jun. 2020.
ISLER, M.L.; ISLER, P.R. & WHITNEY, B.M. 1997. Biogeography and Systematics of the Thamnophilus punctatus (Thamnophilidae) Complex. Ornithological Monographs, 355–
381.Disponível em: <
https://www.researchgate.net/publication/272586377_Biogeography_and_Systematics_of_the_Th amnophilus_punctatus_Thamnophilidae_Complex> Acesso em: 20 Jun. 2020.
KNOUFT, J.H.; LOSOS, J.B.; GLOR, R.E. & KOLBE, J.J. 2006. Phylogenetic analysis of the evolution of the niche in lizards of the Anolis sagrei group. Ecology, 87, 29–38.
KOZAK, K.H. & WIENS, J.J. 2010. Niche conservatism drives elevational diversity patterns in Appalachian salamanders. The American naturalist, 176, 40–54.
LOSOS, J.B. 2008. Phylogenetic niche conservatism, phylogenetic signal and the relationship between phylogenetic relatedness and ecological similarity among species. Ecology Letters, 11, 995–1003.
LOSOS, J.B.; LEAL, M.; GLOR, R.E.; DE QUEIROZ, K.; HERTZ, P.E.; RODRÍGUEZ SCHETTINO, L.; CHAMIZO LARA, A.; JACKMAN, T.R. & LARSON, A. 2003. Niche lability in the evolution of a Caribbean lizard community. Nature, 424, 542–545.
MARIANO, E.F. 2014. Relações biogeográficas entre a avifauna de florestas de altitude no Nordeste do Brasil. Universidade Federal da Paraiba, 230 pp.
MATHIAS, L.B. & COELHO, A.L.N. 2013. Modelagem Ecológica e Ferramentas de SIG Aplicadas à Conservação de Drymophila genei. In Anais XVI Simpósio Brasileiro de Sensoriamento Remoto - SBSR. Foz do Iguaçu: INPE, 6735–6742.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
MEDEIROS, M.C.M.P.; GUISAN, A. & LOHMANN, L.G. 2015. Climate niche conservatism does not explain restricted distribution patterns in Tynanthus (Bignonieae, Bignoniaceae). Botanical Journal of the Linnean Society, 179, 95–109.
OKSANEN, J.; BLANCHET, F.G.; FRIENDLY, M.; KINDT, R.; LEGENDRE, P.; MCGLINN, D.; MINCHIN, P.R.; O’HARA, R.B.; SIMPSOM, G.L.; SOLYMOS, P.; STEVENS, M.H.H.; SZOECS, E. & WAGNER, H. 2019. Package “vegan.” In Community Ecology Package.
PADISÁK, J., VASAS, G. and BORICS, G. Phycogeography of freshwater phytoplankton: traditional knowledge and new molecular tools. Hydrobiologia, 2016, 764(1), 3-27. http://dx.doi.org/10.1007/s10750-015-2259-4.
PEEL, M.C.; FINLAYSON, B.L. & MCMAHON, T.A. 2007. Updated world map of the Köppen-Geiger climate classification. Hydrology and Earth System Sciences Discussions, 4, 439–473.
Peixoto, F.P.; Villalobos, F.; Cianciaruso, M.V. 2017. Phylogenetic conservatism of climatic niche in bats. Global Ecology and Biogeography, 26, 1-11. Doi: 10.1111/geb.12618
PETERSON, A.T. 2011. Ecological niche conservatism: a time-structured review of evidence. Journal of Biogeography, 38, 817–827.
PIGOT, A.L.; OWENS, I.P.F. & ORME, C.D.L. 2010. The environmental limits to geographic range expansion in birds. Ecology Letters, 13, 705–715.
REVELL, L.J. 2012. phytools: an R package for phylogenetic comparative biology (and other things). Methods in Ecology and Evolution, 3, 217–223.
RICKLEFS, R.E. 2007. History and diversity: explorations at the intersection of ecology and evolution. The American naturalist, 170 Suppl, 56–70.
SCHLUTER, D. 2001. Ecology and the origin of species. Trends in Ecology & Evolution, 16, 372– 380.
SCHOENER, T.W. 1970. Nonsynchronous Spatial Overlap of Lizards in Patchy Habitats. Ecology, 51, 408–418.
Seeholzer, G.F.; Claramunt, S.; Brumfield, R.T. Niche evolution and diversification in a Neotropical radiation of birds (Aves: Furnariidae). Evolution, 71-3: 702–715.
SIGRIST, T. 2009. Guia de campo avis brasilis avifauna brasileira: Descrição das espécies. São Paulo: Avis Brasilis Editora, 600 pp.
Sóberon, J.; Arroyo-Peña, B. Are fundamental niches larger than the realized?Testing a 50-year-old
prediction by Hutchinson. Plos one, v. 12, n.4, 1-14 pp.
https://doi.org/10.1371/journal.pone.0175138
STOTZ, D.F. (DOUGLAS F.; CONSERVATION INTERNATIONAL. & FIELD MUSEUM OF NATURAL HISTORY. 1996. Neotropical birds : ecology and conservation. University of Chicago Press, 478 pp.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 56728-56745 aug. 2020. ISSN 2525-8761
TEWS, J.; BROSE, U.; GRIMM, V.; TIELBÖRGER, K.; WICHMANN, M.C.; SCHWAGER, M. & JELTSCH, F. 2004. Animal species diversity driven by habitat heterogeneity/diversity: the importance of keystone structures. Journal of Biogeography, 31, 79–92.
WARREN, D.L.; GLOR, R.E. & TURELLI, M. 2008. ENVIRONMENTAL NICHE EQUIVALENCY VERSUS CONSERVATISM: QUANTITATIVE APPROACHES TO NICHE EVOLUTION. Evolution, 62, 2868–2883.
WIENS, J.J. 2004. What Is Speciation and How Should We Study It? The American Nature, 163, 914–920.
WIENS, J.J. 2011. The niche, biogeography and species interactions. Philosophical Transactions of the Royal Society B: Biological Sciences, 366, 2336–2350.
WIENS, J.J. & DONOGHUE, M.J. 2004. Historical biogeography, ecology and species richness. Trends in Ecology & Evolution, 19, 639–644.
WIENS, J.J. & GRAHAM, C.H. 2005. Niche Conservatism: Integrating Evolution, Ecology, and Conservation Biology. Annual Review of Ecology, Evolution, and Systematics, 36, 519–539