Estratégias para caracterização molecular das espécies aromáticas da flora portuguesa
Texto
(2) UNIVERSIDADE DE LISBOA FACULDADE DE CIÊNCIAS DEPARTAMENTO DE BIOLOGIA VEGETAL. Estratégias para caracterização molecular de espécies aromáticas da flora Portuguesa. Ana Sofia Borges Lima. Dissertação orientada pela Professora Doutora Maria Helena Machado Trindade. Mestrado em Biologia Celular e Biotecnologia. 2009.
(3) Ao Tiago, pela sua paciência e apoio, e principalmente por nunca me ter deixado desistir nos momentos mais difíceis..
(4) «De tantos novos caminhos e descobertas, talvez a que mais me cause espanto é a redescoberta de mim mesma. Vejo-me com outros olhos. Deixei de abrir o livro da minha vida a qualquer pessoa, comecei a desconfiar de tudo e todos, mas continuo a mesma pessoa frágil em relação à vida... Já foram tantos, e tão difíceis os momentos em que acreditei que não valia a pena sequer tentar. Duvidei de mim mesma, da minha força e capacidade. Com o tempo, e só com ele, percebi do quanto eu seria capaz. Do quanto fui, e ainda hoje reconheço com surpresa, do quanto ainda sou. Tenho falado tanto de sonhos e planos, e quando hoje alguém me perguntou quais eram meus planos para o futuro, não hesitei e a resposta veio antes mesmo que eu pudesse sequer articular palavras. Ser feliz comigo e transmitir essa felicidade a todos os que gostam de mim. Nada me importa mais que ser e fazer diferença na vida daqueles a quem eu amo. Nada. Nem trabalho, nem dinheiro, nada. Houve tempos em que eu queria tanto, sonhava tanto. Coisas com as quais toda a gente já sonhou um dia. Uma casa, um lar, uma família. Conforto, estabilidade financeira, uma carreira, um trabalho decente que me motivasse e estimulasse a crescer sempre mais. Um amor verdadeiro, e inteiro. Nunca quis encontrar a "outra metade". Sempre quis encontrar o meu "outro completo". Hoje, eu sei, quero tanto e quero tão pouco. Quero um pedaço de vida fértil e produtiva, para no dia final poder dizer: valeu a pena viver! Não tenho medo da vida, ela é que tem medo de mim.». Joana Miranda (2004, em “Não se escolhe quem se ama”).
(5) AGRADECIMENTOS Parece que foi ontem, mas este é já o terceiro ano na companhia de uma grande equipa de profissionais e amigos a quem não posso deixar de manifestar o meu sincero agradecimento. Aos meus três orientadores (que privilégio!), Professora Doutora Helena Trindade, Professora Doutora Ana Cristina Figueiredo e Professor Doutor Luis Pedro, a quem devo grande parte daquilo que sei hoje, e a quem serei eternamente agradecida por todas as oportunidades que me têm dado para crescer profissionalmente assim como por toda a confiança depositada no meu trabalho, pelo apoio e disponibilidade prestados, pelos conselhos e preocupação, pelas palavras de incentivo mesmo nos momentos mais difíceis, e acima de tudo pela amizade construída. À Professora Doutora Lia Ascensão, pelo seu carinho e preocupação, e pelos constantes conselhos e palavras de apoio. Aos meus colegas de laboratório, Jorge e Marta, pelo convívio diário, pela amizade criada e pela boa disposição contagiante que em muito ajudaram a superar o “strec” e os dias menos bons. À Luísa, pela sua amizade, pela sua extrema simpatia e boa disposição, pelas gargalhadas e lágrimas que partilhamos, pela sua ajuda e paciência em ouvir as minhas confidências nas fases mais difíceis, pelos seus conselhos e por saber que estará sempre disponível quando e para o que for preciso. Simplesmente, obrigada! À Ana Margarida, pela sua amizade e simpatia, pela paz e tranquilidade que me transmite, pelos seus conselhos, apoio e palavras de carinho constantes e pelo seu grande e eterno ombro amigo! À Eva e à Cláudia, pela amizade e simpatia, pelos ensinamentos, auxílio, paciência e acompanhamento prestados na fase inicial da abordagem das terpeno sintases, durante a análise e processamento do RNA, assim como pela cedência de alguns softwares para análise de sequências. Uma palavra de especial apreço ao Professor Doutor Francisco Dionísio por todo o apoio e disponibilidade prestada relativamente a todas as questões da Bioinformática. À Sofia Seabra e à Vera Nunes do Centro de Biologia Ambiental, pela amizade criada, e pela disponibilidade e acompanhamento prestado durante o processo de sequenciação. Ao Francisco Pina, pela cedência de utilização do software “Sequencher” e pela sua enorme paciência e auxílio relativamente ao funcionamento do mesmo, e em todas as questões da Bioinformática. À Dr.ª Isabel Marques, do Instituto Gulbenkian de Ciência, pela sua disponibilidade, pelos conselhos técnicos e apoio relativamente à análise Bioinformática. Aos meus Pais, que apesar da distância, mantiveram sempre uma palavra de apoio, carinho e incentivo. À minha maninha e cunhadito, pelos conselhos e carinho demonstrados, nos bons e maus momentos. Aos meus tios, Maria dos Anjos, Carlos, José Maria, Maria Helena, Milita e tia Ilda, por me terem acolhido, desde o início, de braços abertos, pelo incentivo, conselhos e carinho demonstrado. A todos eles, o meu sincero obrigada! Ao Tiago, por me ter feito olhar a vida de maneira diferente, por me ajudar a tornar numa pessoa melhor, pela sua paciência, apoio extremo, por estar sempre ao meu lado quando precisei,.
(6) pela sua compreensão dada a minha “ausência” durante estes últimos meses e principalmente por nunca me ter deixado desistir. Obrigada Tanisco, pelo nosso passado, presente e futuro!. O presente trabalho foi realizado com o apoio da Fundação para a Ciência e a Tecnologia através da Bolsa de Investigação no âmbito do Projecto PTDC/AGR-AAM/70136/2006..
(7) Abreviaturas acc. – accession AFLP - Amplified Fragment Length Polymorphisms BLAST - Basic Local Alignment and Search Tools BLOSUM - Blocks of Amino Acid Substitution Matrix cDNA – Ácido desoxirribonucleico complementar cm – centímetro d.i. – diâmetro DDBJ - DNA Database of Japan DEPC – Dietilpirocarbonada DMAPP – Dimetilalil difosfato DNA – Ácido desoxirribonucleico DOXP – Dioxixilulose fosfato EDTA – Ethylenediamine tetraacetic acid EMBL - European Molecular Biology Laboratory EST – Expressed Sequence Tags eV – electrovolt FASTA – Fast-all FPP – Farnesil difosfato FID – Flame Ionization Detector Fw – Foward GC – Gas Chromatography GC-MS – Gas Chromatography- Mass Spectrometry gDNA – Ácido desoxirribonucleico genómico GPP – Geranil difosfato GGPP – Geranilgeranil difosfato h – hora IPP – Isopentenil difosfato ISSR - Inter Simple Sequence Repeats ITD – Ion Trap Detector Kb – kilo base kV – kilovolt m – metro M – molar mg – miligrama MgCl2 – Cloreto de magnésio min – minuto ml – mililitro mM – mili molar mm – milímetro mRNA – Ácido ribonucleico mensageiro NCBI - National Center for Biotechnology Information ng – nanograma nm – nanómetro.
(8) NTSYS - Numerical Taxonomy Multivariate Analysis System ºC – graus Celsius PAM – Point Accepted Mutation pb – Pares de bases PCR – Polymerase Chain Reaction RAPD – Random Amplified Polymorphism DNA Rev – Reverse RFLP - Restriction Fragment Length Polymorphism RNA – Ácido ribonucleico rpm – rotações por minuto s – segundo SNP - Single Nucleotide Polymorphism SSR - Simple Sequence Repeats Taq polimerase – Thermus aquaticus polimerase TPS – Terpeno sintases UPGMA – Unweighted Pair Group Method with Arithmetical Averages UV – ultra-violeta V – volt µA – microampere μl – microlitro μm – micrómetro.
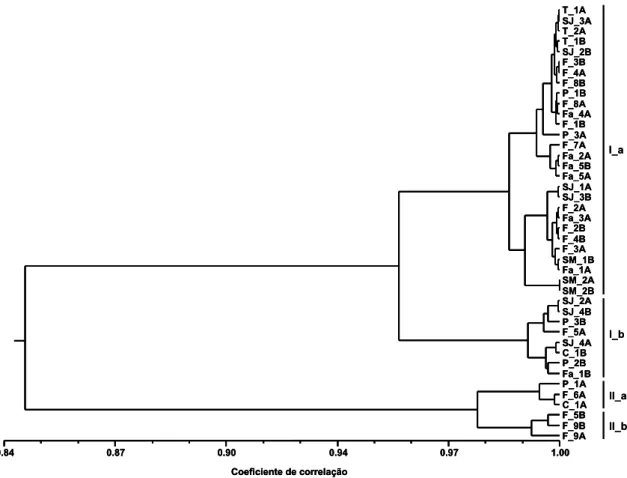
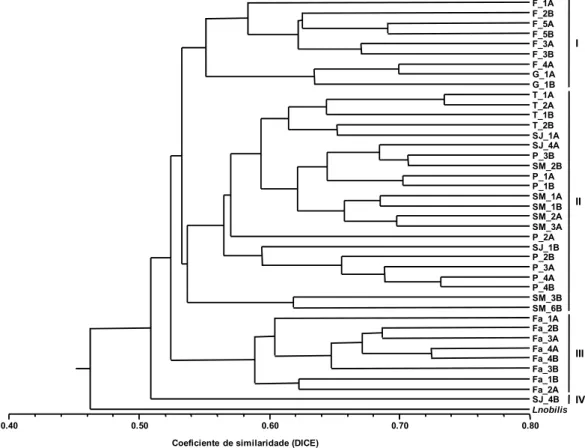
(9) Resumo Este trabalho teve por objectivo aplicar técnicas de análise molecular, utilizando marcadores moleculares RAPDs e ISSRs, e técnicas de análise química, como a Cromatografia Gás-líquido e a Cromatografia Gás-Líquido associada a Espectrometria de Massa, para a caracterização de três espécies aromáticas endémicas da flora Portuguesa: Juniperus brevifolia, Laurus azorica e Thymus caespititius. Na tentativa de entender a razão da elevada diversidade química presente em Th. caespititius, deu-se início a uma abordagem molecular mais direccionada através da análise de terpeno sintases, recorrendo para o efeito a ferramentas de Bioinformática. A análise dos componentes voláteis permitiu corroborar e acrescentar dados aos estudos anteriores referentes às três espécies em questão. A caracterização molecular por RAPDs e ISSRs para as espécies J. brevifolia e L. azorica provenientes de sete ilhas açorianas, é aqui reportada pela primeira vez, tendo-se verificado uma semelhança genética moderada entre os indivíduos, resultante do polimorfismo detectado. Relativamente a Th. caespititius, espécie caracterizada pela existência de quimiotipos, o perfil de bandas obtido revelou uma baixa semelhança genética entre todos os indivíduos. Para as três espécies em questão, a similaridade genética detectada permitiu agrupar os indivíduos maioritariamente pela sua localização geográfica, não tendo sido possível estabelecer uma boa correlação entre os dados moleculares e os dados químicos. Apesar da caracterização com os marcadores moleculares utilizados ter revelado existência de diversidade genética nas espécies endémicas, estes não mostraram ser os mais indicados para revelar correlações com os óleos essenciais. Abordagens moleculares mais específicas, como o estudo das terpeno sintases (TPS) foram iniciadas para o Th. caespititius, sendo reportados pela primeira vez resultados parciais sobre o conteúdo do genoma da espécie. Sendo pioneiros, estes dados da sequenciação parcial do gene remetem para a existência de variação genética intraespecífica, desconhecendo-se, até ao momento, não só em que parte do gene é que esta sequência se localiza, mas também qual a sua função exacta.. Palavras-chave: Juniperus brevifolia, Laurus azorica, Thymus caespititius, componentes voláteis, marcadores moleculares, terpeno sintases, Bioinformática..
(10) Abstract The aim of the present work was the molecular (RAPD and ISSR markers) and chemical (GC and GC-MS techniques) characterization of three Portuguese aromatic species, Juniperus brevifolia, Laurus azorica e Thymus caespititius. A more targeted molecular approach on terpene synthases, using bioinformatics tools, was initiated in order to determine the reason for the high chemical diversity present in Th. caespititius, The herewith reported volatile oil composition results, obtained from individual samples, are in accordance with previous studies and new data is included for the three species. The molecular RAPD and ISSR markers characterization of J. brevifolia and L. azorica from seven Azorean islands are reported for the first time. These data suggest a moderate genetic similarity between individuals as result of the polymorphism detected. Characterized by the presence of chemotypes, Th. caespititius band profile showed a low genetic similarity between all individuals. The genetic similarity found for the three aromatic species grouped individuals mainly by its geographical location, and no straight correlation could be found between the molecular and volatiles clusters. Although the molecular characterization revealed the existence of genetic diversity, the molecular markers used did not show correlation with volatile analysis. Terpene synthases studies were performed for Th. caespititius, and for the first time partial results on the genome content of this species are reported. These results on the partial gene sequence show intraspecific genetic variation, being unknown until present the sequence localization in the gene and its function.. Keywords: Juniperus brevifolia, Laurus azorica, Thymus caespititius, volatile compounds, molecular markers, terpene synthases, Bioinformatics..
(11) Índice 1.. Introdução.................................................................................................................................. 1 1.1. Juniperus brevifolia (Cupressaceae) ...................................................................................... 2 1.2. Laurus azorica (Lauraceae) .................................................................................................... 3 1.3. Thymus caespititius (Lamiaceae) ........................................................................................... 4 1.4. Metabolismo Secundário .................................................................................................. 6 1.4.1. Biossíntese de metabolitos secundários.................................................................. 7 Terpenos....................................................................................................................... 7 Fenóis ........................................................................................................................... 8 1.4.2. Bioquímica e função dos metabolitos secundários.................................................. 9 1.4.3. Metabolitos secundários na quimiotaxonomia ......................................................... 9 1.5. Marcadores moleculares................................................................................................. 10 1.5.1. RAPDs (Random Amplified Polymorphic DNA) ..................................................... 11 1.5.2. ISSRs (Inter Simple Sequence Repeats)............................................................... 12 1.6. Terpeno sintases............................................................................................................. 13 1.6.1. Classificação das TPS ........................................................................................... 15 1.6.2. Mecanismos de variação genética......................................................................... 15 1.6.3. Bioinformática como ferramenta de análise........................................................... 16 1.7. Objectivos ....................................................................................................................... 17 2. Material e Métodos .................................................................................................................. 19 2.1. Material vegetal..................................................................................................................... 19 2.2. Análise química..................................................................................................................... 19 2.2.1. Extracção dos voláteis................................................................................................... 19 2.2.2. Análise quantitativa: cromatografia gás-líquido............................................................. 19 2.2.3. Análise qualitativa: cromatografia gás-líquido - espectrometria de massa ................... 20 2.3. Análise molecular.................................................................................................................. 20 2.3.1. Extracção de DNA ......................................................................................................... 20 2.3.2. Marcadores moleculares: RAPDs ................................................................................. 20 2.3.3. Marcadores moleculares: ISSRs ................................................................................... 21 2.3.4. Terpeno Sintases........................................................................................................... 21 Delineamento experimental........................................................................................ 21 Primeira abordagem: Extracção de RNA e síntese de cDNA .................................... 22 Segunda abordagem: Clonagem................................................................................ 23 Terceira abordagem: DNA genómico ......................................................................... 25 2.4. Tratamento estatístico .................................................................................................... 25 3. Resultados e Discussão .......................................................................................................... 27 3.1. Juniperus brevifolia ......................................................................................................... 27 3.2. Laurus azorica................................................................................................................. 32 3.3. Thymus caespititius ........................................................................................................ 38 3.3.1. Terpeno Sintases ................................................................................................... 45 4. Conclusões .............................................................................................................................. 53 5. Perspectivas Futuras ............................................................................................................... 55 6. Bibliografia ............................................................................................................................... 57 Anexos................................................................................................................................................. I Anexo A – Listagem do material vegetal................................................................................ I Anexo B – Análise de Polimorfismos por RAPDs e ISSRs................................................... V Anexo C – Análise de Terpeno Sintases ............................................................................ VII Anexo D – Resultados da análise da componente volátil.................................................. XIII Anexo E – Resultados da análise de polimorfismos por RAPDs e ISSRs ........................XIX Anexo F – Resultados da análise das terpeno sintases em Th. caespititius.....................XXI. 1.. 1.
(12)
(13) Introdução. 1. Introdução As plantas são capazes de sintetizar e acumular compostos orgânicos de baixo peso, designados por metabolitos secundários, de natureza química e propriedades diversificadas, muitos dos quais são explorados pelo Homem desde longa data (Proença da Cunha e Roque, 2005). Tais compostos encontram-se presentes nas plantas geralmente em pequenas quantidades, em células especializadas, servindo à planta não só nos seus mecanismos de defesa contra agentes invasores, como também na atracção de polinizadores necessários à sua reprodução (Goossens et al., 2003). Muitos destes metabolitos apresentam actividade biológica podendo ser utilizados como matéria-prima nos mais variados tipos de indústria, como a farmacêutica, a agro-alimentar, da cosmética e da perfumaria (Goossens et al., 2003; Wink, 2003; Bakkali et al., 2008). A produção agrícola destes metabolitos com interesse económico, tem o inconveniente de estar sujeita a diversos factores que condicionam o custo e qualidade das matérias-primas, como as condições climáticas e geopolíticas dos países produtores, a sazonalidade das produções agrícolas, as variações em teores de constituintes activos em plantas da mesma espécie, a susceptibilidade a pragas e doenças, a dificuldade de propagação de certas espécies, entre outros (Proença da Cunha e Roque, 2005; Zwenger e Basu, 2008). Tendo em conta estes factores, existem actualmente alternativas à produção de metabolitos secundários (Rao e Ravishankar, 2002), tal como a tecnologia da cultura in vitro de células (Mulabagal e Tsay, 2004) e tecidos vegetais (Kornfeld et al., 2007), biotransformação em culturas de raízes transgénicas (Faria et al., 2009), uso de bioreactores (Suryanarayan, 2003), eliciação (Staniszewska et al. 2003), metodologias estas que visam assegurar e controlar o rendimento e a qualidade da produção (Deans e Svoboda, 1993). Na última década, inúmeras equipas de investigação desenvolveram trabalhos que permitiram esclarecer alguns dos processos metabólicos e bioquímicos nas plantas (Croteau et al., 2006; Hyatt et al., 2007; Wang et al., 2008). No entanto, muitos dos mecanismos envolvidos na biossíntese de metabolitos secundários permanecem desconhecidos. As ferramentas e abordagens de que a genómica funcional dispõe actualmente serão fundamentais para acelerar as investigações no conhecimento do metabolismo celular, quer em tecidos especializados quer em organismos inteiros, assim como os mecanismos genéticos que controlam qualitativa e quantitativamente a variação em metabolitos secundários (Goossens et al., 2003) A existência de diferentes tipos de clima e a presença de diversos microclimas provocados por relevos, pela latitude, pela exposição solar, natureza do solo e proximidade do mar, são características que permitem a existência de uma flora diversificada no nosso país, nomeadamente em plantas aromáticas endémicas. Diversas obras bibliográficas, elaboradas nos últimos anos, descrevem a flora aromática em Portugal (Proença da Cunha et al., 2007). Das 3800 espécies descritas em território nacional, cerca de 500 são aromáticas e/ou medicinais. Em Portugal Continental, para além de espécies próprias de um clima temperado, há registo de certos endemismos particulares de ocorrência na região da Macaronésia (do grego makáronfeliz, afortunado; e nesoiilhas). Sendo parte integrante desta região, em conjunto com as ilhas Canárias, os arquipélagos da Madeira e dos Açores são locais de excelência para o desenvolvimento de endemismos. Segundo Borges et al. (2005) (in Cardoso et al., 2005), os Açores apresentam a menor taxa de endemismos (10%) quando comparada com os 19% e 28% da Madeira e Canárias, respectivamente. No entanto, pouca diversidade não é sinónimo de pouco 1.
(14) Introdução. interesse do ponto de vista da conservação, tendo sido desta forma seleccionado o arquipélago açoriano como local de eleição para recolha do material vegetal, analisado química e molecularmente, e descrito no presente trabalho: Juniperus brevifolia, Laurus azorica e Thymus caespititius.. 1.1. Juniperus brevifolia (Cupressaceae) Juniperus brevifolia (Seub.) Antoine pertence à família Cupressaceae (Figura 1.1). Esta inclui cerca de 20 géneros, contendo desde espécies arbustivas como Diselma archeri Hook, a espécies de porte arbóreo como o cipreste (Cupressus sempervirens L.) e a tuia ou cedro branco (Thuja occidentalis L.). O género Juniperus, dividido em três secções, inclui mais de 60 espécies localizando-se essencialmente no hemisfério norte, excepção apenas para J. procera que se desenvolve no hemisfério sul (Adams, 2000).. b. a Figura 1.1 – Juniperus brevifolia (Seub.) Antoine: (a) parte aérea vegetativa; (b) gálbulas.. Sendo a única espécie conífera endémica dos Açores, distribui-se actualmente por todas as ilhas do arquipélago, com excepção da ilha Graciosa (Sjögren, 2001), sendo localmente designada por “cedro-do-mato”, “cedro-das-ilhas” ou “zimbro” (Silva et al., 2000). No entanto, sabe-se que na ilha de Santa Maria a espécie está à beira da extinção, enquanto nas ilhas do Pico e S. Jorge as áreas de ocorrência estão a ser fragmentadas devido à implantação de pastagens (Elias, 2007). As grandes extensões de floresta ocupada por comunidades de Juniperus, vulgarmente conhecida como a primitiva floresta Laurisilva, encontram-se essencialmente nas ilhas Terceira e Flores, principalmente acima dos 500m de altitude (Sjögren, 2001). É na ilha do Pico que esta espécie em particular atinge a sua máxima expressão (entre os 500 e os 1000m), sendo que acima dos 1500m de altitude a sua distribuição geográfica fica limitada devido às baixas temperaturas que se fazem sentir (Elias, 2007). Esta conífera forma arbustos altos ou árvores de pequeno porte até 5-6m de altura, geralmente resinosos e aromáticos, sendo os seus exemplares dióicos. As folhas são perenes, linearlanceoladas, do tipo agulha e de coloração verde escura. Os frutos ou gálbulas são subglobosos, verdes e pruinosos, passando a apresentar coloração castanho-avermelhado quando maduras (Schäfer, 2005; Bingre et al., 2007; Cavaleiro, 2007). São escassos os estudos realizados para identificação da composição da fracção volátil presente em J. brevifolia colhido no arquipélago dos Açores. Em 1999, Adams isolou a fracção volátil a partir de folhas colhidas em S. Miguel, tendo obtido como componentes maioritários o 2.
(15) Introdução. limoneno (43%), o sandaracopimara-8(14),15-dieno (20%), o β-mirceno e o α-pineno (ambos com 6%). Estudos posteriores revelaram que os óleos essenciais de J. brevifolia colhidos em cinco ilhas açorianas, apresentavam o limoneno (67-79% e 6-17%) e o α-pineno (41-56% e 15-40%) como componentes maioritários, obtidos respectivamente a partir quer das partes aéreas quer de bagas imaturas (Silva et al., 2000). Para além dos óleos essenciais, a composição química dos extractos desta espécie foi posteriormente alvo de estudo. Muito recentemente, Seca et al. (2008) identificaram mais de uma dezena de novos compostos diterpénicos, alguns deles mencionados pela primeira vez no género Juniperus. O J. brevifolia tem características únicas, como a sua elevada longevidade e boa qualidade de biomassa, que lhe conferem o estatuto de espécie pioneira, persistente e com auto-manutenção (Elias e Dias, 2009). No entanto, essas mesmas características traduzem-se em desvantagens para a sua conservação primitiva, constituindo uma apetecível matéria-prima para transformação da indústria da madeira (Silva et al., 2000; Sjögren, 2001; Seca et al., 2008). De igual forma, a destruição da floresta nativa para conversão em pastagens e construção de estradas, promove a plantação em larga escala de espécies introduzidas e invasoras como a Cryptomeria japonica e o Pittosporum undulatum, respectivamente (Ferreira e Eriksson, 2006). O declínio de J. brevifolia tem consequências graves nos ecossistemas naturais, na qualidade e quantidade dos recursos hídricos, nos solos e na flora e fauna insulares, tendo sido implementadas medidas para a conservação genética e ampliação das florestas naturais de Juniperus (Ferreira e Eriksson, 2006).. 1.2. Laurus azorica (Lauraceae) Laurus azorica (Seub.) Franco, vulgarmente chamado de “loureiro” ou “louro” (Figura 1.2), pertence à família das lauráceas, a qual inclui cerca de 2500 espécies localizadas predominantemente em regiões tropicais e sub-tropicais (Simic et al., 2004). Algumas dessas espécies são importantes do ponto de vista económico, devido às suas madeiras aromáticas como a canforeira (Cinnamomum camphora (L.) H. Sieb.), aos seus frutos como o abacateiro (Persea americana Miller), e às propriedades dos óleos essenciais das suas folhas como o loureiro (Laurus nobilis L. e Laurus azorica (Seub.) Franco) (Canhoto et al., 1999 e 2005).. b. a Figura 1.2 – Laurus azorica (Seub.) Franco: (a) aspecto geral; (b) pormenor parte aérea vegetativa.. 3.
(16) Introdução. Devido à sua elevada capacidade de regeneração vegetativa, o Laurus azorica é considerada uma espécie primária pioneira da floresta açoriana (Elias e Dias, 2009), distribuindo-se igualmente em termos geográficos nos arquipélagos da Madeira e Canárias, parte integrante da região da Macaronésia (Rivera e Óbon, 1995). À semelhança do J. brevifolia, também as florestas de montanha de Laurus são caracterizadas pela sua baixa altitude, fortemente relacionada pela frequente nebulosidade, elevada pluviosidade, solos com uma saturação de água permanente e constante exposição ao vento (Sjögren, 2001; Elias e Dias, 2009). O loureiro é uma árvore perene ou arbusto que atinge cerca de 5m de altura, com uma copa bastante densa que serve de abrigo a outras plantas da floresta nativa (Sjögren, 2001). As suas folhas aromáticas são simples, alternadas, lanceoladas, elípticas a ovais, com 4 a 15cm de comprimento, de consistência um pouco coriácea, sendo a página superior glabra e com tonalidade verde escura enquanto a página inferior apresenta tonalidade mais pálida e revestida por pêlos. O ápice é pontiagudo e o pecíolo curto. As flores são sésseis, amarelo-esverdeadas, dióicas axilares, com perianto de 4 lóbulos. Os frutos são ovais, com cerca de 12mm, carnudos em forma de drupa, apresentando coloração negra quando atingem o estado de maturação (Vieira, 1992; Schäfer, 2005; Bingre et al., 2007). O L. azorica tem sido tradicionalmente utilizado com fins culinários, aromáticos e medicinais. A infusão das suas folhas é usada para combater problemas digestivos e respiratórios, enquanto o óleo essencial é frequentemente utilizado no tratamento de queimaduras e como anti-reumático (Rivera e Óbon, 1995; Castilho et al., 2005). Têm sido efectuados alguns estudos na identificação da composição dos óleos essenciais de L. azorica (Tabela 1.1). Dada a proximidade taxonómica, filogenética e morfológica que o L. azorica apresenta com o L. nobilis, têm sido igualmente desenvolvidas análises moleculares com o objectivo de estabelecer níveis de similaridades genéticas entre as duas espécies (Arroyo-Garcia et al., 2001). Devido às suas propriedades medicinais já mencionadas, existem na bibliografia alguns estudos de actividade biológica (Medeiros et al., 2000; Tinoco, 2000; Simić et al., 2004). Integrando a primitiva floresta Laurisilva, o L. azorica foi considerado, até ao ano 2002, uma espécie endémica dos arquipélagos dos Açores, Madeira e Canárias No entanto, revisões taxonómicas consideraram haver distinções suficientes para classificar o Laurus existente nas ilhas da Madeira e Canárias como uma espécie diferente da existente nos Açores, designada como Laurus novocanariensis (Ferrari et al., 2005). Tabela 1.1 – Estudos sobre a composição da fracção volátil isolada a partir de indivíduos e populações de Laurus azorica e Laurus novocanariensis. Material vegetal (Origem) Componentes maioritários (≥10%) Folhas α-pineno (13), 1,8-cineole (10) Folhas (Açores) α-pineno (22), 1,8-cineole (17), β-pineno (16) Bagas (Açores) trans-β-ocimeno (22), α-pineno (16) Folhas (Açores) α-pineno (15-37), 1,8-cineole (12-31) Bagas (Açores) trans-β-ocimeno (27-45), α-pineno (12-22) Parte aérea floral 2-tetradecanona (12), 1,8-cineole (10) (Madeira). Referência Hokwerda et al., 1982 Tinoco, 2000 Pedro et al., 2001 Pino et al., 2004. 1.3. Thymus caespititius (Lamiaceae) O Thymus caespititius Brot., vulgarmente designado por “erva-úrsula”, “alecrim-da-serra” ou “tormentelo” (Figura 1.3), pertence à família Lamiaceae (Labiateae) que inclui cerca de 200 4.
(17) Introdução. géneros. Constituídos por inúmeras espécies de interesse económico, possui espécies arbustivas ornamentais, como o alecrim (Rosmarinus officinalis L.), a alfazema (Lavandula angustifolia Miller), plantas herbáceas como a hortelã-pimenta (Mentha x piperita L.), o orégão (Origanum vulgare L.), a erva-cidreira (Melissa officinalis L.), entre muitas outras.. b. a Figura 1.3 – Thymus caespititius Brot.: (a) parte aérea vegetativa e floral; (b) pormenor parte floral.. Contabilizando mais de 200 espécies, o género Thymus é um dos oito mais importantes, sendo taxonomicamente complexo pela sua poliploidia e pela ocorrência natural de híbridos (Salgueiro, 2006), com distribuição frequente na região Mediterrânica estando bem adaptadas a climas húmidos e quentes (Morales, 2002). Endémica a noroeste da Península Ibérica, na Madeira e Açores, o Thymus caespititius é a única espécie representativa do género presente nos Açores (Pereira et al., 2003). É uma planta rastejante, de caules lenhosos, floríferos e erectos. As folhas aromáticas são pequenas, do tipo agulha e densamente dispostas, apresentando coloração rosa ou branca (Sjögren, 2001; Schäfer, 2005). Cresce preferencialmente nas zonas costeiras, podendo surgir igualmente em elevadas altitudes, em correntes de lava acidentadas, em partes secas e salientes entre as cavernas, e em depósitos vulcânicos de areia negra (Sjögren, 2001). Os tomilhos assumem uma grande importância económica em consequência das suas propriedades aromáticas, condimentares e medicinais, nomeadamente antiséptica, antiinflamatória, expectorante e anti-oxidante (Salgueiro, 2006; Figueiredo et al., 2008a). Estas actividades estão associadas fundamentalmente à sua fracção volátil, dominada por componentes fenólicos e flavonóides (Salgueiro, 2006). Atendendo ao seu interesse, não apenas comercial mas também taxonómico, existem inúmeras referências bibliográficas ao estudo da identificação dos componentes dos óleos essenciais de Th. caespititius (Tabela 1.2). Caracterizados por um acentuado polimorfismo químico, estes estudos contribuíram para estabelecer a existência de quimiotipos: carvacrol; timol; α-terpineol; sabineno; carvacrol / timol; carvacrol / α-terpineol; α-terpineol / τ-cadinol. Esta acentuada variabilidade química pode reflectir a diversidade genética presente nesta espécie, dado que os polimorfismos químicos não estão relacionados com a heterogeneidade das condições ambientais tais como o grau de humidade, a amplitude térmica e o tipo de solo (Figueiredo et al., 2008a). Isso conduziu à realização de abordagens moleculares, como descrito em Trindade et al. (2008), recorrendo a marcadores moleculares aleatórios como os RAPDs. No entanto, nesse estudo não se conseguiu estabelecer uma correlação directa entre os dados químicos e moleculares, uma vez que indivíduos com diferentes quimiotipos agruparam-se num 5.
(18) Introdução. mesmo cluster molecular, sendo este último definido de acordo com o perfil genético. Abordagens moleculares mais específicas, como as terpeno sintases, poderão ser uma ferramenta fundamental para esclarecer as diferenças nas vias metabólicas dos quimiotipos de Th. caespititius, sendo que até ao momento não existe na literatura nenhum estudo sobre este tema. Tabela 1.2 – Estudos sobre a composição da fracção volátil isolada a partir da parte aérea floral indivíduos e populações de Thymus caespititius (adaptado de Figueiredo et al., 2008a). Origem Pico. Componentes maioritários (≥4%) carvacrol (36), timol (16), acetato de carvacrilo (8), p-cimeno (7), α-terpineol (5). Referência Salgueiro et al., 1997. timol (1-58), carvacrol (1-52), α-terpineol (v-68), sabineno (0.1-41), p-cimeno (1-9), Pereira et al., 2000 γ-terpineno (1-8), terpineno-4-ol (1-6), acetato de carvacrilo (v-5) carvacrol (45-57), timol (1-12), acetato de carvacrilo (2-17), p-cimeno (4-6), Pico α-terpineol (0.4-5) carvacrol (51-54), p-cimeno (5-10), α-terpineol (5-12), timol (0.1-5), acetato de Pereira et al., 2003 Faial carvacrilo (3-5) carvacrol (3-35), α-terpineol (15-37), τ-cadinol (4-11), p-cimeno (3-10), γ-terpineno Graciosa (4-8) Corvo, Flores, carvacrol (41-65), acetato de carvacrilo (2-24), p-cimeno (4-19), α -terpineno (1-6), S. Miguel τ –cadinol (nd-15), γ-cadineno (nd-5) timol (35-51), acetato de timilo (10-19), p-cimeno (10-14), γ-terpineno (2-5), Santos et al., 2005 Terceira α-terpineol (1-8) α-terpineol (33-37), sabineno (16-18), β-mirceno (7-10), γ-terpineno (4-6), Madeira terpineno-4-ol (3-5), epi-guaiol (3-5) NW Portugal α-terpineol (31-41), p-cimeno (6-9), γ-terpineno (4-7), τ-cadinol (6-9) Salgueiro, 2006 S. Miguel carvacrol (43-68), acetato de carvacrilo (5-23), p-cimeno (4-7) Mendes, 2007 Faial carvacrol (47-65), α-terpineol (1-13), p-cimeno (5-7), acetato de carvacrilo (2-5) Madeira α-terpineol (33), β-mirceno (6) timol (54-56), carvacrol (51-63), acetato de carvacrilo (1-17), acetato de timol (1-9), Pico p-cimeno (5-9) Trindade et al., sabineno (0.1-72), carvacrol (0.3-58), α-terpineol (0.1-58), timol (0.1-34), τ-cadinol S. Jorge 2008 (0.3-16), γ-terpineno (1-12), p-cimeno (1-9) timol (22-54), acetato de timilo (5-19), p-cimeno (8-13), τ-cadinol (2-6), γ-terpineno Terceira (2-6), carvacrol (2-5) S. Jorge. nd – não detectado; v – vestigial (≤ 0.05%).. 1.4. Metabolismo Secundário As plantas produzem metabolitos primários e secundários que abrangem uma vasta gama de funções. Estes metabolitos são produtos de diferentes vias metabólicas entre as quais não existem por vezes diferenças relevantes, excepção apenas no modo como são reguladas. Em ambas ocorrem reacções químicas muito semelhantes dando origem a moléculas complexas, sintetizadas a partir de precursores simples por intermédio de enzimas catalisadoras (Edwards e Gatehouse, 1999). No metabolismo primário, estão envolvidos compostos, tais como os aminoácidos, os açúcares de cadeia simples, os ácidos nucleicos e os lípidos, que são essenciais no desempenho de processos celulares (Zwenger e Basu, 2008). Os metabolitos secundários incluem compostos que, não sendo directamente necessários ao crescimento e desenvolvimento da planta, são produzidos devido à sua função ecológica de comunicação ou defesa em resposta a condições de stress, a ataques de herbívoros e atracção de polinizadores (Trapp e Croteau, 2001). De acordo com a sua função, os metabolitos secundários podem ser sintetizados em estruturas glandulares ou secretoras internas (idioblastos, lacticíferos, bolsas ou cavidades, canais) ou externas na superfície dos órgãos vegetativos e reprodutores das plantas (tricomas, emergências). A diversidade morfológica destas estruturas, não permite estabelecer relação directa com o tipo de 6.
(19) Introdução. secreção produzida (Ascensão, 2007). Uma vertente prática de utilização humana dos metabolitos secundários acontece desde a antiguidade sob a forma de óleos essenciais. Estes podem ser definidos como misturas complexas de compostos voláteis produzidos essencialmente pelas plantas, tendo já sido detectados alguns de origem animal. O seu isolamento pode ser efectuado por hidro-destilação, sob arrastamento de vapor de água ou ainda sob pressão directa das cutículas exteriores, como no caso dos frutos de Citrus sp. (Waterman, 1993; Başer e Demirci, 2007). Normalmente mantêm-se líquidos à temperatura ambiente e imiscíveis em água, possuindo características físico-químicas particulares conferindo ao óleo odores característicos devido às variações de volatilidade e à concentração relativa dos seus constituintes (Figueiredo et al., 2008). Tendo em conta a sua natureza química, os metabolitos secundários podem ser agrupados em terpenos, fenóis, alcalóides e mucilagens (Croteau et al., 2000). Dada a importância, a disponibilidade e o papel que assumem na planta, segue-se uma breve descrição sobre a síntese e função dos terpenos e dos fenóis.. 1.4.1. Biossíntese de metabolitos secundários Terpenos Os terpenos são a maior e mais diversificada família de produtos naturais, agrupando-se de acordo com a adição sucessiva de unidades em C5 de isopreno, podendo ser classificados em hemiterpenos (C5), monoterpenos (C10), sesquiterpenos (C15), diterpenos (C20), sesterterpenos (C25), triterpenos (C30) e tetraterpenos (C40) (Dewick, 1997). O termo terpeno é atribuído a uma molécula de hidrocarboneto simples, sendo que se essa molécula sofrer modificações estruturais como a adição de radicais, passa a ser designada como terpenóide (Zwenger e Basu, 2008).. acetil CoA 3x 3x acetil CoA. piruvato + fosfato gliceraldeído. TPSb TPSg TPSf (TPSa). IPP. DMAPP. IPP. GPP. Via do Mevalonato. DMAPP CITOPLASMA. monoterpenos. TPSb. mevalonato. PLASTOS. hemiterpenos. Via do Mevalonato Independente. GPP. FPP. FPP. GGPP. triterpenos escaleno esteróis. TPSa. sesquiterpenos ubiquinona. diterpenos carotenóides fitol. TPSc TPSe. tetraterpenos. Figura 1.4 – Locais e produtos da biossíntese dos terpenos (adaptados de Keszei et al., 2008).. 7.
(20) Introdução. A molécula de isopreno, derivada do metabolismo do ácido mevalónico, por acção enzimática de penteniltransferases, origina a síntese de isopentenil difosfato (IPP) que por isomerização leva à formação de dimetilalil difosfato (DMAPP) (Waterman, 1993; Dewick, 1997). Estes dois isómeros servem de precursores às duas vias de biossíntese dos terpenos: a via do mevalonato que decorre no citoplasma celular conduzindo à síntese dos sesquiterpenos e dos triterpenos, e uma via alternativa, conhecida por mevalonato-independente ou dioxixilulose fosfato (DOXP), que origina a síntese dos monoterpenos, diterpenos e tetraterpenos no interior dos plastos (Fig.1.4) (Theis e Lerdau, 2003; Cheng et al., 2007). No entanto, a troca bidireccional de substratos dos plastos para o citoplasma entre estas duas vias alternativas é frequente (Laule et al., 2003). Por acção de preniltransferases, a molécula de DMAPP pode ser condensada com uma, duas ou três unidades de IPP, originando moléculas de geranil difosfato (GDP), farnesil difosfato (FDP) e geranilgeranil difosfato (GGDP), respectivamente (Böhlmann et al., 1998). Contendo 10, 15 e 20 átomos de carbono, o GPP, o FDP e o GGDP servem de precursores à classe de moléculas monoterpénicas, sesquiterpénicas e diterpénicas, respectivamente (Trapp e Croteau, 2001). A estas reacções catalisadas por terpenos sintases, igualmente designadas por terpeno ciclases devido a originarem moléculas cíclicas (Böhlmann et al., 1998), seguem-se muitas outras modificações de oxidação ou redução de cadeias duplas assim como a adição de moléculas de oxigénio conduzindo à formação de álcoois (-OH), cetonas (=O), aldeídos (-COH) e ésteres (-OCO) (Waterman, 1993), originando deste modo a enorme diversidade de compostos secundários presentes nas plantas.. . Fenóis. Os fenóis são genericamente caracterizados como estruturas químicas, que não sendo azotadas, possuem um ou mais anéis benzénicos com um ou mais grupos hidroxilo associados (Proença da Cunha e Roque, 2005a). Destes, destacam-se os ácidos fenólicos, as cumarinas, os flavonóides, os taninos e os compostos quinónicos (Proença da Cunha e Roque, 2005a).. fosfoenolpiruvato (Via da Glicólise). acetato de cinamilo ácido xiquímico. fenilalanina. 4-fosfo-eritrose (Via da Pentose Fosfato). ácido cinâmico. cumarinas ácidos fenólicos. fenilpropanóides. Figura 1.5 – Via metabólica do ácido xiquímico (adaptado de Başer e Demirci, 2006).. Os fenóis podem ser biossintetizados por duas vias metabólicas: pela via do ácido xiquímico (Figura 1.5) e pela via do ácido malónico ou do acetato (Edwards e Gatehouse, 1999). A primeira tem origem no próprio ácido xiquímico, resultante da condensação do fosfoenolpiruvato e da 4-fosfo-eritrose da via da glicólise e da via da pentose fosfato, respectivamente, sendo desta forma responsável pela biossíntese da maior parte dos compostos fenólicos presentes nas plantas, nomeadamente os aminoácidos aromáticos fenilalanina, triptofano e tirosina (Waterman, 1993; Edwards e Gatehouse, 1999; Proença da Cunha e Roque, 2005a). Posteriormente, a fenilalanina é convertida por acção enzimática em ácido cinâmico, traduzindo-se esta na fase mais importante da via metabólica, uma vez que o ácido cinâmico serve de base à síntese de muitos outros 8.
(21) Introdução. compostos fenólicos: as cumarinas, os ácidos fenólicos, e os fenilpropanóides (Waterman, 1993; Başer e Demirci, 2007). Quanto à via do ácido malónico ou do acetato originam ácidos β-policetometilénicos, que por ciclização dão compostos fenólicos (Proença da Cunha e Roque, 2005a).. 1.4.2. Bioquímica e função dos metabolitos secundários A função que os metabolitos secundários desempenham na vida da planta continua a suscitar interesse no mundo científico. Muitos deles auxiliam à síntese de outros metabolitos primários, tais como hormonas, transportadores de electrões, fitoesteróis e carotenóides (Trapp e Croteau, 2001; Theis e Lerdau, 2003; Zwenger e Basu, 2008). Sendo considerada uma resposta ecológica comum a todas as espécies vegetais, a libertação de voláteis pelos órgãos vegetativos da planta tem por objectivo a dissuasão a ataques de fitófagos ou curiosamente a atracção de predadores naturais desses fitófagos (Cheng et al., 2007), a defesa contra agentes patogénicos como fungos e bactérias (Edwards e Gatehouse, 1999), a atracção de insectos auxiliares quer na polinização quer na dispersão de sementes (Carvalho e Fonseca, 2006) e efeitos alelopáticos inibindo a germinação de plantas próximas (Torras et al., 2007). Desempenham um importante papel na economia hídrica das plantas, contribuindo na regulação da evapotranspiração ao saturarem o ambiente envolvente dos estomas, regulando igualmente a temperatura interna da planta por reflexão das radiações, proporcionada pelas propriedades das secreções de aumentarem o brilho da superfície foliar (Proença da Cunha et al., 2005). As estruturas físicas como tricomas e espinhos, em algumas espécies, funcionam como barreiras de defesa exteriores aos agentes invasores (Cheng et al., 2007). No decorrer das últimas décadas, o interesse comercial nos terpenos, essencialmente sob a forma de óleos essenciais, foi aumentando em consequência das suas comprovadas actividades antimicrobianas (Lambert et al., 2001; Burt, 2004), antifúngicas (Wang et al., 2005), antioxidantes (Grassmann, 2005), como protectores contra pragas de culturas agrícolas (Isman, 2000) ou de armazém (Liu e Ho, 1999) e pela sua potencial aplicação na prevenção e terapia de diversas doenças (Briskin 2000; Williamson, 2001), incluindo o cancro (Edris, 2007). Estas actividades terapêuticas estão geralmente associadas à presença de compostos oxigenados com reduzido tamanho molecular, capazes de estabelecer pontes de hidrogénio com hidrossolubilidade razoável, sendo disso exemplo o timol, o carvacrol, o eugenol, o linalol, o geraniol, o aldeído cinâmico, o neral ou o geranial. A acção destes compostos vai incidir na modificação da permeabilidade da membrana dos microrganismos e por inibição de enzimas da cadeia respiratória, comprometendo o balanço energético da célula (Proença da Cunha et al., 2005).. 1.4.3. Metabolitos secundários na quimiotaxonomia O potencial valor dos metabolitos secundários na quimiotaxonomia tem contribuído nas últimas décadas para abordagens na sistemática vegetal, tendo sido desenvolvidas classificações filogenéticas com base na distribuição desses metabolitos (Wink, 2003), consistindo assim numa alternativa às tradicionais análises sistemáticas e filogenéticas. A existência de quimiotipos pode ser definida pela produção de óleos essenciais em plantas da mesma espécie, que apresentem diferenças acentuadas quer na composição química quer nas suas propriedades associadas (Torras et al., 2007). Essas variações químicas intraespecíficas não são resultado apenas da simples presença ou ausência de um composto químico, estando associadas a determinados 9.
(22) Introdução. factores que podem influenciar a produção, tais como variações fisiológicas, condições ambientais, variações geográficas, factores genéticos e evolutivos e condições político-sociais (Figueiredo et al., 2008). Alguns secretados contêm centenas de compostos, alguns dos quais biologicamente activos, contribuindo para o sucesso evolutivo das espécies que os produzem (Ascensão, 2007). A própria acção da selecção natural desempenha um papel fundamental no processo evolutivo (Wink, 2003), existindo inúmeras referências bibliográficas que relatam a caracterização e taxonomia de espécies vegetais, determinando alterações na produção e na composição dos óleos essenciais. A caracterização da componente volátil, e reconhecimento da existência de diversos quimiotipos presentes nas espécies do género Mentha, foi fundamental para os taxonomistas definirem espécies, entenderem os padrões das variações intraespecíficas e detectarem indivíduos híbridos em populações (Kokkini, 1992). Estas diferenças na composição química volátil, que não dependem directamente de factores extrínsecos e fisiológicos, permitem caracterizar geneticamente a espécie, decorrendo da expressão de vias metabólicas distintas em consequência de pequenas diferenças genéticas (Proença da Cunha et al., 2005). As espécies do género Thymus, e em particular Th. caespititius descrito anteriormente, são um bom exemplo destas alterações genéticas intraespecíficas. A elevada variabilidade química verificada nos indivíduos colhidos na ilha de S. Jorge, numa distância de cerca de 200m, e a ausência de diferenças fenotípicas sustentam a hipótese dos factores genéticos determinarem as diferenças entre esses indivíduos (Pereira et al., 2000). Este estudo genético foi considerado no presente trabalho, através da análise das terpeno sintases, sendo descritos resultados preliminares para os quimiotipos em estudo.. 1.5. Marcadores moleculares No decorrer dos últimos anos tem-se assistido ao desenvolvimento de diferentes tipos de marcadores genéticos aplicados com sucesso na genotipagem de plantas (Wünsch e Hormaza, 2002; Gupta e Rustgi, 2004). Esses marcadores genéticos podem ser agrupados em três classes principais: marcadores morfológicos e agronómicos, avaliados com base em características visuais; marcadores bioquímicos, baseados em produtos de genes como proteínas, em particular enzimas; e marcadores moleculares, que dependem da análise do material genético, o DNA (Semagn et al., 2006). O desenvolvimento e utilização de marcadores moleculares para a detecção de polimorfismos de DNA em plantas foi um dos avanços mais explorados na área da genética molecular (Jones et al., 1997). Definidos como sequências específicas de DNA identificáveis e representativas das diferenças ao nível do genoma, os marcadores moleculares diferem no seu modo de transmissão (herança nuclear bipaterna ou materna), no modo de acção dos genes (marcadores dominantes ou co-dominantes) e nos métodos de análise (marcadores por hibridação ou baseados na reacção de polimerase em cadeia – PCR) (Schlötterer, 2004; Semagn et al., 2006; Agarwal et al., 2008). Oferecendo inúmeras vantagens em relação aos marcadores morfológicos, os marcadores moleculares são estáveis e detectáveis em todos os tecidos, independentemente da diferenciação ou do desenvolvimento do organismo, sendo independentes da influência do ambiente e dos efeitos pleiotrópicos (múltiplos efeitos resultantes de um único gene) e epistáticos (interacções génicas) (Joshi et al., 2004; Agarwal et al., 2008). Para serem considerados ideais, os marcadores moleculares devem obedecer aos seguintes 10.
(23) Introdução. critérios: (1) serem polimórficos e estarem uniformemente distribuídos ao longo do genoma; (2) serem resolutivos quanto às diferenças genéticas; (3) gerarem diferenças múltiplas, independentes e fiáveis; (4) de execução fácil, rápida e com baixos custos; (5) requererem pequenas quantidades de amostra de DNA; (6) caracterizarem fenótipos distintos e (7) não necessitarem de informação prévia sobre o genoma do organismo em estudo (Agarwal et al., 2008). No entanto, as suas diferenças de princípios, metodologias e aplicações (Tabela 1.3) não permitem a existência de um marcador ideal para todas as situações, requerendo uma escolha cuidada e direccionada de acordo com os objectivos pretendidos da análise (Hammer et al., 2003; Semagn et al., 2006). Tabela 1.3 - Comparação entre os marcadores moleculares de DNA mais utilizados na análise de plantas (adaptado de Semagn et al., 2006).. Abundância no genoma Parte do genoma detectado Quant. DNA necessário Nível de polimorfismo Tipo de polimorfismo Quantidade loci analisados Herança genética Detecção de alelos Reprodutibilidade Nível de tecnologia necessária Automatização do método Tipo de sondas/ primers Clonagem e/ou sequenciação Detecção por radioactividade Utilidade para mapeamento genético. RFLP elevada regiões codificantes elevada médio inserção ou delecção numa única base pequena co-dominante sim elevada. SSR média. RAPD muito elevada. AFLP muito elevada. ISSR média. todo genoma. todo genoma. todo genoma. todo genoma. pequena elevado. média co-dominante sim elevada. pequena elevado inserção ou delecção numa única base média dominante não baixa. média muito elevado inserção ou delecção numa única base elevada dominante não elevada. pequena elevado inserção ou delecção numa única base média dominante não média. elevada. baixa. baixa. elevada. baixa. baixa. elevada sequências de DNA com repetições específicas sim não especificidade para a espécie. média. média. primers aleatórios com 10 pares de bases. sequências específicas. não não. não sim /não. média sequências de DNA com repetições específicas não não. inter-específico. inter-específico. inter-específico. poucas cópias de DNA genómico ou de cDNA sim sim especificidade para a espécie. tamanho das repetições. Na última década, muitos foram os trabalhos desenvolvidos recorrendo ao uso de marcadores moleculares para a identificação e caracterização de diferentes espécies vegetais, tais como os RAPDs (Random Amplified Polymorphic DNA) (Gounaris et al., 2002; Syamkumar e Sasikumar, 2007; Trindade et al., 2008), AFLPs (Amplified Fragment Length Polymorphisms) (Després et al., 2002 ; Sarwat et al., 2008), ISSRs (Inter Simple Sequence Repeats) (Qiu et al., 2004; Yao et al., 2008), SSRs (Simple Sequence Repeats) (Hayden et al., 2008; Luro et al., 2008), RFLPs (Restriction Fragment Length Polymorphism) (Paran et al., 2004; Lee et al., 2008) e SNPs (Single Nucleotide Polymorphism) (Ching et al., 2002; Zhu et al., 2003).. 1.5.1. RAPDs (Random Amplified Polymorphic DNA) Os RAPDs são uma classe de marcadores moleculares baseados na amplificação aleatória do gDNA pela reacção de PCR (Polymerase Chain Reaction). Utilizando sequências curtas de 10 nucleótidos (primers decâmeros), permitem obter polimorfismos traduzidos por produtos de reacção específicos, devido ao rearranjo ou delecção de bases na zona de ligação aos primers (Schlötterer, 2004; Agarwal et al., 2008). Visualmente, esses polimorfismos entre indivíduos 11.
(24) Introdução. baseiam-se na presença ou ausência de fragmentos de DNA amplificados (Wünsch e Hormaza, 2002). A separação dos produtos de amplificação de uma reacção de RAPDs é feita maioritariamente por electroforese em gel de agarose corado com brometo de etídio, que se intercala com as cadeias de DNA, permitindo a sua visualização sob luz ultravioleta (Semagn et al., 2006). Dispensando um conhecimento prévio do genoma em estudo, a metodologia de RAPDs apresenta outras vantagens associadas, como a sua simplicidade, rapidez e tecnologia de baixo custo, constituindo uma das ferramentas mais utilizadas para estudos preliminares de caracterização e similaridade genética em plantas (Wünsch e Hormaza, 2002). São marcadores segregados pelos alelos de forma dominante, não necessitando de quantidades de DNA muito elevadas. No entanto, um dos factores que limita e penaliza a sua ampla utilização é a dificuldade em obter resultados reprodutíveis entre diferentes laboratórios (Schlötterer, 2004). Um dos critérios fundamentais para se obterem resultados repetíveis com fiabilidade no padrão de bandas obtido, é a consistência nas condições das reacções testadas, nomeadamente na concentração dos primers, do MgCl2 e da Taq polimerase (Jones et al., 1997). No entanto, He et al. (1994) (in Jones et al., 1997) verificaram que a utilização de diferentes termocicladores pode igualmente influenciar a falta de repetibilidade e reprodutibilidade dos resultados. Devido à utilização de um número praticamente ilimitado de primers decâmeros universais, podem existir no genoma diversas regiões que lhes são complementares, não permitindo distinguir entre indivíduos heterozigóticos e homozigóticos (Agarwal et al., 2008). Consequentemente, o padrão de amplificação obtido com o mesmo material em estudo pode variar entre os diferentes ensaios (Jones et al., 1997). Tendo em conta a metodologia destes marcadores arbitrários, a utilização de pequenas sequências de primers complementares ao DNA em estudo, faz com que a reacção de PCR se realize com temperaturas de annealing baixas, geralmente entre os 34 e os 37ºC (Semagn et al., 2006). De modo a não comprometer o sucesso da reacção de PCR, para além dos factores já mencionados, é necessário ter em conta que os primers: (1) devem possuir o teor mínimo de 40% de GC (guanina/ citosina), sendo que valores inferiores podem não resistir à temperatura de 72ºC necessária à extensão do DNA pela enzima Taq polimerase; e (2) ter ausência de sequências palindrómicas (Semagn et al., 2006).. 1.5.2. ISSRs (Inter Simple Sequence Repeats) O primeiro registo da utilização de marcadores moleculares ISSRs data do ano 1994 (Zietkiewicz et al., 1994; Gupta et al., 1994). O desenvolvimento desta metodologia surgiu no seguimento de colmatar algumas das desvantagens que outros marcadores apresentavam, nomeadamente a falta de reprodutibilidade dos RAPDs, os elevados custos dos AFLPs e a necessidade, no caso dos SSRs, do conhecimento prévio do genoma da espécie em estudo de modo a ser possível desenhar primers específicos (Terzopoulos et al., 2005). Pertencendo à mesma classe de marcadores moleculares que os RAPDs, os ISSRs envolvem a amplificação de segmentos de DNA através de reacções de PCR, revelando polimorfismos através de sequências repetidas no genoma (Figura 1.6) (Semagn et al., 2006). A metodologia destes marcadores baseia-se numa variação do princípio aplicado por outro tipo de marcadores moleculares, os microssatélites ou SSRs, por ancoragem terminal de um primer, havendo amplificação de dois SSR do mesmo tipo (Wünsch e Hormaza, 2002). O polimorfismo desenvolvido decorre da falta de um dos SSR no genoma, em consequência de uma delecção ou 12.
(25) Introdução. inserção, modificando desse modo a distância entre as repetições (Wünsch e Hormaza, 2002). Os primers utilizados possuem entre 15-20 nucleótidos, aumentando assim a sua especificidade em comparação com os RAPDs. Estes marcadores são úteis em estudos de diversidade genética, na área da filogenética, de mapeamento genético e na biologia do desenvolvimento de inúmeras espécies vegetais (Reddy et al., 2002), revelando polimorfismos intraespecíficos, segregados de acordo com as leis Mendelianas (Zietkiewicz et al., 1994).. Repetição CA DNA genómico Repetição CA. Produto de PCR primer ancorado região 3’. Produto de PCR primer ancorado região 5’. Figura 1.6 – Esquema exemplificativo da amplificação de uma sequência de DNA genómico com marcadores moleculares ISSR, com um primer constituído por repetições de nucleótidos (CA)n, ancorados na região 3’ (setas brancas) ou na região 5’ (setas pretas) (adaptado de Zietkiewicz et al., 1994).. 1.6. Terpeno sintases Sabe-se que a produção qualitativa dos metabolitos secundários é regulada por processos genéticos e por interacções entre genes. Nos últimos anos, tem-se assistido a um crescente interesse no desenvolvimento de técnicas bioquímicas e moleculares, no que diz respeito à investigação de voláteis de plantas, tendo sido já identificados um grande número de genes que codificam para a sua biossíntese (Liu et al., 2002). A caracterização in vitro da expressão de enzimas tem sido uma ferramenta fundamental no esclarecimento dessas vias biossintéticas de voláteis, especialmente pela determinação dos seus substratos e especificidade dos seus produtos (Dudareva et al., 2004). Outras publicações recentes, relatam o uso de metodologias alternativas incluindo bases de dados de expressed sequence tag (EST) e de DNA complementar (cDNA), cDNAs conjugados com a tecnologia AFLP e tecnologia de microarrays (Goossens et al., 2003). Como mencionado anteriormente, a regulação da síntese dos terpenos deriva primariamente da molécula de GPP, podendo no entanto evoluir de diferentes formas, originando assim uma complexa família de compostos terpénicos (Figura 1.7). A sua biossíntese contempla duas etapas essenciais: a primeira consiste na síntese das diferentes estruturas de terpenos por intermédio de uma complexa série de reacções enzimáticas, originando sub-famílias de compostos com um esqueleto comum; na segunda etapa, ocorre uma série de transformações tais como ciclização, 13.
(26) Introdução. oxidação ou metilação desses compostos de esqueleto químico comum (Torras et al., 2007). Este facto conduz à síntese de uma enorme diversidade de compostos terpénicos através de um reduzido número de catálises processadas pela família de enzimas designadas de terpeno sintases (TPS) (Torres et al., 2007; Keszei et al., 2008).. piperitona. thujol geranial. p-ment-2-en-1-ol. -felandreno. piperitol. -felandreno. -tujeno. citronelol geraniol. sabineno. citronelal linalol. hidrato de sabineno. ocimeno terpineno-4-ol. mirceno. α-terpineno. GPP canfenona. canfeno. -terpineno. p-cimeno terpinoleno. borneol. acetato de bornilo. borneno. 1,8-cineole. acetato de mirtenilo -pineno. α-terpineol. mirtenol α-pineno. mirtenal. -3-careno limoneno. -4-careno. pinocarvona pinocarveol p-mentatrieno isopiperitol. -terpineol isopulegol. carveol. carvona. acetato de α-terpinilo. Figura 1.7 – Compostos monoterpénicos biossintetisados a partir da molécula de geranil difosfato (GPP), por intermédio de enzimas terpeno sintases (adaptado de Keszei et al., 2008).. Estes mecanismos foram já alvo de vários estudos (por exemplo: Trapp e Croteau, 2001; Greenhagen et al., 2006; Hyatt et al., 2007), permitindo esclarecer que as enzimas envolvidas na síntese de diferentes produtos não são específicas, estando dependentes da estrutura química do precursor (Keszei et al., 2008). No entanto, são conhecidas algumas excepções, incluindo exemplos como a geraniol sintase em Cinnamomum tenuipilum e em Ocimum basilicum, e a 1,8-cineole, a limoneno e a trans-β-ocimeno sintases em Citrus unshiu, sendo enzimas produto14.
(27) Introdução. específicas (Keszei et al., 2008). Esta evolução de conhecimentos foi fortemente impulsionada pela acessibilidade de informação massiva sobre o DNA em bases de dados públicas, havendo paralelamente o desenvolvimento tecnológico de ferramentas que permitiam explorar o uso de tal informação, a Bioinformática (Rueff et al., 2002; Wink, 2003).. 1.6.1. Classificação das TPS Em 1998, Böhlmann et al. classificaram as TPS em sub-famílias, baseando-se o critério de identificação em 40% de homologia na sequência de aminoácidos, designando-as como: . TPSa – sesquiterpeno e diterpeno sintases em Angiospérmicas,. . TPSb – monoterpeno sintases em Angiospérmicas; estas têm sido gradualmente alvo de estudo principalmente em Lamiaceae, Salicaceae, Rutaceae, Brassicaceae, Vitaceae e Asteraceae (Keszei et al., 2008);. . TPSc e TPSe – diterpeno sintases responsáveis pela ciclização dos diterpenos;. . TPSd - monoterpeno, sesquiterpeno e diterpeno sintases em Gimnospérmicas;. . TPSf e TPSg – monoterpeno sintases activas na fase floral.. Estas duas últimas sub-famílias, TPSf e TPSg, estão directamente envolvidas nas fases primordiais do metabolismo primário, auxiliando à síntese das giberelinas. Esta actividade biossintética sugere que a bifurcação das TPS do metabolismo primário e secundário ocorre antes da separação entre Angiospérmicas e Gimnospérmicas (Trapp e Croteau, 2001). Apesar de toda a diversidade de estruturas químicas que originam, as enzimas TPS apresentam características físicas e químicas comuns, como por exemplo, necessitarem de apenas um ião metálico divalente (Mg2+ ou Mn2+) como cofactor para a reacção de catálise, e de funcionarem com um ponto isoeléctrico (pI) cerca de 5.0 e com pH óptimo próximo da neutralidade. No entanto, em Gimnospérmicas as TPS diferem um pouco nesses requisitos, utilizando iões monovalentes como o K+ e um pH óptimo com valor mais elevado (Böhlmann et al., 1998; Trapp e Croteau, 2001).. 1.6.2. Mecanismos de variação genética As diferentes famílias de TPS partilham uma origem evolucionária comum, baseada nos seus mecanismos de reacções similares, nas estruturas conservadas e características das sequências, nomeadamente a homologia das sequências de aminoácidos, as zonas conservadas dessas sequências, o número de intrões existentes e o tamanho dos exões (Trapp e Croteau, 2001). Apesar da sua multi-funcionalidade, basta haver uma substituição num único nucleótido, para que aquando do mecanismo de transcrição essa alteração produza um aminoácido diferente e consequentemente altere o produto de reacção de uma determinada terpeno sintase (Wu et al., 2005). Baseado no facto da expressão de genes das TPS ser regulada em células altamente especializadas como os tricomas glandulares, ou estar restrita a um determinado estado de desenvolvimento, ou estar ainda limitada a curtos períodos de tempo em resposta a reacções de defesa contra agentes externos, a sua análise molecular é desenvolvida essencialmente com recurso ao isolamento de mRNA do material vegetal em estudo (Böhlmann et al., 1998). Deste 15.
Imagem




Outline
Documentos relacionados
Quando você seleciona o modo manual no painel, você pode alterar a velocidade e inclinação da esteira, bastando para isso tocar num botão.. À medida que você se exer- cita, o
Nesse sentido, apresentamos uma proposta de ensino e aprendizagem utilizando a Aprendizagem Baseada em Projetos (ABP) como metodologia colaborativa interdisciplinar apoiada
Da análise de todo o material supramencionado, foi possível concluir que (i) não há estatísticas fidedignas sobre o tráfico de pessoas e, especialmente, sobre o tráfico
Núcleo de Pesquisa e Extensão do Curso de Direito – NUPEDIR VIII MOSTRA DE INICIAÇÃO CIENTÍFICA (MIC).. 20 de novembro
Assim, pode-se elencar os pontos fortes e fracos do modelo de decisão multicritério proposto na tese e aplicado em uma organização de serviços: a Pontos fortes: Permite reunir
Ora, essas questões deslocaram-se rapidamente, apontando para o entendimento da imagem (fotográfica, caricatural ou pictórica) em sua dimensão mais ampla, buscando os
Corresponding authors who have published their article open access do not receive a Share Link as their final published version of the article is available open access on
Neste trabalho, após analisar a trajetória das mulheres brasileiras na política e a importância da educação infantil para o desenvolvimento econômico e social,