UNIVERSIDADE DE SÃO PAULO
FACULDADE DE CIÊNCIAS FARMACÊUTICAS
Programa de Pós-Graduação em Ciência dos Alimentos
Área de Concentração: Bromatologia
Estudo da interação entre lipoxigenase da soja e ácido
ascórbico nas propriedades reológicas e sensoriais de pães
Roberto de Moraes Junqueira Junior
Dissertação para obtenção do Título de
MESTRE Orientadora:
Profa. Dra. Inar Alves de Castro
UNIVERSIDADE DE SÃO PAULO
FACULDADE DE CIÊNCIAS FARMACÊUTICAS
Programa de Pós-Graduação em Ciência dos Alimentos
Área de Concentração: Bromatologia
Estudo da interação entre lipoxigenase da soja e ácido
ascórbico nas propriedades reológicas e sensoriais de pães
Roberto de Moraes Junqueira Junior
Dissertação para obtenção do Título de
MESTRE Orientadora:
Profa. Dra. Inar Alves de Castro
Roberto de Moraes Junqueira Junior
Estudo da interação entre lipoxigenase da soja e ácido ascórbico
nas propriedades reológicas e sensoriais de pães
Comissão Julgadora da
Dissertação para obtenção do grau de Mestre
Profa. Dra. Inar Alves de Castro Orientadora/Presidente
1º examinador
2º examinador
"...one of the strongest motives that lead men to art and science is escape from
everyday life with its painful crudity and hopeless dreariness, from the fetters of
one's own ever-shifting desires. A finely tempered nature longs to escape from the
personal life into the world of objective perception and thought."
"...um dos motivos mais fortes que levam os homens para a arte e a ciência é
escapar da vida diária, com sua crueza dolorosa e aridez irremediável, e da
ardência dos próprios desejos, que sempre mudam. Uma natureza finamente
temperada almeja escapar da vida pessoal para o mundo da percepção objetiva e
do pensamento".
AGRADECIMENTOS
À Profa. Inar Alves de Castro que me acolheu em seu laboratório e compartilhou seu conhecimento de forma desprendida, incentivando e ensinando com método e disciplina. Apostou fielmente na idéia deste projeto com estudo e dedicação e diante das inúmeras dificuldades, foi inabalável, inspirando grande confiança para vencer os obstáculos que surgiram nessa extraordinária jornada de quase 4 anos da qual surgiu uma grande amizade.
Ao Prof. João Roberto Oliveira do Nascimento, que me ouviu sem preconceitos, me abriu as portas da Faculdade e acreditou no meu objetivo, sempre incentivando o estudo e a idéia da pós-graduação.
À Profa. Bernadette Dora Gombossy de Mello Franco que acreditou na minha vontade de concretizar este projeto e com imparcialidade e profissionalismo me estimulou e apontou o caminho.
À Profa. Beatriz Rosana Cordenunsi pelo apoio e confiança.
À Prof. Ursula Maria Lanfer Marques pelos valiosos comentários acerca de métodos e resultados.
Ao Prof. Maurílio Moreira da Universidade Federal de Viçosa que compartilhou e ensinou métodos e idéias essenciais desse projeto.
À Mariana Carrapeiro e Vânia Monteiro, minhas colegas de laboratório, pela amizade e prazer da convivência.
À todos do laboratório: Miriam, Kelen, Luciene, Marliz e Joana que tiveram tanta paciência comigo, e pela valiosa ajuda.
Ao Jorge Alves de Lima e a Elaine Midori Ychico da secretaria do programa de pós-graduação, e a Maria José da Silva da Secretaria da Graduação que sempre me orientaram com paciência e atenção.
Às secretárias do Departamento de Alimentos e Nutrição Experimental, Mônica Dealy Perussi e Tânia Cacheiro pela paciência e disposição
À Adriana Barreiros da Biblioteca pela ajuda e sugestão na formatação escrita deste trabalho e à Leila Bonádio da BCQ pela ajuda nas referências.
Ao Fabrício Leal Rocha da Granotec do Brasil pela gentileza, profissionalismo e disponibilidade para contribuir significativamente neste trabalho na base científica da panificação e sobretudo nos testes práticos de panificação, sem o qual este trabalho não teria sido possível.
Aos competentes Anderson, Geni e Dayane da Granotec do Brasil, que nos ensinaram e acompanharam os testes de panificação que foram decisivos para este projeto.
À Cargill-Tatuí, na pessoa do Sebastião Mendes, que desde o inicio acompanhou com genuíno interesse esta pesquisa e nos ensinou e compartilhou valioso conhecimento sobre trigo e pães.
Ao Maurício Sandri (Moinho Paulista) pelo seu interesse no tema ao executar ensaios e enriquecer a discussão sobre mecanismos bioquímicos.
Ao Eng. Giovanni Perticara (Moinho Anaconda) por tornar possíveis os nossos infindáveis testes de panificação, e pelas saudáveis discussões e sugestões.
À Carol Conti pela gentileza e disponibilidade nos ensaios no laboratório da Faculdade de Saúde Pública da USP e todas as consultas posteriores.
AGRADECIMENTOS ESPECIAIS
À Tatiana, minha esposa, pelo apoio incondicional, incentivo, paciência e compreensão.
Ao Rogério Tieppo, com sua grande generosidade e tolerância, nunca deixou de me apoiar na busca do meu objetivo.
Ao Prof. Márcio Felix de Carvalho pelas inúmeras e divertidas aulas de química.
LISTA DE FIGURAS
Figura 1. Produção mundial de trigo em 2004 em milhões de toneladas. ...4
Figura 2. Consumo de pão por ano per capita em kg. ...5
Figura 3. Grão de trigo (corte transversal e seccional) ...6
Figura 4. Molécula de Luteína (C40H5602) ...8
Figura 5. Fatores que regem a qualidade da panificação e propriedades reológicas da massa panificável. ... 11
Figura 6. Estrutura molecular da glutationa reduzida (GSH) e oxidada (GSSG). .... 12
Figura 7. Oxidação do ácido ascórbico pelo oxigênio e da GSH pelo DHAA e mecanismo de formação do PSSG... 13
Figura 8. Estrutura proposta das moléculas do glúten... 17
Figura 9. Clivagem do peróxido de benzoíla... 20
Figura 10. Natureza química do ácido ascórbico e do ácido desidroascórbico.22 Figura 11. Reações propostas para explicar o efeito melhorador do ácido ascórbico de acordo com a hipótese de Grosch. ... 23
Figura 12. Produtos da LOX e especificidade posicional a partir da oxidação do ácido linoléico. ... 24
Figura 13. Modelo do ácido linoléico na estrutura do sitio do ferro na LOX... 26
Figura 14. Mecanismo proposto da reação da LOX... 28
Figura 15. Mecanismo proposto para o branqueamento aeróbico de pigmentos carotenóides. ... 30
Figura 17. Delineamento experimental “centróide-simplex” ... 38
Figura 18. Avaliação sensorial da cor das farinhas... 42
Figura 19. Sistema de cores CIE Lab. ... 43
Figura 20. Alveógrafo Chopin ... 44
Figura 21. Forma para fermentação e forneamento de pão tipo americano. .... 45
Figura 22. Texturômetro Texture Analyser TA-XT2i ... 46
Figura 23. Teste sensorial da elasticidade do pão... 47
Figura 24. Atividade da lipoxigenase acompanhada por espectrofotometria na faixa do ultravioleta. ... 51
Figura 25. Resistência à extensão (P) das diferentes misturas. ... 52
Figura 26. Extensibilidade da massa (L) das diferentes misturas. ... 53
Figura 27. Cor instrumental das misturas de farinha de trigo. ... 54
Figura 28. Curvas de contorno obtidas pelo modelo polinomial ajustado à elasticidade da massa (P) em mm... 59
Figura 29. Curvas de contorno obtidas pelo modelo polinomial ajustado à extensibilidade da massa (L) em mm. ... 59
Figura 30. Curvas de contorno obtidas pelo modelo polinomial ajustado à luminosidade (Lc) da farinha... 60
Figura 31. Determinação de cor em pães usando um colorímetro tipo Minolta.65 Figura 32. Pães Franceses preparados sem melhoradores de panificação. .... 66
Figura 33. Masseiras computadorizadas ... 67
Figura 34. Massas modeladas a mão em 2 kg. ... 67
LISTA DE TABELAS
Tabela 1. Peso e composição das partes do grão do trigo de farinhas com diferentes graus de extração...6 Tabela 2. Conteúdo de lipídios livres e sua distribuição no grão. ...9 Tabela 3. Composição química da farinha de soja e farinha de trigo. ... 49
LISTA DE SIGLAS
13-HPOD 13-hidroperóxido de ácido linoléico 9-HPOD 9-hidroperóxido de ácido linoléico AA ácido ascórbico
AAO ascorbato oxidase ADA azodicarbonamida ANOVA análise de variância DHAA ácido desidroascórbico DP desvio padrão
FAO Food Agricultural Organization (Organização das Nações Unidas para a Agricultura e Alimentação)
FIS farinha integral de soja GS subunidades de glúten GSH glutationa reduzida GSH-DH glutationa dehidrogenase GSSH glutationa oxidada
HMV-GS subunidades de glúten de alto peso molecular LA ácido linoléico
Lc luminosidade
LH ácidos graxos
LMV-GS subunidades de glúten de baixo peso molecular LOX lipoxigenase
MSR metodologia de superfície de resposta PBZ peróxido de benzoíla
pI ponto isoelétrico
PSH grupos sulfidrila da proteína do glúten PSSG proteína-glutationa
PSSP ligações protéicas do glúten PUFA ácidos graxos polinsaturados SH grupos sulfidrila
SUMÁRIO
LISTA DE FIGURAS ... v
LISTA DE TABELAS...viii
LISTA DE SIGLAS ... x
SUMÁRIO ... xi
1. INTRODUÇÃO...1
2. REVISÃO DE LITERATURA...3
2.1 Trigo (Triticum aestivum) ...3
Aspectos Econômicos ...3
2.2 Morfologia e composição ...5
Pigmentos ...7
Lipídios do trigo e da farinha ...8
Proteínas do trigo ...9
Glutationa ...12
2.3 Farinha de trigo... 13
A panificação e os principais ingredientes ...14
A mistura da massa...15
Métodos reológicos ...17
2.4 Aditivos...18
Oxidantes ...19
Peróxido de benzoíla...20
Ácido ascórbico ...21
Lipoxigenase ...23
Mecanismo de oxidação de carotenóides ...29
Mecanismo de fortalecimento da matriz do glúten ...31
A lipoxigenase e a soja ...33
2.5 A metodologia de superfície de resposta... 34
3. OBJETIVOS [PARTE 1] ... 36
4.1 Material ... 37
4.2 Delineamento experimental das massas ... 37
4.3 Delineamento experimental dos pães... 38
4.4 Métodos ...39
Preparo das misturas ...39
Fortificação da farinha de trigo ...39
Determinação da composição centesimal ...39
Determinação da atividade da lipoxigenase ...40
Determinação do conteúdo de ferro nas farinhas de soja ...41
Análise sensorial da cor das farinhas...42
Análise instrumental da cor das farinhas e dos pães ...42
Propriedades reológicas...43
Preparo dos pães ...44
Análise de volume dos pães...45
Propriedades de textura ...46
Avaliação sensorial dos pães ...46
Modelagem e otimização das regressões ...48
Análise estatística ...48
5. RESULTADOS [PARTE 1]... 49
5.1 Composição química ...49
5.2 Atividade de lipoxigenase da farinha de soja ...50
5.3 Propriedades reológicas da massa ...52
5.4 Cor das misturas com farinha de trigo...54
5.5 Cor dos pães ...55
5.6 Volume dos pães...55
5.7 Textura (maciez) dos pães ...56
5.8 Avaliação sensorial dos pães ...56
5.9 Modelos polinomiais das misturas de farinha de trigo...57
5.10 Otimização e validação do modelo das misturas de farinha de trigo...60
6. OBJETIVOS [PARTE 2] ... 62
7.1 Material ... 63
7.2 Delineamento experimental ... 63
7.3 Métodos ...64
Determinação da composição centesimal ...64
Determinação da atividade da lipoxigenase ...64
Análise instrumental da cor dos pães...65
Propriedades reológicas...65
Preparo dos pães ...66
Análise de volume dos pães...69
Avaliação sensorial dos pães ...69
Análise estatística ...70
8. RESULTADOS [PARTE 2]... 72
8.1 Composição química da farinha de trigo ...72
8.2 Atividade de lipoxigenase nas farinhas ...72
8.3 Propriedades reológicas...73
8.5 Modelos polinomiais ...75
10. CONCLUSÕES... 90
11. SUGESTÕES PARA PESQUISAS FUTURAS ... 91
12. REFERÊNCIAS ... 92
Resumo
JUNQUEIRA-JR, R.M. Estudo da interação entre lipoxigenase da soja e ácido ascórbico nas propriedades reológicas e sensoriais de pães. 2007. 130f. [Dissertação (Mestrado) – Faculdade de Ciências Farmacêuticas,
Universidade de São Paulo, São Paulo, 2007].
A enzima lipoxigenase através da farinha integral de soja é amplamente utilizada na panificação com objetivos de branqueamento e melhora da reologia. Com base nesse pressuposto, o objetivo inicial deste estudo foi de observar a ação oxidante dessa enzima na presença de dois outros oxidantes (ácido ascórbico e peróxido de benzoíla) nas propriedades reológicas e sensoriais de pães. Sete misturas com diferentes combinações dos três compostos foram elaboradas utilizando-se um delineamento experimental do tipo “centroide-simplex”, sendo aplicadas à farinha de trigo para o preparo de pães. A enzima apresentou sinergia com o ácido ascórbico na elasticidade da massa, sugerindo uma inter-relação bioquímica entre os dois compostos no fortalecimento da matriz protéica do glúten. A mesma sinergia entre a lipoxigenase da soja e o acido ascórbico foi observada na redução da tonalidade amarela dos pães medida instrumentalmente. A partir desses resultados, buscou-se avaliar a ação da enzima frente a variações tanto na força da farinha como no tempo de fermentação, reproduzindo as condições reais de processamento. Desta vez, um planejamento experimental do tipo Box-Behnken com três fatores (atividade da enzima, força da farinha e tempo de fermentação) em três níveis de variação, foi aplicado no preparo das amostras. Os resultados mostraram que a lipoxigenase da soja (fração 1) é uma enzima oxidante de ação rápida e seu efeito no branqueamento dos carotenóides da farinha de trigo exibiu interação positiva tanto com a força da farinha como o tempo de fermentação. Respostas reológicas e sensoriais decorrentes da ação conjunta de diferentes oxidantes e condições de processamento em pães foram pela primeira vez descritas através de modelos polinomiais com capacidade preditiva.
Abstract
JUNQUEIRA-JR, R.M. Study of the interaction between soy lipoxygenase and ascorbic acid in the rheological and sensory properties of bread. 2007. 130f. [Dissertation (Master) – College of Pharmaceutical Sciences, University of São Paulo, São Paulo, 2007].
Soy lipoxygenase enzyme through soy flour is widely used in breadmaking for bleaching and rheological improvement. Based on this fact, the initial objective of this study was to observe the enzymes’ action in the presence of two other oxidants (ascorbic acid and benzoyl peroxide) in the rheological and sensory properties of breads. Seven mixtures with different combinations of the three compounds were prepared using a ‘centroid-simplex’ design and applied to wheat flour for breadmaking. The enzyme showed synergism with ascorbic acid in the dough elasticity suggesting a biochemical interrelation between the two compounds in strengthening the gluten protein matrix. The same synergy between soy lipoxygenase and ascorbic acid was observed with the yellow hue reduction of breads measured instrumentally. From these results, the enzyme action was evaluated with wheat strength and proofing time variations reproducing real processing conditions. This time, a Box-Behnken experimental design with three factors (enzyme activity, wheat strength and proofing time), and three variation levels were applied in the sample preparation. The results showed that soy lipoxygenase (type 1) is a fast-acting oxidizing enzyme and its bleaching effect on wheat flour carotenoid exhibited a positive interaction with wheat strength and proofing time. Rheological and sensory results attributed to the combined action of the different oxidants and breadmaking conditions were for the first time described through polynomial models with predictive capacity. Key words: Lipoxygenase. Breadmaking. Rheology. Ascorbic Acid.
1. INTRODUÇÃO
A qualidade de massas e produtos panificáveis depende de características únicas apresentadas pelas proteínas do trigo. No Brasil, a diversidade de cultivares produzidos associada às diferenças na procedência do trigo importado, torna difícil a manutenção das propriedades reológicas da farinha e consequentemente da qualidade dos pães. Outro fator que interfere diretamente na caracterização das farinhas produzidas no Brasil é o grau de extração a que o trigo é submetido durante o processo de moagem, sendo que quanto mais elevado é grau de extração, maior rendimento econômico pode ser alcançado, porém, com proporcional prejuízo à qualidade tecnológica da farinha.
Essa realidade levou a indústria a desenvolver e utilizar vários aditivos (enzimas, compostos oxidantes e emulsificantes) com distintos mecanismos de ação para padronizar as farinhas em relação à força do glúten, cor e fermentabilidade. Atualmente o Brasil gasta mais de US$ 47 milhões/ano em aditivos importados para panificação. Além disso, há evidências de que o consumidor tende a preferir alimentos que contenham um número menor de aditivos em sua formulação e rotulagem. Entretanto, reduzir o volume adicionado desses compostos sem alterar as características sensoriais, tem se tornado um dos maiores desafios à ciência e à tecnologia de alimentos.
2. REVISÃO DE LITERATURA
2.1 Trigo (
Triticum aestivum
)
O Trigo é uma gramínea selvagem (família Gramineae) nativa dos países áridos da Ásia ocidental. O seu uso como alimento data da era Neolítica. Ao todo, cerca de 600 gêneros de gramíneas evoluíram e dentre eles as várias formas do gênero Triticum, sendo que o aestivum (vulgare), chamado de trigo comum, domina a produção mundial (MATTERN, 1991).
Após a Idade Média o trigo se tornou o principal grão uma vez que o pão, especialmente o fermentado, havia se tornado parte importante da dieta diária. O trigo era o único grão adequado para a produção de pão fermentado devido à presença de um complexo protéico único conhecido por glúten, capaz de formar uma matriz elástica o suficiente para reter os gases formados na fermentação, conferindo a textura aberta característica do pão (CORNELL; HOVELING, 1998).
Aspectos Econômicos
Figura 1. Produção mundial de trigo em 2004 em milhões de toneladas.
Fonte: FAO (2005).
O Brasil é o segundo maior importador mundial de trigo, consumindo 9,5 milhões de toneladas por ano e produzindo somente 4,8 milhões (CONAB, 2006).
O consumo de pão no Brasil é de 27 kg anuais per capita, representando metade da porção recomendada por organizações como a Organização Mundial da Saúde (OMS) de 60 kg/capita/ano e da FAO de 50 kg/capita/ano (Figura 2). Na Argentina e no Chile, o consumo de pão é significativamente maior. Por falta de dados oficiais, foram apresentados dados obtidos de empresas privadas que mostram que no Brasil o pão industrializado (pão de forma), chega a apenas 20% dos lares (FOUNTOURA; MARTINEZ, 2006) e de acordo com o Sindipan-Aipan (2006a), o consumo de pão tem estado estável desde 1997.
27
50
60
70 73
93
0 10 20 30 40 50 60 70 80 90 100
Brasil Meta FAO Meta OMS Portugal Argentina Chile
Kg por
an
o per
c
api
ta
Figura 2. Consumo de pão por ano per capita em kg.
Fonte: SINDIPAN-AIPAN (2005)
2.2 Morfologia e composição
ENDOSPERMA ENDOSPERMA
Figura 3. Grão de trigo (corte transversal e seccional)
Fonte: The New Zealand Institute for Crop & Research Ltd (2005) [adaptado].
Os diversos componentes químicos do grão não são uniformemente distribuídos nas diversas estruturas. A Tabela 1 compara os pesos e composições das principais partes anatômicas do trigo (POMERANZ, 1987).
Tabela 1. Peso e composição das partes do grão do trigo de farinhas com diferentes graus de extração.
Parâmetros Pericarpo Aleurona Endosperma Gérmen Extração da moagem (%)
Peso % 9,0 8,0 80,0 3,0 75,0 85,0 100,0*
Cinzas % 3,0 16,0 0,5 5,0 0,5 1,0 1,5
Proteína % 5,0 18,0 10,0 26,0 11,0 12,0 12,0
Lipídio % 1,0 9,0 1,0 10,0 1,0 1,5 2,0
Fibras % 21,0 7,0 <0,5 3,0 <0,5 0,5 2,0
Pigmentos
Variações na cor das farinhas e nos métodos para produção de uma farinha uniforme são tópicos relevantes nos processos de moagem e panificação. Segundo Grosch e Wieser (1999), a glutationa, um tripeptídeo presente no trigo, degrada-se durante o armazenamento da farinha. A diminuição desse composto é acompanhada por um aumento no desempenho e um clareamento do produto panificado (GELINAS et al., 1998; SAIZ; MANRIQUE; FRITZ, 2001). No entanto, o processo natural de maturação e clareamento é lento, dispendioso e sem garantia de uniformidade. A solução prática para este problema tem sido o desenvolvimento e uso difundido de “agentes de maturação” que permitem o uso de receitas uniformes, eliminação de perdas na aplicação no uso doméstico e maior apelo visual ao consumidor (FORTMANN; JOINER, 1971).
Os grãos de trigo em processo de maturação contêm pigmentos carotenóides, especialmente presentes na casca. O conteúdo de carotenóides em diversas variedades de trigo varia de 5,5 a 8,4 mg/kg, e não são distribuídos de forma homogênea no grão. A casca contém de 0,9 a 2,2 mg/kg, o gérmen, 4,1 a 11,0 mg/kg e o endosperma, 1,6 a 2,2 mg/kg (CHUNG, 2001). Quando o endosperma é moído para se transformar em farinha, a casca é parcialmente separada. Consequentemente, a farinha recém-moída apresenta pigmentos remanescentes que promovem uma coloração amarelada típica, resultando em produtos panificados com uma cor comercialmente menos aceitável. Isso explica o fato de que farinhas amareladas estão relacionadas com alto grau de extração (FORTMANN; JOINER, 1971). Várias pesquisas têm demonstrado que xantofilas na forma livre ou esterificada, sem atividade de pró-vitamina A, poderiam ser consideradas como os principais pigmentos do trigo, uma vez que representam cerca de 85% do total (FORTMANN; JOINER, 1971; SAIZ; MANRIQUE; FRITZ, 2001; UNITED STATES, 2005b).
pigmentos encontrados no trigo são criptoxantinas e produtos da degradação da clorofila (FORTMANN; JOINER, 1971).
Desta forma, o branqueamento da farinha envolve principalmente o rompimento das ligações duplas conjugadas para um sistema conjugado sem cor (CHUNG, 2001; SAIZ; MANRIQUE; FRITZ, 2001).
OH CH3 CH3 CH3 CH3 CH3 CH3 C H3 O
H CH3
C H3 C H3
Figura 4. Molécula de Luteína (C40H5602)
Fonte: Fortmann e Joiner (1971).
Lipídios do trigo e da farinha
Os lipídios constituem entre 2,5 e 3,3% do grão inteiro e são especialmente ricos em triacilgliceróis contendo grande quantidade de ácido linoléico, representando aproximadamente 60% do total de ácidos graxos. O trigo armazena os triacilgliceróis em corpúsculos de óleo, conhecidos por esferossomas ou oleossomas que são encontrados no gérmen e na aleurona (CARR; DANIELS; FRAZIER, 1992).
Os lipídios do trigo podem ser encontrados na cadeia da amilose (≈20%) ou fora do grânulo de amido (≈80%). Estes últimos, conhecidos por lipídios não-amiláceos, podem por sua vez, apresentarem-se na forma ligada ou livre. Cerca de 90% dos lipídios livres apresentam propriedades apolares e 10% polares. Os lipídios livres, especialmente os polares, estão mais associados ao aumento de volume em pães que os lipídios ligados.
mais suscetíveis à hidrólise lipídica. O trigo também contém a enzima lipoxigenase, que catalisa o processo de oxidação lipídica. Entretanto, sua atividade é desprezível na atividade de água da farinha armazenada (CARR; DANIELS; FRAZIER, 1992). O conteúdo de lipídios livres varia de 1,6 a 2,1% do peso do grão do trigo e são distribuídos de forma não-uniforme no grão (Tabela 2).
Tabela 2. Conteúdo de lipídios livres e sua distribuição no grão.
Partes Distribuição (%)
Endosperma 62,7
Gérmen 33,8
Casca 3,4
Fonte: Chung (1991) [adaptado].
Após a moagem do grão, os lipídios (até 2% podem ser extraídos) interagem com outros constituintes da farinha, sendo que 70% do total dos lipídios da farinha se associam ao glúten modificando e suportando-o estruturalmente, principalmente às gluteninas (81,5% do total de lipídios) (FRAZIER, 1983; CARR; DANIELS; FRAZIER, 1992). Os lipídios polares (fosfolipídios) também podem se ligar à gliadinas por ligações hidrofílicas (CHUNG; POMERANZ; FINNEY, 1978) promovendo a melhora na panificação através de pontes entre as proteínas (gliadinas e gluteninas) e os componentes amiláceos, devido a suas características anfifílicas (CARR; DANIELS; FRAZIER, 1992).
Proteínas do trigo
Do ponto de vista funcional, dois grupos de proteínas do trigo devem ser caracterizadas: as proteínas não-glúten, sem função ou com uma função menor na panificação e as proteínas do glúten, com um papel significativo na panificação. As proteínas não-glúten (entre 15 e 20% do total de proteínas do trigo) ocorrem principalmente nas camadas externas do grão, com baixas concentrações no endosperma.
As proteínas do glúten (entre 80 e 85% do total das proteínas do trigo) são as principais proteínas de armazenamento. São insolúveis em água ou em soluções salinas, sendo encontradas no endosperma do grão maduro onde formam uma matriz contínua em volta dos grânulos de amido. Dois grupos funcionalmente distintos de proteínas do glúten podem ser identificados: gliadinas monoméricas e gluteninas poliméricas (GOESAERT et al., 2005).
As gliadinas e gluteninas são encontradas em proporções iguais no trigo, sendo que as gliadinas são um grupo altamente polimórfico com pesos moleculares variando entre 30.000 e 80.000 Da. Bioquimicamente, três tipos solúveis em álcool foram identificados (α, e ω). Estas exibem propriedades de fluidez viscosa sem elasticidade significativa e são consideradas responsáveis pela extensibilidade e coesividade da massa, sendo extremamente pegajosas quando hidratadas e com pouca ou nenhuma resistência à extensão (BELITZ et al., 1986). Apesar das gliadinas conterem de 2 a 3% de resíduos de cisteína, elas aparentemente não sofrem polimerização extensa por interações sulfidrila-dissulfeto.
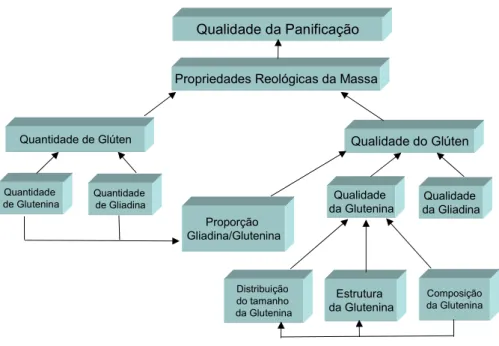
mesma cadeia polipeptídica, contribuindo para a firmeza da massa. De acordo com Bloksma (1975), Belitz et al. (1986) e Goesaert et al. (2005), ensaios de fracionamento e reconstituição demonstraram que a qualidade da panificação do trigo depende fortemente de dois fatores da qualidade do glúten: o primeiro é a proporção gliadina/glutenina nas proteínas do glúten e o segundo é a qualidade (composição, estrutura e distribuição do tamanho) da glutenina que pode resultar em interações não-covalentes diferentes, determinando sua elasticidade (Figura 5).
Qualidade da Panificação
Propriedades Reológicas da Massa
Quantidade de Glúten Qualidade do Glúten
Qualidade da Gliadina Qualidade da Glutenina Quantidade de Glutenina Proporção Gliadina/Glutenina Distribuição do tamanho da Glutenina Estrutura da Glutenina Composição da Glutenina Quantidade de Gliadina
Figura 5. Fatores que regem a qualidade da panificação e propriedades reológicas da massa panificável.
Fonte: Goesaert et al., 2005 [adaptado].
As ligações dissulfídicas são uma forma que a natureza utiliza para conferir força e rigidez às estruturas fibrosas, análogo às ligações que unem escadas ou estruturas de aço (TIECKELMANN; STEELE, 1991). Foi observado, no entanto, que apenas 25 a 35% dos grupos sulfidrila e 4 a 13% das ligações dissulfídicas são reologicamente efetivas. No entanto, uma pequena redução nas ligações é suficiente para causar um considerável efeito reológico.
Glutationa
A glutationa, um metabólico multifuncional da planta, é um tripeptídeo formado por glutamina, cisteína e glicina. Sendo endógena na farinha de trigo nas formas reduzida (GSH) e oxidada (GSSG), a glutationa é encontrada em altas concentrações no gérmem do trigo e no endosperma (Figura 6).
Figura 6. Estrutura molecular da glutationa reduzida (GSH) e oxidada (GSSG).
Fonte: BRENDA: THE COMPREHENSIVE ENZYME INFORMATION SYSTEM, 2005.
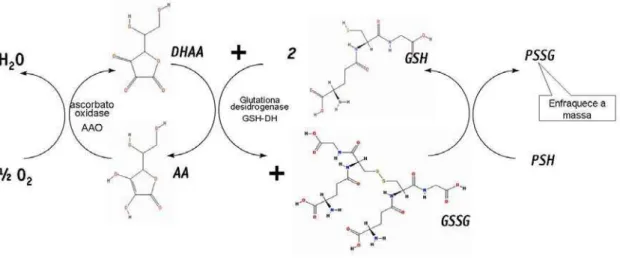
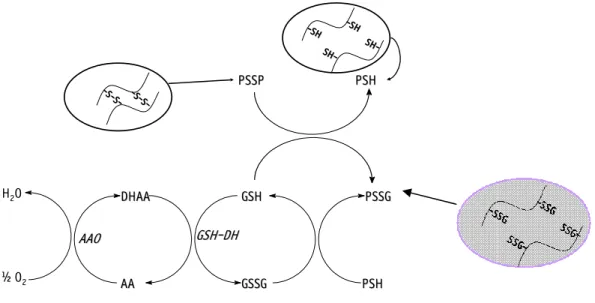
Os dissulfetos mistos “proteínas-glutationas“ (PSSG) também estão presentes na proteína do trigo e podem ser formados durante a mistura da massa, por reação da GSH com ligações dissulfídicas protéicas (PSSP) ou através da reação da GSSG com grupos sulfidrila da proteína (PSH) (CHEN; SCHOFIELD, 1995) (Figura 7). Desta forma, a glutationa oxidada (GSSG) pode enfraquecer a massa panificável através da reação de intercâmbio SH/SS com grupos protéicos sulfidrila. A GSH liberada reage com as ligações dissulfeto protéicas (SCHOFIELD; CHEN, 1993).
Figura 7. Oxidação do ácido ascórbico pelo oxigênio e da GSH pelo DHAA e mecanismo de formação do PSSG.
AA= ácido ascórbico; DHAA= ácido desidroascórbico; AAO= ácido ascórbico oxidase; GSH= glutationa reduzida; GSSG= glutationa oxidada; GSH-DH= glutationa dehidrogenase; PSH= proteína do glúten reduzida; PSSG= proteína ligada a glutationa.
Fonte: Chen; Schofield (1995); Grosch; Wieser (1999); Koehler (2003a); Koehler (2003b) [Adaptado].
2.3 Farinha de trigo
subprodutos são obtidos pelo uso de diferentes tipos de rolos, peneiras e sistemas de classificação por ar. O grau de extração do trigo para produção da farinha é um importante índice de eficiência da técnica de moagem e é expresso na base seca da quantidade de trigo utilizada em relação à quantidade ou rendimento em farinha, que varia de 72% para farinhas brancas para números próximos a 100% para farinhas integrais (CORNELL; HOVELING, 1998).
Quanto maior a extração, mais casca e fragmentos da aleurona serão incorporados, adicionando pigmentos carotenóides (FORTMANN; JOINER, 1971), glutationa (GROSCH; WIESER, 1999) e lipases à farinha (CARR; DANIELS; FRAZIER, 1992).
A panificação e os principais ingredientes
O processo de panificação consiste de diferentes estágios apresentando uma grande variação de tensão imposta ao material (TRONSMO, 2003b), no qual água e farinha são transformadas em uma massa visco-elástica. A farinha de trigo consiste de duas fases contínuas e imiscíveis: o glúten e a fase líquida contendo compostos solúveis e amido. As propriedades de forneamento e manuseio são fortemente influenciadas pelas condições de processamento (mistura, modelagem, laminação, fermentação e forneamento) e pelos ingredientes (AUTIO; LAURIKAINEN, 1997). Existem dois principais métodos de panificação: o método direto, mais curto e o método mais longo, chamado “método-esponja” (STAUFFER, 1990).
a remover a camada hidratada da partícula e expõe mais superfície ainda seca para absorção de mais água. Esse processo é repetido até que a hidratação das partículas da farinha esteja completa. Neste ponto quase toda água livre foi utilizada, a massa está elástica, apresenta resistência às pás do misturador e o desenvolvimento da matriz do glúten se inicia (POMERANZ, 1987).
O açúcar adicionado à formulação do pão em geral na forma de sacarose intensifica a fermentação, contribui para o escurecimento desejável (escurecimento não enzimático), contribui para a estabilidade e a elasticidade da massa e deixa o produto panificado mais adocicado (POMERANZ, 1987).
As gorduras conferem sabor aos produtos panificáveis, deixam a casca mais fina e sedosa e em pequenas quantidades (até 3% sobre o peso da farinha) aumentam volume e retenção de frescor no pão (POMERANZ, 1987). As gorduras também atuam como principal lubrificante da massa e como enriquecimento calórico. A gordura é adicionada na forma de óleo vegetal (soja, milho, amendoim, etc.), gordura animal (manteiga, banha), ou gordura hidrogenada, com ou sem emulsificantes, em variados pontos de fusão e plasticidade (ESTELLER, 2004). Os autores Carr, Daniels e Frazier (1992) também demonstraram que lipídios livres polares são benéficos para panificação, especificamente para o volume dos pães.
O sal é adicionado (aproximadamente 1,5% do peso da farinha) para efeito de sabor e para melhorar a estrutura da massa. O sal diminui a absorção da água e intumescimento das proteínas da farinha, reduz a extensibilidade da massa e melhora a retenção de gás (POMERANZ, 1987). O sal também interage na formação da rede de glúten e controla a fermentação devido ao efeito osmótico na célula da levedura, porém a sua função mais importante é a de conferir sabor (MATUDA, 2004).
A mistura da massa
que todas estas interações afetam a reologia. As proteínas do glúten interagem através de pontes dissulfeto, interações intra-moleculares, pontes de hidrogênio, e interações hidrofóbicas formando uma grande matriz contínua.
Figura 8. Estrutura proposta das moléculas do glúten. Fonte: Tieckelmann; Steele (1991) [adaptado].
Métodos reológicos
forneamento, o crescimento das bolhas de gás determina a expansão da massa e consequentemente a textura e volume final do produto panificado (HE; HOSENEY, 1991).
2.4 Aditivos
Numa padaria no Brasil há alguns anos atrás, um padeiro poderia ajustar o tempo da fermentação e da mistura, do forneamento, condições do forno e fazer ajustes frente às variações das propriedades da farinha, do fermento e da temperatura ambiente. Hoje, este alto grau de flexibilidade não é mais disponível, ou é possível a um alto custo e variabilidade de qualidade inaceitável, já que a mecanização, produção em grande escala e a crescente demanda do consumidor por alta qualidade, conveniência e tempo de prateleira (shelf-life) mais longo criaram a necessidade de estabilizar e trazer uniformidade aos produtos panificados. A utilização de aditivos tais como emulsificantes, oxidantes e enzimas satisfaz a estes propósitos. Para a indústria, a otimização das propriedades da massa e o aperfeiçoamento da qualidade do produto acabado são de grande interesse. Para o consumidor, o apelo sensorial do produto acabado é o atributo mais importante. Após a panificação, o frescor do pão reduz-se rapidamente devido à retrogradação do amido gerando perdas significativas à indústria de panificação: 8 a 10% da produção de pães são invendáveis devido à retrogradação do amido (STAUFFER, 1990; STAMPFLI; NERSTEN, 1994).
Oxidantes
Até a metade do século XX, os padeiros preferiam utilizar farinha que tivesse permanecido estocada a usar a farinha recentemente moída. Haviam aprendido pela prática que a farinha podia sofrer maturação, isto é, oxidação pelo oxigênio do ar durante a estocagem. Esta farinha maturada não produziria massas difíceis de manusear, ao contrário, produziria uma massa mais maleável e pães com maior volume (GUTKOVSKI et al., 1997). Esta teoria foi comprovada por Ewart (1988) que determinou a redução de resíduos SH em farinhas de trigo estocadas durante 6 meses, e reportou que este processo também foi observado em farinhas estocadas por até 6 anos.
Atualmente é impraticável manter a farinha estocada por um tempo suficiente para que ocorra a maturação natural (envelhecimento). Devido à grande capacidade de moagem dos moinhos modernos e para evitar despesas no armazenamento, a farinha é expedida dos moinhos para as panificadoras um dia após sua produção e frequentemente, em menos de uma semana, é iniciada sua utilização. Nas padarias e panificadoras, nem sempre é possível e conveniente a manutenção de grandes espaços para armazenamento de farinhas e usualmente os estoques não são mantidos por grande período de tempo.
Estes fatores foram decisivos à introdução dos melhoradores de farinha que proporcionam os mesmos efeitos obtidos através da maturação natural num tempo muito menor (GUTKOVSKI et al., 1997), sendo prática comum a adição de oxidantes a maioria das fórmulas de pães fermentados (KERR et al., 1992).
O uso de compostos oxidantes na panificação confere as seguintes vantagens:
y branqueamento: a redução da cor amarelo-pálida promovida pelos pigmentos carotenóides presentes naturalmente na farinha;
y o fortalecimento da matriz do glúten necessário para suportar o estresse dos sistemas de manuseio mecânicos de alta velocidade e para conferir melhor volume final ao pão.
De um total de 34 possíveis compostos oxidantes listados por Jørgensen em 1945, 11 são comumente utilizados na indústria (STAUFFER, 1990), sendo que a formação de ligações dissulfídicas entre as subunidades das proteínas do glúten promovendo o fortalecimento da massa é o principal mecanismo de funcionamento desses compostos (KAUFMAN; FENNEMA, 1987; DONG; HOSENEY, 1995).
Peróxido de benzoíla
O peróxido de benzoíla (PBZ) tem sido usado para branquear farinhas de trigo por mais de 75 anos e é adicionado na forma de uma pré-mistura diluída contendo 32% de princípio ativo (AMERICAN INGREDIENTS, 1998). Trata-se do mais comum dos agentes branqueadores de farinha, sendo permitido somente em alguns países, como por exemplo, o Brasil. O PBZ produz a oxidação de carotenóides por um mecanismo típico de radicais livres, rompendo o sistema de ligações duplas conjugadas e segundo Saiz, Manrique e Fritz (2001), exibe sua ação de descoloração ou branqueamento sem influenciar as propriedades de panificação (Figura 9).
O PBZ é extremamente reativo e se degrada a baixas temperaturas (<40 °C) por causa da instabilidade da ligação O2- com uma energia de ligação de aproximadamente 30 kcal/mol. A degradação do PBZ forma radicais derivados do benzoato, na fase de iniciação (Figura 9). Esses radicais propagam a reação reagindo ou com o PBZ ou com o solvente para formar radicais do solvente e mais radicais de benzoato (CHELLQUIST; GORMAN, 1992). Na panificação, o PBZ é amplamente utilizado pela sua eficácia na degradação de carotenóides, sob reduzida atividade de água.
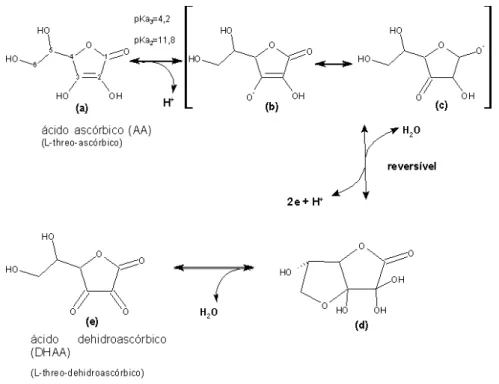
Ácido ascórbico
O ácido ascórbico tem sido extensivamente utilizado na indústria alimentícia como antioxidante em uma grande variedade de produtos (LARSON, 1997a). Em 1935, Jørgensen observou que 20 a 30 mg de L-treo-ácido ascórbico (AA)/kg de farinha de trigo, causavam um aumento pronunciado na força da massa com conseqüente aumento no volume do pão. Atualmente, o ácido ascórbico é um dos ingredientes mais utilizados na formulação de misturas aditivas melhoradoras para a indústria de panificação (AAMODT; MAGNUS; FÆRGESTAD, 2003).
Figura 10. Natureza química do ácido ascórbico e do ácido desidroascórbico. Fonte: Wirsta et al. (2003) [adaptado].
O ácido desidroascórbico, por sua vez, oxida a GSH endógena para a sua forma oxidada, a GSSG (Figura 7). A GSH oxida as proteínas do glúten (PSSP) que tem suas ligações dissulfetos rompidas formando dissulfetos proteína-glutationa (PSSG).
FCF-USP H2O
½ O2
DHAA DHAA AA AA AAO AAO GSH GSH GSSG GSSG GSH GSH--DHDH
PSH
PSH
PSSG
PSSG
PSSP
PSSP PSHPSH
--SS-
-S
S-
--SS
--SS-
-SH SH -SH SH SH
SH-
-SH
SH-
-Figura 11. Reações propostas para explicar o efeito melhorador do ácido ascórbico de acordo com a hipótese de Grosch.
AA= ácido ascórbico; DHAA= ácido desidroascórbico; AAO= ácido ascórbico oxidase; GSH= glutationa reduzida; GSSG= glutationa oxidada; GSH-DH= glutationa dehidrogenase; PSH= proteína do glúten reduzida; PSSG= proteína ligada a glutationa; PSSP= proteína do glúten. Fonte: Chen; Schofield (1995); Grosch; Wieser (1999); Koehler (2003a); Koehler (2003b) [adaptado].
Lipoxigenase
As lipoxigenases (linoleato: oxigênio oxidoredutases; EC 1.13.11.12) constituem uma família heterogênea de enzimas de peroxidação lipídica amplamente distribuídas em plantas e no reino animal, além de também serem encontradas em organismos marinhos inferiores como algas, ouriços, estrelas-do-mar, conchas e corais (KUHN; BORCHERT, 2002).
As LOX formam derivados hidroperóxidos catalisando a dioxigenação de ácidos graxos poliênicos contendo o sistema cis,cis-1,4-pentadieno, como por exemplo o ácido linoléico (LA), α-linolênico ou araquidônico. Considerando que o ácido araquidônico é apenas um ácido graxo polinsaturado (PUFA) secundário no reino vegetal, as LOXs das plantas são classificadas com respeito a sua especificidade quanto à posição da oxigenação do LA, que ocorre no carbono 9 ou no carbono 13 formando dois grupos de hidroperóxidos: 9-HPOD (ácido 9-hidroperóxi-10,12-octadecadienóico) e HPOD (ácido 13-hidroperóxi-9,11-octadecadienóico) conforme demonstrado na Figura 12 (FAUBION; HOSENEY, 1981; NELSON, 1996). Um estudo recente de Coffa et
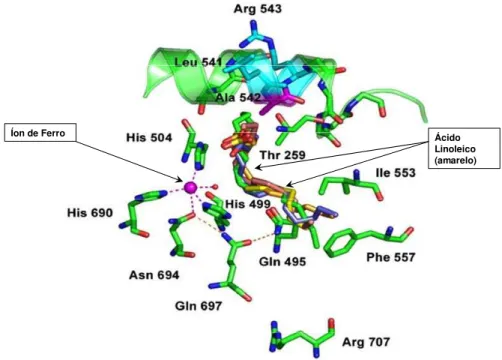
al. (2005) demonstrou que uma mutação no resíduo Ala542 para Gly no sítio
ativo do íon de Ferro na molécula da LOX é responsável pela alteração da proporção dos produtos 9-HPOD e 13-HPOD (Figura 13).
Figura 12. Produtos da LOX e especificidade posicional a partir da oxidação do ácido linoléico. Fonte: Whitaker (1991); Iacazio; Martini-Iacazio (2000) e Frankel (2005) [adaptado].
A oxigenação de PUFAs pode ocorrer por via enzimática e não-enzimática. Ambas as reações levam à formação de ácidos graxos peroxidados, mas há diferenças importantes entre os dois processos. A peroxidação lipídica enzimática forma uma mistura de produtos não-específica consistindo de diversos isômeros óticos e posicionais. Na reação com a LOX, ácidos graxos poliênicos são geralmente oxigenados a um isômero especifico (FEUSSNER; KUHN, 2000).
A oxidação enzimática de componentes celulares lipofílicos é um princípio universal no metabolismo dos organismos vivos e uma variedade de sistemas enzimáticos foi criada com esse propósito. Dentre estes sistemas, as lipoxigenases são únicas porque catalisam a dioxigenação especifica de ácidos graxos poliênicos usando oxigênio atmosférico como segundo substrato. Em contraste com monoxigenases lipídicas, LOXs introduzem oxigênio molecular, formando hidroperóxidos de ácidos graxos. Alternativamente, a formação de peróxidos lipídicos pode ser induzida por radicais livres formados como intermediários da reação de outros mecanismos metabólicos oxidativos, como por exemplo:
LAH + R•
¼
LA• + RH
LA• + O
2¼
LAOO•
LAOO• + LAH
¼
LAOOH + LA•
Fonte: Frankel (2005) [adaptado]. LAH representa a molécula de ácido linoleico, Ry, o composto radical, LAOOy, o peróxido e LAOOH, o hidroperóxido.
Neste caso, a peroxidação lipídica pode ser considerada como um efeito secundário menor e múltiplos sistemas protetores (antioxidantes) são disponíveis para neutralizá-la. Em contraste, as LOXs são especificamente desenhadas para catalisar peroxidação lipídica e muitas defesas antioxidativas que ocorrem naturalmente são ineficientes em regular essa reação (KUHN; BORCHERT, 2002).
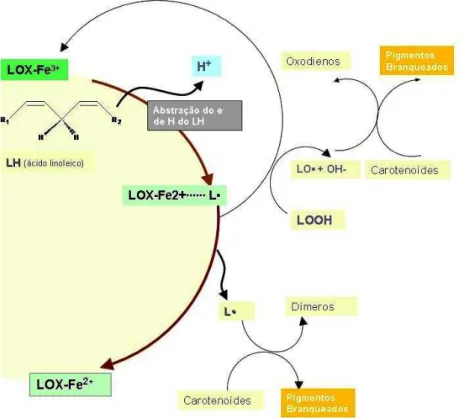
Os aspectos essenciais da atual hipótese do mecanismo de catálise são mostrados na
Essa ativação pode ser realizada com pequenas quantidades de hidroperóxidos. Estes peróxidos oxidam o estado ferroso inativo basal (ground
state) da enzima para uma forma ativa férrica (Fe 3+) (SCHILSTRA; VELDINK;
VLIEGENTHART, 1994; JONES et al., 1996).
Esta reação é bastante conhecida por ser também descrita como a “Reação de Fenton”, um exemplo clássico de reações de radicais livres catalisadas por metais de transição (LARSON, 1997b, HALLIWELL; GUTTERIDGE, 1999c; SPITELLER, 2005).
Coffa et al. (2005) demonstraram que a forma da ligação da enzima com o substrato se dá pela entrada do substrato (ácido linoléico) no sítio ativo da LOX através do canal aberto pelos movimentos das cadeias laterais dos resíduos Thr259 e Leu541 (Figura 13).
Íon de Ferro Ácido
Linoleico (amarelo)
Figura 14. Mecanismo proposto da reação da LOX.
Mecanismo de oxidação de carotenóides
A habilidade da LOX para branquear ou descolorir diversos pigmentos, tais como clorofila e carotenóides são uma das suas mais conhecidas características (KLEIN et al., 1984). O branqueamento enzimático dos carotenóides por co-oxidação (o processo é chamado de co-oxidação porque a enzima não age diretamente no composto a ser oxidado (CASEY et al., 1999)) com ácidos graxos insaturados foi observado em 1934 (HOSENEY; RAO; FAUBION; SIDHU, 1980) e a perda do pigmento amarelo da luteína em relação à atividade da LOX no trigo durum foi investigada em 1950 (MCDONALD, 1979; ADDO et al., 1993; DELCROS et al., 1998; SERPEN; GÖKMEN, 2006b). O branqueamento de carotenóides catalisado pela LOX pode ocorrer em duas etapas: anaeróbica e aeróbica.
Figura 15. Mecanismo proposto para o branqueamento aeróbico de pigmentos carotenóides. Fonte: Cohen et al (1985) [adaptado].
lipoxigenase (Figura 16b). Esta hipótese da via anaeróbica veio a ser posteriormente confirmada por Serpen e Gökmen (2006) que demonstraram a inibição da formação de dienos conjugados pela LOX no ácido linoléico com a adição de crescentes concentrações de ß-caroteno.
Figura 16. Mecanismo proposto para branqueamento anaeróbico de carotenóides durante a oxidação de ácidos graxos pela Lipoxigenase.
Fonte: Klein et al. (1984) [adaptado].
Mecanismo de fortalecimento da matriz do glúten
(TSEN; HLYNKA, 1962; FRAZIER et al., 1977), promove a alteração de propriedades reológicas da massa tal como o aumento do tempo de tolerância à mistura, resultando em um aumento no volume do pão (FRAZIER et al., 1977; CARR; DANIELS; FRAZIER, 1992; ADDO et al., 1993; ARAÚJO; CIACCO; CAMARGO, 1995; DELCROS et al., 1998; GARCIA et al., 2000).
De acordo com Dong e Hoseney (1995), a premissa principal tem sido que os grupamentos sulfidrila da massa panificável são potencialmente capazes de submeter-se a uma reação de troca dissulfeto-sulfidrila, envolvendo a cisão e reformulação de pontes dissulfeto mediada pelos grupos sulfidrila na farinha de trigo. Ou seja, pontes dissulfeto (S-S) do glúten são quebradas durante a mistura da massa criando radicais tiol (-S) (OKADA; NEGHISHI; NAGAO, 1987). Desta forma, as propriedades reológicas da massa e sua matriz tri-dimensional são dependentes do arranjo e do número de pontes dissulfeto e grupos sulfidrila da proteína. A contribuição vital das pontes dissulfeto à estabilidade da massa foi demonstrada em estudos reológicos pela adição de compostos bloqueadores de sulfidrila (DONG; HOSENEY, 1995).
A farinha enzimaticamente ativa de soja altera consideravelmente as propriedades reológicas de massas panificáveis (FRAZIER et al., 1973). A perda de grupos sulfidrila (-SH) é uma evidência de que a melhora causada pela farinha de soja enzimaticamente ativa é devida à oxidação desses grupos durante a formação da rede de glúten (TSEN; HLYNKA, 1962; FRAZIER et al., 1977; HOSENEY; RAO; FAUBION; SIDHU, 1980; ADDO et al., 1993; DELCROS et al., 1998).
A lipoxigenase e a soja
A soja (Glycine max (L.) Merr.) contém pelo menos 8 tipos de LOXs, sendo que três são expressas principalmente nas sementes (LOX1, 2 e 3). As outras cinco estão presentes em diferentes tecidos vegetativos (DUBBS; GRIMES, 2000; CASEY et al., 1999), sendo que algumas delas agem como proteínas de armazenamento. A maioria das LOX de nosso conhecimento na enzimologia e biologia estrutural se origina da fração 1 da soja descoberta há 70 anos (KUHN; BORCHERT, 2002), sendo que a soja é a fonte mais rica e conhecida de LOX (FAUBION; HOSENEY, 1981; RUTH; ROOZEN; MOEST, 1992).
Existe ampla evidência de que as lipoxigenases são elementos cruciais nas estratégias de defesa da planta. O mecanismo de resistência é ainda tema de estudos, mas a lipoxigenase é claramente parte essencial. Muitas plantas respondem à injúria por insetos ou às lesões pela produção de jasmonatos. Experimentos que causaram inibições da atividade da lipoxigenase em folhas de batatas eliminaram a produção de jasmonatos, aumentando a suscetibilidade da planta ao ataque de insetos (CASEY et al., 1999). Esta conhecida função fisiológica da LOX consiste na formação de ácido jasmônico, uma substância de regulação do crescimento, e fito-hormônios relacionados. Vários estudos sustentam o papel deste composto como uma “chave geral” no desenvolvimento e adaptação da planta ao estresse, sendo que leguminosas têm grande quantidade de LOX nas sementes e tecidos vegetativos (FEUSSNER; WASTERNACK, 2002).
que LOX1 forma em maiores quantidades o 13—hidroperóxido (13-HPOD) do que 9-HPOD, numa proporção de 95:05. A LOX2 gerou 80% de seus hidroperóxidos na forma de 13-HPOD e 20% na forma de 9-HPOD (alguns autores relatam 50:50 para esta isoforma) e a LOX3 gerou 40% de 13-HPOD e 60% de 9-HPOD (KLAJN, 1991; FUKUSHIGE et al., 2005). Na semente de soja madura, a LOX3 é a mais abundante das isoenzimas em base protéica. A LOX1 é também abundante representando aproximadamente 1% da proteína da semente enquanto LOX2 corresponde a aproximadamente 0,1 a 1% (HILDEBRAND, 1996).
Um dos efeitos principais da LOX na qualidade dos alimentos se dá através da formação de compostos voláteis de aroma e sabor. O aumento da LOX na massa panificável pode promover a melhora de diversas características reológicas e vida-de-prateleira, mas pode afetar adversamente o sabor, causando o conhecido beany flavour (sabor amargo de grão). Apesar de 74 compostos voláteis terem sido identificados durante a autoxidação do ácido linoléico (GROSCH, 1987), os principais compostos associados ao beany flavour são: hexanal, Z-3-hexenal e hexanol, sendo que o hexanal é o composto volátil mais abundante e está associado à LOX-2 (ADDO et al., 1993; DELCROS et al.,1998). A melhora na qualidade reológica em panificação e a oxidação de carotenóides estão associadas à LOX1 (KLEIN et al., 1984; CUMBEE; HILDEBRAND; ADDO, 1997; SERPEN; GÓKMEN, 2006).
O trigo também contém LOX, mas em menor quantidade em comparação com a soja. A principal diferença é que a LOX do trigo só oxida ácidos graxos livres e monoglicerídeos, enquanto a LOX da soja oxida todos os principais lipídios da farinha que contenham ácido linoléico e linolênico (MORRISON; PANPAPRAI, 1975; CARR; DANIELS; FRAZIER, 1992).
2.5 A metodologia de superfície de resposta
Desta forma, é possível estimar o valor de uma resposta em função de valores assumidos pelos fatores (xi), dentro da faixa experimental estabelecida para a realização dos ensaios. O modelo estatístico descreve as respostas em termos dos efeitos por unidade de variação dos fatores:
y(xi) = n (xi) + 2 (xi),
Onde 2 (xi) representa o erro aleatório com que as respostas flutuam em torno da média definida pelos valores xi (BARROS NETO et al., 2001). A partir de um modelo bem ajustado aos dados experimentais, é possível estimar o valor da resposta de acordo com as variações dos fatores com excelente nível de confiança, e otimizar o modelo buscando a combinação de fatores que resulte na máxima desejabilidade para a resposta de interesse.
A metodologia de superfície de resposta (MSR) representa a associação dessas técnicas estatísticas para ajuste de modelos aos planejamentos fatoriais, permitindo que além do efeito linear de cada fator na variação da resposta também sejam incluídos os efeitos não lineares e as interações. Essa técnica, introduzida na década de cinqüenta por G. Box (BOX; WILSON, 1951) permite que através de um número reduzido de ensaios experimentais, modelos polinomiais possam ser ajustados com objetivo de descrever reações bioquímicas que estejam ocorrendo, por exemplo, dentro de um sistema complexo como uma matriz alimentícia. A resposta pode ser apresentada graficamente através da construção de superfícies apoiadas em três eixos (yij,xi e xj) ou através de curvas de contorno onde as superfícies são projetadas no plano bidimensional, fixando-se o valor das outras variáveis independentes. A visualização das curvas contempla todas as infinitas combinações possíveis entre os fatores (xi) que resultem na mesma isoresposta (yi). Planejamentos experimentais baseados nas técnicas de MSR são muito mais eficientes que procedimentos empíricos na busca do entendimento de como variações conjuntas nos fatores selecionados alteram reações bioquímicas de interesse no alimento.
3. OBJETIVOS [PARTE 1]
Objetivos gerais
O objeto deste estudo foi de investigar a interação entre a lipoxigenase da soja, o ácido ascórbico e o peróxido de benzoíla, utilizando-se técnicas estatísticas que permitam a modelagem dessas reações e a futura otimização das propriedades de interesse.
Objetivos específicos
1. Modelar o efeito combinado dos três oxidantes nas características de cor da farinha, reologia da massa, reologia, cor e aspectos sensoriais dos pães;
2. Otimizar as regressões significativas buscando maximizar as propriedades de interesse na farinha, na massa e nos pães;
3. Validar as regressões através da avaliação da proporção otimizada dos oxidantes;
4. MATERIAIS E MÉTODOS [PARTE I]
“A theory is something nobody believes, except the person who made it. An
experiment is something everybody believes, except the person who made it.”
Albert Einstein (1879-1955).4.1 Material
Foi utilizada farinha de trigo nacional sem aditivos e recém-moida do tipo comum marca Soberana fornecida pela empresa Lapa Alimentos S.A. (Salvador, Brasil). Ferro quelato (Ferrochel Lote 231481) adquirido da Albitech Coml. Dist. Suplementos Minerais Ltda., ácido fólico (Merck & Co. Inc), ácido ascórbico (Cargill Food Ingredients Latin America), peróxido de benzoíla (La Lux 1, a 32%, Granotec do Brasil), maltodextrina (MorRex-1920, Corn Products Brasil), farinha de soja integral ativa não submetida a tratamento térmico (Multsoy Ind. e Com. Ltda.) e farinha de soja inativa obtida da moagem de soja grão sem lipoxigenase (não-transgênica) variedade UFV-TN105 fornecida pela COOPADAP (São Gotardo, MG) foram utilizadas no preparo das misturas avaliadas neste estudo.
4.2 Delineamento experimental das massas
Figura 17. Delineamento experimental “centróide-simplex”
A faixa de variação de cada ingrediente na mistura foi proporcional aos valores máximos permitidos pela legislação: x1 (FIS) ¨ de 0 a 1 g/100 g em cumprimento à Portaria nº 354, de 18 de julho de 1996; x2 (PBZ) ¨ de 0 a 0,006 g/100 g em cumprimento à Resolução nº 385, de 5 de agosto de 1999 e x3 (AA) ¨ de 0 a 0,05 g/100 g em cumprimento à Resolução nº 385, que dispõe sobre o uso de aditivos utilizados segundo as boas práticas de fabricação e suas funções (BRASIL, 1996; BRASIL, 1999a; BRASIL, 1999b). Embora a legislação norte-americana imponha um limite de 0,5 g/100 g para o uso da farinha de soja como agente ‘branqueador’ e 0,02 g/100 g para ácido ascórbico como ‘melhorador’ em farinhas (UNITED STATES, 2003a; UNITED STATES, 2003b), a faixa de variação aplicada a este estudo foi mais ampla em função da menor limitação imposta pela legislação brasileira e pelo fato da metodologia de superfície de resposta possibilitar a otimização sob restrição de fatores. Os ensaios e análises foram executados em até 30 dias da moagem da farinha de trigo.
4.3 Delineamento experimental dos pães
0,05 g de ácido ascórbico (AA), 0,5 g de farinha ativa de soja + 0,5g de farinha inativa de soja/100 g de farinha de trigo + 0,025 g de ácido ascórbico (FIS+AA) e CONTROLE (1,0 g de farinha de soja inativa + 0 g de ácido ascórbico) foram preparados de forma aleatória.
4.4 Métodos
Preparo das misturas
Fortificação da farinha de trigo
A farinha de trigo comum foi adicionada de 4,2 mg de ferro (21 mg de Ferrochel) e 150 µg de ácido fólico (Merck & Co., Inc.) em 100 g, garantindo dessa forma, o aporte desses nutrientes segundo a legislação vigente (BRASIL, 2002), que torna obrigatória a adição de ferro e de ácido fólico nas farinhas de trigo pré-embaladas na ausência do cliente e prontas para oferta ao consumidor, as destinadas ao uso industrial, incluindo as de panificação e as farinhas adicionadas nas pré-misturas, devendo cada 100 g de farinha de trigo e de farinha de milho fornecerem no mínimo 4,2 mg de ferro e 150 µg de ácido fólico (BRASIL, 2002).
Determinação da composição centesimal
Determinação da atividade da lipoxigenase
A atividade da lipoxigenase (fração 1) na farinha integral de soja ativa na farinha inativa e na farinha de trigo foram determinadas de acordo com Axelrod, Cheesbrought e Laakso (1981), com modificações propostas por Oliveira et al. (1998). O linoleato de sódio (10 mM) foi utilizado como substrato e preparado com a adição de 156 µL de ácido linoléico 99% (SIGMA L1376-5G, SIGMA, St. Louis, MO, USA) e 180 µL de Tween 20 em 40 mL de água deionizada. Gotas de NaOH 2 N foram adicionadas até a solução ficar translúcida, sendo completada com água destilada fervida e resfriada em balão volumétrico coberto com papel alumínio para o volume de 50 mL .
1951) foi utilizado para quantificar a proteína do extrato durante a determinação de atividade enzimática de acordo com o seguinte procedimento: uma mistura alcalina foi preparada contendo 2 mL de sulfeto cúprico 2%, 2 mL de solução de tartarato duplo de sódio e potássio 4%. Carbonato de sódio anidro 2% em NaOH 0,1 N foi adicionado até completar o volume de 100 mL. Três tubos de ensaio para cada amostra foram adicionados com 50 µL da amostra, 950 µL de H2O destilada e 2,5 mL da mistura alcalina. As misturas foram agitadas no vortex por 15 segundos, e adicionados de 300 µL de solução Follin Ciocalteau após 5 min de repouso. As soluções foram novamente agitadas, repousadas por 30 min e a absorção medida a 660 nm.
Para os cálculos da dosagem de proteína, foi utilizada uma regressão linear ajustada para uma curva padrão obtida a partir de diferentes alíquotas dissolvidas em 1000 µL de H2O de 50 mg de soro albumina bovina (BSA - Sigma A8022) dissolvida em 100 ml de H2O. A curva padrão utilizada nos cálculos foi: mg/ml = -0,08 + 0,60 abs, apresentado um coeficiente de correlação de 0,97.
Determinação do conteúdo de ferro nas farinhas de soja
A concentração de ferro nas amostras de farinha de soja ativa e inativa foi determinada pelo método de Espectrofotometria de Absorção Atômica (EAA), segundo as normas da AOAC (1985).
Uma curva padrão de ferro foi preparada com padrão de Cloreto Férrico 9972 Titrisol - Merck contendo 1000 mg de Fe/L diluído em água deionizada, nas seguintes concentrações: 0,3; 0,5; 1,0; 2,0; 3,0 e 5,0 µg Fe/mL. A absorbância
Análise sensorial da cor das farinhas
As misturas de farinhas de trigo preparadas de acordo com o delineamento experimental descrito na Figura 17, acrescido de um ensaio controle, foram sensorialmente avaliadas usando um teste de “ordenação diferença” com 18 provadores não treinados em cabine Macbeth Spectral light com luz do dia (6770 oK) (Figura 18). As oito misturas foram codificadas com três dígitos e apresentadas numa única sessão a cada provador. Os julgadores ordenaram as amostras do mais branco ao mais amarelo. Os resultados foram primeiramente avaliados por ANOVA não paramétrica (Friedmann) seguido de teste de contraste LSDrank com um valor α de 5%, conforme recomendado por Meilgaard et al. (1999). Os testes começaram 72 horas após a adição das misturas, permitindo a ação completa do peróxido de benzoíla.
Figura 18. Avaliação sensorial da cor das farinhas.
Análise instrumental da cor das farinhas e dos pães
9 mm utilizando-se um cubeta de quartz de 1 polegada. O mesmo procedimento foi utilizado para as farinhas que foram inseridas dentro da cubeta. Neste colorímetro, a cor das amostras é representada por três dimensões L, a e b, correspondente ao sistema XYZ CIE lab system (Figura 19). O valor L denota a medida de luminosidade do produto de 100 para o branco perfeito ao zero para o preto, assim como o olho humano avaliaria. As tonalidades vermelho/verde são determinadas pela letra a e as tonalidades amarelo/azul pela letra b (FERREIRA,1981). Neste estudo o código “Lc” foi utilizado no lugar de “L”, pelo fato que esta sigla foi aplicada à medida reológica de extensibilidade da massa.
Figura 19. Sistema de cores CIE Lab.
Fonte: Konica Minolta, (1998) [adaptado].
Propriedades reológicas
abscissa média no rompimento da bolha (extensibilidade da massa (L, mm)), proporção da deformação da curva (P/L) e a energia de deformação relacionada a 1 g de massa (W x 10-4J).
Duas curvas foram consideradas para cada amostra e a análise foi conduzida em um alveógrafo Chopin modelo MA95 (Chopin, Villeneuve-la-Garenne, França) a uma temperatura de 18 a 22 oC e umidade relativa de 65 ± 15% com uma solução salina 2,5% (Figura 20).
Figura 20. Alveógrafo Chopin
Preparo dos pães
em formas metálicas de 30 mm x 10 mm x 11 mm (Figura 21) e levadas à câmara de fermentação Suprema (Suprema, Sumaré, SP) por 120 min a 30 oC, com umidade relativa de 90 a 95% (período de tempo padrão da indústria para fermentações curtas). A seguir, as formas foram acondicionadas em forno elétrico semi-industrial de lastro marca Suprema modelo MSE-2.2D (Suprema, Sumaré, SP) padronizado à temperatura de 230 ºC no topo e 218 ºC na base. Após 24 minutos, os pães foram esfriados à temperatura ambiente por 1 hora em carrinhos com prateleiras metálicas para os testes de volume. Cada pão foi posteriormente embalado em sacos de polietileno e congelado a -25 oC para futuras avaliações.
Figura 21. Forma para fermentação e forneamento de pão tipo americano.
Análise de volume dos pães
Propriedades de textura
Os pães foram descongelados à temperatura ambiente e a firmeza do miolo foi determinada instrumentalmente utilizando-se o Texture Analyser (TA-XT2i, Stable Micro Systems Ltd, Surrey, Reino Unido) com o software Texture Expert v.1.20 (Figura 22) com cinco repetições para cada amostra, de acordo com os procedimentos recomendados no método 74-09 (AACC, 2000). Uma sonda cilíndrica de alumínio com 35 mm de diâmetro, modelo P/36R, foi utilizada para o teste de compressão única. A força da sonda durante o teste foi de 5 g e a distância da compressão foi de 30 mm com velocidade e 1 mm seg-1. Cinco amostras com espessura de 25 mm cortadas do centro dos pães foram avaliadas para cada mistura. A força em Newtons foi computada como sendo a força necessária para fazer penetrar a sonda.
Figura 22. Texturômetro Texture Analyser TA-XT2i
Avaliação sensorial dos pães
da USP, treinados no uso de uma escala de intensidade com 9 pontos (MEILGAARD et al., 1999). A escala foi ancorada por produtos comerciais previamente definidos representando as amostras extremas. Após o treinamento, os provadores foram submetidos a um teste contendo 3 amostras (duas iguais e uma diferente). Este teste foi repetido 3 vezes para cada provador, que foi selecionado baseado na sua capacidade de separar as diferentes amostras de acordo com os 5 critérios descritos e medidos pelo valor da probabilidade (p<0,05 e p>0,05 para as amostras e repetições, respectivamente) obtido pelo teste de variância (ANOVA) usado nos testes. Uma descrição completa da escala se encontra nos resultados (Tabela 10). Quatro amostras (FIS, AA, FIS+AA e CONT) foram codificadas com 3 dígitos e apresentadas numa única sessão para cada provador. Todas as amostras foram apresentadas simultâneamente em 24 combinações (4!) de ordem. As avaliações foram conduzidas em laboratório e cada provador avaliou 2 combinações separadas em duas sessões diferentes. Entre cada avaliação, os provadores tomaram água (20°C) para limpar a boca. Os resultados foram submetidos a um teste de normalidade e homogeneidade de variâncias e tratados por two way ANOVA (provadores e testes).
Modelagem e otimização das regressões
Os resultados experimentais obtidos das avaliações sensoriais e reológicas para os sete ensaios foram ajustados a um modelo linear, quadrático ou cúbico para obtenção dos coeficientes de regressão e tratados estatisticamente na modelagem das variáveis respostas (yi):
ŷi = ß1*x1 + ß 2*x2 + ß 3*x3 + ß12*x1x2 + ß 13*x1x3 + ß 23*x2x3 + ß 123*x1x2x3,
onde ŷi = função da estimativa da resposta de interesse, ßi = coeficientes estimados pelo método dos mínimos quadrados, xi = variáveis dependentes,
sendo 1 > xi > 0 e = 1,0 (ERIKSSON; JOHANSSON; WIKSTROM, 1998). Gráficos tridimensionais de superfície de resposta foram gerados para cada parâmetro de qualidade.
A qualidade do ajuste dos modelos aos dados experimentais foi verificada através da análise de variância (ANOVA) da regressão e o coeficiente de determinação (R2), na qual as repetições forneceram graus de liberdade para a obtenção do erro puro e conseqüentemente, análise da falta de ajuste.
O teste qui-quadrado (x2) foi utilizado para comparação entre os valores estimados e observados obtidos para a combinação aleatória das 3 variáveis (FIS, AA e PBZ). A otimização simultânea das respostas (ŷi) foi obtida de acordo com os procedimentos propostos por Derringer e Suich (1980). Todos os cálculos e gráficos foram realizados com auxílio do programa STATISTICA v.7 (Statsoft Inc., Tulsa, USA).
Análise estatística
5. RESULTADOS [PARTE 1]
5.1 Composição química
A Tabela 3 apresenta a composição química da farinha de soja e de trigo utilizadas neste estudo. A composição química da farinha de trigo suplementada com 1% das diferentes misturas, de acordo com o delineamento experimental, está apresentada na Tabela 4, enquanto que a composição química média dos pães pode ser verificada na Tabela 5.
Tabela 3. Composição química da farinha de soja e farinha de trigo.
Nutrientes1 Farinha Integral de Soja Farinha de Trigo
Umidade 5,2 ± 0,1 13,8 ± 0,4
Proteína 40,6 ± 0,9 (N x 6,25) 11,9 ± 0,6 (N x 5,70)
Lipídios 23,5 ± 0,6 1,4 ± 0,1
Cinzas 5,0 ± 0,1 0,6 ± 0,0
Carboidratos2 25,7 72,2
1
Valores em g /100 g expressos pela média ± DP (n=3).
2