UNIVERSIDADE DE SÃO PAULO
FCF / FEA / FSP
Programa de Pós-Graduação Interunidades
em Nutrição Humana Aplicada – PRONUT
LUÍLA ÍVINI ANDRADE DE CASTRO
Efeito da ingestão do óleo de amaranto
no metabolismo lipídico de hamsters
Dissertação para obtenção do grau de Mestre Orientador: Prof. Dr. José Alfredo Gomes Arêas
LUÍLA ÍVINI ANDRADE DE CASTRO
Efeito da ingestão do óleo de amaranto
no metabolismo lipídico de hamsters
Comissão Julgadora
Dissertação para obtenção do grau de Mestre
Prof. Dr. José Alfredo Gomes Arêas (Orientador/Presidente)
__________________________ 1º Examinador
__________________________ 2º Examinador
AGRADECIMENTOS
A Deus, autor da vida e fonte de toda sabedoria, aquele que me capacita e sustenta em todos os momentos da vida. Porque Dele, por Ele e para Ele são todas as coisas. A Ele seja a glória para sempre! (Romanos 11:36).
Ao professor Dr. José Alfredo Gomes Arêas, pela oportunidade de realizar o mestrado, pela convivência agradável e por todos os ensinamentos durante esse tempo.
Aos professores da Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM): Dra. Ivy Scorzi Cazelli Pires, Dr. Christiano Vieira Pires e Dra. Tania Regina Riul, pelos ensinamentos, conselhos e apoio que antecederam o meu ingresso no mestrado.
Aos professores Dra. Emília Ishimoto, Dr. Silvio Vicente e Dra. Elizabeth Torres pelas valiosas sugestões no início do meu trabalho.
À minha família, em especial meus pais Ubirajara e Maria Castro, e meus irmãos Uiara Live e Vítor Hugo, pelo amor, confiança e incentivo em todas as etapas da minha vida.
Aos meus avós Antônio Gomes e Raimunda Andrade, pelo amor e confiança que sempre depositaram em mim.
Ao Braulio Gomes Domingues, pela amizade, incentivo e companheirismo durante todo esse tempo.
À Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP), pela bolsa que usufruí no início mestrado e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela bolsa concedida nos demais meses.
A todos os colegas do Laboratório de Bioquímica e Propriedades Funcionais dos Alimentos e do Laboratório de Bromatologia, pelo convívio e aprendizado.
Agradeço em especial à Técnica do Laboratório de Bioquímica e Propriedades Funcionais dos Alimentos: Rosana Aparecida Manólio Soares, pelo convívio diário, amizade, prontidão em ajudar e pelas valiosas sugestões em todos os momentos que precisei.
Às minhas grandes amigas Patrícia Beleza Antunes e Karen Pacheco, pelos vários momentos de descontração e encorajamento mútuo, que certamente tornaram esta jornada melhor.
À Lilian Carolina de Assis Vaz, pela amizade, paciência, discussões construtivas e grande aprendizado.
À Karoline Frota, Gustavo Fontanari e Yara Severino, pelas dicas e sugestões na etapa do ensaio biológico.
À professora Dra. Vanessa Dias Capriles, pela amizade, momentos agradáveis e aprendizado durante esses anos.
A todos os funcionários do Departamento de Nutrição da Faculdade de Saúde Pública, em especial Roseli, Beth, Zé Bezerra e Bastos.
Aos funcionários do Biotério do Instituto de Medicina Tropical e Centro de Bioterismo da USP: Luiz Mundel, Andréa, Renato, Carlinhos, Vilma, Robison, Luiza, Milena, Marilda, Carlos e Dila.
Às funcionárias do Centro de Ciência e Qualidade dos Alimentos do ITAL (Campinas-SP): Roseli Aparecida Ferrari, Ana Rauen e Claudia Almeida.
Ao Adilson Manzano da Ecirtec (Bauru-SP), pelo auxílio nos primeiros testes de extração do óleo de amaranto por prensagem.
À professora Dra Maria Ângela Meireles e alunas Juliana Prado e Glaucia Helena da Faculdade de Engenharia de Alimentos da Unicamp (Campinas-SP), que possibilitaram o teste de extração do óleo de amaranto por CO2 supercrítico.
Ao professor Dr. Paulo Saldiva da Faculdade de Medicina da USP, pela contribuição na análise histológica.
Aos funcionários do PRONUT, em especial Jorge, Elaine, Mônica, Lilian, Majô e Edilson.
À Rosana, Lilian, Gustavo e Prof. Arêas, por terem dedicado parte de seu tempo à revisão cuidadosa do meu trabalho.
A todos que contribuíram direta ou indiretamente para a realização deste trabalho, os meus sinceros agradecimentos.
Feliz o homem que acha sabedoria, e o homem que adquire
conhecimento; porque melhor é o lucro que ela dá do que o da prata, e
melhor a sua renda do que o ouro mais fino. Mais preciosa é do que
pérolas, e tudo o que podes desejar não é comparável a ela. O
alongar-se da vida está na sua mão direita, na sua esquerda, riquezas e honra.
Os seus caminhos são caminhos deliciosos, e todas as suas veredas,
paz. É árvore de vida para os que a alcançam, e felizes são todos os
que a retêm.
RESUMO
Castro LIA. Efeito do óleo de amaranto no metabolismo lipídico de hamsters [dissertação de mestrado]. São Paulo: Faculdade de Saúde Pública/Faculdade de Economia, Administração e Contabilidade/Faculdade de Ciências Farmacêuticas, Universidade de São Paulo; 2011.
cardíaca, sob anestesia, sendo determinados o colesterol total, triglicérides, HDL-c e colesterol não-HDL plasmáticos. Após sacrifício, os fígados dos animais foram coletados para a realização da análise histológica e do teor de colesterol. Também foram determinados os teores de colesterol e ácidos biliares das fezes dos animais. Resultados. Não houve diferença estatisticamente significante no perfil lipídico e excreção fecal de colesterol dos animais dos grupos hipercolesterolêmico, óleo de amaranto e esqualeno. A excreção fecal de ácidos biliares foi maior nos animais dos grupos óleo de amaranto e esqualeno em comparação com os grupos controle e hipercolesterolêmico. O teor de colesterol hepático dos animais do grupo esqualeno foi maior em relação aos outros grupos, embora tenha se diferenciado estatisticamente apenas do grupo controle. Em relação à análise histológica hepática, os maiores graus de esteatose e inflamação parenquimatosa foram os dos grupos óleo de amaranto e esqualeno. Conclusões. O óleo de amaranto e o seu componente esqualeno não apresentaram efeito hipocolesterolemizante e promoveram um aumento da excreção de ácidos biliares em hamsters alimentados com dieta contendo elevadas quantidades de gordura saturada e colesterol.
ABSTRACT
Castro LIA. Effect of amaranth oil on lipid metabolism of hamsters [MSc Dissertation]. São Paulo (BR): Faculdade de Saúde Pública/Faculdade de Economia, Administração e Contabilidade/Faculdade de Ciências Farmacêuticas, Universidade de São Paulo; 2011.
triglycerides, HDL-C and plasma non-HDL cholesterol. After sacrifice, the livers of animals were collected for histological analysis and determination of cholesterol content. We also determined the levels of cholesterol and bile acids in the feces of animals. Results: There was no statistically significant difference in lipid profile and fecal excretion of cholesterol from animals in the hypercholesterolemic, amaranth oil and squalene groups. Fecal excretion of bile acids was higher in animals in groups of amaranth oil and squalene as compared with the control group and hypercholesterolemic group. The cholesterol content in liver of the animals from squalene group was higher compared to other groups, although this difference was not statistically significant except when compared to the control group. The highest grade of steatosis and parenchymal inflammation were found in the groups of amaranth oil and squalene. Conclusions: The amaranth oil and its component squalene had no effect hypocholesterolemic and promoted an increased excretion of bile acids in hamsters fed a diet containing high amounts of saturated fat and cholesterol.
ÍNDICE
1 INTRODUÇÃO... 19
2 REVISÃO DA LITERATURA... 22
2.1 ASPECTOS GERAIS DO METABOLISMO LIPÍDICO... 22
2.2 BIOSSÍNTESE DO COLESTEROL... 25
2.3 NUTRIÇÃO E DOENÇAS CARDIOVASCULARES... 27
2.4 AMARANTO... 29
2.4.1 Aspectos Históricos ... 29
2.4.2 Características Nutricionais... 31
2.4.2.1 Proteínas ... 31
2.4.2.2 Amido... 31
2.4.2.3 Fibra Alimentar... 32
2.4.2.4 Vitaminas e Minerais... 32
2.4.2.5 Lipídeos ... 33
2.4.2.5.1 Esqualeno... 34
2.5 EFEITO DO AMARANTO E ESQUALENO NO METABOLISMO LIPÍDICO ... 36
3 OBJETIVOS... 40
3.1 OBJETIVO GERAL... 40
3.2 OBJETIVOS ESPECÍFICOS... 40
4 MATERIAL E MÉTODOS... 41
4.1 MATÉRIA-PRIMA E EXTRAÇÃO LIPÍDICA ... 41
4.3 CARACTERIZAÇÃO DOS ÓLEOS DE AMARANTO E MILHO... 43
4.3.1 Determinação de Ácidos Graxos ... 43
4.3.2 Determinação de Esqualeno ... 44
4.3.3 Determinação de Esteróis... 44
4.3.4 Determinação do Índice de Acidez... 46
4.3.5 Determinação do Índice de Peróxido... 46
4.3.6 Determinação do Índice de Refração... 46
4.4 EXPERIMENTO BIOLÓGICO... 47
4.4.1 Biotério... 47
4.4.2 Animais ... 47
4.4.3 Dietas... 48
4.4.3.1 Preparação das dietas... 48
4.4.3.2 Composição centesimal das dietas ... 50
4.4.4 Consumo alimentar ... 50
4.4.5 Ganho de Peso ... 50
4.4.6 Análises no Plasma ... 51
4.4.7 Experimento piloto... 51
4.4.8 Experimento Principal... 54
4.4.9 Análises nas Fezes ... 58
4.4.9.1 Colesterol... 58
4.4.9.2 Ácidos Biliares... 59
4.4.10 Análises no Fígado... 59
4.4.10.1 Colesterol... 59
4.4.11 Análise Estatística... 61
4.4.12 Aspectos Éticos... 62
5 RESULTADOS E DISCUSSÃO... 63
5.1 EXTRAÇÃO LIPÍDICA... 63
5.2 CARACTERIZAÇÃO CENTESIMAL DA MATÉRIA-PRIMA ... 63
5.3 CARACTERIZAÇÃO DOS ÓLEOS DE AMARANTO E MILHO... 64
5.3.1 Perfil de Ácidos Graxos ... 64
5.3.2 Teor de Esqualeno... 66
5.3.3 Conteúdo de Esteróis ... 67
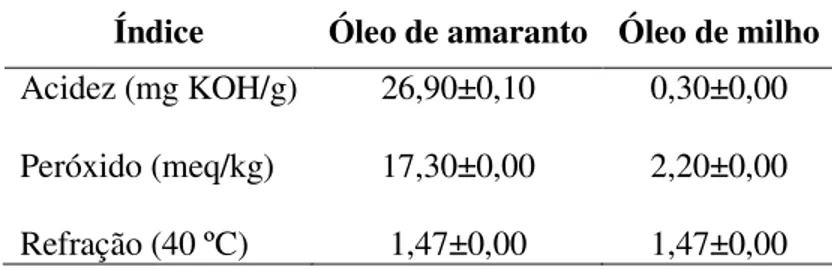
5.3.4 Índices de Acidez, Peróxido e Refração... 69
5.4 EXPERIMENTO BIOLÓGICO... 70
5.4.1 Modelo Experimental Utilizado ... 70
5.5 EXPERIMENTO PILOTO ... 71
5.5.1 Composição Centesimal das Rações... 71
5.5.2 Consumo de Ração e Peso dos Animais ... 73
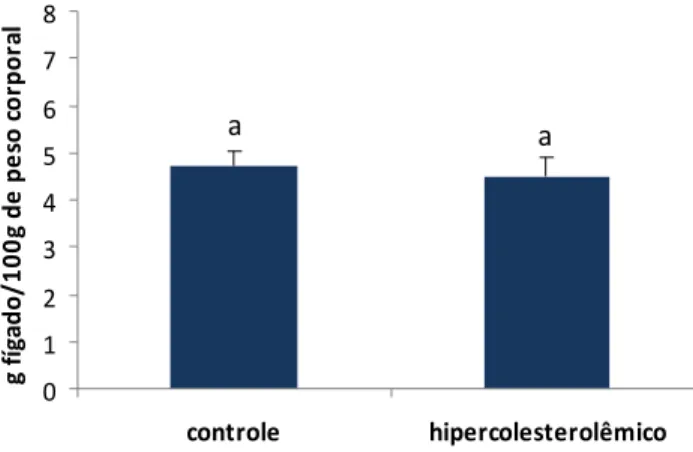
5.5.3 Peso do Fígado... 74
5.5.4 Perfil de Lipídeos Plasmáticos ... 75
5.6 EXPERIMENTO PRINCIPAL ... 76
5.6.1 Composição Centesimal das Rações... 76
5.6.2 Consumo de Rações e Peso dos Animais... 77
5.6.3 Peso do Fígado... 79
5.6.4 Perfil de Lipídeos Plasmáticos ... 81
5.6.5 Teores de Ácidos Biliares e Colesterol nas Fezes ... 86
5.6.6.1 Colesterol... 88
5.6.6.2 Análise Histológica ... 90
6 CONCLUSÕES... 100
7 REFERÊNCIAS... 101
8 ANEXOS... 116
ANEXO I – Aprovação do Comitê de Ética do Instituto de Medicina Tropical (IMT) da USP ... 117
ANEXO II – Aprovação do Comitê de Ética da Faculdade de Ciências Farmacêuticas (FCF) da USP... 118
Lista de Figuras
Figura 1 Esquema simplificado da rota biossintética do colesterol 25 Figura 2 (a) Planta do amaranto (b) Sementes de amaranto 30
Figura 3 Estrutura química do esqualeno 35
Figura 4 Planta de extração por solvente modelo Ecirtec, localizada no
ITAL (Campinas-SP) 41
Figura 5 Animais dispostos em gaiolas individuais contendo maravalha
autoclavada 48
Figura 6 Fluxograma representando o desenho do experimento piloto 54 Figura 7 Fluxograma representando o desenho do experimento
principal
57
Figura 8 Óleo de amaranto (Amaranthus cruentus) bruto, extraído por
solvente (n-hexano) 63
Figura 9 Relação peso do fígado/peso corporal dos animais dos grupos
controle e hipercolesterolêmico 74
Figura 10 Relação peso do fígado/peso corporal dos animais dos grupos
controle, hipercolesterolêmico, óleo de amaranto e esqualeno 80 Figura 11 Esteatose hepática média dos hamsters dos grupos controle,
hipercolesterolêmico, óleo de amaranto e esqualeno 92 Figura 12 Fotomicrografia de secções de 5 µm de espessura do fígado
coradas com HE, ilustrando o acúmulo de gordura hepática focal, em hamster do grupo controle
93
Figura 13 Fotomicrografia de secções de 5 µm de espessura do fígado coradas com HE, ilustrando ausência de esteatose e inflamação hepática, em hamster do grupo hipercolesterolêmico
94
Figura 14 Fotomicrografia de secções de 5 µm de espessura do fígado coradas com HE, ilustrando o acúmulo de gordura hepática difusa (grau 3+), em hamster do grupo óleo de amaranto
Figura 15 Fotomicrografia de secções de 5 µm de espessura do fígado coradas com HE, ilustrando a inflamação parenquimatosa grau 1+, em hamster do grupo óleo de amaranto
97
Figura 16 Fotomicrografia de secções de 5 µm de espessura do fígado coradas com HE, ilustrando a esteatose grau 2+, em hamster do grupo esqualeno
97
Figura 17 Fotomicrografia de secções de 5 µm de espessura do fígado coradas com HE, ilustrando a inflamação parenquimatosa grau 1+, em hamster do grupo esqualeno.
98
Figura 18 Fotomicrografia de secções de 5 µm de espessura do fígado coradas com HE, ilustrando o processo de apoptose, em hamster do grupo óleo de amaranto.
Lista de Tabelas
Tabela 1 Necessidades nutricionais de hamsters em fase de crescimento 49 Tabela 2 Composição planejada das dietas utilizadas no experimento
piloto, representadas em g/kg
53
Tabela 3 Composição planejada das dietas utilizadas no experimento
principal, representadas em g/kg 56
Tabela 4 Composição centesimal do amaranto integral (Amaranthus cruentus L., BRS-Alegria) e do farelo de amaranto desengordurado, representada em g/100 g de matéria-prima, em base seca
64
Tabela 5 Perfil dos principais ácidos graxos (%) dos óleos de amaranto e milho, utilizados nas dietas dos hamsters
65
Tabela 6 Concentração de esqualeno (%) dos óleos de amaranto e
milho, utilizados nas dietas dos hamsters 66
Tabela 7 Teores de fitosteróis (campesterol, estigmasterol e β
-sitosterol), em mg/100 g, dos óleos de amaranto e milho, utilizados nas dietas dos hamsters.
67
Tabela 8 Índices de acidez, peróxido e refração dos óleos de amaranto e
milho, utilizados nas dietas dos hamsters 69
Tabela 9 Composição centesimal das rações utilizadas nos grupos controle e hipercolesterolêmico, representada em g/100g de dieta, em base seca
72
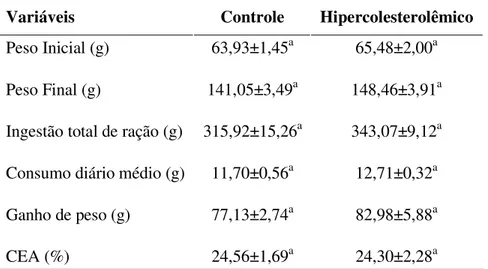
Tabela 10 Peso inicial, final, ganho de peso, ingestão total de ração, consumo diário médio e coeficiente de eficiência alimentar dos grupos controle e hipercolesterolêmico
73
Tabela 11 Concentração plasmática de colesterol total, HDL-colesterol, colesterol não-HDL e triglicérides dos animais (mg/dL) dos grupos basal, controle e hipercolesterolêmico
75
Tabela 12 Composição centesimal das dietas utilizadas nos grupos do experimento principal (controle, hipercolesterolêmico, óleo de amaranto e esqualeno), representada em g/100g de dieta, em base seca
Tabela 13 Peso inicial, final, ganho de peso, ingestão total de ração, consumo diário médio e coeficiente de eficiência alimentar dos hamsters do experimento principal
78
Tabela 14 Perfil lipídico dos hamsters do grupo basal e dos hamsters após 28 dias alimentando com as dietas do experimento principal
82
Tabela 15 Excreção fecal de ácidos biliares e colesterol dos hamsters dos grupos controle, hipercolesterolêmico, óleo de amaranto e esqualeno
86
Tabela 16 Colesterol do fígado dos animais dos grupos controle,
hipercolesterolêmico, óleo de amaranto e esqualeno 88 Tabela 17 Escores de esteatose hepática e respectivos significados
clínicos 91
Tabela 18 Escores de inflamação (parenquimatosa e portal) e respectivos significados clínicos
Lista de Abreviaturas e Siglas
ACAT – Acil CoA Colesterol Aciltransferase Acetil CoA – Acetil Coenzima A
AGL – Ácidos Graxos Livres ANOVA – Análise de Variância Apo B-100 – Apolipoproteína B-100 Apo E – Apolipoproteína E
CBAs – Compostos Bioativos
CEA – Coeficiente de Eficiência Alimentar CG – Cromatografia Gasosa
CO2 – Dióxido de Carbono CT – Colesterol Total
DCNT – Doenças Crônicas Não Transmissíveis DCV – Doenças Cardiovasculares
Fator rec – Fator de Recuperação
FPP – Farnesilpirofosfato GPP – Geranilpirofosfato
HDL – Lipoproteína de Alta Densidade HE – Hematoxilina-Eosina
HMG-CoA redutase – 3-Hidroxi-3-Metilglutaril-Coenzima A redutase HPLC – Cromatografia Líquida de Alta Eficiência
IDL – Lipoproteína de Densidade Intermediária IPP – Isopentenilpirofosfato
kg – Kilograma
LDL – Lipoproteína de Baixa Densidade Lp(a) – Lipoproteína (a)
LPL – Lipase Lipoprotéica M – Molar
meq – Miliequivalente mg – Miligrama nm – nanômetro N – Normal
NRC – National Research Council OMS – Organização Mundial da Saúde
SPSS – Statistical Package for the Social Sciences TG – Triglicérides
VLDL – Lipoproteína de Muito Baixa Densidade BF3 – Trifluoreto de Boro
dL – Decilitro g – Grama µL – Microlitro µmol – Micromol
19
1 INTRODUÇÃO
Estimativas da Organização Mundial da Saúde (OMS) apontam que as doenças crônicas não transmissíveis (DCNT) são responsáveis por 58,5% das mortes ocorridas no mundo e por 45,9% da carga global de doenças (WHO, 2002).
Dentre as DCNT, destacam-se as doenças cardiovasculares (DCV), por serem a causa de um terço dos óbitos no Brasil, constituindo a principal causa de morte em nosso país (MALTA et al., 2006).
A alta proporção de morte precoce por DCV em algumas regiões metropolitanas do Brasil é comparável aos índices encontrados nos países do leste europeu, como na Hungria, que tem um dos coeficientes mais altos do mundo (GARCIA et al., 2002), sendo esse grupo de doenças cada vez mais apresentado e discutido como um dos maiores problemas de saúde pública (LAURENTI; BUCHALLA, 2001).
A elevação de LDL-colesterol (lipoproteína de baixa densidade) e diminuição da HDL-colesterol (lipoproteína de alta densidade) estão associadas com o aumento de doença coronariana em humanos e não humanos. Na maioria dos casos, o consumo elevado de gordura e colesterol altera a concentração e composição das lipoproteínas no plasma (MAGNONI; STEFANUTO; KOVACS, 2007).
20 Uma publicação da OMS sobre a relação entre a alimentação, a atividade física e as DCNT mostra que alguns componentes da dieta podem provocar efeitos adversos ao organismo. Esses componentes aumentam o risco de DCV quando consumidos em periodicidade e quantidades inadequadas. São alimentos ou preparações que contêm elevadas concentrações de colesterol, ácidos graxos saturados, ácidos graxos trans e sódio (WHO, 2003).
Por outro lado, há elementos dietéticos nos vegetais – cereais, leguminosas, frutas e hortaliças – relacionados à redução do risco de desenvolvimento de DCNT, como proteínas, fibras alimentares, antioxidantes e outras substâncias, além dos ácidos graxos monoinsaturados e poliinsaturados presentes nos peixes e óleos vegetais (WHO, 2003). Sendo assim, a American Heart Association recomenda o aumento do consumo destes alimentos (RIQUE; SOARES; MEIRELLES, 2002; BARRETO et al., 2005).
A própria sociedade tem se mostrado mais preocupada com questões relacionadas à alimentação e saúde (FILHO; RISSIN, 2003; ANJO, 2004), onde existe atualmente um mercado em expansão, caracterizado pelo aumento da procura por alimentos funcionais (AMAYA-FARFÁN; MARCÍLIO; SPEHAR, 2005). Alimentos funcionais são aqueles que apresentam, além das funções nutricionais básicas, efeitos metabólicos e/ou fisiológicos e/ou efeitos benéficos à saúde (ANVISA, 1999). É neste contexto que se destaca a importância do amaranto.
21 2007; MENDONÇA et al., 2009; CHÁVEZ-JÁUREGUI et al., 2010; ASSIS-VAZ; ARÊAS, 2010).
Estudos conduzidos com grãos de amaranto em animais demonstraram sua capacidade de reduzir os níveis séricos de colesterol (CHATUVERDI; SAROJINI; DEVI, 1993; PLATE; ARÊAS, 2002; MENDONÇA et al., 2009; ASSIS-VAZ; ARÊAS, 2010). Pesquisadores têm discutido quais substâncias seriam responsáveis pela propriedade hipocolesterolêmica do referido grão. Alguns atribuem esta capacidade à fibra alimentar solúvel (QURESHI; LEHMANN; PETERSON, 1996); outros à sua proteína (PLATE; ARÊAS, 2002; MENDONÇA et al., 2009; ASSIS-VAZ; ARÊAS, 2010); e alguns à presença do esqualeno, substância intermediária do metabolismo do colesterol, presente na fração lipídica do amaranto (CHATUVERDI; SAROJINI; DEVI, 1993).
Até o momento, poucos trabalhos se propuseram a avaliar o impacto exercido pelo óleo de amaranto sobre os níveis séricos de colesterol, já que os estudos têm se concentrado na investigação do efeito da proteína do amaranto no metabolismo lipídico.
22
2 REVISÃO DA LITERATURA
2.1 ASPECTOS GERAIS DO METABOLISMO LIPÍDICO
Dos pontos de vista fisiológico e clínico, os lipídeos biologicamente mais relevantes são os fosfolípides, o colesterol, os triglicérides (TG) e os ácidos graxos. Os fosfolípides formam a estrutura básica das membranas celulares e o colesterol é precursor dos hormônios esteróides, dos ácidos biliares e da vitamina D. Além disso, como constituinte das membranas celulares, o colesterol atua na fluidez destas e na ativação de enzimas aí situadas. Os triglicérides são formados a partir de três ácidos graxos ligados a uma molécula de glicerol e constituem uma das formas de armazenamento energético mais importante no organismo, depositados nos tecidos adiposo e muscular (SPOSITO et al., 2007).
No organismo humano, o transporte de lipídeos é realizado através das lipoproteínas que são constituídas por um núcleo apolar de triglicérides e ésteres de colesterol, colesterol livre e apolipoproteínas, que são proteínas de peso molecular variável e que recebem nomenclatura alfa-numérica (apolipoproteínas AI, AII, AIV, B, CII e E), possuindo cada uma função distinta e específica no metabolismo das lipoproteínas (MAGNONI; STEFANUTO; KOVACS, 2007).
23 de densidade baixa “low density protein” (LDL) e de densidade alta “high density protein” (HDL). Existe ainda uma classe de lipoproteínas de densidade intermediária ou “intermediary density protein” (IDL) e a lipoproteína (a) [Lp(a)], que resulta da ligação covalente de uma partícula de LDL à apo(a) (SPOSITO et al., 2007).
Os quilomícrons são os responsáveis pelo transporte dos lipídeos da dieta e da circulação entero-hepática. Uma vez sintetizados, são lançados na linfa, atingindo a circulação sanguínea através do ducto torácico. Este se torna uma partícula de menor tamanho (quilomícron remanescente), pela retirada de seus ácidos graxos, ao sofrerem hidrólise de seus triglicérides pela ação da enzima lipase lipoprotéica (LPL). Os remanescentes são removidos da circulação para o fígado devido à ligação da apo E com o receptor de remanescentes neste órgão (GENEST, 2003).
Os ácidos graxos provenientes do quilomícron juntamente com os sintetizados no fígado são “re-empacotados” e secretados no sangue na forma de VLDL. Na circulação, as VLDL são hidrolisadas pela LPL, originando as IDL que contêm apo B-100 e apo E em sua superfície. As IDL têm dois destinos: são captadas da circulação pelo fígado, pela interação das apoproteínas com receptores hepáticos, ou processadas pela lipase hepática e se transformam em LDL, que permanecem por longo tempo no plasma (GENEST, 2003).
(HMG-24 CoA) redutase, que é a enzima-chave intracelular para síntese do colesterol hepático (SPOSITO et al., 2007; BROWN; JESSUP, 2009).
O aumento da concentração intracelular de colesterol livre apresenta os seguintes efeitos regulatórios: inibição da HMG-CoA redutase, impedindo a síntese de colesterol; inibição da síntese de receptores de LDL; e estímulo da enzima acil Co-A colesterol aciltransferase (ACAT) para esterificação do colesterol citoplasmático (RADER; WILSON, 1995; ALVAREZ-LEITE; OLIVEIRA; PELUZIO, 2003).
Não existe uma via de catabolismo do colesterol, sendo este eliminado pelo fígado como ácidos biliares secretados na bile (RADER; WILSON, 1995; ALVAREZ-LEITE; OLIVEIRA; PELUZIO, 2003).
As LDL são, portanto, as principais lipoproteínas transportadoras de colesterol hepático para os tecidos periféricos e apresentam propriedades aterogênicas, visto que há evidente associação entre elevadas concentrações desta lipoproteína e o aumento da aterosclerose, que consiste em uma complexa e crônica inflamação que ocorre nas artérias de médio e grande calibre (BERLINER et al., 1995; STEFFENS; MACH, 2004; VAN DER LAAN et al., 2004).
25
2.2 BIOSSÍNTESE DO COLESTEROL
O colesterol é sintetizado nos mamíferos a partir da acetil-coenzima A (acetil-CoA), uma molécula produzida durante o metabolismo de proteínas, carboidratos e lipídios. Existem, no mínimo, 21 passos na via biossintética do colesterol (ZUBAY, 1999).
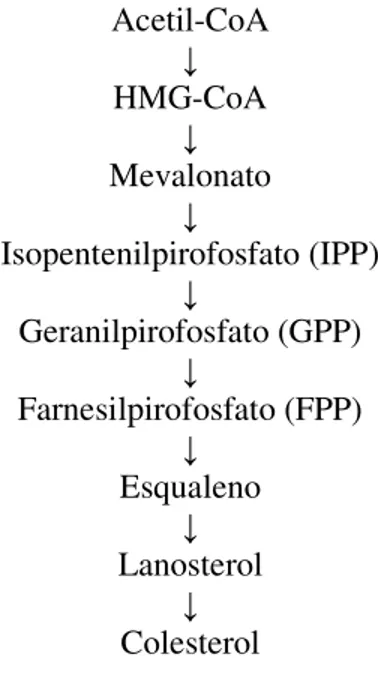
A síntese endógena do colesterol está esquematizada na figura abaixo.
Figura 1 – Esquema simplificado da rota biossintética do colesterol.
A primeira etapa desta síntese envolve a condensação sequencial de três moléculas de acetil-CoA pelas enzimas acetil-CoA C acetiltransferase e HMG-CoA sintase (LYNEN, 1953). Estas reações originam a 3-hidroxi-3-metilgluratil-CoA (HMG-CoA), que é posteriormente reduzida pela HMG-CoA redutase microssomal a
Acetil-CoA
↓
HMG-CoA
↓
Mevalonato
↓
Isopentenilpirofosfato (IPP)
↓
Geranilpirofosfato (GPP)
↓
Farnesilpirofosfato (FPP)
↓
Esqualeno
↓
Lanosterol
↓
26 mevalonato, composto de cinco átomos de carbono (BUCHER; OVERATH; LYNEN, 1960). Este passo irreversível é a etapa limitante da síntese de colesterol e de extrema importância clínica, uma vez que as drogas de primeira escolha no tratamento da hipercolesterolemia são inibidores reversíveis e competitivos da HMG-CoA redutase (SABARENSE; PELUZIO, 2008).
A HMG-CoA redutase tem sua atividade regulada pelo colesterol intracelular, ou seja, quando há excesso ou deficiência de colesterol no ambiente intracelular, esta enzima tem sua atividade diminuída ou aumentada, respectivamente (CHAMPE; HARVEY, 2002; ALVAREZ-LEITE; PELUZIO, 2003).
Fosforilações do ácido mevalônico, dependentes de ATP, e subsequente descarboxilação produzem o isopentenilpirofosfato (IPP), a molécula doadora para todos os compostos poliisoprenóides. As enzimas preniltransferase geram os ésteres pirofosfatoalílicos geranilpirofosfato (GPP) e farnesilpirofosfato (FPP). Duas molélulas de FPP são então unidas enzimaticamente, resultando na formação do esqualeno (CROTEAU; KUTCHAN; LEWIS, 2000).
27
2.3 NUTRIÇÃO E DOENÇAS CARDIOVASCULARES
Fatores ambientais, incluindo a dieta, exercem um importante papel no desenvolvimento das doenças cardiovasculares (SANTOS et al., 2006; STEEBURGO; DALL´ALBA; GOSS, 2007).
A gordura saturada é a principal causa alimentar de elevação do colesterol plasmático, pois reduz os receptores celulares B-E, inibindo a redução plasmática das partículas de LDL, permitindo, além disso, maior entrada de colesterol nessas partículas. Os ácidos graxos saturados estão presentes principalmente na gordura animal (carnes gordurosas, leite integral e derivados), polpa de coco e alguns óleos vegetais (dendê e coco) (RIQUE; SOARES; MEIRELLES, 2002).
Estudos recentes indicaram que os ácidos graxos monoinsaturados trans também aumentam as concentrações de LDL. Estes ácidos graxos são produzidos por hidrogenação de óleos vegetais. A configuração trans confere-lhes propriedades estruturais semelhantes às dos ácidos graxos saturados, o que pode explicar a sua ação de elevar as concentrações séricas de LDL (SHILS et al., 2003).
28 frutos do mar, gema de ovo, pele de aves, embutidos e frios (RIQUE; SOARES; MEIRELLES, 2002).
A constatação de que dietas ricas em vegetais, como a da população mediterrânea contemporânea e da população asiática, reduzem o risco das DCNT, impulsionou pesquisas que identificaram substâncias nutrientes e não nutrientes atuantes em alvos fisiológicos específicos e que, dessa forma, interferem nos processos patológicos dessas doenças (BASTOS; ROGERO; ARÊAS, 2009).
Atualmente tem sido considerado que a ingestão insuficiente de compostos bioativos (CBAs) provenientes de vegetais constitui importante componente de risco das DCNT, contribuindo na mesma magnitude do consumo excessivo de energia e de gorduras totais e saturadas da dieta (BASTOS; ROGERO; ARÊAS, 2009).
Os grãos são ricas fontes de CBAs como os compostos fenólicos, carotenóides, vitamina E, lignanas, inulina, amido resistente, esteróis, tocoferóis, tocotrienóis, dentre outros. Os efeitos aditivos e sinérgicos destes compostos podem ser responsáveis pelos benefícios à saúde promovidos pelas dietas ricas em frutas, verduras, legumes e grãos integrais, como a redução do risco de DCNT (LIU, 2004). Investigações recentes demonstram que alimentos a base de soja possuem potencial efeito protetor sobre uma variedade de doenças crônicas, especialmente as doenças cardiovasculares (CLARKSON, 2002). Numerosos estudos em humanos e animais mostram que o consumo da proteína de soja reduz o colesterol total sérico e o LDL-c, que são os principais fatores de risco para as doenças cardiovasculares (FUKUI et al, 2004; REYNOLDS et al., 2006).
29 já estudados que potencialmente podem trazer benefício na prevenção de doenças cardiovasculares (PLATE; ARÊAS, 2002; MENDONÇA et al., 2009, ASSIS-VAZ; ARÊAS, 2010).
2.4 AMARANTO
2.4.1 Aspectos Históricos
O amaranto é um pseudocereal da classe das dicotiledôneas, domesticado na América há mais de 6.000 anos pelas civilizações que nela se desenvolveram, sendo posteriormente expandido por outras partes do mundo (SPEHAR, 2007).
O amaranto foi cultivado na América pelos Incas, Maias e Astecas, sendo considerado um alimento sagrado. Suas sementes eram utilizadas em cerimônias religiosas, porém, com a chegada dos colonizadores espanhóis, estas práticas e o seu cultivo foram proibidos. Assim, o cultivo do amaranto ficou restrito a apenas algumas regiões dos Andes (SAUNDERS; BECKER, 1984; YÁNEZ et al., 1994).
30 significativamente. As três espécies mais estudadas e cultivadas em todo o mundo para o consumo humano são Amaranthus cruentus L., Amaranthus caudatus L. e Amaranthus hipocondriacus L. (BREENE, 1991).
A planta do amaranto (Figura 2a) se desenvolve de forma vigorosa, com inflorescências (panículas ou cachos) coloridas, com variações do amarelo ao roxo. Apresenta rápido crescimento e pode atingir até 2,0 m, com a inflorescência de até 0,6 m, dependendo do manejo e suprimento de água. As sementes são muito pequenas e arredondadas (Figura 2b), e quando amadurecem, ao cair no solo, germinam rapidamente na presença de umidade (SPEHAR et al., 2003).
Figura 2 – (a) Planta do amaranto. Fonte: flowersgallery.net (b) Sementes de amaranto.
Recentemente o amaranto foi adaptado ao clima e solo brasileiros pela Embrapa Cerrados (Planaltina-DF), recebendo a denominação Amaranthus cruentus L., variedade BRS – Alegria (SPEHAR et al., 2003; TEIXEIRA; SPEHAR; SOUZA, 2003). O nome alegria refere-se a um confeito mexicano preparado com grãos de amaranto estourados e unidos com xarope de glicose ou caramelo (BREENE, 1991).
31
2.4.2 Características Nutricionais
2.4.2.1 Proteínas
Apesar da baixa biodisponibilidade das proteínas de origem vegetal, o teor protéico do amaranto e seu perfil de aminoácidos fazem com que seja uma atrativa fonte protéica, apresentando teores elevados de aminoácidos essenciais, especialmente lisina (5%) e aminoácidos sulfurados (4%), limitantes nos grãos comuns (JAHANIAVAL; KAKUDA; MARCONE, 2000; ESCUDERO et al., 2004; FERREIRA; MATIAS; ARÊAS, 2007; MENDONÇA et al., 2009).
O amaranto, assim como a soja, apresenta as globulinas como sua principal forma de proteína de estocagem. A fração gliadina do trigo, uma prolamina, que é responsável pelas reações alérgicas relacionadas à doença celíaca, não é encontrado no amaranto, o que o faz apropriado para dietas isentas de glúten (GORINSTEIN et al., 2002).
2.4.2.2 Amido
32 Guerra-Matias e Arêas (2004, 2005) verificaram alta digestibilidade do extrusado do amido do grão de amaranto, quando comparado com o controle de pão branco. O Índice de Hidrólise in vitro e Índice Glicêmico foram 103 e 107, respectivamente. Estes resultados foram atribuídos ao pequeno tamanho do grânulo de amido e sua baixa temperatura de gelatinização (FERREIRA; MATIAS; ARÊAS, 2007).
2.4.2.3 Fibra Alimentar
O amaranto possui alto conteúdo de fibra alimentar, concentrações que variam de 4 a 8% (GUZMÁN-MALDONADO; PAREDEZ-LOPEZ, 2000; TOSI; CIAPPINI; MASCIARELLI, 1996. É considerado excelente fonte de fibras insolúveis, compostas principalmente por celulose e lignina, com teores superiores ao encontrado em cereais (SAUNDERS; BECKER, 1984).
2.4.2.4 Vitaminas e Minerais
33 O amaranto ainda é considerado boa fonte de minerais, com conteúdo variando, dependendo da espécie, de 141 a 241 mg/100g de cálcio; de 12,5 a 13,9 mg/100g de ferro; de 2,95 a 3,95 mg/100g de zinco; de 2,03 a 4,53 mg/100g de manganês; e de 478 a 510 mg/100g de fósforo (FERREIRA; MATIAS; ARÊAS, 2007).
2.4.2.5 Lipídeos
O amaranto também contém teor de lipídeos superior ao de outros cereais (GAMEL et al., 2007). A relação ácidos graxos insaturados/saturados é de 3:1 (CHAVEZ-JÁUREGUI; SILVA; ARÊAS, 2000). Os ácidos graxos poliinsaturados são representados em elevada proporção (77%) (MARTIROSYAN et al., 2007), sendo 50% destes constituídos de linoléico (C18:2) e 25% de oléico (C18:1) (GAMEL
et al., 2007).
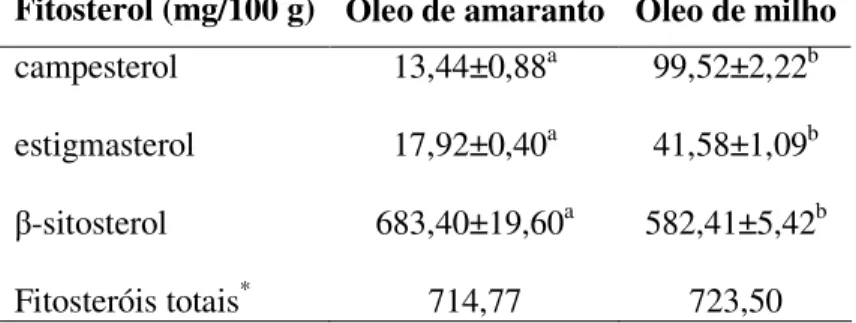
Alguns dos compostos importantes encontrados na fração insaponificável do óleo de amaranto são os fitosteróis, que exercem papel importante na redução do colesterol plasmático. Marcone, Kakuda e Yada (2004) identificaram neste óleo os fitosteróis mais comuns na natureza (β-sitosterol, campesterol e estigmasterol) e
verificaram que o total destes foi superior ao de outros óleos vegetais, como oliva, soja e algodão.
34 doenças crônicas não-transmissíveis, como as doenças cardiovasculares. Além de tal ação benéfica no organismo de animais, em vegetais é observado que estes compostos são capazes de impedir a degradação da membrana celular, evitando que os lipídeos sofram peroxidação. Do total destas substâncias no óleo de amaranto, 43% correspondem aos tocoferóis, 47% aos β-tocotrienóis e 8% a outros tocotrienóis
(QURESHI; LEHMANN; PETERSON, 1996).
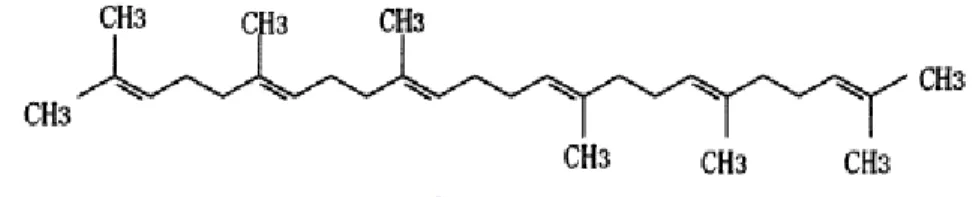
O óleo de amaranto se mostra bastante semelhante ao óleo de milho na sua composição em ácidos graxos (LYON; BECKER, 1987). Entretanto, possui um diferencial por sua fração insaponificável ser rica em esqualeno (2,6,10,15,19,23-hexametil-2,6,10,14,18,22-tetrahexaneno) (BERGANZA et al., 2003; HAN-PING et al., 2003).
2.4.2.5.1 Esqualeno
35 O esqualeno é um hidrocarboneto insaponificável, contendo 6 duplas ligações não conjugadas, pertencente ao grupo dos triterpenos, apresentando 6 unidades de isopreno (Figura 3), conhecido por seu papel chave como metabólito intermediário na biossíntese dos esteróides de plantas e animais (STUCHLÍK; ZÁK, 2002; KO; WENG; CHIOU, 2002).
Figura 3 – Estrutura química do esqualeno. Fonte: Ko, Weng, Chiou (2002).
Em humanos, cerca de 60% do esqualeno dietético é absorvido, sendo transportado geralmente pelas lipoproteínas de muito baixa densidade (VLDL) e distribuído em grandes concentrações na pele, sendo um dos principais constituintes dos componentes lipídicos da superfície da pele (STORM; KIMLER, 1993).
36 também apresenta efeito de redução dos níveis plasmáticos de colesterol e triglicérides (RICHTER; SCHAFER, 1982; FARVIN et al., 2006).
2.5 EFEITO DO AMARANTO E ESQUALENO NO METABOLISMO
LIPÍDICO
Alguns estudos demonstram que o amaranto apresenta efeito hipocolesterolêmico (CHATUVERDI; SAROJINI; DEVI, 1993; GRAJETA, 1997; PLATE; ARÊAS 2002; MENDONÇA et al, 2009; ASSIS-VAZ; ARÊAS, 2010), porém a identificação do componente que exerce maior impacto sobre os níveis plasmáticos de colesterol ainda é objeto de investigação e discussão.
Dentre as hipóteses formuladas para justificar este efeito, pode-se citar o perfil de aminoácidos da proteína do amaranto, seu teor de fibras totais e solúveis, proporção de ácidos graxos insaturados e presença de fitoquímicos, tais como o esqualeno (FERREIRA; MATIAS; ARÊAS, 2007).
Chatuverdi, Sarojini e Devi (1993) observaram o efeito hipocolesterolêmico do amaranto da espécie Amaranthus esculentus através da administração do grão a ratos Wistar, verificando redução dos níveis de lipídeos plasmáticos, triglicérides e aumento das partículas de HDL.
37 Mendonça et al. (2009) observaram em ensaio com hamsters hipercolesterolêmicos, redução do colesterol plasmático com a administração do isolado protéico do grão da espécie Amaranthus cruentus. Foi observada redução de 23% do colesterol total ao longo dos 28 dias de experimento, e concluiu-se que a proteína do amaranto é a fração responsável majoritariamente pelo efeito hipocolesterolêmico do referido pseudocereal.
Mais recentemente, Assis-Vaz e Arêas (2010) verificaram redução de 36% e 37% do colesterol total e triglicérides, respectivamente, quando ratos Wistar consumiram isolado protéico de amaranto e 1% de colesterol, em relação ao grupo controle, que recebeu caseína como fonte protéica e a mesma quantidade de colesterol.
Embora tenha sido bem demonstrado o efeito do amaranto integral e de sua proteína na redução dos níveis de colesterol sérico, a ação do óleo de amaranto e do esqualeno no metabolismo lipídico apresenta resultados controversos.
Plate e Arêas (2002) administraram amaranto da espécie Amaranthus caudatus na forma de grão extrusado e óleo, em dietas distintas, a coelhos hipercolesterolêmicos. Foi observado que a redução nos níveis de colesterol total e LDL após 21 dias foi mais efetiva para o amaranto extrusado (50%), quando comparado aos grupos controle (que recebeu óleo de girassol) e óleo de amaranto. Sendo assim, os autores concluíram que componentes do grão livre de lipídeos e, consequentemente, das demais substâncias lipossolúveis, foram suficientes para responder pelo efeito hipocolesterolêmico.
38 diariamente, durante 8 semanas consecutivas. Ao final do estudo, verificou-se um aumento nos níveis séricos de colesterol total em ambos os grupos suplementados com esqualeno, quando comparados ao grupo controle (que recebeu apenas óleo de milho). Similarmente, Nakamura et al. (1997) observaram um aumento nas concentrações de colesterol plasmático após 6 horas de administração de 86,22 mg deste triterpeno, por gavagem, em ratos Wistar.
Por outro lado, podem-se citar alguns estudos que avaliaram o efeito do óleo de amaranto e esqualeno no metabolismo lipídico de animais e que obtiveram resultados diferentes.
Berger et al. (2003a) observaram que dieta contendo 5% de óleo de amaranto foi capaz de reduzir o colesterol total e colesterol não-HDL de hamsters hipercolesterolêmicos em 15 e 22%, respectivamente, em relação ao grupo controle (que recebeu óleo de milho).
Shin et al. (2004), em ensaio com ratos Wistar, observaram que o esqualeno obtido do óleo de amaranto promoveu queda nos níveis séricos de colesterol total, triglicérides e aumento do HDL-colesterol. Foi também observado aumento da excreção fecal de colesterol e ácidos biliares.
39 Alguns autores apontam o efeito inibitório do esqualeno na atividade da HMG-CoA redutase (SHIN et al., 2004), sendo tal efeito relacionado a um mecanismo de retro-alimentação (“feedback”), ocasionando a redução de uma série de intermediários, tais como o mevalonato, farnesilpirofosfato e geranilpirofosfato, diminuindo assim a produção do colesterol (STRANDBERG; TILVIS, MIETTINEN, 1989; FARVIN; SURENDRARAJ; ANANDAN, 2009).
40
3 OBJETIVOS
3.1 OBJETIVO GERAL
Avaliar o potencial efeito hipocolesterolêmico do óleo de amaranto e esqualeno em hamsters alimentados com dieta contendo colesterol e gordura saturada.
3.2 OBJETIVOS ESPECÍFICOS
Caracterizar nutricionalmente o óleo de amaranto, determinando o perfil de ácidos graxos e os teores de esqualeno e fitosteróis (β-sitosterol, campesterol
e estigmasterol);
Avaliar, no plasma de hamsters hipercolesterolêmicos, a capacidade do óleo de amaranto em melhorar o perfil lipídico;
41
4 MATERIAL E MÉTODOS
4.1 MATÉRIA-PRIMA E EXTRAÇÃO LIPÍDICA
O amaranto (Amaranthus cruentus L., BRS-Alegria) foi fornecido pela Celeiro Alimentos (Planaltina – DF), e após retirada de sujidades, procedeu-se à etapa de extração lipídica, realizada no Centro de Ciência e Qualidade de Alimentos (CCQA) do Instituto de Tecnologia de Alimentos (ITAL), localizado em Campinas-SP.
Inicialmente, 90 kg de amaranto foram submetidos ao processo de prensagem a frio, utilizando uma prensa modelo Ecirtec MPE-40, para que fossem laminados, a fim de aumentar a superfície de contato com o solvente.
A etapa seguinte foi a extração direta com n-hexano PA utilizando a planta de extração por solvente (Figura 4).
42 A amostra proveniente do processo de prensagem (torta residual) foi lavada duas vezes com o solvente a 50 ºC, sendo a primeira lavagem por um período de 30 minutos e a segunda, 20 minutos. Após o término da extração, o solvente foi evaporado a 70 ºC e o óleo coletado. A matéria-prima restante foi denominada farelo de amaranto desengordurado.
Durante o estudo, o óleo de amaranto foi armazenado, a temperatura ambiente, em frasco de vidro âmbar para preservá-lo da luz e do ar. O mesmo procedimento foi realizado com o óleo de milho comercial, refinado, da marca Liza (utilizado nas outras rações deste estudo).
Sempre que era necessário abrir os frascos, ao final introduzia-se nitrogênio nos mesmos antes de tampá-los, para que os óleos não ficassem em contato com o ar atmosférico.
4.2 COMPOSIÇÃO CENTESIMAL DA MATÉRIA-PRIMA
43
4.3 CARACTERIZAÇÃO DOS ÓLEOS DE AMARANTO E MILHO
4.3.1 Determinação de Ácidos Graxos
Os ácidos graxos foram determinados, em triplicata, como ésteres metílicos de ácidos graxos por meio de cromatografia gasosa (CG) em equipamento “Shimadzu” modelo GC-2010. Uma alíquota de 150 mg de lipídio foi tomada e submetida à saponificação com NaOH 0,5N em metanol. Em seguida, foi esterificada com BF3 em metanol com aquecimento a 100 ºC durante 2 minutos em banho Maria
(MORRISON; SMITH, 1964).
Os ésteres metílicos foram extraídos a frio utilizando hexano como solvente e cerca de 5 mL de hexano contendo os éteres ficaram sob refrigeração até injeção em cromatógrafo gasoso.
44 padrões. Utilizou-se como padrão o Fatty acid methyl ester mixtures 47885 da Sigma-Aldrich. A análise foi qualitativa, sendo a proporção de cada ácido graxo calculada dividindo-se a área do seu pico pela área total da corrida.
4.3.2 Determinação de Esqualeno
Inicialmente, a fração insaponificável foi isolada, sendo tomada uma alíquota de 3 g de óleo de amaranto (ou milho) e dissolvida em uma mistura de 30 mL de etanol 95% e 5 mL de KOH 50%, agitando-se por 1 hora. Logo após, a mistura foi lavada com 40 mL de etanol 95% e então diluída para 80 mL com água destilada. Os insaponificáveis foram extraídos 5 vezes utilizando-se 50 mL de éter de petróleo por vez (HE et al., 2002).
A análise do esqualeno foi feita por HPLC (High Performance Liquid Chromatography – cromatografia líquida de alta eficiência), sendo o volume de injeção de 20 µL e a fase móvel uma mistura de acetona/acetonitrila (40:60 v/v). O fluxo isocrático utilizado foi de 1 mL/min, a detecção feita a 208 nm (UV/visível) e o tempo de corrida foi de 20 minutos (NENADIS; TSIMIDOU, 2002). A análise foi realizada em triplicata. Utilizou-se como padrão o squalene 3626 da Sigma-Aldrich.
4.3.3 Determinação de Esteróis
45 10 mL de KOH etanólica (3%). Aqueceu-se em banho maria a 50 ºC por 3 horas. Em seguida resfriou-se a amostra adicionando 10 mL de água destilada. Extraiu-se 4 vezes com 10 mL de hexano e secou-se sob fluxo de N2. Adicionou-se 1 mL de
padrão interno dihidrocolesterol e injetou-se em cromatógrafo gasoso.
Foi utilizado o cromatógrafo gasoso (HP, modelo 6890), equipado com amostrador automático; injetor em modo split, razão 50:1; coluna capilar HP-5MS (30 m, 0,25 mm d.i, 0,25 µL de filme); detector por ionização em chama. As condições cromatográficas foram otimizadas com base na metodologia de Schmarr et al. (1996) sendo: temperatura da coluna programada, temperatura inicial 150 ºC/0,1 min, elevando-se para 300 ºC em uma escala de 10 ºC/min, permanecendo nesta temperatura por 10 minutos; gás arraste de hélio, vazão de 1 mL/min; detector de ionização em chama: gás “make-up”, nitrogênio a 30 mL/min., hidrogênio 30 mL/min. e ar sintético 300 mL/min. e temperatura de 300 ºC; injetor: temperatura 250 ºC.
A identificação dos picos foi realizada através da comparação do tempo de retenção das amostras com os padrões (campesterol 5157; β-sitosterol 9889 e
46
4.3.4 Determinação do Índice de Acidez
Definido como o número de mg de hidróxido de potássio (KOH) necessário para neutralizar os ácidos graxos livres presentes em 1g de amostra. Foi utilizado o método AOCS Ca 5a-40 (2003).
4.3.5 Determinação do Índice de Peróxido
O índice de peróxido determina todas as substâncias que oxidam o iodeto de potássio (KI), em miliequivalentes de peróxido por 100 g de amostra, sob as condições de teste. Essas substâncias são geralmente consideradas como peróxidos ou outros produtos similares da oxidação de gorduras. O método utilizado para esta análise foi o Cd 8-53 da AOCS (2003).
4.3.6 Determinação do Índice de Refração
47
4.4 EXPERIMENTO BIOLÓGICO
4.4.1 Biotério
O experimento biológico foi realizado no biotério de experimentação para hamster do Instituto de Medicina Tropical da Universidade de São Paulo (IMT/USP).
4.4.2 Animais
Foram utilizados hamsters (Mesocricetus auratus) machos, da linhagem Golden Syrian, recém-desmamados (aproximadamente 21 dias), com padrão sanitário convencional, provenientes do Biotério Central da Faculdade de Medicina da USP.
Os animais foram dispostos em gaiolas individuais contendo maravalha autoclavada (Figura 5), em local arejado, com temperatura em torno de 20 a 25 ºC, sendo expostos 12 horas à claridade e 12 horas ao ambiente escuro.
48 Figura 5 – Animais dispostos em gaiolas individuais contendo maravalha autoclavada.
4.4.3 Dietas
4.4.3.1 Preparação das dietas
As dietas dos animais seguiram as recomendações nutricionais da National Research Council (NRC) (1995) e foram formuladas com uma mistura de minerais e vitaminas adequadas ao crescimento de hamsters, de acordo com as recomendações para roedores da AIN-93 (REEVES; NIELSEN; TAHEY, 1993).
49 Tabela 1 - Necessidades nutricionais de hamsters em fase de crescimento.
Componentes da dieta Quantidade (g/100 g)
Fibras 5 a 15
Carboidratos 65
Lipídeos 4 a 20
Proteínas 18 a 24
Total 100
Fonte: National Research Council, 1995
As dietas foram recebidas em pó, para serem reconstituídas com água destilada. Optou-se por adicionar os óleos (amaranto, milho e milho + esqualeno) em laboratório, evitando assim eventuais oxidações durante os processos industriais de fabricação das rações.
Os óleos (quantidades a serem relatadas posteriormente) foram adicionados às dietas em pó, sendo a mistura homogeneizada com o auxílio de uma colher. Para cada 100 g da mistura dieta em pó + óleo, foi adicionado 50 mL de água destilada, sendo a massa formada novamente homogeneizada.
50
4.4.3.2 Composição centesimal das dietas
Os teores de umidade, cinzas, lipídeos e proteína das dietas foram determinados de acordo com os métodos 950.46, 923.03, 920.39C e 960.52 da AOAC (2003), respectivamente. Todas as análises foram realizadas em triplicata. O teor de cardoidratos totais foi calculado por diferença.
4.4.4 Consumo alimentar
A ingestão dos animais foi avaliada diariamente durante todo o ensaio biológico. A quantidade de ração ingerida foi determinada pela diferença entre a quantidade de ração ofertada e a sobra no comedouro.
4.4.5 Ganho de Peso
Os animais foram pesados semanalmente, no mesmo horário, em balança digital semi analítica, durante todo o período experimental, para avaliar o ganho de peso.
51
4.4.6 Análises no Plasma
As análises no plasma foram realizadas pelo Laboratório de Controle de Qualidade Genética e Sanitária Animal da Divisão de Apoio ao Ensino e a Pesquisa do Centro de Bioterismo da Faculdade de Medicina da USP.
Para os procedimentos de coleta de sangue, os animais foram anestesiados em câmara de CO2.
O sangue dos animais foi coletado por punção cardíaca e acondicionado em tubos eppendorf contendo anticoagulante heparina (Liquemine), com concentração final de aproximadamente 1 mg/mL, sendo logo em seguida submetido a centrifugação a baixa velocidade (1.000 g, 15 min, 4 ºC) para obtenção do plasma (WRIGHT; SALTER, 1998). Após a coleta do sangue, os animais foram sacrificados por exsanguinação.
As concentrações de colesterol total (CT), triglicérides (TG) e lipoproteína de alta densidade (HDL) foram determinadas usando o sistema Cobas-Mira (Roche Diagnostics, USA).
O colesterol não-HDL (LDL-c + VLDL-c) foi calculado pela subtração do colesterol total pelo HDL colesterol.
4.4.7 Experimento piloto
52 em outros trabalhos que desenvolveram estudos semelhantes utilizando hamsters (TERPSTRA et al., 1998; LUCAS et al., 2001; FROTA et al., 2008; ISHIMOTO; TORRES, 2008; MENDONÇA et al., 2009; FONTANARI; BATISTUTI; ARÊAS, 2010).
Foram utilizados nove hamsters, que passaram inicialmente por um período de adaptação de 7 dias recebendo ad libitum a ração comercial Nuvilab CR1 (Nuvital). Esta ração tem composição declarada pelo fabricante de proteína mínima 22%, extrato etéreo mínimo 4%, matéria mineral máxima 10%, matéria fibrosa máxima 8% e umidade máxima de 12,5%.
Posteriormente, 3 animais foram sorteados e após jejum médio de 8 horas, tiveram o sangue coletado, sob anestesia, por punção cardíaca, para posteriores análises no plasma, descritas no item 4.4.6. Em seguida, estes animais foram sacrificados.
Os seis animais restantes foram então divididos em dois grupos de três animais cada, que receberam dois diferentes tipos de dietas, conforme descritos a seguir. A composição planejada destas rações se encontra na Tabela 2.
1. Grupo Controle (C): dieta com 20% de óleo de milho;
53 Tabela 2 - Composição planejada das dietas utilizadas no experimento piloto, representadas em g/kg.
Ingredientes (g/kg) Controle Hipercolesterolêmico
Caseína 200 200
Óleo de amaranto - -
Óleo de milho 200 80
Gordura de Côco - 120
Colesterol - 1
Cloreto de Colina 2 2
Sacarose 100 100
Amido de milho 350 349
Celulose 100 100
L-Cistina 3 3
Mistura Mineral* 35 35
Mistura Vitamínica* 10 10
Total 1000 1000
*Reeves, Nielsen e Tahey (1993)
Depois de 28 dias recebendo estas rações, todos os animais foram submetidos a coletas de sangue e em seguida sacrificados.
54 Figura 6 - Fluxograma representando o desenho do experimento piloto.
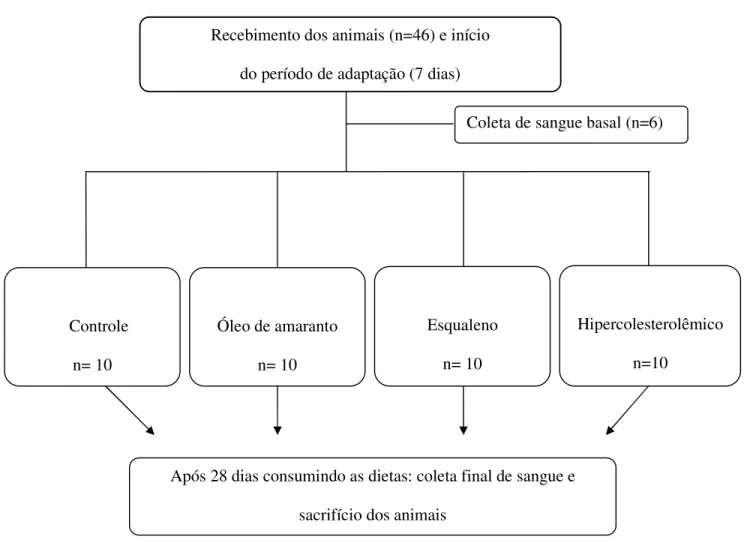
4.4.8 Experimento Principal
O experimento principal foi realizado com 46 hamsters. Após 7 dias de adaptação recebendo ração comercial, 6 animais foram sorteados e deixados em jejum médio de 8 horas para coleta de sangue, da mesma maneira que no experimento piloto, para a realização das análises no plasma descritas no item 4.4.6, sendo em seguida sacrificados por exsanguinação.
Recebimento dos animais (n=9) e início do período de adaptação (7 dias)
Coleta de sangue basal (n=3)
Controle n=3
Hipercolesterolêmico n=3
55 Os animais restantes foram aleatoriamente divididos em 4 grupos de 10, que receberam diferentes tipos de dietas, conforme descrição a seguir.
1. Grupo Controle (C): dieta com 20% de óleo de milho;
2. Grupo Hipercolesterolêmico (H): dieta hipercolesterolêmica, com 12% de gordura de côco, 0,1% de colesterol e 8% de óleo de milho;
3. Grupo Óleo de Amaranto (A): dieta hipercolesterolêmica, com 12% de gordura de côco, 0,1% de colesterol e 8% de óleo de amaranto;
4. Grupo Esqualeno (E): dieta hipercolesterolêmica, com 12% de gordura de côco, 0,1% de colesterol e 8% de óleo de milho adicionado de 4,6% de esqualeno (mesma quantidade de esqualeno presente no óleo de amaranto).
Os animais receberam estas dietas por um período de 28 dias, e a composição planejada destas se encontra na Tabela 3.
Como pode ser observado, todas as dietas experimentais possuem 20% lipídeos, que é o valor máximo das necessidades nutricionais de hamsters em fase de crescimento (Tabela 1). Optou-se pela utilização deste valor para que uma maior quantidade de óleo de amaranto pudesse ser utilizada (8%).
56 Tabela 3. Composição planejada das dietas utilizadas no experimento principal, representadas em g/kg.
Ingredientes (g/kg) Controle Óleo Amaranto
Esqualeno Hipercolesterolêmico
Caseína 200 200 200 200
Óleo de amaranto - 80 - -
Óleo de milho 200 - - 80
Óleo de milho + Esqualeno
- - 80 -
Gordura de Côco - 120 120 120
Colesterol - 1 1 1
Cloreto de Colina 2 2 2 2
Sacarose 100 100 100 100
Amido de milho 350 349 349 349
Celulose 100 100 100 100
L-Cistina 3 3 3 3
Mistura Mineral* 35 35 35 35
Mistura Vitamínica*
10 10 10 10
Total 1000 1000 1000 1000
57 Após 28 dias consumindo estas rações, todos os animais foram submetidos a coletas de sangue sob anestesia, por punção cardíaca, para a realização das análises descritas no item 4.4.6, sendo em seguida sacrificados por exsanguinação.
O Fluxograma representando o desenho do experimento principal se encontra na Figura 7.
Figura 7 – Fluxograma representando o desenho do experimento principal. Recebimento dos animais (n=46) e início
do período de adaptação (7 dias)
Após 28 dias consumindo as dietas: coleta final de sangue e sacrifício dos animais
Óleo de amaranto n= 10
Esqualeno n= 10 Controle
n= 10
Hipercolesterolêmico n=10
58 Os procedimentos operacionais, condições climáticas e período do experimento, tanto para o experimento piloto quanto para o experimento principal foram os mesmos descritos nos itens 4.4.1 a 4.4.6.
As análises descritas a seguir são exclusivas do experimento principal.
4.4.9 Análises nas Fezes
As fezes dos animais foram individualmente coletadas nos cinco últimos dias do experimento, sendo os animais alojados em gaiolas especialmente construídas para esta finalidade.
As fezes foram pesadas e acondicionadas em frascos de polietileno, congeladas e liofilizadas por 72 horas. Após secagem, foram pesadas, trituradas e armazenadas a –20 ºC até realização das análises (FROTA et al., 2008).
4.4.9.1 Colesterol
Alíquotas de 50 mg de fezes foram submetidas à saponificação com 700 µL de metanol e 200 µL de solução de NaOH 5M, por duas horas em banho-maria sob agitação, a 80 °C.
Após a adição de solução saturada de NaCl, o colesterol foi extraído três vezes com 3 mL de éter de petróleo (TERPSTRA et al., 1998).
59 Shimadzu SCL-10A (Shimadzu Scientific Instruments-Inc-Japan), com detector de varredura UV/VIS, injetor manual Rheodyne e bomba quaternária (CSALLANY et al., 1989).
O volume de injeção foi de 20 µL. A fase movel compreendia uma mistura de n-hexano/isopropanol (97:3) com fluxo isocrático de 1 mL/min. e a fase estacionária era composta por Sílica. O comprimento de onda de detecção utilizado foi 206 nm. O tempo de corrida foi de 8 minutos (CSALLANY et al., 1989).
4.4.9.2 Ácidos Biliares
Os ácidos biliares foram quantificados através de um kit comercial da marca Diazyme (San Diego, EUA). Previamente, as fezes foram submetidas à extração com tert-butanol a 50% por 15 minutos a 37 ºC e a centrifugação a 10000 g por 2 minutos para obtenção do sobrenadante contendo os ácidos biliares (VAN DER MEER et al., 1985).
4.4.10 Análises no Fígado
4.4.10.1 Colesterol
Para a determinação da concentração hepática de colesterol, foi utilizado o método proposto por Katsanidis e Addis (1999), com algumas modificações.
60 saponificação. Essa solução consistia de KOH na concentração 11 g/100 mL diluído em etanol 55% (v/v). A amostra foi colocada em banho-maria por 15 minutos a 80 °C. Após resfriamento, foi realizada a partição, sendo selecionada para análise a fase orgânica.
A quantificação do colesterol foi realizada por HPLC em equipamento da marca Shimadzu SCL-10A (Shimadzu Scientific Instruments-Inc-Japan). O volume de injeção foi de 20 µL. A fase móvel foi n-hexano/isopropanol (97:3 v/v), com fluxo isocrático de 1 mL/min. O detector utilizado foi o UV/VIS com varredura, com leitura no comprimento de onda de 206 nm. A quantificação foi realizada utilizando curva de calibração de colesterol padrão da Sterolids Inc-USA. O tempo de corrida foi de 8 minutos. As análises foram realizadas em triplicata.
Para avaliar a eficiência do método empregado, foi realizado o teste de recuperação de colesterol, utilizando colesterol padrão. Segundo Leite (1998), a determinação do fator de recuperação do método é importante para garantir que a substância de interesse seja quantificada na sua totalidade. O fator de recuperação (Fator rec) foi calculado pelo produto entre a área do pico do padrão puro injetado
diretamente no HPLC e a área do pico do padrão processado pelo método de forma equivalente às amostras, segundo a fórmula:
100 processado padrão
do Área
puro padrão do Área
Fatorrec = ×
61
4.4.10.2 Análise Histológica
Após sacrificio, os fígados dos animais foram removidos e preservados em
formol tamponado 10% por, pelo menos, 48 horas. Em seguida foram realizadas
secções transversais destes órgãos.
Os cortes foram submetidos às técnicas histológicas habituais com inclusão
em parafina para obtenção de cortes de 5 µm de espessura, corados com
hematoxilina-eosina (HE) (FROTA et al., 2008).
A análise histológica foi realizada pela equipe do Laboratório de Patologia da
Faculdade de Medicina da USP. Para estudo morfométrico, foi utilizado um
microscópio óptico comum (Nikon Eclipse E200) ao qual foi aclopado uma câmara
fotográfica (Digital color SCC-131 Sansung).
4.4.11 Análise Estatística
Os resultados foram expressos em média, desvio padrão e erro padrão. Para
averiguar a diferença de médias entre as variáveis do experimeto piloto, foi utilizado
o teste T de Student.
Para a comparação de médias das variáveis do experiento principal, foi
realizada análise de variância (ANOVA) seguida do teste de Tukey (quando
detectada diferença entre os grupos).
O programa Statistical Package for the Social Sciences (SPSS) foi utilizado,
62
4.4.12 Aspectos Éticos
O protocolo experimental do ensaio biológico seguiu as normas do Canadian
Council on Animal Care (OLFERT; CROSS; MC WILLIAN, 1993). Os
procedimentos foram aprovados pelos Comitês de Ética em Animais do Instituto de
Medicina Tropical (IMT) e Faculdade de Ciências Farmacêuticas (FCF) da
Universidade de São Paulo (USP), e pelo Sub-Comitê de Ética Ambiental da
63
5 RESULTADOS E DISCUSSÃO
5.1 EXTRAÇÃO LIPÍDICA
Na Figura 8 temos uma fotografia do óleo de amaranto bruto, obtido por
extração com solvente (n-hexano). Dos 90 kg de amaranto submetidos à extração,
foram obtidos 3,1 kg de óleo bruto.
Figura 8 – Óleo de amaranto (Amaranthus cruentus) bruto, extraído por solvente (n-hexano).
5.2 CARACTERIZAÇÃO CENTESIMAL DA MATÉRIA-PRIMA
A Tabela 4 apresenta os resultados obtidos na análise de composição do
64
Tabela 4 – Composição centesimal do amaranto integral (Amaranthus cruentus L., BRS-Alegria) e do farelo de amaranto desengordurado, representada em g/100g de matéria-prima, em base seca.
Componente (g/100g) Amaranto Integral Farelo Desengordurado
Cinzas 2,85±0,17a 2,24±0,01a
Proteínas* 15,3±0,33a 14,96±0,88a
Lipídeos 7,45±0,03a 1,40±0,13b
Carboidratos** 74,4 81,40
Total 100 100
Notas:
*Fator de conversão = 6,25 **Calculado pela diferença
Letras diferentes na mesma linha diferem entre si, teste t de Sudent (p<0,05) Média±desvio-padrão
O teor de óleo do amaranto integral (7,45%) está de acordo com o relatado pela
literatura, que é de 5,7-9,0% (SAUNDERS; BECKER, 1984; LYON; BECKER,
1987; GAMEL et al., 2007). Este é um teor de lipídeos elevado quando comparado
ao de outros cereais como o milho, que contém 4,5%, e o trigo e arroz, os quais
apresentam aproximadamente 2,1% de lipídeos (BELITZ; GROSCH, 1999).
Ao final do processo de extração por solvente, o farelo de amaranto apresentou
1,40% de óleo, o que demonstra a eficiência do processo de extração.
5.3 CARACTERIZAÇÃO DOS ÓLEOS DE AMARANTO E MILHO
5.3.1 Perfil de Ácidos Graxos
O perfil dos principais ácidos graxos dos óleos de amaranto e milho estão
65
Tabela 5 - Perfil dos principais ácidos graxos (%) dos óleos de amaranto e milho, utilizados nas dietas dos hamsters.
Ácidos Graxos (%) Óleo de Amaranto Óleo de Milho
C14:0 (Mirístico) 0,1 0,0
C16:0 (Palmítico) 15,5 11,4
C16:1 (Palmitoléico) 0,4 0,1
C17:0 (Margárico) 0,1 0,1
C18:0 (Esteárico) 3,3 2,3
C18:1 (Oléico) 31,2 38,4
C18:2t (Linoléico trans) 0,4 0,3
C18:2 (Linoléico) 32,8 44,6
C20:0 (Araquídico) 0,9 0,7
C20:1 (Eicosenóico) 0,4 0,5
C18:3 (α-Linolênico) 0,5 1,1
C22:0 (Beênico) 0,4 0,2
C20:4 (Aracdônico) 11,7 0,0
C22:2 (Docosadienóico) 0,1 0,0
C24:0 (Lignocérico) 0,5 0,3
C20:5 (Timnodônico) 0,1 0,0
Totais: Saturados 20,8 15,0
Monoinsaturados 32,0 39,0
Poliinsaturados 45,2 45,7
Insaturados 77,2 84,7
Como pode ser observado, os óleos de amaranto e milho apresentam um
perfil de ácidos graxos semelhante, sendo os ácidos graxos mais abundantes em
ambos o palmítico (C16:0), oléico (C18:1) e linoléico (C18:2). Já o ácido graxo α
-linolênico (C18:3) está presente em pequenas quantidades nestes óleos (0,5% no óleo
de amaranto e 1,1% no óleo de milho).
Lyon e Becker (1987) e Jahaniaval, Kakuda e Marcone (2000) também
verificaram um perfil de ácidos graxos semelhante entre os óleos de amaranto e
milho.
Jahaniaval, Kakuda e Marcone (2000) determinaram o perfil de ácidos graxos