1
Universidade de Trás-os-Montes e Alto Douro
Efeito do exercício físico na vascularização do
cancro da mama quimicamente induzido num
modelo animal
Dissertação de Mestrado em Bioquímica
Michel Filipe Branco Trigo Moutinho
Orientador:
Dra. Ana Isabel Rocha Faustino
Coorientador:
Professora Doutora Paula Alexandra Martins de Oliveira
Vila Real, 2016
2
Efeito do exercício físico na vascularização do
cancro da mama quimicamente induzido num
modelo animal
Dissertação de Mestrado em Bioquímica
Michel Filipe Branco Trigo Moutinho
Orientador:
Dra. Ana Isabel Rocha Faustino
Coorientador:
Professora Doutora Paula Alexandra Martins de Oliveira
Composição do Júri:
___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________
iii
Dedicatória
Dedico este Mestrado aos meus pais, António e Luísa, pelo apoio que sempre me deram ao longo destes anos e pela confiança depositada em mim.
Dedico também a mim próprio, pois apesar de alguns percalços, consegui o que queria e espero alcançar muito mais.
iv
Agradecimentos
A elaboração da presente dissertação não seria possível sem a contribuição de instituições e de determinadas pessoas. Gostaria de expressar os meus agradecimentos:
À Universidade de Trás-os-Montes e Alto Douro, por todo o apoio dado para a elaboração desta dissertação.
À Dra. Ana Faustino, Orientadora desta dissertação, pela ajuda prestada, disponibilidade, transmissão de conhecimentos, compreensão durante a execução de todo o trabalho e simpatia.
À Professora Doutora Paula Oliveira, Coorientadora desta dissertação, pela ajuda prestada, disponibilidade e transmissão de conhecimentos.
À Professora Doutora Adelina Gama, pela ajuda prestada na imuno histoquímica e pela classificação histológica das lesões.
À Fundação para a Ciência e Tecnologia (FCT) pela atribuição de financiamento ao projeto “Avaliação bioquímica, morfológica e funcional do catabolismo muscular associado ao cancro da mama: o papel do exercício físico” (PTDC/DES/114122/2009), com base no qual esta dissertação foi elaborada.
Ao meu colega Rafael, que me acompanhou durante todo o trabalho laboratorial.
Aos meus colegas e amigos do mestrado em Bioquímica, pelo apoio e companheir is mo ao longo destes dois anos.
Aos meus amigos e colegas de casa António e Tiago, pela amizade e boa disposição.
À Mélanie, sempre presente nos bons e maus momentos, pelo seu carinho, compreensão e apoio incondicional.
v
Resumo
O cancro da mama é uma das principais causas de morte no sexo feminino, tendo contabilizado cerca de 8,2 milhões de mortes em todo o mundo no ano de 2012. O fator de crescimento vascular endotelial (VEGF-A) desempenha um papel fundamental na angiogénese de diversos tipos de cancro, nomeadamente no cancro da mama. O seu elevado índice de expressão está correlacionado com pior prognóstico. Os modelos animais têm sido fundamentais para o estudo de diversas doenças, entre elas o cancro.
Os objetivos deste ensaio consistiram em:avaliar a vascularização das neoplasias mamárias em animais exercitados e sedentários através de técnicas de ultrassonografia e imunohistoquímica, e analisar a expressão do marcador tumoral VEGF no cancro da mama, utilizando parâmetros de densidade ótica e de índice de marcação.
Neste ensaio foram utilizados 50 ratos fêmea da estirpe Sprague-Dawley, com 4 a 5 semanas de idade. Os animais foram divididos aleatoriamente em quatro 4 grupos experimentais: MNU sedentário (n=15), MNU exercitado (n=15), controlo sedentário (n=10) e controlo exercitado (n=10). Às sete semanas de idade, os animais dos grupos MNU receberam uma administração intraperitoneal do agente carcinogénico metil- N-nitrosureia (MNU). Os animais dos grupos exercitados foram submetidos a um protocolo de exercício num treadmill durante 35 semanas. Os animais foram observados diariamente e palpados semanalmente para a deteção do desenvolvimento de neoplasias mamárias. No final do ensaio, a vascularização das neoplasias mamárias dos anima is sobreviventes foi avaliada por ultrassonografia (Power Doppler e B Flow). As neoplasias foram avaliadas por histologia e a imunoexpressão do VEGF-A foi avaliada de forma semiquantitativa por imunohistoquímica em termos de extensão e intensidade. Adicionalmente, foi determinada a densidade de microvasos (DMV).
A densidade de pixéis coloridos (DPC) detetada pelos modos Power Doppler e B
Flow não foi estatisticamente diferente entre grupos (p>0,05), no entanto foi superior no grupo MNU exercitado. A DPC detetada pelo modo B Flow foi superior à detetada pelo modo Power Doppler em ambos os grupos, esta diferença apenas foi estatisticame nte significativa no grupo MNU exercitado (p<0,05). Histologicamente, o número de lesões benignas foi numericamente superior no grupo MNU exercitado, enquanto que o número de lesões malignas foi superior no grupo MNU sedentário (p>0,05). Todas as lesões mamárias apresentaram imunorreatividade para o VEGF-A sendo que a maioria das
vi lesões mamárias do grupo de MNU sedentário foram avaliadas com um score 3. No grupo MNU exercitado o score 4 foi o mais frequente. A intensidade da imunomarcação do VEGF-A foi classificada maioritariamente como moderada no grupo MNU sedentário e como fraca no grupo MNU exercitado. A DMV foi superior no grupo MNU exercitado (p<0,05).
A análise dos resultados obtidos permite afirmar que a MNU foi um agente carcinogénico eficaz na indução de lesões mamárias em ratos Sprague-Dawley com sete semanas de idade. Ambos os modos Power Doppler e B Flow são úteis na avaliação da vascularização das neoplasias, sendo o modo B Flow o mais sensível. O carcinoma papilar foi a lesão mais frequente em ambos os grupos MNU. As lesões do grupo MNU exercitado apresentaram menor grau de malignidade e maior vascularização (a DPC, a imunoexpressão do VEGF e a DMV foram superiores neste grupo) do que as lesões do grupo MNU sedentário. Estes dados sugerem que a prática de exercício físico contribuiu para a oxigenação das neoplasias e potencialmente diminuiu a agressividade das neoplasias relacionada com a hipoxia.
Palavras-chave: Imunohistoquímica, cancro da mama, N-metil-N-nitrosureia (MNU), VEGF-A, exercício físico
vii
Abstract
Breast cancer is a leading cause of death among women having accounted for about 8.2 million of deaths worldwide in the year 2012. Vascular endothelial growth factor (VEGF-A) plays an important role in the angiogenesis of several human cancers, namely in breast cancer. Its high level of expression is correlated with poor prognosis. Animal models have been instrumental in the study of various diseases, including cancer. The objectives of this study were: to evaluate the vascularization of breast tumors in trained and sedentary animals by ultrasound techniques and immunohistochemis tr y, and to analyze the expression of tumor marker VEGF in breast cancer.
In this assay 50 female Sprague-Dawley rats with 4 to 5 weeks of age were used. Animals were randomly divided into four experimental groups: MNU sedentary (n=15), MNU exercised (n=15), control sedentary (n=10) and control exercised (n=10). At seven weeks of age, animals from MNU groups received an intraperitoneal administration of the carcinogen agent N-methyl-N-nitrosourea (MNU). Animals from exercised groups were trained in a treadmill for 35 weeks. The animals were daily observed and weekly palpated for the detection of the mammary tumors development. At the end of the experiment, the mammary tumors vascularization was assessed by ultrasonograp hy (Power Doppler and B Flow). Tumors were evaluated by histology and the VEGF-A immunoexpression was semiquantitatively evaluated in terms of extension and intens it y. Additionaly, the microvessels density (DMV) was determined.
The color pixels density (DPC) detected by Power Doppler and B Flow was not statistically different between groups (p>0.05), however it was numerically higher in the MNU exercised group. The DPC detected by B Flow was higher than that detected by Power Doppler mode in both groups, this difference was only statistically significant in the MNU exercised group (p<0.05). Histologically, the number of benign lesions was numerically higher in MNU exercised group, while the number of malignant lesions was higher in MNU sedentary group (p>0.05). All breast lesions showed immunoreactivit y for VEGF-A and the majority of breast lesions from MNU sedentary group were evaluated with a score 3, in the MNU exercised group the score 4 was the most frequent. The intensity of VEGF-A immunostaining was mainly classified as moderate in MNU sedentary group and as low in MNU exercised group. The DMV was higher in MNU exercised group (p<0.05).
viii The results allow to affirm that the MNU was effective in the induction of mammary lesions in seven week-old Sprague-Dawley rats. Both modes Power Doppler and B Flow are useful in assessing the tumors vascularization, being the B Flow the most sensible one. The papillary carcinoma was the most frequent mammary lesion in both MNU groups. The lesions from MNU exercised group exhibited lower grade of malignancy and higher vascularization (the DPC, the VEGF immunoexpression and the DMV were higher in this group) than the lesions from MNU sedentary group. These data suggest that the practice of physical exercise contributed to the mammary tumors oxygenation and potentially reduced the tumors aggressivity related with hypoxia.
Keywords: Immunohistochemistry, breast cancer, N-methyl-N-nitrosourea (MNU), VEGF-A, physical exercise
ix
Publicações decorrentes e relacionadas com o trabalho experimental
Artigos em revistas científicas nacionais com referee
Moutinho M, Gama A, Ferreira R, Ginja M, Oliveira PA, Faustino-Rocha AI. 2015. Immunoexpression of VEGF-A in chemically- induced mammary tumors. Experime nta l Pathology and Health Science (Aceite para publicação).
Comunicações orais em encontros internacionais
Moutinho M, Gama A, Ferreira R, Ginja M, Oliveira PA, Faustino-Rocha AI. 2015. Immunoexpression of VEGF-A in chemically- induced mammary tumors. V Congresso Luso-Brasileiro de Patologia Experimental – XV International Symposium of Experimental Techniques. 3 a 5 de dezembro, Coimbra, Portugal.
Faustino-Rocha AI, Silva A, Gabriel J, Gil da Costa RM, Moutinho M, Oliveira PA, Gama A, Ferreira R, Ginja M. 2015. Mammary tumors’ vascularization: ultrasonograp hic and thermographic evaluation. New Advances in Animal Models and preclinical Imaging for Translational Research in Cancerology. 30 de setembro a 3 de outubro, La Pointe de Pen Bron, França.
Publicações em atas de encontros científicos nacionais
Faustino-Rocha AI, Gama A, Oliveira PA, Moutinho M, Ferreira R, Ginja M. 2015. Biochemical profile of female Sprague-Dawley rats with chemically- induced mammar y cancer. VIII Jornadas de Bioquímica UTAD, p.48, 15 a 16 de abril, Vila Real, Portugal.
Comunicações por painel em encontros nacionais
Faustino-Rocha AI, Gama A, Oliveira PA, Moutinho M, Ferreira R, Ginja M. 2015. Biochemical profile of female Sprague-Dawley rats with chemically- induced mammar y cancer. VIII Jornadas de Bioquímica UTAD. 15 a 16 de abril, Universidade de Trás-os-Montes e Alto Douro, Vila Real, Portugal.
x
Índice
Dedicatória………………..…...… iii Agradecimentos ………. iv Resumo ……… v Abstract ………. viiPublicações decorrentes e relacionadas com o trabalho experimental………..…. viii
Índice de figuras……….xii
Índice de tabelas.………...xiii
Lista de Siglas e Abreviaturas ... xiv
1. Introdução ………...…… 1 1.1. Cancro ... 1 1.2. Desenvolvimento do cancro... 1 1.3. Cancro da mama... 2 1.3.1. Fatores genéticos ...4 1.3.2. Fatores reprodutivos ...4 1.3.3. Fatores hormonais ...5 1.3.4. Dieta ...5 1.3.5. Género e idade ...6
1.4. Glândula mamária do rato fêmea ... 6
1.5. Angiogénese... 7
1.5.1. Fatores pró-angiogénicos...8
1.5.2. Fatores anti-angiogénicos ...8
1.5.3. Células efetoras ...9
1.6. Fator de crescimento endotelial vascular (VEGF) ... 9
1.6.1. O papel do VEGF-A no cancro ...11
1.7. Exercício físico e cancro ... 11
1.7.1. Hipoxia ...12
1.8. Modelos animais ... 13
1.8.1. N-metil-N-nitrosureia como agente carcinogénico ...13
1.9. Ultrassonografia ... 14
1.9.1. Power Doppler e B Flow ...15
1.10. Imunohistoquímica ... 15
2. Objetivos ... 18
xi
3.1. Proveniência das amostras ... 19
3.2. Protocolo experimental ... 19
3.2.1. Indução das neoplasias mamárias...20
3.2.2. Exercício físico e deteção do desenvolvimento de neoplasias ...20
3.2.3. Avaliação ultrassonográfica ...20
3.2.4. Sacrifício dos animais e recolha de amostras ...21
3.3. Avaliação histopatológica ... 21
3.4. Técnica de imunohistoquímica ... 22
3.5. Avaliação da imunoreatividade e contagem de vasos ... 24
3.6. Análise estatística... 24
4. Resultados ... 25
4.1. Avaliação ultrassonográfica ... 25
4.2. Avaliação histopatológica ... 26
4.3. Avaliação da imunoexpressão do VEGF-A e da densidade de vasos (DMV)... 27
5. Discussão………...….……..31
6. Conclusão………...……….…35
xii
Índice de figuras
Figura 1. Representação esquemática das diferentes fases do processo de carcinogénese……… 1
Figura 2. Principais tipos de cancro que afetaram a população do sexo feminino em Portugal no ano de 2014 ………... 3
Figura 3. Representação esquemática da localização anatómica das glândulas mamárias no rato fêmea………. 7
Figura 4. Ligações específicas dos diferentes VEGF aos seus recetores………... 10
Figura 5. Método indireto e método direto em imunohistoquímica……….…. 16
Figura 6. Imagens ultrassonográficas das lesões mamárias identificadas por palpação no grupo MNU exercitado, avaliadas pelo modo Power Doppler (A) e pelo modo B Flow (B). ………..26
Figura 7. Imagens ultrassonográficas das lesões mamárias identificadas por palpação no grupo MNU sedentário, avaliadas pelo modo Power Doppler (A) e pelo modo B Flow (B). ………..26
Figura 8. Carcinoma papilar não invasivo (grupo MNU sedentário). Expressão imunohistoquímica de VEGF-A. ……….………..….…29
Figura 9. Carcinoma papilar não invasivo (grupo MNU exercitado). Expressão imunohistoquímica de VEGF-A………..30
Figura 10. Densidade de microvasos (DMV) nas lesões mamárias induzidas pela MNU,
nos animais dos grupos MNU sedentário e MNU exercitado (p<0,05)
xiii
Índice de tabelas
Tabela 1. Avaliação ultrassonográfica das lesões mamárias identificadas por palpação
nos grupos MNU sedentário e MNU exercitado (média±
E.P.)………...……..25
Tabela 2. Classificação histológica das lesões mamárias identificadas nos grupos MNU
sedentário e MNU exercitado, tendo em conta o padrão histoló gico
predominante……….…..27
Tabela 3. Imunoexpressão de VEGF-A em termos de extensão nas lesões mamárias
induzidas pela MNU nos animais dos grupos MNU sedentário e MNU
exercitado……….28
Tabela 4. Intensidade da imunomarcação do VEGF-A nas lesões mamárias induzidas
pela MNU nos animais dos grupos MNU sedentário e MNU
xiv
Lista de Siglas e Abreviaturas
aFGF/FGF-1 -fator de crescimento fibroblástico ácido Akt/PKB - proteína quinase B
Ang -angiopoietina
APAAP - fosfatase alcalina anti fosfatase alcalina Bcl-2 - célula B de linfoma 2
bFGF/FGF-2 -fator de crescimento fibroblástico básico BH3- domínio pró-apoptótico da família de proteínas Bcl-2 BI-RADS -Relatório de imagem de mama e sistema de dados
BRCA1 - cancro da mama 1 BRCA2 - cancro da mama 2
DAB - diaminobenzidina
DMV - densidade de microvasos DNA - ácido desoxirribonucleico DPC - densidade de pixéis coloridos EGF - fator de crescimento epidérmico
FGF-4/hst/K-FGF -fator 4 de crescimento fibroblástico FGF-3/int-2 -fator 3 de crescimento fibroblástico H&E - hematoxilina e eosina
MAPK - proteína quinase ativada por mitógenios MNU - N-metil-N-nitrosureia
n - número de animais
PAP - peroxidase anti peroxidase PBS - tampão fosfato salino
PI3K - fosfatidilinositol 3'-quinase PKC - proteína quinase C
PLCγ - fosfolipase C
Src - tirosina-quinases coativadoras de receptores esteroidais TGF-α -fator alfa de crescimento transformante
UTAD - Universidade de Trás-os-Montes e Alto Douro VEGF -fator de crescimento endotelial vascular
xv
VEGF-R - recetor de fator de crescimento endotelial vascular WHO - Organização Mundial de Saúde
1
1. Introdução
1.1. Cancro
O cancro é uma das principais causas de morte a nível mundial, tendo sido responsável pela morte de aproximadamente 8,2 milhões de pessoas no ano de 2012. De acordo com a Organização Mundial de Saúde, existe uma tendência para o aumento do número de mortes por cancro em todo o mundo, sendo esperado um aumento de 70% no número de novos casos nas próximas duas décadas (WHO, 2015). Segundo Ferlay et al. (2001), a incidência de cancro varia em todo o mundo, dependendo dos fatores sociodemográficos existentes em cada país, região ou continente, como a classe social, a zona de residência, o estado civil e a etnia. Tendo em conta estes fatores verifica-se que os países menos desenvolvidos têm taxas mais baixas do que os países mais desenvolvidos, sendo a maior incidência na Europa, América do Norte e Oceânia, onde se registam taxas superiores a 80 casos de cancro por cada 100.000 habitantes. Nos países menos desenvolvidos esta taxa é cerca de cinco vezes inferior (Ferlay et al., 2001).
1.2. Desenvolvimento do cancro
De um modo geral, o processo de carcinogénese decorre em três etapas: iniciação, promoção e progressão (Figura 1).
Figura 1. Representação esquemática das diferentes fases do processo de carcinogénese. (Adaptado de:
http://saude.culturamix.com/blog/wp-content/gallery/neoplasmas -tumores-benignos-e-malignos-3/neoplasmas-tumores-benignos-e-malignos-5.jpg)
2 O processo inicia-se com a alteração das características de células consideradas normais (mutação), pela ação da radiação ou de agentes químicos. Segundo dados da
International Agency for Research on Cancer atualmente existem 117 compostos
classificados como agentes carcinogénicos para os humanos, entre os quais se encontram o formaldeído, o benzeno, as acetamidas, as anilinas, o tolueno e o etanol (Beremblum, 1970; IARC, 2015). Estes agentes induzem mutações em genes responsáveis pelo crescimento e divisão das células transformando-os em protoncogenes. Uma vez mutadas, estas células proliferam descontroladamente (promoção), podendo migrar para outros tecidos e formar uma neoplasia/metastizar num órgão distante do qual teve origem (progressão) (Bishop, 1991; Bouck, 1991). A capacidade de metastização é exclusiva das neoplasias malignas, não podendo ocorrer nas neoplasias benignas (IARC, 2015).
O desenvolvimento de neoplasias depende de um conjunto de fatores, entre os quais se destacam: a predisposição genética dos indivíduos (a mutação de determinados genes, por exemplo a mutação dos genes BRCA1 e BRCA2 associada ao desenvolvime nto de cancro da mama), os fatores ambientais (mais evidente nos países desenvolvidos e industrializados onde existe uma maior exposição da população a agentes físicos e químicos que têm a capacidade de provocar danos no DNA potenciando o desenvolvimento de cancro), a dieta (consumo elevado de gorduras e consequente obesidade elevam o risco de desenvolvimento do cancro), o género (cancro do colo do útero na mulher e cancro da próstata no homem), a idade (fatores reprodutivos e níveis hormonais que variam com a idade, podem ser um fator de risco para o desenvolvime nto de cancro da mama) e o estilo de vida (sedentarismo, consumo de álcool que pode afetar os níveis hormonais e consumo de tabaco associado ao desenvolvimento de cancro do pulmão) (Cotran et al., 1989).
1.3. Cancro da mama
A glândula mamária, no seu estado normal, possui um microambiente caracterizado pela interação de diversos tipos de células, entre as quais se encontram as células mioepiteliais, as células epiteliais e a matriz que as rodeia (células endoteliais, leucócitos, fibroblastos e miofibroblastos). As interações entre estes diferentes componentes são responsáveis pelo desenvolvimento celular normal, desde a proliferação à diferenciação (Polyak et al., 2010). Quando este microambiente é alterado, ocorre um desequilíbrio a
3 nível do desenvolvimento celular e dos processos de regulação essenciais ao seu normal funcionamento, aumentando assim o risco de transformação das células mamárias normais em células neoplásicas (Daidone et al., 2004;Lopez-Garcia et al., 2010).
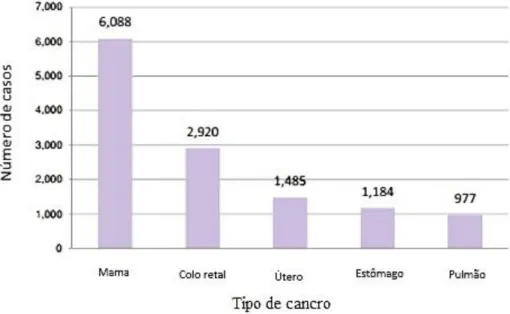
A ocorrência de cancro da mama está associada a determinados fatores de risco, como: genéticos, reprodutivos, hormonais, dieta, género e idade (Daidone et al., 2004; Lopez-Garcia et al., 2010). O cancro da mama é o mais frequentemente diagnosticado nas mulheres em todo o mundo, sendo a principal causa de morte por cancro no sexo feminino. Anualmente, em média, são contabilizados cerca de 1,4 milhões novos casos de cancro da mama em todo o mundo, representado 23% do número total de novos casos de cancro. Em Portugal, no ano de 2014 foram diagnosticados mais de 6000 novos casos de cancro da mama na mulher, o que representa aproximadamente 28% do número total de casos de cancro diagnosticados anualmente no país (Figura 2). Nesse mesmo ano ocorreram 10 600 mortes no sexo feminino, tendo o cancro da mama sido responsável por 16,9% dessas mortes (WHO, 2014).
Figura 2. Principais tipos de cancro que afetaram a população do sexo feminino em Portugal no ano de
4
1.3.1. Fatores genéticos
Existem evidências de que o desenvolvimento do cancro da mama é influenc iado pela ausência ou mutação de genes supressores tumorais e pela presença de oncogenes, que conduzem à desregulação do ciclo celular (Hanahan et al., 2000; Nakles et al., 2011; Van De Vijver, 2000).
Os genes BRCA1 e BRCA2 localizados nos cromossomas 17 e 13,
respectivamente, funcionam como supressores tumorais controlando o ciclo celular. A ocorrência de mutações nestes genes encontra-se associada ao desenvolvimento do cancro da mama (Rahman e Stratton, 1998).
Os oncogenes também desempenham um papel importante no cancro da mama. Estes resultam da alteração de genes que controlam a divisão e a diferenciação celular (proto-oncogenes). A identificação de oncogenes é considerada uma ferramenta útil na deteção precoce do cancro (De Potter, 1994; Slamon et al., 1988).
1.3.2. Fatores reprodutivos
Existem diversos fatores reprodutivos da vida da mulher que estão relacionados com o aumento do risco de desenvolvimento de cancro da mama. Entre estes fatores destacam-se: o aparecimento precoce da menarca, a idade tardia da menopausa, a nuliparidade, a idade tardia do primeiro parto e a utilização de anticoncecionais orais. Todos estes fatores se encontram intimamente associados a uma maior exposição hormonal.
Segundo Colidtz (2005), quanto mais precoce a idade da menarca maior o risco de desenvolvimento de cancro da mama, sendo o risco 30% superior em mulheres cuja menarca surgiu aos 11 anos de idade comparativamente com mulheres cuja menarca surgiu aos 15 anos de idade. O mesmo autor concluiu também que o surgimento da menopausa antes dos 45 anos de idade diminui o risco de desenvolvimento de cancro da mama relativamente a uma mulher cuja menopausa surja após os 55 anos de idade. Segundo o mesmo autor, a nuliparidade e o nascimento doprimeiro filho após os 35 anos de idade encontram-se associados a um risco mais elevado de desenvolvimento de cancro da mama (Colditz, 2005).
5 O uso de anticoncecionais orais aumenta o risco de desenvolvimento de cancro da mama, no entanto este risco diminui progressivamente ao longo de 10 anos após a interrupção do uso destes fármacos (Collaborative Group on Hormonal Factors in Breast Cancer, 1996; Phillips et al., 2009).
1.3.3. Fatores hormonais
A exposição da glândula mamária aos estrogénios e à progesterona está associada a um maior risco de desenvolvimento de cancro da mama. Vários estudos apontam a redução da exposição a estas hormonas como uma forma de reduzir o risco de desenvolvimento deste tipo de cancro (Osborne et al., 2005).
Em mulheres saudáveis, apenas um pequeno número de células normais da glândula mamária expressam recetores de estrogénio e de progesterona. No entanto aproximadamente 2/3 das células neoplásicas da glândula mamária expressam recetores de estrogénios e 1/2 das células expressam ambos os recetores de estrogénios e progesterona (McGuire, 1978).
Atualmente, estes recetores são utilizados na prática clínica como indicadores do prognóstico e da efetividade da terapia hormonal (Mansour et al., 1994;McGuire et al., 1992;Osborne et al., 2005).
1.3.4. Dieta
Diversos estudos demonstraram que a gordura é um fator importante no desenvolvimento de vários tipos de cancro. Assim, está descrito que quanto maior o teor de gordura ingerido na dieta maior o risco de desenvolvimento de cancro da mama (Bishop, 1991). Este tipo de interação deve-se ao facto de a dieta rica em gordura estar associada a um aumento dos níveis séricos de estrogénio, e por sua vez o risco de cancro da mama ser mais elevado em mulheres onde existe uma maior exposição a estas hormonas (Bartsch et al., 1999; Wu et al., 1999).
6
1.3.5. Género e idade
O cancro da mama apresenta uma frequência mais elevada na mulher do que no homem (relação de 70-130 para 1, respetivamente). Estes factos encontram- se intimamente relacionados com o sistema hormonal do sexo feminino, uma vez que a maior exposição aos estrogénios e progesterona aumenta o risco de desenvolvime nto deste tipo de cancro (Osborne et al., 2005).
A idade é um fator importante para o desenvolvimento de cancro da mama. A incidência deste tipo de cancro é mais frequente em mulheres com idade superior a 55 anos (Colditz, 2005).
1.4. Glândula mamária do rato fêmea
A glândula mamária é uma glândula exócrina complexa, essencial para a nutrição das crias dos mamíferos nos primeiros momentos de vida após o nascime nto (McManaman et al., 2003). O desenvolvimento e a manutenção destas glândulas depende essencialmente de hormonas como a prolactina, a hormona de crescimento, os estrogénios, a progesterona, a insulina, o cortisol, as hormonas tiroideas, e a hormona lactogénica placentar. Estas hormonas atuam na formação e desenvolvimento do estroma, dos sistemas de ductos, na deposição de gordura e na lactação (Martín-Calama, 2004). O crescimento do sistema canalicular, o desenvolvimento do estroma e a deposição de gordura estão a cargo dos estrogénios. A diferenciação das estruturas alveolares ocorre devido à progesterona, e a prolactina e o proteína lactogénica placentar são responsáveis pela produção e pela secreção de leite (Cardoso, 2006).
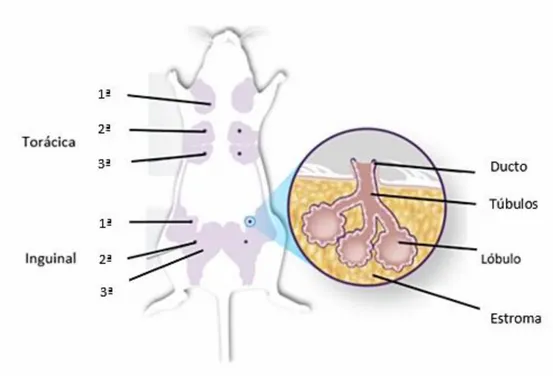
O rato fêmea possui duas cadeias de glândulas mamárias, uma esquerda e uma direita, que se encontram separadas pela linha média ventral. Cada uma destas cadeias é constituída por seis glândulas mamárias, três torácicas e três inguinais, que se localiza m na camada adiposa subcutânea (Lawrence e Lawrence, 2005).
A glândula mamária do rato fêmea tem uma estrutura tubuloalveolar, sendo constituída por um conjunto de alvéolos que formam os lóbulos e por um conjunto de túbulos e ductos que conduzem o leite até ao exterior (Figura 3).
Histologicamente, a glândula mamária é constituída por parênquima (epitélio secretor e células mioepiteliais) e estroma (tecido conjuntivo, tecido adiposo, vasos
7 sanguíneos e nervos). A irrigação das glândulas mamárias é feita por ramos de diversas artérias, nomeadamente: cervical superficial, torácicas interna e externa, subescapular, intercostais, iliolombar, epigástrica superficia l, epigástrica cranial e axilar (Lawrence e Lawrence, 2005).
Figura 3. Representação esquemática da localização anatómica das glândula s mamárias no rato fêmea
(Adaptado de:
http://aegiscreative.com/blog/creating-laboratory-models-help-us-understand-breast-cancer/)
1.5. Angiogénese
A angiogénese é definida como um processo de neovascularização, ou seja, no crescimento e formação de novos vasos sanguíneos a partir de uma rede vascular pré- existente. Este processo desempenha um papel fundamental não só no desenvolvime nto dos tecidos endoteliais e no processo de cicatrização, mas também no desenvolvime nto das neoplasias (Devita et al., 2001).
O processo de angiogénese que ocorre nas neoplasias é designada de angiogé nese neoplásica. Esta desempenha um papel fundamental pelo aporte de nutrientes e oxigénio e por constituir um meio para o processo de metastização, uma vez que o sangue pode ser utilizado como veículo de disseminação das células neoplásicas para outros órgãos (Cotran et al., 1989). Estudos previamente realizados concluíram que quanto maior a
8 densidade de vasos presentes numa neoplasia, maior será a capacidade de metastização dessa neoplasia, maior será a atividade proliferativa e menor a diferenciação histoló gica (Folkman, 1994).
O processo de angiogénese depende de um equilíbrio entre fatores pró-angiogénicos e anti-pró-angiogénicos que são produzidos pelas células neoplásicas e pelas células do hospedeiro, nomeadamente células endoteliais, pericitos e células do sistema imunitário (Cotran et al., 1999;Devita et al., 2001; Rosen, 2005).
1.5.1. Fatores pró-angiogénicos
Os fatores pró-angiogénicos atuam como estimulantes do processo de angiogénese. Estes podem ser encontrados em elevadas concentrações em tecidos tumorais, dependendo de determinados fatores, tais como: os fatores de crescimento, o baixo pH, a hipoxia, a perda da função dos genes supressores, a transdução de sinal e, no caso dos processos de carcinogénese, da dimensão das neoplasias (Cotran et al., 1989; Devita et al., 2001).
Entre os fatores pro-angiogénicos encontramos: o Fator de crescimento placentário, Fator de crescimento epidérmico (EGF), fator de crescimento fibroblás t ico alcalino (bFGF/FGF-2), o fator de crescimento fibroblástico ácido (aFGF/FGF-1), a Interleucina-8, a Angiogenina, a Proliferina, a Pleiotropina, o Fator alfa de necrose tumoral, o Fator alfa de crescimento transformante (TGF-α), a Angiopoietina-1, 2 (Ang), o Fator 4 de crescimento fibroblástico (FGF-4/hst/K-FGF) e o Fator 3 de crescimento fibroblástico (FGF-3/int-2), dos quais se destaca o Fator de crescimento endotelia l vascular (VEGF) (Graça et al., 2004; Hicklin et al., 2005).
1.5.2. Fatores anti-angiogénicos
Os fatores anti-angiogénicos são um conjunto de enzimas que atuam de forma a reduzir os fenómenos de angiogénese. Estes têm sido utilizados como agentes terapêuticos no combate ao desenvolvimento das neoplasias e da sua metastização. Neste grupo de inibidores da angiogénese encontram-se: a endostatina, a angiostatina, a vasostatina, o inibidor do VEGF, a interleucina-10, a angiopoietina-2, e o interferão α e
9 β. A angiostatina e a endostatina têm sido frequentemente utilizados em ensaios clínicos no combate ao desenvolvimento de neoplasias (Graça et al., 2004;Soff, 2000).
1.5.3. Células efetoras
O desenvolvimento de neoplasias e metástases ocorre não só devido à existênc ia de um desequilíbrio entre fatores pró-angiogénicos e anti-angiogénicos, mas também devido a existência de células que influenciam o desenvolvimento angiogénico como: células precursoras de células endoteliais, células neoplásicas (atraem fibroblastos e macrófagos que expressam fatores angiogénicos) e células inflamatórias que libertam fatores angiogénicos (Devita et al., 2001; Folkman, 1994).
1.6. Fator de crescimento endotelial vascular (VEGF)
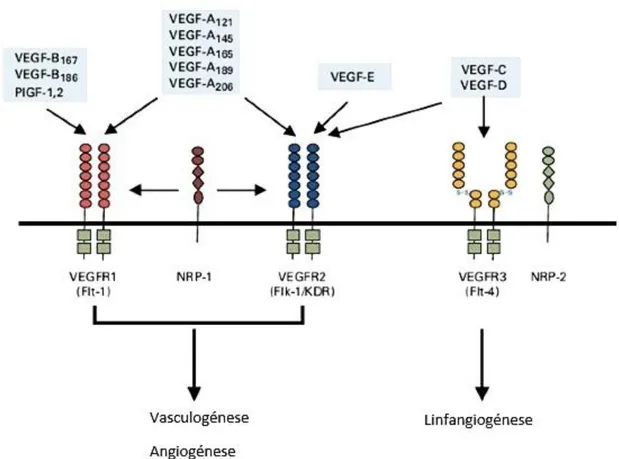
O VEGF é uma família de glicoproteínas diméricas constituída por vários membros (VEGF-A, -B, -C, -D, -E e -F). Todos estes elementos possuem uma estrutura constituída por oito resíduos de cisteína.
O VEGF-A é um dos principais fatores angiogénicos existindo diversas isoformas tais como: VEGF121, VEGF145, VEGF165,VEGF189 e VEGF206. Este desempenha uma função mitogénica, sendo responsável por diversos processos, nomeadamente: pela regulação do crescimento vascular, pelo aumento da permeabilidade vascular, pela diferenciação de células endoteliais e pela migração celular, tanto a nível fisiológico como a nível patológico. Fisiologicamente, o VEGF-A é responsável pelo crescimento longitudinal dos ossos, pela formação endocondral, pela cicatrização, pelo desenvolvimento de vasos sanguíneos durante o ciclo menstrual e pela promoção da ação quimiotática dos monócitos (Banks et al., 1998; Ferrara, 2002;Hicklin et al., 2005).
O VEGF-B inibe a apoptose das células ao impedir a expressão da proteína BH3 em células vasculares, neuronais e nos miócitos cardíacos (Xuri Li et al., 2009). O VEGF-C e o VEGF-D possuem funções de regulação da linfangiogénese (Roy et al., 2006).
O VEGF-E estimula o crescimento endotelial e atua na permeabilidade vascular (Ogawa et al., 1998; Ortega et al., 1999).
10 O VEGF-F é sintetizado por diferentes espécies de víboras, sendo conhecido como o VEGF do veneno da cobra; este atua principalmente como indutor da permeabilidade vascular (Olsson et al., 2006).
O VEGF atua através de ligações específicas a recetores tirosina quinase. Entre estes recetores encontram-se o VEGF-R1, o VEGF-R2 e o VEGF-R3 (Figura 4). O VEGF-R1 e o VEGF-R2 são expressos principalmente nas células endoteliais dos vasos sanguíneos, sendo o VEGF-R2 o principal recetor destas células. O VEGFR-R3 é o principal recetor das células endoteliais dos vasos linfáticos (Roy et al., 2006).
A ligação do VEGF aos seus recetores faz com que seja induzida a dimerização dos mesmos, resultando numa autofosforilação dos resíduos de tirosina dentro do domínio citoplasmático. Esta autofosforilação conduz à transdução de sinais de diversos tipos de moléculas, tais como: fosfolipase C (PLCγ), fosfatidilinositol 3'-quinase (PI3K), proteína quinase B (Akt/PKB), Ras, tirosina-quinases coativadoras de receptores esteroidais (Src) e da proteína quinase ativada por mitógenios (MAPK). A ativação da PLCγ faz com que ocorra a libertação de cálcio (Ca2+) e seja ativada a proteína quinase C
(PKC), sendo este um ponto importante na sinalização da permeabilidade vascular (Kerbel, 2008;Pourgholami et al., 2008).
11
1.6.1. O papel do VEGF-A no cancro
Estudos previamente realizados em humanos, verificaram que a expressão de VEGF-A favorece a progressão neoplásica, induz a angiogénese e aumenta o risco de metastização, sendo um indicador de pior prognóstico nas neoplasias do pulmão, esófago, colon e mama (Hu et al., 2009; Qiu et al., 2008).
O Bcl-2 é um oncogene que influencia a atividade mitocondrial e a permeabilidade membranar em ações anti-apoptóticas, este pode ser encontrando em vários tecidos, tais como: mama, pulmão, ovário e melanoma (Ferrara, 2004). O VEGF-A, através da indução da expressão deste gene, tem também a capacidade de inibir a apoptose, favorecendo a progressão neoplásica (Folkman, 2003).
1.7. Exercício físico e cancro
O exercício físico é definido como o movimento corporal produzido pelo músculo esquelético que resulta num gasto de energia por parte do indivíduo (Thompson et al., 2003). Uma vez que o exercício físico melhora as funções de vários sistemas do organismo, os investigadores têm estudados os seus efeitos em diversas doenças, nomeadamente: diabetes, Alzheimer, obesidade, doença cardiovascular aterosclerótica e cancro (colon, pulmão, endométrio, próstata, mama). O exercício físico tem sido apontado como um dos fatores importantes para a redução do risco de desenvolvime nto de cancro (American Diabetes Association, 2004;Friedenreich e Orenstein, 2002;Garrow
et al., 1986; Radak et al., 2010).
Diversos estudos têm apontado o exercício físico como um fator importante na diminuição da formação de radicais livres e na melhoria da resposta imunitária (aumenta a atividade dos macrófagos, dos linfócitos e das células natural killer) (Woods et al., 1994a; Woods et al., 1994b).
Daneryd et al. (1995) verificaram que a atividade física espontânea favorece a produção de proteínas e a diminuição das concentrações plasmáticas de hormonas, como a insulina e o cortisol, contribuindo para a manutenção da massa muscular e consequente redução da caquexia induzida pelo cancro que é uma das principais causas de morte de pacientes com cancro.
12 Segundo Shepard (1990), o dispêndio de energia durante a prática de exercício físico pode ser benéfico para a redução do desenvolvimento das neoplasias, pois a energia disponível será menor e as células neoplásicas terão de competir com as células do organismo pela energia disponível.
Zielinski et al. (2004), através de um estudo feito em ratos, verificaram que o exercício físico intenso e prolongado é benéfico no combate ao desenvolvimento das neoplasias (estudo realizado em tumores linfoides alogénicos), pois observou uma diminuição da vascularização das neoplasias no grupo exercitado comparativamente com o grupo sedentário.
1.7.1. Hipoxia
A hipoxia consiste numa diminuição do aporte de oxigénio nos tecidos orgânicos. Esta condição ocorre devido à deficiência do transporte de oxigénio pelo sangue em situações como: a anemia, perdas de sangue e envenenamento por monóxido de carbono. Outra condição que pode levar à ocorrência de hipoxia é a prática exagerada de exercício físico, onde a quantidade de oxigénio transportado pelo sangue é inferior à requerida pelas células (Dewhirst et al., 2008; Vaupel e Harrison, 2004).
A hipoxia é vista como uma característica ou condição existente nas neoplasias sólidas, que se mantém durante todo o processo de carcinogénese. De acordo com alguns autores, a diminuição da concentração de oxigénio nos tecidos neoplásicos, contribui para o desenvolvimento das neoplasias (Kunz e Ibrahim, 2003; Lee et al., 2007; Quintero et
al., 2004). Este fenómeno deve-se ao poder de adaptação das células neoplásicas à
carência de oxigénio e nutrientes, através de alterações que ocorrem a nível proteico. A hipoxia induz o aumento da glicólise, a vascularização, o aumento da produção de fatores de crescimento, a inibição dos processos apoptóticos, alterações a nível de DNA, influenciando a alteração dos mecanismos de reparação, assim como o aumento de produção de espécies reativas de oxigénio (Axelson et al., 2005; Vander Heiden et al., 2009).
13
1.8. Modelos animais
Os modelos animais têm sido fundamentais para o estudo de diversas doenças, nomeadamente do cancro. Devido à complexidade da biologia e fisiologia humana não existe um modelo animal perfeito. No entanto, existem diversos modelos anima is, nomeadamente: modelos espontâneos, modelos geneticamente modificados, implantação de linhas celulares animais (modelo singeneico) ou humanas (modelo xenógrafo), ou modelos quimicamente induzidos. Aquando da realização de determinado protocolo experimental, o investigador deve basear-se na sua experiência prévia ou em estudos realizados por outros investigadores para selecionar o modelo mais adequado, tendo sempre em consideração aspetos como: idade dos animais, género, estado reprodutivo, características genéticas e número de animais necessários para a realização do ensaio.
1.8.1. N-metil-N-nitrosureia como agente carcinogénico
O modelo de cancro da mama quimicamente induzido pelo agente carcinogénico
N-metil-N-nitrosureia (MNU) no rato fêmea Sprague-Dawley é um modelo internacionalmente reconhecido para o estudo deste tipo de cancro.
A MNU é um agente carcinogénico de ação direta, ou seja, atua diretamente no material genético sem requerer ativação metabólica e tem um tempo de semivida muito curto. Esta pode ser administrada por diferentes vias: intravenosa, intraperitonea l, subcutânea e intragástrica, e aplicada topicamente (Thompson et al., 1991). Destas vias de administração, a via intraperitoneal é a mais rápida e mais simples de executar, com um elevado grau de fiabilidade.
A dose e via de administração da MNU irão condicionar o órgão onde será desenvolvida a neoplasia, a taxa de incidência, a multiplicidade das neoplasias e o período de latência (Thompson et al., 1991). Quando administrada numa concentração de 50 mg/kg, por via intraperitoneal, aos 50 dias de vida dos animais, apresenta uma elevada especificidade para a glândula mamária e uma taxa de indução de aproximadame nte 100%.
As neoplasias mamárias induzidas por este agente carcinogénico no rato fêmea são hormonodependentes, são histologicamente semelhantes às lesões encontradas em humanos (desenvolvimento de neoplasias de origem ductal e elevada incidência de
14 carcinomas e adenocarcinomas), e têm uma elevada capacidade de invasão e de desenvolvimento de metástases (Thompson, 2011).
1.9. Ultrassonografia
A primeira descrição da utilização da ultrassonografia para avaliação da mama da mulher foi realizada por Wild e Neil (1951). Desde então, assistiu-se a uma evolução nos aparelhos de ultrassonografia disponíveis e nas técnicas utilizadas, sendo atualmente um meio auxiliar de diagnóstico amplamente utilizado na prática clínica.
A ultrassonografia é uma técnica indolor, pode ser utilizada em indivíduos de todas as idades, não utiliza radiações ionizantes, permite a obtenção de imagens com elevada qualidade em tempo real e os aparelhos são mais baratos quando comparados com outros meios de diagnóstico. Como todos os meios de diagnóstico disponíveis, a ultrassonografia apresenta algumas desvantagens, entre as quais se destacam: a dependência do operador, a heterogeneidade do parênquima mamário, o elevado número de falsos positivos, e a dificuldade na deteção de microcalcificações, de nódulos com diâmetro inferior a 5 mm e de massas localizadas profundamente (Berg et al., 2006;Park
et al., 2007). Relativamente à avaliação da mama, a ultrassonografia é bastante útil em
casos de mamas com elevada densidade (apresentam mais de 25% de tecido fibroglandular) e na monitorização de mulheres com elevado risco de desenvolvime nto de cancro da mama (Calas et al., 2011;Hlawatsch et al., 2002).
Segundo o protocolo de classificação e padronização BI-RADS, quando realizada a avaliação mamária por este método, devem ser avaliados essencialmente três aspetos: nódulos, calcificações e vascularização (Cala et al., 2011). Quando na presença de nódulos devem ser avaliados os seguintes parâmetros: forma, limites, localização, tecido circunjacente, ecogenicidade e efeito acústico posterior.
Relativamente às calcificações é possível detetar: macrocalcificações, ou microcalcificações (intra e extra tumorais).
A vascularização é detetada através do aumento do fluxo sanguíneo criado pela neovascularização nas regiões neoplásicas e nas regiões peri-neoplásicas (American College of Radiology, 2003).
15
1.9.1. Power Doppler e B Flow
O modo Power Doppler é uma técnica ultrassonográfica que tem como objetivo detetar a vascularização dos tecidos. Este modo de ultrassonografia usa o sinal acústico modificado emitido pelo movimento do sangue no interior dos vasos para construir as imagens ultrassonográficas, permitindo uma visualização direta dos vasos sanguíneos com diâmetro inferior a 200 μm (Barnard et al., 2008; Kettenbach et al., 2005; Sehgal et
al., 2006). É frequentemente usado na deteção de pequenos vasos sanguíneos, devido à
sua elevada sensibilidade. O Power Doppler permite detetar a presença de lesões intraductais e de carcinomas altamente vascularizados e é uma ferramenta útil na diferenciação de lesões benignas e malignas (Martinoli et al., 1998; Rago et al., 1998). Este modo pode ser utilizado isoladamente ou com auxíilio de agentes de contraste.
O modo B Flow é uma técnica ultrassonográfica com propriedades não Doppler, que permite obter imagens em tempo real, em escala cinza, de fluxos sanguíneos, assim como da parede dos vasos, do lúmen vascular e avaliar lesões presentes nas artérias (Handa et al., 1990; Kagawa et al., 1996). A imagem obtida com o modo B Flow é formada a partir da mobilidade dos ecos intravasculares que simulam um angiograma de contraste convencional, semelhante ao que é obtido durante a infusão de um agente de contraste sonográfico intravenoso (Wachsberg, 2007). Apesar destas características não permite avaliar a direção de fluxo nem a sua velocidade.
1.10. Imunohistoquímica
A imunohistoquímica é uma técnica que permite identificar proteínas, lípidos, hidratos de carbono e ácidos nucleicos em tecidos biológicos, através de reações de alta sensibilidade entre anticorpos e antigénios. O processo de identificação de proteínas é feito através de colorações específicas, permitindo diferenciar células normais de células anormais, tais como células neoplásicas (Kiernan, 2004).
Esta técnica, aliada ao diagnóstico histopatológico, permite observar a presença, a localização e a distribuição de determinadas substâncias ou moléculas a nível do núcleo , citoplasma e membrana celular (Ferro, 2008).
Na imunohistoquímica podem ser utilizados métodos diretos e métodos indiretos (Figura 5).
16
Figura 5. Método indireto e método direto em imunohistoquímica. (Adaptado de: http://slideplayer.com.br/slide/375925/).
Os métodos diretos baseiam-se na utilização de um anticorpo primário conjugado com um marcador que se liga ao antigénio. Este método tem como vantagens o facto de ser um método simples e rápido, no entanto possui uma ampliação de sinal reduzida, existindo apenas um marcador por cada antigénio, e é um método mais económico devido ao uso de anticorpos primários conjugados. Os métodos indiretos realizam-se em duas fases, utilizando-se numa primeira fase um anticorpo primário não conjugado que se liga ao antigénio, e posteriormente, um anticorpo secundário conjugado que se liga ao anticorpo primário (Ferro, 2008).
Este método é mais sensível que o método direto, pois possui um maior número de marcadores para cada antigénio e é mais versátil, pois não necessita que os anticorpos primários estejam marcados, apenas os secundários. Apesar das vantagens, este é um método mais complexo que o método direto e mais demorado.
No grupo dos métodos indiretos existem o método peroxidase anti-peroxidase (PAP), o método fosfatase alcalina anti fosfatase alcalina (APAAP), o método avidina -biotina e os métodos do polímero (esqueleto interno e micropolímeros de enzimas).
O método PAP utiliza 3 reagentes: anticorpo primário, anticorpo secundário e o complexo peroxidase anti peroxidase.
O método APAAP é muito semelhante ao método PAP, alterando apenas o tipo de marcador utilizado (fosfatase alcalina).
17 O método avidina-biotina é um método muito utilizado em imunohistoquímica de fluorescência (imunofluorescência). Tem como vantagens, uma grande afinidade entre a avidina e a biotina, o que faz com que forme um complexo muito forte, a biotina pode ligar a outras moléculas (enzimas e anticorpos) e a avidina pode servir de marcador.
O método polímero permite conjugar uma grande quantidade de anticorpos e marcadores, obtendo-se uma marcação mais intensa devido à maior quantidade de enzimas presentes. Este é também uma técnica mais económica, pois permite reduzir a quantidade de anticorpo utilizado (Ferro, 2008).
Estas técnicas, devido às suas características são essenciais para o diagnóstico e caraterização de neoplasias.
18
2. Objetivos
Este trabalho teve como objetivos:
1- Avaliar a vascularização das neoplasias mamárias em animais exercitados e sedentários através de técnicas de ultrassonografia e imunohistoquímica;
2- Analisar a expressão do marcador VEGF nas neoplasias, utilizando parâmetros de densidade ótica e de índice de marcação.
19
3. Material e Métodos
3.1. Proveniência das amostrasNeste trabalho foram utilizadas 51 neoplasias mamárias provenientes de um projeto financiado pela Fundação para a Ciência e Tecnologia intitulado “Avaliação bioquímica, morfológica e funcional do catabolismo muscular associado ao cancro da mama: o papel do exercício físico” (PTDC/DES/114122/2009). O protocolo experimenta l foi realizado pelo grupo de investigação da Professora Paula A. Oliveira e encontra- se descrito na dissertação de mestrado de Ana Isabel Rocha Faustino (Faustino-Rocha, 2012).
3.2. Protocolo experimental
No protocolo experimental foram utilizados 50 ratos fêmea (Rattus norvegicus) da estirpe Sprague-Dawley, com 4 a 5 semanas de idade. Os animais foram adquiridas à empresa Harlan Interfauna Inc. (Barcelona, Espanha). Durante o ensaio, os animais foram mantidos nas instalações do biotério da Universidade de Trás-os-Montes e Alto Douro, sob condições controladas de temperatura (23±2°C), humidade relativa (50±10%), filtração do ar (10-20 ventilações/hora) e ciclo de luz/escuridão (12 h:12 h). Os anima is foram alojados em gaiolas de policarbonato, tendo sido utilizado carolo de milho para a cama. Os animais foram alimentados com dieta comercial 4RF21 (Mucedola, Itália) e água da torneira ad libitum. As gaiolas e a água foram mudadas semanalmente. Todos os procedimentos foram realizados de acordo com a Legislação em vigor em Portugal e na Europa para a utilização de animais para fins experimentais (Diretiva Europeia 2010/63/EU e DecretoLei 113/2013). Os procedimentos foram aprovados pela Direcção -Geral de Alimentação e Veterinária (Aprovação n. 008961).
20
3.2.1. Indução das neoplasias mamárias
Após a chegada às instalações do biotério, os animais foram submetidos a um período de quarentena com a duração de duas semanas. Após esse período, os anima is foram divididos aleatoriamente em quatro 4 grupos experimentais: MNU sedentário (n=15), MNU exercitado (n=15), controlo sedentário (n=10) e controlo exercitado (n=10). Às sete semanas de idade, os animais dos grupos MNU sedentário e exercitado receberam uma administração intraperitoneal do agente carcinogénico MNU (Isopac, lote 100M1436V, Sigma Chemical Co., Madrid, Espanha), por via intraperitoneal, numa dose de 50 mg/kg. A MNU foi usada dentro de uma hora após a sua preparação. Os anima is de ambos os grupos controlo receberam uma administração do veículo utilizado (solução salina a 0,9%). O início do ensaio foi definido no dia da administração da MNU e o final 35 semanas após a administração do agente carcinogénico.
3.2.2. Exercício físico e deteção do desenvolvimento de neoplasias
Após as administrações, os animais dos grupos exercitados (MNU e controlo) foram adaptados à passadeira de corrida (Treadmill Control® LE 8710, Panlab, Harvard
Apparatus, EUA) durante um período de 5 dias, a uma velocidade de 20 m/min, aumentando progressivamente o período de exercício de 20 para 60 min/dia. Após este período de adaptação, os animais foram exercitados a uma velocidade constante de 20 m/min, 60 min/dia, 5 dias/semana, durante 34 semanas. Os animais foram observados diariamente para monitorizar o seu estado de saúde. Semanalmente, os animais foram palpados para a deteção do desenvolvimento de neoplasias mamárias.
3.2.3. Avaliação ultrassonográfica
No final do protocolo experimental, imediatamente antes do sacrifício dos animais, a vascularização das neoplasias mamárias dos animais sobreviventes foi avaliada por ultrassonografia. Os animais foram sedados com ketamina (75 mg/kg; Imalgene 1000, lot LBF133BB, Merial S.A.S., Lyon, France) e xilazina (10 mg/kg; Rompun 2%, lot KPO78X0, Bayer Healthcare S.A., Kiel, Germany) administradas por via intraperitonea l.
21 A área das neoplasias foi depilada com uma máquina tosquiadora (AESCULAP® GT420
Isis, Aesculap Inc, Center Valley, PA, EUA). Para esta avaliação foi utilizado o aparelho de ultrassonografia Logic P6® (General Electric Healthcare, Milwaukee, WI, EUA) e uma
sonda linear de 10 MHz. Os animais foram colocados em decúbito dorsal e foi aplicado gel ultrassonográfico (Aquasonic®, Parker Laboratories Inc, Fairfield, New Jersey, EUA).
As imagens ultrassonográficas foram obtidas num plano longitudinal com os modos
Power Doppler e B Flow, foram realizados varrimentos aplicando uma pressão lige ira
para evitar a distorção das massas. As imagens foram guardadas e posteriormente foi utilizado o programa Adobe Photoshop versão 7.0 para quantificar a densidade de pixéis coloridos (DPC) de cada massa, aplicando a seguinte fórmula (Denis et al., 2002):
DPC (%) = (nº de pixéis coloridos da massa / nº de pixéis totais da massa) × 100
3.2.4. Sacrifício dos animais e recolha de amostras
Aproveitando a sedação anteriormente descrita para a realização do exame ultrassonográfico, os animais foram humanamente sacrificados por exsanguinação por punção cardíaca, como indicado pela Federation for Laboratory Animal Science
Associations (Forbes, 2007).
Foi realizada uma necrópsia completa dos animais. Após uma avaliação do exterior, procedeu-se ao escalpe dos animais pela linha média dorsal, de modo a que a pele fosse removida intacta e aquando da observação sob uma luz translucente permit isse a identificação de pequenas neoplasias mamárias não identificadas previamente por palpação. As neoplasias mamárias identificadas foram recolhidas e fixadas em formol tamponado a 10% durante 12 horas.
3.3. Avaliação histopatológica
Após a fixação, as neoplasias mamárias foram cortadas, processadas num processador automático e incluídas em parafina. Posteriormente realizaram-se vários cortes de 2 µm de espessura num micrótomo automático (Leica®RM 2255) que foram
22 A avaliação e a classificação histopatológica das neoplasias foi realizada por um patologista tendo em conta a classificação proposta por Russo e Russo (2000) para a avaliação de neoplasias da mama quimicamente induzidas no rato fêmea. Cada neoplasia foi classificada de acordo com o padrão histológico predominante.
3.4. Técnica de imunohistoquímica
Foram realizados cortes com a espessura de 2 µm das áreas adjacentes aos cortes utilizados para a classificação histopatológica. Para a deteção do VEGF-A foi utilizado o clone JH121 (Merck Millipore, Darmstadt, Alemanha) numa diluição de 1:100 (1 µL de anticorpo em 99 µL de tampão fosfato salino (PBS)), que em estudos previame nte realizados por outros autores apresentou reatividade com os tecidos de rato (Shankar et
al., 2005). Foi utilizada a metodologia descrita no kit Novolink™ Max Polymer Detection
System (Leica Biosystems, Newcastle, RU).
O protocolo utilizado para a deteção da imunoexpressão do VEGF-A foi o seguinte:
1. Os cortes em silane, foram desparafinados em xilol durante 15 minutos;
2. Procedeu-se à hidratação dos cortes com uma série de álcoois de concentração decrescente (100%, 90%, 80%, 70%), com tempo de 5 minutos para cada álcool;
3. Foi feita uma lavagem dos cortes com água destilada durante 5 minutos;
4. Procedeu-se à recuperação antigénica: os cortes foram colocados numa solução de tampão citrato (pH=6,2±0,2) durante 20 minutos no micro-ondas a 750 W (foram realizados 4 ciclos com a duração de 5 minutos cada um, entre cada ciclo foi adicionada tampão citrato);
5. Os cortes ficaram a arrefecer à temperatura ambiente durante 30 minutos; 6. Foi feita uma lavagem dos cortes com água destilada durante 5 minutos;
7. Os cortes foram delimitados com uma caneta hidrofóbica e as lâminas foram colocadas numa câmara húmida;
8. Procedeu-se à inibição das peroxidases endógenas: foram colocados 100 µL de
Peroxidase Block (peróxido de hidrogénio a 3%) em cada corte durante 30 minutos;
9. Os cortes foram lavados com PBS (pH=7,4±0,2) durante 5 minutos para remover o excesso de peróxido de hidrogénio a 3%;
23 10. Os cortes foram incubados à temperatura ambiente durante 5 minutos com Protein
Block (caseína a 4%) (100 µL por corte);
11. De seguida procedeu-se à incubação do anticorpo primário VEGF-A (JH121): as lâminas foram mantidas na câmara húmida no frigorífico a 4ºC durante a noite;
12. No dia seguinte retomou-se o protocolo: a câmara húmida foi retirada do frigoríf ico e foi deixada à temperatura ambiente durante 30 minutos;
13. Os cortes foram lavados com PBS durante 5 minutos;
14. Os cortes foram incubados com Post primary (IgG de coelho anti-ratinho) (anticorpo secundário) (100 µL por corte), à temperatura ambiente, durante 10 minutos;
15. Os cortes foram lavados com PBS durante 5 minutos;
16. Os cortes foram incubados com Novolink Polymer (Poly-HRP-IgG anti-coelho) (100 µL por corte), à temperatura ambiente, durante 10 minutos;
17. Os cortes foram lavados com PBS durante 5 minutos;
18. Procedeu-se à revelação da marcação: os cortes foram incubados com a solução cromogénio diaminobenzidina (DAB), tampão de substrato de diaminobenzidina durante 4 minutos, à temperatura ambiente;
19. Os cortes foram colocadas numa tina com água destilada;
20. Realizou-se a coloração de contraste: os cortes foram imersos numa tina com solução de hematoxilina de Gill, durante 1 minuto;
21. Os cortes foram lavados com água corrente até não haver vestígios de hematoxilina; 22. Os cortes foram passados por água destilada;
23. Procedeu-se à desidratação dos cortes com uma séria de álcoois de concentração crescente (95% I, 95% II, 100% I, 100% II), com tempo de 2 minutos para cada álcool; 24. Os cortes foram diafinizados com xilol durante 5 minutos;
25. Procedeu-se à montagem das lâminas utilizando resina Entellan (Merck®, Alemanha );
Em cada procedimento utilizaram-se controlos positivos e negativos. Como controlo positivo foi utilizado o rim normal de rato e como controlo negativo utilizou- se uma neoplasia mamária de rato em que a incubação do anticorpo primário foi omitida, sendo substituída por PBS.
24
3.5. Avaliação da imunorreatividade e contagem de vasos
A imunoexpressão do VEGF-A nas células neoplásicas foi avaliada de forma semiquantitativa, em termos de extensão (percentagem de células positivas/coradas) e intensidade. Tendo em conta trabalhos previamente realizados com este marcador (Saminathan et al., 2014;Shivakumar et al., 2009), a extensão foi avaliada aplicando o seguinte score: grau 0 (negativa, sem marcação), grau 1 (1-24% das células neoplásicas são positivas), grau 2 (25-49% das células neoplásicas são positivas), grau 3 (50-75% das células neoplásicas são positivas) e grau 4 (> 75% das células neoplásicas são positivas). A intensidade de marcação das células neoplásicas foi avaliada como: 0 (sem marcação), 1 (marcação fraca), 2 (marcação moderada) e 3 (marcação intensa).
Adicionalmente, foi realizada a contagem dos microvasos nas 3 regiões mais vascularizadas de cada neoplasia, conhecidas como hot spots, numa ampliação de 200× (correspondente a uma área de aproximadamente 0,76 mm2). Posteriormente foi obtida
uma média, determinando assim a densidade de vasos de cada neoplasia (DMV). As áreas com fibrose, necrose e inflamação, e vasos com paredes musculares não foram contabilizadas. A avaliação da imunoexpressão do VEGF-A e a contagem de vasos foi realizada independentemente por dois investigadores.
3.6. Análise estatística
Os dados foram estatisticamente analisados com o programa SPSS® versão 17
(Chicago, IL, EUA) utilizando o teste T de Student independente e a análise de variância (ANOVA) seguida do teste de Bonferroni para comparações múltiplas. Os resultados histológicos e imunohistoquímicos foram analisados utilizando o teste χ2. Os dados foram
expressos como média±erro padrão (E.P.). Os resultados com valores de p<0,05 foram considerados estatisticamente significativos.
25
4. Resultados
Durante o protocolo experimental um animal do grupo MNU exercitado não se adaptou ao exercício físico e foi excluído do ensaio. Adicionalmente morreram nove animais: quatro animais do grupo MNU sedentário, quatro animais do grupo MNU exercitado e um animal do grupo controlo sedentário. Os dados destes animais não foram incluídos no estudo.
4.1. Avaliação ultrassonográfica
As lesões nodulares palpadas durante o protocolo experimental foram avaliadas pelos modos Power Doppler e B Flow: foram avaliadas 17 lesões nodulares no grupo MNU sedentário, 18 lesões nodulares no grupo MNU exercitado e nos grupos controlo não se desenvolveu qualquer lesão.
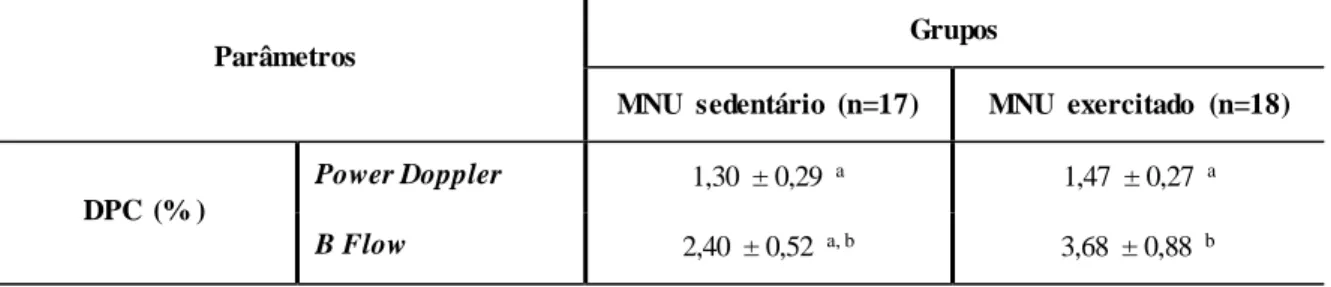
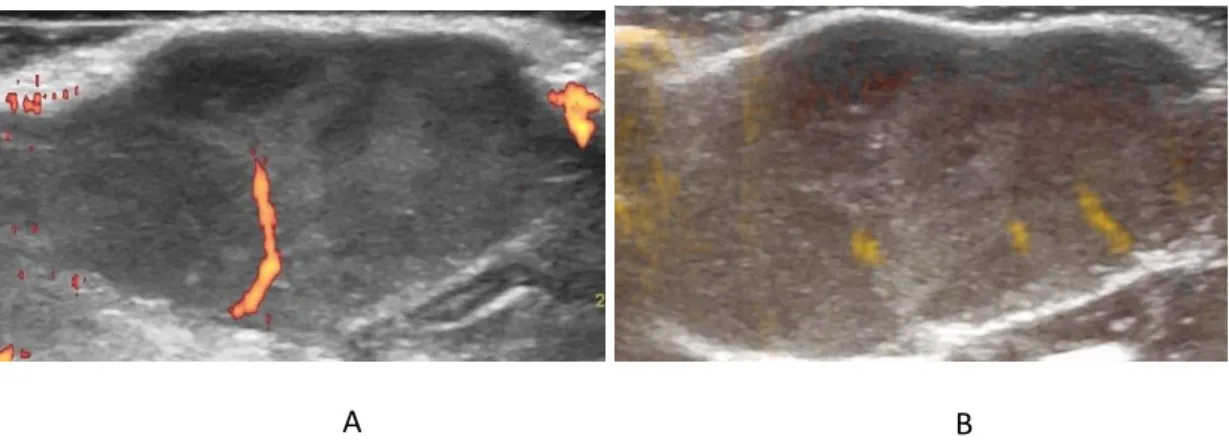
A DPC detetada pelos modos Power Doppler e B Flow não foi estatisticame nte diferente entre grupos (p>0,05). No entanto, a DPC detetada por ambos os modos de ultrassonografia foi numericamente superior no grupo MNU exercitado (Figura 6) comparativamente ao grupo MNU sedentário (p>0,05) (Figura 7) (Tabela 1).
A DPC detetada pelo modo B Flow foi numericamente superior à DPC detetada pelo modo Power Doppler em ambos os grupos, esta diferença apenas foi estatisticame nte significativa no grupo MNU exercitado (p>0,05) (Tabela 1).
Tabela 1. Avaliação ultrassonográfica das lesões mamárias identificadas por palpação nos grupos MNU
sedentário e MNU exercitado (média ± E.P.).
Parâmetros
Grupos
MNU sedentário (n=17) MNU exercitado (n=18)
DPC (% )
Power Doppler 1,30 ± 0,29 a 1,47 ± 0,27 a
B Flow 2,40 ± 0,52 a, b 3,68 ± 0,88 b Valores com letras diferentes foram considerados estatisticamente diferentes (p<0,05).
26
Figura 6. Imagens ultrassonográficas das lesões mamárias identificadas por palpação no grupo MNU
exercitado, avaliadas pelo modo Power Doppler (A) e pelo modo B Flow (B). A DPC detetada pelo modo
Power Doppler neste grupo foi de 1,47% ± 0,27 e a DPC detetada pelo modo B Flow neste grupo foi de
3,68% ± 0,88.
Figura 7. Imagens ultrassonográficas das lesões mamárias identificadas por palpação no grupo MNU
sedentário, avaliadas pelo modo Power Doppler (A) e pelo modo B Flow (B). A DPC detetada pelo modo
Power Doppler foi de 1,30% ± 0,29 e a DPC detetada pelo modo B Flow foi de 2,40% ± 0,52.
4.2. Avaliação histopatológica
Todos os animais dos grupos MNU sedentário e MNU exercitado desenvolver a m lesões mamárias (incidência de 100%). Foram identificadas 28 lesões no grupo MNU sedentário e 23 lesões no grupo MNU exercitado. Embora o número de lesões tenha sido superior no grupo MNU sedentário, a diferença entre grupos não foi estatisticame nte significativa (p>0,05) (Tabela 2). Como esperado, os animais dos grupos controlo não desenvolveram neoplasias.
Histologicamente, as lesões foram classificadas como não neoplásicas, benignas e malignas. O número de lesões benignas foi numericamente superior no grupo MNU exercitado, enquanto o número de lesões malignas foi superior no grupo MNU sedentário.
A B