ANITA MANUELA RODRIGUES CERDEIRA
DETEÇÃO DE ENTEROBACTERIACEAE PRODUTORAS
DE BETA-LACTAMASES DE ESPETRO ALARGADO EM
ISOLADOS CLÍNICOS URINÁRIOS DO AMBULATÓRIO E
ISOLADOS RESPONSÁVEIS POR COLONIZAÇÃO FECAL
DE IDOSOS NA ZONA NOROESTE DE PORTUGAL
Dissertação de 2º ciclo de estudos conducente ao grau de Mestre em Análise Clínicas
TRABALHO REALIZADO SOB A ORIENTAÇÃO DE:
É AUTORIZADA A REPRODUÇÃO PARCIAL DESTA DISSERTAÇÃO, APENAS PARA EFEITOS DE INVESTIGAÇÃO, MEDIANTE DECLARAÇÃO ESCRITA DO INTERESSADO, QUE A TAL SE COMPROMETE.
Agradecimentos
Quero expressar os meus sinceros agradecimentos à minha orientadora, Professora Doutora Helena Neto Ferreira de Sousa, pelo seu incansável apoio e transmissão de conhecimentos durante a orientação deste trabalho.
À provedora da Santa Casa da Misericórdia de Fafe pela disponibilidade para a realização deste trabalho, cedendo-nos as amostras biológicas recolhidas nos diferentes lares de idosos.
Ao Laboratório de Análises Clínicas, LabFafe, pela colaboração e permissão na recolha dos isolados urinários necessários à realização deste trabalho.
A toda a família pelo apoio demonstrado, em especial à minha mãe e à minha madrinha.
Um agradecimento especial ao meu namorado, André Rocha, pela paciência, apoio e dedicação ao longo dos anos e em particular durante a realização deste trabalho.
Resumo
As Enterobacteriaceae são um grupo de bacilos Gram negativo, com elevada importância clínica, podendo fazer parte da microflora comensal normal ou dar origem a infeções oportunistas.
Este trabalho teve como objetivo estudar Enterobacteriaceae produtoras de β-lactamases de espectro alargado, como causadoras de infeções do trato urinário e como colonizadoras do trato intestinal de utentes de lares de idosos, tendo sido obtidos percentagens de 6,6% e 37,5%, respetivamente.
As β-lactamases de espectro alargado têm visto aumentada a sua relevância em todo o mundo e o seu estudo é importante para que possa ser dada mais e melhor informação ao clínico, no sentido de melhorar a prescrição do tratamento.
Com este estudo podemos verificar que além das resistências devidas à produção de β-lactamases de espectro alargado, já são também encontradas outras resistências a antibióticos não-β-lactâmicos como é o caso das quinolonas.
São também encontradas resistências aos carbapenemos, antibióticos utilizados no tratamento de infeções por isolados produtores de ESBL e de uso exclusivo hospitalar. Deste modo, é relevante que haja maior informação e controlo na disseminação de estirpes produtoras de β-lactamases de espectro alargado, tentando evitar o uso inadequado de antibióticos e controlar fatores de risco em termos de controlo de infeção e prevenção de colonização.
Palavras-chave: β-lactamases de espectro alargado, oximino-β-lactâmicos,
Abstract
The Enterobacteriaceae are a group of Gram negative bacilli, with clinical relevance, which could be part of commensal microflora or generate opportunistic infections.
The purpose of this work was to study extended spectrum β-lactamases producing
Enterobacteriaceae as the cause of urinary tract infection and as intestinal tract colonizer
of nursing homes residents, we found 6.6% and 37.5%, respectively.
With an increasing relevance in all world, the study of extended spectrum β-lactamases is important to improve the quality and accessibility of data transmitted to the clinic, in a way to improve the treatment prescription.
In this study, besides founding the resistance due to extended spectrum β-lactamases, it is also possible to find other no-β-lactams antibiotic resistance, for example, quinolones.
We also found resistance to carbapenems, antibiotics used to treat infections by ESBL-producing strains, and of exclusive hospital use.
Consequently, it is important to have more information and control in the dissemination of extended spectrum β-lactamases producing strains, avoiding the misuse of antibiotics and controlling the risk factors in terms of infection control and colonization prevention.
Key-words: Extended spectrum β-lactamases, oximino-β-lactams, Enterobacteriaceae,
Resumo... iv
Abstract ... v
Índice de Tabelas ... viii
Índice de Figuras ... ix
Abreviaturas ... x
1.
INTRODUÇÃO ... 1
1.1. Família Enterobacteriaceae ... 1
1.2. Antibióticos β-lactâmicos ... 1
1.3. Mecanismos de Resistência aos antibióticos ... 2
1.3.1. Genética da resistência a antibióticos ... 3
1.3.2. Alteração da permeabilidade da membrana ... 3
1.3.3. Bombas de efluxo ... 4
1.3.4. Modificação dos alvos (Penicillin Binding Proteins) ... 5
1.3.5. Hidrólise enzimática por β-lactamases ... 5
1.4. Classificação das β-lactamases ... 7
1.5. β-lactamases de espetro alargado (ESBL) ... 10
1.6. Epidemiologia das ESBL ... 11
1.7. Deteção laboratorial de ESBL ... 12
1.7.1. Teste de aproximação de disco ou Teste de duplo disco de “Jarlier” ... 13
1.7.2. Teste de adição de ácido clavulânico ... 14
1.7.3. Métodos automatizados ... 15
1.8. Tratamento de infeções com isolados produtores de ESBL ... 15
2.
OBJETIVOS ... 17
3.
MÉTODOS ... 19
3.1. Tratamento dos isolados urinários cedidos pelo Laboratório de Análises Clínicas ... 20
3.2. Tratamento de amostras cedidas pela Santa Casa da Misericórdia para pesquisa de colonização fecal por Enterobacteriaceae produtoras de ESBL ... 22
4.
RESULTADOS ... 24
4.1. Resultados dos isolados urinários cedidos pelo Laboratório de Análises Clínicas ... 25
4.2. Resultados obtidos das amostras de fezes cedidas pela Santa Casa da Misericórdia para estudo da colonização fecal ... 28
5.
DISCUSSÃO ... 33
6.
CONCLUSÃO ... 37
Índice de Tabelas
Tabela 1 – Classificação segundo Bush-Jacoby group ... 8 Tabela 2 – Critério inicial de despiste para evidenciação de produção de ESBL ... 13 Tabela 3 – Tratamento recomendado para infeções com isolados produtores de ESBL . 16 Tabela 4 – Isolados urinários produtores de ESBL ... 25 Tabela 5 – Perfil de suscetibilidade aos antibióticos dos isolados produtores de ESBL testados pelo sistema automatizado Vitek 2 Compact (bioMérieux, Marcy l'Etoile, França) ... 27 Tabela 6 – Dados relativos aos utentes do Lar de idosos (idade, lar, e internamentos anteriores) ... 28 Tabela 7 – Seleção de Enterobacteriaceae produtoras de ESBL ... 30 Tabela 8 ‒ Perfil de suscetibilidade aos antibióticos beta-lactâmicos dos isolados obtidos no estudo da colonização fecal de idosos ... 31
Índice de Figuras
Figura 1 ‒ Estrutura de uma oximino-aminotiazol cefalosporina (Livermore, 2008). ... 2 Figura 2 ‒ Representação esquemática das cinco famílias das bombas de efluxo organizadas numa bactéria Gram negativa (Martinez et al., 2009). ... 4 Figura 3 ‒ Mecanismo de ação de uma serina β-lactamase na inativação de antibióticos (Livermore, 1995). ... 6 Figura 4 ‒ Mecanismo de ação de uma metalo β-lactamase na inativação de antibióticos (Wang et al., 1999) ... 7 Figura 5 – Deteção de isolados produtores de ESBL pelo teste de aproximação de disco ou teste de duplo disco de “Jarlier”. Discos de Amoxicilina/ácido clavulânico 20+10µg no centro, ceftazidima 30µg à esquerda e cefotaxima 30µg à direita (Livermore and Brown, 2001). ... 14 Figura 6 ‒ Teste positivo de adição de ácido clavulânico à cefotaxima e ceftazidima. (Harada et al., 2008) ... 15 Figura 7 ‒ Localização dos postos de colheita do Laboratório de Análises Clínicas onde foram obtidos isolados produtores de ESBL e Unidades de Cuidados Continuados próximas. ... 20 Figura 8 ‒ Repartição dos isolados de Enterobacteriaceae produtores de ESBL. ... 26 Figura 9 ‒ Amostra 3 do Laboratório. Exemplo de um isolado urinário com manifestação de sinergismo entre amoxicilina/ácido clavulânico e cefotaxima... 26 Figura 10 ‒ Percentagem de resistência a antibióticos não β-lactâmicos nos isolados urinários. ... 28 Figura 11 ‒ Estudo do crescimento de Enterobacteriaceae produtoras de ESBL em meios de cultura. ... 29 Figura 12 ‒ Amostra 4 do lar de Fafe positiva para o teste confirmatório de adição de ácido clavulânico à ceftazidima. ... 32
Abreviaturas
% - Percentagem °C – Graus Centígrados β – Beta ml – Mililitro µg – Micrograma µL – MicrolitroADN – Ácido desoxirribonucleico AMC – Amoxicilina/ácido clavulânico AML – Amoxicilina
ATCC – American Type Culture Collection ATP ‒ Adenosina trifosfato
CAZ – Ceftazidima
CLSI – “Clinical and Laboratory Standards Institute” CIP – Ciprofloxacina
CTX – Cefotaxima
EDTA ‒ Ácido etilenodiamino tetra-acético (“Ethylenediamine tetraacetic acid”) ESBL – β-lactamases de espectro alargado (“Extended spectrum
beta-lactamases)
ETP ‒ Ertapenemo F – Nitrofurantoína FEP – Cefepima FOX – Cefoxitina
LPS ‒ Lipopolissacarídeo MBL ‒ Metalo-β-lactamase MCK – MacConkey MH – Mueller-Hinton NOR – Norfloxacina STX – Trimetropim-sulfametoxazol
TSB – Caldo tripticase soja (“Tryptic Soy Broth”) UCC ‒ Unidade de Cuidados Continuados
1.1. Família Enterobacteriaceae
A família Enterobacteriaceae é o maior e mais heterogéneo grupo de bacilos Gram negativo com importância clínica, que fazem parte da microflora comensal normal e que podem originar infeções oportunistas, como septicemias, infeções do trato urinário e infeções intestinais.
Estes microrganismos são ubiquitários, podendo ser encontrados em diversos habitats, como o solo, água, plantas e também na flora indígena do Homem e de outros animais (De Sousa, 2000).
1.2. Antibióticos β-lactâmicos
Os β-lactâmicos são uma vasta classe de antibióticos que inclui, as penicilinas, cefalosporinas, carbapenemos e monobactâmicos, em que todas têm em comum um anel β-lactâmico que é a base da sua atividade antibacteriana (De Pascale and Wright, 2010).
Atuam na biossíntese do peptidoglicano pela inibição das Penicillin Binding Proteins (PBPs), inibindo a ligação do peptidoglicano às transpeptidases que estão localizadas no exterior da membrana citoplasmática, impedindo a transpeptidação (Giedraitiene et al., 2011).
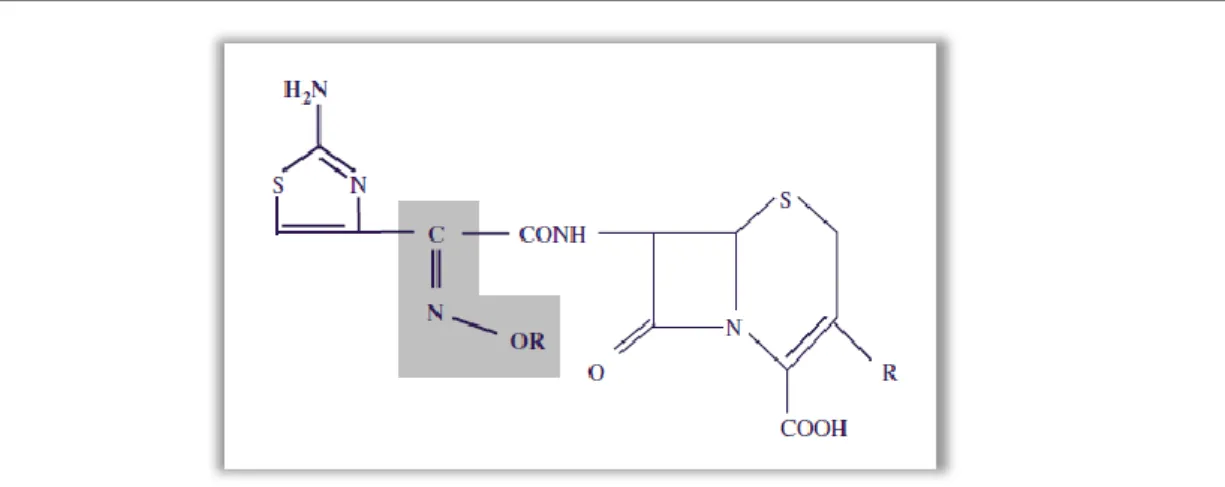
Em meados da década de 70, o aumento da propagação das enzimas β-lactamases, levou a um estímulo na produção de β-lactâmicos estáveis às β-β-lactamases, surgindo os oximino-β-lactâmicos, os quais incluem as oximino-cefalosporinas (cefuroxima, cefotaxima, ceftazidima, ceftriaxona, e cefepima) e o aztreonam, passando estes a serem utilizados como terapia padrão para várias infeções. Na estrutura de uma cefalosporina oximino-aminotiazol o grupo C=N-OR, como se vê na Figura 1, mantem o anel β-lactâmico protegido da ação das β-lactamases clássicas mas não o protege da ação β-lactamases de espectro alargado (ESBL) (Livermore, 2008)
Figura 1 ‒ Estrutura de uma oximino-aminotiazol cefalosporina (Livermore, 2008).
1.3. Mecanismos de Resistência aos antibióticos
O sucesso do uso de um agente terapêutico é comprometido pelo desenvolvimento de tolerância ou resistência a esse composto a partir do momento em que é utilizado pela primeira vez (Davies and Davies, 2010).
A formação de um fenótipo resistente a agentes antimicrobianos depende de vários fatores tais como, o grau de expressão da resistência, a capacidade do organismo suportar os mecanismos de resistência, local de origem da colonização e uso exacerbado de antibióticos (uso inadequado de antibióticos e/ou terapias prolongadas). O uso de antibióticos na alimentação animal, também foi um fator importante relacionado com a resistência bacteriana (Giedraitiene et al., 2011), no entanto, a sua utilização foi proibida na Europa a partir de 1 de Janeiro de 2006.
As resistências a antibióticos podem ser atingidas por mecanismos intrínsecos ou adquiridos. Os mecanismos adquiridos envolvem mutações nos genes que são alvo da ação do antibiótico e transferência de fatores de resistência suportados em plasmídeos, bacteriófagos, transposões e outro material genético. Em geral, estes processos são realizados pelos processos de transdução (via bacteriófagos), conjugação (via plasmídeos e transposões conjugativos) e transformação (por incorporação do ADN cromossomal no cromossoma) (Levy and Marshall, 2004).
Quando os mecanismos são intrínsecos, como o nome indica, a resistência manifesta-se de uma forma espontânea.
Os microrganismos multirresistentes são usualmente resistentes a antibióticos β-lactâmicos, fluoroquinolonas e aminoglicosídeos (Alekshun and Levy, 2007)
1.3.1. Genética da resistência a antibióticos
A resistência a antibióticos pode dever-se a vários fatores genéticos, tais como, as mutações espontâneas que são naturais em todas as bactérias pelo facto das mutações cromossomais ocorrerem espontaneamente na replicação bacteriana devido à incorreta replicação do ADN (Hooper, 2001). Como resultado destas mutações ocorrem alguns mecanismos de resistência, a captação de antibiótico ou a modificação do sistema de efluxo (Hooper, 2001). No caso das mutações adaptativas, a maior parte das mutações ocorre nas células em divisão, no entanto, estas podem ocorrer também em células não divididas ou em divisão lenta. Estas mutações são a principal fonte de microrganismos resistentes a antibióticos originados em condições normais (Erill et al., 2006).
A resistência pode também dever-se à transferência de elementos genéticos móveis de uma célula bacteriana para outra, ou elementos que se movem de um local para outro dentro da mesma célula (Bennett, 2008).
Os principais mecanismos de resistência bacterianos aos antibióticos são os seguintes: Alteração da permeabilidade da membrana, modificação dos alvos (Penicillin Binding Proteins), Bombas de efluxo e Hidrólise enzimática.
1.3.2. Alteração da permeabilidade da membrana
A membrana externa em bactérias Gram negativas é composta por uma camada interna que contem fosfolípidos e uma camada externa que contem o lipopolissacarídeo (LPS). Tal composição reduz a entrada de antibiótico na célula e transfere-o através da membrana externa. As moléculas de antibiótico podem ser transferidas para a célula utilizando os seguintes mecanismos: difusão através das porinas, difusão através da bicamada e por autopromoção da captação. O tipo de entrada na célula, depende da composição bioquímica da molécula de antibiótico, pois pequenas moléculas hidrofílicas (β-lactâmicos e quinolonas) podem atravessar a membrana externa através da porinas (Giedraitiene et al., 2011)
1.3.3. Bombas de efluxo
As bombas de efluxo são um mecanismo de resistência a antibióticos descrito pela primeira vez em 1980, que demonstrou a presença de uma bomba de efluxo de tetraciclina mediada por plasmídeos em Escherichia coli. Nesta resistência há um aumento da síntese de proteínas numa bomba de efluxo devida a uma mutação pontual, levando a uma diminuição da concentração do antibiótico no interior da bactéria (Lupo et
al., 2012).
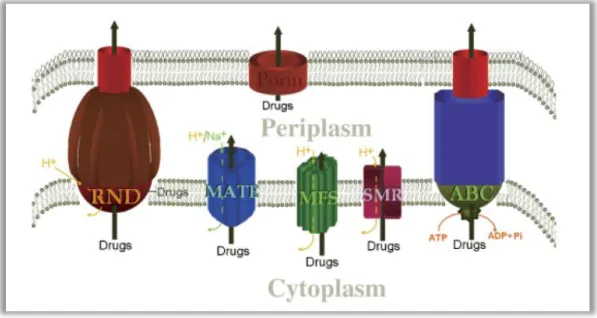
Estas bombas de efluxo são agrupadas em cinco famílias: ABC (ATP binding cassette), MFS (Major facility super family), RND (Resistance/nodulation/cell division), SMR (Small multidrug resistance), e MATE (Multidrug and toxic-compound extrusion) (Martinez et al., 2009)
No caso dos bacilos Gram negativo, este transporte ocorre em proteínas citoplasmáticas, periplasmáticas e proteínas da membrana externa, sendo estas associadas de modo a formar um sistema de efluxo multicomponente que está conectado a uma membrana de fusão e uma membrana externa proteica, permitindo o bombeamento dos antibióticos diretamente para o exterior das bactérias. Este mecanismo de efluxo pode ser acionado por um gradiente de protões (RND, SMR, MATE e MFS), por iões de sódio (MATE) ou por energia proveniente da hidrólise de ATP (ABC) (Martinez et al., 2009) como mostra o esquema da Figura 2.
Figura 2 ‒ Representação esquemática das cinco famílias das bombas de efluxo
1.3.4. Modificação dos alvos (Penicillin Binding Proteins)
As PBPs são transpeptidases ou carboxipeptidases envolvidas no metabolismo do peptidoglicano e a sua inibição devido a mutações pontuais produz um desequilíbrio no metabolismo da parede celular, o que resulta na inibição do crescimento ou em lise celular (Zapun et al., 2008).
As PBPs reagem com os β-lactâmicos para originar ésteres de serina e os ésteres formados pelas β-lactamases não fazem a hidrólise de imediato. Sendo assim, alguns inibidores de β-lactamases formam ésteres de serina com as β-lactamases e por outro lado, algumas PBPs desacilam rapidamente e a sua fraca atividade de hidrólise do anel β-lactâmico pode proteger a célula bacteriana se a entrada do antimicrobiano for suficientemente restringida pela impermeabilização (Livermore, 1995)
A interação entre um antibiótico e uma molécula alvo é muita específica, por isso, mesmo pequenas alterações numa molécula alvo podem influenciar a ligação do antibiótico à mesma. Por vezes, modificações no alvo exigem outras alterações na célula como compensação (Giedraitiene et al., 2011).
1.3.5. Hidrólise enzimática por β-lactamases
A modificação química dos antibióticos, catalisada por enzimas, é o maior mecanismo de resistência aos mesmos e é especialmente tratado por estudos biológicos e químicos. Desde 1940, quando a primeira penicilinase (β-lactamase) foi identificada, milhares de enzimas capazes de degradar e modificar os antibióticos foram identificadas. O mecanismo de degradação resulta numa interrupção do centro reativo ou num rearranjo estrutural que não é facilmente reversível em condições fisiológicas normais. Por outro lado, a modificação covalente dos antibióticos impede a interação do mesmo com o seu alvo (De Pascale and Wright, 2010). A identificação definitiva destas enzimas só é possível por sequenciação de genes ou proteínas (Livermore and Brown, 2001).
A primeira β-lactamase foi identificada em Escherichia coli antes da utilização da penicilina na prática clínica (Gupta, 2007). A hidrólise dos antibióticos β-lactâmicos pelas β-lactamases é o mecanismo de resistência mais comum para esta classe de agentes antimicrobianos nas bactérias Gram negativas importantes na clínica. Quando uma bactéria Gram negativa apresenta resistência a um antibiótico β-lactâmico, a produção de β-lactamases é a mais frequente suspeita (Bush and Jacoby, 2010) e a persistente
exposição de estirpes bacterianas a uma variedade de β-lactâmicos, levou a uma superprodução e mutação dos genes codificadores das β-lactamases (Gupta, 2007).
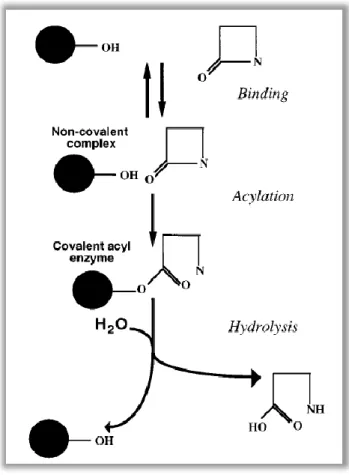
Algumas β-lactamases utilizam os iões zinco para quebrar o anel β-lactâmico, no caso das metalo-β-lactamases (MBL) (Figura 4), mas um grande número atua utilizando o mecanismo da serina éster (Figura 3), no caso das restantes β-lactamases, no qual a enzima é primeiramente associada de modo não covalente com o antibiótico para formar o complexo Michaelis não covalente. De seguida, o anel β-lactâmico é atacado pelo hidroxilo livre, na cadeia lateral do resíduo de serina no local ativo da enzima, formando um acil-éster covalente. Finalmente, a hidrólise do éster liberta a enzima ativa e o antimicrobiano hidrolisado e inativo (Livermore, 1995).
Figura 3 ‒ Mecanismo de ação de uma serina β-lactamase na inativação de antibióticos
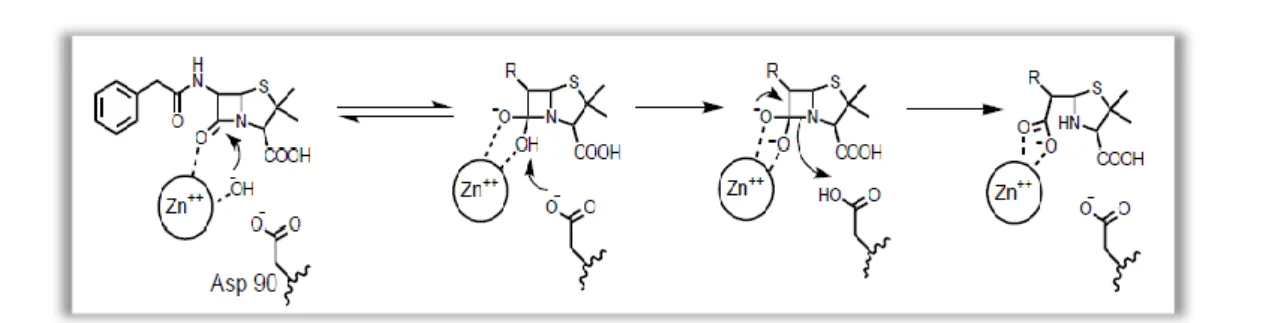
Figura 4 ‒ Mecanismo de ação de uma metalo β-lactamase na inativação de antibióticos
(Wang et al., 1999)
1.4. Classificação das β-lactamases
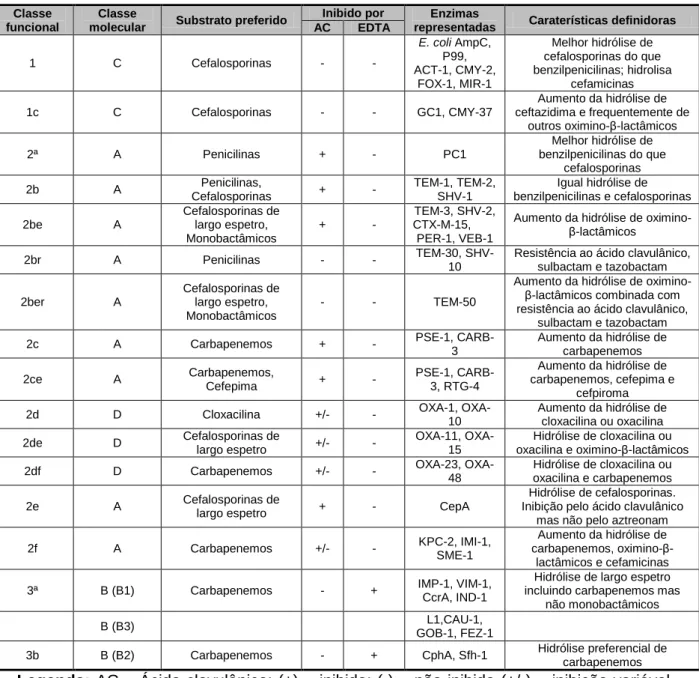
Existem dois grandes esquemas de classificação para caracterizar as enzimas β-lactamases: a classificação molecular de Ambler e a classificação funcional de Bush-Jacoby-Medeiros, os quais estão demonstrados na Tabela 1. O esquema de Ambler classifica as β-lactamases em quatro classes, de A a D, com base na homologia proteica das enzimas, sendo as classes A,C e D serina β-lactamases e a classe B metalo-β-lactamases (MBL). O esquema de Bush-Jacoby-Medeiros, que é o esquema mais usado, classifica as β-lactamases em grupos de 1 a 3, com base nas propriedades funcionais das enzimas, ou seja, no perfil do substrato e inibidor (Harada et al., 2008),
As classes A, C e D são serina β-lactamases pois incluem enzimas que hidrolisam os seus substratos formando uma acil-enzima através de um resíduo de serina no local ativo, enquanto a classe B são MBL pois utilizam pelo menos um ião zinco no seu local ativo de modo a facilitar a hidrólise do β-lactâmico. Na classificação com base nas propriedades funcionais das enzimas, podemos encontrar: o grupo 1 composto por cefalosporinases, pertencente à classe molecular C e resistente ao ácido clavulânico; o grupo 2 que representa o maior grupo de β-lactamases, é composto por penicilinases, carbapenemases e β-lactamases de espetro alargado, pertencem à classe molecular A e D e têm sensibilidade variável aos inibidores; o grupo 3 é composto pelas MBL, pertencem à classe molecular B, são resistentes aos inibidores das β-lactamases e inibidos por EDTA; o grupo 4 foi previamente incluído na classificação funcional em 1995, no entanto, foi omitido na classificação atual. Caso existisse mais informação sobre este grupo, provavelmente seria incluído num grupo já existente (Bush and Jacoby, 2010).
Tabela 1 – Classificação segundo Bush-Jacoby group
Classe funcional
Classe
molecular Substrato preferido
Inibido por Enzimas
representadas Caraterísticas definidoras AC EDTA 1 C Cefalosporinas - - E. coli AmpC, P99, ACT-1, CMY-2, FOX-1, MIR-1 Melhor hidrólise de cefalosporinas do que benzilpenicilinas; hidrolisa cefamicinas 1c C Cefalosporinas - - GC1, CMY-37 Aumento da hidrólise de ceftazidima e frequentemente de outros oximino-β-lactâmicos 2ª A Penicilinas + - PC1 Melhor hidrólise de benzilpenicilinas do que cefalosporinas
2b A Cefalosporinas Penicilinas, + - TEM-1, TEM-2, SHV-1 benzilpenicilinas e cefalosporinas Igual hidrólise de
2be A Cefalosporinas de largo espetro, Monobactâmicos + - TEM-3, SHV-2, CTX-M-15, PER-1, VEB-1
Aumento da hidrólise de oximino-β-lactâmicos
2br A Penicilinas - - TEM-30,
SHV-10
Resistência ao ácido clavulânico, sulbactam e tazobactam 2ber A Cefalosporinas de largo espetro, Monobactâmicos - - TEM-50
Aumento da hidrólise de oximino-β-lactâmicos combinada com resistência ao ácido clavulânico,
sulbactam e tazobactam
2c A Carbapenemos + - PSE-1,
CARB-3 Aumento da hidrólise de carbapenemos 2ce A Carbapenemos, Cefepima + - PSE-1, CARB-3, RTG-4 Aumento da hidrólise de carbapenemos, cefepima e cefpiroma
2d D Cloxacilina +/- - 1,
OXA-10 Aumento da hidrólise de cloxacilina ou oxacilina 2de D Cefalosporinas de largo espetro +/- - 11, OXA-15 Hidrólise de cloxacilina ou oxacilina e oximino-β-lactâmicos
2df D Carbapenemos +/- - 23,
OXA-48
Hidrólise de cloxacilina ou oxacilina e carbapenemos
2e A Cefalosporinas de
largo espetro + - CepA
Hidrólise de cefalosporinas. Inibição pelo ácido clavulânico
mas não pelo aztreonam
2f A Carbapenemos +/- - KPC-2, IMI-1,
SME-1
Aumento da hidrólise de carbapenemos,
oximino-β-lactâmicos e cefamicinas
3ª B (B1) Carbapenemos - + IMP-1, VIM-1,
CcrA, IND-1
Hidrólise de largo espetro incluindo carbapenemos mas
não monobactâmicos
B (B3) L1,CAU-1,
GOB-1, FEZ-1
3b B (B2) Carbapenemos - + CphA, Sfh-1 Hidrólise preferencial de
carbapenemos Legenda: AC – Ácido clavulânico; (+) – inibida; (-) – não inibida (+/-) – inibição variável.
Adaptado de (Bush and Jacoby, 2010).
Em geral, as enzimas da Classe A serina β-lactamases são suscetíveis aos inibidores de β-lactamases comercializados, como o ácido clavulânico, tazobactam e sulbactam (Drawz and Bonomo, 2010).
As enzimas da classe A β-lactamases de largo espetro que degradavam penicilinas e cefalosporinas, sofreram um aumento em Escherichia coli e Klebsiella
pneumoniae, e também o aparecimento destas enzimas noutras bactérias, levou ao
desenvolvimento de cefalosporinas com uma cadeia lateral oximino e monobactâmicos de espectro alargado. Aquando da introdução dos carbapenemos e cefamicinas no início
lactâmicos, no entanto, a pressão seletiva levou à emergência da classe A β-lactamases de espectro alargado (ESBL), que são capazes de hidrolisar muitas das oximino-cefalosporinas e o aztreonamo. As ESBL hidrolisam penicilinas, as cefalosporinas de reduzido e largo espetro e o monobactâmico aztreonamo. Por outro lado, estas não são capazes de degradar eficientemente, cefamicinas, carbapenemos e inibidores das β-lactamases (Drawz and Bonomo, 2010).
As pertencentes à classe A serina carbapenemases são β-lactamases que podem hidrolisar não só carbapenemos como também cefalosporinas, penicilinas e aztreonamo. Estas enzimas hidrolisadoras de carbapenemos foram identificadas primeiramente em
Enterobacter cloacae, Serratia marcescens e Klebsiella pneumoniae, que são bactérias
que muitas vezes apresentam múltiplos fatores de resistência, estreitando assim as opções de tratamento (Drawz and Bonomo, 2010).
As enzimas da classe classe B metalo-β-lactamases (MBL) são β-lactamases caraterizadas pela capacidade de hidrolisarem carbapenemos, resistirem aos inibidores das β-lactamases e serem suscetíveis à inibição por agentes quelantes de iões metálicos, como o EDTA. Os microrganismos que produzem estas enzimas, também apresentam normalmente resistência a penicilinas, cefalosporinas, carbapenemos mas não apresentam resistência ao aztreonamo. O seu mecanismo de hidrólise é dependente da interação do antibiótico β-lactâmico com iões zinco no local ativo da enzima, resultando deste modo num traço distintivo da sua inibição pelo EDTA, um quelante do Zn2+ e outros catiões divalentes (Queenan and Bush, 2007)
As AmpC β-lactamases, pertencentes à classe C serina cefalosporinases, e os microrganismos que as expressam são normalmente ativas em penicilinas, têm maior atividade em cefalosporinas e são capazes de hidrolisar cefamicinas como a cefoxitina e o cefotetan. Os inibidores de β-lactamases, como o ácido clavulânico, tazobactam e sulbactam têm menor atividade em AmpC, no entanto, algumas são inibidadas pelo tazobactam e sulbactam (Jacoby, 2009).
Muitas espécies bacterianas como Enterobacter spp., Serratia marcescens, E.
coli, Pseudomonas aeruginosa e Citrobacter freundii possuem β-lactamases do tipo
AmpC (Komatsu et al., 2003), e o que as distingue das ESBL é o facto de serem ativas contra cefalosporinas mas não serem inibidas pelo ácido clavulânico (Gupta, 2007).
A classe D serina oxacilinases foram inicialmente designadas como “oxacilinases” devido à sua capacidade de hidrolisar a oxacilina numa percentagem de pelo menos 50%
mais do que a benzilpenicilina, ao contrário do que acontece nas Classes A e C onde há uma hidrólise lenta da oxacilina. Nas bactérias, as β-lactamases OXA podem conferir resistência às penicilinas, cefalosporinas, cefalosporinas de largo espectro (ESBL tipo OXA) e aos carbapenemos (carbapenemases tipo OXA). De um modo geral, as OXA β-lactamases são resistentes à inibição pelo ácido clavulânico, sulbactam e tazobactam (Drawz and Bonomo, 2010).
1.5. β-lactamases de espetro alargado (ESBL)
As β-lactamases de espetro alargado são enzimas que conferem resistência a penicilinas, cefalosporinas de reduzido e largo espetro, monobactâmicos e têm demonstrado inatividade contra cefamicinas e carbapenemos (Bradford, 2001;Bradford et
al., 1994;Bush et al., 1995;Pitout et al., 1997).Tem sido também verificado uma grande
associação de resistência à ciprofloxacina em bactérias produtoras de ESBL (Paterson et
al., 2000). O ácido clavulânico, tazobactam, e outros inibidores de β-lactamase são
normalmente efetivos contra ESBL, contudo, algumas variantes de resistência e inibidores têm sido descritas (Bradford, 2001;Bradford et al., 1994;Bush et al., 1995).
Nas bactérias Gram negativas, estas enzimas permanecem no espaço periplasmático, onde atacam o antibiótico antes que este consiga alcançar o seu local recetor (Stratton, 2000).
Klebsiella pneumoniae e Escherichia coli são as bactérias produtoras de ESBL
mais comuns, mas também há outros membros da família Enterobacteriacea (Jarlier et
al., 1988), Pseudomonas aeruginosa e Capnocytophaga ochracea (Bradford,
2001;Rosenau et al., 2000).
As famílias enzimáticas do tipo, TEM e SHV deram origem às ESBL clássicas (Gupta, 2007) e posteriormente às cefotaximases (CTX-M) e oxacilinases (OXA). Várias enzimas têm sido descritas, com mais de 200 enzimas na classe TEM, mais de 150 na classe SHV, mais de 30 na classe CTX-M e mais de 15 na classe OXA (Bonnet, 2004;Bradford, 2001;http://www.lahey.org/Studies/). As β-lactamases do tipo TEM e SHV, resultaram de mutações pontuais nos genes das β-lactamases existentes levando a uma alteração do perfil do substrato, enquanto que outras β-lactamases, como as do tipo CTX-M, foram “emprestadas” das β-lactamases cromossómicas que ocorrem naturalmente em outras espécies de Enterobacteriaceae (Bradford, 2001) .
1.6. Epidemiologia das ESBL
As estirpes produtoras de ESBL são um problema em todo o mundo para os pacientes hospitalizados. Este fenómeno começou na Europa Ocidental, devido provavelmente ao facto dos antibióticos β-lactâmicos de largo espectro serem usados lá pela primeira vez clinicamente (Bradford, 2001). O primeiro microrganismo produtor de ESBL foi detetado na Europa, inicialmente foram reportados na Alemanha e Inglaterra, e mais tarde, muitos foram reportados em França (Brun-Buisson et al., 1987;Sirot et al., 1987).
Além de em Klebsiella pneumoniae, Escherichia coli, Klebsiella oxytoca, a produção de ESBL tem-se tornado comum também em Proteus mirabilis e estão a aumentar em Salmonella spp. (Bauernfeind et al., 1992).
O facto de vivermos num ecossistema faz com que os genes de resistência provenientes de animais que consumimos na nossa alimentação, influenciem a nossa flora intestinal e posteriormente, pela rede de saneamento público, volte ao ecossistema natural permitindo assim a sua disseminação ambiental (Hawkey, 2008).
O excesso de uso de antibióticos em humanos e animais, infeções cruzadas em hospitais, a cadeia alimentar, o comércio e a migração humana, contribuíram para a recente disseminação das estirpes produtoras de ESBL para além do ambiente hospitalar, contudo, estes fatores são variáveis e estão ligados a situações epidemiológicas particulares (Coque et al., 2008).
Resultados de investigação molecular suportam a hipótese de que a transmissão pessoa-a-pessoa em conjunto com a aquisição a partir de uma fonte comum, também contribuem para o aumento da disseminação de Escherichia coli produtoras de ESBL (Rodriguez-Bano, Lopez-Cerero et al. 2008).
Um estudo realizado na Bélgica entre 2008 e 2009 revelou uma prevalência de 4,5% Enterobacteriaceae produtoras de ESBL de (Schoevaerdts et al., 2011) e todos os estudos publicados confirmam que na maioria dos países da Europa do norte, a prevalência de isolados de ESBL é menor comparada com os países da Europa do Sul e Ocidental (Coque et al., 2008).
Cada vez mais se tem reconhecido que a produção de ESBL é importante não só nas infeções nosocomiais mas também em questões de saúde pública no que diz respeito a infeções adquiridas na comunidade, sendo a Escherichia coli produtora de
ESBL do tipo CTX-M a principal causadora de infeções na comunidade e Klebsiella spp. e outras, produtoras de ESBL do tipo TEM e SHV em ambiente hospitalar (Pitout and Laupland, 2008).
Um estudo feito em Espanha, revelou que em 70% das Escherichia coli produtoras de ESBL, estas são do tipo CTX-M (Rodriguez-Bano et al., 2006).
Outro estudo, revelou também vários fatores de risco para infeções por bactérias produtoras de ESBL adquiridas na comunidade, tais como diabetes mellitus, infeções recorrentes do trato urinário, sexo feminino, idade avançada, procedimentos invasivos do trato urinário, doentes acompanhados fora do ambulatório, tratamento anterior com aminopenicilinas, cefalosporinas ou fluoroquinolonas (Rodriguez-Bano et al., 2008), hospitalização nos últimos 12 meses, duração da hospitalização superior a 8 dias e hospitalização anterior em Unidades de Cuidados Continuados (UCC) (Pfaller and Segreti, 2006).
Um estudo realizado em Espanha sobre colonização fecal por Escherichia coli produtoras de ESBL, revelou um facto interessante de que a colonização fecal é significativamente mais elevada em familiares de doentes com diagnóstico de infeção do trato urinário (ITU) por Escherichia coli produtora de ESBL adquirida na comunidade (Rodriguez-Bano et al., 2008). Um estudo realizado em Madrid, Espanha, em 2007, revelou que 8,2% das pessoas são portadoras fecais de estirpes produtoras de ESBL (Paniagua et al., 2010).
1.7. Deteção laboratorial de ESBL
O aumento da prevalência de Enterobacteriaceae produtoras de ESBL criou uma grande necessidade dos laboratórios testarem métodos precisos de deteção dessas enzimas em isolados clínicos (CLSI, 2011;Katsanis et al., 1994).
A deteção de ESBL pode ser feita através de testes fenotípicos ou genotípicos, sendo os fenotípicos usados na rotina dos laboratórios clínicos e os genotípicos usados em laboratórios de referência ou de estudo científico (Falagas and Karageorgopoulos, 2009).
O Clinical and Laboratory Standards Institute (CLSI) recomenda a pesquisa de ESBL em Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca e Proteus mirabilis
pesquisa em dois métodos: testes de despistagem inicial e testes fenotípicos confirmatórios (CLSI, 2011).
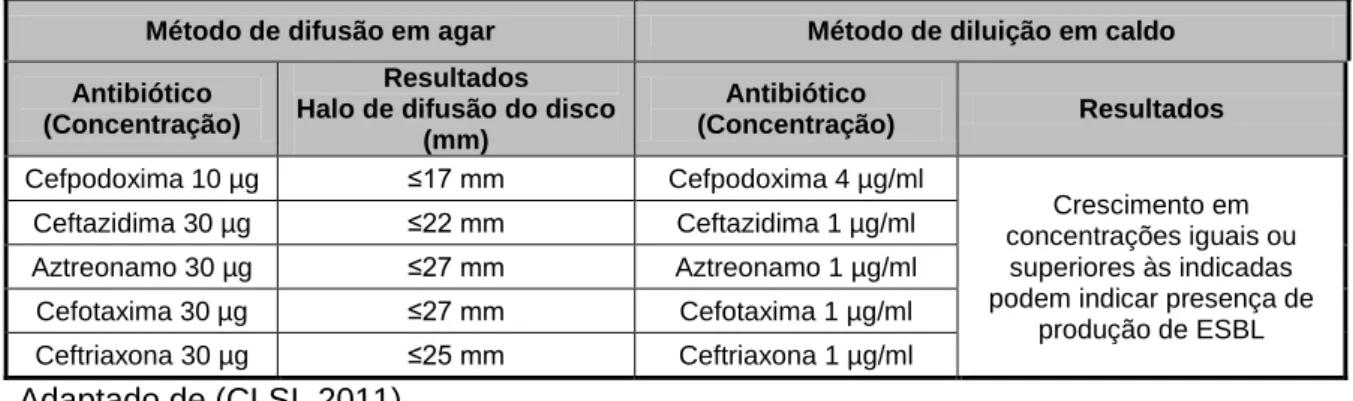
No teste inicial, é avaliada a suscetibilidade a mais do que um destes antibióticos, cefpodoxima, ceftazidima, ceftriaxona, cefotaxima e aztreonamo, usando o método de difusão em agar ou diluição em caldo, de acordo com a Tabela 2. Uma diminuição da sensibilidade a um ou mais destes antibióticos testados, indica uma possível produção de ESBL sendo necessário realizar testes fenotípicos confirmatórios. É de salientar que a diminuição dos valores de MIC em relação aos valores de suscetibilidade é apenas aplicada neste teste de despistagem inicial (Harada et al., 2008). O CLSI recomenda também uma despistagem inicial do crescimento em caldo contendo uma determinada concentração de cada um dos cinco β-lactâmicos de largo espetro do tipo oximino, sendo de igual modo, um resultado positivo, suspeito para a presença de ESBL e seguido de realização de testes fenotípicos confirmatórios (CLSI, 2011).
Tabela 2 – Critério inicial de despiste para evidenciação de produção de ESBL
Método de difusão em agar Método de diluição em caldo Antibiótico
(Concentração)
Resultados Halo de difusão do disco
(mm) Antibiótico (Concentração) Resultados Cefpodoxima 10 µg ≤17 mm Cefpodoxima 4 µg/ml Crescimento em concentrações iguais ou superiores às indicadas podem indicar presença de
produção de ESBL Ceftazidima 30 µg ≤22 mm Ceftazidima 1 µg/ml Aztreonamo 30 µg ≤27 mm Aztreonamo 1 µg/ml Cefotaxima 30 µg ≤27 mm Cefotaxima 1 µg/ml Ceftriaxona 30 µg ≤25 mm Ceftriaxona 1 µg/ml Adaptado de (CLSI, 2011).
Quando os testes de despistagem apresentam um resultado positivo, dando a indicação de que podemos estar na presença de uma estirpe produtora de ESBL é necessário fazer a sua confirmação usando dois testes: teste de aproximação de disco ou teste de duplo disco de Jarlier”, ou o teste de adição de ácido clavulânico.
1.7.1. Teste de aproximação de disco ou Teste de duplo disco de “Jarlier”
Um dos primeiros testes a ser descrito foi a aproximação do duplo disco e foi descrito por Jarlier e os seus colaboradores, o qual consiste em semear uma suspensão de 0,5 Mac Farland do isolado em estudo, numa placa de Mueller-Hinton agar (bioMérieux, Marcy l'Etoile, França), colocar um disco contendo amoxicilina/ácido clavulânico no centro e discos contendo antibióticos oximino-β-lactâmicos colocados a 30
mm (do centro de um disco ao centro do outro). Um aumento do halo de inibição do(s) oximino-β-lactâmico(s) causado pelo sinergismo do ácido clavulânico no disco da amoxicilina/ácido clavulânico é indicado como um resultado positivo, (Harada et al., 2008;Jarlier et al., 1988), como é exemplo a Figura 5, ou ainda a formação de uma terceira zona de inibição de crescimento designada por “ghost zone”. Este teste continua a ser confiável para a deteção de ESBL, no entanto, tem sido sugerido, que a sua sensibilidade pode ser aumentada, reduzindo a distância entre os discos para 20 mm (Thomson and Sanders, 1992;Tzelepi et al., 2000).
Figura 5 – Deteção de isolados produtores de ESBL pelo teste de aproximação de disco
ou teste de duplo disco de “Jarlier”. Discos de Amoxicilina/ácido clavulânico 20+10µg no centro, ceftazidima 30µg à esquerda e cefotaxima 30µg à direita (Livermore and Brown, 2001).
1.7.2. Teste de adição de ácido clavulânico
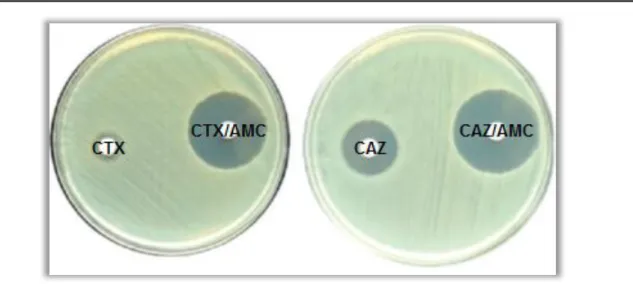
Este método consiste em adicionar ácido clavulânico, que é um inibidor de β-lactamases, a oximino-β-lactâmicos como a ceftazidima e a cefotaxima. A cada disco de ceftazidima (30 µg) e cefotaxima (30 µg), é combinado um disco extra ao qual são adicionados 10 µL de solução de ácido clavulânico (1000 µg/ml). Um aumento ≥5mm do halo de inibição dos discos de antibióticos adicionados de ácido clavulânico em comparação com o halo do disco somente com o antibiótico, indica um resultado positivo para a produção de ESBL (CLSI, 2011), como mostra a Figura 6.
Figura 6 ‒ Teste positivo de adição de ácido clavulânico à cefotaxima e ceftazidima.
(Harada et al., 2008)
1.7.3. Métodos automatizados
Existem vários sistemas comercializados para caraterização fenotípica de
Enterobacteriaceae, um dos quais é o Vitek 2 Compact (bioMérieux, Marcy l'Etoile,
França), que é um sistema automático que inclui deteção de ESBL. Este é uma nova ferramenta para a deteção rápida de ESBL, ao contrário do que se verifica nos métodos manuais, os quais são mais demorados e só permitem ter resultados 18 a 24 horas após a sua realização. O seu método é baseado na avaliação simultânea dos efeitos inibitórios da cefepime, cefotaxima e ceftazidima isoladamente e na presença de ácido clavulânico (Spanu et al., 2006).
1.8. Tratamento de infeções com isolados produtores de ESBL
Dado que os isolados produtores de ESBL têm a capacidade de hidrolisar vários antibióticos β-lactâmicos, a escolha de um antibiótico eficaz nas infeções por estes microrganismos é seriamente reduzida. Além deste facto, os plasmídeos que contêm os genes de codificam as ESBL, frequentemente contêm também genes que codificam resistência a aminoglicosídeos, trimetropim-sulfametoxazol e fluoroquinolonas (Kanj and Kanafani, 2011). Têm vindo a aumentar os casos reportados de plasmídeos que codificam a diminuição da suscetibilidade às quinolonas, frequentemente em associação com plasmídeos mediadores da resistência a cefalosporinas (Mammeri et al., 2005).
In vitro, os carbapenemos (imipenemo, meropenemo e ertapenemo) têm a
atividade mais consistente contra produtores de ESBL devido à estabilidade à hidrólise pelas mesmas. As cefamicinas também são estáveis à hidrólise, no entanto, os produtores de ESBL podem perder proteínas da sua membrana externa, levando assim à resistência às cefamicinas não relacionada com a produção de β-lactamases (Paterson and Bonomo, 2005).
As quinolonas também podem ser usadas no tratamento de infeções por estes isolados, no entanto, tem-se verificado um aumento da resistência in vitro dos produtores de ESBL às quinolonas, o que limita a função destes antibióticos no futuro (Endimiani et
al., 2004). Em estirpes produtoras de ESBL tem-se verificado elevada associação com
resistência à ciprofloxacina (Bradford, 2001).
Na tabela 3 está demonstrado um esquema de tratamento em casos de infeções por estirpes produtoras de ESBL. No entanto, ao longo do tempo este esquema de tratamento pode sofrer alterações visto que se tem vindo a verificar um aumento da resistência a quinolonas e carbapenemos nestas estirpes devido à expressão de vários mecanismos de resistência na mesma estirpe em simultâneo.
Tabela 3 – Tratamento recomendado para infeções com isolados produtores de ESBL
Tipo de infeção Terapia de escolha Terapia de segunda-linha
Infeção do trato urinário Quinolonas Amoxicilina/Ácido clavulânico
Bacteriemia Carbapenemos Quinolonas
Pneumonia adquirida em Hospital Carbapenemos Quinolonas
Infeção intra-abdominal Carbapenemos Quinolonas com metronidazol
Meningite Meropenemo Polimixina B intratecal
Adaptado de (Paterson and Bonomo, 2005).
Muitos autores têm sugerido o uso da combinação de β-lactâmicos com inibidores da β-lactamase no tratamento de infeções por bacilos Gram negativo, em vez do uso de cefalosporinas, podendo assim facilitar o controlo de estirpes produtoras de ESBL. No entanto, a eficácia deste tratamento pode ficar compremetida pelo facto dos microrganismos poderem apresentar múltiplas resistências (Rawat and Nair, 2010).
O grande objetivo deste trabalho foi alertar os laboratórios de análises clínicas para a necessidade de deteção de Enterobacteriaceae produtoras ESBL na sua rotina e o aumento de resistência a outros antibióticos aquando de infeções por estirpes produtoras de ESBL, e posterior informação ao clínico para melhorar a qualidade de vida do paciente e controlar a disseminação destas infeções comunitárias. Teve como objetivo alertar também os clínicos para a crescente colonização fecal em utentes de lares de idosos por
Enterobacteriaceae produtoras de ESBL.
Isolamento e identificação de Enterobacteriaceae produtoras de ESBL, em isolados urinários, provenientes de pacientes do ambulatório de um Laboratório de Análises Clínicas na região Noroeste do País entre os meses de Dezembro e Janeiro de 2012;
Determinação da prevalência de Enterobacteriaceae produtoras de ESBL na zona Norte onde se localizam os postos de colheita do Laboratório de Análises Clínicas;
Avaliação do perfil de suscetibilidade e resistência de Enterobacteriaceae produtoras de ESBL a antibióticos não-β-lactâmicos testados na rotina de um Laboratório de Análises Clínicas;
Comparação entre métodos manuais e automatizados na deteção de estirpes produtoras de ESBL;
Estudo da colonização fecal por Enterobacteriaceae produtoras de ESBL em utentes de lares de idosos numa região Noroeste do País;
3.1. Tratamento dos isolados urinários cedidos pelo Laboratório de Análises Clínicas
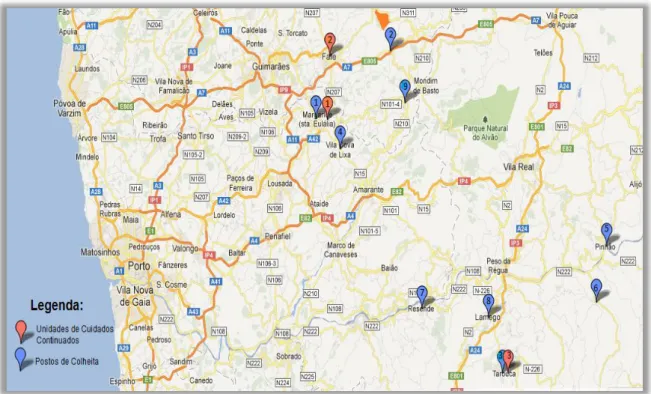
Durante os meses de Dezembro e Janeiro, foram cedidos isolados urinários de um Laboratório de Análises Clínicas da cidade de Fafe, para a realização deste trabalho. A área geográfica abrangida por este laboratório permitiu a recolha de isolados de diferentes pontos da zona nordeste do país como se pode visualizar na figura 7.
Figura 7 ‒ Localização dos postos de colheita do Laboratório de Análises Clínicas onde
foram obtidos isolados produtores de ESBL e Unidades de Cuidados Continuados próximas.
Legenda: 1 – Felgueiras; 2 – Fafe; 3 – Tarouca; 4 – Lixa; 5 – Pinhão; 6 – Tabuaço; 7 –
Resende; 8 – Lamego; 9 – Celorico de Basto
Foram também cedidas para este trabalho, amostras de fezes recolhidas em três lares de idosos pertencentes à Santa Casa da Misericórdia de Fafe, para posterior estudo da colonização fecal por Enterobacteriaceae produtoras de ESBL.
Os isolados urinários cedidos pelo Laboratório, eram Enterobacteriaceae produtoras de ESBL, previamente detetados por sementeira no meio de cultura usado na sua rotina, e identificação e antibiograma usando o sistema automático Vitek 2 Compact (bioMérieux, Marcy l'Etoile, França), sendo parte deste antibiograma confirmado
posteriormente por métodos manuais, segundo o método de difusão em agar de acordo com as indicações do CLSI, para a confirmação de produção de ESBL (CLSI, 2011).
Todos os isolados foram semeados em meio MacConkey para posterior confirmação pelo método de difusão em agar, da presença de ESBL, através da deteção de fenómenos de sinergismo entre oximino-β-lactâmicos em associação com a amoxicilina/ácido clavulânico.
Foram usados os seguintes discos β-lactâmicos segundo os critérios do CLSI 2011: Cefotaxima (30 µg), Amoxicilina (10 µg), Aztreonamo (30 µg), Cefepima (30 µg), Imipenemo (10 µg), Ceftazidima (30 µg), Cefoxitina (30 µg) e Amoxicilina/Ácido clavulânico (30 µg) colocado no centro da placa, sendo os restantes discos colocados a uma distância de aproximadamente 30 mm do disco de Amoxicilina/Ácido clavulânico, para possibilitar a visualização de fenómenos de sinergismo entre estes.
Posteriormente foram lidos todos os halos de inibição manualmente, tendo sido registadas todas as situações de sinergismo e diminuição do halo de suscetibilidade de modo a confirmar os resultados obtidos no Laboratório de Análises Clínicas no sistema automatizado.
Nos casos em que a interpretação suscitou dúvidas, foi realizado outro teste de confirmação indicado pelo CLSI 2011, o teste de adição de ácido clavulânico.
Neste teste, as estirpes que suscitaram dúvidas na interpretação dos resultados, foram semeadas em Mueller-Hinton segundo o método de difusão em agar, e testados os disco de cefotaxima e ceftazidima com e sem adição de ácido de clavulânico sendo incubadas a 37ºC durante 24 horas.
Posteriormente foram lidos os halos de inibição para cada um dos discos e naqueles em que se verificou um aumento ≥5 mm no disco em presença de ácido clavulânico, foi interpretado como resultado positivo para a presença de isolados produtores de ESBL.
De todos os isolados cedidos e confirmados foram realizadas alíquotas de 500 µl de caldo tripticase soja (Tryptic Soy Broth) com glicerol a 15% e congelados a -70ºC, caso seja necessária uma posterior utilização.
3.2. Tratamento de amostras cedidas pela Santa Casa da Misericórdia para pesquisa de colonização fecal por Enterobacteriaceae produtoras de ESBL
As amostras de fezes cedidas pela Santa Casa da Misericórdia tinham proveniência de três lares de idosos com diferentes localizações na cidade de Fafe, sendo estas, Fafe, Docim e Cepães, e foram colhidas aleatoriamente, apresentando assim diferentes idades, sexos, patologias e história clínica.
Foram cedidas, seis amostras do lar de Fafe, cinco amostras do lar de Docim e cinco amostras do lar de Cepães.
No tratamento destas amostras, realizou-se incubação em 40 ml de TSB (bioMérieux, Marcy l'Etoile, França) de uma noz de fezes, no dia da colheita das amostras, durante 24 horas a 37ºC.
Posteriormente foi realizado um teste inicial de despiste que consistiu na sementeira em cinco placas de meio de cultura MacConkey, seletivo para bacilos de Gram negativo. Numa das placas não foi adicionado qualquer antibiótico e as restantes foram adicionadas de antibióticos com o objetivo de selecionar isolados resistentes, 2 µg/ml de Ceftazidima, 2 µg/ml de Cefotaxima, 2 µg/ml de Aztreonamo e 0,25 µg/ml de Meropenemo com incubação durante 24 horas a 37ºC. A cada placa de cultura foram adicionados, pelo método de espalhamento, 100 µL de meio nutritivo TSB incubado com a amostra de fezes, com exceção do meio de cultura com adição de Meropenemo, ao qual foram adicionados 200 µL da suspensão.
Como controlo negativo do crescimento nos meios com adição de antibiótico, foi semeada também uma estirpe de E. coli ATCC 25922, sendo também semeada em MacConkey como controlo de crescimento.
Decorridas as 24 horas de incubação, procedeu-se à leitura e interpretação dos resultados. Nas placas com antibiótico que apresentaram crescimento de colónias, estas foram isoladas para os mesmos meios de cultura, sendo feito posteriormente o seu antibiograma pelo método de difusão em agar. Quando na leitura do antibiograma se verificou um resultado positivo para uma possível estirpe produtora de ESBL, foi realizado o teste confirmatório de adição de ácido clavulânico nos casos que apresentavam dúvidas no sinergismo, seguindo o procedimento anteriormente descrito para a confirmação dos isolados produtores de ESBL sugerido pelo CLSI.
De algumas estirpes confirmadas como produtoras ESBL foram realizadas identificações utilizando a galeria ID 32 GN (bioMérieux, Marcy l'Etoile, França), e em alguns casos foram realizados testes bioquímicos como o meio de citrato de Simmons e meio SIM.
4.1. Resultados dos isolados urinários cedidos pelo Laboratório de Análises Clínicas
De 289 amostras urinárias recebidas pelo Laboratório de Análises Clínicas, que foram positivas para infeção urinária, 211 (73%) desses isolados urinários eram
Enterobacteriaceae e 14 (6,6%) dessas Enterobacteriaceae eram produtoras de ESBL,
sendo posteriormente confirmadas pelos métodos manuais.
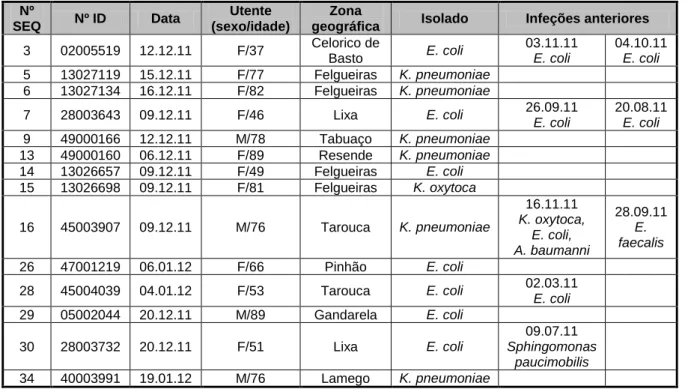
Na Tabela 4 estão descritos esses isolados urinários positivos para a produção de ESBL, caracterizando-os no que diz respeito à idade, sexo, zona geográfica e infeções anteriores do doente.
Tabela 4 – Isolados urinários produtores de ESBL
Nº
SEQ Nº ID Data
Utente (sexo/idade)
Zona
geográfica Isolado Infeções anteriores
3 02005519 12.12.11 F/37 Celorico de Basto E. coli 03.11.11 E. coli 04.10.11 E. coli 5 13027119 15.12.11 F/77 Felgueiras K. pneumoniae 6 13027134 16.12.11 F/82 Felgueiras K. pneumoniae 7 28003643 09.12.11 F/46 Lixa E. coli 26.09.11 E. coli 20.08.11 E. coli 9 49000166 12.12.11 M/78 Tabuaço K. pneumoniae 13 49000160 06.12.11 F/89 Resende K. pneumoniae 14 13026657 09.12.11 F/49 Felgueiras E. coli 15 13026698 09.12.11 F/81 Felgueiras K. oxytoca 16 45003907 09.12.11 M/76 Tarouca K. pneumoniae 16.11.11 K. oxytoca, E. coli, A. baumanni 28.09.11 E. faecalis 26 47001219 06.01.12 F/66 Pinhão E. coli 28 45004039 04.01.12 F/53 Tarouca E. coli 02.03.11 E. coli 29 05002044 20.12.11 M/89 Gandarela E. coli 30 28003732 20.12.11 F/51 Lixa E. coli 09.07.11 Sphingomonas paucimobilis 34 40003991 19.01.12 M/76 Lamego K. pneumoniae
Das 14 estirpes produtoras de ESBL dos isolados urinários, 7 isolados (50%) eram Escherichia coli, 6 isolados (42,9%) eram Klebsiella pneumoniae e 1 isolado (7,1%) era Klebsiella oxytoca, como é demonstrado na Figura 8.
Figura 8 ‒ Repartição dos isolados de Enterobacteriaceae produtores de ESBL.
Houve isolados que na confirmação pelo método de difusão em agar, apresentaram sinergismo como mostra a Figura 8, entre a amoxicilina/ácido clavulânico e a cefotaxima (11 isolados – 78,6%), ceftazidima (2 isolados – 14,3%) e aztreonamo (1 isolado 7,1%).
Figura 9 ‒ Amostra 3 do Laboratório. Exemplo de um isolado urinário com manifestação
de sinergismo entre amoxicilina/ácido clavulânico e cefotaxima.
Na tabela 5 estão descritos os perfis de suscetibilidade dos isolados produtores de ESBL para alguns antibióticos β-lactâmicos e não β-lactâmicos, com base
E. coli 50% K.pneumoniae 43% K.oxytoca 7%
nos resultados obtidos pelo sistema automatizado Vitek 2 Compact (bioMérieux, Marcy l'Etoile, França).
Tabela 5 – Perfil de suscetibilidade aos antibióticos dos isolados produtores de ESBL
testados pelo sistema automatizado Vitek 2 Compact (bioMérieux, Marcy l'Etoile, França) Nº
SEQ Nº ID Estirpe AMC FOX CTX CAZ FEP MER CIP NOR F SXT GEN
3 02005519 E. coli S S I I I S S S S S S 5 13027119 K. pneumoniae I S R I I S R R I R R 6 13027134 K. pneumoniae R R S I S S S S R R S 7 28003643 E. coli I S I I I S R R S R S 9 49000166 K. pneumoniae I S R R I S R R R R S 13 49000160 K. pneumoniae R S R R R S R R S R R 14 13026657 E. coli R R R R S S S S S S S 15 13026698 K. oxytoca R I I I I S R R S S R 16 45003907 K. pneumoniae R R S I S S R R R R S 26 47001219 E. coli I S R I I S R R S S R 28 45004039 E. coli I S R I I S R R S S S 29 05002044 E. coli I I I I I S R R S R S 30 28003732 E. coli I S R I I S R R S S S 34 40003991 K. pneumoniae I S I R I S R R R R S
Legenda: S – Sensível (cor verde); R – Resistente (cor vermelha); I – Intermédio (cor
azul); AMC ‒ Amoxicilina/Ácido clavulânico; FOX ‒ Cefoxitina; CTX ‒ Cefotaxima; CAZ ‒ Ceftazidima; FEP ‒ Cefepima; MER ‒ Meropenemo; CIP – Ciprofloxacina; NOR ‒ Norfloxacina; F – Nitrofurantoína; SXT ‒ Trimetropim-sulfametoxazol; GEN ‒ Gentamicina.
Destas 14 estirpes, no que diz respeito à resistência a quinolonas, 11 (78,6%) apresentaram resistência à ciprofloxacina e 11 (78,6%) à norfloxacina.
Todas as estirpes apresentaram sensibilidade ao carbapenemo testado, Meropenemo.
Como está representado na figura 10, a repartição das 14 estirpes que apresentaram resistência a um ou mais antibióticos não β-lactâmicos foi a seguinte: ciprofloxacina (78,6%), norfloxacina (78,6%), trimetropim-sulfametoxazol (57,1%), nitrofurantoína (28,6%) e gentamicina (28,6%).
Figura 10 ‒ Percentagem de resistência a antibióticos não β-lactâmicos nos isolados urinários.
4.2. Resultados obtidos das amostras de fezes cedidas pela Santa Casa da Misericórdia para estudo da colonização fecal
As amostras cedidas pela Santa Casa da Misericórdia tinham proveniência de três lares de idosos diferentes, Fafe, Cepães e Docim e foram colhidas de forma aleatória. Na tabela 6 esquematizamos as amostras quanto ao número de amostra atribuído, lar de proveniência, a idade dos utentes e informação sobre internamentos anteriores.
Tabela 6 – Dados relativos aos utentes do Lar de idosos (idade, lar, e internamentos
anteriores)
Nº Amostra Idade Lar Internamentos anteriores
1 96 Fafe 1 Internamento 2 89 Fafe 2 Internamento 3 84 Fafe S/ Informação 4 94 Fafe 1 Internamento 5 64 Fafe 1 Internamento 6 95 Fafe 1 Internamento
11 74 Docim Sem Internamentos
12 79 Docim Sem Internamentos
13 73 Docim 1 Internamento
14 78 Docim 1 Internamento
15 83 Docim 1 Internamento
16 69 Cepães 1 Internamento
17 82 Cepães Sem internamentos
18 88 Cepães 1 Internamento 19 85 Cepães 1 Internamento 20 77 Cepães 1 Internamento 28,6% 28,6% 57,1% 78,6% 78,6%
Das 16 amostras de fezes estudadas foram obtidos isolados de
Enterobacteriaceae em meios de cultura MacConkey e MacConkey adicionados de
antibióticos conforme o exemplo indicado na figura 10 para a amostra 1 dos lares de idosos.
Figura 11 ‒ Estudo do crescimento de Enterobacteriaceae produtoras de ESBL em
meios de cultura.
Legenda: MCK – MacConkey; MER – MacConkey adicionado de 0,25 µg/ml de
Meropenemo; AZT – MacConkey adicionado de 2 µg/ml de Aztreonamo; CAZ – MacConkey adicionado de 2 µg/ml de Ceftazidima; CTX – MacConkey adicionado de 2 µg/ml de Cefotaxima.
Tabela 7 – Seleção de Enterobacteriaceae produtoras de ESBL
Nº
SEQ MCK CAZ AZT CTX MERO ESBL
Sinergis mo Δ Clav (mm) Isolado 1 FA L+ L+ L+ L+ L+ 2 FA L+ L+ L+/L- L+/L- L- 3 FA L+ L+ L+ L+ L- ESBL+(L+) ≥5:CTX L- P. aeruginosa L+ E. coli
4 FA L+ L+ L+ L- Ø ESBL+ ≥5:CAZ E. coli
5 FA L+ L+ L+ L+ Ø ESBL+ ≥5:CTX Klebsiella spp.
6 FA L+ L- Ø L- Ø
11 FA L+ L- S/ placa L- L+ ESBL+ AMC/CAZ E. coli
12 FA L+ Ø S/ placa Ø Ø 13 FA L+ L+ S/ placa L- L- 14 FA L+ Ø S/ placa Ø S/ placa 15 FA L+ Ø Ø Ø Ø 16 FA L+ Ø L- L- L- 17 FA L+ Ø Ø L- Ø ≤5:CAZ 18 FA L+ L+ L+ L+ Ø ≤5:CAZ 19 FA L+ L- L- L- Ø
20 FA L+ L+ L+ L+ Ø ESBL+ ≥5:CAZ Klebsiella spp.
Legenda: MCK – MacConkey; MER – MacConkey adicionado de 0,25 µg/ml de
Meropenemo; AZT – MacConkey adicionado de 2 µg/ml de Aztreonamo; CAZ – MacConkey adicionado de 2 µg/ml de Ceftazidima; CTX – MacConkey adicionado de 2 µg/ml de Cefotaxima; ESBL – β-lactamase de espetro alargado; L+ - crescimento de colónia(s) lactose positiva; L- crescimento de colónia(s) lactose negativa; Ø – ausência de crescimento; FA – crescimento de flora abundante; Δ Clav(mm) -Diferença de halos de inibição no teste de adição de ácido clavulânico.
Das amostras de fezes dos lares de idosos previamente colocadas em caldo TSB durante 24 horas, foram realizadas sementeiras nos meios indicados na Figura 11, tendo sido obtidos em algumas amostras, isolados fermentadores de lactose, os quais foram o nosso objeto de estudo. Destes isolados foram realizados antibiogramas pelo método de difusão em agar com os resultados de perfil de suscetibilidade inidicados na Tabela 7.
Tabela 8 ‒ Perfil de suscetibilidade aos antibióticos beta-lactâmicos dos isolados obtidos
no estudo da colonização fecal de idosos Nº
SEQ AMC CTX FOX CAZ FEP IMP AZT AML ETP
1 R R I R S S S R R 2 R R I R S S S R - 3 R R I R R S R R - 4 R R I R S S S R - 5 R R I R S S R R - 11 R R I R I S S R - 18 R R R R S S S R - 20 R I I R S S S R -
Legenda: S – Sensível (cor verde); R – Resistente (cor vermelha); I – Intermédio (cor
azul); (-) ‒ Sem resultado; AMC ‒ Amoxicilina/Ácido clavulânico; CTX ‒ Cefotaxima; FOX ‒ Cefoxitina;; CAZ ‒ Ceftazidima; FEP ‒ Cefepima; IMP ‒ Imipenemo; AZT ‒ Aztreonamo; AML ‒ Amoxicilina; ETP ‒ Ertapenemo
Das amostras de fezes cedidas pela Santa Casa da Misericórdia, 5 foram positivas para a pesquisa de colonização fecal por Enterobacteriaceae produtoras de ESBL.
A amostra 1, produtora de ESBL, apresentou resistência a carbapenemos (Ertapenemo).
No teste confirmatório de adição de ácido clavulânico realizado para alguns isolados, verificou-se que 2 foram positivos para cefotaxima e 2 foram positivos para ceftazidima, como é o exemplo da Figura 12.
Figura 12 ‒ Amostra 4 do lar de Fafe positiva para o teste confirmatório de adição de ácido clavulânico à ceftazidima.
A amostra 15 não obteve crescimento em placas de MacConkey com adição de antibióticos;
Mesmo não sendo um dos objetivos deste trabalho, é de salientar que as amostras 4, 6 e 19 apresentaram uma cultura lactose negativa, que após isolamento em mesmo meio de cultura no qual obteve crescimento, apresentou resultado positivo para a oxidase, e na realização do teste de difusão em agar demonstraram resistência às cefalosporinas de 3ª geração e sensibilidade ao carbapenemo estudado (Imipenemo).
A amostra 13 apresentou uma cultura lactose negativa, que posteriormente, na realização do teste de difusão em agar demonstrou resistência ao carbapenemo estudado (Imipenemo).
Através da confirmação dos resultados apresentados pelo sistema automatizado Vitek 2 Compact (bioMérieux, Marcy l'Etoile, França) usando métodos manuais (método de difusão em disco de “Jarlier” e teste de adição de ácido clavulânico), podemos verificar que os resultados apresentados para os isolados urinários foram todos confirmados como sendo estirpes produtoras de ESBL e deste modo podemos usar este sistema automatizado como um sistema fiável para a deteção de ESBL.
Entre os isolados produtores de ESBL verificou-se uma elevada percentagem de isolados resistentes in vitro às quinolonas, sendo 78,6% dos isolados resistentes à ciprofloxacina e 71,4% resistentes à norfloxacina. Assim, futuramente, é possível que o uso de quinolonas no tratamento de infeções por estirpes produtoras de ESBL seja limitado, visto que começam a apresentar elevada percentagem de resistência neste tipo de isolados.
Os isolados urinários 5, 9, 13, 16 e 34 são considerados estirpes multirresistentes apresentando resistência a várias famílias de antibióticos, como por exemplo às quinolonas (ciprofloxacina e norfloxacina), embora os padrões de resistência sejam diferentes e como tal, o tratamento definido pelo clínico possa consistir em antibióticos diferentes. No que diz respeito às sensibilidades a antibióticos não β-lactâmicos destas amostras, a amostra 5 apresenta sensibilidade ao meropenemo, as amostras 9, 16 e 34 apresentam sensibilidade à gentamicina e a amostra 13, também multirresistente, apresenta sensibilidade à nitrofurantoína, que é um antibiótico usado para tratamento de infeções urinárias não complicadas.
Neste estudo verificou-se elevada sensibilidade à gentamicina e elevada resistência ao ao trimetropim-sulfametoxazol (˃50%).
A maioria dos isolados urinários produtores de ESBL cedidos pelo Laboratório de Análises Clínicas são provenientes de utentes com idade avançada. Isto demonstra que estes utentes são mais propensos a infeções deste género pelo facto de estarem mais expostos a vários fatores de risco como internamentos, uso exacerbado de antibióticos e algumas patologias.
Na figura 7 podemos verificar pela distribuição geográfica dos postos de colheitas de onde foram provenientes os isolados urinários, que estão localizadas na sua proximidade, as Unidades de Cuidados Continuados (UCC) de Fafe, Felgueiras e Tarouca, o que leva a crer que alguns destes isolados possam ser de utentes com internamentos anteriores ou atuais nestas UCC.