Stricto Sensu em Ciências Genômicas e Biotecnologia
PRODUÇÃO, PURIFICAÇÃO E CARACTERIZAÇÃO DA
ATIVIDADE PROTEOLÍTICA PRODUZIDA POR
Trichoderma
harzianum
Brasília - DF
2011
PRODUÇÃO, PURIFICAÇÃO E CARACTERIZAÇÃO DA ATIVIDADE PROTEOLÍTICA PRODUZIDA POR Trichoderma harzianum
Dissertação apresentada ao Programa de Pós- Graduação Stricto Sensu em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito parcial para a obtenção do Título de Mestre.
Orientadora: Drª. Eliane Ferreira Noronha.
Ficha elaborada pela Biblioteca Pós-Graduação da UCB P436p Pereira, Fernanda Fumie Onoyama
Produção, purificação e caracterização da atividade proteolítica produzida por Trichoderma harzianum. / Fernanda Fumie Onoyama Pereira – 2011.
72f. : il. ; 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2011. Orientação: Eliane Ferreira Noronha
1. Enzimologia 2. Controle biológico. 3. Fungos fitopatogênicos . 4. Biotecnologia. I. Noronha, Eliane Ferreira, orient. II. Título.
Pai, obrigada pela vida, por possibilitar cada detalhe que ocorreu durante esse mestrado, seja tanto para o meu crescimento pessoal, quanto para o meu desenvolvimento intelectual.
Sou grata à minha família, principalmente aos meus pais e irmãs, que acompanham e participam desde sempre do meu processo de formação.
Agradeço ao CNPq pelo suporte financeiro concedido a este projeto.
À Universidade Católica de Brasília (UCB), ao Laboratório do Centro de Análises e Proteômicas e Bioquímica (CAPB) e a Universidade de Brasília (UnB) pela oportunidade de vivenciar experiências únicas, por conviver com pessoas de extremo profissionalismo e tornar a realização deste trabalho possível.
Ao Dr. Cirano José Ulhoa, Dr. Robert Neil Gerard Miller por cederem parte do material utilizado no projeto, pelos conselhos, pelas amostras colhidas e informações cedidas.
À Drª Betânia Ferraz Quirino e Dr. Octávio Luiz Franco por acompanhar o desenvolvimento deste projeto, bem como por todas as sugestões durante e depois da qualificação.
Ao Dr. Carlos Bloch Junior, pela infra-estrutura e equipamento em análise em espectrometria de massa.
Ao André Melro Murad e Jackeline Leite Pereira pelas análises em espectrometria de massa.
Evidentemente sou grata à minha orientadora Eliane Ferreira Noronha pela paciência, atenção e dedicação de tempo ao supervisionar este projeto, assim como esclarecer sobre os procedimentos adotados. E também por ter apostado no progresso do nosso trabalho.
Amigos em ordem alfabética: Ana, Betty, Ben, Cris, Dani & Ale/ Lida do Lido & TOP Jóinha, Dica & Gersão/ Jack & Jane, Dud’s, Ísis, Ka, Kêu, Line, as Lu’s da minha vida, Mari, Si, ThaBaTatinha,Juju & Thata (Nicole), Vivis e aos queridos que intercessores desta causa, obrigada pela generosidade, carinho, apoio e compreensão!
bem como aos docentes e companheiros da turma de mestrado em Ciências Genômicas e Biotecnologia da UCB. Dentre essas preciosidades não poderia deixar de realçar/ enfatizar minha gratidão aos que me auxiliaram em diversas circunstâncias, não somente em bons momentos como também nas horas de aperto, em ordem alfabética:
Prof.Dr. Carlos Roberto Félix, por se preocupar e pelo seu exemplo! Cris, Sônia Cristina Jacomini Dias
Elizabete de Souza Cândido
Gilvan Caetano Duarte e sua digníssima esposa, minha xará, Fernanda.
Jack, Jackeline Leite Pereira principalmente pela contínua disponibilização de seu tempo e conhecimentos.
Idacuy Pereira Mundim Ísis Souza
Ivanilde
Luciana Albuquerque
Luciana Aparecida Bernardes Luiz Eduardo da Silva Araújo Margarete Gomes da Silva Lima Marísia Ferreira Côrtes
Mirian Luiza da Silva Pacheco, “... Até aqui nos ajudou o Senhor”(I Samuel 7:12). Osmar Nascimento
Simone Maria Neto Thaís Bergamin Lima
Prof. Tatsuya Nagata, pela preocupação e cuidado. Vanessa Oliveira Leitão
Muito obrigada! Tenham certeza de que todo empenho, conselhos, prestatividade, atenção, dedicação de cada um de vocês foram extremamente importante e inúmeras vezes essencial.
ABSTRACT
1.INTRODUÇÃO ...05
1.1. O fitopatógeno de solo Fusarium oxysporum...06
1.2. Controle biológico...08
1.3. Fungos do gênero Trichoderma: agentes de biocontrole de fungos fitopatogênicos ...12
1.3.1 Mecanismos de biocontrole por Trichoderma spp. ...13
1.4. Micoparasitismo ...15
1.5. Hidrolases de parede celular fúngica ...16
1.6. Proteases ...19
1.6.1. Classificação ...19
1.6.2. Papel no micoparasitismo ...23
2.JUSTIFICATIVA ...25
3. OBJETIVO GERAL ...26
3.1. Objetivos específicos ...26
4. MATERIAL E MÉTODOS ...27
4.1. Microrganismos utilizados ...27
4.2. Produção de micélio de F. oxysporum ...27
4.3. Indução da produção de atividade hidrolítica pelos isolados de T. harzianum ...28
4.4. Análise da atividade proteolítica em gel de poliacrilamida (zimograma) .28 4.5. Indução da produção de atividades de hidrolases de parede celular fúngica pelo isolado ALL 49 ...29
4.5.1. Determinação da atividade proteolítica ...29
4.5.2. Dosagem de atividade de β-1,3-glicanases ...30
4.5.3. Dosagem de atividade de quitinases...30
4.5.4. Dosagem de atividade de N-acetil-glicosaminidase...30
4.6. Quantificação de proteínas ...31
4.7. Purificação da enzima de interesse...31
4.8. Análise do grau de pureza...32
4.9. Análise em espectometria de massa em Matrix Assisted Laser Desorption Ionizated Time of Flight-Time of Flight (MALDI-TOF/TOF) ...32
4.9.1. Preparo da amostra ...32
4.9.2. Seqüenciamento da peptidase purificada ...33
4.10. Caracterização parcial da atividade proteolítica ...33
4.10.1Avaliação do efeito de temperatura...33
4.10.2 Termoestabilidade ...34
5. RESULTADOS ...35
6. DISCUSSÃO ...45
7. CONCLUSÕES ...51
8. PERSPECTIVAS ...52
"Quanto mais estudo a natureza, mais fico maravilhado com os feitos do Criador. Nas menores de suas criaturas Deus colocou propriedades extraordinárias... Um pouco de ciência nos afasta de Deus. Muito, nos aproxima”.
Louis Pasteur, Microbiologista.
"Ainda que conhecesse todos os mistérios e toda a ciência (...) e não tivesse AMOR, eu não seria nada”.
A ação antagônica deste fungo ocorre principalmente pelo mecanismo denominado micoparasitismo que ocorre em várias etapas, iniciando pelo contato micoparasita-hospedeiro e culminando com a invasão da hifa hospedeira. A invasão da hifa hospedeira depende da secreção de hidrolases de parede celular fúngica: as quitinases, -1,3-glicanases e proteases isso tem sido sugerido pois desempenham um papel significativo no micoparasitismo de T. harzianum. Neste trabalho 15
isolados de T. harzianum obtidos de solos de Cerrado da Região Centro-Oeste, com
uso potencial como agentes de biocontrole contra o fungo Fusarium oxysporum
foram avaliados quanto à produção de proteases, tendo como objetivo a purificação e caracterização de proteases com papel na atividade antagônica do fungo micoparasita T. harzianum. Os isolados quando cultivados em meio de cultura
contendo o micélio de F. oxysporum como fonte de carbono secretaram atividade
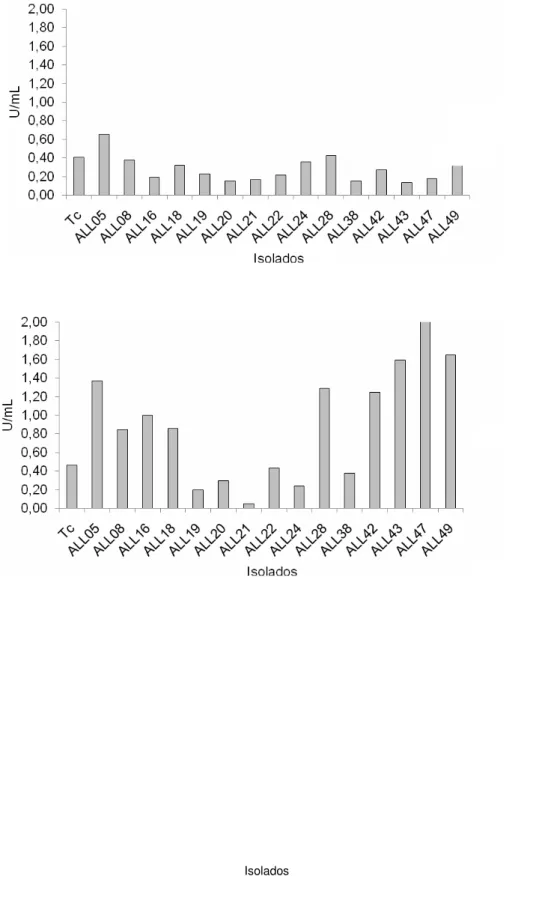
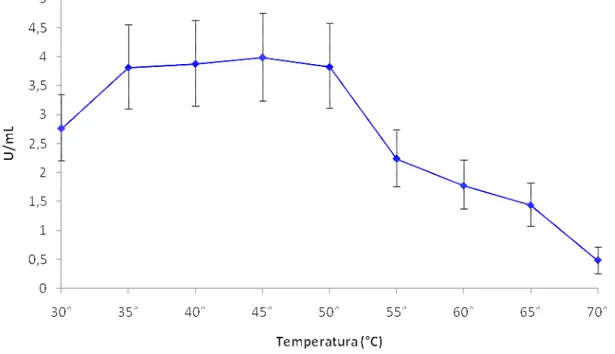
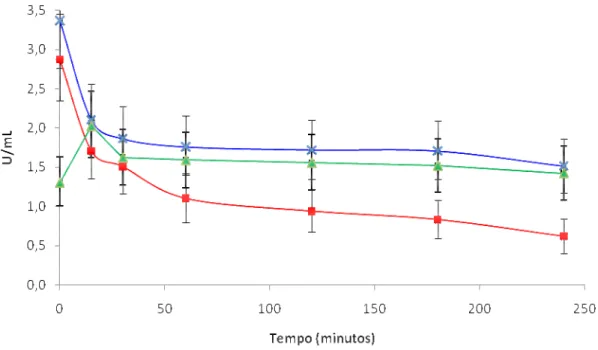
proteolítica. Os maiores valores de atividade proteolítica alcalina (pH 8,0) foram detectados para os isolados ALL 49 (1,99 U / mL), 28 (1,60 U / mL) e 05 (1,19 U / mL) e atividade proteolítica ácida para ALL-05 (0,66 U / mL), 49 (0,47 U / mL), 28 (0,43 U / mL). Isoformas de proteases alcalinas foram detectados para os 14 isolados que apresentaram atividade proteolítica alcalina. Os isolados Tc, ALL 24 e 38 secretaram mais de uma forma de protease e o isolado ALL 20 apresentou duas isoformas não detectadas para os demais. O isolado 49 que apresentou maiores valores significativos das atividades proteolítica e antagônicos, produz uma isoforma da enzima, quitinases (0,007 x x10-2 U / mL), β-1 ,3-glucanases (1,88 x x10-2 U / mL ) e N-acetilglicosaminidases (4,28 x x10-2 U / mL), respectivamente. Esse isolado foi selecionado para os experimentos seguintes de purificação e caracterização parcial da atividade proteolítica. Esta atividade apresentou temperatura ótima de 35-50 ºC, um pH ótimo de 8,0 e retenção de 45% e 21% da atividade residual após pré-incubação a 45 e 50°C, respectivamente. Uma protea se alcalina secretada pelo isolado ALL 49 (TALP) desenvolvida em meio líquido contendo micélio de
F.oxysprum foi purificada utilizando dois passos cromatográficos em colunas de fenil
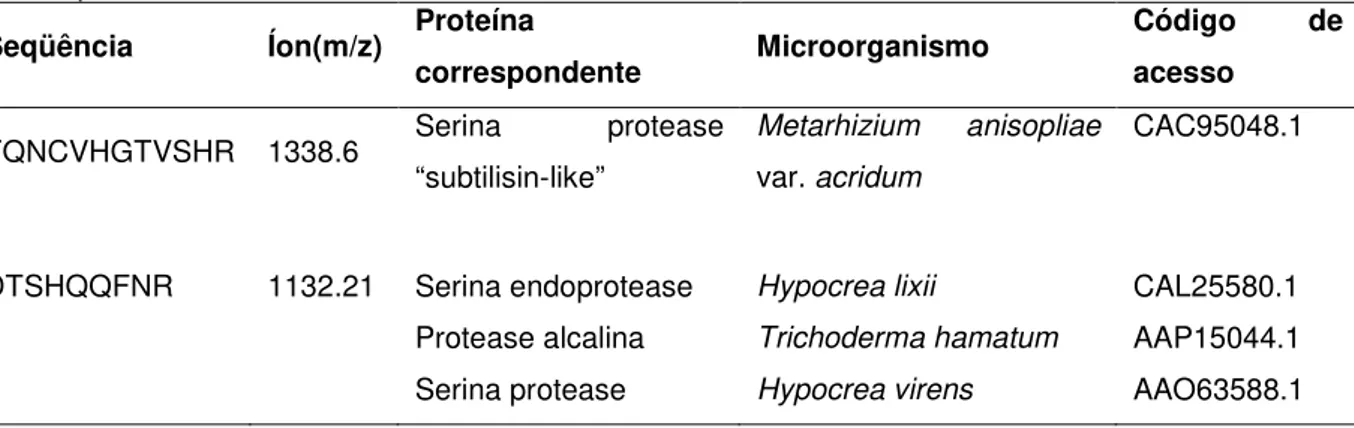
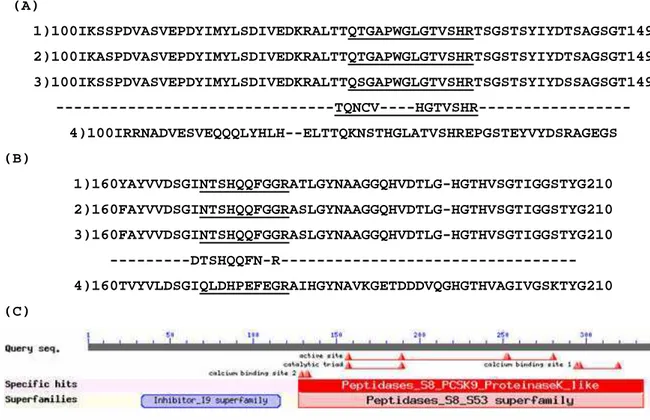
sefarose e SP-sefarose e possui massa molecular estimada de 29 kDa. As seqüências obtidas apresentaram identidade com seqüências de serina proteases tipo subtilisina (DTSHQQFNR) de Hypocrea lixii, Trichoderma hamatum e Hypocrea virens.
application as a biocontrol agent against phytopathogenic fungi. The Trichoderma´s antagonism is carried out by a combination of strategies. The antagonistic action of this fungus occurs mainly through a mechanism called mycoparasitism, which occurs in sequential events, initiated by the contact mycoparasite-host and culminated with the host’s hypha invasion and colonization. The host hyphae invasion is facilitated by the degradation of the fungal cell wall, therefore the chitinases, β- 1,3-glucanases and proteases have been suggested to play significant role in the T. harzianum
mycoparasitism. In the present study, 15 isolates of T. harzianum obtained from
Cerrado soils of the Midwest Region with potential use as biocontrol agents against the fungus Fusarium oxysporum were assessed for protease production, aiming the
purification and characterization of proteases with role in the antagonistic activity of the mycoparasite fungus T. harzianum. The isolates were able to produce proteolytic
activities when grown in liquid culture medium containing mycelium of F. oxysporum
as a unique carbon source. The highest values of alkaline proteolytic activity (pH 8.0) were detected for the isolates ALL-49 (1.99 U / mL), 28 (1.60 U / mL) and 05 (1.19 U /mL); and acidic proteolytic activity for ALL-05 (0.66 U / mL), 49 (0.47 U / mL), 28 (0.43 U / mL). Isoforms of alkaline proteases were detected for the 14 isolates that showed alkaline proteolytic activity. The isolates Tc, ALL 24 and 38 secreted two forms of proteases and ALL 20 showed two isoforms that have not been detected to the others. The isolate ALL 49 with the highest significantly values of proteolytic and antagonistic activities, produce one isoform of this enzyme, chitinases (0.007 x 10-2 U / mL), β-1,3-glucanases (1.88 x 10-2 U / mL) and N-acetilglicosaminidases (4.28 x 10-2
U / mL), respectively. This isolate was selected for furthers experiments including purification and partial characterization of the proteolytic activity. This activity has a temperature optimum of 35-50ºC, a pH optimum of 8,0 and retaining 45% and 21% of the residual activity after pre-incubation at 45 and 50oC, respectively. An alkaline protease (TALP) produced by the isolate growing on liquid medium containing F. oxysporum mycelium as unique carbon source was purified using two
chromatographic steps on phenyl Sepharose and SP-sepharose and has a molecular mass of 29 kDa. It had higher identities and a closer relation to the antifungal serine subtilisin-like (DTSHQQFNR) of Hypocrea lixii, Trichoderma hamatum and Hypocrea virens.
1. INTRODUÇÃO
Doenças de plantas causadas por fungos são responsáveis por perdas severas em culturas de importância econômica em todo o mundo (BERGAMIM – FILHO et al., 1995; LARANJEIRA, 2001). Grande parte da perda em lavouras no Brasil e no mundo atribui-se aos fungos fitopatogênicos “de solo”, sendo que, anualmente milhões de dólares são gastos no seu controle (OARD et al., 2004). Os
fitopatógenos de solo são parasitas não-especializados, geralmente saprófitas, que apresentam capacidade de colonizar resíduos vegetais no solo, bem como de infectar diferentes tipos de culturas (MELO & AZEVEDO, 2000). No Brasil, infecções causadas por patógenos “de solo” como Fusarium oxysporum f.sp. phaseoli, Sclerotium rolfsii e Rhizoctonia solani, causam perdas de até 100% na produção de
culturas suscetíveis, principalmente feijão e batata, cultivadas nos Cerrados e outras regiões (CAFÉ FILHO & LOBO JR., 2000; HALL & NASSER, 1996), e são amplamente reconhecidas como um dos maiores desafios para a agricultura brasileira (LOBO JR., 2002).
As medidas mundialmente utilizadas de controle destes patógenos ainda são as práticas agrícolas tradicionais, que incluem queimadas para eliminar o excesso de resíduos pós-colheita, drenagem do solo, tratamento térmico da água, solarização, rotação de culturas e aplicação de fungicidas (MELO & AZEVEDO, 2000). Estas medidas não são totalmente eficientes, principalmente em função da elevada taxa de sobrevivência de formas resistentes dos patógenos de solo em condições ambientais adversas, além da sua permanência em outras plantas hospedeiras que podem funcionar como reservatórios (YANGUI et al., 2008).
O controle por aplicação de fungicidas, apesar de ser relativamente eficiente é um processo oneroso, uma vez que requer repetidas aplicações, bem como pode levar à seleção de patógenos resistentes e ao surgimento de pragas secundárias (PIRES et al., 2003). Além disso, os produtos químicos utilizados são tóxicos e poluentes, e desta forma tem efeito negativo sobre o meio ambiente e comprometem a saúde dos produtores agrícolas e consumidores (PUNJA & UTKHEDE, 2003). Outra desvantagem no uso de fungicidas está relacionada à sua inespecificidade, podendo eliminar microrganismos já estabelecidos no solo e benéficos às plantas, aumentando assim sua suscetibilidade aos patógenos de solo (PIRES et al., 2003).
pela necessidade de desenvolvimento de métodos de controle mais eficientes, surgiu a demanda por novas estratégias neste controle. Isso para que o aumento na produtividade agrícola não dependa da utilização de medidas que acarretem em danos ambientais e riscos à saúde humana. (FRIGHETTO, 2000).
O controle biológico é uma destas alternativas, sendo que o uso de formulados à base de microrganismos biocontroladores tem aumentado. No entanto, seu uso ainda é restrito quando comparado ao de fungicidas químicos, devido à relação custo/benefício que os mesmos representam em curto prazo (FRAVEL, 2005). Estudos com microrganismos biocontroladores têm descrito também a possibilidade de sua utilização na identificação de genes de resistência a patógenos e de resposta de defesa em plantas hospedeiras, e desta forma, podem também contribuir para o desenvolvimento de cultivares agrícolas resistentes a doenças fúngicas (PUNJA & UTKHEDE, 2003; FRANCHESCHINI et al., 2001).
1.1. O fitopatógeno de solo Fusarium oxysporum
O gênero Fusarium, classificado como Hifomiceto, da ordem Moniliales,
família Tuberculariaceae apresenta amplas distribuições geográficas, ocorrendo em quase todos os ambientes, como espécies cosmopolitas e outras com ocorrência restrita a determinados sítios (ALEXOPOULOS et al., 1996 apud PEREIRA, 2007). Este gênero apresenta dois tipos principais de esporos: microconídios unicelulares e macroconídios multicelulares. Algumas espécies podem persistir como clamidósporos ou como hifas enquanto outras produzem apenas conídios (VENTURA, 1999). Fungos deste gênero têm sido relatados como pátogenos de plantas, contaminantes de alimentos e produtores de micotoxinas que acarretam doenças em humanos e animais de relevância pecuária, o que tem reforçado os estudos de novos agentes antifúngicos contra isolados de Fusarium (NICOLAISEN
et al, 2008). Dentre as principais culturas que este gênero infecta, reduzindo a sua
produtividade, se destacam a cultura do trigo por F. graminearum (ANGELOTTI,
2006); milho por F. moniliforme (CARVALHO et al., 1993); banana por F. oxysporum
f.sp. cubense (ARAUJO et al., 2004); feijão por F. oxysporum f.sp. phaseoli; cana de
açúcar por F. culmorum (SEMPERE & SANTAMARINA, 2010). A espécie F. oxysporum é uma das mais importantes economicamente devido à sua diversidade
saprófita cosmopolita, comum em solo, importante patógeno responsável por causar murcha vascular, também conhecida como murcha de fusário ou fusariose, em diferentes espécies vegetais em todo o mundo, incluindo culturas de interesse econômico (LESLIE & SUMMERELL, 2006; ETHUR, 2006) (Tabela 1). Os isolados de F.oxysporum apresentam especificidade a hospedeiros distintos e formas
especiais com diferenças de patogenicidade em relação a hospedeiros específicos, o que culminou na subdivisão em formae speciales (f. sp.) (SNYDER & HANSEN,
1940). De acordo com Baayen et al. 2000, mais de 150 formas específicas de F. oxysporum ao hospedeiro já foram descritas.
Tabela 1. Formas especiais de F. oxysporum e culturas afetadas.
Forma especial
F.oxysporum Cultura afetada Fonte
F.oxysporum f.sp. basilici
Agente causador da principal doença do
manjericão(Ocimum basilicum) REIS e BOITEUX, 2006
F.oxysporum f.sp. cubense
Agente causador da murcha-da-bananeira identificado em 1920, na região de Piracicaba-SP. Este fungo provocou a erradicação das variedades banana-maçã e banana-terra em todo o Estado de São Paulo
ARAUJO et al., 2004
F.oxysporum f.sp.
herbemontis
Videiras (Vitis spp.)
In:
http://www.mda.gov.br/saf/arquivos /0806509627.pdf
F.oxysporum f.sp. lycopersici
Tomateiro (Lycopersiconesculentum) SILVA et al., 2008
F.oxysporum
f.sp. phaseoli Phaseolus vugaris (feijoeiro comum) ITO, 2005
F.oxysporum f.sp. ricini
Mamona (até 100% de perdas nas
lavouras) DEMANT et al., 2002
F.oxysporum f.sp.
tracheiphilum
Feijoeiro (reduções na produção de
sementes do feijão caupi em até 86 %) ASSUNÇÃO et al., 2003 apud RODRIGUES, 2006
F.oxysporum f.sp.
vasinfectum
Algodoeiro (Gossypium hirsutum L.) e
quiabo (Hibiscusesculentus L.) KIMATI et al., 1997 CANDIDO e SILVA et al., 2007).
provocar tombamento de mudas. Também pode ocorrer necrose marginal nas folhas, seguida de murcha total da planta, bem como queda de folhas, flores e frutos culminando com a morte da planta hospedeira (BEDENDO, 1995). Ao desordenar e bloquear os elementos xilemáticos, o patógeno altera o transporte de água na planta, sintoma evidenciado pelo escurecimento dos vasos do xilema (ZITTER et al.,
1996).
A murcha de fusário (fusariose) apresenta maior severidade quando associada à presença de nematóides, à adubação com baixa concentração de potássio e ao plantio em solos pobres e arenosos. Dependendo também de fatores ambientais favoráveis, tais como, temperatura, umidade e pH. A doença caracteriza-se pela ação do patógeno nos vasos condutores da planta por meio da produção e liberação de toxinas e enzimas hidrolíticas, comprometendo o transporte de seiva (BEDENDO, 1995; JULIATTI & RUANO, 1997 apud SILVA, V. A. S. et al., 2007).
O controle deste agente causador de murcha é complexo, porque ele se desenvolve no solo, infecta o hospedeiro via sistema radicular e tem a capacidade de permanecer neste ambiente por longos períodos, mesmo na ausência de um hospedeiro. Além disto, é de fácil dispersão, que pode ser feita pelo vento, água e solo contaminado com sementes ou produtos do plantio anterior (ETHUR, 2006). A estratégia comumente utilizada no controle de F.oxysporum tem sido a eliminação
de resíduos contaminados do solo, aplicação de fungicidas químicos, plantio de sementes tratadas com agroquímicos, rotação de culturas e uso de cultivares resistentes (AGRIOS, 2005).
Mesmo sendo considerado um método tradicional comumente utilizado devido à ação rápida, o controle químico de doenças de plantas não tem sido totalmente eficiente, uma vez que o fitopatógeno F.oxysporum raramente é erradicado o que
enfatiza sua alta capacidade de sobrevivência (LARANJEIRA, 2001). Além disto, os insumos químicos têm causado impactos negativos nos ecossistemas, representados pela contaminação das águas, solo, impactos à saúde humana e dificuldade na ciclagem de resíduos químicos (FRIGHETTO, 2000).
1.2. Controle biológico
por outro organismo vivo com finalidade de manter as populações de patógenos em equilíbrio e abaixo dos níveis de causar danos econômicos (BELLOTTI, 1992; PIRES et al., 2003). Um bom agente de biocontrole deve apresentar um grupo de características comuns, como por exemplo, alta capacidade reprodutiva, habilidade de sobreviver sob condições desfavoráveis, eficiência na utilização de nutrientes, agressividade e antagonismo contra diferentes hospedeiros (BENÍTEZ et al., 2004). Desta forma, a eficiência do biocontrole está associada às propriedades antagonistas e aos mecanismos de ação que o agente de biocontrole apresentar.
O antagonismo é um processo complexo que pode ocorrer por diferentes mecanismos, ou por uma combinação destes, como a predação, amensalismo (antibiose), parasitismo, e pela competição por nutrientes, espaço e sítios de infecção. Uma das vantagens do emprego de fungos antagonistas é que estes podem ser introduzidos em ambientes diferentes dos quais foram isolados por serem capazes de estabelecer e parasitar o patógeno, bem como se adaptar ao micro habitat deste (MELO & AZEVEDO, 2000).
Diferentes espécies de fungos de solo já foram descritos como biocontroladores de fungos causadores de doenças vegetais, como por exemplo,
Chaetomium globosum, Ch. cochlioides e Ch. cupreum que inibem o crescimento
dos fitopatógenos Curvularia lunata, Pyricularia oryzae, Rhizoctonia oryzae, F.
oxysporum f.sp. lycopersici; Aspergillus niger contra patógenos de podridão branca;
Gliocladiumcatenulatum que reduz a incidência da doença de tombamento causado
por Pythium ultimum e R. solani (PUNJA & UTKHEDE, 2003; FRAVEL, 2005;
KAEWCHAI & SOYTONG, 2010). Fungos dos gêneros Gliocladium, Trichoderma,
Ampelomyces, Candida e Coniothyrium e também algumas estirpes de bactérias
pertencentes aos gêneros, Agrobacterium, Pseudomonas, Streptomyces e Bacillus
já fazem parte de formulados e são disponibilizados como produtos comerciais (VINALE et al., 2008; KAEWCHAI & SOYTONG, 2010). Dentre os fungos utilizados como agente de biocontrole destacam-se espécies do fungo Trichoderma que são
reconhecidas como os antagonistas mais importantes e pesquisados, correspondendo a 90% do total de microrganismos utilizados no controle biológico (GRIGOLETTI et al., 2000; BENÍTEZ et al., 2004).
Tabela 2: Produtos comerciais disponíveis no mercado de formulados a base de Trichoderma (SILVA e MELO, 2007)
Produto Controle
Binab-T (a base de T. harzianum)
(Brasil) Botrytis cinerea
BioFungus (Bélgica) Sclerotinia, Phytophthora, Rhizoctonia, Pythium, Fusarium,
Verticillium.
Biomix (mix de Trichoderma spp.)
(Brasil) Oídio, Uncinula necator, em videira
Biotrich (contendo Trichoderma
spp.) (Brasil) Rizhoctonia, Sclerotina, Fusarium, Phytium, Phomopsis Rosilinia e
ECCB 2001 Solo (Brasil) Doenças da raiz
ECCB 2001 Aéreo (Brasil) Doenças da parte aérea da planta
Green Alive (contendo Trichoderma
spp.) (Taiwan) Pythium, R. solani.
PlantShield (EUA) Pythium spp., R. solani, Cylindrocladium, Thielaviopsis,
Fusarium spp. e Botrytis
R.S.S.I.™ (a base de T. harzianum,
T-22 e T. virens , G-41) (EUA) Doenças de solo
SANJEEVNI (T. viride) (Índia)
Fusarium, Rhizoctonia, Sclerotium, Verticillium,
Macrophomina, Alternaria, Helminthosporium, Pythium,
Phytophthora .
SoilGard (anteriormente Gliocard) (contendo T. virens) (EUA)
damping-off diseases causado por Pythium spp. e
Rhizoctonia spp.
Trichoderma 2000 (Israel) R. solani, S. rolfsii, Pythium spp. e Fusarium spp.
Trichoderma harzianum T-22
(KRL-AG2), RootShield® e PlantShield HC (EUA)
Pythium spp., Fusarium spp. e Rhizoctonia spp.
Trichoderma harzianum T-35
(ATCC n º 20691) (EUA) Atividade antifúngica contra os fungos do gênero spp. Fusarium
Trichoderma viride (T-1-R9) (EUA) Controla fusariose do crisântemo
Trichodex (Israel) Botrytis de hortaliças e videira
Trichonat CE, EF e PM (Brasil) Botritys, Phytophtora, Verticilium, Colleotrotrichum, Armillaria,
Rhizopus, Crinipelis
Trieco (India) Rhizoctonia raiz, podridão de mudas, damping-off . spp., Pythium spp., Fusarium spp., podridão da
Trichoject, Trichopel,
Trichodowels e Trichoseal (Nova Zelândia)
Armillaria, Botryosphaeria, Chondrosternum, Fusarium,
Nectria, Phytophthora, Pythium, Rhizoctonia.
Trichonat EF e Trichonat PM (a base de Trichoderma spp.) (Brasil)
Botritys, Phytophtora, Verticilium, Colleotrotrichum, Armillaria,
Rhizopus, Crinipelis
Tricovab, à base de Trichoderma
stromaticum (Brasil) Crinipelis perniciosa
TUSAL (Espanha) Pythium, Phoma e Rhizoctonia de beterraba e alface.
Vinevax™ Bio-Dowels Sentinel®
(contendo Trichoderma spp.) (Nova Zelândia)
1.3. Fungos do gênero Trichoderma: agentes de biocontrole de fungos fitopatogênicos
O gênero Trichoderma foi descrito por Persoon em 1794, incluindo fungos
anamórficos (reprodução assexuada) isolados principalmente do solo, rizosfera de algumas plantas e matéria orgânica em decomposição. Este gênero compreende um grupo de fungos filamentosos mitospóricos de solo, pertencentes à classe “Hyphomycetes”, que são saprófitas e apresentam esporulação abundante, com conídios pequenos, unicelulares e de fácil disseminação pelo ar (BRAGA et al.,
2003; SAMUELS, 2006). De acordo com Melo (1991), as espécies de Trichoderma,
dentro de um mesmo grupo ou seção, apresenta características sobrepostas, o que torna complexa a sua classificação. Esse gênero é classificado como imperfeito pertencente à subdivisão Deuteromicotina, ordem Moniliales e família Moniliaceae (MELO, 1991). As espécies que apresentam reprodução sexuada, ou seja, que apresentam forma teleomórfica fazem parte do gênero Hypocrea e são encontradas
principalmente em plantas herbáceas e troncos de árvores (HARMAN et al., 2004). O uso de espécies de Trichoderma como agentes de controle biológico de
fungos fitopatogênicos de solo e foliares, tem sido investigado há mais de 70 anos sendo inicialmente reconhecido por Weindling (1932), que ao descrever o micoparasitismo despertou o interesse para o desenvolvimento de mais pesquisas nesta área. Estas espécies são capazes de reduzir a incidência de doenças causadas por fungos fitopatogênicos e fazem parte de formulados disponíveis comercialmente (WOO et al., 2006; HERMOSA et al., 2000 e MONTE & LOBELL, 2003). Algumas linhagens de T. harzianum, T. virens, T. asperellum e T. spirale
foram descritas como eficientes no controle da podridão parda que acomete a plantação de cacau causada por Phytophthora megakarya e P. palmivora (MPIKA et
al., 2009). A estirpe de T. virens utilizada por Howell (2003) mostrou induzir
respostas de defesa em plantas de algodoeiro desempenhando dessa forma um papel fundamental no controle da doença causada pelo fitopatógeno R. solani.
No trabalho realizado por Sempere & Santamarina (2010), T. harzianum foi
relatado por antagonizar fungos patógenos de arroz Alternaria alternata, F. verticillioides e Nigrospora oryzae através de mecanismos como micoparasitismo,
T. harzianum também se mostrou capaz de inibir o crescimento micelial de
Rigidoporus microporus, patógeno de seringueira; assim como T. hamatum que
conseguiu inibir mais de 50% do mesmo (KAEWCHAI & SOYTONG, 2010). Além disso, T. harzianum, bem como T. viride apresentaram potencial de suprimir o
crescimento de colônias de F.oxysporum, patógeno da podridão em pimentão
(Capsicumannuum L.) (SAHI & KHALID, 2007).
Muitas estirpes de Trichoderma, principalmente de T.harzianum, T. viride e T. virens, foram identificados como potencialmente viáveis para aplicação no controle
biológico, e uma lista dos principais gêneros de fungos fitopatogênicos com crescimento controlado por Trichoderma inclui: Armillaria, Botrytis, Chondrostereum, Colletotrichum, Dematophora, Diaporthe, Endothia, Fulvia, Fusarium,
Helminthosporium, Fusicladium, Macrophomina, Monilia, Nectria, Phoma,
Phytophtora, Plasmopara, Pseudoperonospora, Pythium, Rhizoctonia, Rhizopus
sclerotiorum, Sclerotium, Venturia, Verticillium e fungos da podridão de madeira
(MONTE & LOBELL, 2003).
1.3.1 Mecanismos de biocontrole por Trichoderma spp.
O controle de fungos fitopatogênicos por Trichoderma spp. é um processo
complexo que envolve diferentes mecanismos ou uma combinação destes, tais como: produção de antibióticos, micoparasitismo, competição por nutrientes, competição por sítios de infecção, aumento da disponibilidade de nutrientes, interferência com fatores de patogenicidade e indução de resposta de defesa e de resistência nas plantas hospedeiras (STEFANOVA et al.,1999; HERMOSA et al., 2000; VITERBO et al., 2002; PUNJA & UTKHEDE, 2003; BENÍTEZ et al., 2004; VALUEVA & MOSOLOV, 2004; BRUNNER et al., 2005; HARMAN, 2006).
A indução de respostas de defesas em plantas já foi observada para diferentes espécies de plantas quando germinadas a partir de sementes pré-tratadas com os esporos de fungos antagonistas do gênero Trichoderma (HARMAN et al.,
2004; HOWELL, 2003). A capacidade de Trichoderma spp. de ativar
sistemicamente o mecanismo de resistência da planta tem sido demonstrado em Graminaceae, Solanaceae e Curcubitaceae contra fitopatógenos como R. solani, Botrytis cinerea, Alternaria spp., Colletotrichum spp., Magnoporthe grisea e
Phytophthora spp. (WOO et al., 2006; SRIRAM et al., 2009).
A interação física entre Trichoderma e planta hospedeira desencadeia
como a resistência a futuras infecções por fungos fitopatogênicos. Dentre estas se pode citar o aumento na deposição de tecidos vegetais circundantes no sítio de infecção na parede celular formando uma estrutura denominada calose, que é uma barreira para a invasão de fitopatógenos, aumento na expressão de enzimas de defesa, por exemplo, peroxidases e quitinases, aumento na produção de fitoalexinas, flavonóides, terpenóides, e outros compostos com atividade antimicrobiana, assim como aumento da produção de giberelinas e auxinas. Estes compostos promovem o crescimento das plantas hospedeiras, o crescimento de suas raízes e estimulam a expressão de genes de proteínas de defesa (YEDIDIA et al.,1999;BENÍTEZ et al., 2004; HARMAN et al., 2004; VINALE et al., 2004; WOO et al., 2006).
No mecanismo de antibiose este gênero antagonista produz metabólitos secundários voláteis e não voláteis, com amplo espectro de atividade antimicrobiana. Dentre estes se pode citar antibióticos de diferentes classes, como as pironas, isocianatos, gliotoxina, viridina, trichodermina, suzucacilina, alameticina, dermadina, tricotecenos, terpenos, policetídeos, derivados de isocianato, piperacines, e as famílias complexas de “peptaibols” (BASTOS, 1991; SCHIRMBÖCK et al, 1994 apud SILVA e MELO, 2007; MONTE & LOBELL, 2003;
SCHERM et al, 2008).
Em função de sua estrutura química os antibióticos produzidos por espécies de Trichoderma possuem dois tipos principais de mecanismos de ação. Um se
caracteriza pela produção de compostos voláteis de baixa massa molecular, não-polar, o que resulta em uma alta concentração de antibióticos no ambiente do solo com um efeito relativamente longo de influência sobre a comunidade microbiana. O outro mecanismo, ao contrário, apresenta um efeito em intervalo curto de tempo devido a ação dos antibióticos polares e “peptaibols”. “Peptaibols” são antibióticos protéicos lineares e com caráter anfipático, consituídos por 7 a 20 resíduos de aminoácidos, produzidos principalmente por fungos do gênero Trichoderma. Por
apresentarem forte atividade sinérgica quando combinados com enzimas hidrolíticas antifúngicas (quitinases e β-1,3-glicanases), acredita-se que estes compostos interfiram na síntese da parede celular dos fungos hospedeiros (LORITO et al., 1996).
sinergismo com β-glicanases de T. harzianum (SCHIRMBÖCK et al., 1994 apud
SILVA & MELO, 2007; LORITO et al., 1996). Embora o papel e os efeitos dos “peptaibols” sejam bem entendidos, o modo de ação dos demais antibióticos produzidos por Trichoderma, e a possível sinergia com outras atividades
antifúngicas, ainda não foram elucidados por completo (HOWELL, 2003; VINALE et al., 2008).
1.4. Micoparasitismo
O mecanismo de micoparasitismo de espécies de Trichoderma, dentre estas a
espécie T. harzianum, é um processo complexo que ocorre em várias etapas e
inicia-se pelo reconhecimento e contato dos fungos hospedeiro e micoparasita. Uma vez estabelecido o contato, as hifas do micoparasita, enrolam em torno das hifas hospedeiras, secretam enzimas líticas e metabólitos secundários que levam o fungo hospedeiro à morte. As enzimas líticas são responsáveis pela hidrólise da parede celular do hospedeiro, possibilitando assim a sua invasão pelo micoparasita e nutrição (CHET et al., 1998; BENÍTEZ et al., 2004; ALMEIDA et al., 2007).
O contato micoparasita-hospedeiro é mediado por lectinas presentes na parede celular do hospedeiro, e esta interação desencadeia a ativação de uma cascata de transdução de sinal mediada por uma proteína G estimulatória e a enzima adenilil ciclase. O aumento intracelular do mensageiro secundário adenosina monofosfato cíclico (AMPc) leva ao rearranjo do citoesqueleto nas hifas antagonistas que enrolam sobre as hifas hospedeiras possibilitando a penetração nas hifas hospedeiras (SILVA, 1997; OMERO et al., 1999; MELO & AZEVEDO,2000). Alguns trabalhos demonstraram que esta mesma via de sinalização leva ao aumento da expressão de genes que codificam hidrolases de parede celular fúngica, as quitinases, β-1,3-glicanases e proteases e que a ação destas enzimas facilita a penetração da hifa hospedeira, bem como são responsáveis pela maior atividade antagônica do fungo micoparasita (ELAD & KAPAT 1999; FLORES et al. 1997; POZO et al. 2004; ROCHA-RAMÍREZ et al., 2002; SILVA et al., 2004; SUÁREZ et al. 2004; VITERBO et al. 2004 e SUÁREZ et al. 2007).
assim uma maior concentração no local da membrana. E por sua vez, reduz a capacidade do hospedeiro de reparar a parede celular, inibindo a síntese de quitina e β-glicana, ampliando o efeito de enzimas hidrolíticas.
Dentre outras proteínas envolvidas no processo de micoparasitismo estão proteínas da classe das hidrofobinas, encontradas na parede celular do micoparasita e que podem atuar favorecendo a interação com o fungo fitopatogênico, bem como, com a planta hospedeira. Trabalhos recentes demonstraram que estas proteínas são produzidas por fungos do gênero Trichoderma quando crescidos em culturas com
escassez de nitrogênio ou carbono (ROSADO et al., 2007). Estes autores demonstraram que o gene Qid74 que codifica uma proteína de parede celular da classe das hidrofobinas em T. harzianum, aumenta a resistência das hifas do
antagonista à hidrólise enzimática e a sua capacidade de aderência a superfícies hidrofóbicas.
O papel de hidrolases de parede celular no micoparasitismo é bastante estudado, estando disponíveis na literatura várias publicações referentes à sua caracterização e análises de controle de expressão (NORONHA & ULHOA, 1996; LIMA et al., 1997; NORONHA & ULHOA, 2000; OLMEDO-MONFIL et al., 2002, VITERBO et al., 2002; SANZ et al., 2005).
1.5. Hidrolases de parede celular fúngica
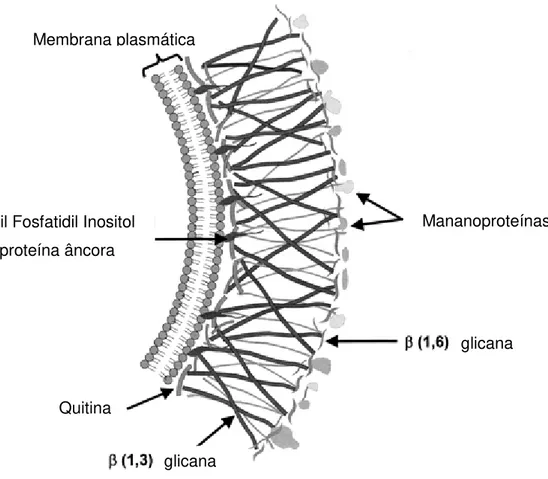
A parede celular de fungos fitopatogênicos é constituída principalmente por quitina, β-1,3-glicana e proteínas e representa a primeira barreira a ser vencida pelo micoparasita até a invasão da hifa hospedeira. A quitina, um biopolímero formado por monômeros de N-acetilglicosamina unidos por ligações glicosídicas do tipo β -1,4, possui uma estrutura cristalina altamente organizada e insolúvel em água e representa o principal componente da parede celular fúngica. Em seguida têm-se as
Figura 1. Composição da parede celular fúngica (Herrera, R.;1992).
Desta forma, as enzimas capazes de hidrolisar estes biopolímeros, são consideradas fator essencial para eficácia do micoparasita no biocontrole de fungos fitopatogênicos. E por esse motivo estas enzimas hidrolíticas como as β -1,3-glicanases (NORONHA et al., 2000a; NORONHA et al., 2000b, MONTEIRO & ULHOA, 2006; De MARCO & FÉLIX, 2007; MARCELLO et al., 2008), N-acetil-β -D-glicosaminidases (SILVA et al., 2004), proteases (De MARCO & FÉLIX, 2002; SUÁREZ et al., 2005) e quitinases (ULHOA & PEBERDY, 1991; ULHOA & PEBERDY, 1992; LIMA et al., 1997) têm sido alvo de pesquisas (NORONHA & ULHOA, 1996; De MARCO et al., 2003; SANZ et al., 2004 e SANZ et al., 2005; ALMEIDA et al., 2007; TSENG et al., 2008; YANG et al., 2009; MONTEIRO et al., 2010 ).
Diferentes formas destas enzimas produzidas por espécies de Trichoderma já
foram purificadas e caracterizadas. Estas proteínas quando testadas isoladamente ou em combinação mostraram atividade antifúngica, eficazes na inibição da germinação de esporos e crescimento micelial para um amplo espectro de fungos fitopatogênicos, como por exemplo, B. cinerea, R. solani, e espécies de Fusarium,
Membrana plasmática
Glicosil Fosfatidil Inositol (GPI)-proteína âncora
Quitina
glicana
Alternaria, Ustilago, Venturia, Colletotrichum e Phytopthora (P. palmivora, P.
parasitica), Pythium (LORITO et al., 1993, ELAD et al., 1999; BENÍTEZ et al., 2004;
MOHAMED et al., 2010; KAEWCHAI & SOYTONG, 2010). No trabalho de Semperere e Santamarina (2010) enzimas hidrolíticas, quitinases, glicanases e proteases produzidas por T. harzianum inibiram o crescimento de F. culmorum,
patógeno de arroz testado em diferentes condições ambientais e foi capaz de degradar a parede celular do fungo hospedeiro.
Portanto, o estudo do papel destas enzimas no processo de micoparasitismo pode contribuir para o desenvolvimento de novas estratégias no biocontrole de fungos fitopatogênicos. Mesmo porque enzimas que degradam parede celular de fitopatógenos, já foram destacadas pelo grande potencial na agricultura como componentes ativos em novas formulações de fungicidas (HERMOSA et al., 2000;
MOHAMED et al., 2010). Além disto, cepas mutantes de Trichoderma
superprodutoras de quitinases, β-glicanases e proteases são mais eficientes no
controle biológico de fungos fitopatogênicos, reforçando o papel destas hidrolases no micoparasitismo (BESOAÍN et al., 2007;. PÉREZ et al., 2007). Haggag e Mohamed (2002) obtiveram mutantes de três espécies de Trichoderma, T. viride, T.
harzianum e T. koningii, superprodutores de antibióticos (gliotoxin, trichodermina e
viridin), após irradiação com raios gama as espécies produziram quitinases com maior atividade de controle da doença podridão branca em cebola, causada pelo fitopatógeno Sclerotium cepivorum. Mohamed et al. (2010) demonstraram que cepas
de T. viride superprodutoras de celulases, quitinases e β-1,3-glicanases são mais
eficientes no controle de doenças causadas por S. rolfsii e Sclerotinia sclerotiorum
em feijoeiro.
A expressão das hidrolases responsáveis pela degradação da parede celular hospedeira é induzida pela presença de quitina ou tecidos de fungos hospedeiros (MACH et al., 1999; VINALE et al., 2008). Essa indução foi observada para espécies de Trichoderma cultivadas em meio de cultura líquido contendo micélio autoclavado
ou parede celular dos fungos fitopatogênicos, R.solani (GOLDMAN & GOLDMAN,
1998; GEREMIA et al., 1993; POZO et al., 2004; ALMEIDA et al., 2007; TSENG et al. 2008; MONTEIRO et al., 2010), B. cinerea (SUAREZ et al. 2007; YANG et al.,
2009), F.solani (RAMADA, 2010; MONTEIRO et al., 2010); Pythium ultimum
Considerando que a parede celular da maioria dos fungos é uma estrutura complexa composta, aproximadamente, por 90% de polissacarídeos como β -glicanas e quitina; e 10 % de proteínas, lipídios, íons orgânicos. Assim como, a expressão de enzimas hidrolíticas é influenciada pela composição dessas estruturas na parede celular dos fungos hospedeiros (ELAD et al., 1985; LATGÉ, 2007). Desta forma, a constituição da parede celular dos fitopatógenos é uma característica importante para o padrão de expressão e secreção de hidrolases de parede celular com papel no micoparasitismo (POZO et al., 2004; MONTEIRO et al., 2010).
1.6. Proteases
1.6.1. Classificação
de catálise e grupos químicos do sítio ativo (Tabela 3) (BARRETT, 1998; RAO et al., 1998).
As serinaproteases, metaloproteases, aspárticoproteases e cisteínoproteases foram classificadas em famílias por Rawlings & Barret (1993). Por ser uma classificação estrutural e evolucionária, cada família é caracterizada pela similaridade entre seqüências considerando a seqüência completa da protease ou domínios de aminoácidos conservados na região do sítio ativo. Após o alinhamento de seqüências destas proteases, Rawlings & Barret subdividiram-nas em famílias e atualmente consta no banco de dados MEROPS o registro de aproximadamente 43 famílias de serinoproteases (S), 58 famílias de metaloproteases (M), 13 famílias de aspárticoproteases (A) e 73 famílias de cisteínoproteases (C). Além disso, estas famílias podem ser agrupadas em clãs que são definidos pela similaridade de estrutura terciária, ordem dos aminoácidos que compõem as tríades ou tétrades catalíticas e dos resíduos de aminoácidos que completam o motivo de ligação a íons metálicos divalentes no caso das metaloproteases. Em alguns casos similaridade de estrutura secundária também é usada como critério adicional para a classificação.
As metaloproteases são peptidases que requerem íon cátion metálico divalente para a sua ação, em sua maioria apresentam maior atividade em pH neutro e que podem ter sua ação inibida por diálise e agentes quelantes. Estas podem ser divididas em metaloproteases dependentes de íons Zn2+ representadas pela carboxipeptidase A, carboxipeptidase B, glicil-glicina dipeptidase, amino-acil-histidina hidrolase e a citossol aminopeptidase. Metaloproteases dependentes de
As cisteínoproteases são inibidas por reagentes sulfidrílicos, são estáveis a temperaturas de 60 a 80 ºC em pH neutro e apresentam resíduos de cisteína (Cys) e histidina no sítio ativo cuja ordem se difere entre as famílias (Cys-His/ His-Cys). São divididos em grupos de acordo com a especificidade de sua cadeia lateral; em grupos que clivam especificamente para ácido glutâmico; em papaína like, tripsina like, que clivam preferencialmente resíduos de arginina e os que clivam outros resíduos. A papaína (mamão), a ficina (figo) e a bromelina (abacaxi) são exemplos de cisteínoproteases. (WHITAKER, 1994).
As aspárticoproteases são constituídas de dois resíduos de aspartato (Asp) no sítio ativo que participam da catálise ácido/base, possuem atividade ótima em pH ácido (entre 2 e 4) e são inibidas por pepstatina. Essas são agrupadas em pepsina (A1), retropepsin (A2) e enzimas pararetrovírus (A3).
As serina proteases apresentam um grupo de serina em seu sítio ativo sendo formado pela tríade catalítica serina-histidina-ácido aspártico (SHD ou ser-his-asp). Com base na suas semelhanças estruturais, as serina proteases foram subdivididas em clãs. Conforme as diferenças na estruturas primárias estas enzimas são dividas em quatro clãs, quimotripsina (SA), subtilisina (SB), carboxipeptidase C (SC), e
Escherichia peptidase D-Ala-D-Ala A (SE). Essas diferenças sugerem que existem
pelo menos quatro diferentes origens evolutivas para serinoproteases.
Os Clãs SA, SB e SC das serinoproteases têm um mecanismo de reação semelhante consistindo de uma tríade catalítica dos três aminoácidos, serina (nucleófilo), aspartato (eletrófilo) e histidina (base). Embora as orientações geométricas desses resíduos sejam similares, as dobras da proteína são bastante diferentes, formando um exemplo típico de uma evolução convergente. Outra característica interessante das serinoproteases é a conservação de resíduos de glicina(Gly) em nas proximidades do resíduo serina catalítica para formar o motivo Gly-Xaa-Yaa-Ser-Gly.
De acordo com o mecanismo de ação, as serino e cisteínoproteases apresentam resíduos de aminoácidos nucleofílicos nos sítio ativo da enzima alinhados como aminoácidos doadores de prótons, resultando na formação de um produto intermediário covalente entre enzima e substrato. Enquanto que para o mecanismo catalíco das metalo e asparticoproteases não ocorre a formação do produto intermediário devido a apresença da molécula de água ativada como sendo grupo nucleofílico. Sendo assim, os resíduos do sítio de catalise atuam como ácidos ou base.
Tabela 3: Classificação de enzimas com atividade proteolítica de acordo com Rao et al. (1998). () Resíduos de aminoácidos que compõem um polipeptídeo. ( ) indicam os resíduos de aminoácidos que são clivados, ( ) Região da clivagem enzimática.
Protease Modo de ação Número EC Exoprotease
Aminoprotease 3.4.11
Dipeptidil protease 3.4.14
Tripeptidil protease 3.4.14
Carboxiprotease 3.4.16 -18
Serina protease 3.4.16
Metalo protease 3.4.17
Cisteíno protease 3.4.18
Peptidil dipeptidase 3.4.15
Dipetidase 3.4.13
Ômega protease
Endoprotease 3.4.21- 99
Serina protease 3.4.21
Metalo protease 3.4.22
Cisteína protease 3.4.23
Aspártico protease 3.4.24
Endoproteases com mecanismos catalíticos desconhecidos
3.4.99
1.6.2. Papel no micoparasitismo
As proteases como as demais hidrolases de parede celular fúngica, também possuem papel no micoparasitismo por espécies de Trichoderma. Estas enzimas
têm sido descritas como importantes no sistema multienzimático de cepas de
Trichoderma, para hidrólise completa da parede celular do hospedeiro, bem como
para colaborar na inativação de enzimas produzidas por patógenos durante o processo de infecção de plantas (GEREMIA et al. 1993; MONTE & LOBELL, 2003;
SUÁREZ et al., 2004; SUÁREZ et al., 2007).
com trabalhos relacionados às quitinases e β-1,3-glicanases. Mesmo assim, os genes de algumas serina proteases (POZO et al. 2004; SUÁREZ et al., 2007; LIU & YANG, 2009) e proteases aspárticas (DELGADO-JARANA et al, 2002; SUÁREZ et al., 2005) de T. harzianum, foram clonados e caracterizados. Trabalhos mostrando a
purificação e avaliação da atividade antifúngica de proteases também já estão disponíveis na literatura sobre micoparasitismo de espécies de Trichoderma. Como
por exemplo, no trabalho de Liu e Yang (2007) que clonaram o gene de uma aspartato protease denominada SA76 de T. harzianum e demonstraram que, assim
como, as proteases prb1 e tvsp1, esta também participa do processo inicial de micoparasitismo inibindo o crescimento de fungos fitopatogênicos (CORTES et al., 1998; POZO et al., 2004). Um gene homólogo a esta enzima também foi identificado na espécie T. asperellum (VITERBO et al., 2004).
De MARCO e FÉLIX (2002) descreveram a purificação e caracterização de uma protease de 18.8 kDa presente no sobrenadante da cultura de T. harzianum,
com atividade antagônica contra o fungo fitopatogênico Crinipellis perniciosa,
responsável pela redução na produção de cacau no sul da Bahia-Brasil. Em outro trabalho, SUÁREZ et al. (2005) descreveram a secreção de diferentes proteases em filtrados de cultura de T. harzianum CECT 2413 cultivado na presença de 1% de
parede celular dos fungos B. cinerea, P. ultimum e R. solani; ou quitina. Uma
protease monomérica de 28 kDa, envolvida no processo antagônico denominada PRA1, foi purificada e classificada como uma serina protease do tipo tripsina (“tripsin-like”). Além disto, a enzima apresentou atividade nematicida reduzindo a infecção de raízes de algodoeiro por ovos do nematóide Meloidogyne incognita.
Elad e Kapat (1999) relataram também o papel de uma protease extracelular de T.
harzianum no biocontrole do fungo B. cinerea causador da doença conhecida como
podridão cinzenta, sugerindo o envolvimento de proteases no biocontrole deste fitopatógeno.
O papel de proteases no micoparasitismo também foi demonstrado pelo desenvolvimento de linhagens mutantes superprodutoras destas enzimas. Mutantes de T. harzianum apresentam atividade antagônica aumentada em função do
aumento da secreção de enzimas proteolíticas (SZEKERES et al., 2004). Como demonstrado por POZO et al. (2004) que relacionaram aumento da atividade de biocontrole de T. virens contra Gossypium hirsutum com a superexpressão de genes
2.JUSTIFICATIVA
Apesar da disponibilidade de formulados à base de Trichoderma utilizados no controle de fitopatógenos, ainda existe a demanda pela busca de agentes de biocontrole mais efetivos e adaptados às condições climáticas e tipo de solo das regiões de cultivo. A região Centro-Oeste é uma das principais produtoras de grãos no Brasil e enfrenta problemas nesta produção em função da ocorrência de doenças fúngicas. Neste sentido, em 2002 foi iniciado por nosso grupo de pesquisa em colaboração com o Dr. Cirano José Ulhoa da Universidade Federal de Goiás, e Embrapa Arroz e Feijão um projeto de isolamento e caracterização bioquímica de isolados do fungo micoparasita T. harzianum obtidos de solos do Cerrado do Estado
de Goiás. Quinze isolados da espécie T. harzianum foram avaliados quanto à sua
atividade antagônica contra os fungos fitopatogênicos F. solani, F. oxysporum e R. solani. Dos isolados avaliados dois denominados, ALL-24 e ALL-49, inibiram mais
eficientemente o crescimento destes fitopatógenos. Dando continuidade ao projeto esta pesquisa visou avaliar o papel de hidrolases de parede celular e de outras proteínas secretadas por T. harzianum durante interação micoparasita/hospedeiro,
em questão, Fusarium oxysporum. Com a perspectiva de contribuir para o
3. OBJETIVO GERAL
Avaliar a produção, purificar e caracterizar proteases de isolados de T.
harzianum obtidos de solos do Cerrado do Estado de Goiás, visando contribuir para
a identificação de enzimas candidatas à utilização no desenvolvimento de formulados e processos biotecnológicos para o controle do fungo fitopatogênico F.
oxysporum.
3.1. Objetivos específicos
- Avaliar a produção de proteases ácidas e alcalinas por isolados de T. harzianum
obtidos de solos do cerrado do Estado de Goiás quando cultivados em meio de cultura contendo o micélio autoclavado de F. oxysporum como fonte de carbono;
- Avaliar o perfil de proteases alcalinas secretadas por estes isolados quando cultivados em meio de cultura contendo o micélio autoclavado de F. oxysporum
como fonte de carbono;
- Purificar uma protease do isolado que apresentar maior atividade inibitória contra
F. oxysporum e maior atividade proteolítica;
- Seqüenciar a proteína purificada;
4. MATERIAL E MÉTODOS 4.1. Microrganismos utilizados
O isolado Tc, Trichoderma harzianum 39.1, foi obtido da coleção de fungos do
grupo de Bioquímica e Genética Microbiana da Universidade de Nottingham (Reino Unido), gentilmente cedido ao Dr. Cirano José Ulhoa da Universidade Federal de Goiás. Este isolado foi utilizado como referência, pois já tem sua atividade micoparasita muito bem caracterizada.
Os demais isolados de T. harzianum (ALL05, ALL08, ALL16, ALL18, ALL19,
ALL20, ALL21, ALL22, ALL24, ALL28, ALL 38, ALL42, ALL43, ALL47 e ALL49) foram isolados de amostras de solos do Cerrado em diferentes municípios do Estado de Goiás, região centro-oeste do Brasil, e gentilmente cedidos pelo Dr. Cirano José
Ulhoa curador da coleção de microrganismos do Laboratório de Enzimologia do Instituto de Ciências Biológicas da Universidade Federal de Goiás. Estes isolados foram classificados com base em características morfológicas e seqüências de ITS (“internal transcribed spacer regions”) do rDNA (LIMA, A.L.). O fitopatógeno
Fusarium oxysporum isolado de batata foi gentilmente cedido pelo Dr. Robert Neil
Gerard Miller do Laboratório de Microbiologia do Instituto de Ciências Biológicas da Universidade de Brasília.
A manutenção dos fungos foi realizada em meio batata dextrose ágar, BDA, (g.L -1: 100 g de batata, 1g de glicose e 25 g de ágar), crescidos a 25~28°C armazenados a 4ºC, com repiques periódicos bimestrais. Os fungos também foram armazenados a -80ºC, em solução salina 0,9 % (m/v) contendo tween 0,01% (v/v) e glicerol 50% (v/v).
4.2. Produção de micélio de F. oxysporum
Discos de meio sólido (BDA) contendo micélio de F. oxysporum foram
inoculados em 50 mL de meio MYG líquido (g.L -1:5g de extrato de malte, 2,5g de extrato de levedura e 10g de glicose) modificado de Noronha & Ulhoa, 2000. Os frascos foram incubados a 25ºC sob agitação constante de 120 rpm por 72h. Após este tempo, as culturas foram centrifugadas por 10 minutos a 4200 g, e os micélios
crescimento dos isolados de T. harzianum para produção de atividade proteolítica e
de outras hidrolases de parede celular fúngica.
4.3. Indução da produção de atividade hidrolítica pelos isolados de T.
harzianum
A produção de hidrolases de parede celular foi realizada como descrito por Noronha & Ulhoa (2000), com modificações. Esporos dos isolados do fungo T. harzianum (1x107 esporos.mL-1), ALL 05, ALL 08, ALL 16, ALL 18, ALL19, ALL 20,
ALL21, ALL22, ALL 24, ALL 28, ALL 42, ALL43, ALL 47 e ALL 49, foram inoculados em frascos cônicos contendo 50 mL de meio de cultura TLE (g. L -1: 10g de glicose, 0,3g de uréia, 1g de bactotriptona, 2g de KH2PO4, 0,3g de MgSO4.7H2O, 1,4g de (NH4)2SO4, 0,3g de CaCl2. 6H2O e 1mL de elementos traços). Após 48 horas de crescimento a 28ºC e 120 rpm, as culturas foram centrifugadas por 10 minutos a 4200 g, lavadas com solução salina (NaCl 0,9%) e novamente centrifugadas como
descrito anteriormente, para a coleta do micélio. Em seguida, os micélios foram transferidos para os frascos contendo meio mínimo suplementado com o micélio de
F. oxysporum, preparado como descrito no item 4.2, e incubados a 28°C e agitação
constante de 120 rpm. Após 48 horas de cultivo as culturas foram filtradas à vácuo, os filtrados armazenados a 4°C e, posteriormente, u tilizados como fonte de proteases nos ensaios enzimáticos e zimograma.
4.4. Análise da atividade proteolítica em gel de poliacrilamida (zimograma)
4.5. Indução da produção de atividades de hidrolases de parede celular fúngica pelo isolado ALL 49
O filtrado da cultura do isolado ALL49, obtido como descrito no item 4.3, também foi utilizado em ensaios enzimáticos para avaliação da produção das hidrolases de parede celular fúngica quitinases, n-acetiglicosaminidases e β
-1,3-glicanases, como fonte de protease nos experimentos de purificação e caracterização parcial da atividade proteolítica quanto ao efeito de pH e temperatura na velocidade da reação enzimática e termoestabilidade de acordo com Noronha & Ulhoa (2000) modificado. Para estes ensaios o filtrado da cultura foi concentrado, 10 vezes, por ultrafiltração utilizando o aparato AMICON® (Millipore), e membrana com limite de exclusão de 10 kDa.
A determinação das atividades de β-1,3-glicanases, quitinases e N-acetil-glicosaminidases foram realizadas apenas para o isolado ALL-49, caracterizado em trabalho anterior como potencial agente de biocontrole de Rhizoctonia solani, F.
oxysporum e Fusarium solani e que apresentou valor mais significativo de atividade
proteolítica.
4.5.1. Determinação da atividade proteolítica
Os filtrados das culturas obtidos como descrito no item 4.3 foram utilizados nos ensaios para determinação da atividade proteolítica, de acordo com Hutadilok-Towatana et al., (1999) e utilizando azocaseína como substrato. Para tanto, foi utilizado um sistema de reação contendo 125µL de solução de azocaseína 0,5% (m/v), em tampão Tris-HCl 100 mM pH 8,0 (para proteases alcalinas) ou tampão acetato de sódio 100 mM pH 4,0 (para proteases ácidas), e 75µL do filtrado da cultura. Após 20 minutos de incubação a 40oC, a reação foi interrompida pela adição de 600 µL de TCA 10% (m/v). As amostras foram então centrifugadas a 4200g por 5
minutos e 600 µL de cada reação, foram transferidos para um novo tubo de ensaio. Aos tubos, foram acrescentados 700 µL de NaOH 1 M e a absorbância foi lida a 440 nm.
realizados em triplicata, estes também foram utilizados para o cálculo de desvio padrão.
4.5.2. Dosagem de atividade de β-1,3-glicanases
A atividade de β-1,3-glicanases foi determinada conforme anteriormente descrito por Noronha & Ulhoa (2000). Para tanto, foram utilizados 250µl de laminarina a 0,5% em tampão acetato de sódio 50mM, pH 5,0 e 125µl do filtrado da cultura. Os tubos foram incubados a 45°C por 30 min utos e após isto, a reação enzimática foi interrompida pela adição de 1,5 mL do reagente de dinitrossalicilato (DNS). Em seguida, os tubos foram incubados por 5 minutos em banho fervente, e a absorbância foi determinada a 550nm. Uma unidade de atividade enzimática foi definida como a quantidade de enzima necessária para produzir 1 mol de açúcar redutor por minuto de reação, utilizando glicose como padrão.
4.5.3. Dosagem de atividade de quitinases
A atividade quitinolítica foi determinada conforme descrito por Ulhoa e Peberdy (1992). O volume de 1 mL do filtrado da cultura foi incubado a 37ºC sob agitação constante, por 18 horas juntamente com 1mL de substrato de quitina coloidal 1%, diluído em tampão acetato de sódio 100mM, pH 5,0. Em seguida, 250µl de cada tubo foram transferidos para novos tubos de ensaio e 1 mL de DNS foi adicionado aos mesmos, interrompendo a reação. Posteriormente, os tubos foram incubados em banho fervente por 10 minutos e a absorbância determinada a 550nm.
Uma unidade de atividade enzimática foi definida como a quantidade de enzimas necessária para produzir 1 mol de n-acetil-D-glicosamina por minuto de reação.
4.5.4. Dosagem de atividade de N-acetil-glicosaminidase
A atividade de N-acetil-glicosaminidase foi determinada em triplicata, conforme descrito por Sobrinho et al., (2005) incubando-se 50µl do filtrado da cultura em 350µl de tampão acetato de sódio 50mM, pH 5,5 e 100µl de p-nitrofenil N-acetil-β-D-glicosamina (PNP-GlcNAc) 5,0 mM. Os tubos foram incubados a 37°C, p or 30
4.6. Quantificação de proteínas
A concentração de proteínas dos filtrados das culturas foi determinada de acordo com o método descrito por Bradford (1976). Uma solução estoque de albumina sérica bovina (BSA) foi utilizada como padrão para a quantificação de proteínas.
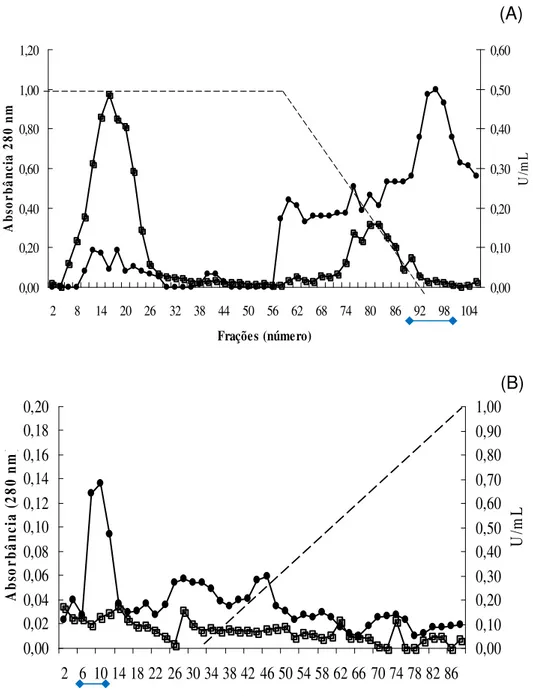
4.7. Purificação da enzima de interesse
Ao filtrado da cultura do isolado ALL 49 cultivado em meio mínimo contendo o micélio de F. oxysporum como fonte de carbono (40mL), foi adicionado sulfato de
amônio (1M) e esta amostra foi aplicada em coluna de interação hidrofóbica fenil-sepharose (1,6 x 11 cm). A coluna foi previamente equilibrada com tampão Tris-HCl 100mM pH 8,0 contendo 1M de sulfato de amônio, (NH4)2SO4, a um fluxo contínuo de 60 mL/hora, e fração de 4,0mL. Em seguida, a coluna foi lavada com 100 mL de tampão Tris-HCl 100mM pH 8,0 contendo 1M de sulfato de amônio até que a absorbância a 280nm das frações eluídas apresentasse valor igual ao obtido para a absorbância do tampão aplicado na coluna.
As proteínas ligantes foram eluídas com gradiente linear de (NH4)2SO4 1-0 M (50 mL de tampão Tris-HCl 100mM pH 8,0 com 1M de (NH4)2SO4 e 50 mL sem (NH4)2SO4). As proteínas mais hidrofóbicas que permaneceram ligadas à coluna mesmo após passagem o gradiente foram eluídas com uma última lavagem com 200 mL de tampão Tris-HCl 100mM pH 8,0. O perfil de eluição das proteínas e atividade proteolítica foram avaliados pela leitura das absorbâncias das frações a 280nm e pelo teste de atividade descrito no item 4.5.1, respectivamente.
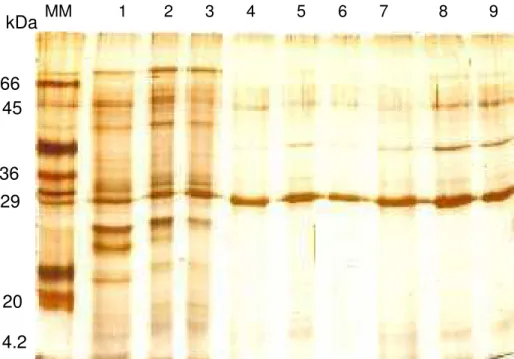
4.8. Análise do grau de pureza
O grau de pureza das frações provenientes das cromatografias foi analisado utilizando eletroforese desnaturante em gel de poliacrilamida a 12% (m/v), SDS-PAGE, conforme descrito por Laemmli (1970). Para visualização das bandas protéicas o gel foi corado utilizando-se o método de coloração com nitrato de prata, como descrito por Blum et al. (1987).
4.9. Análise em espectometria de massa em Matrix Assisted Laser Desorption Ionizated Time of Flight-Time of Flight (MALDI-TOF/TOF)
4.9.1. Preparo da amostra
Para a análise por espectrometria de massa realizada em Ultraflex III MALDI-TOF/TOF (Bruker Daltonics, Billerica, MA), a banda protéica correspondente à proteína purificada foi recortada do gel SDS-PAGE e transferida para microtubo de 1,5 mL e descorada conforme procedimento descrito por Schevchenko et al., (2001).
Ao gel foram adicionados 50µL de solução de ferrocianeto de potássio 15mM e tiossulfato de sódio 50mM, a mistura foi incubada à temperatura ambiente, por 15 minutos. Em seguida, a amostra foi lavada 3 vezes com água destilada e bicarbonato de amônio (NH4HCO3) 100 mM até que os sais contidos na solução anterior fossem removidos da superfície do gel. Por último, a amostra foi lavada uma vez com acetonitrila 100%(m/v) e seca em um concentrador a vácuo por 15 minutos.
mesma solução sem tripsina (50 mM de NH4HCO3 e 5 mM de CaCl2) e incubada durante 14 horas a 37ºC.
Posteriormente o tubo foi incubado por 10 minutos em um sonicador e em seguida foram acrescentados 40 µL de água destilada e mais uma vez incubado em um sonicador por 10 minutos. Depois a amostra foi incubada com 40 µL da solução acetronitila/H2O/ácido trifluoracético (66:33:0.1;v/v/v) durante 15 minutos no sonicador. O sobrenadante foi coletado e este último procedimento repetido. Os sobrenadantes recolhidos nessas duas lavagens foram reunidos em um tubo e submetidos ao processo de secagem no concentrador a vácuo.
As amostras concentradas foram ressuspendidas em 5 l de ácido triflúoracético 1%, e 2 l de cada amostra foram separados, transferidos para um novo tubo contendo 6 l de uma matriz composta por α-ciano-4-hidroxicinâmico (HCCA). Em seguida, 1 L desta mistura foi então pipetado à placa de MALDI, secas a temperatura ambiente e analisadas em um espectrômetro de massa, Ultraflex III MALDI-TOF/TOF (Bruker Daltonics, Billerica, MA). A detecção foi realizada em modo MS, com 200 tiros aleatórios na amostra. Em seguida, o aparelho novamente foi calibrado para o modo LIFT com o calibrante pepmix (número no catálogo: #206195, Bruker Daltonics): Angiotensina I (m/z 1.296,68), ACTH 1-17(m/z 2.093,08) e ACTH 18-39(m/z 2.465,19), para a refragmentação dos íons de alta qualidade e obtenção dos espectros de MS/MS.
4.9.2. Seqüenciamento da peptidase purificada
Os espectros de MS/MS gerados foram seqüenciados por seqüenciamento “de novo”, utilizando os programas FlexControl (Bruker Daltonics) e PepSeq (MicroMass Co.) . As seqüências obtidas foram comparadas com o banco de dados não redundante de proteínas do National Center for Biothecnology Information (NCBI), através do algoritmo Blastp. O alinhamento de seqüências foi realizado utilizando-se o programa ClustalW.
4.10. Caracterização parcial da atividade proteolítica 4.10.1 Avaliação do efeito de temperatura
pH na velocidade da reação foram utilizados os tampões acetato de sódio, fosfato de sódio e Tris-HCl na concentração de 50mM e mesmo valor de força iônica.
4.10.2 Termoestabilidade