UNIVERSIDADE FEDERAL DE UBERLÂNDIA
FACULDADE DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
FLÁVIO CALDEIRA SILVA
EFEITOS DA TEMPERATURA E DA ADIÇÃO DE
AÇÚCARES NA SOLUBILIDADE DOS ACETATOS DE
BUTILA E ETILA EM SOLUÇÃO AQUOSA
UNIVERSIDADE FEDERAL DE UBERLÂNDIA
FACULDADE DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
FLÁVIO CALDEIRA SILVA
EFEITOS DATEMPERATURA E DA ADIÇÃO DE
AÇÚCARES NA SOLUBILIDADE DOS ACETATOS DE
BUTILA E ETILA EM SOLUÇÃO AQUOSA
Orientador: Moilton Ribeiro Franco Júnior
UBERLÂNDIA 2014
MEMBROS DA BANCA EXAMINADORA DA TESE DE DOUTORADO
DE FLÁVIO CALDEIRA SILVA, APRESENTADA À UNIVERSIDADE
FEDERAL DE UBERLÂNDIA, EM 25 DE NOVEMBRO DE 2014.
BANCA EXAMINADORA:
____________________________________________ Prof. Dr. Moilton Ribeiro Franco Júnior
Orientador -PPGEQ/UFU
____________________________________________ Profª. Drª. Miria Hespanhol Miranda Reis
PPGEQ/UFU
____________________________________________ Prof. Dr. Ricardo Amâncio Malagoni
PPGEQ/UFU
____________________________________________ Prof. Dr. Ricardo Francisco Pires
UFTM
____________________________________________ Prof. Dr. Sérgio Marcos Sanches
DEDICATÓRIA
Aos amigos Anízio, Jacson e Moilton, que muito me apoiaram, incentivaram e sem a
AGRADECIMENTOS
Agradeço à Deus pelo dom da vida e por estar presente em cada novo passo da minha vida, iluminando, protegendo e abençoando.
Aos meus pais, Mauro e Vilma, aos meus irmãos, Alisson e Larissa e a todos os familiares que rezaram por mim e com muito carinho me apoiaram e incentivaram nos estudos.
Ao Professor Moilton pela orientação e pelos valiosos ensinamentos, e que sempre paciente em nossas reuniões demonstrou-se sempre humano, correto, prestativo e amigo. E que sem seu auxílio jamais teria vencido essa grandiosa etapa.
Aos membros da banca pelas considerações e sugestões no texto do trabalho.
Aos amigos de Uberlândia Simone Vieira, Letícia Castejon e família, Thiago Taham e família, Janaína Fischer, Ricardo Pires, Cleuzilene Vieira, Taciana Soares, Cida Barros, Kássia Santos e Beatriz Silvério que jamais mediram esforços para me estenderem as mãos.
Aos amigos de Ituiutaba Jacson, Vanessa, Isaura, Sérgio Sanches e Karina pela amizade e fidelidade. À Dayane pelo carinho, boas conversas e risadas no laboratório que embalavam nossos experimentos
À equipe da UFU/Pontal, Prof. André Santos, Profa. Regina Takeuchi , Profa. Renata Lima, os técnicos João Batista, Magayver e Diesley, pela convivência, ajuda constante e amizade, em especial ao Prof. Anízio Márcio (UFU/Pontal) pelo pela disponibilidade e presteza em auxiliar na condução dos experimentos, por sanar minhas dúvidas e pelos bons papos no laboratório.
" O homem se torna muitas vezes o que ele próprio acredita que é .
Se eu insisto em repetir para mim mesmo que não sou capaz de
realizar alguma coisa, é possível que realmente seja incapaz de fazê-la.
Ao contrário , se tenho convicção de que posso realizá-la,
mesmo que não a tenha no começo.
RESUMO
As interações entre as moléculas de aroma e outros compostos são frequentemente investigadas em sistemas binários e ternários (por exemplo, água, compostos de aroma, hidratos de carbono) para caracterizar mecanismos de liberação específicos. A influência de diferentes tipos de açúcar deve ser conhecida em situações em que eles fazem parte da solução de interesse. Contudo, a liberação de aromas de matrizes alimentares complexas é difícil de se prever e o conhecimento de dados de solubilidade, é útil no desenvolvimento de processos industriais. A solubilidade dos acetatos de butila e de etila em água pura e várias soluções aquosas de baixa viscosidade foi investigada. As soluções aquosas foram preparadas com glicose, frutose e sacarose com concentrações variando de 10-30 g L-1. O método estático foi utilizado e as concentrações dos compostos aromatizantes, em equilíbrio termodinâmico, foram monitoradas por cromatografia gasosa com detector de ionização de chama. Os experimentos foram realizados na faixa de temperatura de 5-25 ºC, utilizando vasos encamisados de vidro pyrex conectados em série, denominados de células, interligados por uma mangueira de látex e conectados a um banho ultratermostatizado para controle da temperatura durante os ensaios experimentais. As amostras foram agitadas vigorosamente por 2 h e mantidas em repouso por 24 h, e somente após a etapa de repouso foram realizadas as amostragens em triplicata para injeção no cromatógrafo a gás. As solubilidades dos acetatos de butila e de etila nas misturas, assim como na água pura, aumentaram com o diminuição da temperatura. Os componentes aromatizantes, foram retidos mais extensivamente na presença de soluções com glicose, em comparação com a da água pura. Em algumas situações o tamanho molecular do açúcar influenciou negativamente a solubilidade dos ésteres, como foi o caso da sacarose, que por apresentar maior massa molecular competiu com a molécula de éster pela água. Todas as soluções aquosas tiveram um comportamento semelhante quanto a concentração de açúcar quando foi aumentada, embora era esperado que a massa molecular do açúcar pudesse a ter influência na concentração de equilíbrio. Os sistemas acetato-água-açúcar alcançaram tempo de equilíbrio termodinâmico em tempo igual a 22 h, tanto para o acetato de butila como para o acetato de etila. A técnica de cromatografia gasosa mostrou-se válida para determinar a solubilidade dos ésteres em água pura e em soluções aquosas. Além dos dados experimentais, também foi possível correlacionar os dados experimentais estimando parâmetros de quatro equações. Resultados de solubilidade do acetato de butila e etila em água estão em concordância com a literatura disponíveis. Os valores de solubilidade experimental e da literatura em água a 25ºC do acetato de butila são 0,5917 g 100g-1 e 0,5928 g 100g-1, respectivamente. Já o valor de solubilidade experimental do acetato de etila foi igual a 7,1504 g 100g-1 e da literatura 7,270 g 100g-1. A correlação dos dados experimentais ajustados em software mostrou-se satisfatória.
ABSTRACT
Iinteractions between flavor molecules and other compounds are often investigated in binary and ternary systems (for example, water, aroma compounds, carbohydrates) to characterize specific release mechanisms. The influence of different types of sugar should be noted that in situations where they are part of the solution of interest. However, the release of aromas complex food matrices is difficult to predict and the knowledge of data solubility are useful in the development of industrial processes. Solubilities of butyl acetate and ethyl acetate from pure water and aqueous solutions of low viscosity was investigated. Aqueous solutions were prepared with sucrose, glucose and fructose in concentration range 10-30 g L-1. The static method was used and the concentrations of aroma compounds in thermodynamic equilibrium was monitored by gas chromatography with a flame ionization detector (CG -FID). The experiments were performed in the temperature range of 5-25 ° C, using jacketed Pyrex glass vessels connected in series, called cells, interconnected by a latex hose and connected to a thermostatic bath to control the temperature during the experimental trials. The samples were shaked for 2 h, then they were kept at rest for 24 h and only after these step, triplicate sampling of 1μL injection were carried out in the gas chromatograph. Solubilities of butyl acetate and the ethyl acetate mixtures and the pure water increased with decreasing temperature. The flavour components are retained more extensively in the presence of glucose solutions in comparison with that of pure water. In some situations the size of the sugar molecule showed negatively influence on the solubility of the esters, suchs as sucrose, that due to its higher molecular mass competed with the ester molecule by water. All aqueous solutions had a similar behavior as the sugar concentration was increased when, although it was expected that the molecular weight of sugar could have an influence on the equilibrium concentration. The acetate-water-sugar systems thermodynamic equilibrium reached time to time equal to 22 h, both as the butyl acetate to ethyl acetate. The gas chromatography was found to be valid to determine the solubility of the esters in pure water and in aqueous solutions. Besides the experimental data, it was also possible to correlate the experimental data by estimating parameters of four equations. Results solubility of ethyl acetate in water is in agreement with the literature. The experimental solubility and solubility available in the literature of butyl acetate in pure water at 25 °C are equal to 0.5917 g 100g-1 and 0.5928 g 100g-1, respectively. The value experimental solubility of ethyl acetate in pure water was equal to 7.1504 g 100g-1 and the literature value is 7.270 g 100g-1. The correlation of the experimental data set in software were satisfactory.
SUMÁRIO
1 INTRODUÇÃO ... 23
2 REVISÃO BIBLIOGRÁFICA ... 27
2.1. Solubilidade ... 27
2.2. Açúcares: características e propriedades ... 28
2.3. Análise termodinâmica do processo de solubilização ... 30
2.4. Equilíbrio líquido-líquido e solubilidade ... 32
2.5. Métodos experimentais para determinação da solubilidade ... 33
2.5.1. Métodos diretos ... 34
2.5.2. Métodos indiretos ... 35
2.6. Correlações, ajustes e modelagem de dados de solubilidade ... 42
2.7. Compostos aromáticos aplicados na indústria alimentícia ... 47
3 MATERIAL E MÉTODOS ... 50
3.1. Aparato experimental ... 50
3.2. Reagentes utilizados nos ensaios experimentais ... 51
3.3. Preparação das soluções aquosas ... 52
3.4. Ensaios experimentais ... 53
3.5. Medições da solubilidade dos ésteres... 53
3.6. Curva de calibração ... 55
3.7. Correlação dos resultados experimentais ... 56
4 RESULTADOS E DISCUSSÕES ... 58
4.1. Curva de Equilíbrio ... 58
4.2. Solubilidade dos ésteres em água pura ... 60
4.2.1. Solubilidades dos acetatos de butila e acetato de etila em água pura ... 60
4.3. Acetato de butila... 64
4.3.1. Solubilidade do acetato de butila em função da temperatura em soluções com mesma concentração de açúcar... 64
4.3.2. Dados experimentais das solubilidades do acetato de butila em soluções contendo açúcares em diferentes concentrações ... 68
4.4. Acetato de etila ... 72
4.4.1. Solubilidades do acetato de etila em função da temperatura em soluções com mesma concentração de açúcar... 72
4.4.2. Dados experimentais das solubilidades do acetato de etila em soluções contendo açúcares em diferentes concentrações ... 77
4.5. Correlação dos dados experimentais de solubilidade ... 80
4.5.2. Ajustes dos resultados de solubilidade de acetato de butila em soluções aquosas 88
LISTA DE FIGURAS
Figura 1.1 - Estrutura tridimensional química do acetato de etila ... 23
Figura 1.2 - Estrutura tridimensional química do acetato de butila... 24
Figura 2.1 - Aparato experimental ... 35
Figura 2.2 - Aparato experimental ... 36
Figura 2.3 - Solubilidade do n-hexanol em água e em solução aquosa de sacarose em várias temperatura ... 37
Figura 2.4 - Solubilidade do ácido cítrico em água, etanol e em misturas de etanol e água, em função da temperatura , ajustadas por uma equação exponencial. ... 39
Figura 2.5 - Solubilidade do ácido cítrico em função da fração molar inicial de etanol (X2) na mistura líquida. ... 39
Figura 2.6 - Variação da absorbância da mistura com o tempo à temperatura de 5 oC ... 41
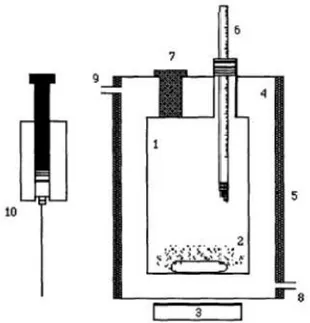
Figura 3.1 - Esquema do aparato experimental ... 50
Figura 3.2 - Imagem da célula de equilíbrio ... 51
Figura 3.3 - Esquema ilustrativo do cromatógrafo a gás (Focus GC SSl/FID – Termo Eletron S.p.A.) ... 54
Figura 3.4 - Ilustração do cromatógrafo Modelo Focus GC SSl/FID – Termo Eletron S.p.A. ... 55
Figura 4.1 - Curva de solubilidade (g 100g-1) em função do tempo de repouso (h) para acetato de butila soluções de glicose, frutose e sacarose com concentrações iguais a 10 g L-1. ... 58
Figura 4.2 - Curva de solubilidade (g 100g-1) em função do tempo de repouso (h) para acetato de etila em soluções de glicose, frutose e sacarose com concentrações iguais a 10 g L-1. ... 59
Figura 4.3 - Solubilidade do acetato de butila (g 100 g-1) em água pura em diferentes temperaturas... 62
Figura 4.4 - Solubilidade do acetato de etila (g 100 g-1) em água pura em diferentes temperaturas... 62
Figura 4.5 - Curva de solubilidade do acetato de butila (g 100g-1) em função da temperatura para as soluções de glicose, frutose e sacarose com concentrações iguais a 10 g L-1. ... 65
Figura 4.6 - Curva de solubilidade do acetato de butila (g 100 g-1) em função da temperatura para as soluções de glicose, frutose e sacarose com concentrações iguais a 20 g L-1. ... 65
Figura C. 30 - Replicatas dos cromatogramas de solubilidade de acetato de etila em solução de Sacarose 20 g L-1 em T=25ºC ... 159 Figura C. 31 - Replicatas dos cromatogramas de solubilidade de acetato de etila em solução de Glicose 30 g L-1 em T=5ºC ... 159 Figura C. 32 - Replicatas dos cromatogramas de solubilidade de acetato de etila em solução de Glicose 30 g L-1 em T=10ºC ... 160 Figura C. 33 - Replicatas dos cromatogramas de solubilidade de acetato de etila em solução de Glicose 30 g L-1 em T=15ºC ... 160 Figura C. 34 - Replicatas dos cromatogramas de solubilidade de acetato de etila em solução de Glicose 30 g L-1 em T=20ºC ... 161 Figura C. 35 - Replicatas dos cromatogramas de solubilidade de acetato de etila em solução de Glicose 30 g L-1 em T=25ºC161
Figura D.3 Curva de calibração de Acetato de Butila em solução de Glicose 10g L-1 ... 168
Figura D.4 - Curva de calibração de Acetato de Butila em solução de Frutose 10g L-1 ... 169
Figura D.5 - Curva de calibração de Acetato de Butila em solução de Sacarose 10g L-1 ... 169
Figura D.6 - Curva de calibração de Acetato de Butila em solução de Glicose 20g L-1 ... 169
Figura D.7 - Curva de calibração de Acetato de Butila em solução de Frutose 20g L-1 ... 170
Figura D.8 - Curva de calibração de Acetato de Butila em solução de Sacarose 20g L- ... 170
Figura D.9 - Curva de calibração de Acetato de Butila em solução de Glicose 30g L-1 ... 171
Figura D.10 - Curva de calibração de Acetato de Butila em solução de Frutose 30g L-1 ... 171
Figura D.11 - Curva de calibração de Acetato de Butila em solução de Sacarose 30g L-1 .... 171
Figura D.12 - Curva de calibração de Acetato de Etila em solução de Glicose 10g L-1 ... 172
Figura D.13 - Curva de calibração de Acetato de Etila em solução de Frutose 10g L-1 ... 172
Figura D. 14 - Curva de calibração de Acetato de Etila em solução de Sacarose 10g L-1 ... 172
Figura D.15 - Curva de calibração de Acetato de Etila em solução de Glicose 20g L-1 ... 173
Figura D.16 - Curvas de calibração de Acetato de Etila em solução de Frutose 20g L-1 ... 173
Figura D.17 - Curvas de calibração de Acetato de Etila em solução de Sacarose 20g L-1 ... 174
Figura D.18 - Curvas de calibração de Acetato de Etila em solução de Glicose 30g L-1 ... 174
Figura D.19 - Curvas de calibração de Acetato de Etila em solução de Frutose 30g L-1 ... 174
LISTA DE TABELAS
Tabela 2.1 - Solubilidade dos açúcares em 100 g de água. ... 29 Tabela 2.2 - Solubilidade do acetato de etila, Ceq (gsoluto/ gsolução) em soluções aquosas de
frutose em temperaturas de 5, 10 e 20 ºC. ... 41 Tabela 2.3 - Parâmetros de interação dos sistemas considerando todos os modelos termodinâmicos via aplicação do MLM e do algoritmo EDsp. ... 46
Tabela 4.15 - Parâmetros obtidos com a Equação 3.2 em sistemas de solução de açúcares e acetato de etila ... 95 Tabela 4.16 - Parâmetros obtidos com a Equação 3.3 em sistemas de solução de açúcares e acetato de etila ... 96 Tabela 4.17 - Parâmetros obtidos com a Equação 3.4 em sistemas de solução de açúcares e acetato de etila ... 97 Tabela A.1 - Dados experimentais de solubilidade de Acetato de Butila em Água ... 103 Tabela A.2 - Dados experimentais de solubilidade de Acetato de Etila em Água ... 103 Tabela B.1 - Dados experimentais de solubilidade de Acetato de Butila em soluções de açúcares com concentração igual 10 g L-1 ... 115 Tabela B.2 Dados experimentais de solubilidade de Acetato de Butila em soluções de açúcares com concentração igual 20 g L-1 ... 116 Tabela B.3 - Dados experimentais de solubilidade de Acetato de Butila em soluções de açúcares com concentração igual 30 g L-1 ... 117 Tabela C.1 - Dados experimentais de solubilidade de Acetato de Etila em soluções de açúcares com concentração igual 10 g L-1 ... 141 Tabela C.2 - Dados experimentais de solubilidade de Acetato de Etila em soluções de
açúcares com concentração igual 20 g L-1 ... 142 Tabela C.3 - Dados experimentais de solubilidade de Acetato de Etila em soluções de
LISTA DE SÍMBOLOS
- atividade do componente i
- parâmetro de interação biária
∆H - entalpia
µ - potencial químico
p - pressão
R - constante universal dos gases
T - temperatura
- fugacidade - componente
σ - desvio padrão
a - parâmetro da Equação 3.1 b - parâmetro da Equação 3.1 c - parâmetro da Equação 3.1 a' - parâmetro da Equação 3.2 b' - parâmetro da Equação 3.2 c' - parâmetro da Equação 3.2 a'' - parâmetro da Equação 3.3 b'' - parâmetro da Equação 3.3 c'' - parâmetro da Equação 3.3
a''' - parâmetro da Equação 3.4
b''' - parâmetro da Equação 3.4
c''' - parâmetro da Equação 3.4
R2 - coeficiente de correlação quadrática - concentração unitária do componente i
λ - comprimento de onda
α - fase α
γ - coeficiente de atividade
β - fase β
x - fração molar
- solubilidade - solubilidade média
- energia de Gibbs
^ - mistura
C - concentração
t - tempo
Xi - fração molar do componente i
N - número de componentes
t - total
SIGLAS
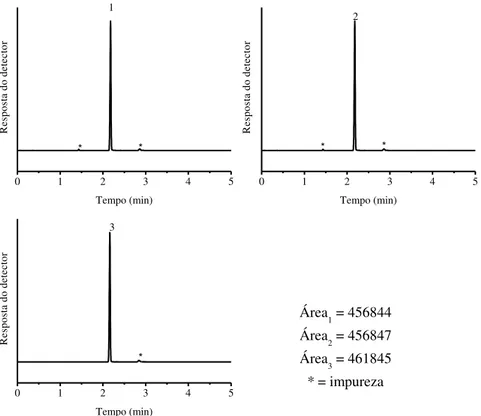
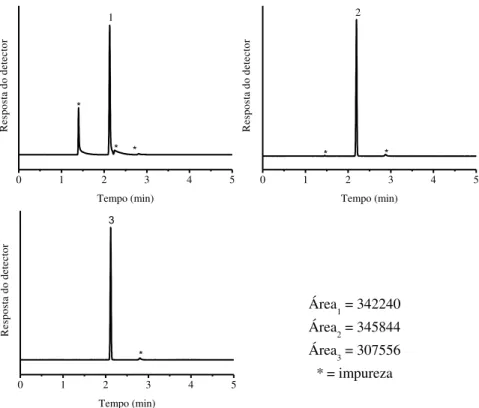
CAS - Chemical Abstracts Service AC - Área cromatográfica
Área1 - Área cromatográfica - primeira amostra
Área2 - Área cromatográfica - segunda amostra
Área3 - Área cromatográfica - terceira amostra
C12H22O11 - Sacarose
C8H14O6 Frutose
C4H8O2 - Acetato de Etila
C6H12O2 - Acetato de Butila
C6H12O6 - Glicose
CO2 - Dióxido de carbono
CG - Cromatógrafo a gás
DMF - dimetilformamida
ELL - Equilíbrio Líquido Líquido ED - Evolução diferencial
FID - Flame Ionization Detector
H2O - Água
Li2SO4 - Sulfato de lítio
N2 - Molécula de Nitrogênio
NaOH - Hidróxido de Sódio
NIST - National Institute of Standards and Technology NPEXP - Número de Pontos Experimentais
NRTL - Non Random Two Liquids RPM - Rotações por minuto
UNIFAC Functional-group Activity Coefficients UNIQUAC - UNIversal QUAsiChemical
U.V. - Ultravioleta
DRM - Desvios dos Resíduos Médios MLM - Método de Levenberg-Marquardt
Introdução
1 INTRODUÇÃO
Aromas e sabores de fruta são o resultado de uma especial variedade e mistura de diferentes metabólitos. Enquanto açúcares e ácidos podem contribuir para a doçura e a acidez, o aroma é derivado a partir de combinações de moléculas voláteis. As proporções diferentes dos componentes voláteis e a presença ou ausência de vestígios de componentes, muitas vezes determinam as propriedades de aroma (AYALA-ZAVALA et al., 2004).
Ésteres são compostos orgânicos produzidos através da reação química denominada de esterificação: ácido carboxílico e álcool reagem entre si e os produtos da reação são éster e água. Ésteres na forma de essências são obtidos através da reação com ácidos e alcoóis de cadeia curta. Este produto de ésteres é muito usado em indústrias de alimentos, ele permite a atribuição de diferentes sabores e aromas aos produtos artificiais. Em geral, os ésteres, principalmente os de baixa massa molar, apresentam aromas agradáveis, estando presentes em frutas e flores (MCMURRY, 1997).
O acetato de etila apresenta, também, como denominação química os nomes de etanoato de etila e éter acético. Sua fórmula estrutural está apresentada na Figura 1.1, apresenta número de registro CAS 141-78-6, possui a fórmula química C4H8O2 e tem como
características ser incolor, inflamável, solúvel em clorofórmio, álcool, éter e é levemente solúvel em água. Também é utilizado na fabricação de aromatizantes, essências artificiais de fruta e em produtos farmacêuticos (SOLOMONS, 1983; NIST, 2014).
Já o acetato de butila ou também denominado de etanoato de butila, que tem seu número CAS 123-86-4 apresenta a fórmula C6H12O2 e tem como características ser um
líquido incolor, ser solúvel em álcool, éter e hidrocarbonetos, pouco solúvel em água. Ele é o responsável por conferir o sabor de maçã verde às balas e gomas de mascar, por exemplo. Sua estrutura química é apresentada na Figura 1.2 (SOLOMONS, 1983; NIST, 2014).
Figura 1.2
-
Estrutura tridimensional química do acetato de butilaAlimentos, naturais ou processados, são preservados por diferentes vias, tais como diminuindo o conteúdo de água, adicionando conservantes ou simplesmente através do armazenamento a baixas e/ou temperaturas abaixo de zero. Baixas temperaturas e temperaturas abaixo de zero também são importantes durante o processamento, formulação e especialmente na armazenagem (COVARRUBIAS-CERVANTES et al., 2005b).
O controle de temperatura durante estas operações unitárias é de importância principal para preservar a cadeia de frio para manter as características de alimentos. Entre estas características o sabor é uma, ou talvez, a característica mais importante em alimentos. Vários compostos aromáticos são responsáveis e constituem o sabor e aroma na formulação de alimentos e bebidas (COVARRUBIAS-CERVANTES et al., 2005b).
Introdução
equilíbrio termodinâmico é buscado por todos os sistemas. A termodinâmica fornece um critério de estabilidade que deve ser satisfeito, estabelecendo que, a uma temperatura e pressão constantes, um estado estável é aquele que apresenta um mínimo na energia livre de Gibbs (SMITH; VAN NESS; ABBOOT, 2009).
Ainda, o conhecimento da termodinâmica de equilíbrio de aromas solubilizados em fase aquosa em bebidas ou submetidos a baixas temperaturas, tais como solubilidade, no modelo de alimentos em média a baixas temperaturas permitirá uma melhor compreensão das interações físico-químicas intermoleculares de substâncias voláteis nesses sistemas. É ainda, bastante complicado, explicar o fenômeno da adição de açúcares em bebidas e a consequente variação do aroma e sabor da mesma (COVARRUBIAS-CERVANTES et al., 2005b).
A revisão de leiteratura mostra que, até então, existem poucos estudos (COVARRUBIAS-CERVANTES et al., 2005b) que avaliem os efeitos do aumento da temperatura do sistema na concentração dos aromatizantes artificiais em sistemas líquidos, na presença de diferentes tipos de alguns açúcares, tais como glicose, frutose e sacarose, por exemplo. Dados experimentais de equilíbrio, seguramente, possibilitam compreender, de forma mais clara e segura, os efeitos da concentração de açúcares e da temperatura, na concentração de equilíbrio de aromatizantes artificiais, bem como contribuir na modelagem da fase líquida, ou seja, no desenvolvimento e uso de modelos de coeficientes de atividade para o projeto de embalagens e estocagem de produtos consumíveis.
Este trabalho tem como objetivo geral utilizar o método estático para determinação experimental da solubilidade de dois ésteres (ou aromas), acetato de etila e acetato de butila, em soluções aquosas insaturadas de diferentes concentrações de glicose, sacarose e frutose, em temperaturas de 5 a 25 0C.
Como objetivos específicos deste estudo têm-se:
Verificar o efeito da presença de um açúcar, em solução aquosa e concentração abaixo da saturação, na solubilidade do acetato de etila e de butila.
Avaliar o efeito da natureza dos açúcares glicose, frutose e sacarose nas concentrações iguais a 10, 20 e 30 g L-1.
Discutir a interação da molécula de açúcar com o éster em termos de tamanho e massa molecular afetando a solubilidade final do aroma;
Avaliar o ajuste dos dados experimentais de solubilidade a partir de equações empíricas apontando os melhores resultados através de estudos estatísticos do coeficiente de correlação quadrático (R2) bem como dos resíduos médios (R.M);
Ademais, os dados experimentais de equilíbrio obtidos enriquecerão a literatura contribuindo para cálculo de equipamentos e o projeto de condições de embalagem, estocagem e armazenamento de produtos que contenha algum composto que confira aroma e sabor em baixas temperaturas.
No Capítulo 2, “Revisão Bibliográfica”, serão apresentadas as técnicas existentes na
literatura para se determinar a solubilidade de um soluto, características dos açúcares e ésteres empregados no estudo, bem como mecanismos de análise termodinâmica para solubilidade.
O procedimento experimental para obtenção dos dados de solubilidade de acetato de butila e etila, encontra-se descrito no Capítulo 3. Neste capítulo, serão informadas, detalhadamente, os equipamentos, materiais e as técnicas de análise adotadas que, via de regra, estão em concordância com os artigos científicos encontrados na literatura.
No Capítulo 4, “Resultados e Discussão”, são apresentados e discutidos os resultados
experimentais obtidos para os sistemas de trabalho. Os dados experimentais de solubilidade foram ajustados, em função da temperatura e da concentração dos açúcares em questão. Desta forma, foi feito um ajuste de parâmetros empregando-se quatro equações, sendo elas uma de potência, e outras três equações empíricas. São também mostrados neste capítulo os resultados e a avaliação dos ajustes dos dados experimentais de solubilidades para equações previamente selecionadas
Revisão Bibliográfica
2 REVISÃO BIBLIOGRÁFICA
2.1.Solubilidade
A solubilidade de um soluto em um dado solvente é definida como a concentração da solução saturada (RUSSEL, 2008). Assim, solubilidade, por definição, é a concentração de soluto dissolvido em um solvente em equilíbrio com o soluto não dissolvido à temperatura e pressão especificadas, ou seja, é a medida da quantidade máxima de soluto que pode ser dissolvida em um determinado solvente (ANDRADE; MARTINS; SILVA, 2004) .
Em termos de solubilidade, o caráter polar ou apolar de uma substância influi diretamente em sua polaridade, onde em determinadas substâncias terão maior ou menor solubilidade. Dessa forma, substâncias polares tendem a se dissolver em líquidos polares e substâncias apolares, em líquidos apolares. Assim, a regra geral é formulada como semelhante dissolve semelhante (LEE, 1999). Contudo, o tamanho molecular (ou iônico), a polaridade (ou carga), forças dispersivas e dipolares, ligações de hidrogênio e a temperatura são fatores que se destacam na determinação da solubilidade e devem ser considerados no seu entendimento (ANDRADE; MARTINS; SILVA, 2004).
A água possui uma importante habilidade que é a de dissolver muitos tipos de substâncias como compostos iônicos (LEE, 1999). Em presença de íons ou de moléculas com grupos hidrofílicos, há formação de diversos tipos de ligações entre moléculas de soluto e da água. A presença dessas ligações altera a formação de agregados de moléculas de água e a proporção de moléculas de água livre. A intensidade da mudança na estrutura da água líquida pela presença de íons ou grupos hidrofílicos não iônicos depende da força iônica do soluto ou da maior ou menor polaridade desses grupos (BOBBIO; BOBBIO, 2001).
De acordo com Ran et al. (2002) o estudo e determinação de modelos preditivos para a solubilidade de solutos em solventes são extremamente importantes em diversos setores ligados à engenharia industrial. A solubilidade de compostos orgânicos em água é um dado importante em indústrias químicas, farmacêuticas, alimentícias e em aplicações ambientais. Alguns autores se preocupam, exclusivamente, em obter dados para uma única temperatura sem avaliar o comportamento da solubilidade em função da temperatura.
Se o processo de dissolução de um soluto é endotérmico, um equilíbrio de solubilidade pode ser escrito como:
soluto + solvente + calor solução (∆H >0)
ou, se for exotérmico,
soluto + solvente solução + calor (∆H <0)
onde ∆H é a variação de entalpia da dissolução ou o calor de dissolução.
De acordo com o princípio de Le Chatelier, pode-se alterar este equilíbrio através da mudança de temperatura. No caso endotérmico, uma elevação da temperatura desloca o equilíbrio para a direita aumentando a solubilidade. Já no caso exotérmico, uma elevação de temperatura altera o equilíbrio para a esquerda, favorecendo o soluto não dissolvido e assim, diminuindo a solubilidade. Contudo, exceções à regra podem ocorrer, quando o ∆HSol (calor
de dissolução) é negativo e dessa forma a solubilidade deve diminuir com o aumento da temperatura como é o caso da solução de Li2SO4 (RUSSEL, 2008; LEE, 1999).
2.2.Açúcares: características e propriedades
Os açúcares são geralmente sólidos cristalinos, incolores e têm sabor adocicado. São compostos naturais, e o mais conhecidos entre eles é a sacarose, que talvez seja o adoçante mais antigo. Como regra geral, os açucares são facilmente solúveis em água (BOBBIO; BOBBIO, 2003).
Todos os açúcares são solúveis em água fria, mas há variação de 30 a 80% na solubilidade. Ainda, podem ser obtidos de fontes renováveis, ocorrem em diversas estruturas e graus de polimerização, apresentam variadas propriedades físicas e químicas, são suscetíveis a modificações físicas e químicas e são biodegradáveis (OETTERER; REGITAN-D'ARCE; SPOTO, 2006).
Revisão Bibliográfica
Analisando a Tabela 2.1 observa-se que a solubilidade dos açúcares apresentados aumenta significativamente com a elevação da temperatura e também que a frutose é altamente solúvel em água, sendo esse açúcar mais solúvel em água do que a glicose e a sacarose. Por exemplo, a 45 ºC, 100 g de água dissolvem 573 g de frutose e 191 g de glicose e 249 g de sacarose (WATANABE, 1978).
Tabela 2.1 - Solubilidade dos açúcares em 100 g de água. Temperatura
(ºC) Glicose Frutose Sacarose
g 100 g-1
20 86,5 368 204
25 111 408 211
30 121 446 219
35 138 487 229
40 158 539 238
45 191 573 249
50 242 662 260
55 272 740 273
(Fonte: Watanabe, 1978)
Um dos monossacarídeos encontrados na natureza com frequência é a D-glicose, conhecida também como açúcar de milho, e é uma das principais fontes de energia dos organismos vivos (BOBBIO; BOBBIO, 2003).
Já a frutose é também conhecida como o açúcar das frutas e ocorre em grande quantidade na natureza, principalmente em frutas e mel (BOBBIO; BOBBIO, 2003).
A sacarose, açúcar de cana de açúcar e de beterraba, é o dissacarídeo mais importante, tanto pela quantidade quanto pela frequência com que é encontrado na natureza, e ainda pela expressividade na alimentação humana (BOBBIO; BOBBIO, 2003).
A energia associada à solubilização envolve uma ruptura das interações intermoleculares entre as moléculas de carboidratos e as moléculas de água com elas próprias seguida pela formação de novas interações entre as moléculas de dois componentes. A energia da rede do carboidrato na forma cristalina é grande e dominante em relação ao processo de solubilização (MILLER; DE PABLO, 2000).
2.3.Análise termodinâmica do processo de solubilização
De acordo com PRAUSNITZ et al. (1999), ao se discutir solubilidade de solutos não voláteis, deve-se primeiramente observar a termodinâmica das soluções que contêm um soluto não volátil em um solvente volátil. Para um componente , à temperatura, pressão e composição conhecidas, a atividade e o coeficiente de atividade são relacionados ao potencial químico :
em que é a constante universal de gases perfeitos, é a temperatura absoluta, representa o potencial químico de em um estado padrão convenientemente definido e é alguma concentração convenientemente definida. Para misturas de líquido voláteis e não eletrólitos, define-se como potencial padrão do líquido puro a temperatura e pressão do sistema. Nesse caso, as frações molares (ou volumétricas) são tipicamente usadas para .
Em uma mistura contendo um soluto não volátil dissolvido num solvente, usa-se a Equação 2.1 para o solvente com a definição convencional de . Entretanto, para um soluto não volátil, um líquido puro, a temperatura (T) e pressão (p) do sistema, não é o estado padrão conveniente porque na maioria dos casos, em temperaturas e pressões normais, um soluto não volátil puro não pode existir como um líquido.
Para o soluto dissolvido, o potencial químico é escrito como:
Revisão Bibliográfica
solvente, na temperatura e pressão do sistema e com concentração unitária ( . Nesta solução ideal, para todas as composições. Na solução real, se ,
Ainda, não é correto afirmar que o estado padrão para o soluto é o soluto à temperatura e pressão do sistema na diluição infinita; pois, na diluição infinita, o potencial químico do soluto é infinito. O potencial químico do soluto no estado padrão deve estar em uma concentração fixa (não nula). Essa concentração é unitária. A concentração unitária é usada porque tem logaritmo zero.
Dessa forma, considerando que (mol L-1), a equação anterior fica:
onde o é o coeficiente de atividade com a concentração expressa em termos de molaridade. O estado padrão é o estado hipotético, ideal, 1-molar de uma solução do soluto no solvente . Porque, no comportamento real,a solução se comporta como ideal na diluição infinita e .
É mais conveniente usar a escala de molalidade para a concentração porque assim não requer dados de densidade. Considerando que , obtém-se
onde é o coeficiente de atividade com a concentração expressa em termos da molalidade. O estado padrão é hipotético de uma solução 1 molal, ideal do soluto no solvente . Porque, no comportamento real, a solução se comporta como ideal na diluição infinita e
.
Desta forma, o conhecimento do potencial químico de um componente numa mistura requer que se proponha, ou se conheça, um modelo de coeficiente de atividade. Os modelos mais tradicionais são Margules, Wilson, NRTL e UNIQUAC (PRAUSNITZ et al., 1999).
2.4.Equilíbrio líquido-líquido e solubilidade
Existe equilíbrio termodinâmico de fases em um sistema – que não possui interações com a vizinhança – quando não se observa macroscopicamente mudanças nas suas variáveis (pressão, temperatura e concentração) num determinado período e a inexistência de fluxos líquidos de massa e/ou energia. A condição para o equilíbrio de fases de um sistema à temperatura e pressão constantes pode ser escrita com o auxílio da segunda lei da termodinâmica como:
T , p = constante => G = mínima
ou seja, o equilíbrio mínimo pode ser estudado através da minimização da energia de Gibbs (G) do sistema, numa dada pressão e temperatura.
Ao se discutir estabilidade e equilíbrio, segundo Smith, Van Ness e Abbott (2009), o estado de equilíbrio de um sistema fechado é aquele estado no qual a energia de Gibbs total é um mínimo em relação a todas as possíveis mudanças em especificadas temperaturas e pressões. Contudo, no estado de equilíbrio podem ocorrer variações diferenciais no sistema, a T e p constantes, sem produzir qualquer variação na Gt (Energia de Gibbs Total). Assim,
tem-se:
Quando a mistura de dois líquidos ocorre a T e p constantes, a energia de Gibbs total deve diminuir, porque o estado da mistura pode ser um estado de menor energia de Gibbs em relação ao estado dos líquidos não misturados.
Alguns pares de espécies químicas, quando misturadas em certa faixa de composições molares (xi), para formar uma única fase líquida, podem não satisfazer o critério de
estabilidade, pela equação abaixo apresentado:
Revisão Bibliográfica
Considerando as faixas de composições, tais sistemas se dividem em duas fases líquidas com composições diferentes e se essas fases estão em equilíbrio termodinâmico, o fenômeno é conhecido como equilíbrio líquido-líquido (ELL), que é muito importante em operações industriais.
Os critérios de equilíbrio para o ELL levam em consideração a uniformidade de T, p e da fugacidade de cada espécie química (i) em ambas as fases (α e β). E que, no equilíbrio, tem-se a igualdade das fugacidades, assim
sendo N o número de espécies químicas na mistura. Considerando fases líquidas, adota-se a representação da equação das fugacidades através da abordagem gama, ou seja,
empregando-se os coeficientes de atividade (γi). Estes coeficientes medem o grau de afastamento do
componente i da mistura em relação ao comportamento ideal, conforme Equação 2.8:
É importante ressaltar que o coeficiente de atividade considera tanto a disposição das moléculas quanto a formação ou quebra de ligações entre as moléculas no processo de misturas dos componentes puros. E se cada espécie pura pode existir como líquido na temperatura do sistema, o o
i i i
f f f , e desta forma, tem-se:
2.5.Métodos experimentais para determinação da solubilidade
2.5.1. Métodos diretos
Os métodos diretos são aqueles em que se quantifica a massa do soluto e solvente, obtendo-se a fração molar do soluto no solvente, ou seja, a solubilidade do composto de interesse.
Poulson et al. (1999) determinaram a solubilidade de tolueno em soluções aquosas salinas. As soluções salinas com três concentrações diferentes foram preparadas e alíquotas de 10 g destas soluções foram transferidas para tubos de vidro, no qual foram acrescentados 0,4 g de tolueno. Esses tubos foram agitados mecanicamente por 72 h, e então as amostras foram centrifugadas por 8 min em rotação igual a 2000 rpm, para separar o tolueno líquido da solução aquosa. Concentrações de tolueno nas soluções salinas foram medidas através de espectrofometria UV-visível com comprimento de onda (λ) de 261,3 nm.
Malagoni e Franco Jr. (2007) estudaram a solubilidade de compostos orgânicos, tais como hidrocarbonetos e organoclorados, utilizando um sistema dinâmico de medida, à temperatura ambiente. As misturas de interesse (1,2-dicloroetano e água, cloreto de metileno e água , tolueno e água pentano e água hexano e água e heptano e água) foram preparadas diretamente na célula de equilíbrio líquido-líquido e todos os sistemas foram diluídos, com fração molar do soluto em água.
O equipamento desse estudo consistiu de dois vasos de vidro pyrex, denominados células, interligados por um tubo de aço inoxidável com dispositivo para manter a temperatura superior a ambiente. O primeiro vaso continha o soluto puro e foi denominado de célula de composto puro. Este vaso possuía uma camisa externa, por onde circulava água proveniente do banho termostático, e uma câmara interna, onde estava o soluto. Uma entrada na base deste vaso possibilitou o escoamento de gás de arraste N2, que arrastava o gás saturado com o
soluto para o segundo vaso, denominado de célula de saturação. Parte do soluto era dissolvida em água pura e a outra parte era liberada na atmosfera. O processo de dissolução foi monitorado por amostragens analisadas por cromatografia gasosa com detecção de chama, no qual obteve-se a concentração das soluções.
Revisão Bibliográfica
medir coeficientes de atividade à diluição infinita. Inúmeros métodos para medir coeficientes de atividade à diluição infinita estão disponíveis (ORBEY; SANDLER, 1991). De acordo com Gmehling et al. (1998) alguns métodos clássicos são a ebuliometria, células estática, cromatografia líquido-líquido e cromatografia gás-líquido.
2.5.2. Métodos indiretos
Nos métodos sintéticos ou indiretos, prepara-se uma mistura de composição conhecida em uma célula de equilíbrio e então, observa-se o comportamento, já os métodos analíticos envolvem a determinação das composições das fases em coexistência. Desta forma, amostras de cada fase podem ser recolhidas e analisadas fora da célula de equilíbrio, à pressão normal. Esta última metodologia foi a escolhida e aplicada neste estudo.
A solubilidade de cloreto de sódio e potássio em misturas de solventes em diferentes temperaturas foi avaliada por Pinho e Macedo (1996). Após 2 h de agitação o sistema foi mantido em repouso e com uma seringa termostatizada foi realizada a amostragem e analisada por gravimetria. A Figura 2.1 apresenta o esquema do aparato utilizado pelos autores.
Misturas de n-butanol e água, metanol e hexano, benzeno e água, foram estudadas em um aparato experimental para coleta de dados de sistemas binários em fase líquida desenvolvido por OLIVEIRA (2004). Este aparato (Figura 2.2) consistia em três células de equilíbrio conectadas em série por mangueiras de látex à um banho termostatizado e foram operados isotermicamente em temperaturas que variavam de 5 a 80 ºC, em pressão igual a 692 mm Hg.
As células foram alimentadas com soluções previamente preparadas e após atingir o equilíbrio, as fases foram amostradas e analisadas por cromatografia gasosa. Através de curvas de calibração foram determinadas as concentrações molar de equilíbrio. Os dados obtidos foram comparados com a literatura disponível e permitiram observar boa eficiência do aparato desenvolvido.
Figura 2.2
-
Aparato experimental - (1, 2 3. Células de equilíbrio; 4, 5 e 6 Agitadores magnéticos ; 7 banho termostático; 8 mangueiras de látex; 9, 10 e 11 posicionamento dos termopares (Extraído de Oliveira, 2004).Revisão Bibliográfica
gravimetricamente utilizando de uma balança analítica. Após a estabilização da temperatura do banho termostatizado, a célula já alimentada era agitada por 1,5 h e mantida posteriormente em decantação por 2 h. A amostragem era realizada por meio de uma seringa de vidro e a análise era realizada por titulação com solução de hidróxido de sódio (NaOH) em concentração conhecida. Por estequiometria da reação de neutralização do ácido benzóico, a quantidade de ácido presente nas amostras eram determinadas e os dados de solubilidade do ácido no solvente obtidas.
O estudo da solubilidade de nove componentes aromáticos (acetona, butanona, 2-hexanona, 2-octanona, acetato de etila, butanoato de etila, n-hexanol e n-hexanal) foi avaliada por Covarrubias-Cervantes et al. (2005b). Os autores introduziram em um frasco hermeticamente fechado 2 mL de solução aquosa e 0,5 mL do componente aromático puro e com o auxílio de um agitador magnético promoveu o máximo de contato entre as fases. Após atingir o equilíbrio, o frasco foi centrifugado por 20 min a 5000 rpm em temperatura igual a 25ºC e, posteriormente, a amostra foi injetada em um cromatógrafo a gás (CG). A quantidade de aroma solúvel em fase aquosa foi calculada pela interpolação dos picos das áreas de uma curva padrão.
A Figura 2.3 reporta as curvas de solubilidade do n-hexanol em função da temperatura em água e em diferentes concentrações de sacarose.
Figura 2.3 - Solubilidade do n-hexanol em água e em solução aquosa de sacarose em várias temperatura ( Água; 30g sacarose/100g água; 43,5g sacarose/100g água e
Na Figura 2.3 observa-se que a solubilidade do n-hexanol em água decresce com a temperatura e em soluções aquosas de sacarose observa-se que em temperaturas mais baixas como -5 e 0º C a solubilidade é maior do que em temperatura igual a 4ºC, demonstrando que a temperatura também influenciou na solubilidade do composto em questão. Ainda, diferenças significativas entre todas as soluções também podem ser observadas, uma vez que em concentrações mais elevadas de açúcar a solubilização do n-hexanol foi comprometida.
De maneira similar ao procedimento e aparato experimental desenvolvido por Oliveira (2004), em estudos de solubilidade de ácidos benzóico, bórico e salicílico, Pires (2011) avaliou vinte e dois sistemas, sem que houvesse formação de duas fases líquidas, em temperaturas variando de 293 a 313 K. As amostras da camada sobrenadante foram analisadas por gravimetria, espectrofotometria ou por titulação. A partir dos dados experimentais, o autor também correlacionou os dados experimentais estimando parâmetros com equações racionais disponíveis na literatura e convenientemente modificadas, permitindo a comparação dos resultados dos ajustes com os dados obtidos experimentalmente para solubilidade dos ácidos.
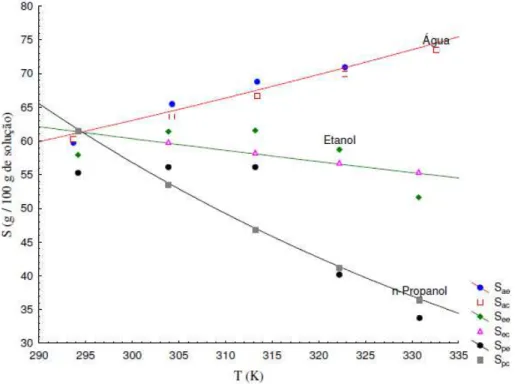
Pires e Franco Jr. (2008) estudaram a solubilidade de ácido benzóico em soluções contendo etanol e n-propanol, em temperaturas entre 30 e 60ºC, o mesmo aparato desenvolvido por Oliveira (2004). Os autores obtiveram sucesso nas determinações da solubilidade do ácido nas misturas de solventes, encontrando que a adição de etanol ou n-propanol em água aumenta a solubilidade do ácido e ainda, que houve contribuição da temperatura, a solubilidade do ácido aumentou com a elevação da temperatura. O estudo também concluiu que o processo utilizado para obter os valores de solubilidade do estudo produziram dados experimentais confiáveis.
Revisão Bibliográfica
Figura 2.4
-
Solubilidade do ácido cítrico em água, etanol e em misturas de etanol e água, em função da temperatura , ajustadas por uma equação exponencial (Extraído de OLIVEIRA, 2009).Figura 2.5
-
Solubilidade do ácido cítrico em função da fração molar inicial de etanol (X2) naOutro estudo interessante e recente foi o realizado por Jouyban et al. (2010) que determinaram a solubilidade do antraceno em misturas binárias e ternárias de acetato de etila+cicloexanona, cicloexanona+metanol, acetato de etila+metanol e cicloexanona+acetato de etila+metanol a 298,15K. As misturas binárias e ternárias de solventes foram preparadas pelas misturas de volumes adequados de solventes para serem determinadas as frações molares dos solventes considerando as densidades dos solventes puros. Testes preliminares foram feitos para obtenção do tempo de decantação, o qual foi confirmado em 72 h. O antraceno foi colocado no interior da célula numa quantidade que excederia a de equilíbrio com as misturas binárias e ternárias de solvente a 298,2K. Utilizou-se um agitador disposto no interior de uma incubadora equipada com um sistema de controle de temperatura com a incerteza de 0,2K. As soluções foram filtradas com filtros hidrofóbicos Durapore (0,45 μm) e em seguida diluídas com 2-propanona. A absorbância dessas soluções foram determinadas no comprimento de onda de 356 nm usando um espectrofotômetro. Investigações preliminares mostraram que o filtro não absorve o soluto ao longo do processo de filtração. As concentrações das soluções diluídas foram determinados a partir de curvas de calibração de absorbância e os dados de solubilidade obtidos foram obtidos em triplicatas.
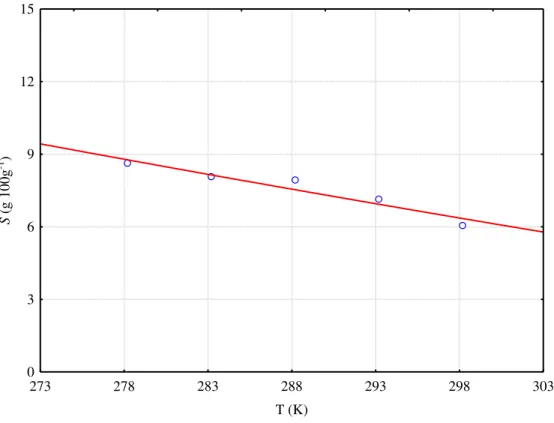
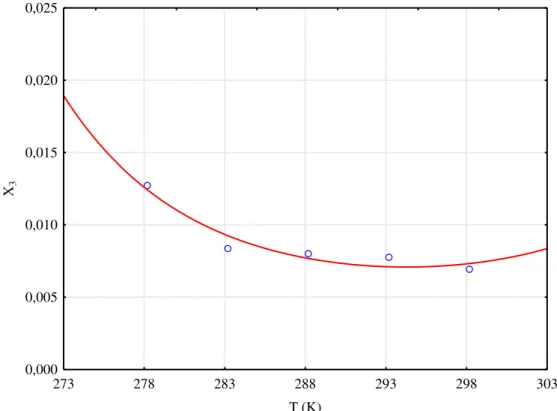
A solubilidade de ácido ascórbico (vitamina C) em água, etanol, propan-1-ol e em misturas de água + etanol e água + propan-1-ol, foi estudada por Ribeiro Neto et al. (2010) em temperaturas de 25 a 35ºC. A solubilidade foi medida por gravimetria em pressão atmosférica de 0,0920 MPa. O estudo foi realizado em célula de equilíbrio com temperatura controlada por um banho termostático e os resultados mostraram concordância satisfatória dos dados experimentais com dados disponíveis na literatura e, ainda, que houve eficiência do método. Verificou-se que a solubilidade do ácido ascórbico aumenta em função da fração da massa de água em misturas iniciais de água e etanol na faixa de temperatura avaliada e que a solubilidade da vitamina C aumenta com a temperatura.
Revisão Bibliográfica
diminuiu à medida que a concentração de frutose aumentou, e ainda, que o aumento na temperatura do sistema desfavoreceu a solubilização do acetato de etila em misturas diluídas de frutose. A Tabela 2.2 apresenta os dados experimentais de solubilidade de acetato de etila em soluções aquosas de frutose em concentrações de 0,005 a 0,0020 g/gH2O.
Tabela 2.2 - Solubilidade do acetato de etila, Ceq (gsoluto/ gsolução) em soluções aquosas de
frutose em temperaturas de 5, 10 e 20 ºC. Temperatura
(ºC)
Concentração da solução de frutose C(g gH2O-1)
Solubilidade Ceq(gsoluto/ gsolução)
5
0,005 0,0529 ± 0,002
0,010 0,0579 ± 0,002
0,020 0,0464 ± 0,001
10
0,005 0,0415 ± 0,001
0,010 0,0413 ± 0,001
0,020 0,0274 ± 0,001
20
0,005 0,0370 ± 0,001
0,010 0,0336 ± 0,001
0,020 0,0276 ± 0,001
(Fonte: BORGES, SILVA E FRANCO JR., 2013).
Figura 2.6 - Variação da absorbância da mistura com o tempo à temperatura de 5 oC ( 0,005 g gH2O-1; 0,010 g g
H2O-1 0,020 g gH2O-1). (Fonte: BORGES, SILVA E FRANCO
2.6.Correlações, ajustes e modelagem de dados de solubilidade
Oliveira e Cabral (1997) coletaram dados de equilíbrio de fases a pressões elevadas dos sistemas binários CO2-Limoneno e CO2-Citral e do sistema ternário CO2-Limoneno-Citral
da literatura e usaram na modelagem termodinâmica que emprega a equação de estado de Peng-Robinson. Os parâmetros de interação binária entre CO2-Limoneno e CO2-Citral foram
obtidos pelo ajuste dos modelos a dados experimentais, fazendo uso de dois programas computacionais, os quais envolvem a minimização de uma função objetivo, pelo método Simplex de Nelder e Mead (1965), que foi escrita em termos dos desvios relativos entre os pontos experimentais e os calculados pelos modelos. O equilíbrio de fases do sistema ternário foi calculado utilizando-se os parâmetros de interação binária ajustados previamente e considerando parâmetros nulos entre os componentes limoneno e citral. A análise dos resultados indicou, para as condições supercríticas, que os dois modelos foram capazes de predizer qualitativamente o sistema ternário, fornecendo resultados compatíveis, em ordem de grandeza, com os valores experimentais.
Revisão Bibliográfica
Gong, Wang e Qu (2011) avaliaram experimentalmente a solubilidade de D-glicose, D-frutose e sacarose em misturas solventes compostas por água e etanol em baixas temperaturas. Ainda, utilizaram o modelos UNIFAC modificado, S-UNIFAC e mS-UNIFAC para predizer o equilíbrio sólido-líquido. Estes autores observaram que a solubilidade dos três açúcares diminui com a diminuição do equilibrio da temperatura e que comparando os modelos, os resultados calculados com o UNIFAC modificado ajusta-se melhor com os resultados experimentais.
Malagoni (2006) e Pires (2011) com o objetivo de verificar a possibilidade da correlação dos dados de solubilidade, a partir de equações empíricas publicadas na literatura para correlacionar dados de solubilidade em função da temperatura, utilizaram duas equações racionais. De acordo com os autores, as equações que foram utilizadas em seus estudos foram desenvolvidas por Heidman et al.(1985) e Yaws et al.(1993), contudo, foram modificadas e adequados para o ajuste aos dados do estudo.
Em estudos sobre o processo de cristalização da sacarose em leito vibrado, Quintino (2014) avaliou, dentre outros aspectos, a análise da influência das variáveis supersaturação, intensidade de vibração e tempo de operação no processo de cristalização. Utilizou o software Table Curve 2D (versão 5.0) para identificar a equação que melhor descrevia a curva de ajuste dos pontos experimentais do processo de cristalização. O software anteriormente citado é uma ferramenta utilizada para indicar previamente equações que possam ser capazes de ajustar dados experimentais a partir da avaliação dos resíduos, dos parâmetros e do coeficiente de correlação quadrática (R2).
Uma vez que é impossível obter dados experimentais em todas as combinações de temperatura e composições de mistura, torna-se essencial a descrição do equilíbrio de fases por um modelo termodinâmico que possa ser utilizado em interpolações e, por conseguinte, auxiliar na seleção de condições operacionais de equipamentos e processos (SANAIOTTI, 2010).
conhecidos dos dados experimentais. Em termos de modelos para ajuste dos dados experimentais notou-se que, sistemas em que se empregou solventes puros, podem ser descritos tanto pela equação exponencial quanto pela polinomial. Por outro lado, os dados de solubilidade em misturas água-álcool foram melhor ajustados pela equação exponencial.
Sousa Jr., Malagonie Franco Jr. (2012) realizaram análises de modelos triviais para estimativa da solubilidade de sistemas contendo ácidos em solução Os autores selecionaram alguns dados de sistemas experimentais contendo um ácido, como por exemplo, ácido tereftálico, ácido isoftálico, ácido salicílico e ácido benzóico, em presença de um ou mais solventes (ácido acético, acetonitrila, acetona, água, etanoato de butila+metanol, água+metanol.). Os dados experimentais foram ajustados com três modelos que os prevêem a influência da temperatura na solubilidade do composto e são apresentados na forma de uma equação contendo seus respectivos parâmetros ajustáveis. Neste estudo as equações utilizadas foram propostas por Williamson et al. (1944), Nordstrom e Rasmuson (2006) e Buchowsky et al.(1980), respectivamente, Equações 2.10, 2.11 e 2.12.
Em que X2 é a fração molar do soluto na fase líquida e A, B e C são parâmetros
ajustáveis.
Revisão Bibliográfica
Nordstrom e Rasmuson (2006) investigaram a solubilidade do ácido salicílico em metanol, acetonitrilo, ácido acético, acetona, água, e acetato de etila, na faixa de temperatura de 10 a 50°C. Nos estudos a fusão do ácido salicílico foi determinada por calorimetria de varredura diferencial e a correlação foi observada entre a solubilidade e a entalpia de van't Hoff de solução. Os autores identificaram que a solubilidade do ácido salicílico variou consideravelmente com solvente, indicativo de comportamento não ideal e a correlação entre diferentes solventes, à temperatura constante foi observada traçando a entalpia van't Hoff da solução em função de ln x. O ácido salicílico exibe uma solubilidade muito baixa em água quando comparado com os solventes orgânicos. Ainda, realizaram os dados e solubilidade do ácido salicílico foram com polinômios de segundo grau e os ajustes apresentaram coeficiente de correlação quadrática (R2) satisfatórios, com valores superiores a 0,9997 para todos os solventes estudados.
O conhecimento do comportamento termodinâmico de misturas é uma informação relevante durante o projeto de equipamentos empregados em processos de separação. Tradicionalmente para a representação do equilíbrio de fases de misturas envolvidas nestes processos são empregados modelos de coeficiente de atividade. Esses por sua vez possuem parâmetros de interação intermoleculares que precisam ser determinados a partir de dados experimentais de equilíbrio.
A determinação destes parâmetros caracteriza um problema inverso, isto é, um problema de estimação de parâmetros (SILVA, FRANCO JR. e LOBATO, 2014). Esses mesmos autores determinaram os parâmetros de interação do sistema ternário acetato de etila/água/açúcar usando o Algoritmo de Evolução Diferencial com sub-populações (EDsp.).
Tabela 2.3
-
Parâmetros de interação dos sistemas considerando todos os modelos termodinâmicos via aplicação do MLM e do algoritmo EDsp.Modelo Metodologia Sistema a12/a21/a23/a32/a13/a31 (cal/mol)
Wilson
MLM
Acetato de etila (1)/ Água (2)/Glicose (3)
1115,34/1998,75/-1078,59/384,75/-3613,21/-5332,59
EDsp 1115,34/1998,75/-1078,58/384,74/-3613,19/-5332,62* MLM Acetato de etila (1)/
Água (2)/Sacarose (3)
1115,34/1998,75/37,66/-43,73/-2296,90/-4630,44 EDsp 1115,34/1998,75/37,65/-43,73/-2296,89/-4630,43*
NRTL
MLM Acetato de etila (1)/ Água (2)/Glicose (3)
734,67/2176,70/366,68/-963,85/2335,93/1911,35 EDsp 734,67/2176,70/366,67/-963,84/2335,92/1911,36* MLM
Acetato de etila (1)/ Água (2)/Sacarose (3)
734,67/2176,70/931,18/-1154,58/2963,60/1875,07 EDsp 1154,55/2963,60/1875,06734,67/2176,70/931,18/-*
UNIQUAC
MLM Acetato de etila (1)/ Água (2)/Glicose (3)
-150,43/-438,35/399,23/-207,34/166,83/409,43 EDsp -150,43/-438,35/399,23/-207,34/166,80/409,42* MLM Acetato de etila (1)/
Água (2)/Sacarose (3)
-150,43/-438,35/-136,87/140,72/-298,63/75,77 EDsp -150,43/-438,35/-136,88/140,70/-298,60/75,78*
(Fonte: SILVA, FRANCO JR. e LOBATO, 2014)
Os pesquisadores concluíram que os resultados obtidos pelo algoritmo EDsp sempre foram superiores aos encontrados pelo Método de Levenberg-Marquardt - MLM e pelo Algoritmo de Evolução Diferencial - ED. Nos casos onde aplicou-se o MLM e o algoritmo ED observou-se que os mesmos são sensíveis a escolha da estimativa inicial, conduzindo desta forma para soluções locais. Já o algoritmo EDsp, observa-se que, independentemente da escolha da semente inicial, o algoritmo sempre foi capaz de obter a melhor solução. Isto se deve ao procedimento de diversidade de soluções através troca de informações entre as sub-populações consideradas. Ainda, em termos dos modelos termodinâmicos considerados, a escolha do melhor, para o sistema considerado, pode ser realizada a partir da predição dos valores de solubilidade para temperaturas na faixa de 5ºC a 25ºC com os parâmetros determinados.
Estudos recentes têm dado atenção especial para o cálculo das propriedades termofísicas usando modelos preditivos. Considerando o sistema em equilíbrio líquido-líquido, empregando a Equação (2.9), já apresentada, é possível avaliar a solubilidade com os dados obtidos através dos experimentos de solubilidade dos compostos aromáticos em várias soluções aquosas, contendo diferentes tipos e concentrações de açúcares. Modelos tradicionais de coeficiente de atividade devem ser inseridos e seus parâmetros deverão, de alguma forma, serem encontrados.
Revisão Bibliográfica
2.7.Compostos aromáticos aplicados na indústria alimentícia
Uma das questões fundamentais para a área de alimentos é a relação entre a qualidade percebida pelo consumidor e a presença de compostos responsáveis por seu sabor e aroma, parâmetros essenciais da qualidade de alimentos (GAVA; SILVA; FRIAS, 2008). O aroma é ocasionado por várias substâncias voláteis, representantes de muitas classes de compostos como hidrocarbonetos, aldeídos, ésteres, cetonas, álcoois, aminas, autoxidação de carotenóides, sulfurados, metabólitos de lipídeos e outros componentes (MACHADO et al., 2007).
Aromatizante é a substância que confere e intensifica o aroma nos alimentos, e flavorizante é a substância que confere ou intensifica o sabor e o aroma dos alimentos (VENTURINI FILHO, 2010).
Ésteres de ácidos carboxílicos são componentes importantes de aromas naturais usados na indústria alimentícia que contribuem na formação e acentuação dos aromas em alimentos. Muitos deles são responsáveis por odores de frutas e fragrâncias dos alimentos que são constituídos principalmente por ácidos e seus derivados de cadeia curta como acetatos, propionatos e butiratos (MACEDO e PASTORE, 1997).
A retenção de componentes aromáticos em matrizes de alimentos é importante na percepção de produtos alimentícios e em sistemas aquosos a retenção destes compostos podem ser modificados pelas interações fisico-químicas entre as macromoléculas assim como proteínas polissacarídeos, lipídios e componentes aromáticos (DRUAUX e VOILLEY, 1997; de ROOS, 2003; SEUVRE et al., 2000).
Ainda, interações específicas resultam na associação de componentes aromáticos aos componentes dos alimentos, tal como as ligações covalentes e ligações de hidrogênio e interações hidrofóbicas. Entretanto, essas interações dependem das propriedades físico-químicas e formulações dos aromas e das macromoléculas (MEYNIER et al. 2004; REINERS et al, 2000). Ainda, por exemplo, de acordo com Rinaudo (2004), o exato mecanismo envolvido na retenção de aromas em soluções contendo polissacarídeos não está completamente entendido, visto que uma das razões para explicar tal dificuldade, são a estrutura química de alguns polissacarídeos que variam de acordo com a quantidade e com processo industrial de obtenção e purificação.
Entre os ésteres , acetato de butila e etila são incluídos. O maior grupo de compostos de sabor nos vinhos consiste em ésteres de ácidos monocarboxílicos alifáticos. Acetato de butila, e muitos dos seus ésteres de cadeia longa de vinho são formadas por leveduras, principalmente, por meio de reações enzimáticas durante a fermentação e não nas reações químicas entre o etanol e os ácidos correspondentes (FRANCO e JANZANTTI , 2005; SUOMALAINEN e NYKÄNEN, 1983). Sabe-se que 29% dos compostos detectados na natureza são os ésteres de fruta . Além disso, eles tinham um maior número de compostos identificados, e as notas frutadas doces de cupuaçu acerola ou aroma, por exemplo, foram atribuídos pela sua presença. Ésteres alifáticos composto da classe maior (31 %) do total de compostos voláteis encontrados no sumo doce frutado. O extrato obtido a partir de diferentes amostras de frutas do Brasil apresenta um agradável aroma frutado doce, ter proporções mais elevadas de compostos de alto ponto de ebulição doces. (FRANCO e JANZANTTI, 2005).
Os flavorizantes e aromatizantes, quando adicionados aos alimentos e bebidas, exercem funções como criar sabores inexistentes, reforçar, repor, substituir e mascarar aqueles presentes. Os principais aromas utilizados na indústria de bebidas são obtidos de extratos alcoólicos ou essências, soluções aquosas ou emulsões, soluções aromáticas em glicerol ou propilenoglicol (VENTURINI FILHO, 2010).
Ésteres encontram-se abundantemente na natureza e muitos deles são responsáveis pelos perfumes naturais e pelos odores e aromas das frutas. Etanoato de pentila (acetato de n-amila), tem odor de banana, metanoato de 2-metilpropila (formiato de isobutila) tem odor e sabor de framboesa, acetato de etila é utilizado como um componente de formulações de essências artificiais de maçã, pera, framboesa, pêssego, e groselha, e o acetato de butila tem sabor de maça verde (RUSSEL, 2008; SAFFIOTI, 1968; SOLOMONS, 1983).
Compostos voláteis do aroma são em sua maioria, substâncias termolábeis, sujeitos a rearranjos, ciclizações e oxidações, quando submetidos a qualquer aumento da temperatura ou mudança físico e química (FRANCO, 2004).
Os ésteres de baixa massa molecular são solúveis em água como resultado da ligação de hidrogênio entre a água e o oxigênio carboxílico. Entretanto, à medida que a massa molecular aumenta a solubilidade diminui (RUSSEL, 2008).
Revisão Bibliográfica
propriedades das soluções como a atividade de água também influenciaram na solubilidade dos aromas.
Covarrubias-Cervantes et al. (2005b) estudaram experimentalmente o efeito da temperatura na solubilidade de vários componentes aromáticos em soluções aquosas, em temperaturas baixas e em temperaturas negativas, objetivando compreender as interações físico e químicas de moléculas voláteis em alimentos em baixas temperaturas. Nos ensaios, os autores observaram que a solubilidade de várias soluções aquosas diminuía quando a concentração do substrato aumentava e que a solubilidade em soluções contendo polióis foi maior quando comparada às soluções que continham apenas polissacarídeos.
As exatas composições de muitas bebidas alcoólicas são segredos comerciais; no entanto, há uma extensa literatura sobre os componentes de aroma que estão normalmente presentes em níveis reduzidos, mais do que 1300 dos quais foram identificados (SUOMALAINEN; NYKÄNEN, 1983). As informações sobre os compostos aromáticos é menos extensa. Um exemplo interessante é o licor chinês (FAN ;QIAN, 2006), que tem forte aroma frutado, como aromas de abacaxi e banana. Sessenta e oito componentes voláteis, incluindo álcoois, ésteres, ácidos, acetais, cetonas, aldeídos e compostos heterocíclicos, foram identificados em licores chineses (FAN; QIAN, 2006). Poucos estudos relatam sobre compostos aromáticos neles. Seria muito importante o conhecimento dos dados de concentração de equilíbrio para o aroma do tipo chinesa aroma de bebidas, com base no coeficiente de atividade do odor calculado. Até agora, nenhum estudo informou sobre a contribuição de compostos aromáticos para o bouquet característico deste licor (FAN; QIAN, 2006).