Ciclo reprodutivo de macacos-prego (Cebus libidinosus) em cativeiro : aspectos comportamentais e hormonais
Texto
(2) UNIVERSIDADE DE BRASÍLIA FACULDADE DE CIÊNCIAS DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE. ROSÂNGELA CORRÊA RODRIGUES. CICLO REPRODUTIVO DE MACACOS-PREGO (Cebus libidinosus) EM CATIVEIRO: ASPECTOS COMPORTAMENTAIS E HORMONAIS. Dissertação apresentada como requisito parcial para a obtenção do grau de Mestre em Ciências da Saúde pelo Programa de Pós-graduação em Ciências da Saúde da Universidade de Brasília.. Orientadora: Profa Dra Maria Clotilde Henriques Tavares. Brasília 2010.
(3) ROSÂNGELA CORRÊA RODRIGUES. Ciclo Reprodutivo de Macacos-prego (Cebus libidinosus) em CATIVEIRO: Aspectos Comportamentais e Hormonais Dissertação apresentada como requisito parcial para a obtenção do grau de Mestre em Ciências da Saúde pelo Programa de Pós-graduação em Ciências da Saúde da Universidade de Brasília.. Aprovado em (dia) (mês) (ano). BANCA EXAMINADORA. ___________________________________________________ Orientadora Profa Dra Maria Clotilde Henriques Tavares UnB ___________________________________________________ Presidente Profa Dr. Valdir Figueiras Pessoa UnB. ___________________________________________________ Profa Dra Maria Bernardete Cordeiro de Sousa UFRN ___________________________________________________ Profa Dra Marília Barros UnB.
(4) Dedico este trabalho aos meus pais e ao grande amor da minha vida, Charles..
(5) AGRADECIMENTOS. Primeiramente, agradeço a Deus por tudo! À Universidade de Brasília e ao Programa de Pós-graduação em Ciências da Saúde pela oportunidade de realizar esse projeto de Mestrado. A Capes pela concessão de bolsa de pesquisa. A minha orientadora Profa. Dra Maria Clotilde Henriques Tavares por toda a confiança depositada em mim, os ensinamentos, sinceridade e amizade. Serei eternamente agradecida por tudo que fez por mim! Ao Prof. Dr. Valdir Figueiras pelo exemplo humildade. Jamais esquecerei aquela tarde que me recebeu tão bem no laboratório e me apresentou a minha orientadora. Ao Prof. Carlos Alberto Bezerra Tomaz pela sua sabedoria e por tudo fez e tem feito por todos seus alunos do Laboratório de Neurociências e Comportamento. Minha eterna admiração! À Profa Marília Barros pela disciplina “Fisiologia do Comportamento” que acrescentou muito em meu aprendizado. À Profa Maria Bernadete Cordeiro de Sousa e toda sua equipe do Laboratório de Medidas Hormonais da Universidade Federal do Rio Grande do Norte (UFRN) pela extração e dosagem hormonal e aprendizado adquirido durante o estágio. Aos meus sujeitos de estudo os macacos-pregos Kiko, Noé, Macaxeira, Dunga, Salete, Maneca, Cida, Aurora, Minha Rosa e Minha Flor. À vocês todo meu carinho e respeito. Aos Veterinários Raimundo Oliveira Silva e Danilo S. Teixeira e aos tratadores Geinaldo Vieira da Silva e Pedro Adão Silva pelo tratamento com os animais e pela manutenção do Centro de Primatologia da UnB. Ao meu colega Carlos Enrique Uribe Valência por toda dedicação com os colegas do Laboratório e principalmente pela sua ajuda nas análises estatísticas..
(6) A. Wanner. Medeiros,. ex-aluno. do. Laboratório. de. Neurociência. e. Comportamento pela amizade e por ter me recebido tão bem. À Maria Marta Mariano, técnica do Laboratório de Neurociências e Comportamento pelo companheirismo. À minha amiga Carla Oda por tudo! Agradeço a Deus por ter te conhecido! À Eldianne Moreira de Lima pelo auxílio incondicional, por estar sempre disponível por solucionar minhas dúvidas, me apoiando nos momentos mais difíceis. À Renata Bezerra Duarte Migliolo pela sua presença que contagia a todos com alegria. Obrigada por todo apoio, disponibilidade e preocupação. À Ana Garcia por desde o primeiro dia ser tão generosa e agradável. Enfim, agradeço a todos os meus colegas do Laboratório Neurociências: Carolina Carrijo, Corina Satler, Lorena D’ Alcântara,Talita Sacramento, Rafael Pupe, Rafael Souto Maior, Patrícia Salleti, Eduardo e Adriana Magalhães. À Minha família por todo carinho e amor em especial: Ao meu marido e companheiro Charles, que esteve ao meu lado em todos os momentos me incentivando, apoiando e proporcionando momentos de muita felicidade. Eu te amo muito! Aos meus pais Ilton e Marlúcia por tudo. Essa vitória é nossa! Aos meus irmãos Raquel, Wilton, Willan, Wanderson e Mosar. Amo vocês! Aos meus raios de sol Sofia e Isadora. Ao meu cunhado Francisco pelo exemplo de vida..
(7) “Não é o mais forte que sobrevive, nem o mais inteligente, mas o que melhor se adapta às mudanças”. Charles Darwin.
(8) RESUMO. Os hormônios sexuais são moduladores do comportamento, os quais têm um papel fundamental na expressão do comportamento sexual. Assim sendo, o presente estudo teve como objetivo avaliar aspectos comportamentais e hormonais do ciclo reprodutivo de Cebus libidinosus mantidos no Centro de Primatologia da Universidade de Brasília. Para isso, durante quatro meses consecutivos foram observados os comportamentos sexuais e não sexuais e, concomitantemente, coletado material fecal para dosagem hormonal de progesterona e androgénos em C. libidinosus. Os dados foram coletados três vezes por semana em 10 indivíduos. Para a coleta dos dados comportamentais foi empregado o método animal focal com registros contínuos e instantâneos. A extração dos hormônios nas amostras fecais ocorreu por meio da hidrólise e solvólise e a dosagem hormonal através de técnica imuno-enzimática. Para fins de análises, indivíduos foram agrupados em: machos adultos, fêmeas adultas e idosas. Os resultados obtidos revelam que o comportamento sexual nos três grupos observados foi distinto, a maior expressão foi encontrada no grupo das adultas. Em relação aos não-sexuais, foram encontradas médias semelhantes nos três grupos estudados. Porém, a média de comportamento de estereotipia foi bem maior no grupo das idosas. Houve diferença significativa no repertório sexual das fêmeas idosas em relação às fêmeas adultas, possivelmente decorrentes do envelhecimento fisiológico, uma vez que essas fêmeas se encontram em idade bem avançada. Os níveis de progesterona foram entre 0,01 e 99 ng/g de fezes, os da testosterona foram 0 e 351 ng/g. Foi encontrada diferença significativa no comportamento sexual das adultas nas diferentes fases do ciclo menstrual, o qual foi maior na fase folicular, confirmando a hipótese de que as flutuações hormonais decorrentes do ciclo menstrual influenciam na expressão comportamental sexual das fêmeas. Os resultados não indicam diferenças significativas do comportamento dos machos em relação às fases do ciclo das suas respectivas companheiras, não confirmando a hipótese que os machos se comportam diferente em decorrência as flutuações hormonais do ciclo reprodutivo das fêmeas. Os resultados desse estudo foram importantes para entender como os hormônios sexuais influenciam no.
(9) comportamento sexual e não-sexual de C. libidinosus com idades e gêneros distintos. Palavras-chave: esteróides, senescência.. macaco-prego,. Cebus. libidinosus,. comportamento,.
(10) ABSTRACT. The sex hormones are modulators of behavior, which have a key role in the expression of sexual repertoire. Therefore, this study aimed to study the behavioral and hormonal profile of the reproductive cycle of Cebus libidinosus kept at Primate Center at the University of Brasilia. Data collections were conducted over three times per week in 10 subjects, divided in three groups: adult males, adult females and elderly females. Sexual and not sexual behavior was observed continuously for four months, using focal animal sampling by either instantaneous or continuous recordings. Fecal material was collected concurrently to measure hormone progesterone and testosterone. Hormone quantification was achieved by hydrolysis, solvolysis and immune-enzymatic techniques. Sexual repertoire observed in the three groups was different, the highest expression was found in the group of adults. Nonsexual behaviors were found not different among the three groups. However, the average behavior of stereotypy was higher in the group of elderly female. There were significant differences in the sexual repertoire of elderly females in relation to adult female, possibly due to physiological aging, since in these older females progesterone levels were between 0.01 and 99 ng / g of feces. Testosterone was 0 and 351 ng / g in the adult male group. Significant differences in sexual behavior of adult females at different stages of the menstrual cycle, which was greater in the follicular phase, confirming the hypothesis that hormonal fluctuations resulting from the menstrual cycle influence the expression of female sexual behavior. The results indicate no significant differences in the behavior of males in relation to the phases of the cycle of their respective companions, not confirming the hypothesis that males behave differently due to hormonal fluctuations of the reproductive cycle of females. The results of this study were to understand how sex hormones influence the sexual and nonsexual behavior of C. libidinosus with different ages and genders Keywords: senescence.. capuchin. monkey,. Cebus. libidinosus,. behavior,. steroids,.
(11) LISTA DE FIGURAS. Figura 1. Fêmea juvenil de Cebus libidinosus (Foto: Maria Clotilde H. Tavares).. 17. Figura 2. Caracterização da atividade sincronizada do eixo hipotálamo-hipofise-gônadas Fonte: http://googleimagens.com.br/eixohipotalamohipofisegonadas.. 18. Figura 3. Vista parcial de um dos viveiros do Centro de Primatologia, UnB. (Foto: Maria Clotilde Henriques Tavares).. 28. Figura 4. Indivíduo de Cebus libidinosus em situação de alimentação no Centro de Primatologia, UnB. 29. Figura 5. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Maneca Cebus libidinosus do Centro de Primatologia, UnB. 0= corresponde ao primeiro dia de coleta do material biológico.. 42. Figura 6. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Aurora Cebus libidinosus do Centro de Primatologia, UnB. 0= corresponde ao primeiro dia de coleta do material biológico.. 42. Figura 7. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Cida Cebus libidinosus do Centro de Primatologia, UnB. 0=corresponde ao primeiro dia de coleta do material biológico.. 43. Figura 8. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Salete Cebus libidinosus do Centro de Primatologia, UnB. 0= corresponde ao primeiro dia de coleta do material biológico.. 43. Figura 9. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea idosa Minha Flor Cebus libidinosus do Centro de Primatologia, UnB. 0=corresponde ao primeiro dia da coleta do material biológico.. 45. Figura 10. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea idosa Minha Flor Cebus libidinosus do Centro de Primatologia, UnB. 0=corresponde ao primeiro dia da coleta do material biológico.. 45. Figura 11. Concentração dos hormônios progesterona e testosterona em metabólitos fecais (ng/g de fezes) dos casais de Cebus libidinosus do Centro de Primatologia, UnB. O número 0 corresponde ao primeiro dia da coleta do material biológico.. 47.
(12) LISTA DE TABELAS. Tabela 1 – Nome, gênero e idade estimada dos indivíduos de Cebus libidinosus do Centro de Primatologia, UnB. (* = idade estimada).. 29. Tabela 2 – Descrições das categorias comportamentais sexuais de Cebus libidinosus do Centro de Primatologia, UnB registrados por registros contínuos e instantâneo. 30. Tabela 3 – Descrições das categorias comportamentais não-sexuais de Cebus libidinosus do Centro de Primatologia, UnB observados por registros contínuos. 31. Tabela 4 – Média (desvio padrão) dos comportamentos não-sexuais e sexuais dos três grupos de Cebus libidinosus do Centro de Primatologia, UnB. 37. Tabela 5 – Média, desvio padrão, nível de significância e intervalo de confiança dos comportamentos não-sexuais em registros contínuos das fêmeas idosas em relação às adultas (valor de referência) de Cebus libidinosus do Centro de Primatologia,UnB 38 Tabela 6 – Média (desvio padrão) e nível de significância dos registros contínuos do comportamentos sexuais das fêmeas idosa em relação às fêmeas adultas (valor de referência) de Cebus libidinosus do Centro de Primatologia da Universidade de Brasília, UnB. 40. Tabela 7 – Média (desvio padrão) dos comportamentos sexuais e não sexuais das fêmeas adultas em relação à fase folicular e lútea de Cebus libidinosus do Centro de Primatologia da Universidade de Brasília, UnB.. 48. Tabela 8 – Média (desvio padrão) da comparação dos comportamentos sexuais e não sexuais dos machos em relação ao longo das fases reprodutiva das fêmeas adultas de Cebus libidinosus do Centro de Primatologia, UnB. 49.
(13) SUMÁRIO. 1. INTRODUÇÃO. 15. 1.1 PRIMATAS NÃO-HUMANOS COMO MODELOS EXPERIMENTAIS. 15. 1.2 Cebus sp. (MACACO-PREGO). 16. 1.3 FISIOLOGIA REPRODUTIVA. 18. 1.3.1. Eixo Hipotálamo-Hipófise-Gonadal. 18. 1.3.2. Comportamento Reprodutivo. 19. 1.3.3. Ação dos Hormônios Sexuais sobre o Comportamento Sexual. 22. 1.3.4. Maturidade Sexual. 23. 1.3.5. Senescência Reprodutiva. 24. 2. OBJETIVOS. 26. 2.1 OBJETIVO GERAL. 26. 2.2 OBJETIVOS ESPECÍFICOS. 26. 3. 27. MATERIAL E MÉTODOS. 3.1 LOCAL. 27. 3.2 SUJEITOS. 28. 3.3 PROCEDIMENTO. 29. 3.3.1. Observações Comportamentais. 29. 3.3.2. Coleta do Material Biológico. 31. 3.3.3. Extração dos Hormônios. 32. 3.3.4. Dosagem. 33. 3.3.5. Análise de Dados. 34. 3.4 ASPECTOS ÉTICOS. 35. 4. 36. RESULTADOS. 4.1 DESCRIÇÃO DOS COMPORTAMENTOS NÃO-SEXUAIS E SEXUAIS EM MACACOSPREGO 4.1.1. Comparação Entre os Comportamentos das Fêmeas Adultas e Idosas. 36 38. 4.1.1.1 Comportamentos Não-sexuais. 38. 4.1.1.2 Comparação dos Comportamentos Sexuais. 38. 4.2 CARACTERIZAÇÃO DO CICLO REPRODUTIVO. 40. 4.2.1. Fêmeas Adultas. 40. 4.2.2. Fêmeas Idosas. 44. 4.3 NÍVEIS DE TESTOSTERONA EM AMOSTRAS FECAIS DOS MACHOS AO LONGO DO CICLO DAS ADULTAS. 46.
(14) 4.4 COMPORTAMENTOS DAS ADULTAS EM RELAÇÃO À FASE FOLICULAR E À FASE LÚTEA. 47. 4.5 COMPORTAMENTOS DOS MACHOS EM RELAÇÃO À FASE FOLICULAR E À FASE 5. LÚTEA DAS FÊMEAS ADULTAS. 49. DISCUSSÃO. 51. 5.1 COMPORTAMENTOS SEXUAIS E NÃO-SEXUAIS DOS GRUPOS. 51. 5.2 COMPORTAMENTO DAS FÊMEAS IDOSAS EM RELAÇÃO ÀS ADULTAS. 52. 5.3 DOSAGEM HORMONAL. 53. 5.4 COMPORTAMENTO SEXUAL DAS FÊMEAS ADULTAS EM RELAÇÃO ÀS FASES DO 6. CICLO OVARIANO. 56. CONCLUSÕES. 59. REFERÊNCIAS. 60. ANEXO I - FICHA DE REGISTRO. 68. ANEXO II – DOCUMENTO DE APROVAÇÃO DO COMITÊ DE ÉTICA. 70.
(15) 15. 1. INTRODUÇÃO. 1.1 PRIMATAS NÃO-HUMANOS COMO MODELOS EXPERIMENTAIS. Primatas não-humanos têm sido amplamente utilizados na investigação de diversas disciplinas como biologia, matemática, lingüística, psicologia e antropologia (1). Enquanto modelos experimentais, eles têm sido utilizados na área de fisiologia comparada em estudos que incluem desde a análise de comportamentos básicos e de dominância cerebral até fenômenos cognitivos mais complexos. Dessa forma, têm contribuído significativamente para a investigação do funcionamento cerebral humano e de seus mecanismos em estudos moleculares, celulares, filogenéticos, ontogenéticos, de plasticidade, de aprendizagem, memória e cognição (2). A principal justificativa para a utilização dos primatas não-humanos em todas essas áreas devese. à. considerável. similaridade. anatômica,. fisiológica,. endocrinológica. e. comportamental em relação aos humanos (3) Na medida em que eles são considerados a base biológica para compreensão dos aspectos evolutivos, biológicos, genéticos e fisiológicos do comportamento humano. Por essa razão, a utilização de primatas não-humanos na pesquisa científica tem sido bastante profícua em virtude das razões previamente expostas e assim, diversas espécies de primatas não-humanos do Velho Mundo e do Novo Mundo são usadas diariamente em centros de pesquisas científicas. Primatas do Novo Mundo, por exemplo, têm sido utilizados atualmente com as mais diversas finalidades como, promoção do bem-estar animal (4), percepção de cores (5, 6), medo e ansiedade (7), influência ambiental na excreção de esteróides (8), aspectos evolutivos (9, 10), potencial cognitivo e memória (11), estratégias reprodutivas (12), comportamento sexual (13, 14) morfologia do ciclo ovariano (15), fisiologia reprodutiva (16, 17) e senescência reprodutiva (18-20). O presente estudo foi desenvolvido com uma espécie de primata do Novo Mundo, o macaco-prego (Cebus libidinosus) cujas características são expostas a seguir..
(16) 16. 1.2 Cebus sp. (MACACO-PREGO). Dentre as principais características para o sucesso da utilização do Cebus como sujeito experimental é o fato de serem animais altamente treináveis, ativos e apresentarem uma saúde robusta (21). O gênero Cebus é comumente usado em pesquisas biomédicas com ênfase nos aspectos reprodutivos; tais como técnicas reprodutivas, ciclo ovariano, citologia vaginal durante o ciclo menstrual e hormônios sexuais (22). Além das caracteristicas citadas acima, o gênero Cebus possui um cérebro bastante desenvolvido, com eficiente sistema de comunicação visual, olfativa, auditiva, além de habilidades manuais altamente elaboradas (23). A complexidade cerebral é atribuida a sua capacidade em mapear, em termos espaciais e temporais, suas fontes de alimentos (24). Macacos-prego também apresentam habilidades de armazenamento de informações a longo prazo pelo uso da memória operacional e capacidade de resolução de testes cognitivos complexos (11, 25). As suas habilidades incluem também a capacidade sofisticada de utilização de ferramentas (26, 27), que possibilitam a esses primatas conseguir abrir frutas de casca dura usando pedras e pedaços de pau, ferramentas rústicas, as quais os auxiliam a quebrar a casca e acessar o fruto (28). Apresentam ainda a capacidade de cooperação com membros da espécie para obtenção de alimento (21). Macaco-prego é nome popular para todos os representantes do gênero Cebus, que pertence à ordem dos Primate, à infra-ordem Platyrrhini (primatas do Novo Mundo) e à família Cebidae (29) (Figura 1). O gênero Cebus é composto por sete espécies, das quais seis ocorrem no Brasil: Cebus albifrons, C. apella, C. libidinosus, C. nigrivittatus, C. xanthosternos, C. olivaceus e C.flavius (30), Cebus apella é a espécie mais estudada no gênero Cebus (31)..
(17) 17. Figura 1. Fêmea juvenil de Cebus libidinosus (Foto: Maria Clotilde H. Tavares).. O gênero Cebus é encontrado nas áreas florestais da América Central e do Sul. No Brasil, esse táxon ocupa florestas tropicais e áreas montanhosas do litoral do sudeste. Em habitat natural formam grupos contendo indivíduos de ambos os sexos e todas as idades (23). As habilidades manipulativas e a flexibilidade comportamental dos macacos-prego facilitam a sua ampla distribuição (21), As dimensões dos grupos sociais variam de 3-5 indivíduos até 40 indivíduos (32). Nos grupos o número de fêmeas adultas parece, geralmente, superar o de machos adultos. Dentre os primatas neotropicais, o macaco-prego possui tamanho corporal médio, pesando entre 1,4 e 4,8 kg, porém os machos adultos são maiores que as fêmeas, o que lhes confere um aparente dimorfismo sexual (33). A estrutura social dos grupos selvagens é comumente caracterizada como multimachos, com a dominância hierárquica influenciando diretamente no sucesso de forrageamento e no comportamento social. (28). Os macacos-prego são animais onívoros consumindo uma grande variedade de itens alimentares (21). A maior parte de sua dieta é constituída principalmente por frutos maduros carnosos e insetos, embora também possam incluir sementes, flores, brotos e pequenos vertebrados (34)..
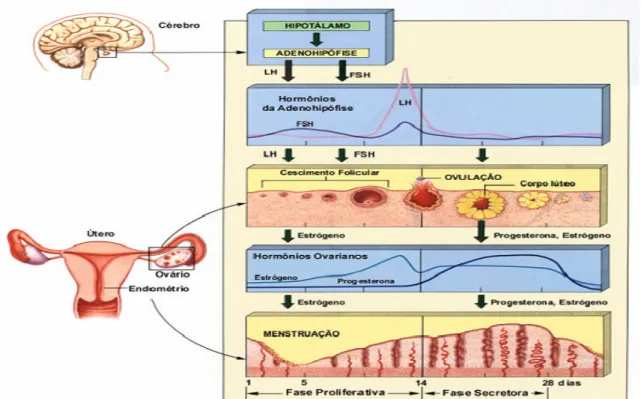
(18) 18. 1.3 FISIOLOGIA REPRODUTIVA. 1.3.1 Eixo Hipotálamo-Hipófise-Gonadal. A reprodução é um processo fundamental para a manutenção e a perpetuação das espécies (35). A produção de gametas maduros requer uma orquestração adequada entre os diversos órgãos envolvidos na reprodução: hipotálamo, hipófise e gônadas. O hipotálamo e a glândula hipófise formam uma unidade que exerce controle sobre a função de várias glândulas endócrinas, como tireóide, adrenais e gônadas (36). Em ambos os sexos, o cérebro age como um maestro: os neurônios peptidérgicos hipotalâmicos produzem hormônios liberadores de gonadotrofinas (GnRH), que após alcançarem a adeno-hipófise, via sistema porta-hipofisário, estimulam a produção e secreção de duas gonadotrofinas, o hormônio luteinizante (LH) e o hormônio folículo-estimulante (FSH) (36) (Figura 2).. Figura 2. Caracterização da atividade sincronizada do eixo hipotálamo-hipofise-gônadas Fonte: http://googleimagens.com.br/eixohipotalamohipofisegonadas..
(19) 19. Em homens, o LH e o FSH estimulam a produção de andrógeno e inibina, os quais agem no trato reprodutivo coordenando a maturação e o transporte de espermatozóides, além de sinalizadores para o sistema hipotálamo-hipofisário no sentido de regular a secreção de gonadotrofinas. Em mulheres, as mesmas gonadotrofinas estimulam o crescimento dos folículos ovarianos e induzem a ovulação, que inicia a formação do corpo lúteo. As gonadotrofinas também iniciam a formação de estrógenos, progesterona e inibina, que agem nos órgãos reprodutores femininos e no eixo hipotálamo-hipofisário. O LH age conjuntamente com o FSH durante o período de desenvolvimento dos folículos ovarianos. O FSH também é responsável pelo processo de ovulação que ocorre aproximadamente na metade do ciclo sexual feminino e também pelo estímulo da síntese de outro esteróide sexual, a progesterona. Antes da ovulação a progesterona é sintetizada nas células do estroma ovariano e, depois da ovulação, no corpo lúteo. Esses esteróides, basicamente, estimulam as funções secretoras do endométrio e inibem a contratilidade uterina, ações, portanto, muito relacionadas à manutenção do feto no útero (36). Na mulher, o clico menstrual é caracterizado por modificações cíclicas através de hormônios sexuais no ovário, na camada interna do útero e no miométrio. Se o óvulo não for fecundado, haverá uma diminuição de estrógeno no sangue, cessando a secreção hipofisária de LH. Na ausência do LH, o corpo lúteo deixa de formar progesterona resultando no espessamento da parede uterina ocorrendo, assim, à descamação dessa estrutura, o que é conhecido como menstruação (37). O ciclo ovulatório em Cebus apella a descamação do epitélio vaginal ou período menstrual, coincide com o pico de progesterona (38).. 1.3.2 Comportamento Reprodutivo. O. comportamento. reprodutivo. inclui. vários. comportamentos. como. cortejamento, acasalamento, cuidado com a prole entre outros. Ele constitui a categoria mais importante entre os comportamentos sociais, pois sem ele as espécies não perpetuariam (39)..
(20) 20. Em termos do comportamento sexual, o primeiro estágio consiste na atração entre machos e fêmeas, em que há a emissão de sinais químicos (40). Assim, do ponto de vista biológico, o que torna um ser vivo funcionalmente pleno é a sua possibilidade de transmitir o patrimônio genético para a geração subseqüente, ou seja, reproduzir-se (41). Dentro dessa perspectiva, vários estudos objetivam esclarecer os mecanismos fisiológicos relacionados à reprodução, processo fundamental para a manutenção e perpetuação das espécies (36). O comportamento reprodutivo em muitas espécies de animais pode ser influenciado por vários fatores importantes, tais como: a extensão do dia durante o inverno (23), a oferta de recursos alimentares (42), as mudanças na cor da genitália feminina (43), os níveis dos hormônios sexuais (14), e o envelhecimento reprodutivo (44). Nos primatas, assim como ocorre em várias outras espécies, a seqüência reprodutiva durante a vida de uma fêmea corresponde à ovulação, copulação, gestação, nascimento e lactação. Este ciclo reprodutivo geralmente, não recomeça, até que a prole da gestação anterior se desenvolva (37), embora sejam vistas exceções para algumas espécies. Em fêmeas de primatas do Velho Mundo, com exceção do homem, e poucas outras espécies, a ovulação coincide com um aumento da temperatura, há um aumento do tamanho (inchaço sexual) e mudança da cor que podem indicar a fase fértil (43) exemplos: Macaca sylvanus (45) Macaca fascicularis (46), Macaca mulatta, (47). O macho possui percepção ao estro feminino, fenômeno produzido por glândulas olfatórias que cedem informações sobre o ciclo reprdutivo das fêmeas. Cabe ainda mencionar que o comportamento sexual das fêmeas é alterado durante a fase fértil, na qual elas tornam-se mais ativas e solicitam o acasalamento prestes à ovulação ocorrer (23). Na fase periovulatória, foi verificado para Cebus capucinus que embora as fêmeas não forneçam pistas morfológicas ou comportamentais de que a ovulação está ocorrendo, os machos são capazes de detectá-la (31). Nesse caso, o melhor indicador da fase do ciclo pareceu ser um aumento na expressão de comportamento sexuais do macho dirigidos às fêmeas no período periovulatório.Tanto na natureza como em cativeiro, fêmeas de Cebus apella se reproduzem sazonalmente ou.
(21) 21. apresentam picos de nascimento entre os meses de outubro e fevereiro, coincidindo com a época de maior disponibilidade de frutos e insetos (42). Em Cebus sp. a variedade imensa de comportamentos sexuais permite o melhor entendimento sobre os comportamentos relacionados com a fertilidade e a concepção. As fêmeas Cebus apella exibem notáveis evidências do comportamento sexual. e. solicitam. cópula. com. machos. “alfa”. (dominantes). através. de. comportamentos como: levantar das sobrancelhas, tocar e correr, massagear as axilas, erguer a cabeça, vocalizar, e outros. Estes comportamentos persistentes são ditos como indicativos de estro, uma vez que as fêmeas os exibem durante o período ovulatório e, os direcionam somente aos machos “alfa” (13). As fêmeas dessa espécie também copulam com machos subordinados, mas somente no final de sua fase proceptiva, quando o suposto período conceptivo estiver passado (31) e a ovulação ocorre perto do fim da fase proceptiva da fêmea (38). Sendo assim, existem grandes chances da concepção ter ocorrido através da cópula com machos subordinados. Vale advertir que as fêmeas são seletivas e escolhem machos com melhor combinação física e sexual, sendo esse o provável pai da futura geração. Existem três componentes - atratividade, proceptividade, e receptividade importantes na fase de sexualidade de muitas espécies de fêmeas primatas (38). A atração, definida como o conjunto de características físicas não-comportamentais que aumentam o interesse sexual dos machos pelas fêmeas, como por exemplo, mudança na cor dos pêlos, odor e aumento da temperatura. A proceptividade, referese aos padrões comportamentais apresentados pela fêmea no intuito de iniciar e manter uma interação sexual com machos, tais como, tocar e correr, tocar gentilmente no nariz e a emissão de sinais vocais. E por fim, a receptividade, confere a prontidão da fêmea em permitir a copulação e a ejaculação do macho (21). Desta forma, durante a época do acasalamento, o comportamento sexual de fêmeas e machos apresenta-se alterado em relação à fase não-reprodutiva (14).
(22) 22. 1.3.3. Ação dos Hormônios Sexuais sobre o Comportamento. Sexual. As alterações do ambiente interno e externo requerem do animal respostas que possibilitam sua adaptação. Muitas dessas respostas são dadas pela ação dos hormônios, os quais possuem papel fundamental na fisiologia da reprodução, estimulando ou inibindo o desenvolvimento de características sexuais e reprodutivas, do ponto de vista morfológico, fisiológico e psíquico (37). Essa mesma visão é compartilhada por Aires (36) na regulação das funções reprodutoras, o hipotálamo constitui uma estrutura integradora das modificações hormonais produzidas pelas gônadas e das alterações do meio interno proveniente do ambiente. As. modificações. na. produção. dos. hormônios. induzem. alterações. morfológicas e comportamentais que caracterizam cada um dos ciclos sexuais. A ação dos hormônios sexuais está diretamente ligada ao comportamento sexual apresentado durante a época reprodutiva.existem diferenças entre o comportamento sexual de machos e fêmeas, o qual é influenciado pelas taxas hormonais dos hormônios sexuais (48). De fato existe um dimorfismo sexual no sistema nervoso desses animais, e ele se estabelece ao longo do desenvolvimento embrionário e pósnatal, esse processo depende dos hormônios das gônadas. São muitos os exemplos de dimorfismo sexual no sistema nervoso (40). Muitos comportamentos diferem entre os sexos e, por conseguinte, refere-se ao dimorfismo sexual (49). O ciclo ovariano durante a época reprodutiva em muitas espécies de primatas mostram variações morfológicas refletidas por diferentes níveis de estrógenos e progesterona (50). Os níveis de hormônios ovarianos estão associados com o comportamento sexual (14). A análise dos hormônios sexuais possibilita o monitoramento do ciclo ovariano e do comportamento sexual (14). Em um estudo que mensurou os níveis plasmáticos de hormônios sexuais em fêmeas de macacos-prego submetidas ao tratamento à base de testosterona intranasal. Tavares. et. al.,. (52). verificaram. aumento. da. expressão. dos. comportamentos sexuais durante o tratamento com testosterona, acompanhado do aumento de seus níveis plasmáticos, sugerindo uma possível sensibilidade ao.
(23) 23. hormônio e, conseqüentemente, uma ação potencializadora na expressão dos comportamentos sexuais. Outra função importante dos hormônios em relação ao comportamento sexual é a inibição da fertilização em fêmeas subordinadas (22). Em estudos sobre o comportamento social dos Leontophitecus rosalia (mico-leão-dourado), Pissinatti et al., (53) analisaram os ovários das fêmeas com o objetivo de avaliar, classificar e comparar a taxa de atresia folicular de três grupos de fêmeas: dominantes, dominantes não reprodutiva e subordinadas. Quando se comparou esses três grupos de fêmeas em relação à percentagem de folículos degenerados, observou- se diferença estatística entre os níveis hormonais das fêmeas dominantes e dominantes não reprodutivas, e entre as fêmeas dominantes e subordinadas.A supressão ou inibição da reprodução das demais fêmeas do grupo imposta pela fêmea reprodutora parece influenciar na fisiologia reprodutiva das demais fêmeas, por meio da ação dos ferormônios emitidos pela fêmea ativamente reprodutiva através de marcações anogenitais ou circungenitais de cheiro.. 1.3.4 Maturidade Sexual. Em mamíferos um dos últimos sistemas de órgãos a amadurecer é o sistema reprodutivo, e a maturidade sexual acontece concomitante ao amadurecimento das estruturas reprodutivas. Em muitas espécies de primatas, notáveis mudanças hormonais e morfológicas são indicadores de amadurecimento reprodutivo (31). O amadurecimento reprodutivo conhecido como puberdade na mulher e em algumas espécies de primatas é caracterizada pela fase de desenvolvimento das estruturas reprodutivas do organismo, essa fase começa com o aparecimento da primeira menstruação ou menarca. A maturidade sexual na mulher aparece entre 09 e 17 anos de idade variando em virtude de fatores como clima, raça, estado nutricional e emocional e outros (36). O ciclo menstrual ou estral tem em média 28 dias. e (37) a ovulação ocorre em torno do 14o dia, isto é, no meio do ciclo ovariano, que é dividido em duas fases: a primeira corresponde ao amadurecimento do folículo (fase proliferativa) e a segunda, após a ovulação, corresponde à formação do corpo lúteo (fase secretora)..
(24) 24. No gênero Cebus, ciclo menstrual dura entre 15 a 21 dias e é acompanhado de um sangramento muito discreto. As fêmeas atingem a maturidade sexual entre 0 e 4 anos de idade, embora dificilmente reproduzam até que tenham atingido inteiramente o seu peso de adulta, e isso ocorre em torno dos cinco anos de idade (21). Os machos expressam o seu interesse pelo sexo oposto por volta dos três anos de idade, enquanto os juvenis se engajam em comportamentos e brincadeiras sexuais. Em cativeiro, a maturidade sexual pode ocorrer mais precocemente (54). A menstruação é uma indicação da maturidade reprodutiva (38). Em Cebus sp. o ciclo menstrual quando comparados aos primatas do Velho Mundo e humanos se correlacionam em parâmentros morfológicos e endócrinos (54). Sendo assim, são bons modelos de estudo para uma análise comparativa e os achados poderão contribuir para um melhor entendimento dos fatores reprodutivos em humanos.. 1.3.5 Senescência Reprodutiva. A ação do tempo sobre o sistema nervoso não se resume ao desenvolvimento embrionário e pós-natal, uma vez depois de atingir a maturidade, as células vão envelhecendo lentamente (40). O envelhecimento faz parte do ciclo biológico de todos os seres vivos (nascer, crescer, reproduzir, envelhecer e morrer). Após os indivíduos atingirem certa idade, inicia-se uma redução dos níveis de testosterona em homens e estrogênio e progesterona em mulheres, fases conhecidas, respectivamente, como andropausa e menopausa, caracterizadas por mudanças na fisiologia reprodutiva dos indivíduos e conseqüente declínio nas atividades sexuais (36). O envelhecimento traz consigo uma série de conseqüências indesejáveis para o organismo animal, tais como a perda da vitalidade e alterações no funcionamento dos sistemas biológicos, afetando direta ou indiretamente a função reprodutiva, devido ao mau funcionamento dos demais sistemas (51). No entanto, o envelhecimento reprodutivo apresenta-se de maneira distinta em machos e fêmeas. Nos machos está ligado à perda gradual das funções testiculares, enquanto que, nas fêmeas ocorre exaustão completa das células germinativas, perda completa da fertilidade e diminuição na circulação dos esteróides.
(25) 25. gonadais (17). Na realidade, o envelhecimento reprodutivo em fêmeas é caracterizado por um processo contínuo, iniciado próximo ao nascimento e estendido até a menopausa. Um bom modelo para estudo da senescência reprodutiva são as fêmeas de macaco Rhesus (Macaca mulatta), cujas mudanças hormonais apresentadas são semelhantes à espécie humana (17). Essas mudanças incluem um declínio nos níveis dos estrógenos (18). Diante do mencionado acima o presente estudo apresentou um aspecto importante do comportamento sexual que é a utilização de duas fêmeas de idade avançada (35 anos) cujos dados permitirão verificar como se encontram nessa faixa etária o comportamento sexual, uma vez que, o fenômeno da senescência reprodutiva em primatas não humanos ainda tem sido pouco estudado, porém, tem suma importância para o entendimento do processo natural de envelhecimento e do conjunto de fenômenos associados ao declínio reprodutivo..
(26) 26. 2. OBJETIVOS. 2.1 OBJETIVO GERAL. Caracterizar o ciclo reprodutivo de Cebus libidinosus, considerando os aspectos comportamentais e hormonais.. 2.2 OBJETIVOS ESPECÍFICOS. Descrever o comportamento sexual e não-sexual das fêmeas idosas, adultas e machos; Comparar o comportamento sexual das fêmeas idosas em relação às adultas; Caracterizar o ciclo reprodutivo das fêmeas adultas e idosas através da mensuração do hormônio progesterona; Mensurar os níveis de testosterona em amostras fecais dos machos ao longo do ciclo das adultas; Analisar o comportamento sexual dos machos segundo a fase do ciclo das fêmeas adultas; Analisar o comportamento sexual das fêmeas adultas segundo a fase do ciclo menstrual..
(27) 27. 3. MATERIAL E MÉTODOS. 3.1 LOCAL. O presente estudo foi realizado no Centro de Primatologia da Universidade de Brasília (UnB) que se encontra situado na Fazenda Água Limpa (FAL), na região de Vargem Bonita, a cerca de 25 km do centro de Brasília, no Distrito Federal. A FAL possui uma área de 4.340 ha, dos quais a metade corresponde à área de preservação ambiental (APA) e o restante destina-se à prática de ensino, pesquisa e extensão, alem de integrar uma área de importante corredor ecológico no Distrito Federal. O Centro de Primatologia, é um criadouro científico (no de registro IBAMA 1/53/1999/000006-2) vinculado ao Instituto de Ciências Biológicas (IB) da UnB, o qual, dispõe de assistência veterinária permanente. Seus animais são mantidos segundo as normas de manutenção dos animais em cativeiros do Instituto Nacional dos Recursos Renováveis e do Meio Ambiente (IBAMA). As instalações do Centro de Primatologia estão organizadas em laboratório, escritórios, sala de aula, quarentena, cozinha, além de 36 viveiros (Figura 3). Estes viveiros estão situados em meio à vegetação local, próximos à mata de galeria. Atualmente o centro abriga três espécie de primatas do Novo Mundo: Callithrix sp, Cebus sp e Saimiri sp..
(28) 28. Figura 3. Vista parcial de um dos viveiros do Centro de Primatologia, UnB. (Foto: Maria Clotilde Henriques Tavares).. 3.2 SUJEITOS. Participaram desse estudo dez indivíduos de Cebus libidinosus (macacoprego), sendo seis fêmeas (quatro adultas e duas idosas) entre 15 e 34 anos de idade, e quatro machos adultos com idade média de 20 anos, de acordo com registros do Centro de Primatologia (Tabela 1). A distribuição dos animais está apresentada na Os sujeitos estavam expostos às mesmas condições de manutenção: em viveiros medindo 4m x 2,5 m x 3m (comprimento, largura e altura, respectivamente), sob condições naturais de luminosidade e temperatura. Os viveiros possuem um sistema de divisão interna com porta guilhotina que permite a separação de sujeito de seu (s) companheiro (s) durante as sessões experimentais. Esse sistema auxiliou na coleta do material biológico, facilitando a entrada do pesquisador dentro dos viveiros. Os animais foram alimentados Figura 4 diariamente entre 7:00h e 7:30 h da manhã, com uma dieta à base de frutas, legumes, ovos, ração, suplementos vitamínicos, e água fornecida ad libitum..
(29) 29. Tabela 1 – Nome, gênero e idade estimada dos indivíduos de Cebus libidinosus do Centro de Primatologia, UnB. (* = idade estimada). Grupos. Sexo. Idade em anos. Fêmeas Idosas. Minha Rosa Minha Flor. 36 36. Fêmeas Adultas. Maneca Cida Aurora Salete. 17 18 14 19. Machos Adultos. Kiko Noé Dunga Macaxeira. 09 24 19 18. Figura 4. Indivíduo de Cebus libidinosus em situação de alimentação no Centro de Primatologia, UnB. 3.3 PROCEDIMENTO. 3.3.1 Observações Comportamentais. Anteriormente à coleta dos dados, os indivíduos passaram por um período de habituação ao pesquisador, o qual consistiu de dois meses. Esse contato visou minimizar interferência do observador no registro de estudo, além possibilitar o aperfeiçoamento das técnicas de registro do comportamento..
(30) 30. Os animais foram observados durante um período de quatro meses entre os meses de março e junho de 2009 com finalidade de se quantificar o comportamento sexual e não-sexual. Todos os animais foram observados, no período da manhã, uma vez por dia durante três vezes por semana, em dias fixos as segundas, quartas e sextas-feiras. O comportamento observado foi dividido em: sexual (Tabela 2), definidos com base nos estudos de (50) e não-sexuais (Tabela 3), baseado em (52). O repertório comportamental foi anotados e analisados, de acordo com a freqüência e duração. Para tal, foram utilizadas as técnicas de observação método amostragem focal com registro contínuo (duração em segundos) e registro instantâneo (frequência) de cada comportamento apresetado pelos animais(55). Para cada sessão de observação, 14 minutos foram registrados sendo sete minutos para o registro contínuo e outros sete para o registro instantâneo. No Registro instantâneo a cada 15 segundos durante sete minutos foi anotado o comportamento apresentado pelo individuo. O modelo de ficha de registro utilizada encontra-se no Anexo I. Tabela 2 – Descrições das categorias comportamentais sexuais de Cebus libidinosus do Centro de Primatologia, UnB registrados por registros contínuos e instantâneo continua. Comportamento. Descrição. Contato físico*. Tocar, segurar, agarrar ou outro contato físico dissociado do contexto sexual (catação, brincadeira). Tentativa de Cópula*. Comportamento dirigido do macho para a fêmea, com monta ou tentativa de monta.. Cópula*. Acasalamento do macho e fêmea, independentemente da postura de ocorrência.. Exibição*. Apresentar a genitália para o parceiro, podendo ser do macho para a fêmea ou vice-versa.. Levantar Sobrancelhas** Machos e fêmeas levantam e abaixam as sobrancelhas Encarar**. Ambos se encaram mutuamente.
(31) 31. conclusão. Comportamento. Descrição. Massagear** Peito, Axila e Genitália**. A fêmea manipula com a mão as regiões da mama, da axila e genitália.. Olhar com Inclinada**.. a. Cabeça Inclinar a cabeça lateralmente em relação ao plano vertical. * Método de registros contínuos ** Método de registro instantâneo Tabela 3 – Descrições das categorias comportamentais não-sexuais de Cebus libidinosus do Centro de Primatologia, UnB observados por registros contínuos. Comportamento. Descrição. Atividade. Deslocamento ou movimentação do animal dissociada de contexto sexual. Inclui forrageio, alimentação e, outros comportamentos sociais. Repouso Estereotipia. Catação Agonístico Outros. Ausência de atividade por parte do animal e de engajamento em comportamento o ativo. Inclui parar, dormir, descansar. Movimentos repetidamente apresentado pelo animal sem sentido . Catar os pêlos de outro individuo Ameaça de um animal para o outro com mostra de dentes, corpo direcionado para frente, podendo envolver luta franca ou injuria Que incluem comportamentos de brincadeiras, vigília, bebendo água.. 3.3.2 Coleta do Material Biológico. Concomitantemente ao período de monitoramento comportamental foram coletadas amostras de fezes frescas para extração hormonal. Primeiramente, o chão de todos os viveiros foi vistoriado no intuito de descartar as fezes frescas.
(32) 32. indiscriminadas e não identificadas em relação ao animal de estudo, pois nos viveiros habita mais de um animal e esses não foram separados no período noturno. Após a coleta dos dados comportamentais, os animais eram separados nos respectivos viveiros em compartimentos diferentes através do sistema de porta guilhotina que dividia o viveiro em dois ambientes diferentes. Isso permitiu a identificação das fezes de cada sujeito separadamente e também a entrada do pesquisado no recinto para a coleta do material biológico. Após a defecação as fezes foram coletadas em saquinho plástico previamente identificado com nome, data e horário da coleta, e em seguida, acondicionadas em isopor contendo gelo para transporte até ao Laboratório de Neurociências e Comportamento, UnB. No laboratório as amostras de fezes foram armazenadas em freezer à temperatura de 20° C anteriormente as análises.. 3.3.3 Extração dos Hormônios. A extração dos hormônios foi realizada no Laboratório de Análises Hormonais da Universidade Federal do Rio Grande do Norte (UFRN). Após serem retiradas do freezer as amostras foram colocadas à temperatura ambiente por um período de aproximadamente 10 minutos para descongelamento. Em seguida, com o auxílio de uma espátula, cada amostra fecal foi homogeneizada, e por meio de uma balança de precisão foi pesada uma alíquota de 0,1g de fezes, a qual foi transferida para um tubo plástico de 15 mL, devidamente identificado. Nas amostras de fezes foram dosados os hormônios progesterona e testosterona. Os procedimentos de dosagem hormonal em fezes requerem a separação dos hormônios do material biológico. Para isso, foram utilizados dois processos seqüenciais ,os quais serviram para separar os hormônios unidos por meio de ligações simples, duplas e triplas para posterior quantificação. Conforme descrito por (56), compreendendo as etapas de hidrólise e solvólise. O primeiro processo teve como objetivo separar os esteróides que estavam na forma livre e sob conjugação simples do restante do material da amostra, enquanto, segundo objetivou separar os esteróides que estavam sob dupla e tripla conjugação. Esses processos encontram-se descritos abaixo:.
(33) 33. 1) Hidrólise: Nessa etapa foi adicionado 05 mL de etanol 50% em água destilada nas alíquotas das fezes Após este procedimento, as amostras foram agitadas em vórtex durante 05 minutos, centrifugadas e decantadas em tubos de vidro de 07 mL. Posteriormente, as amostras foram estocadas em freezer a -200 C. 2) Solvólise: Nessa etapa, as amostras hidrolisadas foram acondicionadas à temperatura ambiente durante 10 minutos e o volume de 500µl de cada alíquota foi pipetado em tubos de extração. Em seguida, foram adicionadas à cada amostra os volumes de 100 µl de cloreto de sódio (NaCl) saturado, 50 µl de ácido sulfúrico (H2SO4) e 05 mL de acetato de etila. Após estes procedimentos, os tubos foram levados ao agitador durante 01 minuto e em seguida colocados em banho-maria à 400 C, durante toda a noite. No dia seguinte, foi adicionado 2,5 mL de água destilada e filtrada. As amostradas foram agitadas em vórtex durante 05 minutos e depois centrifugadas a 3.000 rpm durante 03 minutos. O sobrenadante foi separado em tubos de 12x75 mm e levado para secar em banho-maria, até a parte líquida ser toda evaporada. O volume foi ressuspendido utilizando 500 µl de álcool etílico. Por último, as amostras novamente foram agitadas durante 30 segundos.. 3.3.4 Dosagem. Após os processos de extração de hormônios das amostras fecais foi utilizada a técnica imuno-enzimática (ELISA) para dosagem de progesterona para as fêmeas e testosterona para os machos. Essa técnica foi realizada de acordo com o protocolo desenvolvido originalmente por (57) para dosagem de esteróides no plasma e modificada para o emprego em fezes, conforme descrito por (56). O procedimento geral para determinação dos níveis de esteróides em fezes consiste nos seguintes passos: 1. Pipetagem das alíquotas após retirar da geladeira e agitá-la durante 5 segundos; 2. Secagem do volume com jato de ar em banho-maria à 400 C; 3. Adição aos tubos após secagem de 300µl da solução preparada com enzima (HRP) conjugada ao respectivo hormônio;.
(34) 34. 4. Agitação dos tubos e transferência do volume, para tubos de plástico de 1,6 mL; 5. Pipetagem de um volume de 100 µl em cada um dos furos da placas (Nunc) contendo o anticorpo anti-Progesterona ou anti-Testosterona; 6. Incubação das placas durante duas horas em câmara de umidade; 7. Após este período, foi feita a adição de 100 µl/furo da placa da solução preparada a partir de 25 mL de tampão citrato (citric acid anhydrous-C6H807/SIGMA) a 10% ABTS (2,2’-anzino-bis 3 ethylbenzthiazoline-6-sulfonic acid/SIGMA) 250 µl do substrato e 80 µl de H202 a 15%; 8. Incubação da placa por cerca de uma hora na câmara de umidade; 9. Adição de 100 µl/furo da placa da solução para parar a reação, preparada a partir de 25mL da solução de ácido fluorídrico (3,5 mL de ácido fluorídrico a 70% 6,0 mL de NaOH 1 M, completando o volume para 50 mL, com 25 mL de água destilada e 50 µl de EDTA (Ethylenediamine-tetraacetic acid/SIGMA). 10. Leitura da densidade óptica no espectrofômetro (Dynatech, MR-500), com filtro de 410 nm.. 3.3.5 Análise de Dados. A análise do comportamento sexual e não-sexual foi realizada com base na soma da duração (segundos) dos registros contínuos e a soma das freqüências absolutas para todos os comportamentos dos registros instantâneos e contínuos respectivamente. As medidas escolhidas para a descrição dos resultados foram a média e o desvio padrão. Após análise do nível de progesterona as fases do cilo menstrual foram determinadas em fase folicular e fase lútea. A fase folicular foi definida como o período com os mais baixos níveis de progesterona. O período com elevação da concentração de progesterona representou a fase lútea..
(35) 35. A tabulação de todo o banco de dados foi realizada no programa Excel 2007 para Windows. Para a análise dos dados, foi usado o programa SPSS (Statistical Package for Social Sciences) versão 13.0 para Windows. Foram calculados valores de referência para os comportamentos sexuais e não-sexuais das fêmeas adultas (média dos valores). Os comportamentos de cada fêmea idosa foram comparados a esses valores de referência mediante o teste t para uma amostra. Como os dados do presente estudo não apresentaram distribuição normal pelo teste de Kolmogorov-Smirnov, foram utilizados testes não-paramétricos. Para as comparações entre dois grupos foi utilizado o teste de Mann-Whitney. Para todos os testes estatísticos realizados o nível de significância foi estabelecido em p≤ 0,05.. 3.4 ASPECTOS ÉTICOS. Anteriormente à execução deste estudo, o projeto de pesquisa foi avaliado e aprovado pelo Comitê de Ética no Uso Animal (CEUA) do Instituto de Ciências Biológicas da Universidade de Brasília (Protocolo no UnBDOC no. 32945/2009) (Anexo II)..
(36) 36. 4. RESULTADOS. 4.1 DESCRIÇÃO DOS COMPORTAMENTOS NÃO-SEXUAIS E SEXUAIS EM MACACOS-PREGO. Na Tabela 4 são apresentadas as médias e respectivos desvios dos comportamentos não-sexuais e sexuais para os três grupos de C. Libidinosus. Em virtude de que várias categorias comportamentais não foram exibidas pelas fêmeas idosas e pelos machos adultos, não foi possível verificar se as diferenças obtidas foram significativas do ponto de vista estatístico. Desta forma, os comportamentos serão apenas descritos com base nas suas médias e desvios-padrão. Dentre os comportamentos não-sexuais, o tempo médio gasto em “atividade” foi maior em comparação às outras categorias estudadas, ou seja, os indivíduos passaram a maioria do tempo alimentando-se, forrageando e deslocando-se. Entretanto, dentro dessas subcategorias a alimentação foi a mais evidenciada. A média dessa categoria foi maior nos grupos das fêmeas e machos adultos. No entanto, a estereotipia teve uma média muito maior no grupo das idosas em relação às fêmeas e machos adultos, sendo que estes últimos apresentaram o dobro da média das fêmeas adultas. As categorias repouso e comportamento agonístico foram semelhantes tanto para as fêmeas idosas como para as adultas, porém, nos machos adultos o tempo gasto emitido para essas categorias foi inferior em relação aos outros dois grupos. Em relação à catação e outros comportamentos, foi encontrado que os machos tiveram tempo gasto maior do que as fêmeas as quais, apresentaram tempo médio similar entre si. Os comportamentos sexuais verificados por meio de registro contínuo e instantâneo dos grupos de estudo também são apresentados na Tabela 4. Somente os machos apresentaram comportamento de corte. O contato físico, tentativa de cópula e tocar e correr foram emitidos apenas pelos animais adultos, não sendo emitidos pelas fêmeas idosas. O tempo médio gasto em exibição foi bem maior nas.
(37) 37. fêmeas adultas e embora tenha sido encontrado apenas nas fêmeas. Todos os comportamentos oriundos de registro instantâneo foram realizados pelas fêmeas adultas, os quais, em média foram superiores aos apresentados pelas idosas e pelos machos adultos. Dentre esses comportamentos, o de levantar as sobrancelhas, encarar, massagear o peito e olhar com a cabeça inclinada foram emitidos com maior freqüência pelas fêmeas adultas. As idosas e os machos adultos não apresentaram os comportamentos de massagear as axilas e genitália. Os machos adultos não tiveram emissão de braço tenso, massagear axila, genitália e o peito. Tabela 4 – Média (desvio padrão) dos comportamentos não-sexuais e sexuais dos três grupos de Cebus libidinosus do Centro de Primatologia, UnB. Comportamentos. Grupos Idosas. Adultas. Adulto. 196,3 (133,2). 232 (138). 234,9 (110,6). Estereotipia Repouso Agonístico Catação. 127,9 (138,8) 26 (54,3) 5,2 (21,2) 12,8 (38,8). 31,1 (71,3) 24,2 (61,7) 7,5 (35,5) 13,6 (49,1). 63,2 (94,1) 15,6 (39,9) 3,7 (15,2) 19,3 (65,6). Outros. 32,7 (44,7). 34,1 (62,3). 42,5 (62,8). _. _. 4,6 (26,9). _ _ 1,6 (7,4) _. 5,5 (26,9) 0,2 (1,6) 18,3 (61,8) 0,8 (5,6). 10,5 (46,2) 1,2 (7,5) _ 0,5 (3,6). Levantar sobrancelhas Massagear axila Massagear genitália. 0 (0,3) _ _. 1,1 (2,8) 0,4 (1,6) 0,4 (2,1). 0,1 (0,3) _ _. Encarar Massagear peito Braço tenso Olhar com cabeça virada. 0,3 (1,2) 0 (0,1) 0,1 (0,4) 0,1 (0,4). 1,1 (3) 0,9 (3,4) 0,6 (2,9) 0,9 (3,4). 0,1 (0,4) _ _ 0 (0,1). Não-sexuais Registro contínuo Atividade. Sexuais Registro contínuo Corte Contato Físico Tentativa de cópula Exibição Tocar e correr Registro instantâneo.
(38) 38. 4.1.1 Comparação Entre os Comportamentos das Fêmeas Adultas e Idosas. 4.1.1.1 Comportamentos Não-sexuais. Como mencionado anteriormente, foram calculados valores de referência para os comportamentos sexuais e não-sexuais das fêmeas adultas (média dos valores). Assim, os comportamentos de cada fêmea idosas obtidos foram comparados com esses valores de referência mediante o teste t para uma amostra. Os comportamentos não-sexuais das idosas estão expostos na Tabela 5. A média de atividade na fêmea M. Rosa foi menor em relação aos das adultas (p < 0,001). No entanto, a idosa M. Flor teve uma média significativamente maior em relação ao valor de referência (p< 0,001). A média de estereotipia foi muito maior na M. Rosa e menor na M.Flor (p <0,001). Os demais comportamentos (repouso, catação, agonístico, e outros) emitidos pelas fêmeas não apresentaram diferenças significativas. Tabela 5 – Média, desvio padrão, nível de significância e intervalo de confiança dos comportamentos não-sexuais em registros contínuos das fêmeas idosas em relação às adultas (valor de referência) de Cebus libidinosus do Centro de Primatologia, UnB. Comportamentos não-sexuais. Registro contínuo Atividade Estereotipia Repouso Agonístico Catação Outros. Idosas Valor M. Rosa referência Média (dp). p-valor. Média(dp). p-valor. 232 31,1 24,2 7,5 13,6 34,1. <0,001* <0,001* 0,254 0,538 0,234 0,888. 298,9 (84,4) 9,6 (27,7) 34 (66,9) 5,1 (19,1) 18,3 (44,4) 35,2 (46,3). <0,001* <0,001* 0,384 0,453 0,526 0,505. 89,4 (80,3) 249,8 (92,5) 17,3 (35,8) 5,1 (23,1) 7,1 (31,7) 29,3 (43,2). M. Flor. 4.1.1.2 Comparação dos Comportamentos Sexuais. Como identificado na Tabela 6, a duração total dos comportamentos analisados em registro contínuo foi estatisticamente diferente entre o valor de.
(39) 39. referência e as idosas (p<0,001). Os comportamentos de corte, contato físico, tentativa de cópula e tocar e correr não foram apresentados pelas idosas. Já em relação ao comportamento de exibição, as duas idosas apresentaram média diferente do valor de referência (p<0,001). Ainda de acordo com a Tabela 6, no registro instantâneo a soma total dos comportamentos sexuais das adultas foi superior ao das idosas (p<0,001). Os comportamentos de massagear (axila e genitália) não foram apresentados por nenhuma fêmea idosa. A M. Rosa não ostentou nenhum comportamento de levantar das sobrancelhas, braço tenso e nem olhar com a cabeça inclinada, categorias emitidas pela M. Flor. No entanto, foi observada diferença significativa entre o comportamento desta última em relação às adultas (p<0,001). Entre as idosas, apenas M. Rosa apresentou o comportamento de massagear o peito que também foi significativamente diferente das adultas (p<0,001). Ambas figuraram o comportamento de encarar, no entanto, M. Rosa apresentou média maior que M. Flor e não houve diferença estatística entre o comportamento de M. Rosa (p=0, 006) e as fêmeas adultas, diferentemente do que ocorreu para M. Flor em relação às idosas, cuja diferença foi significativa (p<0,001)..
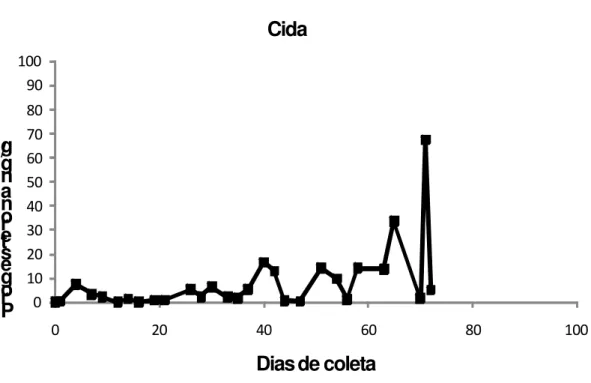
(40) 40. Tabela 6 – Média (desvio padrão) e nível de significância dos registros contínuos do comportamentos sexuais das fêmeas idosa em relação às fêmeas adultas (valor de referência) de Cebus libidinosus do Centro de Primatologia da Universidade de Brasília, UnB. Idosas Valor M. Rosa Comportamentos sexuais referência Média (dp) p-valor. M. Flor Média (dp) p-valor. Registro contínuo Corte. _. _. _. _. _. Contato Fisico Tentativa de cópula Exibição Tocar e correr Total. 5,5 0,2 18,3 0,8 24,3. _ _ 0,1 (0,7) _ 0,1 (0,7). _ _ <0,001* _ <0,001*. _ _ 3,1 (10,2) _ 3,1 (10,2). _ _ <0,001* _ <0,001*. Registro instantâneo Levantar sobrancelhas Massagear axila Massagear genitália Encarar Massagear peito Braço tenso Olhar com cabeça virada Total. 1,1 0,4 0,4 1,1 0,9 0,6 0,9 5,6. _ _ _ 0,3 (1,6) 0,1 (0,2) _ _ 0,4 (1,6). _ _ _ 0,006 <0,001* _ _ <0,001*. 0,1 (0,4) _ _ 0,2 (0,5) _ 0,2 (0,6) 0,1 (0,5) 0,6 (1,3). <0,001* _ _ <0,001* _ <0,001* <0,001* <0,001*. 4.2 CARACTERIZAÇÃO DO CICLO REPRODUTIVO. 4.2.1 Fêmeas Adultas. Os valores de progesterona extraídos de amostras fecais das quatro fêmeas adultas são apresentados nas figuras abaixo. Na fêmea Maneca (Figura 5) os níveis de progesterona foram extremamente baixos até o 27o dia e não ultrapassaram 3 ng/g de fezes. Ocorrem três picos hormonais, o primeiro pico de progesterona ocorreu no 28o dia de coleta com 34 ng/g de fezes, no 58o dia foi registrado um segundo pico hormonal com 86 ng/g de fezes e o terceiro pico foi no 77o dia com valor de 33 ng/g de fezes. Os demais valores foram entre 0,01 e 9 ng/g de fezes..
(41) 41. Em relação ao ciclo menstrual das fêmeas adultas estudadas, o pico de progesterona de Aurora (Figura 6), foi o maior registrado no 42º dia com 99 ng/g de fezes. Nos quinze primeiros dias, o ciclo menstrual da Aurora figurou níveis muito baixos de progesterona próximos de 1 ng/g de fezes. A partir do 16o dia, esses valores começaram a elevar e o primeiro pico ocorreu no 21o com 25 ng/g de fezes. O ciclo apresentou variações com pequenas elevações que não ultrapassaram 7 ng/g de fezes. A fêmea Cida (Figura 7) apresentou um ciclo menstrual muito irregular, onde até 36o dia os níveis de progesterona sofreram variações entre 0,01 e 7 ng/g de fezes. A partir do dia 37º dia, os níveis de progesterona tiveram um aumento e no 40º dia foi registrado um pico de 17 ng/g de fezes. Do 44º ao 64o dia os valores hormonais sofreram variações de 0,5 e 14 ng/g de fezes. O segundo pico hormonal foi registrado no 65º dia com 34 ng/g de fezes. O maior valor hormonal ocorreu no terceiro pico no 71o dia com 67 ng/g de fezes, esse valor sofreu um declínio muito rápido no 72º dia, no qual o nível de progesterona foi de 6 ng/g de fezes. Em Salete (Figura 8) o maior nível de progesterona no ciclo menstrual ocorreu no primeiro pico, que foi registrado no 7º dia de coleta com 21 ng/g de fezes. Do 10º ao 35º dia foram encontrados valores muito baixos de progesterona, não ultrapassando 2 ng/g de fezes. Entre 36º ao 42º dia houve uma pequena elevação do nível de progesterona entre 5 e 10ng/g de fezes. A inexistência de valores hormonais entre os dias 48º ao 59º deveu-se à impossibilidade de coleta de dados nesse período. Os demais valores foram entre 0,01 e 9 ng/g de fezes..
(42) 42. Maneca 100 90 g / 80 g n 70 a n 60 o r 50 e t 40 s e 30 g o r 20 P 10 0 0. 20. 40. 60. 80. 100. Dias de coleta Figura 5. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Maneca Cebus libidinosus do Centro de Primatologia, UnB. 0= corresponde ao primeiro dia de coleta do material biológico.. Aurora 100 90. /g g n a n o r e t s e g o r P. 80 70 60 50 40 30 20 10 0 0. 20. 40. 60. 80. 100. Dias de coleta Figura 6. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Aurora Cebus libidinosus do Centro de Primatologia, UnB. 0= corresponde ao primeiro dia de coleta do material biológico..
(43) 43. Cida 100 90. /g g n a n o r e t s e g o r P. 80 70 60 50 40 30 20 10 0 0. 20. 40. 60. 80. 100. Dias de coleta Figura 7. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Cida Cebus libidinosus do Centro de Primatologia, UnB. 0=corresponde ao primeiro dia de coleta do material biológico.. Salete 100 90 g / 80 g n 70 a n 60 o r 50 e t 40 s e g 30 o r 20 P 10 0 0. 20. 40. 60. 80. 100. Dias de coleta Figura 8. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea adulta Salete Cebus libidinosus do Centro de Primatologia, UnB. 0= corresponde ao primeiro dia de coleta do material biológico..
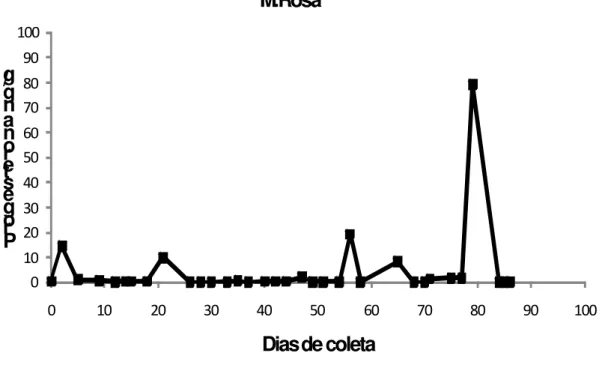
(44) 44. 4.2.2 Fêmeas Idosas. Os níveis de progesterona da M.Flor (Figura 9) foram menores do que os da M. Rosa (Figura 10) ao longo de todo o período estudado. Nos dias em que foram apresentados os maiores valores pela M. Rosa, M.Flor apresentou valores muito baixos. M. Rosa apresentou um pico de 15 ng/g de fezes no 2º dia da coleta e sofreu um declínio rápido no 5º dia de aproximadamente 1 ng/g de fezes; esses valores mantiveram-se baixos até o 20º dia. No dia seguinte, ocorreu o segundo pico com 10ng/g de fezes. No intervalo do 26º ao 54º dia, os níveis de progesterona permaneceram praticamente sem variações com valores muito baixos entre 0,1 e 2 ng/g de fezes. O terceiro pico ocorreu no 56º dia com 19 ng/g de fezes. O maior nível de progesterona da M. Rosa foi encontrado no 79º dia com valor de 79 ng/g de fezes. Esse valor foi semelhante ao encontrado nas fêmeas adultas. M. Flor apresentou níveis de progesterona bem baixos durante todos os dias de observação e do 1º ao 13º dia os valores estiveram próximos de 0 ng/g de fezes. No 14º dia, houve um aumento no nível hormonal com o valor de 6 ng/g de fezes, porém não foi caracterizado como um pico hormonal. Entre o 15º ao 33º dias, os valores foram de 0 a 5 ng/g de fezes. O maior nível de progesterona foi dosado no 42º dia com 10ng/g de fezes. Os outros registros mais altos não ultrapassaram 9 ng/g de fezes, e os demais ficaram entre 0 e 6 ng/g de fezes..
(45) 45. M.Flor 100 90. g / g n a n o r e t s e g o r P. 80 70 60 50 40 30 20 10 0 0. 10. 20. 30. 40. 50. 60. 70. 80. 90. 100. Dias de coleta Figura 9. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea idosa Minha Flor Cebus libidinosus do Centro de Primatologia, UnB. 0=corresponde ao primeiro dia da coleta do material biológico.. M.Rosa 100. g / g n a n o r e t s e g o r P. 90 80 70 60 50 40 30 20 10 0 0. 10. 20. 30. 40. 50. 60. 70. 80. 90. 100. Dias de coleta Figura 10. Concentração de progesterona em metabólitos fecais (ng/g de fezes) da fêmea idosa Minha Flor Cebus libidinosus do Centro de Primatologia, UnB. 0=corresponde ao primeiro dia da coleta do material biológico..
(46) 46. 4.3 NÍVEIS DE TESTOSTERONA EM AMOSTRAS FECAIS DOS MACHOS AO LONGO DO CICLO DAS ADULTAS. Os dados coletados para cada fêmea foram classificados como pertencentes a duas categorias: fase folicular ou lútea. O critério de classificação foi o aumento dos níveis de progesterona. A fase lútea inicia-se com o aumento dos níveis de progesterona, inclui o pico máximo e termina quando os valores de hormônio voltam aos valores basais (antes do aumento). A Figura 11 ilustra os níveis de testosterona (machos) em relação aos níveis de progesterona (fêmeas). O casal Salete e Kiko apresentou os níveis mais baixos desses hormônios. Os níveis de testosterona foram entre 6 e 90 ng/g de fezes. Já para a progesterona, os níveis variaram entre 0,01 e 21 ng/g de fezes. O maior valor encontrado de testosterona não coincidiu com o pico da progesterona, pois no 7º dia a fêmea apresentou o maior nível com 21 ng/g de fezes, e o macho teve o maior nível no 82º dia 90 ng/g de fezes. No entanto, houve entre os menores valores uma sincronia hormonal. Um pequeno aumento dos níveis de testosterona foi registrado no 42º dia, ocorrendo também o aumento nos níveis de progesterona da fêmea. O casal Maneca e Noé apresentou níveis hormonais mais altos quando comparados ao casal anterior. Os níveis de testosterona foram entre 4 e 319 ng/g de fezes para esse macho, já para a progesterona foram entre 0,01 e 86 ng/g de fezes. O maior nível de testosterona foi registrado no 2º dia com 319 ng/g de fezes, nesse mesmo dia a fêmea registrou nível muito baixo de progesterona com 0,02 ng/g de fezes. O maior nível de progesterona foi no 58º dia com 68 ng/g de fezes, e nesse mesmo dia o nível de testosterona foi baixo 9 ng/g de fezes. Entre o período do 15º ao 26º dia foram encontrados baixos níveis hormonais tanto na fêmea como no macho. A partir do 98º dia, os níveis de testosterona sofreram um aumento contínuo e esse aumento também foi observado na fêmea. Em seguida, os dois hormônios sexuais declinaram. No casal Cida e Macaxeira foram evidenciados valores hormonais entre 0 e 351 ng/g de fezes para testosterona e 0,01 e 67 ng/g de fezes para progesterona. Os níveis de testosterona no Macaxeira mostrou-se bastante irregular quando relacionados aos outros machos estudados, pois no 37º dia foi registrado o maior.
Imagem


Documentos relacionados
Atividades – Execução de pesquisa bibliográfica; Utilização de normas e guidelines para a prática clínica especializada; Utilização de protocolos
populações ribeirinhas para ambientais e de Desenvolvimento desenvolvimento sustentável na e Tecnologias Apropriadas na Amazônia Amazônia - Grupo Inter-Ação da Universidade Federal
Além do mais, acreditamos que estes elementos acima relacionados já são suficientes para sinalizarem o avanço na direção do desenvolvimento sustentável na agricultura,
O referido amuleto foi elaborado, deste modo, a partir da experiência e dos instrumentais do próprio Pedro Gonçalves Pereira, elemento que define, inclusive, nossa ótica
“The European understanding is that pharmaceutical care basically is ‘the professional care for the individual pa- tient in a pharmacy.’ It can be described as follows:
36 6376 ELAINE RODRIGUES SANTOS SANTIAGO 6,00 AMPLA CONCORRÊNCIA NÃO CLASSIFICADO. 37 6111 JUCIARA ALVES DOS SANTOS 6,00 AMPLA CONCORRÊNCIA
Para isto serão separados em quatro 4 grupos com utilização do sistema adesivo ParaBond para as resinas Fill-Up e foram analisados dois tipos de sistemas
Neste trabalho serão descritas e analisadas as principais soluções tecnológicas de aperfeiçoamento dos motores de combustão interna – ciclo Diesel - que