Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
Allium cepa e teste do Micronúcleo como bioindicadores de citogenotoxicidade
em extratos aquosos de plantas medicinais
Allium cepa and Micronucleus test as bioindicators of cytogenotoxicity in
aqueous extracts of medicinal plants
DOI:10.34117/bjdv6n10-610
Recebimento dos originais: 13/09/2020 Aceitação para publicação: 28/10/2020
Lorene Rodrigues do Carmo
Graduanda em Biomedicina pelo Centro Universitário de Formiga – UNIFOR - MG R. Dr. Arnaldo Sena, 328, Água Vermelha - Formiga - MG, CEP: 35570-000
E-mail: lorenebiomed@gmail.com
Lizandra Stefânia Leal
Graduanda em Biomedicina pelo Centro Universitário de Formiga – UNIFOR - MG R. Dr. Arnaldo Sena, 328, Água Vermelha - Formiga - MG, CEP: 35570-000
E-mail: lizandrasleal@gmail.com
Lília Rosário Ribeiro
Doutora em Genética e Melhoramento de Plantas, pela Universidade Federal de Lavras Professora titular do Centro Universitário de Formiga – UNIFOR - MG
R. Dr. Arnaldo Sena, 328, Água Vermelha - Formiga - MG, 35570-000 E-mail: lilia@uniformg.edu.br
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
RESUMO
Introdução: Plantas medicinais são utilizadas mundialmente na forma de chás e infusões e, da
mesma forma que podem trazer a cura ou o alívio dos sintomas de determinadas doenças, podem apresentar metabólitos capazes de desencadear efeitos adversos indesejáveis. Os bioensaios A. cepa e o teste do MN são utilizados para o rastreio inicial da citogenotoxicidade de compostos presentes em extratos aquosos de plantas. Objetivo: Avaliar a eficácia dos bioensaios A. cepa e teste do MN no rastreio de compostos tóxicos presentes em extratos aquosos vegetais. Metodologia: Revisão narrativa da literatura, realizada nas bases de dados Pubmed, SCIELO, Google Acadêmico e ANVISA, utilizando as palavras chaves Plantas Medicinais, Teste do Micronúcleo e Allium cepa.
Resultados: Os testes A. cepa e do MN demonstraram ser excelentes bioindicadores para uma
triagem primária de citogenotoxicidade, devido ao seu baixo custo, alta sensibilidade e boa correlação com outros sistemas biológicos. Conclusão: A. cepa e MN são bioensaios promissores e apresentam reprodutibilidade satisfatória, além de serem validados por órgãos reguladores, ampliando sua confiabilidade.
Palavras-chave: Bioensaios, Extratos vegetais, Citogenotoxicidade. ABSTRACT
Introduction: Medicinal plants are used worldwide in the form of teas and infusions and, in the
same way that they can cure or alleviate the symptoms of certain diseases, they can present metabolites capable of triggering undesirable adverse effects. The A. cepa bioassays and the MN test are used for the initial screening for cytogenotoxicity of compounds present in aqueous plant extracts. Objective: To evaluate the effectiveness of A. cepa bioassays and MN testing in the screening of toxic compounds present in aqueous plant extracts. Methodology: Narrative review of the literature, carried out in the databases Pubmed, SCIELO, Google Scholar and ANVISA, using the keywords Plants Medicinal, Micronucleus Test and Allium cepa. Results: The A. cepa and MN tests proved to be excellent bioindicators for primary cytogenotoxicity screening, due to their low cost, high sensitivity and good correlation with other biological systems. Conclusion: A. cepa and MN are promising bioassays and have satisfactory reproducibility, in addition to being validated by regulatory bodies, increasing their reliability.
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
1 INTRODUÇÃO
As plantas medicinais são os principais agentes terapêuticos utilizados desde os tempos antigos (SOUZA et al., 2020). De acordo com a Organização Mundial da Saúde, cerca de 80% das pessoas dependem do consumo de fitoterápicos, e a demanda é crescente devido à pobreza e a falta de acesso à medicina moderna (MELTRO et al., 2019). Segundo o Ministério da Saúde, cerca de 40% dos fármacos disponíveis no mercado dispõem de plantas e outros princípios naturais para seu desenvolvimento (BRASIL, 2016).
De acordo com a Agência Nacional de Vigilância Sanitária (ANVISA) ([2020]) plantas medicinais são aquelas capazes de aliviar ou curar doenças, comumente utilizadas na forma de chás e infusões. Os compostos ativos das plantas que atuam como agentes medicinais, podem estar presentes nas sementes, raízes, folhas, frutos, flores ou em todas as partes de uma planta (JAMSHIDI-KIA; LORIGOOINI; AMINI-KHOEI, 2018). Dentre as funções terapêuticas, merecem destaque as aplicações nos tratamentos de transtorno de ansiedade e depressão, propriedades diuréticas na prevenção de hipertensão arterial, distúrbios gástricos, complemento ao tratamento de diabetes mellitus tipo 2 e atividade antimicrobiana (COSTA et al., 2019; NUNES, 2018; RIGODANZO; DUTRA; ALMEIDA ALVES, 2019).
As plantas medicinais necessitam de algumas condições para que suas propriedades farmacológicas sejam mantidas e, para usufruir de todos os benefícios que elas oferecem, é fundamental analisar o local de armazenamento e as condições de cultivo, de forma que seus princípios ativos sejam preservados e o seu uso seja capaz de desempenhar o efeito terapêutico esperado (SILVA; OLIVEIRA, 2018). Da mesma forma que podem trazer a cura ou o alívio dos sintomas, as plantas podem produzir metabólitos capazes de desencadear doenças gástricas, cardiovasculares e neurológicas que, em alguns casos, podem levar a óbito (BONIL; BUENO, 2009; CAMPOS et al., 2016), a depender de aspectos fisiológicos de quem as consome, tais como: sexo, idade, sistema imune, tempo de exposição ao metabólito ou da quantidade que foi absorvida pelo organismo (BALBINO; DIAS, 2010).
Quando as plantas medicinais são avaliadas quanto à sua eficácia terapêutica e seguridade de uso, estão cientificamente aprovadas a serem utilizadas pela população nas suas necessidades básicas de saúde (RODRIGUES, 2004). Desta forma, muitas das preparações que utilizam plantas medicinais ainda necessitam de investigações científicas minuciosas, abrangendo padronização química, ensaios biológicos in vitro e em modelos animais (SOUZA-MOREIRA; SALGADO; PIETRO, 2010).
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
Os bioensaios Allium cepa (A. cepa) e o teste do micronúcleo (MN) são comumente utilizados para o rastreio da citogenotoxicidade de compostos presentes em extratos aquosos de plantas (ABREVAYA; CARBALLO; MUDRY, 2007; RIBEIRO; BELO; MONTEIRO, 2018).
Desta forma, este trabalho teve como objetivo a realização de uma revisão de literatura sobre a eficácia dos bioensaios A. cepa e o teste do MN no rastreio de compostos tóxicos presentes em extratos aquosos vegetais.
2 METODOLOGIA
Para o desenvolvimento do presente estudo, foi realizada uma revisão literária narrativa, sobre a importância dos testes de citogenotoxicidade na avaliação da seguridade do uso das plantas medicinais, respaldada em um levantamento de dados em algumas bases de informações científicas: Medical Literature Analysis and Retrieval System Online (MEDLINE) via Pubmed., Scientific Electronic Library Online (Scielo), Google Acadêmico, Portal da Agência Nacional de Vigilância Sanitária (ANVISA). Foram utilizadas as seguintes palavras chaves: Plantas Medicinais, Teste do Micronúcleo e Allium cepa, no período de maio de 2020 a setembro de 2020, com o objetivo de sintetizar pesquisas que já foram realizadas sobre o tema. Foram selecionados artigos nos idiomas português e inglês.
Foram excluídos artigos que não estavam com acesso inteiramente disponível ou cujo resumo não era relevante ao tema proposto.
3 OS BIOENSAIOS COMO FERRAMENTAS PARA O RASTREIO DE
CITOGENOTOXICIDADE
Os efeitos citogenotóxicos produzidos por substâncias existentes nos produtos naturais, sobretudo extratos vegetais e seus derivados podem ser avaliados por meio de bioensaios (VERRI; MOURA; MOURA, 2017).
Um dos parâmetros mais aplicados para a caracterização citogenética é a análise do comportamento dos cromossomos durante a divisão celular (TEDESCO et al., 2016).
Considerando que estudos sobre a seguridade da utilização de extratos aquosos vegetais na medicina popular são incipientes, os testes descritos no presente estudo são excelentes bioindicadores para o screening inicial de agentes citogenotóxicos em extratos aquosos de plantas (ALBAS et al., 2014; BAGATINI; CARLOS; BIBI et al., 2019; MOTA et al., 2017; RIBEIRO; BELO; MONTEIRO, 2018; SANTOS, 2019; TEDESCO et al., 2016).
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761 3.1 TESTE DO MICRONÚCLEO
Os MN são originados de fragmentos cromatídicos acêntricos ou de cromossomos perdidos durante a mitose em razão de não se prenderem adequadamente às fibras do fuso, durante o processo de segregação na anáfase (ALBAS et al., 2014; BONASSI et al., 2007; CARRARD et al., 2007; KIRSCH-VOLDERS et al., 2011; RUSSO; DEGRASSI, 2018).
Desta forma, o teste possibilita a identificação de aneugenicidade provocada por distúrbios na divisão celular, e clastogenicidade decorrente de quebras cromossômicas (CARVALHO et al., 2017; ÇELIK; ÖZPARLAK, 2019; KIRSCH-VOLDERS, 1997), auxiliando na observação do aumento da frequência de MN (MALUF; RIEGEL, 2011), além de detectar mecanismos de ação de alguns agentes químicos que intervêm na formação do fuso mitótico, modificando a distribuição equitativa dos cromossomos (ALBAS et al., 2014).
O teste para a detecção de MN foi desenvolvido por Howell no ano de 1891, e baseia-se na coloração do núcleo celular para a identificação de alterações citogenotóxicas visíveis ao microscópio (SANTOS, 2019; VERRI; MOURA; MOURA, 2017). Para a sua realização, podem ser adotados distintos tipos de células, como linfócitos humanos, vegetais e de outros mamíferos, desde que sejam capazes de se dividirem ou que seja possível induzir a divisão; e que este processo seja conhecido e controlável (CHEQUER, 2008; FENECH, 2007; VERRI; MOURA; MOURA, 2017).
É considerado muito vantajoso quando comparado a outros testes devido ao seu custo baixo e reprodutibilidade satisfatória (FLORES; YAMAGUCHI, 2008).
Para realização do teste, alguns parâmetros devem ser adotados: as células devem possuir dois núcleos com tamanho e intensidade de cor similares, podendo estar ligados por uma ponte nucleoplasmática, e as membranas nucleares devem estar dentro do mesmo espaço citoplasmático, considerando que o limite do citoplasma deve estar intacto e ser facilmente distinguível das outras células (CHEQUER, 2008; FENECH et al., 2003).
Na identificação da ocorrência de MN, são observados o diâmetro, sua morfologia e a ausência de refringência, o que possibilita a sua diferenciação dos artefatos como fragmentos de corantes. Quanto à coloração, deve-se considerar que os MN desenvolvem a mesma tonalidade dos nucléolos principais, mas eventualmente essa intensidade de cor pode ser maior (MALUF; RIEGEL, 2011). Para o cálculo da frequência de MN, utiliza-se a expressão MN = nº de células com MN x 100/nº total de células observadas.
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761 3.2 ALLIUM CEPA
O bioensaio A. cepa foi introduzido no ano de 1938 por Levan, demonstrando distúrbios no fuso mitótico devido ao uso de colchicina (LEME; MARIN-MORALES, 2009).
Dentre suas vantagens, o teste A. cepa pode ser extrapolado para outros organismos, incluindo seres humanos, promovendo melhor custo benefício, sendo dispensado o uso de equipamentos sofisticados. A eficácia e confiabilidade nos resultados se deve ao fato de ser um modelo in vivo onde raízes de cebola crescem em contato direto com a substância de interesse, prevendo os danos ao DNA (BELCAVELLO et al., 2012). Além disso, o teste avalia o índice mitótico (IM) que é um excelente parâmetro de identificação de alterações citogenotóxicas e cromossômicas (LEME; MARIN-MORALES, 2009; LESSA; SILVA; CARIELLO, 2017).
Um dos benefícios do teste é que os cromossomos são facilmente distinguíveis por serem grandes e em número reduzido (2n=2x=16) e possui elevada sensibilidade para a detecção de agentes clastogênicos, além de poder correlacioná-lo com outros ensaios citogenéticos (LEME; MARIN-MORALES, 2009; MANGALAMPALLI; DUMALA; GROVER, 2017; RIBEIRO; BELO; MONTEIRO, 2018).
O teste A. cepa baseia-se em alguns parâmetros de análise macroscópicos (índice de germinação de sementes, crescimento de raízes em bulbos, alteração na coloração, formação de tumores nas radículas, inibição ou crescimento acelerado do comprimento médio das raízes) e microscópicos (IM e avaliação da presença de alterações cromossômicas (AC) (LESSA; SILVA; CARIELLO, 2017; RIBEIRO; BELO; MONTEIRO, 2018).
As AC (FIG. 1) podem ocorrer de forma espontânea ou como resultado da exposição a agentes físicos e químicos. O cálculo do número de AC pode ser obtido através da expressão:AC = nº de células com AC x 100 (LEME; MARIN-MORALES, 2009 ).
O IM pode ser caracterizado pelo número total de células em divisão no ciclo celular. Alterações neste índice podem indicar citogenotoxicidade de um agente, sendo que valores estatisticamente significativos em relação aos controles, podem estar relacionados a alterações decorrentes da ação química no crescimento e desenvolvimento de organismos expostos. (LEME; MARIN-MORALES, 2009).
A presença de anormalidades nucleares (FIG. 1) é outro parâmetro avaliado no teste A.cepa, sendo determinado por alterações na morfologia dos núcleos interfásicos, como resultado da ação do agente testado. Outra variável relevante é a análise do tamanho dos MN, onde o tamanho maior do MN indica um efeito aneugênico resultante de perdas cromossômicas, enquanto que MN pequenos podem indicar ação clastogênica resultante da quebra de cromossomos. Já o aparecimento
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
de núcleos condensados, é um indício que as células estão iniciando um processo de morte celular (ANDRADE-VIEIRA et al., 2011; BAGATINI; CARLOS; TEDESCO, 2007; LEME; MARIN-MORALES, 2009).
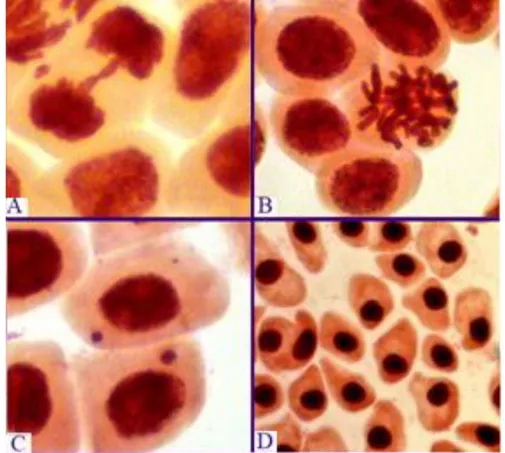
Figura 1 - Alterações nucleares observadas em células meristemáticas de raiz de A. cepa.
A- Ponte anafásica; B- Duplicação cromossômica; C- Micronúcleos, D- Núcleos condensados. Fonte: Das Autoras.
4 DISCUSSÃO
Os testes de citogenotoxicidade são considerados de grande importância na detecção de compostos que provoquem danos genéticos direta ou indiretamente por diversos mecanismos (MORAES, 2014). Portanto, pesquisas que abordem esta temática são relevantes por contribuírem para um maior conhecimento a respeito do uso seguro dos extratos aquosos na medicina popular (VERRI; MOURA; MOURA, 2017).
Os ensaios são bem aceitos para avaliar efeitos citogenotóxicos, com sua viabilidade operacional permitindo análise de diferentes concentrações da amostra. Os testes mostram alta sensibilidade e boa correlação com outros sistemas biológicos (BRÍGIDO et al., 2016; VERRI; MOURA; MOURA, 2017).
Para o monitoramento dos efeitos citogenotóxicos dos extratos aquosos de plantas medicinais, os testes de A. cepa e MN foram reportados por diversos autores como ferramentas
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
promissoras. A utilização do bioensaio A. cepa permitiu identificar efeitos citogenotóxicos nos extratos aquosos das plantas Ageratum conyzoides, Plectranthus amboinicus, Campomanesia
xanthocarpa, Vernonia condensata, Plectrantus barbatus, Plectrantus amboinicus, Sambucus
australis, Morinda citrifolia, Annona muricata,Costus spiralis e Lafoensia pacari. (BAGATINI;
CARLOS; TEDESCO, 2007; BELO; MONTEIRO; RIBEIRO, 2017; BIBI et al., 2019; BRÍGIDO et al., 2016; IGANCI et al., 2006; MOTA et al., 2017; PASTORI et al., 2013; SREERANJINI; SIRIL, 2011; TEDESCO et al., 2016). Os trabalhos relataram variações no IM, presença de AC, parâmetros utilizados para o rastreio de substâncias citotóxicas que podem ser exploradas como anticancerígenas ou como indicativo dos extratos avaliados.
Albas et al. (2014), Silva e colaboradores (2020) e Mohamed et al. (2018) não relataram variação na frequência de MN dos extratos aquosos das plantas Ilex paraguariensis, Euphorbia
triaculeata Forssk, através do Teste do Micronúcleo, descartando inicialmente a presença de agentes
citogenotóxicos.
A partir da análise desses estudos, os testes A. cepa e do MN demonstraram ser excelentes bioindicadores para uma triagem primária de citogenotoxicidade de infusões de plantas por seu baixo custo e confiabilidade satisfatória em um curto espaço de tempo. Essas particularidades favorecem sua utilização, que os tornam os principais testes utilizados pela comunidade científica na análise de extratos aquosos.
Portanto, os extratos aquosos que apresentam potencial citogenotóxico a partir dos parâmetros dos bioensaios A. cepa e do MN devem ser considerados indicativos de que o fator químico testado pode apresentar um risco à saúde (BELCAVELLO et al., 2012; CARVALHO et al., 2017).
5 CONSIDERAÇÕES FINAIS
Os testes de A. cepa e MN são bioensaios promissores para o screening inicial de citogenotoxicidade presente nos extratos aquosos de plantas medicinais, apresentam considerável custo benefício e reprodutibilidade satisfatória, além de possuírem validação em órgãos reguladores, garantindo sua confiabilidade.
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
REFERÊNCIAS
ABREVAYA, X. C.; CARBALLO, M. A.; MUDRY, M. D. The bone marrow micronucleus test and metronidazole genotoxicity in different strains of mice (Mus musculus). Genetics and
Molecular Biology, v. 30, n. 4, p. 1139–1143, 2007.
ALBAS, C. S. et al. Avaliação da genotoxicidade da Ilex paraguariensis (erva mate) pelo teste do micronúcleo. Revista Brasileira de Plantas Medicinais, v. 16, n. 2, p. 345–349, 2014.
ANDRADE-VIEIRA, L. F. et al. Spent Pot Liner (SPL) induced DNA damage and nuclear alterations in root tip cells of Allium cepa as a consequence of programmed cell death.
Ecotoxicology and Environmental Safety, v. 74, n. 4, p. 882–888, 2011.
ANVISA. Agência Nacional de Vigilância Sanitária. Medicamentos fitoterápicos e plantas
medicinais. Disponível em: <http://portal.anvisa.gov.br/fitoterapicos>. Acesso em: 13 mai. 2020.
BAGATINI, M. D.; CARLOS, A.; TEDESCO, S. B. Uso do sistema teste de Allium cepa como bioindicador de genotoxicidade de infusões de plantas medicinais. Revista Brasileira de
Farmacologia, v. 17, n. 3, p. 444–447, 2007.
BALBINO, E. E.; DIAS, M. F. Farmacovigilância: Um passo em direção ao uso racional de plantas medicinais e fitoterápicos. Brazilian Journal of Pharmacognosy, v. 20, n. 6, p. 992–1000, 2010.
BELCAVELLO, L. et al. Citotoxicidade e danos ao DNA induzidos pelo extrato de Zornia diphylla , uma planta medicinal Cytotoxicity and DNA damages induced by the Zornia diphylla extract , a medicinal plant. Natureza on line, v. 10, p. 140–145, 2012.
BELO, G. A.; MONTEIRO, A. B.; RIBEIRO, L. R. Avaliação da atividade citogenotóxica dos extratos aquosos de Ageratum conyzoides utilizando o bioensaio Allium cepa. In: 69ª REUNIÃO ANUAL DA SBPC, 2017, Belo Horizonte. Anais/Resumos da 69ª Reunião Anual da SBPC. São Paulo: SBPC, 2017.
BIBI, R. et al. Analysis of the mitotic effect of Annona muricata leaf extracts on Allium cepa root tip cells. African Journal of Biotechnology, v. 18, n. 8, p. 155–162, 2019.
BONASSI, S. et al. An increased micronucleus frequency in peripheral blood lymphocytes predicts the risk of cancer in humans. Carcinogenesis, v. 28, n. 3, p. 625–631, 2007.
BONIL, L.; BUENO, S. Plantas Medicinais: Beneficios e maleficios. Unilago, v. 2, n. 5, p. 1–12, 2009.
BRASIL. Política Nacional de Plantas medicinais e fitoterápicos. Brasília: Ministério da Saúde., p. 17, 2016.
BRÍGIDO, C. F. C. et al. Toxic Effects of Aqueous Extract of Plectranthus amboinicus (Lour) Spreng on Allium cepa. British Journal of Pharmaceutical Research, v. 10, n. 3, p. 1–6, 2016.
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761 v. 18, n. 1, p. 373–382, jan. 2016.
CARRARD, V. et al. Teste dos Micronúcleos – Um Biomarcador de Dano Genotóxico em Células Descamadas da Mucosa Bucal Micronucleus Assay – A Biomarker Of Genotoxic Damage In Exfoliated Oral Mucosa Cells. Revista Faculdade Odontológica Porto Alegre, v. 48, n. 1/3, p. 77–81, 2007.
CARVALHO, L. G. DE et al. Análises citológicas do inseticida Deltametrina usando o Teste de Micronúcleo. Revista da Biologia, v. 17, n. 1, p. 1–5, 2017.
ÇELIK, B.; ÖZPARLAK, H. Determination of genotoxic and antigenotoxic effects of wild-grown Reishi mushroom (Ganoderma lucidum) using the hen’s egg test for analysis of micronucleus induction. Biotechnic and Histochemistry, v. 94, n. 8, p. 628–636, 2019.
CHEQUER, F. M. D. Utilização do Teste de Micronúcleo na avaliação da toxicidade dos azo corantes Disperse Red 1 , Disperse Orange 1 e Disperse Red 13. Usp - Rp, p. 1–28, 2008.
COSTA, A. R. F. C. et al. Uso De Plantas Medicinais Por Idosos Portadores De Hipertensão Arterial. Revista de Ciências da Saúde Nova Esperança, v. 17, n. 1, p. 1–13, 2019.
FENECH, M. et al. HUMN project: Detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures. Mutation Research - Genetic
Toxicology and Environmental Mutagenesis, v. 534, n. 1–2, p. 65–75, 2003.
FENECH, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols, v. 2, n. 5, p. 1084– 1104, 2007.
FLORES, M.; YAMAGUCHI, M. Teste do Micronúcleo: Uma triagem para avaliação genotóxica.
Revista saúde e pesquisa, v. 1, n. 3, p. 337–340, 2008.
IGANCI, J. R. V. et al. EFEITO DO EXTRATO AQUOSO DE DIFERENTES ESPÉCIES DE BOLDO SOBRE A GERMINAÇÃO E INDICE MITÓTICO DE ALLIUM CEPA L. Arq. Inst.
Biol., v. 73, n. 1, p. 79–82, 2006.
JAMSHIDI-KIA, F.; LORIGOOINI, Z.; AMINI-KHOEI, H. Medicinal plants: Past history and future perspective. Journal of HerbMed Pharmacology, v. 7, n. 1, p. 1–7, 2018.
KIRSCH-VOLDERS, M. Towards a validation of the micronucleus test. Mutation research, v. 392, n. 1, p. 1–4, 1997.
KIRSCH-VOLDERS, M. et al. The in vitro MN assay in 2011: Origin and fate, biological significance, protocols, high throughput methodologies and toxicological relevance. Archives of
Toxicology, v. 85, n. 8, p. 873–899, 2011.
LEME, D. M.; MARIN-MORALES, M. A. Allium cepa test in environmental monitoring: A review on its application. Mutation Research - Reviews in Mutation Research, v. 682, n. 1, p. 71–81, 2009.
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
cepa L . como bioindicador de mutagenicidade e citotoxicidade de plantas medicinais. Revinter, v.
10, n. 3, p. 39–48, out. 2017.
MALUF, S. W.; RIEGEL, M. Citogenética Humana. In: PASSOS, P. R.; WEIDNER, M. S. (Eds.). . Técnica de Micronúcleos com bloqueio da citocinese celular. Porto Alegre: [s.n.]. p. 182–192.
MANGALAMPALLI, B.; DUMALA, N.; GROVER, P. Allium cepa root tip assay in assessment of toxicity of magnesium oxide nanoparticles and microparticles. Journal of Environmental
Sciences (China), v. 66, n. May, p. 125–137, 2017.
MELTRO, L. C. et al. Erratum: Ethnodirigid study of Medicinal plants used by the population assisted by the “Programa de Saúde da Família” (Family Health Program) in Marechal Deodoro - AL, Brazil. Brazilian Journal of Biology, v. 80, n. 2, p. 410–423, 2019.
MOHAMED, H. M.; ALY, M. S. Evaluation of genotoxicity of Euphorbia triaculeata Forssk. extract on mice bone marrow cells in vivo. Toxicology Reports, v. 5, n. 1, p. 625–631, 2018
MORAES, J. P. G. Análise de genotoxicidade de compostos 4-amino 2,6-diaril-5-carbonitrila-pirimidínicos. Dissertação de Mestrado. Universidade Federal de Pernambuco, p. 12, 2014.
MOTA, G. A. et al. Avaliação do potenccial citotóxico de duas espécies botânicas do cerrado de uso medicinal por meio do sistema- teste Allium cepa. Curso de Farmácia da Faculdade Montes
Belos. p. 1–10, 2017.
NUNES, A. Utilização de planta medicinal erva-de-são-joão((Hypericum perforatum L.) no tratamento de depressão. Journal of Chemical Information and Modeling, v. 19, n. 3, p. 80–92, 2018.
PASTORI, T. et al. Genotoxic effects of Campomanesia xanthocarpa extracts on Allium cepa vegetal system. Pharmaceutical Biology, v. 51, n. 10, p. 1–7, 2013.
RIBEIRO, L. R.; BELO, G. A.; MONTEIRO, A. B. Avaliação Da Atividade Citogenotóxica E Antimutagênica Do Extrato Aquoso De Bidens Pilosa. Conexão Ciência (Online), v. 13, n. 4, p. 15–22, 2018.
RIGODANZO, C.; DUTRA, B.; ALMEIDA ALVES, I. Diabetes mellitus tipo 2: Plantas medicinais e fitoterápicos como alternativas terapêuticas para o controle da doença. Revista Interdisciplinar
Em Ciências Da Saúde E Biológicas, v. 3, n. 1, p. 67–79, 2019.
RODRIGUES, V. G. S. Cultivo, uso e manipulação de plantas medicinais. Embrapa - Empresa
Brasileira de Pesquisa Agropecuária, p. 9–30, 2004.
RUSSO, A.; DEGRASSI, F. Molecular cytogenetics of the micronucleus: Still surprising. Mutation
Research - Genetic Toxicology and Environmental Mutagenesis, v. 836, p. 36–40, 2018.
SANTOS, N. DE CARVALHO. Avaliação citotóxica e genotóxica da infusão de Equisetum sp. L (Equisetaceae). Universidade do vale do ParaíbaFaculdade de Educação e Artes, p. 1–41, 2019.
Braz. J. of Develop.,Curitiba, v. 6, n. 10, p.82419-82430, oct. 2020. ISSN 2525-8761
aquosos por micronúcleo e Allium cepa ensaios. Revista Brasieleira de Ciências Farmacêuticas, v. 56, p. 1–9, 2020.
SILVA, M. I. DA; OLIVEIRA, H. B. DE. Desenvolvimento de software com orientações sobre o uso de plantas medicinais mais utilizadas do sul de Minas Gerais. Brazilian Applied Science
Review, v. 2, n. 3, p. 1104–1110, set. 2018.
SOUZA, E. et al. Estudo químico de chás de folhas de urucuzeiro (Bixa orellana L.). Braz. J. of
Develop., v. 6, n. 7, p. 49132-49148, jul. 2020
SOUZA-MOREIRA, T. M.; SALGADO, H. R. N.; PIETRO, R. C. L. R. O Brasil no contexto de controle de qualidade de plantas medicinais. Revista Brasileira de farmacognosia, v. 20, n. 3, p. 435–440, 2010.
SREERANJINI, S.; SIRIL, E. Avaliação da antigenotoxicidade dos extratos foliares de Morinda citrifolia Linn. Departamento de Botânica, Universidade de Kerala, Kariavattom, v. 2011, n. 5, p. 222–227, 2011.
TEDESCO, M. et al. Assessment of the antiproliferative and antigenotoxic activity and phytochemical screening of aqueous extracts of sambucus australis cham. & schltdl. (ADOXACEAE). Annals of the Braziliam Academy of Sciences, v. 89, n. 3, p. 2141–2154, 2016.
VERRI, A. M.; MOURA, A. D. A.; MOURA, V. M. DE. Testes Citogenéticos na Avaliação da Genotoxicidade de Produtos Naturais Provindos de Plantas Medicinais. Revista UNINGÁ Review, v. 30, n. 1, p. 55–61, 2017.