Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761
Estudo de eficácia in vitro de doxiciclina frente à cultura de Rickettsia
rickettsii
Study of in vitro efficacy of doxycycline against the culture of Rickettsia
rickettsii
DOI:10.34117/bjdv5n12-322
Recebimento dos originais: 10/11/2019 Aceitação para publicação: 23/12/2019
Fernanda Aparecida Nieri-Bastos
Docente do Curso de Medicina Veterinária da Faculdade Anclivepa Instituição: Faculdade Anclivepa, São Paulo, Brasil
Endereço: R. Ulisses Cruz, 285 - Tatuapé, São Paulo – SP, CEP: 03077-000 E-mail: fenieri@usp.br
Jonas Moraes-Filho
Docente do Mestrado em Medicina e Bem-Estar Animal Instituição: Universidade Santo Amaro, São Paulo, Brasil
Endereço: R. Prof. Enéas de Siqueira Neto, 340 - Jardim das Imbuias, São Paulo - SP, CEP: 04829-300
Email: jmfilho@prof.unisa.br
Giovanna Stefani Nosberto Castelli Médica Veterinária
Instituição: Universidade Santo Amaro, São Paulo, Brasil
Endereço: R. Prof. Enéas de Siqueira Neto, 340 - Jardim das Imbuias, São Paulo - SP, CEP: 04829-300
E-mail: giovanna.nosberto@gmail.com
Zahi Êni Santos Souza Graduanda em Medicina Veterinária
, Instituição: Universidade Santo Amaro, São Paulo, Brasil
Endereço: R. Prof. Enéas de Siqueira Neto, 340 - Jardim das Imbuias, São Paulo - SP, CEP: 04829-300
E-mail: zahisouza@gmail.com
Ryan Emiliano da Silva
Doutorando em Ciências
Instituição: Faculdade de Medicina Veterinária e Zootecnia, USP, São Paulo, Brasil Endereço: Av. Prof. Orlando Marques de Paiva, 87 - Butantã, São Paulo - SP, CEP:
05508-010
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761
Arlei Marcili
Docente do Mestrado em Medicina e Bem-Estar Animal Instituição: Universidade Santo Amaro, São Paulo, Brasil
Endereço: R. Prof. Enéas de Siqueira Neto, 340 - Jardim das Imbuias, São Paulo - SP, CEP: 04829-300
Email: amarcili@usp.br
RESUMO
A Febre Maculosa Brasileira é uma zoonose causada por Rickettsia rickettsii com manifestações clínicas iniciais gerais e inespecíficos com altas taxas de mortalidade quando não tratados. Apesar de clinicamente efetivo frente a R. rickettsii, são escassos os estudos que comprovem a eficácia in vitro da doxiciclina. Este estudo propõe avaliar a taxa de infecção em monocamadas de células Vero infectadas com R. rickettsii e tratadas com doxiciclina através da contagem bacteriana e Reação de cadeia da polimerase (PCR) em tempo real após tratamento com doses de 5, 10 e 15mg de antimicrobiano. O tratamento com doxiciclina foi efetivo com diminuição de 88,4% da infecção e diminuição de Cycle threshold (Ct) na técnica de PCR em tempo real.
Palavras chaves: Carrapato, tratamento, antibiótico
ABSTRACT
Rock Mountain Spotted Fever is a zoonosis caused by Rickettsia rickettsii with clinical manifestations general and non-specific with high mortality rates when untreated. Although clinically effective against R. rickettsii, studies demonstrating the in vitro efficacy of doxycycline are scarce. This study proposes to evaluate the infection rate in monolayers of Vero cells infected with R. rickettsii and treated with doxycycline through bacterial counting and real-time PCR after treatment with doses of 5, 10 and 15mg of antimicrobial. Doxycycline treatment was effective with an 88.4% decrease in infection and a decrease in Cycle threshold (Ct) in the real-time PCR.
keywords: Ticks, treatment, antibiotic
1 INTRODUÇÃO
1.1 CARRAPATOS
Os carrapatos estão inseridos na ordem Acari, subordem Ixodida e representados por três famílias: Ixodidae, Argasidae e Nuttalliellidae. As famílias Argasidae e Ixodidae são amplamente distribuídas, enquanto Nuttalliellidae está restrita à África do Sul e Tanzânia (BARROS-BATTESTI et al., 2006).
Devido às particularidades de seus hábitos alimentares, os carrapatos constituem o principal grupo em importância de vetores em saúde pública. Eles podem transmitir uma
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 grande variedade de agentes patogênicos e ainda causar paralisias, dermatites e alergias (JONGEJAN et al., 2004).
O gênero Amblyomma é o mais numeroso do Brasil com 32 espécies estabelecidas (KRAWCZAK et al., 2015).O gênero é o de maior importância médica, já que inclui as principais espécies que parasitam humanos neste país. Dentre elas, destacam-se A. aureolatum,
A. sculptum e A. ovale, que são incriminados na transmissão da febre maculosa e outras
riquetsioses para humanos (LABRUNA et al., 2004; GUEDES et al., 2005; PINTER et al., 2006; LABRUNA, 2009; SABATINI et al., 2010; SPOLIDORIO et al., 2010; SILVA et al., 2011; NIERI-BASTOS et al., 2014).
1.2 RICKETTSIAS
O gênero Rickettsia compreende organismos intracelulares obrigatórios pertencentes à família Rickettsiaceae e ordem Rickettsiales (RAOULT et al., 1997). Estão separadas em cinco grupos: 1) grupo do tifo (GT), composto pelas espécies Rickettsia prowazekii e Rickettsia
typhi; 2) grupo da febre maculosa, representado por mais de vinte espécies de riquétsias, onde
está inserida Rickettsia rickettsii; 3) grupo de transição, onde estão inseridas R. akari e R.
australis; 4) grupo Canadensis, representado pela espécie R. canadensis e ; 5) grupo Bellii,
representado pela espécie R. bellii (WEINERT et al., 2009).
Sem dúvida R. rickettsii é a mais conhecida e letal das riquetsioses, sobretudo no Brasil. Sua distribuição está restrita às Américas, com registros de casos confirmados no Canadá, Estados Unidos, México, Costa Rica, Panamá, Colômbia, Brasil e Argentina. Diferentes espécies de carrapatos estão implicadas como vetor nas diferentes localidades geográficas. No Brasil, além de A. sculptum, a espécie de carrapato Amblyomma aureolatum (Pallas) é reconhecida como vetor de R. rickettsii na região metropolitana da cidade de São Paulo, onde
R. sanguineus também é suspeito como vetor (LABRUNA, 2009).
O primeiro relato de riquetsiose no Brasil foi em 1900, no Instituto Bacteriológico de São Paulo, pelo Dr. Adolpho Lutz. Sendo posteriormente descritos casos da infecção em humanos por José Toledo Piza, em 1932 no município de São Paulo, na época denominando a afecção de tifo exantemático. A doença reemergiu e se tornou importante problema de saúde pública no Brasil a partir da década de 1980. Desde então, observou-se aumento no número de casos, expansão das áreas de transmissão, ocorrência da transmissão em áreas urbanas e, em especial, elevadas taxas de letalidade. De 1985 a julho de 2011 foram confirmados 440 casos de febre maculosa brasileira e 152 óbitos em 79 municípios no Estado de São Paulo.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 Entre os anos de 1997 a 2010 houve a notificação no Brasil de 868 casos confirmados da doença, dentre os quais 227 óbitos, distribuídos entre São Paulo, Minas Gerais, Espírito Santo, Rio de Janeiro, Bahia, Paraná, Santa Catarina, Rio Grande do Sul e Distrito Federal (PINTER et al., 2011; PINTER et al., 2016). No período de 2007 a 2015 foram notificados 1.322 casos suspeitos de FMB em residentes da região metropolitana da cidade de São Paulo (RMSP), com apenas 7% de confirmações. A distribuição dos casos ocorridos na RMSP demonstra uma correlação com proximidade a resquícios de vegetação. A gravidade da doença ficou demonstrada tanto pela taxa de hospitalização de 93% (69 casos), quanto pela letalidade de 64%, com 47 óbitos (PINTER et al, 2016).
As manifestações clínicas iniciais da riquetsiose causada por R. rickettsii em humanos, são gerais e inespecíficas como febre, mialgia, calafrios e dores de cabeça. Com a evolução da doença aparecem erupções cutâneas (máculas) e hemorragias devido ao quadro de vasculite, pois ocorre a invasão das células endoteliais pelas bactérias. A taxa de mortalidade, em casos não tratados, ultrapassa 30%. Em estudo retrospectivo, Angerami e colaboradores, 2006, avaliaram os principais sinais clínicos de pacientes atendidos no Hospital das Clínicas da UNICAMP com diagnóstico confirmado de febre maculosa brasileira. Esses autores observaram que 100% dos pacientes apresentaram febre. Sintomas gerais como: mialgia, dores de cabeça, vômito e dor abdominal foram observados em 80%, 60%, 42% e 32% dos pacientes, respectivamente. Sintomatologia mais severa estava associada com casos fatais e incluía icterícia (52%), acometimento do sistema nervoso central (43%), dificuldades respiratórias (37%) e insuficiência renal (35,3%). Ainda foram observados diferentes graus de hemorragia em 69,5% dos pacientes(ANGERAMI et al., 2006).
A doença clínica em cães é sintomatologicamente semelhante a doença em humanos (BREITSCHWERDT et al., 1999). Os casos clínicos foram descritos principalmente nos Estados Unidos (GRINDEM et al., 1999). No Brasil os casos clínicos foram descritos, principalmente, após infecção experimental(PIRANDA et al., 2008), mas casos de infecção natural já foram relatados (LABRUNA, 2009).
Em decorrência da inespecificidade das manifestações clínicas da FMB, muitas vezes seu diagnóstico é confundido com outras doenças infecciosas (como leptospirose e erliquiose, principalmente) sendo a causa, muitas vezes, do retardo na obtenção do diagnóstico e início da terapia específica (LABRUNA, 2009).
Estudos demonstram dois cenários epidemiológicos para a transmissão de R. rickettsii no Brasil com a participação de espécies diferentes de vetores ixodídeos: 1) na região
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 metropolitana de São Paulo, a doença é transmitida pela espécie A. aureolatum, cujo adulto se alimenta primariamente em canídeos silvestres, mas que em áreas de Mata Atlântica antropizadas, o cão doméstico também faz o papel de hospedeiro, trazendo, dessa forma, o ectoparasita para o interior das residências, onde o humano é um hospedeiro acidental, pois A. aureolatum é uma espécie com baixo grau de antropofilia. Após um período mínimo de parasitismo de 10 minutos já é possível a transmissão de R. rickettsii por esta espécie de carrapato(SARAIVA et al., 2014); 2) no interior do Estado de São Paulo, bem como, em todo o Sudeste a espécie de carrapato envolvida é A. sculptum, especialmente em áreas rurais. Essa espécie na fase adulta se alimenta principalmente em equinos e capivaras, mas os estágios imaturos podem se alimentar em uma grande variedade de hospedeiros e são altamente antropofílicos.Com menor possibilidade, a contaminação pode acontecer através da retirada incorreta de carrapatos parasitados com as mãos sem proteção, ou o esmagamento do artrópode com as unhas, propiciando penetração da riquétsia através de pele lesada ou mucosas íntegras. Há também relatos de transmissão da bactéria em acidentes de laboratório (PINTER et al., 2016).
Todos os animais e os seres humanos são suscetíveis em contrair a infecção pela riquétsia. A doença desenvolve uma imunidade sólida e duradoura nos indivíduos que se recuperam, prevenindo os de novas infecções pela mesma bactéria. A imunidade adquirida é provavelmente mediada pela resposta celular e não pela humoral. O período de incubação da doença é de 2 a 14 dias (PINTER et al., 2016).
Atualmente, cães em áreas florestais e rurais são vistos como um risco potencial para a saúde pública e conservação da biodiversidade (OGRZEWALSKA et al., 2011; BARBIERI et al., 2015; FOURNIER, 2017). São animais com grande proximidade com os humanos e podem desempenhar importante papel na cadeia epidemiológica da Febre Maculosa Brasileira, principalmente aqueles que vivem próximos as áreas de matas, pois estes adentram as florestas podendo ser parasitados por carrapatos e quando saem os trazem para as habitações humanas, favorecendo a ocorrência da doença no homem (OGRZEWALSKA et al., 2011; LABRUNA et al., 2001).
Além disso, estes animais são importantes sentinelas para a vigilância da Febre Maculosa Brasileira em função de sua sororreatividade por longos períodos, indicando a circulação da bactéria no local de estudo nos últimos 6 a 12 meses (PIRANDA et al., 2008).
Após início das manifestações clínicas, o tratamento deve ser iniciado precocemente, sendo um fator determinante na diminuição da letalidade. Num tratamento precoce, a
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 terapêutica revela-se bastante eficaz, com queda do quadro febril após 24 a 72 horas do início do tratamento e a administração do antibiótico poderá ser interrompida após 2 ou 3 dias do desaparecimento da febre. O tratamento iniciado após o 4º dia do início dos sintomas, pode não ter a eficácia esperada, ocasionando consequências graves (ANGERAMI et al., 2006).
A doxiciclina é o antimicrobiano de escolha nos pacientes com suspeita de FMB e para cães (MORAES-FILHO, 2017). Entretanto os estudos in vitro que indiquem a eficácia do antimicrobiano para R. rickettsii são escassos. Assim, neste estudo propomos o teste in vitro da eficácia da doxiciclina frente a monocamada de células Vero infectadas com Rickettsia
rickettsii.
2 MATERIAL E MÉTODOS
2.1 MANUTENÇÃO EM LABORATÓRIO E PRODUÇÃO DOS INÓCULOS
O isolado de Rickettsia rickettsii cepa ITU foi submetido a passagens seriadas em monocamadas de células Vero em garrafa de 75cm3 para ativação e manutenção da infectividade. Monocamadas que demonstrarem nível de infecção próximo ou igual de 100% das células (determinado visualmente através de coloração de Gimenez) foram raspadas, e a suspensão de células foi centrifugada. O sedimento de células foi ressuspendido em tampão sucrose-fosfato-glutamato (SPG), pH 7.0, estéril, sendo então congelado a -80°C (LABRUNA et al., 2004), constituindo o inóculo para novas infecções.
2.2 INFECÇÃO E TRATAMENTO COM O FÁRMACO DOXICICLINA (DOXITRAT® - AGENER UNIÃO QUÍMICA)
Monocamadas de células Vero mantidas em meio RPMI acrescido de 10% de soro fetal bovino em garrafas de 75cm3 foram infectadas com inóculos de R. rickettsii cepa ITU. Após 24 horas da infecção inicial foi iniciado o tratamento com a Doxiciclina nas dosagens de 5mg, 10mg e 15mg diluídas diretamente no meio RPMI acrescido de 10% de soro fetal bovino.
Nos tempos de 12, 24 e 36 horas após o início do tratamento, uma garrafa de células Vero infectada para cada diluição do produto, teve o DNA extraído e foram avaliados pela técnica de Real Time PCR para detecção de R. rickettsii. Além disso, foram confeccionadas lâminas da monocamada de células para a avaliação das células infectadas com o patógeno.
Uma garrafa infectada com R. rickettsii foi mantida sem tratamento durante todo o período do experimento e foi utilizado controle positivo da infecção e utilizada como comparativo às células tratadas. Monocamadas de células Veras foram mantidas durante
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 todo o experimento com meio RPMI acrescido de 10% de soro fetal bovino e as diferentes concentrações do fármaco para avaliar a toxicidade as células.
Os testes foram repetidos três vezes em períodos distintos e denominados de módulos.
2.3 AVALIAÇÃO DA INFECTIVIDADE DAS CÉLULAS VERO POR RICKETTSIA
RICKETTSII
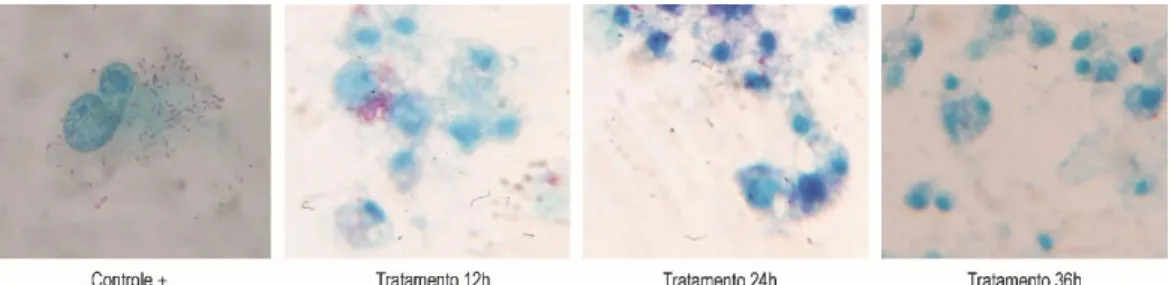
Laminas confeccionadas durante a infecção e tratamento das células com doxiciclina nos tempos 12, 24 e 36 horas foram submetidas a coloração de Gimenez. A presença de, ao menos, uma bactéria no interior de cada célula no campo visual do microscópio na objetiva de imersão (1000X) era considerada com 100% de infecção. As taxas foram avaliadas por três pesquisadores e os valores apresentados por módulo do experimento refere-se a média dos valores apresentados.
2.4 EXTRAÇÃO DE DNA
As monocamadas de células Vero mantidas em meio RPMI acrescido de 10% de soro fetal bovino em garrafas de 75cm3 foram processados individualmente à extração de DNA, utilizando-se o “kit” de extração “Dneasy Tissue Kit” (Qiagen, Chatsworth, CA), conforme instruções do fabricante. Para detecção de Rickettsia rickettsii através de PCR, cada amostra de DNA extraída foi testada individualmente pelo protocolo de real-time PCR descrito por Labruna e colaboradores, 2008. Este protocolo utiliza um par de primers (CS5 e CS6) que amplificam um fragmento de 147 nucleotídeos do gene citrato sintase de Rickettsia spp, associado a uma sonda interna fluorogênica (5´ 6-FAM – BHQ-1 3´) de 23 nucleotídeos. Este protocolo de PCR mostrou-se sensível o suficiente para detecção de uma única cópia do gene citrato sintase de R. rickettsii.
2.5 AVALIAÇÃO DA INFECTIVIDADE PELA TÉCNICA DE REAL TIME PCR
A avaliação da infectividade das monocamadas de células Vero pela técnica de Real Time foi através dos valores de Ct (Cycle threshold), ou seja, em qual ciclo da reação molecular a amostra se tornou positiva, conforme Moraes-Filho e colaboradores (MORAES-FILHO et al., 2015).
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761
3 RESULTADOS
Os inóculos utilizados na infecção da monocamada de células Vero apresentavam 100% de infecção. Não houve citotoxicidade do composto (Doxitrat) sobre a monocamada de células Vero.
A análise das lâminas obtidas durante os três diferentes tempos do tratamento com doxiciclina (12, 24 e 36 horas) em comparação as lâminas obtidas do controle de infecção nos mesmos tempos demonstrou redução de 88,4% na infecção por R. rickettsii na monocamada de células Vero independente da dosagem de doxiciclina testada.
Os controles de infecção sempre apresentaram 100% de infectividade. Os valores apresentados nos três diferentes módulos variaram menos de 10%.
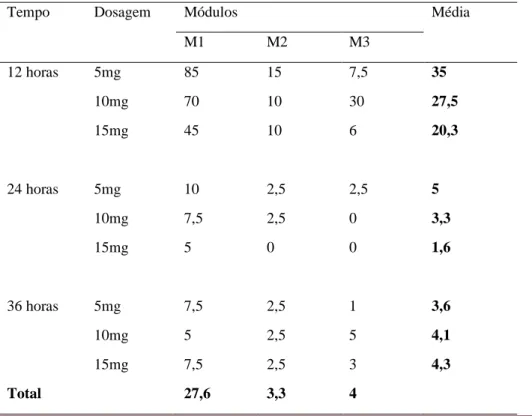
A dosagem de 5mg apresentou taxas de infectividade de 35, 5 e 3.6% nos tempos de 12, 24 e 36 horas respectivamente. Os testes com 10mg as taxas de infecção foram 27.5, 3.3 e 4.1% nos tempos 12, 24 e 36 horas. Os valores de infectividade de 20.3, 3.3 e 4% nos tempos de 12, 24 e 36 horas foram registrados para a dosagem de 15mg (Tabela 1 e Figura 1).
Todas as amostras foram positivas pela técnica de Real Time PCR, porém a amostra controle apresentou valor de Ct (Cycle threshold) de 18, enquanto no tratamento de 15mg de doxiciclina nos tempos de 12, 24 e 36 horas apresentaram valores de 26, 28 e 32 de Ct.
Tabela 1. Valores de infectividade de células Vero por R. rickettsii nas diferentes concentrações de Doxitrat e tempo de infecção
Tempo Dosagem Módulos Média
M1 M2 M3 12 horas 5mg 85 15 7,5 35 10mg 70 10 30 27,5 15mg 45 10 6 20,3 24 horas 5mg 10 2,5 2,5 5 10mg 7,5 2,5 0 3,3 15mg 5 0 0 1,6 36 horas 5mg 7,5 2,5 1 3,6 10mg 5 2,5 5 4,1 15mg 7,5 2,5 3 4,3 Total 27,6 3,3 4
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761
4 DISCUSSÃO
No Brasil a Febre Maculosa é transmitida por Amblyomma cajennense em diversas regiões do País e Amblyomma aureolatum na região metropolitana de São Paulo (LABRUNA et al., 2008). Estudos experimentais demonstraram a capacidade vetorial de Rhipicephalus
sanguineus, espécie de carrapato mais comum em cães, na transmissão de Rickettsia rickettsii
(LABRUNA et al., 2008; PIRANDA et al., 2011). Além disso, R. sanguineus coletados de cães e naturalmente infectados foram detectados com R. rickettsii no município de Juiz de Fora no estado de Minas Gerais (PACHECO et al., 2011). Tal fato, demonstra a vulnerabilidade dos cães a R. rickettsii e corrobora a necessidade da utilização de antimicrobianos na terapêutica veterinária quando necessário (presença de sintomatologia).
O sucesso do tratamento está relacionado à precocidade e especificidade de sua instalação e os únicos fármacos com eficácia são as tetraciclinas e cloranfenicol em humanos (ROLAIN et al., 1998). Os agentes beta-lactâmicos e aminoglicosídeos não possuem eficácia sobre as riquétsias, as sulfas são contraindicadas por servirem de substrato para os microorganismos facilitando sua replicação (PURVIS et al., 2000). A escolha entre cloranfenicol e tetraciclina (doxiciclina) relaciona-se a gravidade da doença.
No Brasil, os casos mais severos são tratados com cloranfenicol pela ausência de doxiciclinas endovenosas. Em pacientes adultos a doxiciclina é empregada por sete dias com duas doses diárias de 100mg. A dose em crianças com menos de 45kg é de 2.2mg/kg a cada 12 horas (PURVIS et al., 2000).
Os dados sobre o tratamento e drogas utilizadas em cães são incipientes pela baixa especificidade e/ou ausência de sintomatologia em cães dificulta o diagnóstico e o tratamento específico (BREITSCHWERDT et al., 1999). A gravidade de sintomas está relacionada a existência de outras infecções concomitantes e podem ser transmitidas por carrapatos, como a erliquiose canina (BREITSCHWERDT et al., 1999).
O tratamento in vitro é dependente da viabilidade da monocamada de células Vero. Nas infecções para manutenção de isolados ou preparação de antígenos para diagnóstico sorológico observa-se a citotoxicidade a partir de 48 horas de infecção, com a deterioração progressiva do tapete celular (PINTER et al., 2006).
O tratamento proposto iniciou após 24 horas de infecção da monocamada de células Vero e após 36 horas demonstrou a redução de quase 90% na taxa de infecção. O tratamento por um período maior seria letal às bactérias. Entretanto, o aumento no tempo de tratamento acarretaria a nutrição das células e modificação na concentração do fármaco.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 As diferentes dosagens não apresentaram diferença significativa e somente o tempo de tratamento. O Doxitrat (doxiciclina) não é um composto hidrossolúvel e dificultou sua total diluição no meio RPMI para ser aplicado na monocamada de células Vero. O precipitado do composto não foi tóxico para as células durante todo o tempo de experimento, porém pode diminuir a quantidade de composto disponível e assimilação pelas células impossibilitando a avaliação adequada das concentrações utilizadas. Dados semelhantes foram observados em estudos anteriores (BOTELHO-NEVERS et al., 2012; RAOULT et al., 1991; RAOULT et al., 1989).
Todas as monocamadas de células Vero foram positivas pela técnica de Real Time PCR, independente do tratamento preconizado. Mas, é digno de nota que valores de Ct (Cycle threshold) observados nessas amostras foram diferentes. As garrafas de células Vero que receberam 5 mg, independente do intervalo de tratamento (12, 24 ou 36 horas) apresentaram Ct maiores, devido o início da amplificação ocorrer a partir do ciclo 16. As amostras que receberam um tratamento de 10mg apresentaram Ct menores, nos tratamentos iniciados 24h e 36h após as monocamadas de células Vero estarem 100% infectadas, com a amplificação de positividade ocorrendo no ciclo 15 e 16, respectivamente. As garrafas tratadas com 15mg apresentaram valores de 26, 28 e 32 de Ct para os tempos (12, 24 e 36 horas) demonstrando clara aumento nos valores de Ct, demonstrando a clara diminuição da carga bacteriana após tratamento. Os controles positivos (garrafas com células totalmente infectadas) apresentaram Ct de 18 após 12 horas. Os resultados encontrados na PCR com intuito de avaliar infectividade também foi realizado por Moraes-Filho e colaboradores (MORAES-FILHO et al., 2015), onde os resultados de Ct foram menores nos amostraram que tinham uma maior infectividade, sendo semelhante aos nossos resultados encontrados neste trabalho. Esses dados corroboram que o tratamento com doxiciclina nessas amostras, independente do momento em que se iniciou o tratamento após as células estarem 100% infectadas, apresentou boa resposta terapêutica.
A diminuição nos valores de Ct foi observada em estudo realizado com Anaplasma
phagocytophilum semi-quantitativo com diferentes dosagens de antimicrobianos e apresentou
redução 3 ciclos, demonstrando a eficácia da técnica na avaliação da atividade antimicrobiano (HUNFELD et al., 2004).
Os dados apresentados demonstram claramente o efeito microbicida da Doxiciclina sobre bactérias da espécie Rickettsia rickettsii. Apesar de amplamente utilizada no tratamento da Febre Maculosa, e de outras patologias causadas por outras espécies do gênero Rickettsia, os estudos sobre a suscetibilidade ao antimicrobiano in vitro são extremamente escassos.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 Estudos conduzidos por grupos europeus demonstram o efeito da doxiciclina e outros antimicrobianos no tratamento de diversas espécies de Rickettsia (HUNFELD et al., 2004; RAOULT et al., 1989). O estudo realizado é inédito e corrobora a terapêutica observada em medicina humana e veterinária.
5 CONSIDERAÇÕES FINAIS
- O tratamento in vitro com Doxiciclina (Doxitrat®) em monocamadas de células Vero infectadas com Rickettsia rickettsii foi efetivo.
- A infectividade diminui em 88,4% a infecção na monocamada de células Vero com
Rickettsia rickettsii frente ao tratamento com Doxitrat independente da dosagem.
- Não houve diferença no tratamento referente as dosagens testadas 5mg, 10mg e 15mg. - O tempo de 12 horas apresentou a menor diminuição nos valores de infectividade (média de 27.6%) e as maiores diminuições na taxa de infecção referem-se aos tempos de 24 e 36 horas (médias de 3.3 e 4%, respectivamente).
- As análises baseadas na técnica de Real Time PCR evidenciaram diferenças entre os valores de Ct (Cycle threshold).
- A técnica baseada na taxa de infecção de células é a mais efetiva para avaliação do tratamento in vitro de monocamadas de células Vero frente a infecção por Rickettsia rickettsii quando comparado a técnica de Real Time PCR.
AGRADECIMENTOS
Agradecemos os Prof. Dr. Marcelo Bahia Labruna por ceder a cepa Taiaçu de Rickettsia
rickettsii e ao Departamento de Mecidina Veterinária Preventiva e Saúde Animal da Faculdade
de Medicina Veterinária e Zootecnia da Universidade de São Paulo.
REFERÂNCIAS
ANGERAMI, R. N.; RESENDE, M. R.; FELTRIN, A. F. C.; KATZ, G.; NASCIMENTO, E. M.; STUCCHI, R. S. B.; SILVA, L. J. Brazilian Spotted Fever: A Case Series from a Endemic Area in Southeastern Brazil – Clinical Aspects. Annals New York Academy Sciences, v. 1078, p. 252-254, 2006. doi: 10.1196/annals.1374.044
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 BARBIERI et al. Altitudinal Assessment of Amblyomma aureolatum and Amblyomma ovale (Acari: Ixodidae). Vectors of Spotted Fever Group Rickettsiosis in the state of São Paulo, Brazil. Journal of medical entomology, v.52, n.5, p.1170-1174, 1 set. 2015.
BARROS-BATTESTI, D. M.; ARZUA, M.; BECHARA, G. A. Carrapatos de importância médico-veterinária da região neotropical: um guia ilustrado para identificação de espécies. São Paulo, Vox/ICTTD-3/Butantan, 2006. 223p.
BOTELHO-NEVERS, E.; SOCOLOVSCHI, C.; RAOULT, D.; PAROLA, P. Treatment of
Rickettsia spp. infections: a review Expert Rev. Anti. Infect. Ther., v.10, ed.12, p. 1425–1437,
2012.
BREITSCHWERDT EB, PAPICH MG, HEGARTY BC, GILBER B, HANCOCK SI, DAVIDSON MG Efficacy of doxycycline, azithromycin, or trovafloxacin for treatment of experimental Rocky Mountain spotted fever in dogs. Antimicrob Agents Chemother, v. 43, p. 813-821, 1999.
FOURNIER, Gislene Fátima da Silva Rocha, Epidemiological aspects of semi-domiciled domestic dogs presente in the Brazilian Atlantic Rain forest Area of Caraguatatuba City and the correlation betwen the genetic variability of dogs’ticks and the wild environment. Tese para obtenção do Título de Doutorado pela USP, São Paulo, 2017.
GRINDEM CB, BREITSCHWERDT EB, PERKINS PC, CULLINS LD, THOMAS TJ, HEGARTY BC Platelet-associated immunoglobulin (antiplatelet antibody) in canine Rocky Mountain spotted fever and ehrlichiosis. J Am Anim Hosp Assoc, v. 35, p. 56-61, 1999.
GUEDES, E.; LEITE, R.; PRATA, M. C. A.; PACHECO, R. C.; WALKER, D. H.; LABRUNA, M. B. Detection of Rickettsia rickettsii in the tick Amblyomma cajennense in a new Brazilian spotted fever–endemic area in the state of Minas Gerais. Memórias do Instituto Oswaldo. Cruz, v. 100, p. 841-848, 2005.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 HUNFELD, K. P.; BITTNER, T.; RODEL, R.; BRADE, V.; CINATL, J. New real-time PCR-based method for in vitro susceptibility testing of Anaplasma phagocytophilum antimicrobial agents. International Journal of Antimicrobial Agents, v. 23, p. 563-571.2004.
JONGEJAN, F.; UILENBERG, G. The global importance of ticks. Parasitology. v. 129, p. S3–S14, 2004.
KRAWCZAK, F. S.; NIERI-BASTOS, F. A.; NUNES, F. P.; SOARES, J. F.; MORAES-FILHO, J.; LABRUNA, M. B. Rickettsial infection in Amblyomma cajennense ticks and capybaras (Hydrochoerus hydrochaeris) in a Brazilian spotted fever-endemic área. Parasites & Vectors, v. 7, p. 1-7, 2015.
LABRUNA, M. B.; WHITWORTH, T.; BOUYER, D.; MCBRIDE, J.; CAMARGO, L. M. A.; CAMARGO, E. P.; POPOV, V.; WALKER, D. H. Rickettsia bellii and Rickettsia
amblyommii in Amblyomma ticks from the state of Rondônia, western Amazon, Brazil. Journal of Medical Entomology, v.41, ed.6, p. 1073-1081, 2004.
LABRUNA, M.B. & PEREIRA, M.C. Ticks on dogs in Brazil. Clinica Veterinária, V.30, p.24-32, 2001.
LABRUNA, M. B.; WHITWORTH, T.; HORTA, M. C.; BOUYER, D. H.; MCBRIDE, J. W.; PINTER, A.; POPOV, V.; GENNARI; S. M.; WALKER, D. H. Rickettsia species infecting
Amblyomma cooperi ticks from an area in the state of Sao Paulo, Brazil, where Brazilian
spotted fever is endemic. J. Clin. Microbiol., v.42, p. 90-98, 2004.
LABRUNA, M. B.; OGRZEWALSKA, M.; MARTINS, T. F.; PINTER, A.; HORTA, M. C. Comparative susceptibility of larval stages of Amblyomma aureolatum, Amblyomma
cajennense and Rhipicepahlus sanguineus to infection by Rickettsia rickettsia. Journal of
Medical Entomology, v.45, ed.6, p. 1156-1159, 2008.
LABRUNA, M. B. Ecology of Rickettsia in South America. Annals New York Academy Sciences, v. 1166, p. 156–166, 2009.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 MORAES-FILHO, J.; KRAWCZAK, F. S.; COSTA, F. B.; SOARES, J. F.; LABRUNA, M. B. Comparative Evaluation of the Vector Competence of Four South American Populations of the Rhipicephalus sanguineus Group for the Bacterium Ehrlichia canis, the Agent of Canine Monocytic Ehrlichiosis. Plos One, v. 10, P. 1-16, 2015.
MORAES-FILHO, J. Febre Maculosa Brasileira. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP. São Paulo: Conselho Regional de Medicina Veterinária, v.15, n.1, p. 38-45, 2017.
NIERI-BASTOS, F. A.; LOPES, M. G.; CANÇADO, P. H.; FACCINI, J. L. H.; GENNARI, S. M.; LABRUNA, M. B. Candidatus ‘Rickettsia andeanae’ infecting the tick Amblyomma
parvum in two Brazilian biomes. Memórias do Instituto Oswaldo Cruz, 2014.
http://dx.doi.org/10.1590/0074-0276140283.
OGRZEWALSKA, M. et al. Effect of forest fragmentation on tick infestations of birds and tick infection rates by Rickettsia in the Atlantic Forest of Brazil. Ecohealth, v.8, n.3, p.320-331, 2011.
PACHECO, R. C.; MORAES-FILHO, J.; GUEDES, E.; SILVEIRA, I.; RICHTZENHAIN, L.; LEITE, R. C; LABRUNA, M. B. Rickettsial infection of dogs, horses, and ticks in Juiz de Fora, southeastern Brazil, and isolation of Rickettsia rickettsii from Rhipicephalus sanguineus ticks. Medical and Veterinary Entomology, v.25, p. 148-155, 2011.
PINTER, A.; LABRUNA, M. B. Isolation of Rickettsia rickettsii and Rickettsia bellii in cell culture from the tick Amblyomma aureolatum in Brazil. Ann. N. Y. Acad. Sci., v.1078, p. 523-529, 2006.
PINTER, A. et al. Febre maculosa brasileira. BEPA, Boletim Epidemiológico Paulista, São Paulo, v. 8, n. 1, p. 3-31, 2011. Suplemento.
PINTER, A. et al. (Coord.). A febre maculosa brasileira na região metropolitana de São Paulo. BEPA, Boletim Epidemiológico Paulista, São Paulo, v. 13, n. 151, p. 3-47, 2016.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 PIRANDA, E.M. et al. Experimental infection of dogs with a Brazilian strain of Rickettsia rickettsii: clinical and laboratory findings. Mem.Inst.Oswaldo Cruz, Rio de Janeiro, v.103, n.7, p. 696-701, 2008.
PIRANDA, E. M.; FACCINI, J. L. H.; PINTER, A.; PACHECO, R. C.; CANÇADO, P. H. D.; LABRUNA, M. B. Experimental infection of Rhipicephalus sanguineus ticks with the bacterium Rickettsia rickettsii, using experimentally infected dogs. Vector-Borne and zoonotic Diseases, v. 11, ed.1, p. 1-12, 2011.
PURVIS, J. J.; PAC, M. S.; MORVEN, S. E. Doxycycline use for rickettsial disease impediatric patients. Pediatric Infectious Disease Journal, v.19, ed.9, p. 871-874, 2000.
RAOULT, D. A Antibiotic Susceptibility of Rickettsia and Treatment Of Rickettsioses. Eur. J. Epidemiol., v.5, ed.4, p. 432-435, 1989.
RAOULT, D.; DRANCOURT, M. Antimicrobial Therapy of Rickettsial Diseases. Antimicrobial Agents and Chemotherapy, v.35, ed.12, p. 2457-2462, 1991.
RAOULT, D.; ROUX, V. Rickettsioses as Paradigms of New or Emerging Infectious Diseases. Clin. Microbiol. Rev., v.10, p. 694-719, 1997.
ROLAIN, J. M.; MAURIN, M.; VESTRIS, G.; RAOULT, D. In Vitro Susceptibilities of 27 Rickettsiae to 13 Antimicrobials. Antimicrobial Agents and Chemotherapy, v.42, ed.7, p. 1537-1541, 1998.
SABATINI, G. S.; PINTER, A.; NIERI-BASTOS, F. A.; MARCILI, A.; LABRUNA, M. B. Survey of ticks (Acari: Ixodidae) and their rickettsia in an Atlantic rain forest reserve in the State of São Paulo, Brazil. J Med Entomol., v.47, p. 913–916, 2010. doi: 10.1603/ME10073.
SARAIVA, D. G. et al. Feeding period required by Amblyomma aureolatum ticks for transmission of Rickettsia rickettsii to vertebrate hosts. Emerging Infectious Diseases, Atlanta, v. 20, n. 9, p. 1504-1510, 2014.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761 SILVA, N.; EREMEEVA, M. E.; ROZENTAL, T.; RIBEIRO, G. S.; PADDOCK, C. D.; RAMOS, E. A. G.; FAVACHO, A. R. M.; REIS, M. G.; DASCH, G. A.; DE LEMOS, E. R. S.; KO, A. I. Eschar-associated Spotted Fever Rickettsiosis, Bahia, Brazil. Emerg Infect Dis. v.17, ed.2, p. 275-278, 2011. DOI: 10.3201/eid1702.100859.
SPOLIDORIO, M. G.; LABRUNA, M. B.; MANTOVANI, E.; BRANDAO, P. E.; RICHTZENHAIN, L. J.; YOSHINARI, N. H. Novel spotted Fever group rickettsiosis, Brazil. Emerg. Infect. Dis., v.16, p. 521-523, 2010.
WEINERT, L. A.; WERREN, J. H.; AEBI, A.; STONE, G. N.; JIGGINS, F. M. Evolution and diversity of Rickettsia bacteria. BMC Biol., v.7, ed.6, p.1-10, 2009.
Braz. J. of Develop., Curitiba, v. 5, n. 12, p.32580-32596 dec 2019 . ISSN 2525-8761
ANEXOS
Legenda das Figuras
Figura 1. Microscopia óptica de monocamada de célula Vero infectadas com Rickettsia
rickettsii sem e com tratamento com doxiciclina na dosagem de 10mg. Coloração de Gimenez