Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos
Texto
(2)
(3) Ana Filipa Marques Almeida Baltazar. Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Universidade Fernando Pessoa Faculdade de Ciências da Saúde Porto, 2010.
(4) Ana Filipa Marques Almeida Baltazar. Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Trabalho original realizado por: _____________________________________________. Trabalho apresentado à Universidade Fernando Pessoa como parte dos requisitos para obtenção do grau de Mestre em Ciências Farmacêuticas.. Orientador: Professora Doutora Márcia Carvalho.
(5) Resumo. O própolis é uma mistura complexa de substâncias resinosas de ampla utilidade para as abelhas e para o homem. O desenvolvimento crescente de novas técnicas analíticas tem permitido um considerável avanço na química dos produtos naturais, assim como na elucidação de suas estruturas moleculares. A composição química do própolis é complexa e está relacionada com a flora da região em que foi originada e a época da colheita. As suas actividades farmacológicas têm sido atribuídas aos compostos fenólicos, entre eles flavonóides e ácidos fenólicos, cujos teores têm sido propostos como parâmetros para o controle da qualidade. Devido às inúmeras propriedades benéficas do própolis, o seu uso comercial em produtos farmacêuticos, cosméticos e de higiene pessoal na forma de extractos líquidos é vasto.. O presente trabalho teve como objectivo avaliar a actividade antioxidante do própolis de origem portuguesa em sistemas biológicos, utilizando como modelo celular in vitro o eritrócito humano. Pretendeu-se assim estudar o papel protector de extractos metanólicos obtidos do própolis proveniente de duas regiões portuguesas distintas, Bornes (Nordeste de Portugal) e Fundão (Centro de Portugal), relativamente aos danos oxidativos induzidos por radicais livres em eritrócitos humanos. O 2,2´-azo-bis(2amidinopropano) (AAPH) é um sistema gerador de radicais livres peroxilo no meio extracelular que atacam a membrana eritrocitária causando várias alterações oxidativas, as quais foram avaliadas neste estudo pela libertação de hemoglobina (hemólise) e pela peroxidação dos lípidos da membrana dos eritrócitos.. Os resultados obtidos neste estudo mostram que ambos os extractos protegem significativamente a membrana dos eritrócitos da hemólise induzida pelo AAPH, de um modo dependente da concentração de extracto e do tempo de incubação. No entanto, o extracto de própolis de Bornes apresentou um efeito anti-hemolítico superior ao do própolis do Fundão, sendo o valor de IC50 determinado para o extracto de Bornes após três horas de incubação de 6,3 ± 0,7 µg/mL e de 10,4 ± 2,7 µg/mL para o do Fundão. Dada a reconhecida actividade antioxidante do ácido ascórbico, a actividade antihemolítica dos extractos de própolis foi comparada com a do ácido ascórbico (IC50 de.
(6) 31,0 ± 5,6 µg/mL), tendo-se verificado um efeito antioxidante significativamente superior para os extractos de própolis.. A. extensão. da. peroxidação. lipídica. foi. avaliada. pela. formação. de. malonildialdeído (MDA), que é conhecido como um produto carbonilo do dano lipídico oxidativo. Sob a acção oxidativa do AAPH, os eritrócitos humanos tratados com os extractos de própolis diminuíram significativamente a acção do AAPH de um modo dependente da concentração de extracto. Os valores de IC50 para os extractos do própolis de Bornes e do Fundão foram respectivamente de 8,1 ± 2,3 e 9,7 ± 2,3 µg/mL.. Os resultados deste estudo mostram que o própolis de origem portuguesa apresenta um considerável potencial antioxidante e sequestrador de radicais livres, o que sugere a sua eventual aplicação na prevenção e/ou tratamento de diversas situações patológicas em que os radicais livres estão envolvidos..
(7) Abstract. Propolis is a complex resinous bee product with great interest to bees and humans. The increasing development of new analytical techniques allowed a considerable advance in the chemistry of natural products, as well as the elucidation of their molecular structures. The chemical composition of propolis is complex and is related to the flora of the region they originated and the time of harvest. Their pharmacological activities have been attributed to phenolic compounds, including flavonoids and phenolic acids, whose contents have been proposed as parameters for quality control. Due to the numerous beneficial properties of propolis, its commercial use in pharmaceuticals and cosmetics in the form of liquid extracts is broad.. In this study, the antioxidant potential of propolis samples from Bornes (Northeast) and Fundão (Centre) regions of Portugal was evaluated by their ability to inhibit the 2,2´-azobis(2-amidinopropane) dihydrochloride (AAPH)-induced oxidative hemolysis and lipid peroxidation in human erythrocytes. Bornes and Fundão propolis strongly protected the erythrocyte membrane from hemolysis (IC50 of 6.3 ± 0.7 and 10.4 ± 2.7 µg/ml, respectively), in a time- and concentration-dependent manner. This effect was found to be significantly higher than that presented by ascorbic acid (IC50 of 31.0 ± 5.6 µg/ml). In addition, human erythrocytes treated with propolis extracts showed concentration-dependent decrease in levels of malondialdehyde, a breakdown product of lipid peroxidation.. Overall, these findings support Portuguese propolis as a promising therapeutic agent in the prevention of diseases mediated by free radicals..
(8) Agradecimentos. Para a realização deste trabalho de conclusão de curso pude contar com várias pessoas que, de diferentes formas, me apoiaram. Sendo assim, pretendo expressar a minha sincera gratidão:. Ao Reitor da Universidade Fernando Pessoa, Prof. Doutor Salvato Trigo, e ao Director da Faculdade de Ciências da Saúde da Universidade Fernando Pessoa, Prof. Doutor Luís Martins, pela formação e disponibilização das condições materiais indispensáveis ao desenvolvimento do trabalho experimental.. À Professora Doutora Márcia Carvalho pela forma como me orientou e motivou durante a realização do trabalho e por todo o tempo que me dispensou.. À Mestre Mary Duro, pelas recolhas de sangue que prontamente efectuou.. À Professora Doutora Branca Silva por toda a disponibilidade demonstrada.. Aos meus colegas, Lídia e Rui, pelo companheirismo e boa disposição sempre presentes no laboratório na realização das pesquisas práticas.. Aos técnicos dos laboratórios, pelo apoio e ajuda prestados.. Aos meus pais, obrigada..
(9) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Índice Geral. Índice de Figuras ..............................................................................................................X Índice de Tabelas ............................................................................................................ XI Índice de Gráficos .........................................................................................................XIII Abreviaturas................................................................................................................. XIV. I.. Introdução ............................................................................................................. 1. 1.1. Enquadramento e objectivos .................................................................................. 2 1.2. Plano Geral ............................................................................................................ 3 II.. Revisão Geral: O própolis .................................................................................... 4. 2.1. Características ........................................................................................................ 5 2.2. Distribuição geográfica .......................................................................................... 6 2.3. Caracterização química .......................................................................................... 8 2.4. Aplicações terapêuticas ........................................................................................ 10 III.. O eritrócito como modelo in vitro para avaliação da actividade antioxidante ... 14. 3.1. O eritrócito humano ............................................................................................. 15 3.2. Sistema antioxidante do eritrócito ....................................................................... 16 3.3. Danificação oxidativa eritrocitária ....................................................................... 17 3.4. Substâncias oxidantes usadas como modelos experimentais ............................... 18 IV.. Parte experimental: Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos............................................... 19. 4.1. Materiais e Métodos ............................................................................................. 20. VIII.
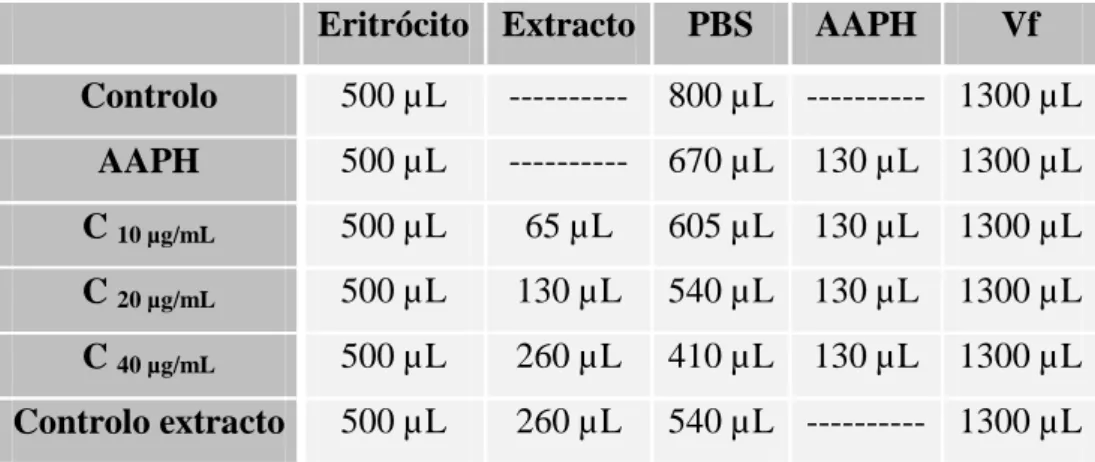
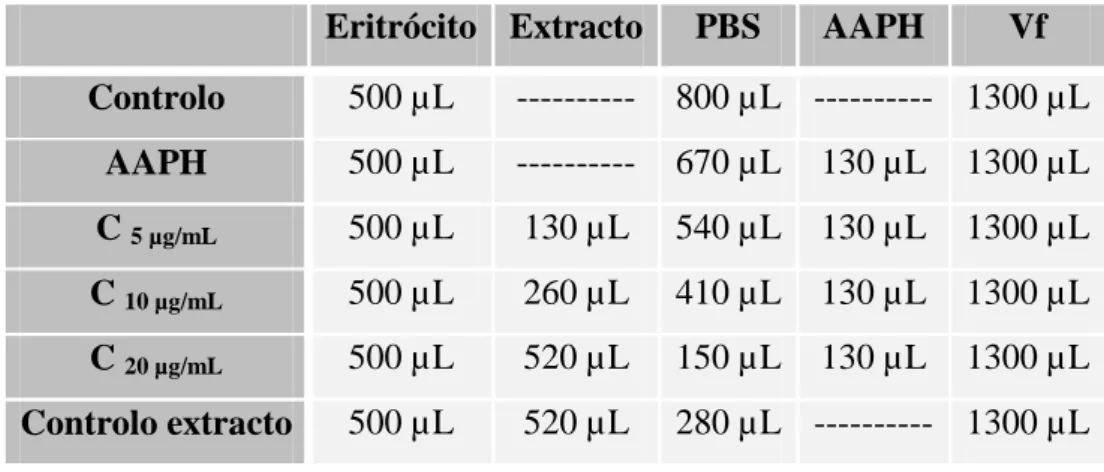
(10) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 4.1.1. Preparação dos extractos ............................................................................... 20 4.1.2. Avaliação da actividade antioxidante usando como modelo celular o eritrócito humano .................................................................................................... 20 4.1.2.1. Preparação da suspensão de eritrócitos .................................................. 20 4.1.2.2. Incubação com AAPH ............................................................................ 20 4.1.2.3. Avaliação da percentagem de hemólise.................................................. 23 4.1.2.4. Avaliação da extensão da peroxidação lipídica ...................................... 23 4.2 Resultados ............................................................................................................. 25 4.2.1. Efeito protector do própolis na hemólise induzida pelo AAPH .................... 25 4.2.2. Efeito protector do própolis na peroxidação lipídica induzida pelo AAPH.. 32 4.3. Discussão ............................................................................................................. 35 V.. Conclusões .......................................................................................................... 38. VI.. Referências Bibliográficas .................................................................................. 41. VII.. Anexos ................................................................................................................ 49. IX.
(11) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Índice de Figuras. Figura 1- Colheita de própolis ......................................................................................... 5. Figura 2- Aspecto das amostras brutas de própolis de Bornes (A) e do Fundão (B) usadas no estudo. .............................................................................................................. 6. Figura 3- Núcleo fundamental dos flavonóides .............................................................. 9. Figura 4- Eritrócitos humanos apresentando morfologia normal de disco bicôncavo .. 15. Figura 5- Reacção de oxidação do AAPH ..................................................................... 18. X.
(12) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Índice de Tabelas. Tabela 1- Tabela usada na preparação dos tubos de hemólise para o ensaio da actividade anti-hemolítica do própolis do Fundão. ........................................................ 21. Tabela 2- Tabela usada na preparação dos tubos de hemólise para o ensaio da actividade anti-hemolítica do própolis de Bornes. ......................................................... 22. Tabela 3- Tabela usada na preparação dos tubos de hemólise para o ensaio da actividade anti-hemolítica do ácido ascórbico................................................................ 23. Tabela 4- Resultados obtidos para a percentagem de hemólise para o própolis de Bornes ............................................................................................................................. 25. Tabela 5- Percentagem de inibição da hemólise para o extracto de própolis de Bornes 27. Tabela 6- Tabela representativa do IC50 do própolis de Bornes .................................... 27. Tabela 7- Resultados obtidos para a percentagem de hemólise para o própolis do Fundão ............................................................................................................................ 28. Tabela 8- Percentagem de inibição da hemólise para o extracto de própolis do Fundão ........................................................................................................................................ 30. Tabela 9- Tabela representativa do IC50 para o própolis do Fundão ............................. 30. Tabela 10- Resultados obtidos para a percentagem de hemólise e percentagem de inibição de hemólise para o ácido ascórbico .................................................................. 31. XI.
(13) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Tabela 11- Valores obtidos de área de pico para os padrões de tetraetoxipropano (TEP) ........................................................................................................................................ 32. Tabela 12- Resultados obtidos para a concentração de MDA ....................................... 33. Tabela 13- Resultados obtidos para a percentagem de inibição da peroxidação lipídica para os extractos de própolis de Bornes e do Fundão..................................................... 35. XII.
(14) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Índice de Gráficos. Gráfico 1- Representação gráfica do efeito protector do extracto de própolis de Bornes na hemólise induzida pelo AAPH .................................................................................. 26. Gráfico 2- Gráfico representativo do cálculo do IC50 para o extracto de própolis de Bornes ............................................................................................................................. 27. Gráfico 3- Representação gráfica do efeito protector do extracto de própolis do Fundão na hemólise induzida pelo AAPH .................................................................................. 29. Gráfico 4- Gráfico representativo do cálculo do IC50 para o extracto de própolis do Fundão ............................................................................................................................ 30. Gráfico 5- Curva de calibração obtida para os padrões de tetraetoxipropano (TEP) .... 32. Gráfico 6- Representação gráfica do efeito protector dos extractos de própolis de Bornes e do Fundão na indução da peroxidação lipídica pelo AAPH............................ 34. XIII.
(15) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Abreviaturas AAPH- 2,2´-azo-bis(2-amidinopropano) ATP- adenosina trifosfato BHT- butilhidroxitolueno CAPE- Caffeic acid phenethyl ester DMSO- dimetilsulfóxido GSH- glutationa reduzida HPLC-UV- cromatografia líquida de alta eficiência com detecção ultravioleta IC50- concentração de extracto que inibe 50% da hemólise MDA- malonildialdeído mg- miligrama ml- mililitro mm- milímetros PBS- solução de tampão fosfato RNS- espécies reactivas de azoto ROO•- radical peroxilo ROS- espécies reactivas de oxigénio Rpm- rotações por minuto SD- desvio padrão SH- grupo sulfidrilo SOD- superóxido dismutase TBA- ácido tiobarbitúrico TCA- ácido tricloroacético TEP- 1,1,3,3-tetraetoxipropano UV- ultra-violeta Vf- volume final μg- micrograma μm- micrómetro μL- microlitro. XIV.
(16) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Capítulo I. Introdução. 1.
(17) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 1.1. Enquadramento e objectivos O própolis é uma mistura complexa de substâncias recolhidas pelas abelhas de certas partes das plantas, especialmente dos gomos florais e foliares, sendo depois trabalhado pelas suas glândulas salivares, resultando uma massa final de aspecto resinoso (Nunes, 2009; Pereira, 2008). Este produto natural tem sido largamente usado na medicina popular há milhares de anos em todo o mundo. O própolis possui diversas propriedades biológicas e terapêuticas, sendo utilizado com maior frequência na prevenção e tratamento de feridas e infecções da via oral (devido às suas reconhecidas propriedades antibacterianas), também como antifúngico e cicatrizante (Ghisalberti et al., 1979; Millet-Clerc et al, 1987). Mais recentemente, foram-lhe reconhecidas outras actividades biológicas, nomeadamente antiviral (Kujumgiev et al., 1999), antiinflamatória (Park et al, 1998; Ozturk et al., 2000; Borrelli et al., 2002; Cardile et al., 2003), antioxidante (Russo et al., 2004), imuno-estimuladora (Bratter et al., 2008) e antitumoral (Lee et al., 1999).. O própolis contém uma grande variedade de compostos químicos, entre os quais polifenóis (flavonóides, ácidos fenólicos e os seus ésteres), terpenóides, esteróides e aminoácidos, sendo a sua composição variável e dependente da vegetação presente na área onde for recolhido. Desta forma, existe uma variabilidade significativa nas características e no potencial biológico do própolis oriundo de diferentes localidades.. Por esta razão, o objectivo do presente trabalho de investigação é o de avaliar a actividade antioxidante do própolis de origem portuguesa em sistemas biológicos. O eritrócito humano será usado neste estudo como modelo in vitro para avaliação da actividade antioxidante, visto a membrana eritrocitária ser rica em ácidos gordos insaturados que são muito susceptíveis à peroxidação lipídica mediada por radicais livres. Pretende-se assim estudar o papel protector de extractos metanólicos obtidos do própolis proveniente de duas regiões portuguesas distintas, Bornes (Nordeste de Portugal) e Fundão (Centro de Portugal), relativamente aos danos oxidativos induzidos por radicais livres em eritrócitos humanos. O 2,2´-azo-bis(2-amidinopropano) (AAPH) será utilizado como sistema gerador de radicais livres. Estes radicais gerados no meio extracelular atacam a membrana eritrocitária causando várias alterações oxidativas, tais como formação de peróxidos lipídicos, redução da deformabilidade, mudanças na 2.
(18) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. morfologia, ligação cruzada e fragmentação de proteínas, hemólise e alterações no metabolismo intracelular. Os danos oxidativos serão avaliados neste estudo pela libertação de hemoglobina (hemólise) e pela peroxidação dos lípidos da membrana dos eritrócitos.. 1.2. Plano Geral Este trabalho de conclusão de ciclo está dividido em seis capítulos.. No presente Capítulo procedeu-se ao enquadramento do trabalho e são apresentados os objectivos a que o trabalho se propõe.. No Capítulo 2 faz-se uma revisão da literatura no que concerne as características, composição química e aplicações terapêuticas do própolis.. No Capítulo 3, “O eritrócito como modelo in vitro para avaliação da actividade antioxidante”, é apresentado o modelo experimental escolhido para a realização do estudo do efeito antioxidante do própolis de origem portuguesa.. A “parte experimental” é apresentada no Capítulo 4, no qual são apresentados os vários procedimentos utilizados na execução do trabalho laboratorial, os resultados obtidos no estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos e a discussão dos mesmos.. No Capítulo 5, “Conclusões”, procedeu-se à sinopse deste trabalho.. Por último, no Capítulo 6 é apresentada uma listagem de todas as referências bibliográficas citadas ao longo do texto.. 3.
(19) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Capítulo II. Revisão Geral: O própolis. 4.
(20) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 2.1. Características O própolis é uma mistura complexa de substâncias que as abelhas recolhem de várias partes das plantas, tais como brotos, botões florais e exsudados resinosos, sendo depois transportada para dentro das colmeias e modificada pelas abelhas através das suas próprias enzimas (Park et al., 1999). É um produto que está relacionado com a protecção da colónia e o termo traduz exactamente essa função. O termo é originário das palavras gregas pró (defesa) e polis (cidade ou comunidade), que neste caso é a colmeia onde vivem as abelhas.. Figura 1 – Colheita de própolis (adaptado de http://passagempelafaculdade.blogspot.com/). O própolis possui um aroma característico (resinoso e balsâmico), sabor de suave balsâmico a forte, amargo e picante, cor variável desde a amarelada, parda, esverdeada clara ao pardo escuro e consistência maleável, ligeiramente rígida à temperatura ambiente, e rígida a menos de 20ºC. As características do própolis variam de acordo com a sua proveniência (Veronez, 2002).. As abelhas utilizam o própolis como produto higiénico sobre as paredes internas da colmeia de modo a reduzir ou vedar as aberturas, ajudando na regulação da temperatura interna e defesa contra inimigos naturais. É também utilizada para embalsamar pequenos animais mortos que não conseguem remover da colmeia, evitando assim a sua decomposição e a proliferação de microorganismos (Salatino et al., 2005).. 5.
(21) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. A. B. Figura 2- Aspecto das amostras brutas de própolis de Bornes (A) e do Fundão (B) usadas no estudo.. 2.2. Distribuição geográfica O mercado de produtos apícolas tem aumentado em todo o mundo, em consequência da procura crescente por produtos naturais, de alta qualidade, e que, principalmente, atendam os anseios dos consumidores. Actualmente, o própolis é usado principalmente pelas indústrias farmacêuticas e de cosméticos.. Por todo o mundo existem vários sinónimos de própolis, tais como cola de abelha, própolis de abelha, penicilina russa e cera de abelha sintética.. Os maiores produtores de própolis no mundo incluem a China, o Brasil, Estados Unidos, Austrália e Uruguai (Spethmamm, 2004). O consumo de própolis no mundo é estimado em cerca de 700-800 toneladas/ano.. Conforme dados do Japan Trade Organization (JETRO), 92% de toda a própolis in natura consumida no Japão é de origem brasileira (Teixeira et al., 2003). Nakamura et al. (1997) identificaram, por meio de análises cromatográficas, Populus italica e Betula platyphylla como sendo as principais espécies que originavam a própolis na região de Tóquio, no Japão (Teixeira et al., 2003). De acordo com Joly (2001), o Brasil é recordista em termos de biodiversidade, detendo cerca de 20% das espécies do planeta. Banskota et al. (1998), por meio de comparações dos resultados de análises sugeriram que Baccharis spp. seria uma importante fonte de própolis no Brasil, além de Clusia minor, Clusia major e Araucaria heterophylla (Pinaceae) (Teixeira et al., 2003).. 6.
(22) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. O género Baccharis possui mais de 500 espécies e apresenta distribuição cosmopolita, podendo ser encontrado na Oceânia, América do Sul, América do Norte e América Central (Teixeira et al., 2003). Baccharis dracunculifolia foi demonstrado como sendo a planta preferida por abelhas africanizadas de Apis mellifera para a colecta de própolis (Pires et al., 2002).. O género Xanthorrhoea (Juncaceae) constitui a fonte de material para a produção de própolis no oeste da Austrália (Ghisalberti, 1979).. Na América do Norte e oeste da Ásia, a fonte vegetal dominante é o exsudado do botão de choupo (Populus sp.). Entretanto, na América do Sul a espécie vegetal do género Populus não é nativa, existindo uma grande diversidade vegetal para retirada de resina, o que dificulta a correlação do própolis com a origem botânica (Park et al., 2002). Bonvehí e Coll (1994) atribuíram a origem do produto na China às seguintes espécies: Melia azederach, Morus spp., Populus spp., Prunus spp., Pyrus spp., Salix spp., Robinia pseudacacia L. e Ulmus spp (Teixeira et al., 2003). Outras espécies vegetais empregadas como fontes de própolis em várias partes do mundo são o carvalho, salgueiro, acácia, choupo, entre outras.. Popravko (1976) verificou que espécies de Populus (de nome vulgar choupo ou álamo) são as principais fontes de própolis na Europa, sendo Betula spp., Quercus spp. (Fagaceae), Alnus spp., Salix spp. (Salicaceae) e Corylus avellana (Corylaceae, aveleira) de importância secundária (Teixeira et al., 2003).. Montenegro et al. (2000) indicaram que as fontes principais de própolis no Chile são Baccharis linearis, Buddleja globosa, Peumus boldus e Salix humboldtiana.. O própolis vermelho é típico de Cuba e da Venezuela, onde a sua origem botânica foi identificada como sendo Clusia nemorosa e Clusia scrobiculata, respectivamente.. Para Valcic et al. (1999), o pólen e fragmentos de folhas têm considerável valor em termos de sistemática, na análise da origem botânica do própolis. Sendo assim, a. 7.
(23) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. análise da composição polínica específica do própolis pode ser usada prioritariamente na determinação de sua origem botânica (Teixeira et al., 2003).. 2.3. Caracterização química A composição química do própolis é complexa e variada, estando relacionada com a ecologia da flora de cada região e o período da colecta da resina. Além disso, a variabilidade genética das abelhas rainha também influencia a sua composição química (Park, 1998).. O crescente desenvolvimento de novas técnicas analíticas, como a cromatografia, e o contínuo aperfeiçoamento dos instrumentos de análise espectrómetros, têm permitido um considerável avanço na química dos produtos naturais, assim como na elucidação de suas estruturas moleculares (Teixeira et al., 2003).. Geralmente a composição do própolis engloba 50-60% de resinas e bálsamos, 3040% de ceras, 5-10% de óleos essenciais e 5% de pólen, possuindo ainda uma enorme variedade de microelementos como alumínio, estrôncio, ferro, cobre, césio, mercúrio, cálcio, magnésio, outras vitaminas como B1, B2, B6, C, E e provitamina A (Marcucci, 1995). O seu ponto de fusão situa-se geralmente entre os 60-70ºC, sendo que pode atingir, em alguns casos, os 100ºC (Marcucci, 1996).. O própolis é solúvel em solventes tais como o éter, etanol, acetona, tolueno e tricloroetileno, os quais permitem a dissolução da maior parte dos seus constituintes (Marcucci, 1996).. Os compostos identificados na resina do própolis são provenientes de 3 fontes: do exsudado das plantas colectado pelas abelhas, de substâncias secretadas pelo metabolismo da abelha e de materiais introduzidos durante a elaboração do própolis (Marcucci, 1995).. 8.
(24) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Segundo Wink (1990), os compostos secundários presentes no própolis estão directa ou indirectamente relacionados a adaptações das plantas ao meio em que se encontram, em função da presença de microorganismos, de condições climáticas, ou mesmo de interações com animais (incluindo dispersores de sementes, polinizadores ou insectos herbívoros) (Teixeira et al., 2003).. Até ao momento já foram identificados mais de 300 compostos químicos no própolis, nomeadamente flavonóides, ácidos aromáticos, terpenóides, aldeídos, álcoois, ácidos alifáticos e ésteres, aminoácidos, esteróides, açúcares, entre outros (Marcucci, 1995). As suas actividades farmacológicas têm sido atribuídas aos compostos fenólicos, entre eles flavonóides e ácidos fenólicos, cujos teores têm sido propostos como parâmetros para o controle da qualidade (Geckil et al., 2005).. Figura 3 - Núcleo fundamental dos flavonóides. Apesar de os flavonóides serem os constituintes bioactivos do própolis mais extensivamente estudados, estes não são os únicos responsáveis pelas suas propriedades farmacológicas. Outros compostos, tais como aminoácidos, ácidos alifáticos e seus ésteres, ácidos aromáticos e seus ésteres, álcoois, aldeídos, chalconas, dihidrochalconas, hidrocarbonetos, cetonas, terpenóides, esteróides e açúcares, têm sido relacionados com as propriedades biológicas do própolis (Daugsch, 2007).. Alguns componentes de própolis estão presentes em todas as amostras, enquanto outros estão só presentes em própolis derivadas de espécies particulares de plantas (Lustosa et al., 2008).. 9.
(25) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Nas zonas temperadas do hemisfério norte, as abelhas colectam o própolis apenas no verão e por isso as variações sazonais na composição do própolis são insignificantes. (Pereira, 2008). As cinzas são um constituinte natural do própolis, porém um material inorgânico que, em quantidades exageradas, pode denunciar adulterações como, por exemplo, por adição de terra ao produto (Própolis com controlo de qualidade, 1999).. As substâncias voláteis são responsáveis pelo aroma característico do própolis (Própolis com controlo de qualidade, 1999). Teores baixos de substâncias voláteis podem denunciar o seu armazenamento por tempo excessivamente prolongado. Da mesma forma, o teor de humidade torna-se mais elevado se o própolis não for armazenado de forma adequada, podendo levar a uma deterioração mais rápida do produto (Própolis com controlo de qualidade, 1999).. Para uma correcta análise e controlo de qualidade do própolis torna-se necessário efectuar uma análise organoléptica, avaliando-se o aroma, sabor, coloração, estrutura e consistência, e físico-química, avaliando-se o teor de humidade, sólidos insolúveis totais, misturas mecânicas, índice de oxidação e análise qualitativa para compostos flavonóides (Cavia et al., 2002; Isengard et al., 2001; Faria, 1993).. 2.4. Aplicações terapêuticas Como referido anteriormente, as propriedades biológicas do própolis estão directamente ligadas à sua composição química, e este é provavelmente o maior problema para o uso do própolis em fitoterapia, tendo em vista que a sua composição química varia com a flora da região e época da colheita, com a técnica empregada, assim como com a espécie da abelha.. O própolis foi amplamente utilizado na segunda guerra mundial devido às suas propriedades cicatrizantes (Pereira et al., 2002). Na antiga União Soviética, este produto natural mereceu especial atenção em medicina humana e veterinária, com aplicações inclusive no tratamento da tuberculose, observando-se a regressão dos problemas 10.
(26) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. pulmonares e recuperação do apetite (Pereira et al., 2002). Os gregos, entre os quais Hipócrates, adoptaram-na como cicatrizante interno e externo. Do mesmo modo, Plínio, historiador romano, refere-se ao própolis como medicamento capaz de reduzir inchaços e aliviar dores (Pereira et al., 2002).. Os compostos fenólicos, particularmente os flavonóides, são tidos como os principais constituintes responsáveis pelas acções terapêuticas do própolis (ArvouetGrand et al., 1994). Estes compostos auxiliam na absorção e na manutenção da vitamina C no organismo, sendo por isso usadas na medicina tradicional para o tratamento de doenças que atacam as vias aéreas superiores (gripes, dores de garganta, constipações), e foram ainda indicadas no tratamento de problemas de mau hálito, aftas, gengivites, feridas, cortes, micoses, espinhas, verrugas, frieiras, furúnculos e manchas da pele (Marcucci, 1995; Daugsch, 2007). Existem no mercado pomadas à base de própolis para acelerar o processo de cicatrização de feridas e prevenir infecções. É ainda indicado no tratamento em aplicação local ou sistémica em processos inflamatórios, erosivos e distróficos como as cervicites e erosão do colo uterino, adenoma de próstata, prostatite, cistite, transtornos do apetite sexual, impotência, frigidez feminina, trichomoníases, entre outras (Marcucci, 1995). Notavelmente, foi considerada ainda uma substância com actividade anti-stress, diminuindo transtornos do sono.. O própolis encontra-se disponível actualmente em várias formulações farmacêuticas como cápsulas, extractos, elixir bucal, na forma de pó, pomadas, homogeneizados de mel, entre outras (Lustosa et al., 2008).. Vários trabalhos têm sido publicados descrevendo as propriedades biológicas do própolis, nomeadamente:. Actividade antimicrobiana: inibe a proliferação de bactérias (antibacteriana), fungos (antifúngica) e vírus (antiviral). Esta acção é atribuída aos flavonóides, ácidos aromáticos e ésteres presentes na sua composição. Os ácidos cafeico e o ferúlico contribuem também para essa propriedade (Popova et al., 2004; Bankova et al., 1995; Mazzuco et al., 1996 e Park et al., 1998). O própolis possui actividade antibacteriana maior contra bactérias Gram-positivas e limitada contra Gram negativas (Lu et al., 11.
(27) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 2005; Marcucci et al., 2001). Parece isso dever-se ao facto de estas bactérias possuírem uma parede celular quimicamente mais complexa e um teor lipídico maior, o que pode explicar essa maior resistência (Vargas et al., 2004). O própolis parece ainda possuir acção sinérgica relevante, sendo uma alternativa terapêutica para a resistência microbiana, no entanto dependente de sua composição (Stepanovic et al., 2003; Onlen et al., 2007).. Actividade imunomoduladora: o própolis aumenta a resistência natural do corpo contra infecções por estimulação do sistema imune (Daugsch, 2007). Actua estimulando o sistema imunológico, assegurando a maturação dos linfócitos T, dos nódulos linfáticos e do baço, que garantem o potencial de fagocitose e os números de anticorpos (Sforcin et al., 2000). Segundo Sy et al. (2006), o tratamento com própolis atenua inflamações das vias aéreas em ratos, provavelmente por modular a produção de citocina.. Actividade antiparasitária: as mais recentes pesquisas clínicas reportam numerosas comunicações relacionadas com a manifesta actividade antiparasitária do própolis, destacando-se a sua efectividade face à Giardia lamblia (Veronez, 2002). Hollands et al. (1988) refere-se à observação de uma marcada redução na produção de quistos em fezes de animais, aquando do tratamento com extractos de própolis. Extractos de própolis foram activos ainda contra Trypanosoma cruzi (Higashi e Castro, 1995), e letais para Trichomonas vaginalis (Starzyk et al., 1977).. Actividade anti-inflamatória: previne e impede o desenvolvimento de processos inflamatórios.. Esta. actividade. está. associada. à. presença. de. flavonas. e. metoxiflavonóides na sua composição química. Considera-se que este mecanismo de acção está baseado na intervenção destes compostos a nível dos mediadores da inflamação e ainda na redução da migração celular e na inibição da produção de radicais livres (Ivanovska et al., 1995; Park et al., 1996; Ledón et al., 1997; Menezes et al., 1999; Ozturk et al., 2000).. Acção anestésica: atribuída aos compostos voláteis presentes no própolis (Ghisalberti, 1979). Extractos alcoólicos e aquosos de própolis da Coréia mostraram um forte efeito analgésico, que foi comparado com o ácido acetilsalicílico (Daugsch, 2007).. 12.
(28) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Actividade hepatoprotectora: foi demonstrado que o extracto aquoso de própolis possui acção antioxidante hepatoprotectora, prevenindo a insuficiência hepática fulminante induzida pelo paracetamol em animais tratados com uma sobredosagem do fármaco (Said et al., 1998).. Actividade antitumoral: retarda o desenvolvimento de células malignas. Estudos demonstraram. ainda. que. o. própolis. possui. propriedades. mitodepressivas. particularmente fortes em células geneticamente modificadas (Burdock, 1998 e Banskota et al., 2001). A citotoxidade do própolis foi comprovada em estudos realizados quer em animais quer in vitro (Bankova, 2005). Outros estudos indicam que o éster fenetil do ácido cafeico (CAPE), um composto isolado do própolis, tem potencial como agente anti-metastático (Liao et al., 2003). Estudos realizados por Mishima et al. (2005) demonstraram que a baccharina e a drupanina isoladas do própolis possuem potente acção antitumoral.. Actividade radioprotectora, o que tem permitido a sua aplicação com a finalidade de diminuir as reacções desagradáveis em pacientes submetidos a radioterapia (Suárez et al.,1996).. Actividade vasoprotectora: protege a fragilidade e permeabilidade dos vasos sanguíneos. Esta acção deve-se especialmente aos flavonóides presentes no própolis.. Contudo, e à semelhança de outros produtos naturais, até ao momento não foram avaliados no própolis parâmetros essenciais como a sua segurança e qualidade, de forma a permitir o uso racional deste produto.. 13.
(29) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Capítulo III. O eritrócito como modelo in vitro para avaliação da actividade antioxidante. 14.
(30) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 3.1. O eritrócito humano O eritrócito tem como principal função transportar oxigénio para os tecidos através da hemoglobina (Pereira et al., 2007). O eritrócito maduro é uma célula anucleada que vive cerca de 120 dias na circulação periférica, apresentando uma conformação normal de disco bicôncavo (Figura 4) com aproximadamente 7,5 μm de diâmetro, 0,8 µm de espessura no seu centro e 2,5 μm de espessura na borda (Frydman, 2009).. Figura 4 - Eritrócitos humanos apresentando morfologia normal de disco bicôncavo. A membrana do eritrócito é constituída por 42% de lípidos, 52% de proteínas e 7% de carbohidratos e é representada por uma bicamada lipídica com proteínas integrais (intrínsecas) e periféricas (extrínsecas) nas faces interna e externa membranares (Pinto et al., 2007). Os fosfolípidos encontram-se distribuídos assimetricamente de um e outro lado da bicamada, sendo que no folheto interno predominam aminofosfolípidos (fosfatidilserina e fosfatidiletanolamina) enquanto no folheto externo imperam a fosfatidilcolina e a esfingomielina. O colesterol está intercalado entre as cadeias alifáticas das moléculas de fosfolípidos. Os ácidos gordos mais comuns, constituintes dos lípidos da membrana, são o palmítico (l6:0), o esteárico (l8:0), o oleico (l8:1), o linoleico (l8:2) e o araquidónico (20:4). Esta bicamada lipídica representa aproximadamente 50% de sua massa total e forma barreira entre compartimentos líquidos extra e intracelular (Murador et al., 2007). Entre esses compartimentos são efectuadas trocas, através de canais de trocas de iões, bombas e transporte molecular. A interacção das proteínas do citoesqueleto (periféricas) com a bicamada lipídica e com as. 15.
(31) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. proteínas integrais da membrana são responsáveis pela flexibilidade e deformabilidade do eritrócito (Krukoski, 2006).. Durante o processo de diferenciação do eritrócito, a partir de células progenitoras da medula óssea, ocorre a perda, por exocitose, do núcleo e organelos citoplasmáticos, como o retículo endoplasmático, mitocôndrias e ribossomas. Dessa forma, o eritrócito maduro é incapaz de sintetizar proteínas, e não possui metabolismo aeróbio, dependendo da glicólise anaeróbica para suprir as suas necessidades energéticas (Burtis et al., 1998). O ATP é necessário para manter o equilíbrio hidrolítico e a morfologia do eritrócito. Baixos níveis de ATP acarretam alterações danosas para a célula, tais como a diminuição da actividade da bomba Na/K e a capacidade de síntese de fosfolípidos.. O eritrócito constitui um excelente modelo experimental, em virtude da sua simplicidade estrutural, acessibilidade e vulnerabilidade dos seus constituintes à oxidação. Distúrbios causados por alterações genéticas ou exposição a agentes externos químicos e físicos podem levar a uma diminuição na vida média do eritrócito, muitas vezes relacionada a processos oxidativos (Magalhães, 2009).. 3.2. Sistema antioxidante do eritrócito Os eritrócitos estão constantemente em contacto com o oxigénio molecular de forma relativamente segura para a sua integridade. Isto torna-se possível graças a um complexo sistema de defesa antioxidante, o qual previne a acumulação de radicais livres e de outras espécies altamente reactivas. Estes mecanismos incluem antioxidantes enzimáticos e antioxidantes não enzimáticos endógenos (Magalhães, 2009). Entre estes, a glutationa (GSH) tem um papel crucial na manutenção do estado redox eritrocitário. A GSH tem como função manter os componentes intracelulares no estado reduzido, especialmente proteínas e iões Fe2+ de grupos heme. A GSH também actua como um nucleófilo, ligando-se covalentemente a centros electrofílicos, e como cofactor da glutationa peroxidase, exercendo aí um papel fundamental na metabolização de peróxidos. Outras enzimas importantes são a superóxido dismutase (SOD), que forma peróxido de hidrogénio a partir do radical superóxido, e a catalase, que remove o peróxido de hidrogénio formado. A hemoglobina auto-oxidada pode ser convertida à. 16.
(32) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. desoxihemoglobina pela metahemoglobina redutase, uma enzima NADH-dependente (Harris, 1991). Os eritrócitos possuem ainda mecanismos capazes de transferir equivalentes redutores através da sua membrana para o meio extracelular. A actividade da oxirredutase transmembranar está relacionada à manutenção do estado redox de proteínas, neutralização de agentes oxidantes externos e reciclagem da vitamina E na membrana (Magalhães, 2009).. Compostos não enzimáticos de baixo peso molecular que actuam na remoção preventiva de espécies reactivas de oxigénio (ROS) e azoto (RNS) também são muito importantes para a manutenção do equilíbrio redox no eritrócito. Entre estes, citam-se compostos como os tocoferóis (vitamina E), compostos fenólicos, como os flavonóides e ácidos fenólicos, o ácido ascórbico e quelantes de ferro. A vitamina E revela-se mais eficaz na protecção da membrana das células e consequentemente na prevenção de hemólise oxidativa, especialmente na presença de co-antioxidantes que a regeneram continuamente, nomeadamente a vitamina C (Magalhães, 2009).. Compostos polifenólicos, como os flavonóides, também têm actividade antioxidante comprovada, sendo capazes de entrar no eritrócito e inactivar radicais hidroxilo e peroxilo. Os flavonóides são ainda capazes de quelatar metais e podem inibir o dano oxidativo resultante da reacção de Fenton (Magalhães, 2009).. 3.3. Danificação oxidativa eritrocitária As principais estruturas eritrocitárias afectadas por radicais livres e outras espécies oxidantes são os constituintes membranares e a hemoglobina. Como referido anteriormente, a membrana do eritrócito é rica em ácidos gordos poliinsaturados sendo, por isso, muito susceptível à peroxidação lipídica. As proteínas do eritrócito também podem ser modificadas no processo oxidativo, sobretudo se possuírem grupos sulfidrilo (-SH), ocorrendo uma acumulação intracelular de proteínas desnaturadas.. A acção dos radicais livres em membranas eritrocitárias pode levar a uma série de alterações como formação de peróxidos lipídicos, redução da deformabilidade, fenómenos de cross-linking proteico, hemólise e alterações no metabolismo intracelular 17.
(33) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. (Shiva et al., 2007; Sato et al., 1995). Estas alterações têm como principal consequência a diminuição do tempo médio de vida do eritrócito.. O eritrócito constitui assim um excelente modelo experimental para o estudo in vitro quer dos mecanismos de lesão oxidativa induzidos por radicais livres em membranas biológicas, quer para a investigação do efeito protector de alguns compostos.. 3.4. Substâncias oxidantes usadas como modelos experimentais Diversas substâncias têm sido utilizadas como modelos de agentes oxidantes para estudar o mecanismo de lesão oxidativa em eritrócitos, especificamente o peróxido de hidrogénio (Lii e Hung, 1997), o terc-butilhidroperóxido (Rice-Evans et al., 1985; Zou et al., 2001), a primaquina (Grinberg e Samuni, 1994) e hidrazinas (Biswas et al., 2005). Entre os agentes oxidantes usados, o 2,2´-azo-bis(2-amidinopropano) (AAPH) tem sido largamente empregue como gerador de radicais livres em estudos biológicos (Dai et al.; Shiva et al., 2007). O AAPH é um composto azo hidrossolúvel gerador de .. radicais livres do tipo peroxilo (ROO ) por decomposição térmica a 37º C (Figura 5) (Sato et al., 1995). A geração de radicais pelo AAPH é dependente do tempo e da concentração (Sato et al.; Zou et al., 2001). Estes radicais gerados no meio extracelular atacam a membrana do eritrócito causando várias alterações oxidativas, tais como formação de peróxidos lipídicos, redução da deformabilidade, mudanças na morfologia, ligação cruzada e fragmentação de proteínas, hemólise e alterações no metabolismo intracelular. Essas alterações têm como principal consequência a diminuição do tempo de semi-vida do eritrócito.. Figura 5 - Reacção de oxidação do AAPH (adaptado de Dunlap et al., 2003). 18.
(34) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Capítulo IV. Parte experimental: Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 19.
(35) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 4.1. Materiais e Métodos 4.1.1. Preparação dos extractos As amostras de própolis foram colhidas por apicultores em Setembro de 2007 de colmeias de abelhas Apis mellifera localizadas na Serra de Bornes (Nordeste de Portugal) e no Fundão (região da Beira Interior) e imediatamente congeladas a -20ºC. Posteriormente, estas amostras foram extraídas usando metanol (1:1, v/v) com agitação (200 rpm) durante a noite, à temperatura ambiente. A solução obtida foi filtrada e o resíduo foi re-extraído mais duas vezes nas mesmas condições. Os extractos combinados foram colocados a baixas temperatutas durante 12 horas e filtrados para a remoção das ceras e, em seguida, evaporados à secura. O rendimento da extracção foi de 49% e 53% para o própolis de Bornes e do Fundão, respectivamente.. 4.1.2. Avaliação da actividade antioxidante usando como modelo celular o eritrócito humano 4.1.2.1. Preparação da suspensão de eritrócitos O sangue venoso humano foi colhido em citrato (anticoagulante) de dadores saudáveis, não fumadores, após obtenção do consentimento informado (ver Anexo I). Para obter os eritrócitos empacotados centrifugou-se o sangue total (5 a 10 mL) a 1.500 rpm durante 10 minutos a 4ºC. O plasma e a camada leucocitária (buffy coat) foram removidos por aspiração e os eritrócitos foram lavados 3 vezes com solução tampão de fosfato (PBS; pH 7,4), repetindo-se em cada lavagem a centrifugação nas condições referidas anteriormente. Após a última lavagem perfez-se o volume com PBS de modo a obter uma suspensão eritrocitária com hematócrito 5,2% (0,52 mL de eritrócitos compactados para um volume final de 10 mL em PBS).. 4.1.2.2. Incubação com AAPH Para avaliar o efeito protector do própolis português foram estudadas várias concentrações dos extractos de própolis de Bornes (5, 10 e 20 µg/mL) e do Fundão (10, 20 e 40 µg/mL). 20.
(36) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Os extractos de própolis de Bornes e do Fundão foram inicialmente solubilizados em dimetilsulfóxido (DMSO) de modo a obter uma solução stock de 50 mg de extracto/mL e posteriormente diluídos em PBS.. Aos tubos de hemólise adicionou-se 500 μL da suspensão eritrocitária a 5,2% de modo a obter um hematócrito final de 2,0%, tendo em conta que o volume final nos tubos será de 1300 μL, sendo estes colocados a incubar a 37 ºC durante 5 minutos. Após a incubação, adicionou-se os antioxidantes (extractos de própolis de Bornes e do Fundão e ácido ascórbico) ou não, de acordo com as tabelas apresentadas abaixo, sendo os tubos pré-incubados a 37 ºC durante 30 minutos.. As concentrações testadas do extracto de própolis do Fundão foram obtidas a partir da solução stock anteriormente descrita, da qual se retirou 100 µL e adicionou-se 9,9 mL de PBS obtendo-se uma concentração de 0,5 mg de extracto/mL. Finalmente, retiraram-se 3 mL da anterior aos quais foram adicionados 4,5 mL de PBS, obtendo-se assim uma solução de 200 µg/mL. A partir de uma solução de 200 µg/mL em PBS e, de acordo com a Tabela 1, obtiveram-se as concentrações finais nos tubos de 10, 20 e 40 µg/mL. A actividade hemolítica deste extracto foi avaliada expondo as células à concentração mais alta estudada (40 µg/mL), na ausência de AAPH (controlo do extracto).. Tabela 1 - Tabela usada na preparação dos tubos de hemólise para o ensaio da actividade anti-hemolítica do própolis do Fundão.. Eritrócito Extracto. PBS. AAPH. Vf. Controlo. 500 µL. ----------. 800 µL ---------- 1300 µL. AAPH. 500 µL. ----------. 670 µL. 130 µL. 1300 µL. C 10 µg/mL. 500 µL. 65 µL. 605 µL. 130 µL. 1300 µL. C 20 µg/mL. 500 µL. 130 µL. 540 µL. 130 µL. 1300 µL. C 40 µg/mL. 500 µL. 260 µL. 410 µL. 130 µL. 1300 µL. Controlo extracto. 500 µL. 260 µL. 540 µL ---------- 1300 µL. As concentrações testadas do extracto de própolis de Bornes foram obtidas a partir da solução stock em DMSO, da qual se retirou 100 µL e adicionou-se 9,9 mL de 21.
(37) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. PBS obtendo-se uma concentração de 0,5 mg de extracto/mL. Finalmente, retirou-se 1 mL da anterior aos quais foram adicionados 9 mL de PBS, obtendo-se assim uma solução de 50 µg/mL, a partir da qual se prepararam as concentrações finais de 5, 10 e 20 µg/mL (Tabela 2). Do mesmo modo, a actividade hemolítica do extracto de própolis de Bornes foi avaliada expondo as células à concentração mais alta estudada (20 µg/mL), na ausência de AAPH (controlo do extracto).. Tabela 2 - Tabela usada na preparação dos tubos de hemólise para o ensaio da actividade anti-hemolítica do própolis de Bornes.. Eritrócito Extracto. PBS. AAPH. Vf. Controlo. 500 µL. ----------. 800 µL ---------- 1300 µL. AAPH. 500 µL. ----------. 670 µL. 130 µL. 1300 µL. C 5 µg/mL. 500 µL. 130 µL. 540 µL. 130 µL. 1300 µL. C 10 µg/mL. 500 µL. 260 µL. 410 µL. 130 µL. 1300 µL. C 20 µg/mL. 500 µL. 520 µL. 150 µL. 130 µL. 1300 µL. Controlo extracto. 500 µL. 520 µL. 280 µL ---------- 1300 µL. Findo o tempo de pré-incubação, adicionou-se (amostras) ou não (controlos) o oxidante AAPH, de acordo com as tabelas acima apresentadas, de modo a obter a concentração final de AAPH de 50 mM. Os tubos de hemólise foram depois incubados durante 4 horas, a 37ºC, com agitação suave e constante e ao abrigo da luz.. Neste estudo o ácido ascórbico foi utilizado como antioxidante de referência, com o qual será comparado o efeito protector das amostras de própolis. Para tal, a partir de uma solução stock de 1 mg/mL de ácido ascórbico em PBS, preparou-se uma solução de 250 µg/mL. A partir desta solução e, de acordo com a Tabela 3, foram realizadas diluições nos tubos para obter soluções com as concentrações finais de 100, 50 e 25 µg/mL.. 22.
(38) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Tabela 3 - Tabela usada na preparação dos tubos de hemólise para o ensaio da actividade anti-hemolítica do ácido ascórbico. Eritrócito Extracto. PBS. AAPH. Vf. Controlo. 500 µL. ----------. 800 µL ---------- 1300 µL. AAPH. 500 µL. ----------. 670 µL. 130 µL. 1300 µL. C 25 µg/mL. 500 µL. 130 µL. 540 µL. 130 µL. 1300 µL. C 50 µg/mL. 500 µL. 260 µL. 410 µL. 130 µL. 1300 µL. C 100 µg/mL. 500 µL. 520 µL. 150 µL. 130 µL. 1300 µL. 4.1.2.3. Avaliação da percentagem de hemólise Durante as 4 horas de incubação, com intervalos de 1 hora, retiraram-se duas alíquotas de 50 µL de cada tubo. Uma das alíquotas é adicionada a 950 µL de água (B) e a outra a 950 µL de soro fisiológico (A), em eppendorfs previamente colocados no gelo (4ºC) de modo a parar a hemólise. De seguida, centrifugou-se os eppendorfs a 4.000 rpm durante 10 minutos, removendo-se depois cerca de 300 µL do sobrenadante para uma placa de 96 poços, de modo a proceder-se à leitura da absorvância a 545 nm no leitor de placas. A % de hemólise é calculada a partir da razão entre as duas leituras, ou seja, % hemólise = (A/B) x 100. A concentração de extracto que inibe 50% da hemólise (IC50) ao fim de três horas foi calculada através do traçado do gráfico da percentagem de inibição de hemólise em função da concentração de extracto. Para estes cálculos foram realizados 4 ensaios independentes.. 4.1.2.4. Avaliação da extensão da peroxidação lipídica A peroxidação lipídica é um processo mediado por radicais livres. Numa situação de stress oxidativo pode haver falência dos mecanismos de defesa antioxidantes endógenos com formação de espécies reactivas de oxigénio, capazes de desencadear o ataque oxidativo aos lípidos poliinsaturados das membranas eritrocitárias. A consequente fragmentação dá origem a hidrocarbonetos como o etanol e a aldeídos como o 4-hidroxinonenal e o malonildialdeído (MDA). Este método tem como princípio a reacção de uma molécula de malonildialdeído com duas moléculas de ácido tiobarbitúrico (TBA) com formação de um complexo MDA-(TBA)2 que é quantificado 23.
(39) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. por cromatografia líquida de alta eficiência com detecção ultravioleta (HPLC-UV). Foram realizados ensaios para várias concentrações dos extractos de Bornes e do Fundão, assim como para o padrão 1,1,3,3-tetraetoxipropano (TEP), obtendo-se através deste a curva de calibração padrão. Os resultados foram calculados como mM equivalente a MDA. O IC50 foi calculado pela curva de calibração obtida através da percentagem de peroxidação lipídica em função da concentração de extracto. Os valores percentuais de inibição foram calculados considerando como 100% o valor da peroxidação lipídica induzida pelo AAPH na ausência de extracto. Para estes cálculos foram realizados três ensaios independentes.. Para avaliar a extensão da peroxidação lipídica, os eritrócitos humanos foram mantidos nas condições experimentais descritas anteriormente para a determinação da percentagem de hemólise com excepção da utilização de uma suspensão eritrocitária com um hematócrito de 5,2%. Os tubos de hemólise foram incubados durante 3 horas. No final da incubação, retiraram-se alíquotas de 250 µL para eppendorfs, às quais adicionou-se 25 µL de butilhidroxitolueno (BHT) a 0,2%, e 1 mL de ácido tricloroacético (TCA) a 1% previamente colocado no gelo (4 ºC). As amostras foram agitadas no vórtex e depois centrifugadas em centrífuga refrigerada a 10.000 rpm durante 10 minutos. Posteriormente, retirou-se 500 µL de sobrenadante para outro eppendorf, sendo adicionado 500 µL de ácido tiobarbitúrico a 1%. Os eppendorfs foram agitados no vórtex e colocados num banho de água fervente (95 ºC) durante 45 minutos. Após este período os eppendorfs foram arrefecidos em gelo (4 ºC), centrifugados em centrífuga refrigerada a 10.000 rpm durante 5 minutos e 50 µL do sobrenadante foram injectados no HPLC (Hewlett Packard 1100 series) com detector UV a 532 nm. A separação cromatográfica realizou-se através de uma coluna Spherisorb C18 ODS2 (5 µm; 4,6 x 250 mm) da Waters Corporation e a fase móvel utilizada foi acetato de amónio 0,05 M: metanol (60:40), com fluxo de 0,7 mL/min. Paralelamente, preparou-se uma curva de calibração com diferentes concentrações do padrão 1,1,3,3tetraetoxipropano (TEP) (10, 5, 2, 1, 0,5 e 0,25 µM em etanol a 40%.), procedendo-se de forma idêntica à descrita para as amostras com excepção das centrifugações que para os padrões não se executam.. 24.
(40) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. 4.2 Resultados 4.2.1. Efeito protector do própolis na hemólise induzida pelo AAPH Própolis de Bornes. Na tabela seguinte são apresentados os valores da percentagem de hemólise nas células incubadas com as diferentes concentrações do extracto de própolis de Bornes, obtidos em 4 ensaios independentes.. Tabela 4 - Resultados obtidos para a percentagem de hemólise para o própolis de Bornes. Controlo Média SD AAPH Média SD Própolis Bornes 5 µg/mL Média SD Própolis Bornes 10 µg/mL Média SD Própolis Bornes 20 µg/mL Média SD. 1 3,9 1,2 5,0 3,7 3,4 1,6 4,0 2,8 4,7 3,7 3,8 0,8 4,1 1,9 4,0 2,4 3,1 1,1 1,9 5,0 3,4 1,9 3,1 1,5 2,8 2,3 2,4 2,8 2,6 0,3. Tempo (h) 2 3 3,3 2,0 3,6 3,8 5,0 5,0 3,7 3,7 3,9 3,6 0,8 1,2 75,3 106,8 43,7 90,5 70,3 91,0 43,2 91,7 58,1 95,0 17,1 7,9 8,1 60,6 4,9 68,9 25,9 60,0 3,5 57,2 10,6 61,7 10,4 5,0 4,3 20,7 3,7 23,1 8,1 31,2 3,8 7,7 5,0 20,7 2,1 9,7 1,9 6,6 5,2 14,7 3,0 4,7 0,6 2,8 2,7 7,2 1,9 5,2. 25. 4 1,4 7,0 4,9 2,5 4,0 2,5 114,1 90,1 89,2 85,5 94,7 13,1 92,8 93,9 86,3 89,4 90,6 3,5 69,6 55,2 57,2 63,3 61,3 6,5 28,2 47,1 36,6 16,1 32,0 13,1.
(41) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Estes resultados são seguidamente apresentados na forma de gráfico. Cada valor representa a média ± SD de quatro ensaios independentes. *Representa resultados significativos (P <0,05) quando o grupo tratado foi comparado com o grupo AAPH, nos respectivos tempos. #Representa resultados significativos (P <0,05) quando o grupo tratado foi comparado com o grupo controlo, nos respectivos tempos.. 120 #. #. Hemólise (%). 100. Controlo AAPH. #. 80. *#. 60. *#. + Propolis Bornes 5 g/ml + Propolis Bornes 0 g/ml + Propolis Bornes 20 g/ml. *#. 40. *. 20. *# *. *. 3. 4. 0 0. 1. 2. 5. Tempo (h). Gráfico 1 - Representação gráfica do efeito protector do extracto de própolis de Bornes na hemólise induzida pelo AAPH. Para o cálculo da concentração inibitória 50 (IC 50), ou seja, a concentração de extracto que inibe 50% da hemólise induzida pelo AAPH, determinou-se a percentagem de inibição de hemólise para cada concentração de extracto ao tempo 3 horas, tal como apresentado na tabela seguinte.. 26.
(42) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Tabela 5 - Percentagem de inibição da hemólise para o extracto de própolis de Bornes. Controlo. AAPH. Própolis Bornes 5 µg/mL Própolis Bornes 10 µg/mL Própolis Bornes 20 µg/mL. T=3h % hemólise 1,96 3,77 5,00 3,70 106,79 90,48 91,00 91,70 60,60 68,89 60,00 57,20 20,70 23,08 31,20 7,70 6,60 14,70 4,70 2,80. -Controlo. % Inibição. 104,83 86,70 86,00 88,00 58,64 65,12 55,00 53,50 18,74 19,30 26,20 4,00 4,64 10,93 0,00 0,00. 44,06 24,90 36,05 39,20 82,12 77,74 69,53 95,45 95,57 87,40 100,00 100,00. Em seguida, traçou-se o gráfico da % inibição de hemólise versus a concentração de extracto para cada ensaio independente (Tabela 6 e Gráfico 2).. Tabela 6 - Tabela representativa do IC50 do própolis de Bornes. Concentração (µg/mL). % Inibição de hemólise. 5 10 20. 44,1 82,1 95,6. 5,63. IC50. y = -0,4178x2 + 13,88x - 14,891 R² = 1. 120 100 80 60 40 20 0 0. 5. 10. 15. 20. 25. Gráfico 2 - Gráfico representativo do cálculo do IC50 para o extracto de própolis de Bornes. 27.
(43) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. O valor de IC50 calculado para o extracto de própolis de Bornes foi de 6,3 ± 0,7 µg/mL.. Própolis do Fundão. Na tabela seguinte são apresentados os valores da percentagem de hemólise nas células incubadas com as diferentes concentrações do extracto de própolis do Fundão obtidos em 4 ensaios independentes.. Tabela 7 - Resultados obtidos para a percentagem de hemólise para o própolis do Fundão. Controlo Média SD AAPH Média SD Própolis Fundão 10 µg/mL Média SD Própolis Fundão 20 µg/mL Média SD Própolis Fundão 40 µg/mL Média SD. 1 3,9 2,7 5,1 1,8 3,4 1,4 5,2 7,3 4,2 4,2 5,2 1,5 3,1 7,6 1,9 2,5 3,8 2,6 2,5 3,3 4,2 4,4 3,6 0,9 3,1 4,0 1,6 4,6 3,3 1,3. Tempo (h) 2 3 2,6 3,0 9,5 3,0 1,4 1,4 2,0 1,2 3,9 2,2 3,8 1,0 79,9 90,0 70,6 100,0 70,5 100,0 51,2 100,0 68,1 97,5 12,1 5,0 4,7 62,3 6,4 67,6 3,7 22,4 3,9 50,0 4,7 50,6 1,2 20,2 6,3 5,0 4,7 19,2 2,0 4,9 2,6 8,0 3,9 9,3 2,0 6,8 3,5 4,2 7,0 8,1 1,7 2,6 2,0 3,7 3,6 4,7 2,4 2,4. 28. 4 2,2 3,5 2,8 3,1 2,9 0,5 90,0 99,1 100,0 95,9 96,3 4,5 94,5 96,5 91,0 96,4 94,6 2,6 37,8 50,4 19,9 29,7 34,5 12,9 14,0 16,8 4,5 12,7 12,0 5,3.
(44) Estudo do efeito protector do própolis de origem portuguesa na danificação oxidativa em eritrócitos humanos. Estes resultados são seguidamente apresentados na forma de gráfico. Cada valor representa a média ± SD de quatro ensaios independentes. *Representa resultados significativos (P <0,05) quando o grupo tratado foi comparado com o grupo AAPH, nos respectivos tempos. #Representa resultados significativos (P <0,05) quando o grupo tratado foi comparado com o grupo controlo, nos respectivos tempos.. 120 #. #. Hemólise (%). 100. Controlo AAPH + Propolis Fundão 10 g/ml. #. 80. #. *. 60. *#. + Propolis Fundão 20 g/ml + Propolis Fundão 40 g/ml. 40 20. *. *. *. 3. 4. 0 0. 1. 2. 5. Tempo (h) Gráfico 3 - Representação gráfica do efeito protector do extracto de própolis do Fundão na hemólise induzida pelo AAPH. Para o cálculo do IC50 determinou-se a percentagem de inibição de hemólise para cada concentração de extracto ao tempo 3 horas, tal como apresentado na tabela seguinte.. 29.
Imagem




Documentos relacionados
Nota: a presente abordagem ´ e prefer´ıvel ao bot˜ ao de simula¸c˜ ao para obter melhor controlo sobre a simula¸c˜ ao (e.g. passo de simula¸c˜ ao, tempo final, condi¸c˜
The surface immunglobulin that serves as the BCR has two functions in B‐cell activation. First, like the antigen receptor on T cells,
Para Reale 6 , a evolução histórica demonstra o domínio de um valor sobre o outro, ou seja, a existência de uma ordem gradativa entre os valores; mas existem os valores fundamentais
Esta informação veio espontaneamente da própria doadora: “Além desses materiais citados, fiz uma doação para o Peabody Museum de Harvard, dos materiais e artefatos da pesquisa
Para desenhar inbetweens, é comum que animadores sobreponham dois keyframes em seus computadores para observar suas diferenças, e então desenhar os inbetweens, utilizando sua
[r]
Os conhecimentos em nutrição de puérperas acompanhadas pelo pré-natal em Unidades de Saúde da Família são influenciados por múltiplos fatores, dentre os quais: os anos de
• Ponte the Lima success is partly due to the fact of being a rural county located in an Urban Region – the Portuguese Northwest Metropolitan Region. If it was located in