Dissertação
Síntese e caracterização de molibdatos de
metais de transição
Guilherme Mendes Martins
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DE OURO PRETO
UNIVERSIDADE
FEDERAL DE OURO PRETO
Instituto de Ciências Exatas e
Biológicas
Programa de Pós-Graduação em Química
PPGQUIM
Ouro Preto
MINISTÉRIO DA EDUCAÇÃO Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Programa de Pós-graduação em Química
SÍNTESE E CARACTERIZAÇÃO DE MOLIBDATOS DE METAIS DE TRANSIÇÃO
Autor: Guilherme Mendes Martins
Orientador: Prof. Dr. Anderson Dias
Dissertação apresentada ao Programa de Pós-Graduação em Química da Universidade Federal de Ouro Preto, como parte dos requisitos para obtenção do título de Mestre em Química.
Área de concentração:
Físico-química
Ouro Preto/MG
iii
Agradecimentos
A Deus por fazer tudo em minha vida ser especial.
Aos meus pais, Gardênia e Wagner, por estarem sempre me incentivando e por se sacrificarem tanto para que eu possa conquistar meus objetivos, me orgulho muito de ser filho de vocês. A minha irmã Ana Luísa, presente em todos os momentos em que precisei de uma força maior. Aos meus avós, as minhas bisavós e todos os familiares pelas orações e conselhos. Obrigado por acreditarem mais em mim do que eu mesmo.
Ao professor Anderson Dias, pela orientação, aprendizado, e paciência. Seu exemplo de profissionalismo é inspirador.
Aos meus amigos de Sete Lagoas, Ouro Preto e Ouro Branco por entender as minhas ausências e pelo privilégio de poder chamá-los de amigos. A todos dos laboratórios de físico-química, principalmente Mariana e Roberta, vocês foram fundamentais para a conclusão deste trabalho. Às Repúblicas Partenon, Porãozinho, Nômades e Diferença pelas hospedagens e acolhidas.
Aos professores Kisla Prislen Félix Siqueira e Roberto Luiz Moreira pelas relevantes contribuições ao trabalho.
Ao Laboratório de Difração de Raios X do Departamento de Geologia da UFOP pelas medidas de DRX. Ao Centro de Microscopia da UFMG pelas imagens.
iv RESUMO
Neste trabalho, foram investigados molibdatos de metais de transição (MnMoO4, CuMoO4, ZnMoO4, NiMoO4 e CoMoO4), hidroximolibdatos e
compostos tipo Natrocalcita. Os processos de síntese utilizados foram a
hidrotérmica convencional e a hidrotérmica assistida por micro-ondas. No reator micro-ondas, foi fixada a temperatura em 150ºC e os tempos variaram de 10 a 120 minutos. As condições dos experimentos realizados no reator Parr
foram temperaturas entre 110ºC e 250ºC e tempo fixo de 24 horas. De acordo com os resultados obtidos, realizaram-se procedimentos adicionais para alguns conjuntos de materiais, tais como tratamentos térmicos, aumento do tempo de preparo no reator Parr e sínteses com controle da velocidade da reação. Foram
obtidas fases puras e cristalinas, além de materiais contendo mistura de fases, comprovadas pelas técnicas de difração de raios X e espectroscopia Raman. Os compostos TMoO4 (T = Mn, Co, Ni), em sua forma anidra, exibiram
estruturas monoclínicas (C2/m e P2/c); já em sua forma hidratada, a estrutura observada foi a triclínica (P-1). Os hidroximolibdatos produzidos exibiram em um caso a estrutura ortorrômbica (Pnnm) e em sua maioria eram fases monoclínicas (P21/n). No caso das fases tipo Natrocalcita sintetizadas,
estruturas monoclínicas (C2/m) foram observadas. Realizaram-se, também, medidas de espectroscopia Raman polarizado para algumas amostras monoclínicas, podendo-se assim identificar e atribuir seus modos de vibração ativos em Raman com o auxílio da teoria de grupos. A diferença das bandas Raman observadas em função da coordenação (octaédrica ou tetraédrica) do átomo de molibdênio na estrutura TMoO4 foi evidenciada; dessa forma, foi
possível relatar a existência de uma fase de MnMoO4 ainda não reportada pela
literatura. Através das medidas de microscopia eletrônica (varredura e de transmissão), pode-se obter informações sobre a morfologia e estrutura dos compostos estudados. Foram observados materiais com características monocristalinas e partículas nanoestruturadas com diferentes morfologias.
v ABSTRACT
In this work, transition metal molybdates (MnMoO4, CuMoO4, ZnMoO4,
NiMoO4 and CoMoO4), hydroximolybdates and Natrocalcite-type compounds
were investigated. The synthesis procedures employed were conventional hydrothermal synthesis and microwave-assisted hydrothermal processing. In the microwave reactor, the temperature was set at 150°C with times ranging from 10 to 120 minutes. The experimental conditions performed in the Parr
reactor were temperatures between 110ºC and 250ºC and fixed times of 24 h. According to the obtained results, additional procedures were carried out for some samples, such as thermal treatments, increase of the preparation time in the Parr reactor, and synthesis with controlled reaction rate. Pure and
crystalline phases were obtained, besides materials containing phase mixture, as verified by X-ray diffraction and Raman spectroscopy. The compounds
TMoO4 (T = Mn, Co and Ni), in their anhydrous form, exhibited monoclinic
structures (C2/m and P2/c). In their hydrated form, the observed structure was triclinic (P-1). The hydroxymolybdates produced exhibited, in one case, the orthorhombic structure (Pnnm), while the other samples exhibited monoclinic (P21/n) structures. In the case of the synthesized Natrocalcite-type phases,
monoclinic structures (C2/m) were observed. Measurements of polarized Raman spectroscopy were also performed for some monoclinic samples, allowing us to identify and assign their active vibration modes besides group theory calculations. The difference of the Raman bands observed as a function of the coordination of the molybdenum atom (octahedral or tetrahedral) in the
TMoO4 structure was evidenced. Thus, it was possible to discuss the existence
of a MnMoO4 phase not yet reported in the literature. Through the
measurements of scanning and transmission electron microscopies, information about the morphology and structure of the studied compounds could be obtained. Monocrystalline and nanostructured materials with different morphologies were observed.
vi
LISTA DE FIGURAS
Figura 1: Diferenças estruturais dos molibdatos: o arranjo octaédrico (MoO6) da fase α e tetraédrico (MoO4) da fase β 3. ... 6
Figura 2: Representação dos sistemas cristalinos. FONTE: Adaptado de www.fem.unicamp.br/~caram/estrutura.pdf23. ... 7 Figura 3: Estrutura da Lindgrenita, Cu3(MoO4)2(OH)2, mostrando os
octaedros de CuO4(OH)2 interligados pelos tetraedros de MoO424. ... 8
Figura 4: a) Padrões de DRX e b) espectros Raman das amostras MnMoO4.H2O sintetizadas no reator micro-ondas (MW) a 150ºC nos tempos de
10, 20, 30 e 120 minutos, e no reator Parr a 110ºC e 150ºC, por 24 horas, e
110ºC, durante uma semana. ... 19 Figura 5: Microscopia eletrônica de varredura da amostra sintetizada no reator MW a 150ºC por a) 10min – Mn10 e b) 120min – Mn120, e no reator Parr
a 110ºC por c) 24horas – Mn110 e d) uma semana – Mn110/1s. ... 22 Figura 6: a) Difratogramas de Raios X e b) espectros Raman dos MnMoO4 sintetizados no reator Parr Mn200, Mn250 e Mn250/1s. ... 25
Figura 7: Espectro Raman polarizado da amostra Mn250/1s. A configuração em paralelo (//) está indicada em preto e a perpendicular () em vermelho... 27 Figura 8: Microscopia eletrônica de varredura da amostra sintetizada no reator Parr a 250ºC em a)24horas – Mn250 e b)Uma semana – Mn250/1s. ... 29
Figura 9: Imagens de MET da amostra sintetizada no reator Parr a
250ºC por uma semana. (a) e (c) imagens de MET de alta resolução evidenciando os espaçamentos interplanares. (b) Típica imagem de MET mostrando as partículas em escala micrométrica. (d) Padrão de DEAS ... 30 Figura 10: a) Difratogramas de Raios X e b) espectros Raman da amostra Mn250 e dos tratamentos térmicos de 300ºC a 600ºC. ... 31 Figura 11: Espectro Raman polarizado da amostra Mn600 (MnMoO4,
vii
Figura 12: (a) Difratogramas de Raios X e (b) espectros Raman dos MnMoO4 C2/m obtidos através dos percussores sintetizados no reator MW
(vermelho) e Parr (azul). ... 35
Figura 13: a) Padrões de DRX e b) espectros Raman das amostras sintetizadas no reator MW (em vermelho) a 150ºC nos tempos de 10, 20, 30 e 120 minutos, e no reator Parr (em azul) a 110ºC, 150ºC, 200ºC e 250ºC, por 24
horas. ... 39 Figura 14: Espectros Raman polarizados da amostra Cu250 (Cu3(MoO4)2(OH)2) divididos em 3 regiões (a) 50-450cm-1; (b) 450-1000cm-1 e
(c) 3100-3850 cm-1. ... 41
Figura 15: Microscopia eletrônica de varredura das amostras de Cu3(MoO4)2(OH)2 sintetizadas no reator MW a 150ºC por a) 20 min – Cu20 e b)
120 min – Cu120; e das amostras sintetizadas no reator Parr por 24 horas a c)
110ºC – Cu110 e d) 250ºC – Cu250. ... 43 Figura 16: a) Padrões de DRX das amostras sintetizadas por coprecipitação lenta a 75ºC (preto), processada no micro-ondas a 150ºC por 120 minutos (vermelho), e no reator Parr a 250ºC por 24h (azul) e (b) na parte
superior DRX do material produzido por Rahini-Nasrabadi et al9 e na parte
inferior a referência utilizada por eles. ... 46 Figura 17: MEV das amostras de molibdatos de cobre sintetizadas (a) através da adição controlada da solução de Cu2+ a 75ºC, (b) com o auxílio do MW a 150ºC por 120 minutos, e (c) com o auxílio do reator Parr a 250ºC. ... 48
Figura 18: Imagens de MET das amostras de molibdatos de cobre sintetizadas via coprecipitação lenta (a) sem auxílio de reator; (b) com o tratamento no micro-ondas por 120min a 150ºC; (c) com o tratamento no reator
Parr por 24 h a 250ºC. ... 50
Figura 19: a) Padrões de DRX e b) espectros Raman das amostras NaZn2(MoO4)2(OH)(H2O) sintetizadas no reator MW a 150ºC nos tempos de 10,
20, 30 e 120 minutos. ... 53 Figura 20: a) Padrões de DRX e b) espectros Raman das amostras de molibdato de zinco sintetizadas no reator Parr, por 24 horas, nas temperaturas
viii
Figura 21: Microscopia eletrônica de varredura das amostras sintetizadas no reator MW a 150ºC por a) 10 min – Zn10 e b) 120 min – Zn120; e c) da amostra sintetizada no reator Parr por 24 horas a 110ºC – Zn110. ... 57
Figura 22: Padrões de DRX das amostras de molibdatos de zinco sintetizadas por coprecipitação lenta a 75ºC (preto), processada no MW a 150ºC por 120 minutos (vermelho) e no reator Parr a 250ºC por 24h (azul). ... 59
Figura 23: MEV das amostras de molibdatos de zinco sintetizadas (a) através da adição controlada da solução de Zn2+ a 75ºC, e (b) com o auxílio do
MW a 150ºC por 120 minutos. ... 60 Figura 24: a) Padrões de DRX e b) espectros Raman das amostras NaCo2(MoO4)2(OH)(H2O) sintetizadas no reator MW a 150ºC nos tempos de
10, 20, 30 e 120 min. ... 63 Figura 25: Microscopia eletrônica de varredura das amostras sintetizadas no reator MW a 150ºC por a) 10min – Co10 e b) 120min – Co120. ... 64
Figura 26: a) Padrões de DRX e b) espectros Raman para β-CoMoO4
preparadas no reator Parr por 24 horas nas temperaturas de 110, 150, 200 e
250ºC ... 65 Figura 27: Microscopia eletrônica de varredura das amostras sintetizadas no reator Parr por 24 horas a a) 110ºC – Co110 e b) 250ºC –
Co250. ... 66 Figura 28: a) Padrões de DRX e b) espectros Raman das amostras NaNi2(MoO4)2(OH)(H2O) sintetizadas no reator MW a 150ºC nos tempos de 10,
20, 30 e 120 min. ... 69 Figura 29: Microscopia eletrônica de varredura das amostras sintetizadas no reator MW a 150ºC por a) 10min – Ni10 e b) 120min – Ni120. 70 Figura 30: Imagens de MET das amostras NaNi2(MoO4)2(OH)(H2O)
ix Figura 31: a) Padrões de DRX e b) espectros Raman das amostras β -NiMoO4 preparadas no reator Parr por 24 horas nas temperaturas de 110, 150,
200 e 250ºC. ... 73 Figura 32: Microscopia eletrônica de varredura das amostras sintetizadas no reator Parr por 24 horas a a) 110ºC – Ni110 e b) 250ºC – Ni250.
... 74 Figura 33: Imagens de MET das amostras sintetizadas em meio hidrotérmico convencional no reator Parr por 24 horas a (a) 110ºC e (b) 250ºC.
... 76 Figura 34: Padrões de DRX das amostras de molibdatos de níquel sintetizadas por coprecipitação lenta a 75ºC (preto), processada no MW a 150ºC por 120 minutos (vermelho), e no reator Parr a 250ºC por 24h (azul). .. 77
Figura 35: MEV das amostras de molibdatos de níquel sintetizadas (a) através da adição controlada da solução de Ni2+ a 75ºC; (b) com o auxílio do MW a 150ºC por 120 minutos; e (c)com o auxílio do Reator Parr. ... 78
Figura 36: Imagens de MET das amostras de NiMoO4.H2O sintetizadas
via coprecipitação lenta (a) sem auxílio de reator; (b) com o tratamento no MW
por 120min a 150ºC; e (c) β-NiMoO4 com o tratamento no reator Parr por 24 h a
250ºC. ... 80 Figura 37: DRX das amostras queimadas a 340ºC e 600ºC a partir de NaNiMoO4.nH2O sintetizados (a) através da adição controlada da solução de
Ni2+ a 75ºC, e (b) com o auxílio do MW a 150ºC por 120 minutos. ... 82 Figura 38: Espectros Raman das diferentes regiões da amostra de NiMoO4. O espectro da região onde se encontra a fase alfa está em azul, em
x
LISTA DE TABELAS
Tabela 1: Classificação quanto à estrutura das espécies de
MT2(MoO4)2(OH)(H2O)36. ... 9
Tabela 2: Relação do cátion de metal de transição e o respectivo reagente que foi utilizado como fonte desse cátion. ... 12 Tabela 3: Análise da teoria de grupos para o cristal de MnMoO4.H2O, triclínico
P-1 (#2, C1i) ... 18
Tabela 4: Parâmetros de rede das amostras de MnMoO4.H2O sintetizadas no
MW (Mn10, Mn20, Mn30, Mn120), no Reator Parr (Mn110, Mn150, Mn110/1s), e da referência ICDD #01-078-0220. ... 23 Tabela 5: Análise da teoria de grupos para o cristal MnMoO4 monoclínico P2/c
(#13, 4 2h
C ) ... 24
Tabela 6: Parâmetros de rede das amostras de w-MnMoO4 sintetizadas no reator Parr (Mn200, Mn250, Mn250/1s) e da referência ICDD #01-078-0221. ... 26 Tabela 7: Relação dos modos ativos Raman observados no estudo de polarização na amostra Mn250/1s. ... 28 Tabela 8: Análise da teoria de grupos para o cristal de MnMoO4 monoclínico
C2/m (#12, C23h) ... 32
Tabela 9: Relação dos modos ativos Raman observados no estudo da polarização da amostra MnMoO4 tratada a 600ºC por 2 horas. ... 34
Tabela 10: Análise da teoria de grupos para o cristal de Cu3(MoO4)2(OH)2
monoclínico P21/n (#14,
5 2h
C )... 40
Tabela 11: Relação dos modos ativos Raman polarizado observados na amostra Cu250 (Cu3(MoO4)2(OH)2). ... 42
Tabela 12: Parâmetros de rede das amostras de molibdatos de cobre sintetizadas no MW (Cu10, Cu20, Cu30, Cu120), no Reator Parr (Cu110, Cu150, Cu200 e Cu250), e das fichas de referência ... 44 Tabela 13: Parâmetros de rede das amostras de molibdatos de cobre sintetizadas através da adição controlada da solução de Cu2+ a 75ºC (CL), com o
auxílio do Micro-ondas a 150ºC por 120 minutos (MWCL), com o auxílio do reator Parr
(ParrCL), e da ficha de referência. ... 47
Tabela 14: Análise da teoria de grupos para o cristal NaZn2(MoO4)2(OH)(H2O)
monoclínico C2/m (#12, C23h) ... 53
Tabela 15. Parâmetros de rede das amostras NaZn2(MoO4)2(OH)(H2O)
xi
Tabela 16: Parâmetros de rede das amostras Zn2MoO4(OH)2 sintetizadas no
Reator Parr (Zn200, Zn250) e da referência ICDD #00-028-1474. ... 56 Tabela 17: Parâmetros de rede das amostras de molibdatos de zinco sintetizadas através da adição controlada da solução de Zn2+ a 75ºC (CL), com o
auxílio do MW a 150ºC por 120 minutos (MWCL), e com o auxílio do Reator Parr
xii SUMÁRIO
1. Introdução ... 1
2. Objetivos ... 3
3. Revisão Bibliográfica ... 4
3.1. Materiais Cerâmicos: o início dos estudos de Molibdatos ... 4
3.2. Molibdatos de Metais de Transição: TMoO4 ... 5
3.3. Hidroximolibdatos de Metais de Transição ... 7
3.4. Molibdatos do tipo Natrocalcita ... 8
3.5. Molibdatos e Tecnologia ... 11
4. Materiais e Métodos ... 12
5. Caracterização dos Materiais ... 14
5.1. DRX ... 14
5.2. Espectroscopia Vibracional Raman ... 14
5.3. MEV... 15
5.4. MET ... 16
6. RESULTADOS ... 17
6.1. Manganês ... 17
6.1.1. MnMoO4.H2O ... 17
6.1.2. MnMoO4– P2/c ... 24
6.1.3. MnMoO4 – C2/m ... 30
6.2. Cobre ... 38
6.2.1. Coprecipitação Instantânea ... 38
6.2.2. Coprecipitação Lenta ... 45
6.3. Zinco... 52
6.3.1. Coprecipitação Instantânea ... 52
6.3.2. Coprecipitação Lenta ... 58
6.4. Cobalto ... 62
6.5. Níquel ... 68
xiii
6.5.2. Reator Parr - β-NiMoO4 ... 73
6.5.3. Coprecipitação lenta ... 76
6.6. Transição de fases: α e β – Paralelo com MnMoO4 ... 82
7. Conclusão ... 85
8. Sugestões para Trabalhos Futuros ... 86
1 1. Introdução
Os materiais cerâmicos vêm se tornando protagonistas cada vez mais recorrentes nas pesquisas em diversos setores industriais; dentre esses materiais, podem-se citar os óxidos ternários de fórmula empírica ABO4. Desde meados do
século XX, as rotas de síntese desses materiais, bem como suas estruturas, propriedades e aplicações vêm sendo estudadas. Esse vasto grupo de materiais inclui as eletrocerâmicas (ou cerâmicas eletrônicas) do tipo ABO4 que, inicialmente,
eram utilizados somente como isoladores elétricos. Ao contrário das décadas anteriores, esses materiais vêm sendo aplicados para outras finalidades como: capacitores e aparelhos de ultrassom, materiais ópticos e em combustíveis para a indústria nuclear1,2
. A aplicação dos materiais cerâmicos depende das suas
propriedades que, por sua vez, estão relacionadas com as rotas sintéticas utilizadas. As propriedades elétricas, mecânicas e ópticas de um material podem ser otimizadas, por exemplo, através de tratamento térmico, dopagem e substituição química de elementos na composição dos materiais2.
Os molibdatos de metais de transição fazem parte da classe de cerâmicas eletrônicas avançadas. Além das propriedades elétricas, esses compostos tem se destacado por possuir propriedades termo- e piezocrômicas, o que faz com que a síntese desses materiais e o seu comportamento em temperaturas e pressões diferentes se tornem foco de várias pesquisas3. Atualmente, a produção dos materiais em nanoescala vem sendo o foco principal das pesquisas, pois as diferentes morfologias (nanopartículas, nanotubos, nanobastões) podem determinar a aplicação do material4. Dessa forma, entender as características do pó produzido em menor escala torna-se primordial para o entendimento de onde cada material poderá ser utilizado, a fim de se obter produtos com propriedades finais de elevada qualidade.
A síntese de materiais deve ser discutida levando-se em conta aspectos não só científicos e tecnológicos, mas também econômicos e ambientais. Na literatura, percebe-se que há muitos trabalhos que utilizam a síntese em estado sólido para produzir molibdatos de metais de transição do tipo TMoO4, (T= cátion bivalente de
2
ser considerada um dos métodos de síntese de menor impacto ao meio ambiente, o presente trabalho propõe a utilização dessa tecnologia de duas maneiras diferentes: síntese hidrotérmica convencional e a síntese hidrotérmica assistida por micro-ondas, sendo essa última ainda menos impactante ao meio ambiente do que a síntese convencional4,5. O uso das rotas hidrotérmicas nos permitirá conhecer as particularidades da síntese dos molibdatos de metais de transição do tipo TMoO4 e
3 2. Objetivos
4 3. Revisão Bibliográfica
3.1. Materiais Cerâmicos: o início dos estudos de Molibdatos
Os materiais cerâmicos são compostos formados entre elementos metálicos e não metálicos e podem ser definidos levando em consideração o tipo de material que os constituem ou o processamento que caracteriza a sua formação. Os materiais cerâmicos podem ser óxidos, nitretos, carbetos, argilo-minerais, vidros, dentre outros grandes subgrupos7,8. Desde as primeiras civilizações, as cerâmicas vêm sendo utilizadas como ferramenta em diversas finalidades, mas se trabalhava com materiais de relativa fragilidade (ausência de ductilidade). As principais cerâmicas tinham como matéria prima a argila, sendo denominadas “cerâmicas
tradicionais”8. Com o avanço tecnológico, pesquisas para aumentar a ductilidade
desses materiais foram surgindo e consequentemente materiais mais avançados começaram a se evidenciar. Em paralelo, surgiram as chamadas “cerâmicas avançadas” que são aquelas desenvolvidas para aplicação nas indústrias de tecnologia de ponta8.
No amplo grupo dos materiais cerâmicos avançados, existem aqueles constituídos pelos ânions molibdatos (MoO42-). Esses oxiânions de molibdênio
constituem um grupo de materiais inorgânicos em que o átomo de molibdênio se encontra no estado de oxidação +6, formando quatro ligações iônicas com quatro átomos de oxigênio, sendo assim, a carga resultante do ânion é -29-12. No início da década de 1960, os estudos dos molibdatos eram acompanhados em paralelo com as pesquisas dos respectivos tungstatos, tanto de terras raras quanto de metais de transição. Nassau et al.14 provaram em seu trabalho a existência de diferentes
estruturas presentes em uma série de molibdatos e tungstatos de terras raras14. Além disso, assim como Peterson e Bridenbaugh15, Nassau et al.14 estudaram as
cerâmicas Eu2(WO4)3 e o Ce2(WO4)3, e concluíram que esses materiais possuíam
estrutura monoclínica, sendo um dos trabalhos de maior relevância na época. A partir de trabalhos de caracterização e determinação da estrutura dos tungstatos de terras raras, como os de Peterson e Bridenbaugh15, Nassau et al.14 começaram a
estudar a estrutura e características de outros tungstatos e molibdatos, dentre eles os de metais de transição.
5
as estruturas dos molibdatos de metais de transição fossem conhecidas um pouco depois das dos respectivos tungstatos13. Esse fato justifica o surgimento de vários estudos a respeito desses materiais em paralelo aos tungstatos, principalmente na segunda metade da década de 1960. No mesmo período, Smith e Ibers13 estudaram a estrutura cristalina do CoMoO4 e sua principal conclusão foi que essa espécie é
isoestrutural ao NiMoO413. Nessa época, por ser uma novidade, outros trabalhos
envolvendo molibdatos de metais de transição foram surgindo como os trabalhos do grupo de Abrahams16-18, que no final da década de 1960 estudaram, com a contribuição de outros pesquisadores, molibdatos de manganês16, cobre17 e zinco18.
A partir de então, já se sabia que molibdatos de diferentes metais de transição poderiam ocorrer em diferentes estruturas e que um material de mesma fórmula química poderia existir em mais de uma fase, ou seja, já se sabia da existência de polimorfos desses materiais. Dessa forma, o interesse em relacionar um material com outro ficou mais evidente, como nos estudos de Sleight e Chamberland19
. Esses
estudos estão no conjunto dos primeiros trabalhos a comparar distintos métodos de síntese de diferentes molibdatos e relacioná-los com fases já conhecidas19.
3.2. Molibdatos de Metais de Transição: TMoO4
Em termos estruturais, a diferença do número de coordenação do átomo de molibdênio faz com que existam duas estruturas diferentes: os molibdatos do tipo
scheelita e wolframita. Os molibdatos do tipo scheelita são aqueles em que o átomo
de molibdênio possui o número de coordenação igual a 4, formando com os oxigênios uma estrutura tetraédrica MoO4. Essa estrutura ocorre com mais
frequência em molibdatos de cátions bivalentes cujo raio iônico é maior que 0,99 Å (Ex.: Ca, Ba, Pb e Sr). Já na estrutura wolframita, o número de coordenação do
átomo de molibdênio é 6; dessa forma, adota a coordenação octaédrica, MoO6. Essa
estrutura é mais comum em molibdatos de cátions bivalentes cujo raio iônico é inferior a 0,77 Å (Ex.: Mn, Ni, Fe e Mg) 3,9-11,20.
Com o intuito de facilitar o estudo dos polimorfos, convencionou-se o uso de letras gregas antes da fórmula química para diferenciar os polimorfos que ocorrem com aumento de temperatura, assim α-CoMoO4 e β-CoMoO4 são exemplos de
polimorfos. Segundo Sleight et al.19, a designação do polimorfo α é para a espécie
6
monoclínico (C2/m), que alguns autores denominam como fase α, pois não se verificou ainda um polimorfo para esse material, mesmo sendo isomorfo ao β -NiMoO4, β-CoMoO4 e β-FeMoO43,19. Com o intuito de organizar o entendimento das
fases, será seguida a mesma regra que Robertson3 apresenta: os molibdatos monoclínicos, C2/m, cuja coordenação do átomo de molibdênio é octaédrica são os polimorfosα, já os materiais cuja coordenação do átomo de molibdênio é tetraédrica, são denominados como fase β. Para polimorfos que ocorrem com aumento na pressão, utiliza-se a numeração romana após a fórmula química, como exemplo CuMoO4-II e CuMoO4-III19,22. A Figura 1 apresenta as estruturas dos molibdatos
monoclínicos tipo αeβ.
Figura 1: Diferenças estruturais dos molibdatos: o arranjo octaédrico (MoO6 ) da fase α e
tetraédrico (MoO4) da fase β 3.
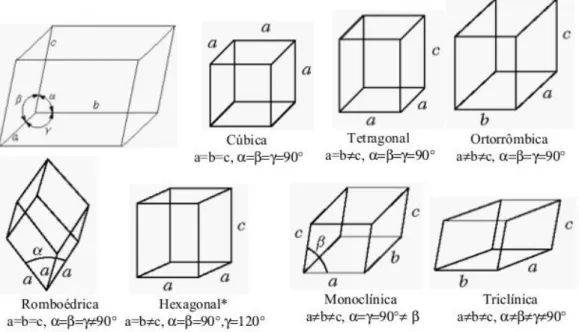
Os molibdatos podem ser encontrados estruturados em diferentes sistemas cristalinos, podendo ser materiais cúbicos, tetragonais, ortorrômbicos, romboédricos, hexagonais, monoclínicos ou triclínicos. Esses dois últimos são os sistemas mais comuns dentre os materiais estudados neste trabalho, sendo que o sistema monoclínico é aquele em que os lados (a, b e c) da célula unitária são todos
7
além de todos os lados, tem os três ângulos diferentes de 90º (α, β e γ) 8. A Figura 2
ilustra os sistemas cristalinos.
Figura 2: Representação dos sistemas cristalinos. FONTE: Adaptado de www.fem.unicamp.br/~caram/estrutura.pdf23.
3.3. Hidroximolibdatos de Metais de Transição
Algumas fases de molibdatos de metais de transição despertam o interesse dos pesquisadores na aplicação em reações de catálise, processos de absorção, produção de sensores, como materiais magnéticos e condutores elétricos. A fórmula básica desses compostos é Tx(MoO4)y(OH)z, em que T consiste em um metal de
transição24-26.
Dentro desse grupo, pode-se destacar a Lindgrenita (Cu3(MoO4)2(OH)2), que
tem esse nome em homenagem ao professor Waldemar Lindgren (1860-1939) geólogo do MIT (Massachussets Instititute of Tecnology) norte americano com
origens suecas27. Na natureza, ela já foi encontrada no Chile24,27, Estados
8
Figura 3: Estrutura da Lindgrenita, Cu3(MoO4)2(OH)2,mostrando os octaedros de CuO4(OH)2
interligados pelos tetraedros de MoO424.
Ao analisar a Figura 3, percebe-se que a Lindgrenita possui cadeias de octaedros de
cobre, porém com uma sequencia alternada de um e dois átomos de cobre ao longo do plano bc30-32. Os octaedros, CuO4(OH)2,formam tiras paralelas ao eixo c, sendo
interligados por tetraedros de MoO4. Cada tetraedro é ligado a três linhas dos
octaedros e a quarta ligação ocorrendo ao longo do eixo das linhas de octaedros24. Além da ocorrência natural, há estudos de síntese hidrotérmica da Lindgrenita24,29
cuja rota de síntese se baseia no método hidrotérmico, sendo que a fonte de cobre pode ser de um composto inorgânico, como Cu(NO3)2 e CuCl2 ou um composto
organometálico, como o Cu(CH3COO)2, sendo este último reagente a escolha de Xu
et al27 para a realização da síntese dos seus materiais.
Além da Lindgrenita, pode-se citar a Szenicsita, Cu3MoO4(OH)4, outro tipo de
molibdato de cobre que, em termos de estrutura, alguns estudos comparam com a
Anterlita, um sulfato de cobre cuja estrutura é Cu3(SO4)(OH)4. A Szenicsita não é
isoestrutural à Anterlita; porém, ambos contêm em sua estrutura semelhantes
cadeias triplas de octaedros de cobre30.
3.4. Molibdatos do tipo Natrocalcita
Outra fase que merece destaque é a que contém não apenas a presença de hidroxila em sua fórmula, como também a de um cátion monovalente:
9
metal de transição. Materiais que possuem essa estrutura passaram a ser chamados de Natrocalcitas, esse nome se origina do mineral Natrocalcita, cuja fórmula química
é NaCu2(SO4)2(OH)(H2O), descoberto no início do século XX, no Chile. O nome vem
de uma combinação de duas palavras: natrium, que significa sódio em latim (Na) e chalcos que, em grego, significa cobre (Cu)32.
Dentre os materiais tipo Natrocalcitas, Pezerat33 determinou que existem duas
diferentes classificações em termos de estrutura, Φx e Φy. A primeira espécie
classificada como Φx foi o KCo2(MoO4)2(OH)(H2O), monoclínica, C2/m e a primeira
Φy foi a espécie NH4Zn2(MoO4)2(OH)(H2O) que, por sua vez, é hexagonal, R-3m34,35.
A partir de então, os isomorfos desses compostos foram sendo estudados e classificados. Mitchell et al36 classificaram quanto à estrutura algumas espécies de
MT2(MoO4)2(OH)(H2O), conforme apresentado na Tabela 1.
Tabela 1: Classificação quanto à estrutura das espécies de MT2(MoO4)2(OH)(H2O)36.
T M
NH4+ Na+ K+
Mn2+ Φ
x Φx Φx
Co2+ Φ
x / Φy Φx Φx
Ni2+ Φy Φx Φx
Cu2+ Φy - -
Zn2+ Φy Φx Φx
A partir da Tabela 1, pode-se concluir que somente as Natrocalcitas de
molibdênio do tipo NH4+ se encontram na estrutura Φy, sendo que a do tipo NH4+
-Co2+ pode ser sintetizada tanto na fase Φy (hexagonal, R-3m)36 quanto na fase Φx
(monoclínica, C2/m)34. Os estudos das Natrocalcitas contendo molibdênio e sódio
em sua estrutura começaram por volta do final da década de 1960. Em 1976, Clearfield et al37 estudaram o composto NaZn2(MoO4)2(OH)(H2O). Eles sintetizaram
esse material em um processo em refluxo, reagindo ZnCl2 ou ZnSO4 com Na2MoO4
e concluíram que a ordem de adição dos reagentes não alterava o produto final. Houve o interesse de Clearfield et al.37 em estudar os molibdatos de zinco, pois já
naquela época a síntese desses materiais já apresentava contradições em sua síntese. Em estudos anteriores aos de Clearfield et al.37, já haviam sido sintetizadas
10
tão simples como parecia; além disso, perceberam que ao se utilizar Co e Ni como metais de transição, o produto final seria semelhante ao NaZn2(MoO4)2(OH)(H2O)
que eles sintetizaram anteriormente37.
Na década de 1980, os estudos de síntese dos molibdatos TMoO4 e dos tipos
Natrocalcita se encontravam interligados sendo que estudos variando os parâmetros
da síntese de ambas as fases começaram a surgir em evidência. Clearfield et al.38
sintetizaram em diferentes pH molibdatos de manganês, no intervalo de pH 4 e 7,1 e obtiveram MnMoO4.H2O em três fases diferentes, sendo o pH determinante na
definição dessas fases. Essas três fases, quando levadas a um tratamento térmico a 550ºC, resultam em uma mesma fase monoclínica MnMoO4. Ainda sobre esse
trabalho, foi sintetizado um material de estrutura diferente, Na2Mn2(MoO4)3.3H2O,
utilizando excesso de Na2MoO4; dessa forma, eles verificaram a existência de outras
estruturas pertencentes ao conjunto dos molibdatos. A partir do MnMoO4.H2O
sintetizado em pH=7,1, através da rota hidrotérmica convencional (Reator Parr,
71mL a 200ºC) e da adição de mais Na2MoO4, conseguiram obter o
NaMn2(MoO4)2(OH)(H2O). Essa nova fase também foi obtida com impurezas de
MnMoO4 quando o MnMoO4.H2O foi substituído pelo outro percussor
(Na2Mn2(MoO4)3.3H2O). Eles concluíram que a fase monohidratada poderia ser
obtida através de uma longa síntese por refluxo e a fase Natrocalcita com excesso
do reagente Na2MoO438.
Moini et al.39 em 1986 confirmaram que para a síntese de uma fase Natrocalcita seria necessário excesso de Na2MoO4. Ao sintetizarem com excesso
desse reagente a fase NaNi2(MoO4)2(OH)(H2O) era obtida. Confirmaram também
que o material sintetizado por eles é de mesma estrutura de seus equivalentes de zinco, cobalto e manganês39. Jang et a.l40, no início dos anos 2000, sintetizaram
através da cristalização em meio aquoso KMn2(MoO4)2(OH)(H2O) utilizando a
proporção 1:1 dos reagentes (MnSO4.H2O e K2MoO4). Quando substituiu o reagente
de potássio pelo equivalente de sódio, o resultado encontrado foi diferente: eles chegaram ao produto final MnMoO4.H2O, semelhante ao obtido por Clearfield et al40
em pH 7,1. Esse resultado confirma o que já se esperava para os materiais com sódio em sua estrutura: para se obter NaMn2(MoO4)2(OH)(H2O), precisa-se de
excesso de Na2MoO4. Para os materiais com potássio, KMn2(MoO4)2(OH)(H2O), o
raciocínio não é o mesmo, visto que Jang et al.40 conseguiram obter esse materiais
sem excesso de reagentes e em temperatura ambiente. Jang et al.40 concluíram
11
que todas as sínteses com os diferentes reagentes (K2MoO4, Na2MoO4 e
(NH4)2MoO4) foram feitas em pH semelhantes.
3.5. Molibdatos e Tecnologia
Atualmente, as propriedades dos molibdatos de metais de transição mais estudadas são a termocromicidade e a piezocromicidade, que são as propriedades do material em alterar a sua cor com variação de temperatura e pressão, respectivamente3,41.A variação de cor está relacionada com a alteração da estrutura
dos materiais, visto que, como já citado anteriormente, um composto de mesma fórmula química pode apresentar arranjos estruturais diferentes41-44. Os materiais
termocrômicos desse grupo mais estudados são os CoMoO4, que apresentam uma
notável alteração de cor entre as fases α-CoMoO4 (verde)e β-CoMoO4(roxo)41.Além
do cobalto, existem estudos com FeMoO4 e MgMoO4 em que esses materiais
possuem não só características termocrômicas, como também possuem propriedades piezocrômicas43.
Nos dias de hoje, os materiais do tipo Natrocalcitas são produzidos devido às
suas características magnéticas interessantes para aplicação em diversas áreas como a geologia, a química de materiais e a física35,42-48. Isso justifica o fato de que os estudos de síntese desses materiais vêm ganhando tanta relevância, sendo que a preferência entre os pesquisadores tem sido a síntese hidrotérmica como método de obtenção desses materiais45.
A síntese dos molibdatos pode ser feita através de diversos processos, como utilização de uma solução de precursor polimérico formando um complexo com o metal10, processo hidrotérmico9,11,49,50, solvotérmico51 e reação de estado sólido20,22. A síntese hidrotérmica assistida por micro-ondas tem se mostrado um método eficiente para a produção de cerâmicos, principalmente devido ao seu reduzido tempo de síntese e menor consumo de energia quando comparado, por exemplo, ao processo de síntese por reação em estado sólido49,50.
12 4. Materiais e Métodos
A Tabela 2 apresenta os reagentes utilizados como fonte dos cátions de metais de transição nas sínteses dos molibdatos. Com exceção do reagente CoSO4.7H2O (Synth), os demais reagentes da Tabela 2 foram fornecidos pela
Sigma-Aldrich. A fonte do ânion MoO42- escolhida foi o Na2MoO4; em algumas
reações, o ânion foi obtido através da reação do H2MoO4 com NaOH, e em outras foi
utilizado um reagente Na2MoO4 também da Sigma-Aldrich.
Tabela 2: Relação do cátion de metal de transição e o respectivo reagente que foi utilizado como fonte desse cátion.
Cátion Reagente
Mn2+ MnCl2.4H2O
Co2+ CoSO4.7H2O
Ni2+ Ni(NO3)2.6H2O
Cu2+ CuCl2.2H2O
Zn2+ ZnSO4.7H2O
Os molibdatos foram produzidos por rota hidrotérmica convencional e pela síntese hidrotérmica assistida por micro-ondas. Na síntese hidrotérmica convencional utilizou-se o Reator Parr modelo 4913, de capacidade de 1,0 L. Esse
tipo de reator pode ser de aço inox, como o utilizado no presente trabalho, titânio, níquel, zircônio, ligas carbono-aço e outras ligas metálicas. Normalmente, é constituído de uma câmara, com uma ou duas portas, além de possuir válvula de segurança, manômetros de pressão e um indicador de temperatura52. O método é
eficiente e econômico, porém não é tão rápido como a síntese hidrotérmica assistida por micro-ondas.
13
econômica53. Neste trabalho, o reator micro-ondas utilizado foi fabricado pela
Milestone, modelo Batchsynth.
Inicialmente, para cada cátion apresentado na Tabela 2, foram feitas 4 sínteses no reator Parr, sendo que se manteve o tempo de 24 horas nas
14 5. Caracterização dos Materiais
5.1. DRX
Na maioria dos sólidos, os átomos se ordenam em planos cristalinos espaçados entre si por distâncias da mesma ordem de grandeza dos comprimentos de onda dos raios X. Assim, no momento em que se incide um feixe de raios X em um cristal, há a interação com os átomos presentes, um dos efeitos originados por essa incidência é a difração. A difração de raios X ocorre segundo a Lei de Bragg, onde se é estabelecido a relação entre o ângulo de difração e a distância entre os planos, característicos para cada fase cristalina que a originaram54. A Lei de Bragg é representada pela Equação 1:
nλ = 2d sen θ , (1)
onde:
n: número inteiro;
λ: comprimento de onda dos raios X incidentes; d: distância interplanar;
θ: ângulo de difração.
Por ser uma técnica rápida e simples e ter uma grande confiabilidade dos resultados obtidos, a difração de raios X é uma técnica que possibilita a análise de materiais compostos por uma mistura de fases e analisar qualitativamente a fases presentes54. O difratrômetro utilizado foi, um equipamento de alta resolução
PANalytical modelo Empyrean com um goniômetro teta-teta, tubo de cobre
(λ=0,15406 nm), tensão de 4,5kV, corrente de 40 mÅ pertencente ao Laboratório de Difração de Raios X do Departamento de Engenharia Geológica da UFOP. A faixa de varredura (2θ) foi de 5 a 80º com intervalo de 0,0170º e o tempo de medida de 19,70 s por intervalo.
5.2. Espectroscopia Vibracional Raman
15
espalhados têm a mesma energia e mesmo comprimento de onda que os fótons incidentes (espalhamento Rayleigh), chamada assim de espalhamento elástico. No outro caso, chamado espalhamento inelástico, a luz é espalhada a frequências ópticas diferentes dos fótons incidentes55,56. Esse espalhamento é conhecido como efeito Raman, descrito em 1928 por C. V. Raman.
Nesse trabalho, o espectrômetro utilizado foi um Horiba/Jobin-Yvon LABRAM-HR com linha de excitação 632,8 nm (vermelho), pertencente ao Laboratório de Espectroscopia Raman do Departamento de Química da UFOP. O equipamento possui um microscópio acoplado (micro-Raman) com objetivas de 10, 50 e 100X, CCD resfriada por efeito Peltier e filtros Edge para remoção do espalhamento Rayleigh. Polarizadores e placas meia-onda foram utilizadas nos experimentos de polarização das cerâmicas e cristais obtidos.
5.3. MEV
O microscópio eletrônico de varredura é utilizado para se obter informações sobre as características e/ou microestrutura de uma amostra. Esse equipamento é constituído principalmente de uma fonte de elétrons, sistemas de lentes eletromagnéticas, unidade de varredura, detectores dos sinais e sistema de formação e aquisição de imagens57,58. Através dessa técnica, obtém-se a imagem tridimensional da amostra a partir do mapeamento das interações que ocorrem entre elétrons e a superfície da mesma; tal mapeamento acontece quando um feixe colimado de elétrons é incidido na amostra. A composição e a topografia local da amostra são responsáveis pela quantidade de elétrons espalhados e elétrons secundários que são capturados pelo detector para construir uma imagem58.
O feixe de elétrons quando incidido na amostra provoca a emissão de raios X, sendo que a detecção dos mesmos pode ser realizada tanto pela medida de sua energia (EDS) como do seu comprimento de onda (WDS). Na espectroscopia de dispersão de energia de raios X (EDS-Energy-dispersive spectroscopy), a
distribuição dos raios X no espectro ocorre por ordem crescente do número atômico, quanto menor o número atômico menor a energia58.
16
recobrimento com liga de ouro-paládio. As medidas ocorreram em diferentes condições de aceleração e em alto vácuo.
5.4. MET
O Microscópio Eletrônico de Transmissão é constituído por um feixe de elétrons controlados por um conjunto de lentes eletromagnéticas que se encerra em uma coluna evacuada com uma pressão em torno de 10-5 mm de Hg. Ao longo do caminho do feixe existem aberturas e bobinas eletromagnéticas de deflexão. Entre seus componentes destaca-se a lente objetiva, abertura objetiva e abertura seletiva de difração59.
No caso da microscopia eletrônica de transmissão, os elétrons atravessam a amostra e atingem uma tela fosforescente, gerando assim a imagem. Essa técnica se torna útil na caracterização de materiais, pois permite obter informações da morfologia e da estrutura cristalina dos mesmos. A análise de amostras por MET em alta resolução demanda um tempo significante, o que limita a quantidade de amostras que podem ser observadas no microscópio eletrônico de transmissão59.
17 6. RESULTADOS
6.1. Manganês
A síntese dos molibdatos de manganês se deu através da reação entre MnCl2.4H2O e Na2MoO4, na proporção 1:1. A solução de Na2MoO4 foi previamente
preparada via reação entre H2MoO4 e NaOH Então, fez-se a adição da solução do
cloreto de manganês à solução de molibdato de sódio; a solução resultante com o precipitado formado foi enviada a dois reatores, o reator Micro-ondas e o reator Parr.
O primeiro método de síntese realizado foi a síntese hidrotérmica assistida por micro-ondas a 150ºC nos tempos de 10, 20, 30 e 120 minutos, sendo as amostras geradas denominadas, respectivamente, Mn10, Mn20, Mn30 e Mn120. Além da síntese realizada com o auxílio do reator Micro-ondas, houve também a síntese dos materiais no reator Parr, cujas condições iniciais foram de temperaturas
de 110ºC, 150ºC, 200ºC e 250ºC, todas com duração de 24 horas. Com a intenção de investigar se o tempo de síntese iria interferir na morfologia dos molibdatos de manganês, houve duas sínteses complementares nas temperaturas de 110ºC e 250ºC com duração de uma semana (7 dias). Para facilitar a discussão dos resultados, as amostras sintetizadas por 24 horas foram denominadas Mn110, Mn150, Mn200 e Mn250; já as amostras sintetizadas por uma semana foram denominadas Mn110/1s e Mn250/1s.
6.1.1. MnMoO4.H2O
Foram realizados medidas de difração de raios X das quatro amostras sintetizadas no reator micro-ondas e das amostras Mn110, Mn150 e Mn110/1s preparadas no reator Parr. Os padrões de DRX dessas amostras foram indexados
pela estrutura MnMoO4.H2O, de acordo com a ficha do ICDD (International
Committee of Diffraction Data) #01-078-0220. Além de DRX, também foram
realizadas medidas de espectroscopia Raman para as amostras de MnMoO4.H2O.
Esses materiais possuem valores diferentes das arestas a, b e c, além de possuir ângulos α, β e γ diferentes entre si; portanto, são compostos triclínicos (P-1, #2)38 isoestruturais aos compostos CoMoO4.nH2O60 e NiMoO4.nH2O61. Em sua estrutura,
há 14 átomos diferentes na posição 2i (Wyckoff)60, e para cada átomo nessa posição
18
método de Rousseau et al.62, o resultado da teoria de grupos fica da forma
apresentada na Tabela 3.
Os modos Au (ungerade) são modos ativos no infravermelho, e os modos Ag
(gerade) são modos ativos em Raman; assim, espera-se observar 42 modos ativos
Raman (42Ag). Os dois últimos átomos de oxigênio são relativos aos oxigênios da
molécula da água60. A Figura 4a exibe os difratogramas de raios X e a Figura 4b os espectros Raman das amostras do reator micro-ondas (Mn10, Mn20, Mn30 e Mn120) e do reator Parr (Mn110, Mn150 e Mn110/1s).
Tabela 3: Análise da teoria de grupos para o cristal de MnMoO4.H2O, triclínico P-1 (#2, C1i)
Átomo Posição Wyckoff Simetria Representação
Mn (1) 2i
1
C 3Ag + 3Au
Mn (2) 2i
1
C 3Ag + 3Au
Mo (1) 2i
1
C 3Ag + 3Au
Mo (2) 2i
1
C 3Ag + 3Au
O (1) 2i
1
C 3Ag + 3Au
O (2) 2i
1
C 3Ag + 3Au
O (3) 2i
1
C 3Ag + 3Au
O (4) 2i
1
C 3Ag + 3Au
O (5) 2i
1
C 3Ag + 3Au
O (6) 2i
1
C 3Ag + 3Au
O (7) 2i
1
C 3Ag + 3Au
O (8) 2i
1
C 3Ag + 3Au
O (9) 2i
1
C 3Ag + 3Au
O (10) 2i
1
C 3Ag + 3Au
ΓTOTAL = 42Ag + 42Au ΓACOUSTIC = 3Au
19
10 20 30 40 50 60
2 Theta (º)
Mn110/1s
Mn20
MnMoO4.H2O
#01-078-0220 Mn10 Mn120 Mn30 Mn150 Mn110 (a) Parr * Inten s idade ( U.A .) * * * * * (0 0 1 ) (0 1 0 ) (1 0 0
) (-1
1 0 ) (-1 0 1
) (1-1
1
) (10
1 ) (-1 1 1 ) (0 0 2 ) (1 1 0 ) (-1 -1 1 ) (0 -1 2 ) (-1 2 0
) (-2
1 0 ) (0 -2 1 ) (-1 -1 2 ) (2 0 0 ) (0 0 2
) (1
1 0 ) (-2 0 2 ) (1 -2 2 ) (0 0 3 ) (0 -2 3 ) (2 0 2 ) (0 -3 1 ) (1 -3 2 ) (-1 -2 3 ) (2 -3 1 ) (-3 2 1 ) MW
200 400 600 800 1000
Número de Onda ( cm-1) (b) Mn20 Mn10 Mn120 Mn30 Mn110/1s Mn150 Mn110 Int ens idade R am an (U .A. )
Figura 4: a) Padrões de DRX e b) espectros Raman das amostras MnMoO4.H2O
sintetizadas no reator micro-ondas (MW) a 150ºC nos tempos de 10, 20, 30 e 120 minutos, e no reator Parr a 110ºC e 150ºC, por 24 horas, e 110ºC, durante uma semana.
De acordo com o padrão de referência, o pico de DRX de maior intensidade é o referente ao plano (-110), cujo ângulo 2θ é de 18,845º, seguido pelo pico em 2θ
igual a 26,218º, que se refere aos planos (002) e (110). Quando se compara os resultados apresentados na Figura 4a com a referência, percebe-se que a ordem de intensidade dos picos é mantida, porém em alguns casos eles estão com tamanhos mais parecidos do que é apresentado na ficha de referência. Pode-se observar que nas amostras Mn10 e Mn120 há picos marcados com (*) na Figura 4a, que se trata de picos não indexados. Quando se observa o pico referente ao plano (010) da amostra Mn120, percebe-se que a sua intensidade em relação aos demais é semelhante à da ficha de referência. A análise das intensidades dos picos permite suspeitar que a síntese hidrotérmica assistida por micro-ondas direciona o crescimento dos materiais conforme as direções <-110> e <110>.
Mi et al63 também sintetizaram MnMoO4.H2O, cujo DRX se assemelha aos
20
apresentarem picos em 2θ menor que 20º, eles concluem que seus materiais cresceram preferencialmente ao longo da direção <110>. O método da síntese do MnMoO4.H2O utilizado por Mi et al63 foi através de micro emulsão, sendo que a sua
duração foi de dois dias. Logo, pelo fato da síntese hidrotérmica assistida por micro-ondas utilizada nesse trabalho possuir uma duração máxima de 120 minutos, verifica-se que esse método poderia ser considerado mais vantajoso em relação ao tempo de processamento. Através dos DRX das amostras Mn110 e Mn150, percebe-se que as relações das intensidades dos picos também respeitam a ficha de referência.
Os espectros Raman desses compostos também são muito semelhantes entre si, por se tratarem da mesma estrutura, como pode ser observado na Figura 4b. Porém, há algumas diferenças na intensidade das bandas, sendo que os espectros referentes às amostras sintetizadas com o auxílio do micro-ondas são menos intensas. As bandas nos retornam a resposta dos movimentos de vibração dos átomos, e a diferença nas intensidades de um espectro para outro é sinal de que as amostras possuem diferenças sutis nas suas vibrações. Além disso, percebe-se que na região entre 800 e 900cm-1 nas amostras produzidas no Micro-ondas
(vermelho) há uma banda que se encontra em aproximadamente 865 cm-1, e nos espectros do conjunto das amostras feitas no reator Parr (azul) a banda equivalente
se encontra em uma frequência um pouco maior, o que confirma uma pequena diferença na organização atômica desses materiais.
21
Em termos morfológicos, observou-se nas amostras produzidas via reator micro-ondas que houve a tendência em crescer em forma de agulhas ou bastões. Essa forma de crescimento é a mesma observada por Mi et al63; além disso, há o
surgimento de agulhas maiores na amostra com maior tempo de processamento. Na microscopia eletrônica de varredura da amostra Mn10 (Figura 5a) há agulhas cujas dimensões são de 5µm; já a imagem da microscopia eletrônica de varredura da Mn120 (Figura 5b) mostra que há a existência de agulhas com aproximadamente o dobro do comprimento em relação à Mn10. Esse aumento pode ser explicado pela forma de aquecimento do reator ondas, a qual se dá pela radiação de micro-ondas, gerando campos eletromagnéticos que induzem o crescimento das amostras formando agulhas melhor definidas com o passar do tempo.
As morfologias das amostras Mn110 e Mn110/1s podem ser observadas nas Figuras 5c e 5d. As amostras de MnMoO4.H2O sintetizadas a 110ºC, seja por 24
horas ou por uma semana, cresceram em forma de esferas, diferente dos materiais obtidos pela síntese no reator micro-ondas e dos materiais obtidos por Mi et al63,
cujo crescimento se deu em forma de agulhas ou paralelogramos. Esse fato comprova a influência da forma de aquecimento no crescimento das amostras; como no reator Parr não há a orientação de campos eletromagnéticos, houve o
22
Figura 5: Microscopia eletrônica de varredura da amostra sintetizada no reator MW a 150ºC por a) 10min – Mn10 e b) 120min – Mn120, e no reator Parr a 110ºC por c) 24horas – Mn110 e d)
uma semana – Mn110/1s.
Os parâmetros de rede das amostras de MnMoO4.H2O sintetizadas no
Micro-ondas e no Reator Parr foram calculados com o auxílio do software Jade 9.0 e são
apresentados na Tabela 4; junto deles, há os dados dos valores das arestas das células unitárias e dos ângulos da ficha usada como referência.
a
b
23
Tabela 4: Parâmetros de rede das amostras de MnMoO4.H2O sintetizadas no MW (Mn10,
Mn20, Mn30, Mn120), no Reator Parr (Mn110, Mn150, Mn110/1s), e da referência ICDD #01-078-0220.
Amostra a(Å) b(Å) c(Å) α(º) β(º) γ(º) V(Å3)
MW
Mn10 5,755 5,920 6,986 100,18 96,34 107,26 220,34
Mn20 5,781 5,988 6,948 99,93 95,19 107,11 223,85
Mn30 5,731 5,989 6,940 100,67 95,86 106,49 221,40
Mn120 5,759 5,991 6,897 99,70 95,70 107,70 220,55
Parr
Mn110 5,743 5,988 6,973 100,23 96,39 106,59 222,77
Mn150 5,644 5,915 7,020 103,19 96,47 106,22 215,14
Mn110/1s 5,716 5,940 6,974 99,81 95,09 106,87 220,84
Ref. #01-078-0220 5,776 5,964 6,992 100,32 95,56 106,81 223,99
Ao analisar a Tabela 4, percebe-se que as quatro amostras produzidas no reator micro-ondas possuem parâmetros de rede semelhantes entre si e também em relação aos apresentados na ficha do ICDD de referência. Vale destacar que o valor da aresta b para a amostra Mn10 é bem inferior à da referência que, por sua vez, é
menor que o valor das outras três, os quais são bem parecidos entre si. Outra influência do tempo nesses fatores que pode ser observada é a redução da dimensão da aresta c à medida que o tempo de processamento aumenta, sendo que
nenhuma das amostras apresentou valor superior ao da referência para essa aresta. De acordo com a Tabela 4, percebe-se que as três amostras de MnMoO4.H2O
sintetizadas no Reator Parr possuem parâmetros de rede semelhantes entre si e
24
6.1.2. MnMoO4– P2/c
Os materiais sintetizados no reator Parr nas temperaturas de 200ºC e 250ºC
não são espécies hidratadas, como os anteriores, sendo que seus padrões de DRX foram indexados pela estrutura wolframita MnMoO4, de acordo com a ficha do ICDD
#01-078-0221. Para essas amostras, foram realizadas também medidas de espectroscopia Raman, sendo que para a fase monoclínica MnMoO4 P2/c, a teoria
de grupos para esse material é a apresentada na Tabela 5.62,64,65
Tabela 5: Análise da teoria de grupos para o cristal MnMoO4 monoclínico P2/c (#13, C24h)
Dessa forma, como os modos gerade são os modos ativos no Raman,
espera-se observar 18 modos Raman ativos sendo 8Ag e 10 Bg64-66. A Figura 6a
exibe os difratogramas de raios X e a Figura 6b os espectros Raman das amostras Mn200, Mn250 e Mn250/1s.
Átomo Posição Wyckoff Simetria Representação
Mn 2f C2 Ag + 2Bg + Au + 2Bu
Mo 2e C2 Ag +2Bg + Au + 2Bu
O (1) 4g
1
C 3Ag + 3Bg + 3Au + 3Bu
O (2) 4g
1
C 3Ag + 3Bg + 3Au + 3Bu
ΓTOTAL = 8Ag + 10Bg + 8Au + 10BuΓACOUSTIC = Au + 2Bu
25
20 30 40 50 60 70 80
MnMoO4 P2/c
#01-078-0221
2 Theta (°)
MnMoO4 C2/m
#01-072-0285 Mn250 Mn250/1s Mn200 Intensidade ( U.A.) (4 0 0 ) (-1 4 2 ) (2 2 3 ) (-3 2 2 ) (3 3 0 ) (-3 2 1 ) (0 4 1 ) (3 1 1 ) (2 2 2 ) (-3 1 1 ) (1 1 3 ) (0 3 2 ) (3 1 0 ) (-2 1 2 ) (-2 2 1 ) (-2 0 2 ) (1 3 0 ) (2 2 0 ) (0 2 2 ) (2 1 1 ) (-2 1 1 ) (1 1 2 ) (-1 1 2 ) (1 2 1 ) (-1 2 1 ) (-1 0 2 ) (-2 0 3 ) (2 0 0 ) (0 0 2 ) (0 2 0 ) (1 1 0 ) (1 0 0 ) (0 1 0 ) (-2 2 2 ) (1 1 1 ) (-1 1 1 ) (0 1 1 ) (a)
200 400 600 800 1000
Número de onda (cm-1)
Intensidade Raman (U.A.) Mn200 Mn250 (b) Mn250/1s
Figura 6: a) Difratogramas de Raios X e b) espectros Raman dos MnMoO4 sintetizados no
reator Parr Mn200, Mn250 e Mn250/1s.
Ao se analisar a Figura 6a, percebe-se que os difratogramas das amostras de MnMoO4 mesmo sendo indexada pela ficha #01-078-0221 apresentam significativas
diferenças nas relações de intensidade de alguns picos. Esses molibdatos são materiais monoclínicos (P2/c, #13) e isoestruturais ao MnWO4 estudado por Iliev et
al64. Esses molibdatos P2/c foram chamados por Meddar et al67 de w-MnMoO4 para
diferenciar do β-MnMoO4, um material também monoclínico porém C2/m, #1216,68-70.
De acordo com a ficha de referência #01-078-0221, o pico de maior intensidade é o referente ao plano (-111), cujo valor de 2θ é de 29,96º, seguido pelo
pico em 2θ igual a 30,28º, que se refere ao plano (111). Nas três amostras o pico de maior intensidade é o referente ao plano (100), que está localizado em 2θ
26
picos se indexam com a ficha #01-072-085, β-MnMoO4 monoclínico C2/m (#12), e
são referentes ao planos (-222) e (-203).
A Figura 6b, onde são apresentados os espectros Raman das amostras Mn200, Mn250 e Mn250/1s, confirma a semelhança das amostras. No que se refere a DRX e Raman, não há diferença se o processo acontecer nas temperaturas de 200ºC ou 250ºC, ao passo que, ao se analisar o espectro Raman da amostra sintetizada por uma semana, se observa um deslocamento das bandas para a esquerda, quando comparado com as duas anteriores. Isso mostra uma tendência de melhor organização dos átomos na estrutura, o que pode ser confirmado pelos parâmetros de rede das amostras.
Os parâmetros de rede das amostras de w-MnMoO4 sintetizadas no reator
Parr também foram calculados com o auxílio do software Jade 9.0 e são
apresentados na Tabela 6; junto deles, há os valores das arestas das células unitárias e dos ângulos da ficha de referência.
Tabela 6: Parâmetros de rede das amostras de w-MnMoO4 sintetizadas no reator Parr (Mn200, Mn250, Mn250/1s) e da referência ICDD #01-078-0221.
Amostra a(Å) b(Å) c(Å) β(º) V(Å3)
Parr
Mn200 4,815 5,757 4,978 90,91 137,98
Mn250 4,810 5,756 4,969 90,91 137,54
Mn250/1s 4,818 5,759 4,964 90,89 137,72
Ref. #01-078-0221 4,818 5,759 4,965 90,82 137,75
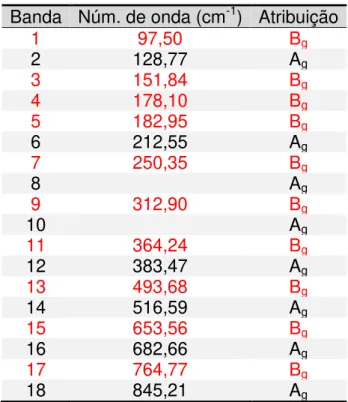
Como já se suspeitava, percebe-se que o aumento do tempo fez com que os parâmetros de rede se assemelhassem aos da ficha de referência, que se trata dos parâmetros de um monocristal. A partir dessa característica, foi isolado um cristal da amostra Mn250/1s com o intuito de se observar os 18 modos ativos das amostras de MnMoO4 (P2/c). Para isso, foram feitas medidas de espectroscopia Raman
27
distintos, conforme ilustra a Figura 7. Dessa forma, as bandas que se fortaleceram na polarização paralela (//), acompanhadas do enfraquecimento das demais, são referentes aos modos Ag, e aquelas bandas que ganham intensidade ao serem
realizadas medidas com a polarização perpendicular (), com a simultânea perda de força das outras bandas, são atribuídas aos modos Bg.
100 200 300 400 500 600 700 800 900
Número de Onda (cm-1
)
Bg Bg
Bg
Bg
Bg
Ag
Ag Ag
Ag Ag
Bg
Bg
Bg
Bg
Log Intensidade Rama
n (
U.A.)
Ag
Bg
T
//
Figura 7: Espectro Raman polarizado da amostra Mn250/1s. A configuração em paralelo (//) está indicada em preto e a perpendicular () em vermelho.
Os modos observados coincidem com os atribuídos por Iliev et al.64 e por Siqueira e Dias66 no estudo do MnWO4 que, conforme mencionado anteriormente, é
um composto isoestrutural ao MnMoO4 (P2/c, #13). A substituição do átomo de
28
causadas pela incidência do laser nas moléculas não serão de mesma frequência64. A atribuição dos modos Ag e Bg é apresentada na Tabela 7.
Tabela 7: Relação dos modos ativos Raman observados no estudo de polarização na amostra Mn250/1s.
Banda Núm. de onda (cm-1) Atribuição
1 97,50 Bg
2 128,77 Ag
3 151,84 Bg
4 178,10 Bg
5 182,95 Bg
6 212,55 Ag
7 250,35 Bg
8 Ag
9 312,90 Bg
10 Ag
11 364,24 Bg
12 383,47 Ag
13 493,68 Bg
14 516,59 Ag
15 653,56 Bg
16 682,66 Ag
17 764,77 Bg
18 845,21 Ag
29
Figura 8: Microscopia eletrônica de varredura da amostra sintetizada no reator Parr a 250ºC em
a)24horas – Mn250 e b)Uma semana – Mn250/1s.
Conforme mencionado anteriormente, esses materiais são classificados como monoclínicos, pois possuem três arestas da célula unitária diferentes entre si e somente um ângulo diferente de 90º, o ângulo β. No caso desse conjunto de amostras, o ângulo β é bem próximo de 90º, que é uma característica dos molibdatos de metais de transição monoclínicos P2/c, #13, como o composto CoMoO4-II, que possui ângulo β em aproximadamente 90,52º sintetizado em alta
pressão por Livage et al71, e os compostos MnMoO4 e ZnMoO4, ambos P2/c ,cujos
ângulos β são respectivamente 90,83º e 90,28º, sintetizados por Pavani e Ramanan72 com o uso da 2-aminopiridina em uma síntese hidrotérmica. Os três resultados experimentais (Mn200, Mn250 e Mn250/1s) se assemelharam bastante entre si, sendo que a amostra Mn250/1s foi a mais semelhante aos dados da ficha de referência. Dessa forma, como a referência é um DRX de um monocristal38, a síntese no reator Parr foi satisfatória na produção de w-MnMoO4 com alta
cristalinidade.
Além das medidas de MEV, foram realizadas medidas no microscópio eletrônico de transmissão da amostra Mn250/1s. A Figura 9 representa imagens de MET, MET de alta resolução e difração de elétrons em área selecionada (DEAS).
30
Figura 9: Imagens de MET da amostra sintetizada no reator Parr a 250ºC por uma semana. (a) e (c) imagens de MET de alta resolução evidenciando os espaçamentos interplanares. (b) Típica imagem
de MET mostrando as partículas em escala micrométrica. (d) Padrão de DEAS
Ao se analisar a Figura 9, pode-se confirmar a morfologia em forma de agulhas da amostra Mn250/1s semelhante às características observadas nas imagens de MEV. Além disso, pode-se observar os espaços interplanares relativos a dois diferentes planos: (100) e (002). O pico referente ao plano (100) no resultado de DRX dessa amostra é muito intenso (Figura 6a), sendo a orientação que o material preferiu crescer, percebe-se que a distância entre os planos na Figura 9a é de 4,8Å. De acordo com o resultado apresentado na Figura 9c, a distância interplanar medida é de 2,5 Å referente ao plano (002). Além disso, percebe-se, através da Figura 9d, que o perfil da DEAS indica que aquela microrregião analisada é de caráter monocristalino.
6.1.3. MnMoO4 – C2/m
De acordo com a literatura, pode-se obter outra fase para o MnMoO4, também
monoclínica, C2/m (#12), cuja coordenação do átomo de Mo é tetraédrica, a partir de temperaturas superiores a 500ºC67,68,70,73. Assim, a partir da amostra Mn250, sintetizada a 250ºC por 24 horas realizou-se um tratamento térmico onde essa amostra foi queimada no forno nas temperaturas de 300ºC, 400ºC, 500ºC, 550ºC e
d
a
c
b
A
31
600ºC, sendo que o tempo de cada queima foi de 2 horas. Esse tratamento foi realizado para acompanhar o comportamento dessa amostra à medida que se aumenta a temperatura. Os DRX e os espectros Raman desse estudo são apresentados na Figura 10.
10 15 20 25 30 35 40
2 Theta (°)
500°C
400°C
300°C
Mn250 600°C
550°C
MnMoO4 P2/c
#01-078-0221 MnMoO4 C2/m#01-072-0285
Inten
s
idade
(
U.A
.)
(a)
600
(b)
C2/m
550
500
Intensidade Raman
(U.A.)
400
300
200 400 600 800 1000
Número de onda ( cm-1)
250 P2/c
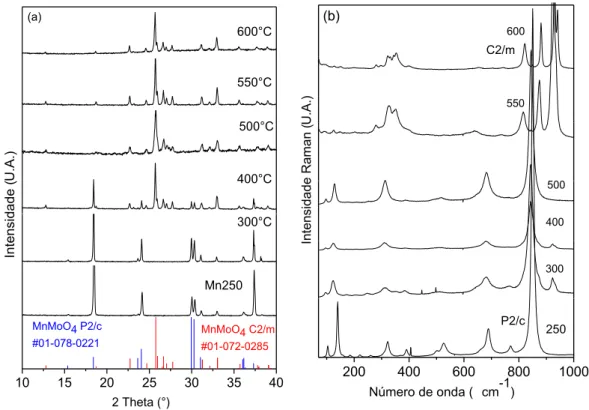
Figura 10: a) Difratogramas de Raios X e b) espectros Raman da amostra Mn250 e dos tratamentos térmicos de 300ºC a 600ºC.
Através desses experimentos ilustrados na Figura 10, pode-se observar a transição de uma fase monoclínica P2/c para uma fase C2/m. É possível perceber também que somente a partir da queima a 400ºC há o surgimento da fase β -MnMoO4, que é isoestrutural ao β-CoMoO4,β-NiMoO4 e β-MgMoO4;ou seja, em sua
estrutura os átomos se organizam em octaedros de MnO6 e tetraedros de MoO43,21.
Apenas a partir de 550ºC os traços da amostra P2/c desaparecem, obtendo-se a partir desse ponto uma fase β-MnMoO4 pura. Vale ressaltar que nos dados
apresentados no difratograma da amostra queimada a 500ºC e no seu respectivo Raman percebe-se que essa amostra indexa com a fase C2/m (β-MnMoO4), ao
passo que seu Raman se assemelha com a fase P2/c. Esse fato ocorreu pois a técnica de DRX faz uma leitura da amostra como um todo, e por ela os sinais da difração da radiação nos planos dos átomos da amostra β-MnMoO4 ficaram mais