UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA
DEPARTAMENTO DE TECNOLOGIA DE PROCESSOS QUÍMICOS APOSTILA DE BIOTECNOLOGIA EXPERIMENTAL
Isolamento e Identificação de
Micro-organismos do Solo
DANIELE AVILEZ DUÓ
PARTE 1 - Teoria
1- Introdução
O solo é uma camada viva, que recobre a superfície terrestre entre a litosfera e a atmosfera. Os solos são constituídos de três fases: sólida (minerais e matéria orgânica), líquida (solução do solo) e gasosa (ar). Essas fases podem ser encontradas em diferentes proporções, dependendo de fatores como tipo de solo e forma de utilização. É produto do intemperismo sobre um material de origem, cuja transformação se desenvolve em um determinado relevo, clima, bioma ao longo de um tempo e está em evolução permanente.
O solo é o resultado de algumas mudanças que ocorrem nas rochas. Estas mudanças são bem lentas, sendo que as condições climáticas e a presença de seres vivos são os principais responsáveis pelas transformações que ocorrem na rocha até a formação do solo.
2 - Microbiologia do Solo
O solo é habitado por uma enorme variedade de micro-organismos vegetais (microflora do solo) e animais (microfauna do solo) e ainda por organismos animais que vão de dimensões submicrocóspicas a dimensões médias ou mesmo relativamente grandes (macrofauna).
As comunidades de organismos micro e macroscópicos que habitam o solo realizam atividades imprescindíveis para a manutenção e sobrevivência das comunidades vegetais e animais. No solo as principais atividades dos organismos são a decomposição da matéria orgânica, produção de húmus, ciclagem de nutrientes e energia, fixação de nitrogênio atmosférico, produção de compostos complexos que causam agregação do solo, decomposição de xenobióticos e controle biológico de pragas e doenças, proporcionando assim, condições ideais para uma biodiversidade extremamente elevada.
influência na gênese e manutenção da organização dos constituintes do solo, principalmente nos horizontes superficiais.
Praticamente todos os micro-organismos existentes na natureza possuem representantes no solo. Quando um microbiologista procura um determinado organismo, o solo é a sua primeira consulta. Tendo em vista a composição do solo (rochas, minerais, água, gases e matéria orgânica - húmus) oriunda de vegetais, animais e micro-organismos, muitos grupos taxonômicos de micro-organismos estão presentes no solo influindo na sua fertilidade, consequentemente também associada à reciclagem dos elementos químicos.
O solo é o maior reservatório de micro-organismos do planeta, onde 1 hectare de solo pode conter até 4 toneladas de micro-organismos, recebendo direta ou indiretamente todos os dejetos dos seres vivos. É um local de transformação da matéria orgânica em substâncias nutritivas e tem grande abundância e diversidade de micro-organismos.
3 - Fatores que afetam os micro-organismos do solo
Os principais fatores que afetam os micro-organismos do solo são: substratos e fontes de energia, fatores de crescimento, nutrientes minerais, composição do solo, arejamento e condições de umidade, pH, pressão atmosférica, temperatura e radiação solar, e da competição e antagonismos que se estabelecem entre os próprios grupos de micro-organismos, dentre outros fatores.
4 - Principais grupos de micro-organismos do Solo
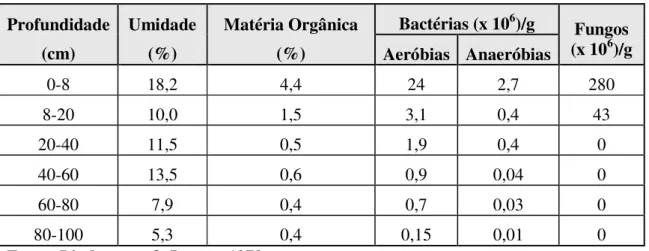
Tabela 1 - Quantidade de Micro-organismos no Solo Profundidade (cm) Umidade (%) Matéria Orgânica (%)
Bactérias (x 106)/g Fungos (x 106)/g Aeróbias Anaeróbias
0-8 18,2 4,4 24 2,7 280
8-20 10,0 1,5 3,1 0,4 43
20-40 11,5 0,5 1,9 0,4 0
40-60 13,5 0,6 0,9 0,04 0
60-80 7,9 0,4 0,7 0,03 0
80-100 5,3 0,4 0,15 0,01 0
Fonte: Lindegreen & Jensen, 1973
4.1 - Bactérias
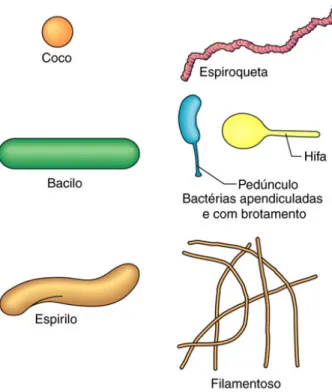
As bactérias são o grupo mais importante de organismos do solo, no qual, em condições favoráveis, atingem números extraordinariamente elevados. Há bactérias aeróbias obrigatórias, anaeróbias obrigatórias e facultativas. As bactérias desempenham papel importante na decomposição de resíduos orgânicos e na formação do húmus. Compostos extracelulares ajudam a se ligarem às partículas dos solos nos agregados. Grupos especializados estão envolvidos em cada etapa do ciclo do Nitrogênio.
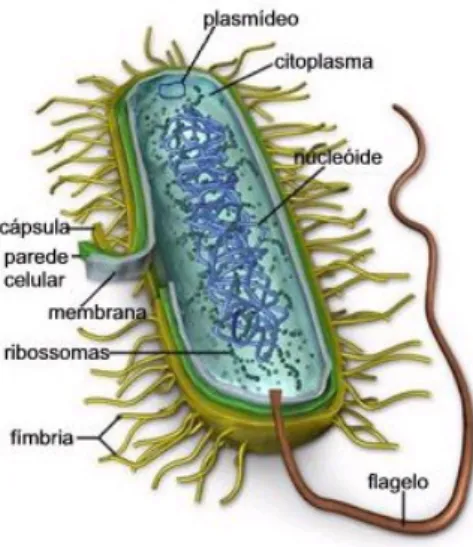
Figura 1 - Estrutura de uma bactéria
As bactérias podem ser identificadas por meio da técnica de coloração de Gram. Durante o processo de coloração de Gram, as células são tratadas com cristal violeta (corante primário) e em seguida com uma solução de iodo, o que resulta na formação de um complexo cristal violeta-iodo (CVI) dentro das células. Quando uma bactéria Gram-negativa é tratada com etanol, o lipídeo na membrana externa é dissolvido e removido, o que rompe a membrana externa e aumenta a sua permeabilidade. Assim, o complexo corante pode ser removido, descorando a bactéria Gram-negativa, que pode então ser tingida com o corante de fundo safranina. Em bactérias Gram-positivas, etanol faz com que os poros no peptideoglicano se contraiam, e o complexo corante CVI permanece no interior da célula.
4.2 - Actinomicetos
Actinobacteria é um filo de bactérias Gram-positivas conhecidas como actinomicetos ou actinobactérias. Estas bactérias têm organização filamentosa, muitas vezes ramificada. Dada sua semelhança com fungos e por produzirem, como estes, cadeias de esporos semelhantes a conídios, os Actinomicetos são com freqüência erroneamente classificados como tais. Ao contrário dos fungos, porém, são organismos procarióticos, em sua grande maioria aeróbios e gram-positivos.
Os Actinomicetos ocorrem amplamente no solo, onde desempenham relevante papel biológico. Especialmente representantes do subgrupo dos estreptomicetos são muito comuns na terra. Entre estes, contam-se o Streptomyces griseus e o Streptomyces
aureofaciens. Os representantes do gênero Streptomyces produzem importantes antibióticos, como a estreptomicina, sintetizada por S. griseus, a clorotetraciclina, sintetizada por S. aureofaciens, a terramicina, sintetizada por S. rimosus, entre muitos outros.
4.3 - Fungos
além disso, os micélios melhoram a estrutura física do solo. Os gêneros mais comuns são Penicillium, Mucor, Rhizopus, Cladosporium, Aspergillus.
Os fungos apresentam um conjunto de características próprias que permitem sua diferenciação das plantas: não sintetizam clorofila, não tem celulose na sua parede celular, exceto alguns fungos aquáticos e não armazena amido como substância de reserva. A presença de quitinas na parede da maior parte das espécies fúngicas e a sua capacidade de depositar glicogênio os assemelham às células animais.
Os fungos são seres vivos eucarióticos, sendo reconhecidos três principais grupos: as leveduras - apresentam um só núcleo, os fungos filamentosos ou bolores - são multinucleados e os cogumelos - são macroscópicos. Seu citoplasma contém mitocôndrias e retículo endoplasmático rugoso. São heterotróficos e nutrem-se de matéria orgânica morta - fungos saprofíticos, ou viva - fungos parasitários. Suas células possuem vida independente e não se reúnem para formar tecidos verdadeiros.
Os componentes principais da parede celular são hexoses e hexoaminas, que formam mananas, ducanas e galactanas. Alguns fungos têm parede rica em quitina (N-acetil glicosamina), outros possuem complexos polissacarídeos e proteínas, com predominância de cisteína.
4.4 - Algas
Desenvolvem-se principalmente na camada superficial de solos encharcados. Parece que desempenharem papel importante no arejamento de solos pantanosos.
PARTE 2 - Práticas
1 - Objetivo do trabalho experimental
Promover o isolamento e identificação de micro-organismos de uma amostra de solo.
Estudar as características dos principais micro-organismos do solo.
Proporcionar conhecimento prático das técnicas assépticas de manipulação de micro-organimos.
Despertar os alunos para as normas de biossegurança.
2 - Principais etapas
1ª Prática – Apresentação/Preparo de vidrarias para uso no laboratório de Microbiologia.
2ª Prática - Preparo de meios de cultivo/Esterilização pelo calor.
3ª Prática - Isolamento de micro-organismos do solo - plaqueamento.
4ª Prática - Descrição das colônias selecionadas/isoladas no plaqueamento. Repique.
5ª Prática - Observação/descrição das culturas repicadas e de sua tolerância ao oxigênio./Preparações microscópias I: a fresco
6ª Prática - Preparações microscópias II: fixadas e coradas
1ª Prática – Apresentação/Preparo de vidrarias para uso no laboratório
de Microbiologia
1 - Materiais de uso no laboratório de microbiologia
1.1 - Autoclave (calor úmido) - Seu funcionamento baseia-se no vapor d’água sob pressão. É utilizada para esterilização de materiais usados em microbiologia e meios de cultura.
1.2 - Estufa de incubação - Onde os micro-organismos são mantidos durante o seu desenvolvimento em uma temperatura constante.
1.3 - Microscópio - Para a observação dos micro-organismos
1.4 - Placa de Petri - Recipiente redondo de vidro ou de poliestireno cristal, com tampa rasa, destinada ao cultivo de micro-organismos em meio sólido.
1.5 - Tubo de cultura - Destinado ao cultivo de micro-organismos em pequeno volume de meio (líquido ou sólido).
1.6 - Pipeta graduada ou sorológica - Utilizada para diluição, inoculação, etc. Deve conter um tampão de algodão no bocal.
1.7 - Espátula de Drigalsky - Bastão de vidro com formato de triângulo em uma das extremidades. É usado para distribuir de forma homogênea uma cultura líquida sobre o meio de cultura sólido contido na placa de Petri.
1.8 - Cabo de Kolle - Cabo em cuja extremidade há um fio de platina ou outra liga metálica (níquel-cromo) que pode ser reto (agulha) ou encurvado (alça). Serve para semear micro-organismos em meio sólido ou líquido.
1.9 - Lâminas - São retângulos de vidro claro e transparente, de espessura média e bordos polidos, que servem para o exame de micro-organismos ao microscópio.
1.11 - Pinça para lâmina - Servem para fixar uma lâmina com material que vai sofrer coloração, podendo ser de metal ou madeira;
1.12 - Algodão cardado – Algodão cru não absorvente. Serve de tampão de frascos e tubos contendo meio de cultura ou soluções esterilizadas, pois funciona como um filtro para micro-organismos.
2 - Preparo de vidrarias para uso no laboratório de microbiologia
2.1 - Pipetas - são lavadas com água corrente, deixadas em solução detergente e novamente passadas em água. Depois de secas, coloca-se algodão no bocal e em seguida, são esterilizadas em estojos especiais ou embrulhadas em papel Kraft. Não esquecer de anotar o volume.
2.2 - Tubos de cultura - se estiverem com culturas, devem ser inicialmente autoclavados (120°C, 20min), o meio de cultura escorrido ainda quente, lavadas com água e sabão e deixadas por algumas horas em solução detergente. Depois disso são passadas em água corrente e secas. Após a lavagem, e antes da esterilização, os tubos são arrolhados firmemente com algodão, de modo que ao ser pego somente pela rolha o tubo não se solte. A esterilização deve ser feita em autoclave, quando já possuem meio de cultura em seu interior.
2ª Prática - Preparo de meios de cultivo/Esterilização pelo calor.
1 - Definição
Meio de cultura é o nome que se dá à associação, qualitativamente e quantitativamente equilibrada, de substâncias que, por sua natureza, permitem o cultivo dos micro-organismos fora do seu habitat ou meio natural.
O cultivo artificial em condições previamente definidas e reprodutíveis integra, junto com a esterilização e a prática asséptica, o fundamento científico da técnica microbiológica.
2 - Exigências Nutritivas
O meio de cultura deve conter os elementos necessários para o crescimento ideal do micro-organismo a ser cultivado. Sabemos que há diferentes grupos microbianos que exigem determinados compostos que são utilizados no preparo dos meios tais como:
-água
-sais minerais -fontes de carbono
-fontes de nitrogênio (orgânica ou inorgânica) -fontes de enxofre (orgânica ou inorgânica) -extrato de leveduras
-extrato de carne
-agar-agar (meios sólidos ou semi-sólidos)
Outros requisitos: pH, tensão de oxigênio e esterilidade.
3 - Classificação dos Meios de Cultura
Podem ser classificados de acordo com diferentes critérios, desde a forma em que se apresentam até sua finalidade.
Quanto à origem dos constituintes: naturais ou sintéticos.
Quanto à natureza dos constituintes: meios minerais, meios orgânicos, meios mistos e meios complexos (adição de fatores de crescimento).
Quanto à finalidade: meios de cultivo, meios de enriquecimento, meios de identificação, meios diferenciais, meios especiais e meios para conservação.
4 - Normas de Preparação
Embora cada meio de cultura tenha sua composição própria ou detalhes técnicos especiais para o preparo, todos os meios devem ser preparados obedecendo algumas regras básicas. Em geral, todas as substâncias devem ser solubilizadas. No caso de meios sólidos, primeiramente deve-se solubilizar o agar em água aquecida numa temperatura em torno de 60oC, em seguida adicionar os demais componentes do meio após solubilizá-los individualmente em água. Os sais, a peptona e os açúcares também devem ser solubilizados em água fria, enquanto que o extrato de carne e de levedura em água ligeiramente aquecida. Finalizada a solubilização o pH do meio deve ser ajustado para o valor desejado com soda ou ácido, distribuído em recipientes adequados e esterilizado.
5 - Composição dos Meios de Cultura/Soluções Utilizadas Gelose Simples →→→→ isolamento de bactérias
Composição: extrato de carne - 3g peptona - 10g Na2HPO4 - 1g NaCl - 5g agar-agar - 18g água destilada - 1 litro pH - 7,4 a 7,6
Distribuir: 250 mL de meio sólido/erlenmeyer 500 mL Esterilizar a 121oC/15 min.
Gelose Sabouraud →→→→ isolamento de fungos (leveduras)
Composição: peptona - 10g glicose - 20g
água destilada - 1 litro pH - 5,6
Distribuir: 250 mL de meio sólido/erlenmeyer 500 mL Esterilizar a 121oC/15 min.
Gelose Czapeck →→→→ isolamento de fungos (bolores)
Composição: sacarose - 30g NaNO3 - 3g MgSO4 - 0,5 KCl - 0,5 K2HPO4 - 1g agar-agar - 18g água destilada - 1 litro pH - 7,3
Distribuir: 250 mL de meio sólido/erlenmeyer 500 mL Esterilizar a 121oC/15 min.
Obs.: Para cada um dos meios acima, preparar 250 mL de meio líquido.
Solução Salina → diluição
Composição: NaCl - 8,5g
água destilada - 1 litro
3ª Prática - Isolamento de micro-organismos do solo - plaqueamento.
1 - Definição
Em microbiologia, isolamento é a operação que consiste em separar uma espécie microbiana de outra, a partir de certo material contaminado. Imagine, se for preciso obter um micro-organismo existente no solo, uma bactéria por exemplo, sabendo que no solo, encontram-se bactérias, leveduras e bolores. Como será possível obter essa bactéria isolada dos outros micro-organismos?
Tomando uma porção representativa desse material, faz-se uma suspensão em solução fisiológica de maneira a se obter um extrato do solo. Esse extrato vai ser diluído e a diluição plaqueada. A finalidade da diluição é diminuir o número de micro-organismos para que na placa de Petri as colônias apareçam bem separadas a fim de permitir um bom isolamento. Os micro-organismos vão se desenvolver à custa dos nutrientes presentes no meio adicionado à placa. A composição dos nutrientes varia de acordo com grupo microbiano que se deseja isolar.
2 - Técnicas de Plaqueamento
2.1- Superfície
a) Espalhamento → o meio de cultura fundido é colocado na placa de Petri, deixado solidificar até que se tenha uma superfície bem rígida e sobre ela colocamos a amostra convenientemente diluída. Espalha-se o material por toda a superfície da placa com espátula de Drigalsky e incubamos por tempo determinado na temperatura adequada, após marcar as placas com as diluições e o nome do operador.
2.2 - Mistura (incorporação ou pour-plate)
É indicada para os casos em que o micro-organismo é móvel e tende a invadir toda a placa ou quando há suspeita de anaeróbios. O material, devidamente diluído, será colocado na placa e o meio de cultura fundido (≅ 50oC) deve ser adicionado e misturado ao mesmo com movimentos giratórios. Incubar na temperatura e tempo adequados, após marcar as placas com as diluições e o nome do operador.
3 - Técnica de diluição sucessiva
Em um erlenmeyer contendo 90 mL de solução salina adicionar de forma asséptica 10 g de solo, homogeneizar e prosseguir de acordo com o esquema apresentado na figura a seguir:
Figura 2 – Técnica da diluição sucessiva para o plaqueamento de amostra de solo.
Em cada uma dessas técnicas o objetivo é diminuir a população microbiana, assim as células individuais estarão localizadas a certa distância umas das outras. E também para facilitar a contagem das placas selecionadas contendo entre 30 e 300 colônias. Cada célula se estiver distante o suficiente das demais, produzirá uma colônia que, por estar afastada das demais pode ser considerada pura. Todas as células em uma colônia têm o mesmo parentesco. Para isolar uma cultura pura, uma colônia individual deve-se transferir uma amostra da colônia para um tubo de ensaio contendo meio estéril, seguindo as práticas assépticas para evitar recontaminação.
4 - Quantificação do no de micro-organismos presentes numa amostra de solo
Selecionar a placa contendo entre 30 e 300 colônias. Contar o número de colônias e, de acordo com a diluição utilizada no material de origem, expressar o número de unidades formadoras de colônia (UFC) presentes na amostra, nas condições de teste.
Exemplo de cálculo: nº de colônias = 54 diluição = 10-5
4ª Prática - Descrição das colônias selecionadas/isoladas no
plaqueamento. Repique.
1 - Leitura da Placa
Examina-se a placa contra a luz, por ambos os lados, procurando colônias isoladas que serão marcadas (Figura 1). Em seguida, com auxílio da lupa, observa-se cuidadosamente estas colônias marcadas e numera-se aquelas que, pelo aspecto, parecem provir de espécies diferentes.
2 - Características Morfológicas das Colônias Anotar cuidadosamente as seguintes características: a) Tamanho:
b) Forma:
c) Elevação:
d) Bordos:
3 - Repique
É a operação que consiste no transporte de certa porção de uma cultura para um meio esterilizado. A porção transportada denomina-se inóculo ou semente. Podemos ter dois casos:
Repique da placa ao tubo → as colônias selecionadas serão transferidas, ou seja, repicadas uma a uma, para tubos contendo meio líquido e tubos contendo agar inclinado com emprego de uma alça de platina. Primeiramente é semeado o agar e a seguir o meio líquido, sem carregar novamente a alça, uma vez que para o meio líquido um pequeno inóculo é suficiente. Os tubos são identificados com o nome do material, número da colônia e a data, e incubados na temperatura e tempo adequados. A placa é conservada fora da estufa, de preferência na geladeira, até que o repique tenha crescido e a seguir descarregada.
5ª Prática - Observação/descrição das culturas repicadas e de sua
tolerância ao oxigênio./Preparações microscópias I: a fresco
1 - Descrição das Culturas Repicadas e de sua Tolerância ao Oxigênio
1.1 - Tubos de Gelose Inclinada: Examinar os tubos contendo as culturas repicadas com objetivo de verificar se estes se apresentam homogêneos em toda sua extensão.
1.2 - Tubos de Meio Líquido: Examinar a tolerância das culturas repicadas ao oxigênio, de acordo com a classificação abaixo.
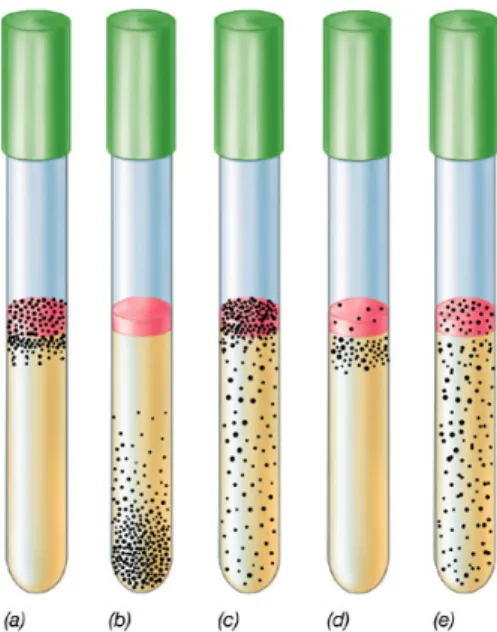
Figura 1 – Esquema representativo das formas de crescimento de micro-organismos em meio líquido dependendo de sua relação com o oxigênio atmosférico.
(a) Aeróbios→ como o O2 penetra pouco no tubo, os aeróbios obrigatórios crescem na superfície.
(b) Anaeróbios estritos→ são sensíveis ao O2, crescem somente no fundo.
(c) Aeróbios facultativos→ são capazes de crescer tanto na presença como na ausência de O2, por toda a extensão do tubo.
(d) Microaerófilos→ se afastam da zona com maior quantidade de O2.
2 - Preparações microscópias I: a fresco
É o método de observação mais simples e o mais antigo. Permite que se observem as células ou micro-organismos sem nenhum artifício. É possível observar a forma, cor e o movimento das células, que são conservadas vivas. Não permitem inspeções prolongadas, pois há sempre o perigo de ressecar o líquido dispergente.
2.1 - A partir de cultivo em meio sólido - Secar a lâmina
- Colocar uma pequena gota do líquido dispergente (solução fisiológica) no centro da lâmina com auxilio de uma pipeta Pasteur.
- Retirar com auxilio da alça de platina, previamente esterilizada (aquecida ao rubro e resfriada), uma pequena quantidade do crescimento do micro-organismo da gelose e ressuspender na gota do líquido sem espalhar pela lâmina.
- Colocar sobre a suspensão de células a lamínula de modo a não formar bolhas de ar.
2.2 - A partir de culturas em meio líquido - Secar a lâmina
- Retirar com a pipeta Pasteur um pouco do cultivo previamente agitado e colocar uma gota no centro da lâmina.
- Colocar sobre a suspensão a lamínula de modo a não formar bolhas de ar.
Essas preparações podem ser coradas ou não. Neste caso, os corantes empregados são os corantes vitais, ou seja, não comprometem a vida da célula. Há difusão do corante no líquido celular. Ex: azul de metileno é usado para pesquisa de células vivas.
3 - Observações das Preparações
Deve-se sempre anotar todos os dados relativos às observações, tais como:
- material em exame e suas condições (no caso de culturas de micro-organismos: o meio de cultivo, data da cultura, temperatura de incubação);
- tipo de preparação e a técnica usada;
- tipo de observação feita e jogo ótico usado.
Deve-se procurar sempre desenhar o material em observação, anotando a forma, a estrutura e quaisquer outros detalhes presentes.
6ª Prática - Preparações microscópias II: fixadas e coradas
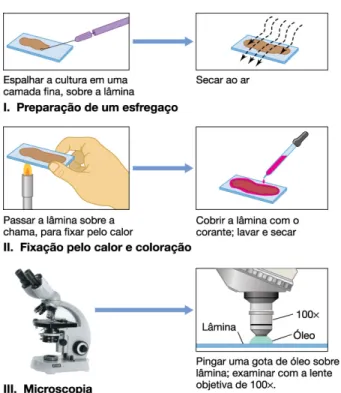
1 - Preparações Fixadas e Coradas: Consiste em fixar o esfregaço sobre a lâmina, o qual sofrerá o método de coloração.
1.1 - Preparo do esfregaço
A partir de cultivo em meio sólido
- Secar a lâmina
- Com auxilio de urna pipeta Pasteur colocar no centro da lâmina uma gota de solução fisiológica.
- Com a alça de platina, previamente esterilizada (aquecida ao rubro e resfriada), retirar urna pequena quantidade do crescimento do micro-organismo da gelose e ressuspender na gota de solução fisiológica, espalhando bem, de modo a formar uma camada homogênea e fina.
- Esperar secar e fixar.
A partir de cu1turas em meio líquido - Secar a lâmina
- Retirar com a pipeta Pasteur um pouco do cu1tivo previamente agitado e espalhar bem, de modo a formar uma camada homogênea e fina.
- Esperar secar e fixar.
1.2 - Fixação A Marchoux - Método químico
- Mecanismo: precipitação das proteínas celulares pelo etanol - Execução: cobrir o esfregaço com etanol, escorrer e flambar.
Calor - Método físico
- Mecanismo: coagulação das proteínas celulares.
1.3 - Coloração: As células fixadas podem sofrer diversos processos de coloração, sendo o mais importante a coloração de Gram.
Coloração de Gram - Técnica segundo Hucker
- Cobrir a preparação com Gram I (solução de cristal violeta). Deixar 60 segundos. Escorrer e lavar com água corrente.
- Recobrir com gotas de Gram II (solução de Lugol). Deixar 30 seg. Escorrer e lavar. - Tratar com Gram III (etanol) até descorar. Escorrer e lavar.
- Recobrir com Gram IV (solução de safranina). Deixar 5-7 seg. Escorrer, lavar e secar.
Neste caso as células são observadas com a objetiva de imersão. Para tal, colocar diretamente sobre a preparação uma gota de óleo e levar ao microscópio para focalizar. As preparações deste tipo são observadas com bastante luz (condensador elevado e diafragma bem aberto).
Diagnóstico: células roxas – Gram positivas
células vermelhas - Gram negativas
2 - Observações das Preparações
Deve-se sempre anotar todos os dados relativos às observações, tais como:
- material em exame e suas condições (no caso de culturas de micro-organismos: o meio de cultivo, data da cultura, temperatura de incubação);
- tipo de preparação e a técnica usada;
- tipo de observação feita e jogo ótico usado.
Deve-se procurar sempre desenhar o material em observação, anotando a forma, a estrutura e quaisquer outros detalhes presentes.