UNIVERSIDADE FEDERAL DE OURO PRETO PROGRAMA DE PÓS GRADUAÇÃO EM NANOTECNOLOGIA FARMACÊUTICA
DESENVOLVIMENTO, CARACTERIZAÇÃO E AVALIAÇÃO DE NANOESTRUTURAS CONTENDO FOTOSENSITIZADOR PARA O TRATAMENTO DE LESÕES MALIGNAS E POTENCIALMENTE MALIGNAS
EM MODELOS EXPERIMENTAIS
TESE DE DOUTORADO
CARINA SILVA DE PAULA
Orientadora: Profa Dra Vanessa Carla Furtado Mosqueira Co-orientador: Prof. Dr. Ricardo Alves de Mesquita
CARINA SILVA DE PAULA
DESENVOLVIMENTO, CARACTERIZAÇÃO E AVALIAÇÃO DE NANOESTRUTURAS CONTENDO FOTOSENSITIZADOR PARA O TRATAMENTO DE LESÕES MALIGNAS E POTENCIALMENTE MALIGNAS
EM MODELOS EXPERIMENTAIS
Tese de doutorado apresentada ao Programa de Pós- Graduação em Nanotecnologia Farmacêutica da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para obtenção do título de Doutor em Ciências Farmacêuticas.
Este trabalho está sendo apresentado para a avaliação de Comissão Examinadora do Exame de Doutorado em Nanotecnologia Farmacêutica, como requisito
essencial para obtenção do grau de doutor.
A comissão examinadora será constituída pelos professores:
Prof. Dr. Lucas Antônio Miranda Ferreira Profa. Dra. Maria Cassia Ferreira de Aguiar
Profa. Dra. Soraya de Mattos Camargo Grossmann Almeida Profa. Dra. Renata Fonseca Vianna Lopez
Profa. Dra. Vanessa Carla Furtado Mosqueira (orientador - presidente)
Este trabalho contou com a colaboração dos pesquisadores: Antonio Claudio Tedesco FCF-USP-RP
Elaine Amaral Leite (UFMG) Emily Correna Carlo Reis (UFOP-UFV) Laser Antônio Machado Oliveira (UFOP) Maria Vitória Lopes Badra Bentley – FCF-USP-RP
AGRADECIMENTOS
Á minha orientadora Professora Dra. Vanessa Carla Furtado Mosqueira, pela oportunidade, orientação e, principalmente, pela confiança no meu trabalho.
Ao meu co-orientador Prof. Dr. Ricardo Alves de Mesquita pela dedicação e contribuição imensa na co-orientação desse trabalho.
Ao Professor Laser Antônio Machado Oliveira pela imensa colaboração e disponibilidade na realização dos experimentos com Microscopia Confocal.
Ao Centro de Aquisição e Processamento de Imagens e ao Professor Gregory Thomas Kitten que possibilitaram a realização da Microscopia Confocal.
À Professora Emily Correna Carlo Reis pelo auxílio no processo de indução da leucoplasia.
À Professora Elaine Amaral Leite pela colaboração e disponibilidade na indução dos tumores sólidos de Ehrlich.
À Professora Maria Vitória Lopes Badra Bentley pela colaboração que permitiu a realização dos estudos de permeação e rentenção das formulações desenvolvidas.
À Margareth Spangler, pela oportunidade de realização da microscopia de força atômica no Centro Tecnológico de Minas Gerais.
Ao Vilela, pela dedicação e entusiasmo na realização das imagens de microscopia de força atômica.
Ao Programa de Pós- Graduação em Nanotecnologia Farmacêutica- PPGNanoFarma, CAPES, CNPq e NANOBIOMG/FAPEMIG pelo auxílio financeiro.
Aos colegas de Pós-Graduação, pela cooperação e pelos bons momentos.
Aos técnicos e amigos Leonardo César e Patrícia Capelari pela grande contribuição na realização dos experimentos.
Á Mirela pela imensa disponibilidade em ajudar.
Aos funcionários do biotério da UFOP, em especial a Érika Cristina, por colaborarem com esse trabalho.
A todos os colegas do Laboratório de Patologia Bucal da Faculdade de Odontologia da UFMG, em especial a Geovana, Márcio, Alessandro e Inês.
A todos os colegas do Laboratório de Desenvolvimento Galênico e Nanotecnologia, Renata Branquinho, Líliam Teixeira, Giani Martins, Carlos Henrique, Raquel Castanheira, Izabel Trindade, Carolina Oliveira, Larissa Cotrim, Daline de Assis, Eliane Fialho e, em especial, a Samantha de Almeida Silva pelo incansável auxílio na realização dos experimentos, a Pollyanna Spósito, pela grande amizade de longa data, a Alessandra Vidal pelo companheirismo e a Mônica Auxiliadora pela imensa disponibilidade e auxílio na realização dos experimentos.
À minha família, minha mãe Maria da Penha e meu pai José de Paula por sempre estarem ao meu lado me incentivando e apoiando, aos meus irmãos Flávia e Leandro pelo companheirismo e cumplicidade nos momentos difíceis, a minha sobrinha Manuela pelos momentos de descontração e alegria.
Ao meu marido Eduardo por todo amor, compreensão, paciência e por ter me apoiado durante todo o desenvolvimento deste trabalho.
RESUMO
mostrando eficácia de NC-AlClPc no tratamento experimental por PDT em nosso modelo animal.
Por outro lado, NE e NC aniônicas e catiônicas foram desenvolvidas e caracterizadas para utilização no tratamento tópico de desordens potencialmente malignas da mucosa oral, visando aplicações no tratamento futuro da leucoplasia. Nanoestruturas catiônicas compostas de estearilamina (EA) ou dodecilamina (DA) foram preparadas por nanoemulsificação espontânea. O procedimento resultou em NE monodispersas com diâmetro médio das gotículas de aproximadamente 273 nm. NC também foram preparadas e comparativamente apresentaram tamanho médio muito semelhante (263 nm). As nanoestruturas compostas de DA e EA apresentaram um potencial zeta de +17 e +76 mV, respectivamente. AlClPc-carregada em nanoestruturas catiônicas exibiram porcentagem de encapsulação de 100%. A porcentagem de AlClPc liberada in vitro de NC EA e NE EA foi de 13% e 15%, respectivamente, após 156
horas. A hemólise induzida por nanoestruturas catiônicas apresentou-se aumentada em relação às nanoestruturas aniônicas. Ambas foram também caracterizadas quanto a penetração in vivo de AlClPc através da mucosa da língua e bolsa de hamster, sendo as
mucosas analisadas por microscopia confocal. Entretanto, a NE catiônica preparada com dodecilamina apresentou menor penetração na mucosa quando comparado às demais formulações. Estudos de permeação e retenção in vitro foram realizados utilizando-se
mucosa da bolsa jugal de hamster com leucoplasia induzida por 7, 12- dimetil-benzoantraceno (DMBA). Os estudos de permeação e retenção in vitro demonstraram
contendo AlClPc são um sistema de vetorização promissor para aplicações clínicas na TFD em alterações potencialmente malignas, como a leucoplasia oral.
Palavras- chave:
ABSTRACT
In this work, the fotossensitizer chloroaluminum phthalocyanine (AlClPc) was incorporated in different colloidal systems: conventional nanocapsules of, poly(D,L -lactide) (PLA), sterically stabilized or peguilated NC (monometoxipolyethylene glycol
co- poly(D,L-lactide)) (PLA-PEG) and anionic and cationic nanoemulsions (NE), using the method of precipitation followed by solvent evaporation. PLA and PLA-PEG NC containing AlClPc were developed and characterized for the intravenous treatment of solid tumors in animal model by photodynamic therapy. The nanocapsules were produced by interfacial polymer deposition. The NC preparations containing AlClPc showed narrow distribution of size (monodisperse) with a mean polydispersive index of 0.13. The mean diameter ranged around of 200 nm, according to the formulation and determined by photon correlation spectroscopy. All formulations presented negative potential zeta. The encapsulation percentage of AlClPc was of 100% for all formulations. The release profile was investigated for all preparations and sustained release was observed for 168 hours. The hemolysis induced by free AlClPc or in PLA NC was extremely low (<10%), the NC PLA-PEG containing AlClPc induced higher hemotoxicity (maximum of 37%).The antitumoral activity of free AlClPc and incorporated in PLA NC and in PLA-PEG NC was assessed on murine model of solid Ehrlich tumor in doses of 0.5 and 6.0mg/kg of AlClPc and 50 J/cm2 of light. Control groups present similar macroscopically and histological patterns, while PDT treatment induced 70% e 68% of tumor necrosis after one single application of PLA NC and PLA-PEG NC, respectively, in high doses, showing the efficacy of NC-AlClPc mediated PDT on the treatment of model malignant disease.
malignant disease of oral mucosa, for the future treatment of leukoplakia. Cationic nanostructure composed of stearylamine (EA) or dodecylamine (DA) were prepared by spontaneous emulsification. The procedure resulted in monodispersed NE with a droplet size of approximately 273 nm. NC were also prepared and showed comparatively very similar average size (263nm).The nanostructures composed of DA and EA presented the mean zeta potential of +17 and +76 mV, respectively. AlClPc-loaded cationic nanostructures exhibited encapsulation percentage values close to 100%. Amount of AlClPc in vitro released of NC EA and NE EA was 13% and 15%, respectively, after
156 hours. Hemolysis induced nanostructures cationic presented increased compared to anionic nanostructures. The anionic and cationic nanostructures were also characterized in terms of AlClPc penetration across the hamster tongue and pouch mucosa and analyzed by confocal microscopy. However, cationic NE prepared with dodecylamine exhibited reduced penetration into the mucosa when compared to other formulations. In
vitro permeation and retention studies were performed using mucosal hamster cheek
pouch with oral leukoplakia induced by 7, 12- dimetil-benzoantraceno (DMBA). The in
vitro retention and permeation studies demonstrated that AlClPc incorporated into the
NE and free in solution can penetrate to the viable layers of the mucosa containing induced leukoplakia and remaining retained after 6 hours of application. The results suggest, therefore, that nanoparticles containing AlClPc is a promising drug delivery system for photodynamic therapy of potentially malignant disorders, as oral leukoplakia.
Keywords:
LISTA DE FIGURAS
Figura 1: Fluxograma representativo dos objetivos propostos nesse trabalho... 4
Figura 2: Etapas da terapia fotodinâmica. ... 8
Figura 3: Modificação do diagrama de Jablonski utilizado para ilustração das reações fotoquímicas a partir da excitação de fotossensibilizadores ... 9
Figura 4: Estrutura química de cloro-alumínio ftalocianina ... 12
Figura 5: Desenho esquemático da organização física e estrutural de alguns vetores principais para cloro-alumínio ftalocianina. ... 14
Figura 6: Diferentes tipos de interações entre nanocarreadores e tecido tumoral por meio do efeito de permeação e retenção aumentada nos tumores (“EPR effect”) ... 22
Figura 7: Perfil de liberação do AlClPc em NC PLA e NC PLA-PEG e perfil de dissolução do AlClPc livre. ...Erro! Indicador não definido.
Figura 8: Propriedades hemolíticas de AlClPc livre em solução e incorporado às formulações de NC convencional (NC PLA) e NC peguilada (NC PLA-PEG) testadas em diferentes diluições em
PBS ...Erro! Indicador não definido.
Figura 9: Protocolo experimental de tratamento por terapia fotodinâmica com AlClPc por via intravenosa em modelo murino com tumor sólido de Ehrlich. ... 46
Figura 10: Corte histológico de tumor de Ehrlich corado com HE ...Erro! Indicador não definido.
Figura 11: Análise histológica do tecido tumoral corado com HE. ...Erro! Indicador não definido.
Figura 12: Corte histológico de tumor de Ehrlich 21 dias após terapia fotodinâmica com AlClPc em NC de PLA-PEG na dose de 6,0 mg/kg. ...Erro! Indicador não definido.
Figura 13: Terapia fotodinâmica in vivo com AlClPc na dose de 0,5 mg/kg.Erro! Indicador não definido.
Figura 15: Porcentagem média da área com células tumorais viáveis quantificadas em tumores dos animais sem tratamento (receberam solventes injetáveis) e com AlClPc livre sem exposição
à luz. ...Erro! Indicador não definido.
Figura 16: Porcentagem da área de células tumorais viáveis em cortes de tumores dos animais tratados com AlClPc livre e encapsulada em NC de PLA e NC de PLA-PEG, na dose de 0,5
mg/kg. ...Erro! Indicador não definido.
Figura 17: % da área com células tumorais viáveis dos animais tratados com AlClPc livre) e encapsulada em NC de PLA e NC de PLA-PEG, na dose de 6,0 mg/kg.Erro! Indicador não
definido.
Figura 18: Porcentagem da área de necrose dos tumores dos animais tratados com AlClPc livre e encapsulada em NC PLA e NC PLA-PEG, na dose de 0,5 e 6,0 mg/kg.Erro! Indicador não
definido.
Figura 19: Imagem confocal de cortes tumorais 24 horas após a administração i.v. da AlClPc livre em solução, NC PLA e NC PLA-PEG, todas na dose de 6 mg/kg de AlClPc.Erro! Indicador
não definido.
Figura 20 : Leucoplasia oral antes (A) e após remoção cirúrgica (B). ... 63
Figura 21: Excisão com auxílio de punch da área da língua seccionada destinada à dosagem de AlClPc ... 69
Figura 22: Administração tópica de NE catiônica contendo AlClPc (0,2 mg/mL) em língua(A)e bolsa jugal(B) de hamster sírio dourado ... 72
Figura 23: Realização de biópsia incisional para análise histológica comprovatória de leucoplasia ... 73
Figura 24: Estrutura química da dodecilamina (A) e da octadecilamina ou estearilamina (B)
...Erro! Indicador não definido.
Figura 26: Cromatograma de AlClPc em solução etanólica (0,1 µg/mL).Erro! Indicador não definido.
Figura 27: Curva de calibração do AlClPc em etanol: acetonitrila (1:1)Erro! Indicador não definido.
Figura 28: Imagem de altura de NC EA contendo 0,2 mg/mL de AlClPc. Área: 4 µm x 4 µm .. Erro!
Indicador não definido.
Figura 29: Imagem de altura de NC EA contendo 0,2 mg/mL de AlClPc. Área: 10 µm x 10 µm
...Erro! Indicador não definido.
Figura 30: Imagem de altura de NE aniônica contendo 0,2 mg/mL de AlClPc. Área: 4µm x 4µm
...Erro! Indicador não definido.
Figura 31: Imagem de altura de NE catiônica contendo 0,2 mg/mL de AlClPc. Área: 4µm x 4µm
...Erro! Indicador não definido.
Figura 32: Perfil de liberação do AlClPc em NC e NE catiônicas. ...Erro! Indicador não definido.
Figura 33: Perfil de liberação do AlClPc em NC aniônica e NC catiônicaErro! Indicador não definido.
Figura 34: Perfil de liberação do AlClPc em NE aniônica e NE catiônica. Erro! Indicador não definido.
Figura 35: Propriedades hemolíticas de AlClPc livre em solução e incorporado a formulações de NC e NE aniônicas e catiônicas testadas em diferentes diluições em PBS.Erro! Indicador não
definido.
Figura 36: Cromatograma de AlClPc extraída do epitélio + lâmina própria.Erro! Indicador não definido.
Figura 37: Penetração de AlClPc in vivo (a) na camada de queratina e (b) no epitélio + lâmina própria da mucosa após 60 minutos da aplicação tópica de AlClPc livre em solução e
Figura 38: Imagem confocal de língua de hamster sem administração tópica de AlClPc (controle negativo). ...Erro! Indicador não definido.
Figura 39: Imagem confocal de língua de hamster após administração tópica por 30 minutos de NE aniônica contendo 0,2 mg/mL de AlClPc. ...Erro! Indicador não definido.
Figura 40: Imagem confocal de bolsa jugal de hamster após administração tópica por 30 minutos de NC aniônica contendo 0,2 mg/mL de AlClPc. ...Erro! Indicador não definido.
Figura 41: Imagem confocal de língua de hamster após administração tópica por 60 minutos de NC convencional (aniônica ) e catiônica contendo 0,2 mg/mL de AlClPc.Erro! Indicador não
definido.
Figura 42: Imagem confocal de língua de hamster após administração tópica por 60 minutos de NE aniônica e catiônica preparada com estearilamina ambas contendo 0,2 mg/mL de AlClPc
...Erro! Indicador não definido.
Figura 43: Imagem confocal de língua de hamster após administração tópica por 60 minutos de NE catiônica preparada com dodecilamina, contendo 0,2 mg/mL de AlClPc.Erro! Indicador não
definido.
Figura 44: Imagem confocal de língua de hamster após administração tópica por 60 minutos de NE catiônicas preparadas com estearilamina (a) e com dodecilamina (b), ambas contendo 0,2
mg/mL de AlClPc. ...Erro! Indicador não definido.
Figura 45: Imagem confocal de língua de hamster após administração tópica por 30 minutos de AlClPc livre em solução. ...Erro! Indicador não definido.
Figura 46: Aspecto macroscópico (A) e microscópico (B e C) de bolsa jugal de hamster.. ... Erro!
Indicador não definido.
Figura 47: Aspecto macroscópico (A) e microscópico (B e C) de bolsa jugal de hamster com leucoplasia induzida pela aplicação de 9,10-dimetil-1,2-benzantraceno (DMBA).Erro! Indicador
Figura 48: Perfil de permeação in vitro de AlClPc livre em solução e em NE aniônica através da mucosa da bolsa jugal de hamster com leucoplasia. ...Erro! Indicador não definido.
Figura 49: Corte histológico de bolsa com leucoplasia após experimento de permeação corado com HE...Erro! Indicador não definido.
LISTA DE TABELAS
Tabela 1: Principais fotossensitizadores usados clinicamente ... 7
Tabela 2: Principais sistemas de vetorização utilizados na incorporação do AlClPc ... 14
Tabela 3:Preparo de amostras de nanocápsulas de PLA e PLA-PEG contendo AlClPc utilizadas no teste de atividade hemolítica ... 29
Tabela 4: Comparação do diâmetro médio, índice de polidispersão e potencial zeta de NC convencionais (PLA)e peguiladas (PLA-PEG) contendo AlClPc ...Erro! Indicador não definido.
Tabela 5: Eficiência de encapsulação, porcentagem de fármaco precipitado na suspensão coloidal e rendimento de encapsulação de AlClPc em formulações de NC convencional e
peguilada ...Erro! Indicador não definido.
Tabela 6: Comparação do diâmetro médio e potencial zeta de NE produzidas com diferentes lipídeos catiônicos ...Erro! Indicador não definido.
Tabela 7: Comparação do diâmetro médio e potencial zeta de NC produzidas com diferentes lipídeos catiônicos ...Erro! Indicador não definido.
Tabela 8:pH antes e após diálise de NC e NE produzidas com diferentes lipídeos catiônicos Erro!
Indicador não definido.
Tabela 9: Eficiência de encapsulação, porcentagem de fármaco precipitado na suspensão coloidal e rendimento de encapsulação de AlClPc nas diferentes formulações de NE ... Erro!
Indicador não definido.
Tabela 10: Eficiência de encapsulação, porcentagem de fármaco precipitado na suspensão coloidal e rendimento de encapsulação de AlClPc nas diferentes formulações de NC ... Erro!
Indicador não definido.
Tabela 11: Parâmetros de permeação de AlClPc através da mucosa da bolsa jugal de hamster com leucoplasia ...Erro! Indicador não definido.
LISTA DE ABREVIATURAS ALA = Ácido aminolevulínico
AlClPc = Cloro-alumínio ftalocianina ANOVA = Análise de variância
CLAE = Cromatografia Líquida de Alta Eficiência DA = Dodecilamina
DMA = N,N-dimetil-acetamida
DMBA = 7, 12- dimetil-benzoantraceno DP = Desvio Padrão
EP = Erro Padrão
EPR = Efeito de permeabilidade e retenção aumentada FS = Fotosensitizador
HpD = Derivados Hematoporfirínicos i.v. = intravenosa
LO = Leucoplasia oral
MET = Microscopia eletrônica de transmissão MFA = Microscopia de força atômica
NC = Nanocápsulas NE = Nanoemulsão NP = Nanopartículas NS = Nanoesferas
OMS = Organização Mundial de Saúde PBS = Tampão fosfato- salina
Pc = ftalocianina
PEG = Polietilenoglicol pH = Potencial hidrogeniônico PI = Índice de Polidispersão PLA = Ácido poli-D,L-láctico PM = Peso molecular (g/mol) p/p = peso por peso
p/v = peso por volume v/v = volume por volume R2 = Coeficiente de correlação ROS = espécies reativas de oxigênio rpm =Rotações por minuto
SA= Estearilamina SC = subcutânea
SMF = Sistema Mononuclear Fagocitário TFD = Terapia Fotodinâmica
SUMÁRIO
INTRODUÇÃO ... 1
CAPÍTULO 1: REVISÃO DA LITERATURA ... 5
1.1. TERAPIA FOTODINÂMICA ... 6
1.2. FOTOSSENSIBILIZADORES ... 10
1.3. NANOSISTEMAS CONTENDO AlClPc ... 12 OBJETIVOS ... 17
OBJETIVO GERAL: ... 18
OBJETIVOS ESPECÍFICOS ... 18
CAPÍTULO 2: CARACTERIZAÇÃO, PERFIL DE LIBERAÇÃO E ATIVIDADE
HEMOLÍTICA DE NANOCÁPSULAS CONTENDO AlClPc ... 20
INTRODUÇÃO ... 21
MATERIAL E MÉTODOS ... 24
2.1. MATERIAIS ... 24
2.2. PREPARAÇÃO DE NANOCÁPSULAS CONVENCIONAIS E PEGUILADAS 24
2.3. DISTRIBUIÇÃO DE TAMANHO E POTENCIAL ZETA ... 25
2.4. DETERMINAÇÃO DO TEOR DE AlClPc POR CROMATOGRAFIA LÍQUIDA
DE ALTA EFICIÊNCIA COM DETECÇÃO POR FLUORESCÊNCIA ... 26 2.5. LIBERAÇÃO DO AlClPc DAS NANOCÁPSULAS CONVENCIONAIS E
PEGUILADAS ... 28
2.6. TESTE DE ATIVIDADE HEMOLÍTICA DAS NANOCÁPSULAS
CONVENCIONAIS E PEGUILADAS ... 28
RESULTADOS E DISCUSSÃO ... 30
2.8. PORCENTAGEM E EFICIÊNCIA DE ENCAPSULAÇÃOErro! Indicador não
definido.
2.9. LIBERAÇÃO DO AlClPc DAS NANOCÁPSULAS CONVENCIONAIS E
PEGUILADAS ...Erro! Indicador não definido. 2.10. TESTE DE ATIVIDADE HEMOLÍTICA DAS NANOCÁPSULAS
CONVENCIONAIS E PEGUILADAS ...Erro! Indicador não definido. CAPÍTULO 3: AVALIAÇÃO HISTOPATOLÓGICA E MORFOMÉTRICA DE
NANOCÁPSULAS CONTENDO AlClPc NO TRATAMENTO EXPERIMENTAL DE
LESÃO MALIGNA ... 41
INTRODUÇÃO ... 42
MATERIAIS E MÉTODOS ... 44
3.1. ATIVIDADE FOTODINÂMICA IN VIVO ... 44 3.1.1. ANIMAIS EXPERIMENTAIS ... 44
3.1.2. MODELO EXPERIMENTAL DE TUMOR SÓLIDO ... 44
3.1.3. TRATAMENTO ... 45 3.1.4. ANÁLISE HISTOPATOLÓGICA E MORFOMÉTRICA DOS TUMORES APÓS
TERAPIA FOTODINÂMICA ... 46
3.2. IDENTIFICAÇÃO DA PRESENÇA DE AlClPC NOS TECIDOS TUMORAIS
POR MICROSCOPIA CONFOCAL ... 47
3.3. ANÁLISE ESTATÍSTICA ... 48
RESULTADOS E DISCUSSÃO ... 48
3.4. ANÁLISE HISTOPATOLÓGICA E MORFOMÉTRICA DOS TUMORES APÓS
TERAPIA FOTODINÂMICA ...Erro! Indicador não definido.
3.5. IDENTIFICAÇÃO DA PRESENÇA DE AlClPc NOS TECIDOS TUMORAIS
CAPÍTULO 4: DESENVOLVIMENTO E CARACTERIZAÇÃO DE NANOCARREADORES
CATIÔNICOS CONTENDO AlClPc PARA O TRATAMENTO EXPERIMENTAL DA
LEUCOPLASIA ORAL... 61
INTRODUÇÃO ... 62
MATERIAL E MÉTODOS ... 65
4.1. MATERIAIS ... 65
4.2. PREPARAÇÃO DE NANOCÁPSULAS ANIÔNICAS E CATIÔNICAS ... 65
4.3. PREPARAÇÃO DE NANOEMULSÕES ANIÔNICAS E CATIÔNICAS ... 66
4.4. CARACTERIZAÇÃO FÍSICO-QUÍMICA ... 67
4.5. ANÁLISE MORFOLÓGICA... 67
4.6. DETERMINAÇÃO DO pH ... 67
4.7. ESTUDO DE PENETRAÇÃO IN VIVO ... 68
4.8. ESTUDO DE PENETRAÇÃO IN VIVO POR MICROSCOPIA CONFOCAL ... 71
4.9. ESTUDO DE PERMEAÇÃO E RETENÇÃO IN VITRO EM MUCOSA DA
BOLSA JUGAL DE HAMSTER COM LEUCOPLASIA ... 72
4.8.1. INDUÇÃO DA LEUCOPLASIA EM BOLSA JUGAL DE HAMSTER ... 73
4.8.2. ESTUDO DE PERMEAÇÃO IN VITRO ... 74
4.8.3. ESTUDO DE RETENÇÃO IN VITRO ... 75
4.10. ANÁLISE ESTATÍSTICA ... 76
RESULTADOS E DISCUSSÃO ... 77
4.11. CARACTERIZAÇÃO FISICO-QUÍMICA ... 77
4.12. PORCENTAGEM E EFICIÊNCIA DE ENCAPSULAÇÃOErro! Indicador não
definido.
4.13. ANÁLISE MORFOLÓGICA...Erro! Indicador não definido.
4.14. LIBERAÇÃO DO AlClPc DAS NANOESTRUTURAS CATIÔNICAS ... Erro!
4.15. TESTE DA ATIVIDADE HEMOLÍTICA DAS NANOESTRUTURAS
CATIÔNICAS ...Erro! Indicador não definido.
ESTUDO DE PENETRAÇÃO IN VIVO E ESTUDOS DE PERMEAÇÃO E RETENÇÃO
IN VITRO ...Erro! Indicador não definido. 4.16. ESTUDO DE PENETRAÇÃO IN VIVO ...Erro! Indicador não definido. 4.17. MICROSCOPIA CONFOCAL DE BOLSA JUGAL E LÍNGUA DE HAMSTER
APÓS ESTUDO DE PENETRAÇÃO IN VIVO ...Erro! Indicador não definido.
4.18. ESTUDO DE PERMEAÇÃO E RETENÇÃO IN VITRO EM BOLSA JUGAL
DE HAMSTER COM LEUCOPLASIA ...Erro! Indicador não definido.
DISCUSSÃO GERAL ... 118
CONCLUSÕES ... 125
2 INTRODUÇÃO
As indicações clínicas para terapia fotodinâmica (TFD) têm sido amplamente divididas em indicações para tratamento de alterações malignas e não-malignas (Chatterjee et al., 2008). As lesões neoplásicas, entretanto, foram o primeiro alvo da
TFD e, ao longo das três últimas décadas, essa terapia tem se mostrado eficaz na fase inicial de câncer de pulmão (Kato et al., 1998), câncer de bexiga (Skyrme et al., 2005),
cabeça e pescoço (Schuller et al., 1985), além de ser indicada no tratamento do câncer
de pele (Rhodes et al., 2004). A TFD baseia-se na aplicação tópica ou sistêmica de um
composto fotossensibilizador (FS) que, após ser irradiado, utilizando-se uma fonte de luz de comprimento de onda adequado e na presença de oxigênio, leva a formação de oxigênio singleto (1O2) e espécies reativas de oxigênio que podem oxidar lipídios, aminoácidos e proteínas induzindo necrose e apoptose (Chatterjee et al., 2008).
A cloro alumínio ftalocianina (AlClPc), fotossensibilizador de segunda-geração, apresenta diversas vantagens quanto ao seu emprego na terapia fotodinâmica. Entre as principais vantagens desse fotossensibilizador encontra-se o fato de se tratar de um composto com tempo de vida longo nos estados excitados singleto e tripleto, elevado rendimento quântico nesses estados e, consequentemente, elevada atividade fotoquímica e fotodinâmica em relação aos compostos de primeira geração, tais como os derivados hematoporfirínicos (Anand et al., 2012), a exemplo do ácido aminolevulínico (ALA),
um pró-fármaco. O ALA é um aminoácido que ocorre naturalmente e é convertido enzimaticamente a protoporfirina (PpIX) (Lopez et al., 2004). O AlClPc apresenta,
3 luz solar, o que é uma grande vantagem desta substância. O AlClPc é um composto encontrado comercialmente com alta pureza, bem caracterizado, muito estável quimicamente e apresenta muito baixa citotoxicidade na ausência de luz (Nunes et al.,
2004 e De Paula, 2008). Contudo, apesar de suas vantagens, a sua utilização na TDF é limitada pela sua baixa solubilidade em água e em solventes aceitos na composição de medicamentos adequados para administração sistêmica, tópica ou parenteral.
Uma forma efetiva de se contornar os problemas de solubilidade/dispersibilidade em água é a associação do AlClPc a carreadores coloidais, como os lipossomas (Nunes
et al., 2004; Tapajós et al., 2008 e Longo et al., 2009), as NE (Siqueira, et al., 2010 e
Rodrigues et al., 2012) e as nanopartículas poliméricas, como as nanoesferas (NS) (De
Paula, 2008) e as NC (Siqueira, et al., 2010; Oliveira et al., 2011 e De Paula , 2008).
A incorporação da AlClPc às nanocápsulas convencionais e modificadas pelo PEG, mostrou-se uma alternativa eficaz na obtenção de formulações endovenosas desse composto, conforme descrevemos anteriormente em nosso grupo (De Paula, 2008). As nanopartículas obtidas apresentaram características físico-químicas adequadas, elevada porcentagem de encapsulação, perfil de liberação sustentada e melhora nas características fotofísicas do fotossensibilizador, aumentando seu tempo de vida no estado tripleto e o rendimento quântico nesse estado, além de melhorar a atividade fotodinâmica in vitro (De Paula., 2008) em relação ao composto livre. Entretanto, faz-se
necessário ainda o desenvolvimento de vetores que permitam também aumentar a permeação desse composto pela aplicação tópica, o que geralmente não é conseguido de maneira eficaz com nanopartículas poliméricas que em geral apresentam limitada permeação nesses tecidos (Watkinson et al., 2013), embora este tema seja muito
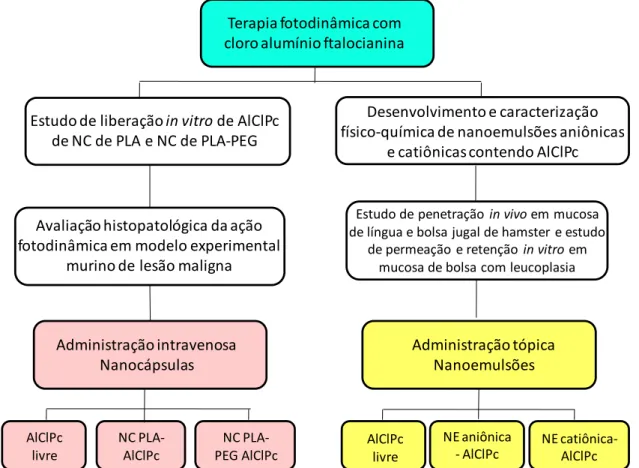
4 Diante do exposto, o presente trabalho teve como objetivo a investigação histopatológica e morfométrica da ação fotodinâmica das NC convencionais e com a superfície modificada pelo PEG para administração endovenosa em modelo experimental murino de lesão maligna (tumor sólido de Ehrlich), visando aprofundar estudos anteriores de eficácia (De Paula, 2008). E, como um segundo objetivo deste trabalho, o desenvolvimento de sistemas carreadores mais adequados à utilização tópica. Para tal, desenvolveu-se NE aniônicas e catiônicas de forma a potencializar os efeitos fototóxicos do AlClPc no tratamento local de lesões potencialmente malignas da cavidade oral, especialmente destinados ao tratamento clínico futuro da leucoplasia, lesão cancerizável mais freqüente da cavidade bucal e que apresenta-se como uma mancha ou placa branca na mucosa, não removível à raspagem e que não pode ser caracterizada clínica ou patologicamente como outra enfermidade (Warnakulasuriya et al., 2007). O esquema apresentado na Figura 1 sumariza os objetivos deste trabalho.
AlClPc livre
Terapia fotodinâmica com cloro alumínio ftalocianina
NC PLA-AlClPc
Avaliação histopatológica da ação fotodinâmica em modelo experimental
murino de lesão maligna
Estudo de penetração in vivo em mucosa de língua e bolsa jugal de hamster e estudo
de permeação e retenção in vitroem mucosa de bolsa com leucoplasia
Administração tópica Nanoemulsões NC PLA-PEG AlClPc Administração intravenosa Nanocápsulas NE aniônica - AlClPc NE catiônica-AlClPc AlClPc livre
Desenvolvimento e caracterização físico-química de nanoemulsões aniônicas
e catiônicas contendo AlClPc Estudo de liberação in vitrode AlClPc
de NC de PLA e NC de PLA-PEG
6
1.1.TERAPIA FOTODINÂMICA
Embora subseqüentemente utilizada para uma série de aplicações, o conceito de TFD iniciou-se em 1900, através da observação por Raab da morte de microorganismos expostos à luz solar e ao ar na presença de certos corantes (Raab et. al., 1900). Essa
primeira observação foi um marco inicial para o que é atualmente conhecido como TFD. Entretanto, a primeira aplicação clínica das reações fotodinâmicas foi descrita por Von Trappeiner em 1903 no tratamento de carcinoma baso-celular (Von Trappeiner et al., 1903), utilizando a administração tópica de eosina combinada com a luz do sol para
o tratamento de pacientes com câncer de pele. Em 1950, com o objetivo de aumentar o acúmulo do corante no tecido tumoral, Lipson e colaboradores sintetizaram derivado hematoporfirínico, (HpD). Em 1961, esse corante foi utilizado também como um marcador fluorescente no diagnóstico de câncer (Lipson et al., 1961). Entretanto, a
compreensão dos mecanismos citotóxicos da TDF iniciou-se somente na década de 70, quando Dougherty e colaboradores relataram que a excitação do HpD com luz vermelha erradicou completamente o crescimento de tumor mamário de ratos (Dougherty et al.,
1975).Subsequentes triagens clínicas com utilização da HpD para tratamento de câncer de bexiga e pele foram também realizadas (Dougherty et al., 1978). O Photofrin®,
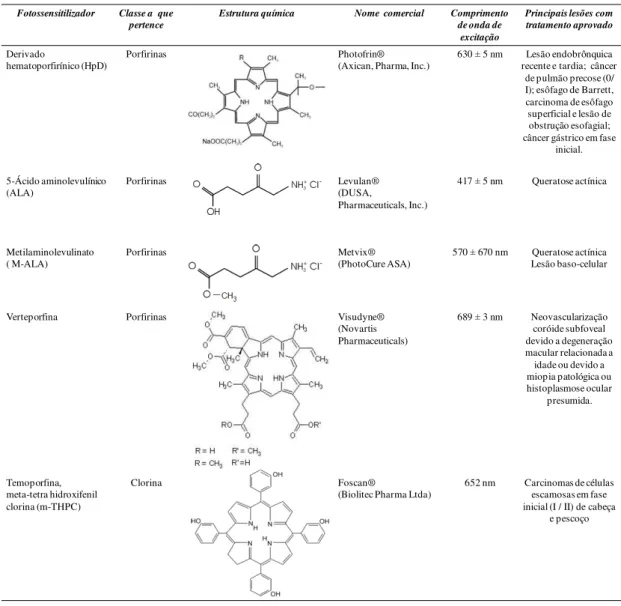
7 2008). Os principais compostos usados clinicamente na TFD estão apresentados na
Tabela 1.
Tabela 1: Principais fotossensitizadores usados clinicamente Fotossensitilizador Classe a que
pertence
Estrutura química Nome comercial Comprimento de onda de
excitação
Principais lesões com tratamento aprovado
Derivado
hematoporfirínico (HpD)
Porfirinas Photofrin®
(Axican, Pharma, Inc.)
630 5 nm Lesão endobrônquica recente e tardia; câncer
de pulmão precose (0/ I); esôfago de Barrett, carcinoma de esôfago superficial e lesão de obstrução esofagial; câncer gástrico em fase
inicial. 5-Ácido aminolevulínico (ALA) Porfirinas Levulan® (DUSA, Pharmaceuticals, Inc.)
417 5 nm Queratose actínica
Metilaminolevulinato ( M-ALA)
Porfirinas Metvix®
(PhotoCure ASA)
570 670 nm Queratose actínica Lesão baso-celular
Verteporfina Porfirinas Visudyne®
(Novartis Pharmaceuticals)
689 3 nm Neovascularização coróide subfoveal devido a degeneração macular relacionada a idade ou devido a miopia patológica ou histoplasmose ocular presumida. Temoporfina, meta-tetra hidroxifenil clorina (m-THPC) Clorina Foscan®
(Biolitec Pharma Ltda)
652 nm Carcinomas de células escamosas em fase inicial (I / II) de cabeça
e pescoço
Adaptado de Kawasi e Iseki, 2013 e Allison et al., 2004
8 seguintes etapas: excitação do composto fotossensibilizador, geração de espécies reativas de oxigênio e morte celular (Figura 2).
Local
Sistêmico Células
neoplásicas
Figura 2:Etapas da terapia fotodinâmica. Administração do fotossensibilizador (local ou sistêmica) (etapa I), acumulação na região tumoral (etapa II), ativação pela luz externa (etapa III) e dano e morte celular (etapa IV). (Adaptado de Chatterjee et al., 2008).
9 Figura 3: Modificação do diagrama de Jablonski utilizado para ilustração das reações fotoquímicas a partir da excitação de fotossensibilizadores (Adaptado de O’ Connor et al., 2009)
O fotossensibilizador excitado no estado tripleto possui um tempo de vida mais longo, suficiente para participar de reações químicas, assim, a ação fotodinâmica ocorre na maioria das vezes com o composto no estado tripleto. Portanto o tempo de vida no estado tripleto é uma das características importantes na escolha de um bom fotosensitizador, pois está relacionado diretamente ao seu efeito. Existem dois tipos de reações fotodinâmicas: reações do tipo I e reações do tipo II. Nas reações do tipo I, o fotossensibilizador no estado excitado, através de reações de transferência de átomos de hidrogênio ou de elétrons, interage diretamente com um substrato orgânico ou com outras moléculas vizinhas, principalmente O2, produzindo espécies radicais (Ochsner,
1997 e O’Connor et al., 2009). A maioria dos radicais formados reage imediatamente
com o O2 gerando várias espécies reativas de oxigênio (ROS), tais como o peróxido de hidrogênio (H2O2), radical superóxido (•O2) e o radical hidroxila (•OH) (Ochsner, 1997), os quais são capazes de oxidar uma variedade de biomoléculas (Ribeiro et al.,
10 responsável pela maioria das lesões geradas pela terapia fotodinâmica (Sharman et al.,2000; Nyman e Hynninem, 2004). Após transferir o excesso de energia, o
fotossensibilizador excitado retorna ao seu estado fundamental ou torna-se fotoquimicamente degradado, processo referido como fotobranqueamento. Ambos os tipos de reações fotodinâmicas causam a oxidação de biomoléculas celulares, como triacilgliceróis insaturados, colesterol, fosfolipídeos, aminoácidos, tais como tiptofano, histidina e metionina, e, também, bases de ácido nucléico como guanina (Nyman e Hynninem, 2004). A oxidação dessas moléculas leva à morte celular.
1.2.FOTOSSENSIBILIZADORES
Fotossensibilizadores (FS) são definidos como moléculas capazes de produzir oxigênio singleto após estímulo luminoso (Allison et al., 2008). A primeira geração de
compostos fotossensibilizadores foi constituída por derivados da hematoporfirina (HpD). Entretanto, os derivados hematoporfirínicos são uma mistura complexa de várias porfirinas parcialmente não identificadas e apresentam várias limitações na sua utilização. Primeiramente, esses compostos possuem um baixo coeficiente de extinção molar, o que requer uma administração em altas doses para a obtenção de uma resposta fototerapêutica satisfatória. Apresentam também pequena seletividade por tecidos doentes e absorção máxima em comprimentos de onda relativamente curtos (630 nm), o que leva a uma pobre penetração da luz pelos tecidos. Além disso, causam uma prolongada fotossensibilidade cutânea devido a elevada taxa de retenção na pele, o que limita sua aplicação clínica (O’ Connor et al., 2009). Para o emprego na terapia
11 pelas células-não-alvo e elevada capacidade de produção de oxigênio singleto (Allison e Sibata, 2010).
Compostos puros e bem caracterizados vêm sendo desenvolvidos com o intuito de solucionar os inconvenientes obtidos com derivados da hematoporfirina, como o Photofrin®. Para tal, várias modificações químicas no anel tetrapirrólico das porfirinas têm sido realizadas levando ao desenvolvimento de novas moléculas
fotossensibilizadoras consideradas de “segunda geração”. Os derivados porfirínicos, as
ftalocianinas, as naftalocianinas, as clorinas e as bacterioclorinas são exemplos de fotossensibilizadores de segunda geração. Entre os fotossensibilizantes de segunda geração mais promissores estão às ftalocianinas (Nunes et al., 2004). A estrutura
química das ftalocianinas é semelhante a das porfirinas. As ftalocianinas apresentam uma unidade cíclica tetrapirrólica com as unidades pirrólicas unidas por átomos de nitrogênio, sendo que a conjugação do macrociclo é estendida por anéis benzênicos sobre as quatro unidades pirrólicas, resultando em uma forte banda de absorção na região do vermelho do espectro visível (Figura 4). A absorção máxima desses compostos ocorre em comprimentos de onda maiores do que os das porfirinas (Garcia et al., 2003). O metal inserido no anel central do macrociclo das ftalocianinas determina as
propriedades fotofísicas desses compostos. A complexação das ftalocianinas com metais como zinco e alumínio resulta em complexos com alto rendimento quântico do estado tripleto e longo tempo de vida nesse estado, os quais são requeridos para uma eficiente fotossensibilização (Owens et al., 1998; Nunes et al., 2004; Ricci et al., 2006 e
De Paula, 2008). As ftalocianinas apresentam, também, alta absorção em comprimento de onda de 650-680 nm, faixa denominada como “janela terapêutica”, devido à ótima
12 geradores de oxigênio singleto; possuem rápida eliminação do corpo, o que reduz a ocorrência das reações adversas de fotossensibilidade e, finalmente, são compostos puros e bem caracterizados (Nunes et al., 2004e Garcia et al., 2003). Nesse trabalho, a
cloro alumínio ftalocianina (AlClPc), que apresenta as propriedades benéficas supracitadas, foi utilizada (Figura 4).
Cl Al N N N N N N N N
Figura 4: Estrutura química de cloro-alumínio ftalocianina
Entretanto, assim como a maioria dos fotossensibilizantes de segunda geração, a AlClPc é altamente lipofílica, praticamente insolúvel em água e em solventes fisiologicamente compatíveis. Para solucionar esse problema de solubilidade causado por sua elevada hidrofobicidade, a cloro alumínio ftalocianina foi avaliada incorporada em diferentes formulações nanoestruturadas (Nunes et al., 2004; Tapajós et al., 2008;
Longo et al., 2009, Siqueira-Moura, et al., 2010; Oliveira et al., 2011, Rodrigues et al.,2012 e De Paula, 2008).
13 A cloro alumínio ftalocianina é um composto altamente hidrofóbico, log P
estimado em 3,86 (ChemAxon software) e, embora sua natureza lipofílica seja uma característica importante, facilitando sua passagem através das membranas celulares, sua baixa solubilidade em água dificulta, entretanto, sua administração sistêmica e sua aplicação médica. Dessa forma, o desenvolvimento de sistemas de vetorização, como lipossomas, nanopartículas poliméricas, microesferas para carreamento dessa molécula até as células alvo é uma estratégia importante, a qual possibilita também a utilização do AlClPc por diferentes vias de administração.
Outra razão para a utilização da vetorização do AlClPc é permitir que este seja administrado em sua forma monomérica, uma vez que devido a estrutura química, a maioria das ftalocianinas (Fc) tende a se agregar em meio aquoso de forma a diminuir o contato das moléculas hidrofóbicas com a água (Rosenthal et al.,1991). Este estado
agregado é um dos fatores determinantes que podem influenciar na eficácia do fármaco
in vivo diminuindo sua biodisponibilidade e limitando sua capacidade de absorver a luz
(Brasseur et al., 1988;Isele et al., 1995; Rossetti et al., 2011).
Várias são as características desejáveis para o sistema de vetorização ideal para a terapia fotodinâmica. Entre elas tem-se a necessidade de que o vetor seja capaz de acumular seletivamente o FS no tecido doente em concentrações terapêuticas e, ao mesmo tempo, impedir ou diminuir a captura desse composto pelas células ou órgãos sadios. Os vetores devem também ser capazes de incorporar o FS sem a perda ou alteração de sua atividade. Além de serem biodegradáveis e não alergênicos (Paszko et al., 2011). Na Figura 5 tem-se uma representação esquemática dos principais vetores
14 _ _ _ _ _ _ AlClPc Polietilenoglicol (PEG) Fosfolipídios Ligantes Lipídios catiônicos PC Lecitina Poloxamer
Figura 5: Desenho esquemático da organização física e estrutural de alguns vetores principais para cloro-alumínio ftalocianina.
Tabela 2: Principais sistemas de vetorização utilizados na incorporação do AlClPc
Vetor Efeitos observados Referência
Micelas poliméricas pH sensíveis
Apresentaram maior fototoxicidade in vitro contra
células de tumor mamário EMT-6 que a formulação em cremophor.
In vivo, apresentaram eficácia semelhante a da
formulação em CRM contra tumor EMT-6.
Taillefer et al., 2001
Lipossomas A associação do AlClPc com proteínas plasmáticas aumentou após a sua incorporação a lipossomas unilamelares pequenos.
Nunes et al., 2004
Lipossomas Redução de 95% da viabilidade celular de células de carcinoma oral, sendo que a destruição das células neoplásicas foi predominantemente iniciada por processo necrótico.
15 Lipossomas Terapia fotodinâmica com lipossomas contendo
AlClPc induziu a 90% de necrose no tumor de Ehrlich implantado em língua de camundongos swiss.
Longo et al., 2009
Lipossomas Completa remissão de tumor de língua e inibição de metástase para região de linfonodos. Inibição de metástase confirmada por análise histopatológica e imunohistoquímica.
Bicalho et al., 2013
Nanoemulsão e Nanocápsulas
Validação de método espectrofotométrico e espectrofluorimétrico para dosagem de AlClPc em nanocarreadores.
Siqueira-Moura et
al., 2010
Nanocápsulas (PLA, PLA-PEG e PLA-CS)
Validação de método cromatográfico para quantificação de AlClPc em nanopartículas, em plasma e tecidos.
Oliveira et al., 2011
Nanoemulsão Apresentaram atividade fotodinâmica in vitro contra
células de Cryptococcus neoformans, reduzindo em
mais de 6 log a sobrevivência das células.
Rodrigues et al., 2012
Nanocápsulas poliméricas (PLGA)
Apresentaram atividade fototóxica contra células de melanoma maligno humano empregadas em baixas doses de AlClPc e luz.
Siqueira-Moura et
al., 2013
Nanocápsulas (PLA, PLA-PEG e PLGA) Nanoesferas (PLA)
Apresentaram melhora das propriedades fotofísicas e fototóxicas in vitro quando comparado ao AlClPc
livre.
De Paula et al., 2013
Nanopartículas de poli(vinil metil
éter-co-anidrido maléico)
Apresentaram atividade fotodinâmica in vitro contra
cálulas de carcinoma mamário murino 4T1 e contra células de adenocarcinoma mamário humano MCF-7.
Muehlmann et al., 2014
Complexos policatiônicos ou coacervatos
(PEI-HSA)
Foram obtidas dispersões estáveis e com exelente eficiência de encapsulação.
Siqueira-Moura et
18 OBJETIVO GERAL:
Avaliar, por análise histopatológica e morfométrica, a ação fotodinâmica da AlClPc encapsulada em nanocápsulas convencionais e peguiladas administradas por via endovenosa em modelo experimental murino de tumor subcutâneo. E, desenvolver e caracterizar nanoemulsões aniônicas e catiônicas contendo AlClPc. Avaliar também as formulações desenvolvidas quanto sua capacidade de permeação in vitro e penetração in vivo em mucosa de hamster, visando sua futura utilização tópica no tratamento de lesões
potencialmente malignas da boca.
OBJETIVOS ESPECÍFICOS:
- Desenvolver nanoemulsões e nanocápsulas catiônicas contendo AlClPc a partir dos lipídios catiônicos estearilamina e dodecilamina;
- Caracterizar as novas nanoestruturas desenvolvidas quanto ao tamanho, índice de
polidispersão, potencial zeta, aspectos morfológicos e quanto à capacidade de encapsulação de AlClPc;
- Estudar o perfil de liberação do AlClPc das nanoestruturas convencionais, peguiladas e catiônicas, comparando-os com o perfil de dissolução do AlClPc livre;
- Avaliar a atividade hemolítica das formulações convencionais, peguiladas e catiônicas comparativamente ao AlClPc livre;
- Avaliar a atividade fotodinâmica in vivo do AlClPc por meio de estudo histopatológico
quanto à morte celular induzida em modelo murino de tumor sólido de Ehrlich após terapia fotodinâmica com as diferentes formulações nanométricas;
19 - Avaliar, por meio da dosagem do fotossensibilizador por HPLC-FL, a penetração in vivo das formulações de nanoemulsões aniônica e catiônicas contendo AlClPc em
mucosa de língua de hamster sadio.
-Estudar a permeação e retenção in vitro do AlClPc livre em solução e incorporado a
21 INTRODUÇÃO
Sistemas de liberação de fármacos têm sido desenvolvidos nas últimas décadas com intuito de controlar a liberação e vetorizar compostos a locais específicos do organismo. O uso de carreadores, tais como nanopartículas, micropartículas e lipossomas, permite modular a liberação e a distribuição do fármaco, constituindo uma importante ferramenta no desenvolvimento de medicamentos. Contudo a rápida captura pelas células do sistema fagocitário mononuclear (SFM) é um fator limitante para o sucesso desses carreadores. Assim, o desenvolvimento de sistemas estericamente estabilizados, também denominados sistemas peguilados, ou com a superfície modificada (Figura 6), parece ser bastante vantajoso, visto que esses sistemas podem permanecer mais tempo na circulação sanguínea, permitindo que o fármaco encapsulado seja liberado lentamente no compartimento sanguíneo ou em tecidos altamente vascularizados (Mosqueira et al., 2001a; Maeda, 2010).
A ligação covalente de cadeias hidrofílicas de PEG à superfície das nanocápsulas possibilita a hidrofilização da partícula como um todo por solvatação (Figura 6). Logo, ao serem injetadas pela via intravenosa, apresentam menor opsonização, escapando do rápido reconhecimento e captura pelas células do SFM (Mosqueira et al., 2001 e 2001a, Gref et al., 1994 e 1995). Dessa forma, a circulação
sanguínea mais prolongada determina também maior captação das nanoestruturas peguiladas em tecidos tumorais, pois o efeito de permeação e retenção apresenta-se
aumentado nesses tecidos (“EPR effect”), devido ao aumento da permeabilidade capilar
22 Direcionamento vascular ativo Direcionamento tumoral ativo Direcionamento passivo
NPs direcionadas NPs não-direcionadas
Figura 6: Diferentes tipos de interações entre nanocarreadores e tecido tumoral por meio do efeito de permeação e retenção aumentada nos tumores (“EPR effect”), mostrando as estratégias de direcionamento ativo e passivo dos nanovetores. Fonte: Adaptado de Farokhzad and Langer, 2009.
A cloro alumínio ftalocianina (AlClPc) é um composto fotossensibilizador promissor para a terapia fotodinâmica, entretanto, é altamente lipofílico e, embora isso facilite sua passagem através das membranas celulares, sua baixíssima solubilidade em água impede sua administração sistêmica, principalmente pela via endovenosa. Para solucionar essa limitação, nanocápsulas convencionais e peguiladas contendo AlClPc foram recentemente desenvolvidas e caracterizadas por De Paula et al., 2008. Essas
nanoestruturas apresentaram propriedades físico-químicas adequadas à administração endovenosa, elevada porcentagem de encapsulação e melhora nas características fotofísicas do fotossensibilizador, aumentando seu tempo de vida no estado tripleto e seu rendimento quântico nesse estado. Além disso, apresentaram melhor atividade fotodinâmica in vitro em cultivo de fibroblastos que o AlClPc em sua forma livre (De
24 MATERIAL E MÉTODOS
2.1. MATERIAIS
Foram utilizados os seguintes reagentes: AlClPc, Cloro (29H, 31H-ftalocianato) de alumínio (Aldrich Chemical Company Inc., Milwaukee, EUA), fosfolípide de soja (lecitina com fosfatidilcolina ~70%) (Epikuron 170®, Lucas Meyer, França), Miglyol 810® N (triglicerídeo dos ácidos cáprico/caprílico) (Hulls, Alemanha), poloxamer 188, (Aldrich, EUA), ácido poli-D,L-láctico (PLA) de PM 42.500 g/mol (Phusis, France) e
PM 75.000 g/mol (Sigma-Aldrich, EUA), PLA-PEG (Mn 66.000 g/mol copolimerizado com PEG 5.000 g/mol) (Alkermes, EUA), n-octanol (Spectrum®, Brasil), acetonitrila grau CLAE, etanol grau CLAE (Tedia, Brasil), metanol grau CLAE, dimetilformamida grau CLAE (Sigma-Aldrich, EUA), acetona, diclorometano (Ecibra®, CETUS, Brasil), glicose, N, NN-dimetilacetamida (DMA) (VETEC, Brasil), PEG 300 (Synth, Brasil). A água de qualidade MilliQ foi purificada no sistema Symplicity/System 185 (Millipore®, EUA).
2.2. PREPARAÇÃO DE NANOCÁPSULAS CONVENCIONAIS E PEGUILADAS
Nanocápsulas convencionais (NC de PLA) foram preparadas pelo processo de deposição interfacial de um polímero pré-formado, descrito por Fessi et al., 1989 e
25 de óleo (Miglyol, 810N). Essa solução foi vertida em uma solução aquosa (10 mL) contendo 75mg de Poloxamer 188, também em agitação magnética. A mistura resultante foi mantida sob agitação por mais 10 minutos para permitir a formação das NC. Posteriormente, o excesso de solvente foi evaporado a pressão reduzida em
rotavapor (Heidolph Instruments, Alemanha) em uma temperatura máxima de 45˚C.
Para obtenção das formulações de NC contendo fármaco, foi necessário adicionar etanol na fase orgânica, devido a baixa solubilidade do AlClPc em acetona (De Paula, 2008). Nanocápsulas com superfície modificada (NC de PLA-PEG) contendo AlClPc também foram preparadas pelo método descrito por De Paula, 2008, o qual é semelhante ao descrito anteriormente, entretanto, utilizando-se de 75 mg do copolímero PLA-PEG na ausência do poloxamer. As NC de PLA e NC de PLA-PEG foram preparadas contendo AlClPc na concentração de 0,2mg/ml.
2.3. DISTRIBUIÇÃO DE TAMANHO E POTENCIAL ZETA
26 2.4. DETERMINAÇÃO DO TEOR DE AlClPc POR CROMATOGRAFIA LÍQUIDA DE ALTA EFICIÊNCIA COM DETECÇÃO POR FLUORESCÊNCIA
A porcentagem e a eficiência de encapsulação foram determinadas por Cromatografia Líquida de Alta Eficiência (CLAE) utilizando o método analítico validado por Oliveira et al., 2011 para quantificação do teor de cloro alumínio
ftalocianina contido em nanopartículas poliméricas.
CONDIÇÕES CROMATOGRÁFICAS
Foi utilizado o módulo de separação Alliance Waters e2695 acoplado ao detector
de fluorescência Multi λ Waters 2475. A coluna utilizada da marca Phenomenex®,
modelo Gemini 5μ C18(2), de 150 mm de comprimento e 4,60 mm de diâmetro interno,
contendo partículas de 5 μm e pré-coluna também da marca Phenomenex®, modelo
AJ0-4287 C18, de 0,5 cm de comprimento 4,6 mm de diâmetro interno, contendo
partículas de 5 μm. Como fase móvel, foi utilizada a mistura de metanol,
dimetilformamida (DMF) e acetona, na proporção de 90:5:15 (v/v/v). A fase móvel foi filtrada em membrana de acetato de celulose, com 47 mm de diâmetro e poro de 0,22
μm e, para degaseificar, levada ao banho ultrassônico por trinta minutos. O fluxo e
temperatura utilizados foram de 1,0 mL/min e 30°C, respectivamente. Para análise
foram injetados 10 μL de cada amostra e o tempo de corrida de cada amostra foi de 7
minutos. O comprimento de onda empregado no detector de fluorescência foi de 610 nm para excitação e 675 nm para emissão.
27 A porcentagem de encapsulação objetiva determinar o teor de fármaco incorporado às nanoestruturas em relação ao total de fármaco na formulação, conforme descrito por De Paula., 2008. A porcentagem foi calculada pela diferença entre a quantidade total de AlClPc na suspensão coloidal após a retirada do precipitado grosseiro da formulação, por meio da filtração em membrana de 0,8 µm (Millex®-Millipore), e a quantidade de AlClPc livre solúvel na fase aquosa externa, dividida pela quantidade total de AlClPc na suspensão após a filtração x 100.
A porcentagem de encapsulação foi calculada pela seguinte fórmula:
% encapsulação = (fármaco total na suspensão após filtração (mL) - fármaco no ultrafiltrado (mL)) x 100
fármaco total na suspensão após filtração (mL)
O AlClPc total, após filtração, foi determinado pela completa dissolução de 400µL da suspensão de nanocarreadores, após filtração em 0,8µm, em acetonitrila/etanol (1:1). O AlClPc livre solúvel na fase externa aquosa foi obtido pelo método de ultrafiltração/centrifugação de 400 µL da suspensão de nanoestruturas a 500 × g por 30 minutos em unidades AMICON (membranas MICROCON de 100.000Da,
Millipore®). A quantidade de AlClPc ligado a membrana foi determinado após a ultrafiltração/centrifugação. Para isso, a membrana do AMICON foi retirada, lavada com água MiliQ, imersa em 500µL de etanol/acetonitrila (1:1), levada ao vórtex por 15 minutos, centrifugada e o AlClPc dosado no sobrenadante.
A eficiência de encapsulação (ou rendimento de encapsulação) das nanoestruturas foi calculada pela quantidade de AlClPc encapsulado em 400µL de formulação dividido pela quantidade de AlClPc pesado colocado em 400µL de formulação x 100. A eficiência de encapsulação foi calculada, portanto, pela seguinte fórmula:
Eficiência de Encapsulação = Quantidade total de fármaco encapsulado (mL) x 100
28 2.5. LIBERAÇÃO DO AlClPc DAS NANOCÁPSULAS CONVENCIONAIS E
PEGUILADAS
No doseamento do AlClPc foram utilizadas as mesmas colunas e pré-colunas e mesmas condições cromatográficas citadas anteriomente (secção 2.4). O método adotado para o estudo de liberação da AlClPc das NC de PLA e NC de PLA-PEG foi o
“external sink” descrito anteriormente por Chorny et al., 2002.A liberação foi realizada
em condições sink sendo o n-octanol utilizado como meio externo de liberação, devido à
sua lipofilicidade semelhante à das membranas biológicas. As formulações de NC foram primeiramente filtradas em membrana 0,8 µm (Millex®-Millipore) para retirar o AlClPc precipitado da formulação. Em seguida, alíquotas de 0,5 mL de formulação contendo 0,2 mg/mL de AlClPc foram colocadas em tubos de ensaio, e 1,5 mL de n
-octanol foi adicionado em cada tubo. Os tubos de ensaio foram imersos em banho de
água a 37˚C com agitação. Em determinados intervalos de tempo, três tubos de cada
formulação foram retirados e centrifugados a 5900 × g por 5 minutos. O sobrenadante
foi então separado e o AlClPc liberado dosado por CLAE com detecção por fluorescência. A liberação do AlClPc das nanoestruturas foi acompanhada por um período de 168 horas ou 7 dias. A dissolução do AlClPc livre em meio sink de n-octanol
foi realizada como controle, respeitando-se as mesmas condições descritas para o AlClPc encapsulado.
2.6. TESTE DE ATIVIDADE HEMOLÍTICA DAS NANOCÁPSULAS CONVENCIONAIS E PEGUILADAS
29 AlClPc livre (em solução de DMA:PEG 300 (2:3) diluído 5 vezes em glicose 5%), das formulações de NC PLA e NC PLA-PEG, sendo que em todas as formulações o AlClPc apresentava-se na concentração de 0,2 mg/mL.
Amostras de sangue total periférico humano foram coletadas em tubo contendo citrato de sódio como anticoagulante. A partir do sangue total, um concentrado de hemácias foi adquirido por meio da centrifugação do sangue a uma velocidade de 800 ×
g durante 15 minutos. O sobrenadante foi retirado e três lavagens foram realizadas com
tampão fosfato-salina (PBS), para a retirada de traços de plasma e de outras impurezas. As hemácias obtidas foram ressuspendidas em PBS de modo que a concentração de células resultante apresentasse uma absorbância 0,4 a 540 nm.
As formulações contendo 0,2 mg/mL de AlClPc foram adicionadas em PBS nas diluições de 1:20, 1:30, 1:40, 1:50, 1:100 e 1:200 para obtenção do branco. As amostras também foram preparadas nas diluições de 1:20, 1:30, 1:40, 1:50, 1:100 e 1:200, segundo o Tabela 3.
Tabela 3:Preparo de amostras de nanocápsulas de PLA e PLA-PEG contendo AlClPc
utilizadas no teste de atividade hemolítica
Fator de diluição da formulação
Volume de formulação (µL)
Volume de PBS (µL)
Volume da suspensão de
hemáciasa (hemácias + PBS)
(µL)
1:20 50 50 900
1:30 33 67 900
1:40 25 75 900
1:50 20 80 900
1:100 10 90 900
1:200 5 95 900
a
Suspensão de hemácias com absorbância 0,4 a 540 nm
30 hemólise em todos os experimentos foi de 1,0 mL. Os brancos, amostras e controles positivo e negativo preparados foram incubados por 30 minutos a 37°C. Após incubação, os mesmos foram resfriados em banho de gelo e levados para centrifugação a 800 × g por 10 minutos. O sobrenadante obtido foi lido em espectrofotômetro no
comprimento de onda de 540 nm contra o branco. Antes da leitura no espectrofotômetro, as suspensões coloidais foram removidas das amostras e do branco por filtração em 0,22 µm (Milex, Millipore) para se evitar a interferência da turbidez dos sistemas coloidais nanoestruturados.
A porcentagem de hemólise foi calculada utilizando-se a equação abaixo: % hemólise = (T – T0/ T100) × 100
Sendo T = Densidade ótica obtida para amostra, T0 = Densidade ótica do controle negativo, T100 = Densidade ótica do controle positivo
RESULTADOS E DISCUSSÃO
42 INTRODUÇÃO
A terapia fotodinâmica causa à morte celular através da produção de espécies reativas de oxigênio, principalmente oxigênio singleto, os quais podem levar a necrose ou apoptose. Oxigênio singleto e outras espécies reativas de oxigênio são oxidantes poderosos que podem reagir com triacilgliceróis insaturados, colesterol, fosfolipídeos, aminoácidos, tais como tiptofano, histidina e metionina, e, também, bases de ácido nucléico como guanina (Nyman e Hynninem, 2004). O oxigênio singleto, principal agente citotóxico formado na terapia fotodinâmica, apresenta um curto tempo de vida em sistemas biológicos e, conseqüentemente, um raio de ação de apenas 0,02µm (Moan e Berg, 1991), o que implica que o local inicial da lesão celular é muito próximo ao local de formação do oxigênio singleto. Assim, o mecanismo predominante de morte celular, além de depender da localização do FS é influenciado também por sua concentração, pela dose de luz de irradiação, pelo tipo celular tratado, pelo tempo de incubação antes de sua exposição à luz e pela localização do alvo (lesão) que será submetido à fotosensibilização (Villanueva et al., 2003).
Enquanto a apoptose é um processo extremamente controlado e requer energia, a necrose é um processo passivo, ou seja, um processo não programado e acompanhado pela rápida perda da integridade da membrana e homeostase metabólica (Mundle et al.,
1994). Os fatores que promovem a necrose incluem a localização extra-mitocondrial do FS, alta dose de TFD e a privação de glicose (Almeida et al., 2004; Kiesslich et al.,2005; Oberdanner et al.,2002). A necrose é um tipo de morte celular caracterizada
43 Durante a necrose, o conteúdo celular é liberado, causando dano às células vizinhas e uma reação inflamatória local (Ziegler et al., 2004).
44 MATERIAIS E MÉTODOS
3.1. ATIVIDADE FOTODINÂMICA IN VIVO
3.1.1. ANIMAIS EXPERIMENTAIS
Foram utilizados camundongos Swiss fêmeas (25 a 30 g) provenientes do Biotério da Universidade Federal de Ouro Preto (UFOP). Os animais foram mantidos em ciclos padronizados de claro/escuro e com livre acesso a ração e água. Todos os experimentos seguiram as normas do Conselho Brasileiro de Experimentação Animal (COBEA) e o protocolo foi previamente aprovado pelo comitê de ética em experimentação animal da UFOP com o número 2011/59.
3.1.2. MODELO EXPERIMENTAL DE TUMOR SÓLIDO
Tumor sólido de Ehrlich, derivado de um adenocarcinoma mamário murino espontâneo, foi utilizado como modelo experimental para avaliação da atividade fotodinâmica in vivo. As células do tumor de Ehrlich foram gentilmente cedidas pelas
professoras Dra. Mônica Cristina Oliveira e Dra. Elaine Amaral Leite (Departamento de Farmácia da UFMG).
45 com azul de tripan 0,1% e contagem em câmera de Neubawer, a viabilidade celular foi determinada no líquido ascítico. A partir do líquido ascítico obtido, foi preparada uma suspensão de células de tumor de Ehrlich com densidade média de 2 x107células/mL. Logo em seguida, essas células tumorais foram implantadas (1 x106 células/animal), por via subcutânea, dorso-lateralmente em camundongos Swiss fêmeas (20 a 25g). O tumor se desenvolveu durante 15 dias até que o mesmo pudesse ser palpável em todos os animais, com medidas entre 9 a 12 mm, realizadas com paquímetro.
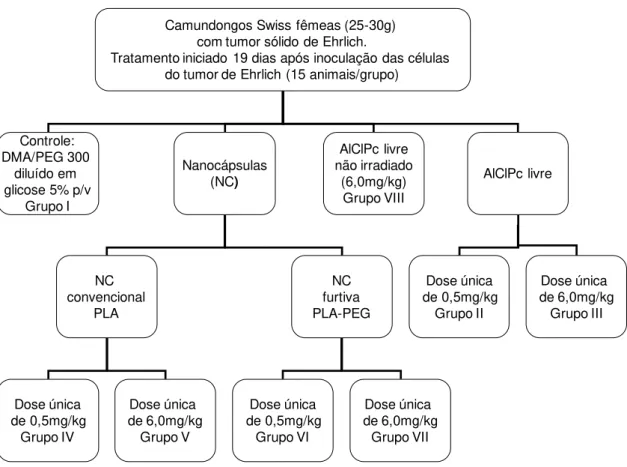
3.1.3. TRATAMENTO
46 mW para uma dose final de luz de 50 J/cm2 em cada aplicação e para um diâmetro de incidência de luz 0,5 cm2
Camundongos Swiss fêmeas (25-30g) com tumor sólido de Ehrlich.
Tratamento iniciado 19 dias após inoculação das células do tumor de Ehrlich (15 animais/grupo)
Controle: DMA/PEG 300
diluído em glicose 5% p/v
Grupo I Nanocápsulas (NC) AlClPc livre não irradiado (6,0mg/kg) Grupo VIII NC convencional PLA NC furtiva PLA-PEG AlClPc livre Dose única de 0,5mg/kg Grupo IV Dose única de 6,0mg/kg Grupo V Dose única de 0,5mg/kg Grupo VI Dose única de 6,0mg/kg Grupo VII Dose única de 0,5mg/kg Grupo II Dose única de 6,0mg/kg Grupo III
Figura 7: Protocolo experimental de tratamento por terapia fotodinâmica com AlClPc por via intravenosa em modelo murino com tumor sólido de Ehrlich.
3.1.4. ANÁLISE HISTOPATOLÓGICA E MORFOMÉTRICA DOS TUMORES APÓS TERAPIA FOTODINÂMICA