UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA DEPARTAMENTO DE CIRURGIA
PROGRAMA DE PÓS-GRADUAÇÃO STRICTO SENSU EM CIRURGIA
JOSÉ RICARDO DE MOURA TORRES DE MELO
MODELO EXPERIMENTAL EM CANINOS PARA PESQUISA DE LINFONODO SENTINELA DO ESTÔMAGO
JOSÉ RICARDO DE MOURA TORRES DE MELO
MODELO EXPERIMENTAL EM CANINOS PARA PESQUISA DE LINFONODO SENTINELA DO ESTÔMAGO
Dissertação a ser submetida à Coordenação do Programa de Pós-Graduação Stricto Sensu em Cirurgia, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre em Cirurgia.
Orientador: Prof. Dr. Luiz Gonzaga Porto Pinheiro
T646m Torres de Melo, José Ricardo de Moura
Modelo experimental em caninos para pesquisa de linfonodo sentinela do estômago / José Ricardo de Moura Torres de Melo. – Fortaleza, 2010. 85f. : il.
Orientador: Prof. Dr. Luiz Gonzaga Porto Pinheiro
Dissertação (Mestrado) – Universidade Federal do Ceará. Faculdade Medicina. Programa de Pós-Graduação em Cirurgia
1. Neoplasias gástricas. 2. Metástase linfática. 3. Estadiamento de neoplasias. 4. Biópsia de linfonodo sentinela. I Pinheiro, Luiz Gonzaga Porto (Orient.). II. Título.
A DEUS, Nosso Senhor JESUS CRISTO e ao Divino ESPÍRITO SANTO, que, através do meu amigo Dr. Francisco Sálvio Cavalcante Pinto, resgataram-me e colocaram-me novamente no meu caminho, com chance e oportunidade de concluir este trabalho.
Aos meus Pais Lauro e Isolda, eternos exemplos de luta, empenho e probidade. Obrigado pela personalidade!
À minha esposa, Rosana, mulher combativa e destemida, minha cúmplice e dona de minhas vitórias (impossível sem você!).
AGRADECIMENTO ESPECIAL
Ao PROF. DR. LUIZ GONZAGA PORTO PINHEIRO, Professor Adjunto do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, idealizador e fundador do GEEON – Grupo de Educação e Estudos Oncológicos / Extensão do Departamento de Cirurgia da Universidade Federal do Ceará. Homem guerreiro com personalidade científica desbravadora, incansável e contagiante, que veio para inteirar a pesquisa médica nacional. Dono de um caráter abençoado por Deus, sua liderança e abnegação devem ser creditadas a coordenação de uma equipe comprometida com a investigação e estudo na Medicina, em especial, para a Cirurgia Radioguiada – Linfonodo Sentinela.
AGRADECIMENTOS
Ao PROF. DR. SAUL GOLDENBERG, idealizador e fundador da SOBRADPEC – SOCIEDADE BRASILEIRA PARA O DESENVOLVIMENTO DA PESQUISA EM CIRURGIA e da Revista ACTA CIRÚRGICA BRASILEIRA. Professor Titular e Coordenador do Curso de Pós-Graduação da Disciplina de Técnica Operatória e Cirurgia Experimental da Escola Paulista de Medicina – Universidade Federal de São Paulo, foi o primeiro mentor que fez despertar a nossa curiosidade científica. O Prof. Saul é para nós o exemplo maior de consagração e devotamento no Ensino e na Pesquisa Médica Brasileira.
Ao PROF. DR. JOAQUIM JOSÉ GAMA-RODRIGUES, Titular da Disciplina de Cirurgia do Aparelho Digestivo da Faculdade de Medicina da Universidade de São Paulo e a PROF.ª DRA. ANGELITA HABR-GAMA, Titular da Disciplina de Cirurgia do Aparelho Digestivo da Faculdade de Medicina da Universidade de São Paulo, responsáveis por minha formação profissional e, continuamente, modelo e lição de empenho científico na profissão e na dedicação meticulosa para com os pacientes.
Ao PROF. DR. PAULO ROBERTO LEITÃO DE VASCONCELOS, Coordenador do Programa de Pós-graduação stricto sensu do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, pelo incentivo e dedicação nas suas atividades neste programa.
Ao PROF. DR. LUSMAR VERAS RODRIGUES, Professor Livre-Docente do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, a competência, seriedade e abnegação do seu trabalho executado nesta Universidade é exemplo permanente que nos “contamina” a todos.
Ao PROF. DR. FRANCISCO SÉRGIO PINHEIRO REGADAS, Professor Titular do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, pela sua notável e talentosa participação na banca examinadora.
Ao PROF. DR. RENATO SANTOS DE OLIVEIRA FILHO, Professor Adjunto Visitante e Professor Orientador de Pós-Graduação da Escola Paulista de Medicina/Universidade Federal de São Paulo pela sua importante e ilustre participação na banca examinadora.
Ao PROF. DR. ANTÔNIO BORGES CAMPOS, Professor Adjunto do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, pela admirável e minuciosa participação no exame de qualificação.
Ao PROF. DR. JOSE HUYGENS PARENTE GARCIA, Professor Adjunto do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, pela essencial participação no exame de qualificação.
A PROF.ª DRA. LÚCIA LIBANEZ BESSA CAMPELO BRAGA, Professora Adjunta do Departamento de Medicina Clínica da Faculdade de Medicina da Universidade Federal do Ceará, pela importante participação no exame de qualificação.
À BIBLIOTECÁRIA NORMA DE CARVALHO LINHARES, Diretora da Biblioteca de Ciências da Saúde da Universidade Federal do Ceará, responsável pela normalização deste trabalho, muito obrigado pelo seu empenho.
Aos Acadêmicos de Medicina PEDRO MACEDO ESMERALDO BARBOSA, DOUGLAS HENNING PINHEIRO ARAGÃO, PEDRO HENRIQUE DE OLIVEIRA FILGUEIRA, MARIZA BANDEIRA DE ARAUJO e aos Acadêmicos de Medicina Veterinária RAÍSSA VASCONCELOS CAVALCANTE e HUGO ENRIQUE ORSINI BESERRA pela participação efetiva nas cirurgias experimentais no Laboratório Prof. Saul Goldenberg.
A CLÍNICA SONIMAGEM FORTALEZA/MEDICINA NUCLEAR que através do Médico Nuclear DR. JULIO MARCUS SOUSA CORREIA, forneceu material radioativo e orientação precisa no manuseio do Tecnécio nos experimentos cirúrgicos.
Às senhoras MARIA LUCIENE VIEIRA DE OLIVEIRA e MAGDA MARIA GOMES FONTENELE secretárias do Programa de Pós-graduação stricto sensu do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, sempre muito atenciosas, assíduas e resolutivas, obrigado pela essencial ajuda em todos os momentos deste trabalho.
À Sra. MARIA ROCILDA FONSECA DE ALENCAR ao Sr. MÁRIO JORGE DE MELO SOUSA em nome dos quais agradecemos a todos os funcionários do GEEON – GRUPO DE EDUCAÇÃO E ESTUDOS ONCOLÓGICOS pela paciência e interesse na evolução deste estudo.
A todos os INOFENSIVOS ANIMAIS, que através de seus sacrifícios, presentearam-nos com suas importantes cotas de contribuição para o progresso da ciência neste despretensioso e honrado estudo.
Dedico este trabalho a (aos):
Aos amigos e companheiros de labuta diária DR. EVERARDO LEITE GONÇALVES, DR. EVALDO JOSÉ PAES PINHEIRO, DR. ANTÔNIO FERREIRA DE MENEZES, DR. IRINEU NOGUEIRA COSTA e DR. ÁLVARO OSCAR MAIA DEMÉTRIO pela importante participação na minha vida profissional.
Ao DR FRANCISCO SÁLVIO CAVALCANTE PINTO, Cirurgião Oncológico/Urologista, Mestre em Cirurgia Pela Universidade Federal do Ceará e Doutor em Ciências (Oncologia) pela Universidade de São Paulo, sua competência e amizade devolveram-me a possibilidade de realizar este sonho. Muito obrigado pela dedicação e assiduidade com minha saúde.
Aos amigos e companheiros de trabalho do Hospital Edmilson Barros de Oliveira, Hospital Regional Unimed e Hospital Fernandes Távora, graças a Deus são tantos que denominá-los individualmente não caberia neste espaço, entretanto vocês permanecem no espaço pessoal mais importante de minha vida, principalmente no meu momento mais difícil. O carinho e sentimento de afeto de todos vocês foram fundamentais. Minha eterna dívida de agradecimento!
Aos PADRES JOÃO RODRIGUES FARIAS e JOAQUIM COLAÇO DOURADO que alimentam minha fé em Deus e estiveram do meu lado quando solicitei, meus agradecimentos especiais.
Aos meus pais LAURO RAMOS TORRES DE MELO e ISOLDA DE MOURA TORRES DE MELO (em memória, porém tão à vista!) extremamente presentes na minha trajetória pessoal e de fundamental importância nas minhas realizações. Obrigado pela mobilização de forças intelectuais, morais e pecuniárias e por alicerçar valores que hoje dirigem minha vida.
Aos meus filhos RAFAELLA HENRIQUES CAVALCANTI TORRES DE MELO, estudante de Medicina, fotografou alguns animais dos experimentos, MARCELLA HENRIQUES CAVALCANTI TORRES DE MELO, estudante de Arquitetura e Urbanismo e JOSÉ RICARDO DE MOURA TORRES DE MELO FILHO, vestibulando, vocês alimentam meu coração, justificam meu sentido de viver.
À minha esposa, ROSANA HENRIQUES CAVALCANTI TORRES DE MELO, pela presença incessante em todos os meus momentos, sempre digna e consciente do melhor caminho, em muitas situações não enxergaria sem os seus olhos. Você é exemplo genuíno e belo de mãe, mulher e companheira.
(...) Talvez não tenhamos conseguido fazer o melhor, mas lutamos para que o melhor fosse feito (...) Não somos o que deveríamos ser, mas somos o que iremos ser.
Mas, graças a DEUS, não somos o que éramos.
LISTA DE ILUSTRAÇÕES
FIGURA 1. Representação gráfica da definição de linfonodo sentinela ... 20
FIGURA 2. Linfonodos regionais do estômago ... 21
FIGURA 3. Representação gráfica de cirurgias realizadas pela equipe do Dr. Takashi Ichikura ... 22
FIGURA 4. Laboratório de Cirurgia Experimental Prof. Saul Goldenberg ... 24
FIGURA 5. Instrumental cirúrgico ... 25
FIGURA 6. Seqüência da técnica de abertura da parede abdominal da cadela... 26
FIGURA 7. Estômago da cadela. Demonstração do local a ser estudado ... 27
FIGURA 8. Seringas de 1 ml com Tecnécio (99mTc) e corante azul patente (AP) ... 27
FIGURA 9. Aparelho Gamma Probe ... 28
FIGURA 10. Injeção do Tecnécio ... 29
FIGURA 11. Identificação de focos de material radioativo com o aparelho Gamma Probe ... 30
FIGURA 12. Introdução do azul patente ... 31
FIGURA 13. Estudo “in vivo” do linfonodo sentinela ... 32
FIGURA 14. Estudo “ex-vivo” do linfonodo sentinela ... 32
FIGURA 15. Linfonodos sentinelas do trabalho ... 35
GRÁFICO 1. Demonstração gráfica dos linfonodos sentinelas (LS) achados neste estudo nos 25 animais ... 34
GRÁFICO 2. Captação média do Tecnécio no LS PC por tempo ... 42
LISTA DE TABELAS
1. Ordenação dos cinco principais tipos de câncer nas regiões brasileiras (por 100 mil) – HOMENS ... 17 2. Ordenação dos cinco principais tipos de câncer nas regiões brasileiras
(por 100 mil) – MULHERES ... 17 3. Análise estatística do LS PC do estômago da cadela quando utilizado o
Tecnécio e azul patente (Teste de McNemar) ... 36 4. Coeficiente de Concordância de Kappa quando comparado a avaliação do
Tecnécio + azul patente com Tecnécio isolado no LS PC... 36 5. Coeficiente de Concordância de Kappa quando comparado a avaliação do
azul patente + Tecnécio com azul patente isolado no LS PC... 37 6. Análise estatística do LS IP do estômago da cadela utilizando-se o
Tecnécio e azul patente (Teste de McNemar). ... 38 7. Coeficiente de Concordância de Kappa quando comparado a avaliação do
Tecnécio + azul patente com Tecnécio isolado no LS IP ... 38 8. Coeficiente de Concordância de Kappa quando comparado a avaliação do
azul patente + Tecnécio com azul patente isolado no LS IP... 39 9. Análise estatística do LS PC do estômago da cadela utilizando-se o
Tecnécio/relação “in vivo” e “ex vivo” (Teste de McNemar)... 40 10. Análise estatística do LS PC do estômago da cadela utilizando-se o azul
patente/relação “in vivo” e “ex vivo” (Kappa) ... 40 11. Análise estatística do LS IP do estômago da cadela utilizando-se o
Tecnécio/relação “in vivo” e “ex vivo” (Kappa) ... 41 12. Análise estatística do LS IP do estômago da cadela utilizando-se o azul
LISTA DE ABREVIATURAS E SIGLAS
99mTc Tecnécio
AP Corante azul patente CaE Câncer de estômago
CCZ Centro de Controle de Zoonoses do Município de Fortaleza CG Câncer gástrico
EC Estadiamento clínico
EERI Endoscopia eletrônica com raio infravermelho GC Gastric cancer
GEEON Grupo de Educação e Estudos Oncológicos ICV Indocianina verde
INCA Instituto Nacional do Câncer IP Infrapilórico
JGCA Japanese Gastric Cancer Association
JRSGC Japanese Research Society for Gastric Cancer
LS Linfonodo sentinela PC Pequena curvatuta
SLN Sentinel lymph node
RESUMO
ABSTRACT
The gastrectomy with extensive lymphadenectomy still is the gold standard for the dressing treatment of the gastric cancer (GC), even so these procedures can take high index of morbidity or mortality, mainly in the patients who do not present lymphatic dissemination of the illness. The research of sentinel lymph node (SLN), already consecrated in the initial tumors of breast and the melanomas, presents each time more frequent for upper gastrointestinal cancers, specially in GC with encouraging results. Studies initiated in the middles of 2000 portray increasing and sufficiently prosperous search for clarification of this question. The objective of this work is to elaborate an experimental model that can demonstrate technically, in laboratory, the research viability of SLN in gastric antrum of the dog. 25 female dogs had been studied with approach weight of 11 kg and age of 01/02 years, without definite race (WDR), healthful clinically, proceeding from the Control Center of Zoonosis of Fortaleza City with programming for euthanasia. With random choice, these animals had been studied individually and weekly. It was used, separately, radioisotopic
99m
technetium labeled phytate and patent blue dye (V Guerbert 2.5%) injected at 01 cm above the piloro, on the small bending in the antrum gastric of the dog and analyzed in the times zero, 05, 10, 15 and 20 minutes. After this period, the injection place of the markers and gastric lymph nodes were appraised “in vivo” (in the animal) and the gastric lymph nodes “ex vivo” (out of the animal). For the study with the 99mtechnetium it was used the device Gamma Probe model Nuclearlab DGC-II (radioguiada surgery with sounding lead of irradiation connected to unit of counting and sonorous tracking) and for the patent blue dye, direct vision. For the analysis statistics were used the test of McNemar and the Quantify agreement with Kappa. The level of significance was established in 5% (p≤0,05). When the radioisotopic
99m
technetium labeled phytate was used single, the LS was identified in 20 animals (80%). With the patent blue dye single, in 24 animals (96%). There is no statistic significance with the use of those markers for the LS research in the gastric antrum of the dog. The conclusions are (1) The stomach of the dog is adjusted for experimental model in alive research of the sentinel lymph node (2) The radioisotopic 99mtechnetium labeled phytate and patent blue dye (V Guerbert 2.5%) are efficients as markers of sentinel lymph node of the dog’s gastric
antrum.
Key Word: Stomach neoplasms. Lymphatic metastasis. Neoplasm staging. Sentinel lymph node biopsy.
SUMÁRIO
1 2 3 3.1 3.2 3.3 4
5 6
INTRODUÇÃO ... OBJETIVO ... MATERIAL E MÉTODOS ... Critérios de inclusão e exclusão ... Procedimento anestesiológico ... Procedimento cirúrgico ... RESULTADOS ... DISCUSSÃO ... CONCLUSÃO ...
17 22 23 23 24 25 34 43 46 REFERÊNCIAS ... 47 ANEXOS ... APÊNDICE ...
1 INTRODUÇÃO
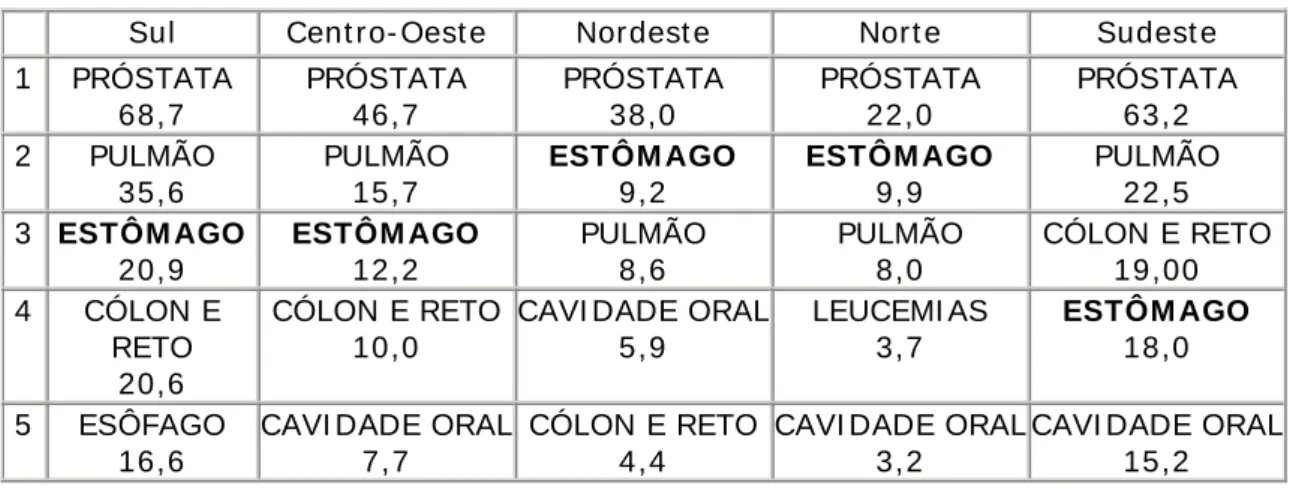
O Câncer de estômago (CaE) é atualmente a quarta neoplasia maligna mais freqüente e a segunda causa de morte entre todos os tipos de câncer no mundo. O maior número de casos ocorre no Japão, onde se encontram 780 casos por 100.000 habitantes. Por ordem, o CaE ocupa posições variadas nas regiões brasileiras – TABELAS 1 e 2 (INSTITUO NACIONAL DO CANCER -INCA, 2008).
Tabela 1 - Or denação dos cinco principais t ipos de câncer nas r egiões br asileir as ( por 100 m il) - HOMENS
Sul Cent r o- Oest e Nor dest e Nor t e Sudest e
1 PRÓSTATA 68,7 PRÓSTATA 46,7 PRÓSTATA 38,0 PRÓSTATA 22,0 PRÓSTATA 63,2 2 PULMÃO 35,6 PULMÃO 15,7 ESTÔM AGO 9,2 ESTÔM AGO 9,9 PULMÃO 22,5 3 ESTÔM AGO
20,9 ESTÔM AGO 12,2 PULMÃO 8,6 PULMÃO 8,0
CÓLON E RETO 19,00
4 CÓLON E
RETO 20,6
CÓLON E RETO 10,0
CAVI DADE ORAL 5,9 LEUCEMI AS 3,7 ESTÔM AGO 18,0 5 ESÔFAGO 16,6
CAVI DADE ORAL 7,7
CÓLON E RETO 4,4
CAVI DADE ORAL 3,2
CAVI DADE ORAL 15,2
Tabela 2 - Or denação dos cinco principais t ipos de câncer nas r egiões br asileir as ( por 100 m il) – MULHERES
Sul Cent r o- Oest e Nor dest e Nor t e Sudest e
1 MAMA 67,1 MAMA 38,2 MAMA 28,4
COLO DO ÚTERO 22,2
MAMA 68,1
2 COLO DO
ÚTERO 24,4
COLO DO ÚTERO 19,4
COLO DO ÚTERO 17,6
MAMA 15,6
CÓLON E RETO 21,1
3 CÓLON E
RETO 21,9
CÓLON E RETO 10,9
CÓLON E RETO 5,8
ESTÔM AGO 5,4
COLO DO ÚTERO 17,8 4 PULMÃO 16,2 PULMÃO 8,8 ESTÔM AGO 5,5 PULMÃO 5,0 PULMÃO 11,4 5 ESTÔM AGO
10,4
ESTÔM AGO 6,0
PULMÃO 5,3
CÓLON E RETO 3,8
ESTÔM AGO 9,5
única chance de cura da doença. (ADACHI et al., 1996; CATALANO et al., 2009; COBURN, 2009).
Disseminações por contigüidade e hematogênica são de difícil controle, porém a linfática pode ser controlada, com eficiência, através de cirurgias ampliadas. Estes procedimentos, todavia, podem levar a alto índice de morbidade ou mortalidade, com prognóstico ainda discutível, especialmente nos doentes sem comprometimento linfático da doença. (ADACHI et al., 1996; BONENKAMP et al., 1999; KITAGAWA; KITAJIMA, 2002).
Por outro lado ainda não existem, até o momento, técnicas satisfatórias de diagnóstico por imagem para detectar metástase linfonodal no CaE (PET scan, com sensibilidade de 30 a 60 %, ultrassonografia convencional e endoscópica ou ressonância magnética). (LEE et al., 2006; OTT et al., 2008; COBURN, 2009).
Surgem, neste século, trabalhos científicos demonstrando nova tecnologia na detecção de micrometástases no CaE, sem a realização destes extensivos procedimentos. Trata-se do mapeamento linfático (linfocintilografia) e da pesquisa do linfonodo sentinela (LS) que aplicados a estes tumores representam, atualmente, tentativa de aperfeiçoar a capacidade de detecção de metástases linfonodais e orientar a indicação terapêutica individualizada. O princípio da pesquisa do LS no CaE baseia-se na premissa de que, na ausência de metástase linfonodal estadiamento clínico (EC) N0, procedimentos menos radicais (laparoscópicos ou endoscópicos) poderiam ser realizados diminuindo a morbidade e mortalidade cirúrgicas. Atentar para os resultados falso-negativos que em algumas situações são devidos a obstrução dos vasos linfáticos nos tumores mais avançados (tamanho e profundidade maiores) que eventualmente teriam disseminação atípica. Parece ser consenso que a pesquisa do LS no CaE deva ser feita em tumores na fase inicial (EC T1N0M0). (TSIOULIAS et al., 2000; KITAGAWA et al., 2002a, 2002b; KITAGAWA; KITAJIMA, 2002; HAYASHI et al., 2003; CHENG et al., 2005; ZULFIKAROGLU et al., 2005; BOFF et al., 2007; OHDAIRA et al., 2007, 2009; ICHIKURA et al., 2009).
doença é mais avançada que a indicada pelo resultado dos exames comumente realizados. (NAKAJO et al., 2001; KITAGAWA et al., 2002b)
A drenagem linfática no planejamento terapêutico do câncer data de meados do século XVIII quando HENRY FRANÇOIS LE DRAN o fez para o câncer de mama descrevendo sua progressão linfática. Estes estudos levaram HALSTED, no século XIX, a desenvolver a primeira perspectiva de cura do câncer de mama - mastectomia com ressecção dos músculos peitorais e a linfadenectomia axilar - ressecção em monobloco. Esta estratégia cirúrgica que foi aplicada a outros tumores malignos (melanomas, neoplasias uterinas, gástricas, intestinais) perdurou por um século (PINHEIRO et al., 2003).
Até 1969 Veronesi e Zingo, entendiam desta maneira o tratamento para o câncer de mama, porém no ano seguinte este grupo mostrou a viabilidade de cura para este câncer realizando ressecções mamárias parciais com linfadenectomia axilar associadas a radio e quimioterapia. Enfatizou também os esvaziamentos axilares desnecessários em pacientes com axila negativa e mostrou ainda a progressão escalonada da colonização dos linfonodos axilares nas neoplasias mamárias (níveis um, dois e três) sustentando controvérsias, deste modo, aos princípios do tratamento para este tumor (BUCALOSSI et al., 1971, 1972).
A primeira citação sobre mapeamento linfático foi realizada por Braithwaite (1923) com injeção de corante índigo carmim ao nível da válvula ileocecal. Weinberg e Cohn demonstraram a baixa toxicidade do corante vital injetado próximo ao tecido tumoral e também iniciaram estudos em pacientes com carcinomas gástrico e pulmonar para aprimorar o entendimento de radicalidade da linfadenectomia (WEINBERG et al., 1951; COHN Jr.; LEON; STRUG, 1958; ALVES, 2007). Porém a idéia da linfadenectomia extensa do câncer gástrico foi primeiramente defendida por Mikulics em 1889 que na época declarou ser necessária também a remoção do pâncreas distal. (COBURN, 2009).
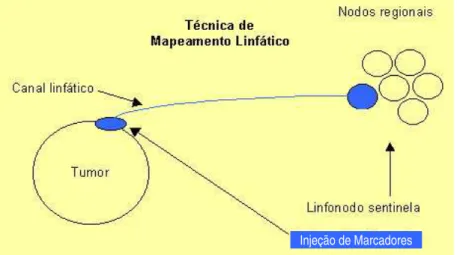
Figur a 1 – Repr esent ação gr áfica da definição de linfonodo sent inela
A denominação linfonodo sentinela foi proposta por Cabanas (1977) que, na avaliação terapêutica do carcinoma de pênis e com a utilização de linfangiograma, estudou a disseminação linfática deste tumor e utilizou o termo LS para o primeiro linfonodo que fazia a drenagem deste tumor ao nível da arcada inguinal. A retirada deste linfonodo minimizaria a mutilação de um esvaziamento inguinal bilateral, caso o mesmo fosse negativo. Deste modo, este autor acreditava que a drenagem linfática poderia ser previsível. Porém a identificação de vias de disseminação alternativas invalidou o pensamento até então da linfadenectomia seletiva.
Somente em 1991 Morton e Cagle, empregando o corante azul isosulfan, desenvolveram modelo experimental para a pesquisa do LS em felinos através da drenagem linfática da pele destes animais, demonstrando a possibilidade de uma linfadenectomia seletiva.
Após a demonstração experimental na pata do felino, Morton demonstrou sua utilidade na identificação de LS em melanoma de extremidades (WEINBERG et al., 1951; MORTON et al., 1992).
No momento atual, vários trabalhos demonstram que combinando o uso de marcadores radioativos, Tecnécio com traçador/colóide fitato (99mTc) e corantes, azul patente V Guerbert 2,5 % (AP), o mapeamento linfático e a identificação do linfonodo sentinela já estão clinicamente estabelecidos na cirurgia do câncer de mama inicial (EC T1 e T2) e melanoma para verificar presença de metástases (COCHRAN; WEN; MORTON, 1992; MORTON et al., 1992; ALEX; KRAG, 1993; ALEX et al., 1993; KRAG et al., 1993;
VERONESI et al., 1999; OLIVEIRA FILHO et al., 2000, 2002, 2003; MORTON, 2001; SIMMONS;SMITH; OSBORNE, 2001; PINHEIRO et al., 2006; OLIVEIRA et al., 2007).
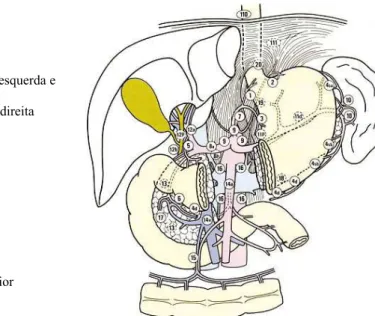
A Sociedade Japonesa de Pesquisa do Câncer Gástrico (JRSGC), denominada desde 1997 de Associação Japonesa do Câncer Gástrico (JGCA), empenha-se há quase cinco décadas no estudo do CaE visando um aperfeiçoamento mais detalhado no diagnóstico e tratamento desta enfermidade. Atualmente esta comissão define que os linfonodos regionais do estômago são classificados em estações numeradas (JGCA, 1998) (FIGURA 2).
1. Paracárdico direito
2. Paracárdico esquerdo
3. Pequena curvatura 4. Grande curvatura
4s: Acompanham Art. Gastroepiplóica esquerda e Art. Gástricas curtas
4d: Acompanham Art. Gastroepiplóica direita 5. Suprapilórico
6. Infrapilórico
7. Art. Gástrica esquerda 8. Art. Hepática comum 9. Art. Celíaca
10. Hilo Esplênico 11. Art. Esplênica 12. Pedículo Hepático
13. Posterior a cabeça do pâncreas
14. Raiz Mesentérica
110. Grupo para Esofágico Torácico inferior
111. Diafragmático
old.consilium-medicum.com/ .../ 04_01/ 24.shtml Figur a 2 – Linfonodos regionais do est ôm ago hum ano
Ohdaira et al., (2007) publicou estudo que avalia 161 pacientes portadores de câncer gástrico (CG) com EC pT1pN0 (tumor em fase inicial). Este estudo analisou a eficácia da cirurgia de gastrectomia modificada utilizando concomitantemente a pesquisa do LS com indocianina verde (ICV) e endoscopia eletrônica com raio infravermelho (EERI) demonstrando resultados bastante promissores. Este mesmo grupo, em 2009, voltou a publicar um estudo estabelecendo critérios para a pesquisa do LS no CG Inicial após ressecção endoscópica da lesão neoplásica e utilização de ICV e EERI (OHDAIRA et al., 2009).
FI GURA 3 – Repr esent ação gr áfica de cir ur gias r ealizadas pele equipe do Dr . Takashi I chikur a. Desenho à esquer da: r essecção gást r ica em cunha com linfadenect om ia r egional ( níveis 4d e 6) . Desenho à dir eit a: r essecção gást r ica segm ent ar “ em m anga” com linfadenect om ia regional ( nív eis 3 e 4d)
Fonte: I CHI KURA et al., 2009.
Devido a importância da disseminação linfática no tratamento cirúrgico do CaG a pesquisa de LS no antro gástrico utilizando 99mTc e AP poderá constituir-se em relevante método capaz de selecionar pacientes para serem submetidos a técnicas cirúrgicas mais conservadoras.
O interesse deste trabalho é demonstrar e avaliar tecnicamente, a possibilidade de criar em laboratório, um modelo experimental para pesquisa de LS no antro gástrico da cadela utilizando 99mTc e AP e que se preste também como método de ensino para treinamento de profissionais na área da cirurgia oncológica.
Pinheiro et al. (2003) demonstrou a eficiência e viabilidade da utilização deste método (99mTc + AP), na identificação de LS da mama da cadela.
2 OBJETIVO
3 MATERIAL E MÉTODOS
Este estudo foi realizado no Laboratório de Cirurgia Experimental Prof. Saul Goldenberg Cirurgia Radioguiada/Linfonodo Sentinela vinculado ao Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará (FIGURA 4).
O projeto de pesquisa foi aprovado pela Comissão de Ética em Pesquisa Animal (CEPA) da Universidade Federal do Ceará (Protocolo nº 35/06) e está de acordo com os Princípios Éticos na Experimentação Animal adotados pelo Colégio Brasileiro de Experimentação Animal (COBEA) em 22 de novembro de 2006 e pelo Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará em 22 de maio de 2007.
Foram selecionados vinte e cinco cães mestiços da espécie Canis familiaris, fêmeas, com peso aproximado de 11 Kg e com idade variando de 12 a 24 meses (estabelecida por critérios clínicos: dentição, mamas, penugem, genitália, paridade) fornecidos pelo Centro de Controle de Zoonoses do Município de Fortaleza (CCZ). A opção pelo gênero feminino foi pelo fato de já existirem, neste laboratório, outros estudos em andamento na pesquisa do LS na cadela (mama e vulva) e decidiu-se por pesquisar, também, LS no estômago deste animal. Os animais foram escolhidos aleatoriamente e estudados individualmente, uma a cada sessão, semanalmente, no período de julho a dezembro de 2008. Resgatados nas ruas de Fortaleza pelo CCZ, estes cães são programados para eutanásia em um período preestabelecido, caso não sejam identificados seus donos.
3.1 Critérios de inclusão e exclusão
Estabeleceram-se como critérios de inclusão:
• Animais clinicamente saudáveis
• SRD
• Sexo feminino. Critérios de exclusão:
• Animais clinicamente doentes
Neste estudo foram excluídos cinco animais, dois clinicamente doentes com lesão de focinho e orelha compatíveis com leishmaniose e três com achados intra-operatórios de doença abdominal.
Contactava-se o CCZ no dia anterior ao experimento para o fornecimento do animal a ser estudado, que era acomodado em canil próprio do laboratório. A Clínica Sonimagem Fortaleza/Medicina Nuclear preparava e fornecia o material radioativo, recolhido na manhã do experimento. Checava-se antecipadamente todo o material do laboratório a ser utilizado na pesquisa (Instrumental cirúrgico, drogas anestésicas, bisturi elétrico, foco, seringas, fios, soro, gazes, fichas individualizadas etc.).
FI GURA 4 – Labor at ór io de Cir ur gia Exper im ent al Pr of. Saul Goldenber g. Cir ur gia Radioguiada - Linfonodo Sent inela
3.2 Procedimento anestesiológico
seguimento anestesiológico eram utilizados cloridrato de cetamina (15 mg/kg) e cloridrato de xilasina 2% (2 a 5 mg/kg) que podem ser realizados tanto por via intramuscular como por via intravenosa. Nestes experimentos, a partir do momento que o animal tinha acesso venoso, optou-se por realizar toda medicação via intravenosa. A estabilidade hemodinâmica era analisada pela freqüência respiratória, freqüência cardíaca, nível de inatividade e sensibilidade do animal.
3.3 Procedimento cirúrgico
Com instrumental cirúrgico montado (FIGURA 5) e após realização de tricotomia abdominal o animal era submetido à incisão subcostal bilateral com abertura da parede abdominal por planos, utilizando bisturi elétrico e realizando, quando necessário, ligadura de vasos com fio algodão 2-0 (FIGURA 6).
(a) (b)
(c) (d)
FI GURA 6 – Seqüência da t écnica de aber t ur a da par ede abdom inal da cadela - ( a) : Tr icot om ia abdom inal. ( b) : Aposição de cam po cir úr gico. ( c) : I ncisão abdom inal subcost al bilat eral. ( d) : Abert ura de par ede abdom inal por planos.
FI GURA 7 – Est ôm ago da cadela. Dem onst r ação do local a ser est udado.
Identificadas as estruturas anatômicas e o local a ser injetado o 99mTc e o AP, deu-se continuidade ao procedimento. Estes marcadores foram alocados com um volume de 0,2 ml, em seringa com marcação milimétrica (individualizada) descartável de 1,0 ml (tipo para insulina) com agulha de 100µ. O aperfeiçoamento da técnica demonstrou que se deve deixar 0,2 ml de ar entre o líquido (marcador) e a agulha para evitar extravasamentos e favorecendo assim uma injeção sem margem de erro (FIGURA 8).
FI GURA 8 – Ser ingas individualizadas de 1 m l ( m arcação m ilim ét r ica) com 0,2 m l de Tecnécio ( 99m Tc) e 0,2 m l de corant e azul pat ent e ( AP) . At enção par a o espaço com ar ( t am bém de 0,2 m l) ent r e a agulha e os m arcadores líquidos.
99mTc
CAP 0,2 ml de ar
0,2 ml de ar
Estômago Piloro
Duodeno
• Tecnécio (99mTc), substância radioativa diluída em 0,2 ml de solução de fitato com um total de 0,5 milicurrie/0,2 ml com atividade de 19 Mega Becquerel a ser detectado pelo aparelho Gamma Probe - detector para cirurgia radioguiada, modelo Nuclearlab DGC-II, para captação do material radioativo com um valor de corte para consideração mínima de linfonodo sentinela positivo “quente” de 4,57% (antro/LS). Este aparelho permite identificar focos de material radioativo (pontos “quentes”) inclusive, linfonodos sentinelas (FIGURA 9).
• Corante azul patente V Guerbert 2,5 % (AP) com um volume de 0,2 ml para avaliação visual da marcação de vias de drenagem linfáticas e eventuais linfonodos. Para a análise da absorção linfonodal do AP seguiu-se a seguinte escala numérica (escores):
00 – Linfonodo e canais linfáticos não corados 01 – Canais linfáticos corados
02 – Linfonodos parcialmente corados 03 – Linfonodo corado
Foi considerado linfonodo sentinela aquele completamente tatuado (corado) pelo azul patente (escore 03).
FI GURA 9 – Apar elho Gam m a Probe - det ect or par a cir ur gia r adioguiada e sonda capt ador a de ir r adiação acoplada. Unidade de cont agem e r ast r eam ent o sonor o m odelo Nuclear lab DGC- I I
Inicialmente é realizada a injeção de 99mTc na camada seromuscular do estômago, através do orifício feito no antro gástrico da cadela, com a agulha direcionada para a região a 1,0 cm do piloro. A introdução da agulha pode ser vista e acompanhada até a região
que vai receber o marcador, pois se tem idéia real da espessura da parede do estômago quando se dispõe daquela pequena abertura de 0,3 cm nesta região (FIGURA 10).
FI GURA 10 – I nj eção do Tecnécio
Após injetar o 99mTc no antro gástrico da cadela, foram analisados e identificados focos de captação de material radioativo no local de injeção (antro) e nas regiões lifonodais peri e extra gástricas, utilizando a sonda do aparelho Gamma Probe nos tempos de ZERO (logo após injeção do tecnécio), 05, 10, 15 e 20 minutos e era anotado, em ficha específica (APÊNDICE A), os valores do número de contagem radioativa por minuto que aparecem na tela do aparelho (FUGURA 11).
Seringa com 99mTc Estômago Duodeno
FI GURA 11 – I dent ificação de focos de m at er ial r adioat ivo com sonda capt ador a de irradiação acoplada ao apar elho Gam m a Pr obe, conduzida pelo pesquisador .
Logo após o estudo do 99mTc, procedeu-se o mesmo com o AP utilizando-se técnica de injeção exatamente igual à anterior, com todo cuidado para não extravasar o corante na cavidade abdominal comprometendo assim o trabalho. A agulha da seringa com o AP era introduzida na camada seromuscular da parede do estômago da cadela, sob visão direta, através do orifício previamente realizado em direção a região localizada a 1,0 cm do piloro. Neste momento, o AP ao ser injetado nesta região, podia-se observar que mesmo antes de terminar sua completa introdução, identificavam-se canais linfáticos corando e, em tempo variável, o LS corado (FIGURA 12).
Sonda Probe
Tela de leitura
(a) (b)
(c) (d)
FI GURA 12 – I nt r odução do azul pat ent e. ( a) I dent ificação de aber t ur a ser om uscular . ( b) I nt r odução da ser inga/ agulha ( com AP) at é a r egião a ser est udada no ant r o gást r ico. ( c) I nt r odução do azul pat ent e. ( d) I dent ificação do LS.
Em seguida era realizado avaliação visual da marcação do corante no local de injeção (antro) e nas regiões lifonodais peri e extra gástricas, nos tempos de ZERO (logo após injeção do corante), 05, 10, 15 e 20 minutos e anotado, em ficha específica, para cada animal (APÊNDICE A).
Após este período de 40 minutos de observação, foram examinadas novamente as regiões de linfonodos peri e extra gástricas em busca da eventual presença de LS “quente” utilizando-se o aparelho Gamma Probe e LS corado, com visão direta. Foram detectados linfonodos que se apresentavam “quentes” e corados ao mesmo tempo, assim como somente “quentes” ou somente corados. Esta fase do estudo foi denominada exame “in vivo”, ou seja, o estudo dos linfonodos ainda era realizado na cavidade abdominal da cadela (FIGURA 13).
Estômago
Estômago
Estômago com canais linfáticos corados
LS Corado I ncisão 0,3 cm
Duodeno
Duodeno
Duodeno
Duodeno
Piloro Piloro
Piloro
Piloro
Seringa com Azul Patente
FI GURA 13 – Est udo “ in vivo” do linfonodo sent inela.
Localizado o LS, realizava-se sua exerese para mais uma vez ser medida sua radioatividade e observar a presença ou ausência do seu tingimento pelo AP. Esta fase foi denominada “ex-vivo”, ou seja, o LS foi extraído do animal, estudado e comparado com a fase “in-vivo” (FIGURA 14)
FI GURA 14 – Est udo “ ex- vivo” do linfonodo sent inela Tela de leitura
Sonda Probe
Estômago com canais linfáticos corados
Sonda Probe
Tela de leitura
LS Corado
LS “quente” LS Corado
Por tratar-se de dados nominais e emparelhados, para os cálculos na análise estatística, utilizou-se o teste de McNemar e o Coeficiente de Concordância de Kappa. Estabeleceu-se em 5 % o nível de significância (p≤0,05).
4 RESULTADOS
Após análise individual de cada marcador tabulou-se os resultados obtidos.
Os dados estatísticos foram analisados utilizando-se o teste de McNemar e o Coeficiente de Concordância de Kappa. Estabeleceu-se em 5% o nível de significância (p≤0,05).
Usando o 99mTc foram detectados vinte e sete linfonodos “quentes” em vinte animais (treze na Pequena Curvatura – PC e quatorze Infrapilóricos – IP).
Usando o AP foram detectados trinta e nove linfonodos corados em vinte e quatro animais (vinte na Pequena Curvatura – PC e dezenove Infrapilóricos – IP) (GRÁFICO 1).
GRÁFI CO 1 – Dem onst r ação gráfica dos linfonodos sent inelas achados nest e est udo nos 25 anim ais. LS PC – linfonodos sent inelas da pequena cur vat ur a gást r ica. LS I P – linfonodos sent inelas infrapilór icos.
Foi encontrado no hilo hepático de um animal 01 linfonodo corado. A cadela tem linfonodos hepáticos (portais) direito e esquerdo. O linfonodo identificado seria o linfonodo hepático esquerdo com tamanho de 4,0 cm (varia de 1,0 a 6,0 cm) que tem vasos linfáticos aferentes provenientes do esôfago, estômago, diafragma, fígado , pâncreas, mediastino e peritônio (SAAR; GETTY, 1986). O corante seguiu apenas seu fluxo de drenagem o que para este estudo não expressa resultado.
Por três vezes, ao ser utilizada a sonda do Gama Probe, houve captação na região suprapilórica por provável contaminação da substância radioativa desta região sem identificação de LS. O mesmo aconteceu, apenas uma vez, com o azul patente que nesta mesma região foi tatuado canal linfático sem identificação de LS.
Abaixo foto ilustrativa dos LS encontrados - LS PC (linfonodo sentinela da pequena curvatura a esquerda e LS IP (linfonodo sentinela infrapilórico) a direita (FIGURA 15).
FI GURA 15 - LP PC ( linfonodo sent inela da pequena cur vat ur a) à esquer da e LP I P ( linfonodo sent inela infrapilórico) à direit a
LINFONODO SENTINELA DA PEQUENA CURVATURA (LS PC) DO ESTÔMAGO DA CADELA - ANÁLISE ESTATÍSTICA
Estômago Piloro
Estômago
Piloro LS PC
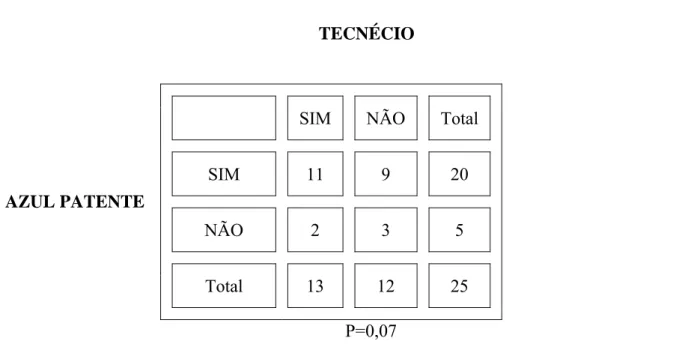
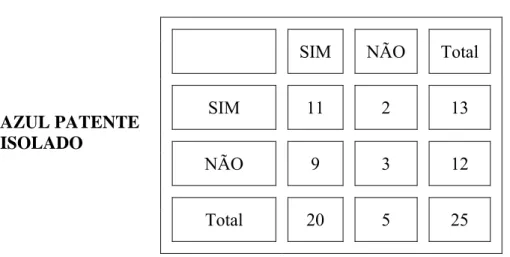
A diferença no uso do Tecnécio e AP na detecção do LS PC não foi estatisticamente significante TABELA 3.
TABELA 3 - Análise est at íst ica do LS PC do est ôm ago da cadela quando ut ilizado o Tecnécio e AP ( Test e de McNem ar )
TECNÉCIO
AZUL PATENTE
P=0,07
Quando a avaliação do Tecnécio + AP é comparada com o Tecnécio isolado na detecção do LS PC, o Coeficiente de Concordância de Kappa é igual a 0,09 com um número de concordância observado de 56%, considerado fraco, vide TABELA 4.
TABELA 4 - Coeficient e de Concordância de Kappa quando com parado a avaliação do
Tecnécio + AP com Tecnécio isolado no LS PC.
TECNÉCIO + AZUL PATENTE
TECNÉCIO ISOLADO
Kappa=0,09/Número de concordância observado 56% - Fraco SIM NÃO Total
SIM 11 9 20
NÃO 2 3 5
Total 13 12 25
SIM NÃO Total
SIM 11 2 13
NÃO 9 3 12
Porém se a avaliação é do AP + Tecnécio comparado com o AP isolado na detecção do LS PC o Coeficiente de Concordância de Kappa é igual a 0,71 com um número de concordância observado de 92%, considerado bom, vide TABELA 5.
TABELA 5 - Coeficient e de Concordância de Kappa quando com par ado a avaliação do AP + Tecnécio com AP isolado no LS PC.
AZUL PATENTE + TECNÉCIO
AZUL PATENTE ISOLADO
Kappa= 0,71/ Número de concordância observado 92% - Bom
LINFONODO SENTINELA INFRAPILÓRICO (LS IP) DO ESTÔMAGO DA CADELA - ANÁLISE ESTATÍSTICA
Comparando a diferença no uso do Tecnécio com o AP na detecção do LS IP não houve diferença estatisticamente significante (TABELA 6).
SIM NÃO Total
SIM 11 2 13
NÃO 9 3 12
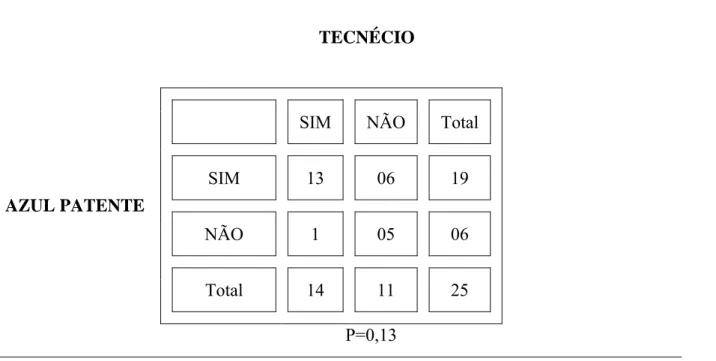
TABELA 6 - Análise est at íst ica do LS I P do est ôm ago da cadela ut ilizando- se o Tecnécio e AP ( t est e de McNem ar )
TECNÉCIO
AZUL PATENTE
P=0,13
Quando a avaliação do Tecnécio + AP é comparada com o Tecnécio isolado na detecção do LS IP, o Coeficiente de Concordância de Kappa é igual a 0,04 com um número de concordância observado de 72%%, considerado moderado. (TABELA 7)
TABELA 7 - Coeficient e de Concordância de Kappa quando com parado a avaliação do
Tecnécio + AP com Tecnécio isolado no LS I P.
TECNÉCIO + AZUL PATENTE
TECNÉCIO ISOLADO
Kappa=0,40/Número de concordância observado 72% - Moderado SIM NÃO Total
SIM 13 06 19
NÃO 1 05 06
Total 14 11 25
SIM NÃO Total
SIM 13 01 14
NÃO 06 05 11
Porém se a avaliação é do AP + Tecnécio comparada com o AP isolado na detecção do LS IP o Coeficiente de Concordância de Kappa é igual a 0,88 com um número de concordância observado de 96%, considerado muito bom. (TABELA 8)
TABELA 8 - Coeficient e de Concordância de Kappa quando com par ado a avaliação do AP + Tecnécio com AP isolado no LS I P.
AZUL PATENTE + TECNÉCIO
AZUL PATENTE ISOLADO
Kappa= 0,88/ Número de concordância observado 96% - Muito Bom
As análises anteriores (Tecnécio e AP) foram feitas “in vivo”. O estudo “ex vivo” também foi realizado. As tabelas a seguir retratam os resultados.
SIM NÃO Total
SIM 19 00 19
NÃO 01 05 06
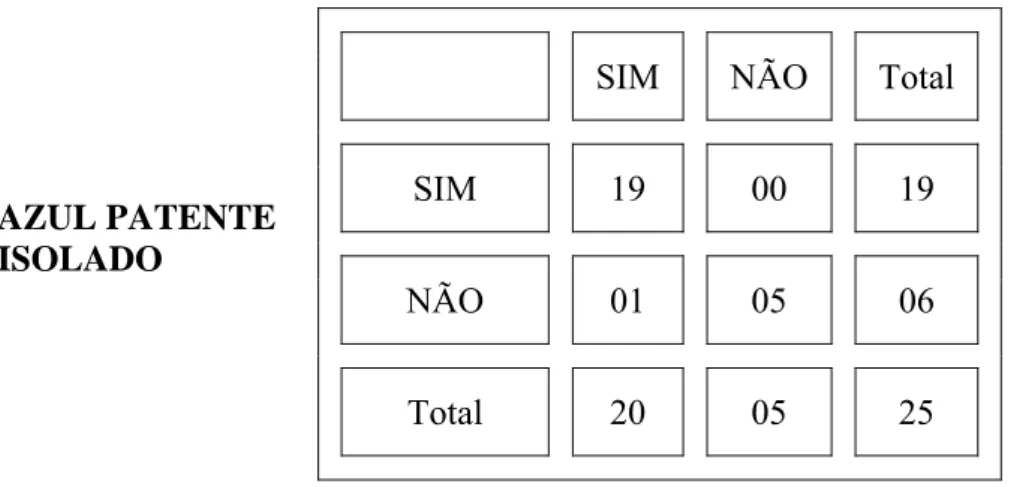
Quando é analisado e comparado o estudo “in vivo” com o estudo “ex vivo” do LS PC utilizando o marcador Tecnécio a diferença não é estatisticamente significante. (TABELA 9)
TABELA 9 - Análise est at íst ica do LS PC ( linfonodo sent inela da pequena curv at ura) do est ôm ago da cadela ut ilizando- se o Tecnécio/ relação “ in v iv o” e “ ex v iv o” ( t est e de McNem ar )
LS PC - análise “in vivo”
LS PC -
análise “ex vivo”
P=0,61
Comparando a utilização do AP na identificação do LS PC “in vivo” com “ex vivo”, o Coeficiente de Concordância de Kappa é igual a 1,0 com um número de concordância observado de 100%, considerado perfeito (TABELA 10).
TABELA 10 - Análise est at íst ica do LS PC ( linfonodo sent inela da pequena cur vat ur a) do est ôm ago da cadela ut ilizando- se o AP/ relação “ in vivo” e “ ex vivo” ( Kappa)
LS PC - análise “in vivo”
LS PC -
análise “ex vivo”
Kappa= 1,0/ Número de concordância observado 100% - Perfeito SIM NÃO Total
SIM 21 01 22
NÃO 03 00 03
Total 24 01 25
SIM NÃO Total
SIM 20 00 20
NÃO 00 05 05
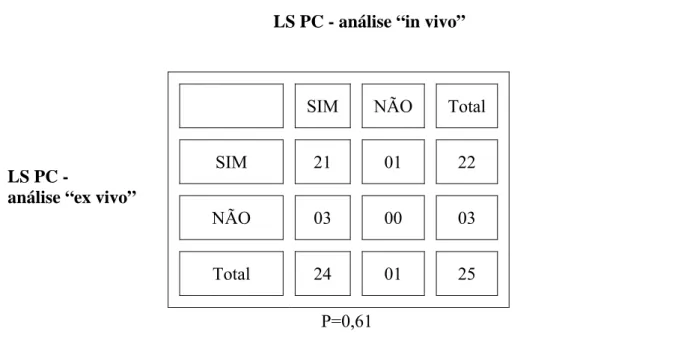
Este resultado repete-se quando comparado a utilização do 99mTc e AP na identificação do LS IP “in vivo” com “ex vivo”, ou seja, o Coeficiente de Concordância de Kappa é igual a 1,0 com um número de concordância observado de 100%, considerado perfeito. (TABELAS 11 e 12)
TABELA 11 - Análise est at íst ica do LS I P ( linfonodo sent inela infrapilórico) do est ôm ago da cadela ut ilizando- se o Tecnécio/ r elação “ in vivo” e “ ex vivo” ( Kappa)
LS IP - análise “in vivo”
LS IP -
análise “ex vivo”
Kappa= 1,0/ Número de concordância observado 100% - Perfeito
TABELA 12 - Análise est at íst ica do LS I P ( linfonodo sent inela infrapilórico) do est ôm ago da cadela ut ilizando- se o AP/ r elação “ in vivo” e “ ex vivo” ( Kappa)
LS IP - análise “in vivo”
LS IP -
análise “ex vivo”
Kappa= 1,0/ Número de concordância observado 100% - Perfeito SIM NÃO Total
SIM 24 00 24
NÃO 00 01 01
Total 24 01 25
SIM NÃO Total
SIM 19 00 19
NÃO 00 06 06
Os valores da captação média do Tecnécio pelos LS PC e LS IP após 20 minutos foram de 804,40 e 607,08 respectivamente. (GRÁFICOS 02 e 03).
GRÁFI CO 2 – Dem onst r ação gr áfica da capt ação m édia do Tecnécio por t em po analisado do LS PC ( LS PC – linfonodo sent inela da pequena curv at ur a gást r ica)
GRÁFI CO 3 – Dem onst r ação gr áfica da capt ação m édia do Tecnécio por t em po analisado do LS I P ( LS I P – linfonodo sent inela infr apilór ico)
5 DISCUSSÃO
A Pesquisa do LS para tumores malignos tais como o de mama, melanoma, vulva, neoplasia uterina, neoplasias do trato urinário, neoplasias de cabeça e pescoço, neoplasias do aparelho digestório vem desenvolvendo-se em larga extensão e com uma rapidez que impressiona. Os trabalhos científicos avolumam-se em todas as áreas. (VERONESI et al., 1999; COLDIRON; DINEHART; ROGERS, 2009; EL-GHOBASHY; SAIDI, 2009; GUR et al., 2010; ORNELLAS et al., 2009; SLAMA et al., 2009; WINTER et al., 2009).
E, mais especificamente, os trabalhos relativos ao aparelho digestório e com referência ao CaE, motivaram a realização deste estudo. (BONENKAMP et al., 1999; TSIOULIAS et al., 2000; KITAGAWA et al., 2002a, 2002b; KITAGAWA; KITAJIMA, 2002; HAYASHI et al., 2003; CHENG et al., 2005; ZULFIKAROGLU et al., 2005; BOFF et al., 2007; ICHIKURA, 2009; ICHIKURA et al., 2009).
É consenso que o único tratamento com chances de cura para o CaE é a gastrectomia parcial ou total com linfadenectomia ampliada mesmo que este procedimento ainda apresente alto índice de morbidade ou mortalidade. O comprometimento linfonodal é um dos mais importantes preditivos na sobrevida dos pacientes portadores de CaE. Vários trabalhos demonstram que pacientes portadores de neoplasia de estômago EC T4 e sem metástase linfonodal tem sobrevida maior quando comparados com os que possuem metástase linfonodal. (ADACHI et al., 1996; BONENKAMP et al., 1999; CHENG; ZHONG; HUANG, 2004; CATALANO et al., 2009).
Embora bastante recentes alguns trabalhos já contestam esta definição tão longínqua e consagrada quando trata-se de tumores de estômago em fase inicial com EC T1N0M0. (OHDAIRA et al., 2007, 2009; ICHIKURA, 2009; ICHIKURA et al., 2009). A necessidade de mais estudos urge, pois apesar de promissora, a pesquisa de LS para tratar CaE precoce pode apresentar resultado falso negativo. A metástase salteada (skip/jumping metastasis) pode ocorrer em 15 a 25 % dos casos. São linfonodos situados em cadeias distantes do tumor primário por obstrução dos linfáticos peri gástricos ou por drenagem linfática atípica do estômago (CHENG; ZHONG; HUANG, 2004; BOFF, 2005; LEE, S.E., et al., 2009; LEE, J.H et al., 2009), porém mesmo na presença de eventuais falhas na investigação do LS, as discussões têm seus méritos e merecem considerações.
nestes estudos, seja do tipo molecular ou genético (MEKICAR; OMEJC, 2009), radioativo (Tecnécio) ou corantes (azul de metileno, azul patente, indocianina verde fluorescente, isosulfan) associados ou não com a utilização de endoscopia eletrônica com raio infravermelho ou laparoscopia, tem demonstrado a viabilidade do método na inclusão no tratamento definitivo destes tumores. (TSIOULIAS et al., 2000; KITAGAWA et al., 2002a, 2002b; HAYASHI et al., 2003; NIMURA et al., 2004; CHENG et al., 2005; ISHIKAWA et al., 2007; ICHIKURA et al., 2009; MARKL et al., 2009; OHDAIRA et al., 2009; ORSENIGO; STAUDACHER, 2009; TAJIMA et al., 2009; TAKAHASHI et al., 2009).
A complexa rede linfática do estômago, as características anatomopatológicas e atividade biológica do CaE e a existência de considerável número de metástases salteadas (em ponte) definem a necessidade de novos estudos.
O interesse deste trabalho é criar um modelo experimental em animal para que, em laboratório, fosse possível provar e demonstrar a pesquisa do LS no estômago. Optou-se por estudar o antro (pequena curvatura) por ser esta região a de maior incidência no desenvolvimento de neoplasia maligna gástrica em humanos (56 a 60 %). O que aconteceria se fossem injetados marcadores de LS nesta região sem a presença de neoplasia? Eis a dúvida e inquietação científica.
Haveria a necessidade de um animal de médio porte. No Laboratório Prof. Saul Goldenberg já existiam estudos em andamento para pesquisa de LS em mama e com programação para pesquisa de LS em vulva utilizando-se cadelas cedidas pelo CCZ do Município de Fortaleza. Aleatoriamente optou-se por estudar também LS em estômago (antro) da cadela. E por uma feliz coincidência estes animais possuem estômagos com topografia bastante semelhantes ao dos humanos.
Kim (2008) demonstrou traçador alternativo para pesquisa de LS em estômagos de coelhos utilizando nanopartículas magnéticas fluorescentes (n = 07), porém concluiu-se que o coelho seria inviável para este estudo por limitação de seu tamanho.
A literatura é clara e bastante vasta quando demonstra, atualmente, a existência de três métodos para pesquisa do LS:
(1) Radiotraçador isolado (ALEX; KRAG, 1993; KITAGAWA et al., 2002a, 2002b; SANTOS et al., 2009),
(2) Corante isolado (MORTON et al., 1992; BOFF, 2005; BOFF et al., 2007; MARKL
et al., 2009) e
Seguindo o que é mais habitual foi utilizada técnica combinada com marcador radioativo (Tecnécio com traçador/colóide Fitato) analisado pelo aparelho Gama Probe e corante vital (azul patente V Guerbert 2,5 %) analisado sob visão direta. No início estes marcadores foram avaliados individualmente e em seguida, associadamente. Não há consenso de qual seja o melhor marcador. Com o Tecnécio foram identificados vinte e sete LS em vinte animais, sendo treze na Pequena Curvatura e quatorze Infrapilóricos. Com o azul patente, identificaram-se trinta e nove LS em vinte e quatro animais, sendo vinte na pequena curvatura e dezenove infrapilóricos. Este resultado demonstra a viabilidade técnica do modelo.
Parece que o AP obteve melhor índice de sucesso na identificação do LS, porém não houve significância estatística na análise dos dois marcadores na detecção dos 66 linfonodos sentinelas (LS PC e LS IP) quando utilizado o 99mTc ou o AP nas 25 cadelas.
Não restam dúvidas que para a pesquisa do LS a utilização do AP demonstrou maior praticidade e um custo muito mais baixo. Para o 99mTc, por ser substância radioativa, exigia preparo específico e transporte especializado em caixa de chumbo proveniente de uma Clínica de Medicina Nuclear. Em algumas situações o experimento foi suspenso pela falta desta substância.
No Projeto Piloto utilizou-se seis animais. Optou-se por realizar incisão subcostal bilateral, porém a incisão mediana supra/infra umbilical também pode ser realizada. Embora mais trabalhosa a primeira incisão expõe melhor os órgãos abdominais para a pesquisa do LS.
A realização da pequena incisão (0,3 cm) na camada serosa extra mucosa do antro gástrico da cadela favoreceu muito a injeção do 99mTc e AP com a introdução da agulha na parede do estômago (camada seromuscular) podendo ser acompanhada com precisão a olho nu, sem possibilidades de extravasamento destes marcadores.
Os procedimentos cirúrgicos foram tranqüilos, facilmente exeqüíveis e a cadela demonstrou-se um animal adequado, pois não houve complicações e nem óbitos durante este estudo.
A análise do 99mTc injetado na camada seromuscular do antro gástrico da cadela foi realizada da mesma maneira que todos os autores o fizeram, usando-se o aparelho Gamma Probe, que é um detector para cirurgia radioguiada. Este aparelho permite identificar focos de alta captação de material radioativo. É capaz de detectar pontos “quentes” tais como linfonodos sentinelas.
parcialmente corados e 03 – Linfonodo corado. Para confirmar a presença do LS com este marcador, somente interessava o escore 03.
A visualização do corante nos canais linfáticos ou no LS, na maioria das vezes foi instantânea e muito nítida demonstrando uma imagem contrastada marcante com o estômago do animal que chamava atenção. Em alguns animais sua excreção foi rápida, porém não invalidou o experimento.
Não se encontrou na literatura trabalhos realizados em animais de médio porte que pudessem ser comparados com este no que diz respeito à pesquisa de LS no estômago. Livre de se cometer ilação houve uma coincidência feliz para este estudo, quando alguns autores pesquisando LS em pacientes portadores de câncer gástrico na região do antro identificaram linfonodos sentinelas perigástricos semelhantes ao encontrado nesta pesquisa, ou seja, linfonodo da pequena curvatura (LS PC) e linfonodo Infrapilóricos (LS IP) (KITAGAWA et al., 2002b; BOFF et al., 2007; ICHIKURA et al., 2009).
O modelo criado se presta para demonstrar a viabilidade da pesquisa experimental do LS no estômago de cães e para treinamento de especialistas que eventualmente se interessem por este assunto. A técnica é facilmente executável e o animal demonstrou-se bastante apropriado.
As evidências expostas neste estudo demonstram que há muito para se comprovar, entretanto parece ser o caminho para discussão e definição do tratamento do CG na sua fase inicial. As perspectivas são extraordinárias e abrem bastante espaço para pesquisa.
6 CONCLUSÃO
O presente estudo mostrou duas conclusões:
1– O estômago da cadela é adequado para modelo experimental de pesquisa “in vivo” do linfonodo sentinela.
REFERÊNCIAS
ADACHI, Y.; OSHIRO, T.; MORI, M.; MAEHARA, Y.; SUGIMACHI, K. Prediction of early and late recurrence after curative resection for gastric carcinoma. Cancer, v.77. n.12, p.2445-2448, 1996.
ALEX, J. C.; KRAG, D. N. Gamma-probe guided localization of lymph nodes. Surg. Oncol., v. 2, n. 3, p.137-143, 1993.
ALEX, J. C.; WEAVER, D. L.; FAIRBANK, J. T.; RANKIN, B. S.; KRAG, D. N. Gamma-probe-guided lymph node localization in malignant melanoma. Surg. Oncol., v. 2, n. 5, p. 303-308, 1993.
ALVES, F. A. H. Pesquisa de linfonodo sentinela em pacienetes com adenocardcinoma de cólons. 2007.77 p. Dissertação (Mestrado). Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte, 2007.
BOFF, M. F. Pesquisa do linfonodo sentinela em câncer gástrico com o corante vital azul patente: 2005. 71 p. Dissertação (Mestrado). Faculdade de Medicina, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2005.
BOFF, M. F.; SCHIRMER, C. C.; EDELWEISS, M. I. A.; MEURER, L. Pesquisa do linfonodo sentinela em câncer gástrico com o corante vital azul patente. Rev. Col. Bras. Cir., v. 34, n. 6, p. 367-373, 2007.
BONENKAMP, J. J.; HERMANS, J.; M. SASAKO, M.; VAN DE VELDE, C. J.; WELVAART, K.; SONGUN, I.; MEYER, S.; PLUKKER, J. T.; VAN ELK, P.; OBERTOP, H.; GOUMA, D. J.; VAN LANSCHOT, J. J.; TAAT, C. W.; DE GRAAF, P. W.; VON MEYENFELDT, M. F.; TILANUS, H. Extended lymph-node dissection for gastric cancer. N. Engl. J. Med., v. 340, n. 12, p. 908-914, 1999.
BRAITHWAITE, L. R. Flow of lymph from the ileocecal angle. Br. J. Surg., v.11, p. 7-26, 1923.
BUCALOSSI, P.; VERONESI, U.; ZINGO, L.; CANTU, C. Enlarged mastectomy for breast cancer. Review of 1,213 cases. Am. J. Roentgenol. Radium Ther. Nucl. Med., v.111, n.1, p. 119-122, 1971.
CABANAS, R. M. An approach for the treatment of penile carcinoma. Cancer, v. 39, n. 2, p. 456-466, 1977.
CATALANO, V.; LABIANCA, R.; BERETTA, G. D.; GATTA, G.; DE BRAUD, F.; VAN CUTSEM, E. Gastric cancer. Crit. Rev. Oncol. Hematol., v. 71, n. 2, p. 127-164, 2009.
CHENG, L. Y.; CHEN, X. D.; ZHANG, Y. X.; FENG, X. D. Clinical significance of sentinel lymph node detection by combining the dye-directed and radioguided methods in gastric cancer. Zhonghua Wai Ke Za Zhi, v. 43, n. 9, p. 569-572, 2005.
CHENG, L. Y.; ZHONG, S. Z.; HUANG, Z. H. Sentinel lymph node concept in gastric cancer with solitary lymph node metastasis. World J. Gastroenterol., v. 10, n. 20, p. 3053-3055, 2004.
COBURN, N. G. Lymph nodes and gastric cancer. J. Surg. Oncol., v. 99, n. 4, p. 199-206, 2009.
COCHRAN, A. J.; WEN, D. R.; MORTON, D. L. Management of the regional lymph nodes in patients with cutaneous malignant melanoma. World J. Surg., v. 16, n. 2, p. 214-221, 1992.
COHN JR., I.; LEON, W.; STRUG, L. H. Vital staining of the thoracic duct. Ann. Surg., v.148, n. 6, p. 867-870, 1958.
COLDIRON, B. M.; DINEHART, S.; ROGERS, H. W. Sentinel lymph node biopsy and completion lymph node dissection for malignant melanoma are not standard of care. Clin. Dermatol., v. 27, n. 4, p. 350-354, 2009.
EL-GHOBASHY, A. E.; SAIDI, S. A. Sentinel lymph node sampling in gynaecological cancers: techniques and clinical applications. Eur. J. Surg. Oncol., v. 35, n. 7, p. 675-685, 2009.
GUR, A. S.; UNAL, B.; OZBEK, U.; OZMEN, V.; AYDOGAN, F.; GOKGOZ, S.; GULLUOGLU, B. M.; AKSAZ, E.; OZBAS, S.; BASKAN, S.; KOYUNCU, A.; SORAN, A. Validation of breast cancer nomograms for predicting the non-sentinel lymph node metastases after a positive sentinel lymph node biopsy in a multi-center study. Eur. J. Surg. Oncol., v. 36, n. 1, p. 30-35, 2010.
HAYASHI, H.; OCHIAI, T.; MORI, M.; KARUBE, T.; SUZUKI, T.; GUNJI, Y.; HORI, S.; AKUTSU, N.; MATSUBARA, H.; SHIMADA, H. Sentinel lymph node mapping for gastric cancer using a dual procedure with dye- and gamma probe-guided techniques. J. Am. Coll. Surg., v. 196, n.1, p. 68-74, 2003.
ICHIKURA, T. Progress in sentinel node navigation surgery for gastric cancer. Nippon Geka Gakkai Zasshi, v.110, n. 2, p. 68-72, 2009.
ICHIKURA, T.; SUGASAWA, H.; SAKAMOTO, N.; YAGUCHI, Y.; TSUJIMOTO, H.; ONO, S. Limited gastrectomy with dissection of sentinel node stations for early gastric cancer with negative sentinel node biopsy. Ann. Surg., v. 249, n. 6, p. 942-947, 2009.
INSTITUTO NACIONAL DO CÂNCER -INCA. Estimativa de incidência de câncer no Brasil para 2008. Rio de Janeiro: Ministério da Saúde, 2008. Disponível em: <http://www.inca.gov.br/estimativa/2008/index.asp?link=conteudo_view.asp&ID=5>. Acesso em: 19 fev 2009.
ISHIKAWA, K.; YASUDA, K.; SHIROMIZU, A.; ETOH, T.; SHIRAISHI, N.; KITANO, S. Laparoscopic sentinel node navigation achieved by infrared ray electronic endoscopy system in patients with gastric cancer. Surg. Endosc., v. 21, n. 7, p.1131-1134, 2007.
JAPANESE GASTRIC CANCER ASSOCIATION - JGCA. Japanese classification of gastric carcinoma. Gastric Cancer, v.1, p.10–24, 1998.
KITAGAWA, Y.; FUJII, H.; MUKAI, M.; KUBOTA, T.; ANDO, N.; OZAWA, S.; OHTANI, Y.; FURUKAWA, T.; YOSHIDA, M.; NAKAMURA, E.; MATSUDA, J.; SHIMIZU, Y.; NAKAMURA, K.; KUMAI, K.; KUBO, A.; KITAJIMA, M. Intraoperative lymphatic mapping and sentinel lymph node sampling in esophageal and gastric cancer. Surg. Oncol. Clin. N. Am., v.11, n. 2, p. 293-304,2002a.
KITAGAWA, Y.; KITAJIMA, M. Gastrointestinal cancer and sentinel node navigation surgery. J. Surg. Oncol., v. 79, n. 3, p.188-193, 2002.
KRAG, D. N.; WEAVER, D. L.; ALEX, J. C.; FAIRBANK, J. T. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg. Oncol., v. 2, n. 6, p. 335-339, 1993.
LEE, J. H.; RYU, K. W.; KIM, C. G.; KIM, S. K.; LEE, J. S.; KOOK, M. C.; CHOI, I. J.; KIM, Y. W.; CHANG, H. J.; BAE, J. M. Sentinel node biopsy using dye and isotope double tracers in early gastric cancer. Ann. Surg. Oncol., v. 13, n. 9, p. 1168-1174, 2006.
LEE, J. H.; RYU, K. W.; NAM, B. H.; KOOK, M. C.; CHO, S. J.; LEE, J. Y.; KIM, C. G.; CHOI, I. J.; PARK, S. R.; KIM, Y. W. Factors associated with detection failure and false-negative sentinel node biopsy findings in gastric cancer: results of prospective single center trials. J. Surg. Oncol., v. 99, n. 3, p. 137-142, 2009.
LEE, S. E.; LEE, J. H.; RYU, K. W.; CHO, S. J.; LEE, J. Y.; KIM, C. G.; CHOI, I. J.; KOOK, M. C.; NAM, B. H.; PARK, S. R.; LEE, J. S.; KIM, Y. W. Sentinel node mapping and skip metastases in patients with early gastric cancer. Ann. Surg. Oncol., v.16, n. 3, p. 603-608, 2009.
MARKL, B.; WUNSCH, K.; HEBICK, K. U.; ANTHUBER, M.; PROBST, A.; ARNHOLDT, H. M.; SPATZ, H. Methylene blue-assisted lymph node dissection in combination with ex vivo sentinel lymph node mapping in gastric cancer. Histopathology, v. 54, n. 4, p. 433-441, 2009.
MEKICAR, J.; OMEJC, M. Preoperative prediction of lymph node status in gastric cancer patients with the help of computer analysis. Dig. Surg., v. 26, n. 3, p. 256-261, 2009.
MORTON, D. L. Lymphatic mapping and sentinel lymphadenectomy for melanoma: past, present, and future. Ann. Surg. Oncol., v. 8, n. 9 suppl, p. 22S-28S, 2001.
MORTON, D. L.; WEN, D. R.; WONG, J. H.; ECONOMOU, J. S.; CAGLE, L. A.; STORM, F. K.; FOSHAG, L. J.; COCHRAN, A. J. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch. Surg., v. 127, n. 4, p. 392-399, 1992.
NAKAJO, A.; NATSUGOE, S.; ISHIGAMI, S.; MATSUMOTO, M.; NAKASHIMA, S.; HOKITA, S.; BABA, M.; TAKAO, S.; AIKOU, T. Detection and prediction of micrometastasis in the lymph nodes of patients with pN0 gastric cancer. Ann. Surg. Oncol., v. 8, n. 2, p. 158-162, 2001.
NIMURA, H.; NARIMIYA, N.; MITSUMORI, N.; YAMAZAKI, Y.; YANAGA, K.; URASHIMA, M. Infrared ray electronic endoscopy combined with indocyanine green injection for detection of sentinel nodes of patients with gastric cancer. Br. J. Surg., v. 91, n. 5, p. 575-579, 2004.
OHDAIRA, H.; NIMURA, H.; FUJITA, T.; MITSUMORI, N.; TAKAHASHI, N.; KASHIWAGI, H.; NARIMIYA, N.; YANAGA, K.. Tailoring treatment for early gastric cancer after endoscopic resection using sentinel node navigation with infrared ray electronic endoscopy combined with indocyanine green injection. Dig. Surg., v. 26, n. 4, p. 276-281, 2009.
OHDAIRA, H.; NIMURA, H.; MITSUMORI, N.; TAKAHASHI, N.; KASHIWAGI, H.; YANAGA, K. Validity of modified gastrectomy combined with sentinel node navigation surgery for early gastric cancer. Gastric Cancer, v.10, n. 2, p.117-122, 2007.
OLIVEIRA, A. F.; SANTOS, D. A. O.; TUCUNDUVA, T. C. M.; SANCHES, L. G.; OLIVEIRA FILHO, R. S.; ENOKIHARA, M. M. S.; FERREIRA, L. M. Sentinel lymph node biopsy in cutaneous melanoma. Acta Cir. Bras., v. 22, n. 5, p. 332-336, 2007.
OLIVEIRA FILHO, R. S.; FERREIRA, L. M.; BIASI, L. J.; ENOKIHARA, M. M. S. S.; PAIVA, G. R.; WAGNER, J. Vertical growth phase and positive sentinel node in thin melanoma. Braz. J. Med. Biol. Res., v. 36, n. 3, p. 347-350, 2003.
OLIVEIRA FILHO, R. S.; PAIVA, G. R.; FERREIRA, L. M.; ALVES, M. C.; SANTOS, I. D.; ENOKIHARA, M. M. S. S. Sentinel lymph node in children with melanoma--case report. J. Pediatr. (Rio J), v.78, n. 5, p. 429-432, 2002.
OLIVEIRA FILHO, R. S.; SANTOS, I. D.; FERREIRA, L. M.; ALMEIDA, F. A.; ENOKIHARA, M. M. S. S.; BARBIERI, A.; TOVO FILHO, R. Is intra-operative gamma probe detection really necessary for inguinal sentinel lymph node biopsy? São Paulo Med. J., v.118, n. 6, p.165-168, 2000.
ORSENIGO, E.; STAUDACHER, C. Sentinel node mapping during laparoscopic distal gastrectomy for gastric cancer. Surg. Endosc., v. 23, n. 4, p. 919, 2009.
OTT, K.; HERRMANN, K.; KRAUSE, B. J.; LORDICK, F.. The value of PET imaging in patients with localized gastroesophageal cancer. Gastrointest. Cancer Res., v. 2, n. 6, p. 287-294, 2008.
PINHEIRO, L. G. P.; VALENTE, P. V.; AGUIAR, P. H.W.; MARTINS, F. S.; SALES, L. A.S.; BARROSO, T. A.; MESQUITA NETO, J. W.; OLIVEIRA FILHO, R. S. Internal mammary lymph nodes identification from isolated sternum of human cadaver. Acta Cir. Bras., v. 21, n. 6, p. 430-433, 2006.
PINHEIRO, L. G. P.; MORAES, M. O.; SOARES, A. H.; LOPES, A. J. T.; NAGUÉRE, M. A. S. P.; BRANDÃO, C. B.; NASCIMENTO, D. C. H.; SOARES, J. P. H.; SILVA, J. M. M. Estudo experimental de linfonodo sentinela na mama da cadela com azul patente e Tecnécio Tc99m. Acta Cir. Bras., v. 18, n. 6, p. 545-552, 2003.
SAAR, L. I.; GETTY, R. Anatomia dos animais domésticos. In: SISSON, S.; GROSSMAN, J. D. Sistema linfático do carnívoro. 5. ed. Rio de Janeiro: Interamericana, 1986. cap. 56, p.1566-1568.
SANTOS, P. C.; SANTOS, I. D.; NAHAS, F. X.; OLIVEIRA FILHO, R. S.; FERREIRA, L. M. National equipment of intraoperatory gamma detection in the identification of sentinel lymph node in animal model. Acta Cir. Bras., v. 24, n. 3, p. 195-199. 2009.
SIMMONS, R. M.; SMITH, S. M.; OSBORNE, M. P.. Methylene blue dye as an alternative to isosulfan blue dye for sentinel lymph node localization. Breast J., v. 7, n. 3, p.181-183, 2001.
SLAMA, J.; DRAZDAKOVA, M.; DUNDR, P.; FISCHEROVA, D.; ZIKAN, M.; PINKAVOVA, I.; FREITAG, P.; PAVLISTA, D.; ZIMA, T.; CIBULA, D.. High-risk human papillomavirus DNA in the primary tumor, sentinel, and nonsentinel pelvic lymph nodes in patients with early-stage cervical cancer: a correlation with histopathology. Int. J. Gynecol. Cancer, v.19, n. 4, p.703-707, 2009.
TAKAHASHI, N.; NIMURA, H.; FUJITA, T.; MITSUMORI, N.; KASHIWAGI, H.; YANAGA, K. Detection of sentinel node by fluorescence and infrared ray imaging system in gastric cancer. Ann. Surg. Oncol., v. 16, n. 6, p. 1720, 2009.
TSIOULIAS, G. J.; WOOD, T. F.; MORTON, D. L.; BILCHIK, A. J. Lymphatic mapping and focused analysis of sentinel lymph nodes upstage gastrointestinal neoplasms. Arch. Surg., v. 135, n. 8, p. 926-932, 2000.
VERONESI, U.; PAGANELLI, G.; VIALE, G.; GALIMBERTI, V.; LUINI, A.; ZURRIDA, S.; ROBERTSON, C.; SACCHINI, V.; VERONESI, P.; ORVIETO, E.; CICCO, C.; INTRA, M.; TOSI, G.; SCARPA, D. Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series. J. Natl. Cancer Inst., v. 91, n. 4, p. 368-373, 1999.
VERONESI, U.; ZINGO, L. Surgical technic of breast amputation associated with axillary, internal mammary, supraclavicular and mediastinal lymph node excision. Tumori, v. 55, n. 6, p. 413-416, 1969.
WEINBERG, J.; GREANEY, E. M.; RAWLINGS, B.; HALEY, T. J. The use and toxicity of Pontamine Sky Blue. Science, v. 114, n. 2950, p. 41-42, 1951.
WINTER, A.; UPHOFF, J.; HENKE, R. P.; WAWROSCHEK, F. First results of PET / CT-guided secondary lymph node surgery on patients with a psa relapse after radical prostatectomy. Aktuelle Urol., v. 40, n. 5, p. 294-299, 2009.
ANEXOS
ANEXO A
TERMO DE APROVAÇÃO COMISSÃO DE ÉTICA EM PESQUISA
ANEXO B
TERMO DE APROVAÇÃO DEPARTAMENTO DE CIRURGIA
ANEXO C
Resolução n° 879 do Conselho Federal de Medicina Veterinária
RESOLUÇÃO Nº 879, DE 15 DE FEVEREIRO DE 2008
Dispõe sobre o uso de animais no ensino e na pesquisa e regulamenta as
Comissões de Ética no Uso de Animais (CEUAs) no âmbito da Medicina
Veterinária e da Zootecnia brasileiras e dá outras providências
Art. 3º As atividades científicas e de ensino envolvendo animais
devem ser realizadas apenas com a finalidade de:
II – realizar experimentos científicos que visam desenvolver novas
técnicas de diagnóstico e tratamento de doenças do homem e dos animais;
Art. 4º O uso de animais em atividades de ensino deve observar as
seguintes exigências:
II – não utilizar métodos que induzam o sofrimento;
IV – utilizar animais em boas condições de saúde.
Art. 7º O preceito das Cinco Liberdades do bem-estar animal deve
ser adotado com a finalidade de manter os animais:
I – livres de fome, sede e desnutrição;
II – livres de desconforto;
III – livres de dor, injúrias e doenças;
APÊNDICE A