UNIVERSIDADE DE LISBOA
Faculdade de Medicina Veterinária
AVALIAÇÃO DA EXPRESSÃO DA TOPOISOMERASE IIα EM TUMORES MAMÁRIOS CANINOS
HELENA RAQUEL CORREIA VALDEVINO
CONSTITUIÇÃO DO JÚRI ORIENTADOR
Doutor Jorge Manuel de Jesus Correia
CO-ORIENTADOR Doutor Fernando António da Costa Ferreira
2018 LISBOA Doutora Maria da Conceição da Cunha e
Vasconcelos Peleteiro
Doutor Jorge Manuel de Jesus Correia Doutora Solange Judite Roque Coelho Alves Gil
UNIVERSIDADE DE LISBOA
Faculdade de Medicina Veterinária
AVALIAÇÃO DA EXPRESSÃO DA TOPOISOMERASE IIα EM TUMORES MAMÁRIOS CANINOS
HELENA RAQUEL CORREIA VALDEVINO
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
CONSTITUIÇÃO DO JÚRI ORIENTADOR
Doutor Jorge Manuel de Jesus Correia
CO-ORIENTADOR Doutor Fernando António da Costa Ferreira
2018 LISBOA Doutora Maria da Conceição da Cunha e Vasconcelos Peleteiro
Doutor Jorge Manuel de Jesus Correia Doutora Solange Judite Roque Coelho Alves Gil
ii
Aos meus pais, por todas as oportunidades que me proporcionaram e por acreditarem em mim.
iv
“The greatness of a nation and its moral progress can be judged by the way its animals are treated.”
v
AGRADECIMENTOS
Em primeiro lugar, gostaria de agradecer ao Professor Jorge Correia por aceitar ser meu orientador e pela oportunidade de realizar este trabalho na área de Oncologia. Agradeço toda a ajuda, sabedoria, orientação e simpatia durante o período de estágio e por mostrar que há vida para além da clínica.
Ao Professor Fernando Ferreira, também pela oportunidade de participar neste projecto, por todos os conhecimentos transmitidos e por ter sempre a porta aberta às minhas dúvidas.
À FCT – Fundação para a Ciência e Tecnologia, pelo financiamento através do projecto PTDC/CVT – EPI/3638/2014, pelo qual foi possível realizar este trabalho.
À Srª. D. Maria do Rosário Luís e à Drª. Sandra Carvalho do Laboratório de Anatomia Patológica, pela ajuda durante o período de estágio. Em especial à Sandra por todas as explicações e simpatia na fase laboratorial do trabalho.
À Drª. Angelina Pedrosa pela ajuda e disponibilidade em fornecer os dados necessários à elaboração deste estudo.
À Drª. Cláudia Marques por toda a ajuda no tratamento estatístico dos dados.
A todos os Professores desta faculdade e profissionais do Hospital Escolar Veterinário por me ajudarem a formar enquanto veterinária.
Ao Dr. Pedro Pinho Lopes e Drª. Rita Pinho Lopes, um agradecimento especial por estarem sempre disponíveis a me receberem na clínica, e permitirem o primeiro contacto direto do que é ser médica veterinária.
À minha família, sobretudo aos meus pais, por todo o apoio e confiança, e por me permitirem sempre escolher o meu caminho. Sem vocês não teria chegado até aqui.
Às minhas amigas Mónica, Sílvia, Jéssica, Ana e Sofia, por continuarem ao meu lado ao fim destes anos todos, e tanta paciência que tiveram ao longo deste curso.
À Teresa, a minha amiga mais antiga, pelo apoio e coragem durante estes anos.
Agradeço também a todos os meus colegas de curso, principalmente à Raquel e à Vânia, que foram sem dúvida um pilar durante todo este percurso desde o primeiro ano.
E por último, mas não menos importante, a todos os animais que passaram pela minha vida, que me fizeram ver desde criança que o meu futuro passaria por cuidar deles, e por me ensinarem responsabilidade e compromisso.
vi
Avaliação da expressão da Topoisomerase IIα em tumores mamários
caninos
RESUMO
As neoplasias mamárias representam a neoplasia mais frequente em cadelas não esterilizadas, assumindo grande importância em clínica veterinária. Neste estudo foram analisados carcinomas mamários de cadela por imunohistoquímica (IHQ) para quantificação e avaliação da expressão da Topoisomerase IIα (TOPIIA).
Objetivo: Quantificar a expressão da TOPIIA em carcinomas mamários de cadela, e correlacionar a expressão desta com variáveis como o Ki-67, a expressão de HER-2, a dimensão, o grau de malignidade e o tipo histológico do carcinoma.
Materiais e métodos: Cinquenta e seis carcinomas mamários e cinco amostras de tecido mamário normal, foram submetidos a IHQ para avaliar a expressão de TOPIIA, e em cada caso foram classificadas 1000 células de marcação negativa, fraca, moderada ou forte.
Resultados: Dos 56 tumores mamários analizados, 53,57% foram considerados positivos para a expressão da TOPIIA. Comprovou-se a existência de correlação positiva entre a sobreexpressão da TOPIIA e do Ki-67 (p=0,0364), e entre a sobreexpressão da proteína e menor tempo de sobrevivência (p=0,0264). Contudo, não foi demonstrada correlação entre as variáveis grau de malignidade, dimensão, tipo histológico do tumor e a sobreexpressão do HER-2.
Conclusões: Este estudo sugere que a expressão da TOPIIA é maior nas células de carcinomas mamários do que nas células de tecido mamário normal, sendo que as cadelas com tumores classificados como positivos apresentaram menor tempo de sobrevivência, podendo este marcador ser considerado como fator de prognóstico. Contudo é indispensável a realização de mais estudos sobre este assunto, que contribuam para um maior conhecimento da importância desta proteína em oncologia veterinária assim como em medicina humana.
Palavras-chave: tumor mamário, carcinoma mamário, topoisomerase IIα, imunohistoquímica, antraciclina, prognóstico.
vii
Topoisomerase IIα expression in canine mammary tumors
ABSTRACT
Mammary tumors are the most common neoplasm in intact female dogs; therefore they are extremely important in veterinary clinic. The aim of this study was to assess Topoisomerase IIα (TOPIIA) expression in canine mammary carcinomas by immunohistochemistry (IHC). Objective: To quantify the expression of TOPIIA in mammary carcinomas in female dogs, and correlate its expression with other factors such as Ki-67, HER-2, tumor size, histologic grade and type.
Patients and methods: Fifty six mammary carcinomas and five samples of normal breast tissue were analyzed by IHC, and in each case, 1000 cells were classified accordingly to their labeling intensity: negative, weak, moderate or strong.
Results: 53,57% of the 56 mammary tumors were considered to have increased expression of TOPIIA. A positive correlation between positive TOPIIA tumors and Ki-67 overexpression (p=0,0364) and an inferior survival time (p=0,0264) was found. However, there was no correlation between TOPIIA expression and histologic grade, tumor size and HER-2 positivity.
Conclusions: This study supports the idea that mammary tumors cells have higher TOPIIA expression than normal breast tissue cells, and animals with those considered to be positive tumors, have a lower survival time, which can indicate that TOPIIA expression may be considered as a prognostic factor. It is however important that more studies be performed, to assess the importance of this protein in veterinary oncology as well in human medicine.
Key-words: mammary tumor, mammary carcinoma, topoisomerase IIα, immunohistochemistry, anthracycline, prognostic.
viii
ÍNDICE GERAL
AGRADECIMENTOS ... V RESUMO ... VI ABSTRACT ... VII ÍNDICE DE FIGURAS ... X ÍNDICE DE TABELAS ... XI LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS ... XIII. RELATÓRIO DE ESTÁGIO ... 1
II. INTRODUÇÃO ... 2
III. REVISÃO BIBLIOGRÁFICA ... 3
III.1. CANCRO, DO QUE FALAMOS? ... 3
III.2. ANATOMIA E HISTOLOGIA DA GLÂNDULA MAMÁRIA ... 4
III.3. NEOPLASIA MAMÁRIA EM ANIMAIS DOMÉSTICOS ... 5
III.3.1. Circulação sanguínea e linfática da glândula mamária ... 6
III.3.1.1. Circulação sanguínea ...6
III.3.1.2. Circulação linfática ...6
III.3.2. Fatores de risco ... 7
III.3.3. Diagnóstico e estadiamento de tumores mamários ... 9
III.3.4. Classificação histológica ... 10
III.3.5. Prognóstico ... 11
III.3.6. Tratamento ... 13
III.3.6.1. Cirurgia ...14
III.3.6.2. Quimioterapia ...14
III. 3.6.3. Radioterapia ...16
III. 3.6.4. Terapia hormonal ...16
III.4. ONCOLOGIA COMPARADA (MULHER VS CADELA) ... 16
III.5. TOPOISOMERASES ... 17
III.5.1 Biologia da topoisomerase ... 17
III.5.2. Tipos de TOPII ... 18
III.5.3. Importância clínica da TOPIIA ... 19
III.5.4. Determinação da TOPIIA ... 21
III.6. IMUNOHISTOQUÍMICA ... 21
III.6.1. Técnica IHQ... 21
III.6.2. Imunoglobulinas ... 22
III.6.3. Anticorpos... 23
III.6.3.1. Anticorpos policlonais ...23
III.6.3.2. Anticorpos monoclonais ...24
III.6.4. Métodos de deteção ... 24
III.6.4.1. Método de polímero indireto ...25
III.6.5. Etapas na IHQ ... 26
III.6.6. Pontos críticos na IHQ ... 26
III.6.7. Padronização e otimização da técnica ... 27
IV. OBJETIVOS DO TRABALHO EXPERIMENTAL ...28
V. MATERIAL E MÉTODOS ...28
V.1. RECOLHA DE MATERIAL ... 28
ix
V.3. SELEÇÃO DOS CONTROLOS ... 29
V.4. CARACTERIZAÇÃO DO ANTICORPO PRIMÁRIO ... 30
V.5. TÉCNICA IHQ ... 30
V.6. CLASSIFICAÇÃO DA IMUNOMARCAÇÃO FINAL DA TOPIIA ... 32
V.7. ANÁLISE ESTATÍSTICA ... 33
VI. RESULTADOS...34
VI.1. AVALIAÇÃO DA EXPRESSÃO DA TOPIIA ... 34
VI.2. EXPRESSÃO DA TOPIIA VERSUS ESTATUTO DO HER-2 ... 38
VI.3. EXPRESSÃO DA TOPIIA VERSUS KI-67 ... 39
VI.3.1. Avaliação do Ki-67 (cut-off de 10%) ... 39
VI.3.2. Avaliação do Ki-67 como variável contínua ... 39
VI.4. EXPRESSÃO DA TOPIIA VERSUS DIMENSÃO DO CARCINOMA ... 40
VI.4.1. Análise da dimensão dos TMC enquanto variável contínua ... 40
VI.4.2. Análise da dimensão dos TMC por classes ... 40
VI.5. EXPRESSÃO DA TOPIIA VERSUS GRAU DE MALIGNIDADE DOS TMC ... 40
VI.6. EXPRESSÃO DA TOPIIA VERSUS TIPO HISTOLÓGICO ... 41
VI.7. EXPRESSÃO DA TOPIIA E CURVA DE SOBREVIVÊNCIA ... 42
VII. DISCUSSÃO ...43
VIII. CONCLUSÕES ...47
IX. PERSPETIVAS FUTURAS ...48
X. BIBLIOGRAFIA ...49
x
ÍNDICE DE FIGURAS
Figura 1 - Distribuição das glândulas mamárias na cadela (adaptado de Dyce et al., 2010) ... 4
Figura 2a e 2b– Linfonodos e vasos sanguíneos das glândulas mamárias da cadela (adaptado de Dyce et al., 2010) ... 7
Figura 3 - Diagrama de decisão do tratamento na neoplasia mamária canina (adaptado de Dobson & Lascelles, 2011). ... 13
Figura 4 - Estrutura química de alguns fármacos quimioterapêuticos: 5- fluoracil e doxorrubicina (adaptado de Nitiss, 2009). ... 15
Figura 5 – Mecanismo de ação das TOPII (adaptado de Nitiss, 2009). ... 18
Figura 6 - Modelo da TOPIIA humana (adaptado de McCledon & Osheroff, 2007). ... 19
Figura 7 - Cromossoma 17 (Humano): Região 17q12 a 17q21, onde se encontram respetivamente os genes do HER-2 e TOPIIA (adaptado de Romero et al, 2012). ... 21
Figura 8 - Estrutura de uma imunoglobulina (adaptado de Ramos-Vara, 2005). ... 23
Figura 9 - Produção de soros de anticorpos monoclonais (adaptado de Michnick & Sidhu, 2008). ... 24
Figura 10 - Método de IHQ indireta baseado em polímero de dextrano (adaptado de Taylor & Rudbeck, 2013). ... 25
Figura 11 - Controlo positivo: Linfonodo de cão com várias intensidades de marcação. Coloração de fundo pela Hematoxilina de Gill 2 (Barra=20 µm). ... 29
Figura 12 - Controlo negativo: Linfonodo normal de cão com ausência de marcação. Coloração de fundo pela Hematoxilina de Gill 2 (Barra= 20 µm). ... 29
Figura 13 – Imunomarcação para TOPIIA em tecido mamário normal e carcinomas mamários com marcação específica de células neoplásicas de diferentes intensidades. Coloração de fundo pela Hematoxilina de Gill 2. (Barra = 20µm). ... 34
Figura 14 - Gráfico representativo do número de células associado a cada intensidade de expressão da TOPIIA, em tecido mamário normal e carcinomas mamários. ... 37
Figura 15 - Distribuição dos TMC consoante a sua classificação para TOPIIA e Ki-67. ... 39
Figura 16 - Correlação entre TOPIIA e Ki-67. ... 40
Figura 17- Distribuição dos tipos histológicos dos TMC quanto à classificação da TOPOIA. ... 42
Figura 18 - Curva de Kaplan-Meier do tempo de sobrevivência, em função da expressão da TOPIIA no tumor. ... 42
xi
ÍNDICE DE TABELAS
Tabela 1 – Drenagem linfática normal e neoplásica da glândula mamária na cadela (adaptado de Sorenmo et al., 2011) ... 7 Tabela 2 – Sistema de estadiamento modificado da WHO – Estadiamento TNM (adaptado de Sorenmo et al., 2011) ... 9 Tabela 3 – Classificação histológica de tumores mamários da cadela, segundo as classificações de 1974 e 1999 (adaptado de Goldschmidt et al., 2011). ... 10 Tabela 4 – Critérios de classificação do grau histológico de malignidade – método de Elston e Ellis (adaptado de Goldschmidt et al., 2017). ... 12 Tabela 5 – Tipos de cirurgias recomendadas em tumores mamários de cadela (adaptado de Dobson & Lascelles, 2011). ... 14 Tabela 6 - Métodos imunohistoquímicos (adaptado de Ramos Vara, 2005; Taylor & Rudbeck, 2013)24 Tabela 7- Etapas e variáveis da técnica IHQ (adaptado de Ramos-Vara & Borst, 2017). ... 26 Tabela 8 - Número de células analisadas e classificadas para a intensidade de marcação de TOPIIA em amostras de tecido mamário normal, e respetiva mediana. ... 35 Tabela 9 - Número de células observadas por amostra de TMC, distribuídas por intensidade, e
respetiva classificação do tumor com base num cut-off de 45%. ... 35 Tabela 10- Comparação dos níveis de significância da expressão da TOPIIA em células negativas e positivas no tecido mamário normal e tecido de carcinomas mamários. ... 37 Tabela 11 - Comparação dos níveis de significância relativos à intensidade de marcação em tecido mamário normal e carcinoma mamários. ... 38 Tabela 12 - Tabela de contingência com as percentagens de TMC quanto à sua classificação para TOPIIA e Ki-67. ... 39
xii
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
ADN – ácido desoxirribonucleico ARN – ácido ribonucleico ATP – adenosina trifosfato
CISH – hibridização in situ cromogénica, “chromogenic in situ hybridization” CK – citoqueratinas
CMF – tratamento quimioterapêutico com ciclofosfamida, metotrexato e 5-fluororacilo DAB – 3,3’ - diaminobenzidina tetrahidrocloreto
EBCTCG – Early Breast Caner Trialist´s Collaborative Group EDTA – ácido etilenodiaminotetraacético
Fab – “fragment antigen binding”
FAC – tratamento quimioterapêutico com 5-fluorouracil, adriamicina (doxorrubicina) e ciclofosfamida
Fase G0 – fase quiescente do ciclo celular
Fase G1 – fase de pré-síntese de ADN do ciclo celular Fase G2 – fase pré-mitótica do ciclo celular
Fase M – fase mitótica do ciclo celular Fase S – fase de síntese do ciclo celular FC – fração cristalizável
FEC – tratamento quimioterapêutico com 5-fluororacil, epirubicina e ciclofosfamida FISH – hibridização in situ por fluorescência, “fluorescent in situ hibridization” FMV – Faculdade de Medicina Veterinária
HER-2 – recetor do fator de crescimento epidérmico humano tipo 2 HRP – Horseradish peroxidase
Ig – imunoglobulina
IHC – immunohistochemistry IHQ – imunohistoquímica
Ki-67 – marcador de proliferação celular
NCBI – National Center forBiotechnology Information OMS – Organização Mundial de Saúde
OVH – ovariohisterectomia p – valor de prova, “p-value”
PAAF – punção aspirativa por agulha fina PBS – tampão fosfato salino
xiii PCR – Polimerase Chain Reaction
RE – recetor de estrogénio
ROS – espécies reativas de oxigénio, “reactive oxygen species” RP – recetor de progesterona
SMA-α – smooth muscle actin-α TBS – tris buffered saline
TMC – tumores mamários caninos
TNM – Tumor size, node infiltration, metastasis TOP – Topoisomerase
TOPI – topoisomerase I TOPII – topoisomerase II TOPIIA – topoisomerase IIα TOPIIB – topoisomerase IIβ TS – tempo de sobrevivência WHO – World Health Organization
1
I. RELATÓRIO DE ESTÁGIO
O estágio curricular foi realizado entre 1 de fevereiro e 28 de julho de 2017, no Laboratório de Anatomia Patológica e no Hospital Escolar, pertencentes à Faculdade de Medicina Veterinária (FMV) da Universidade de Lisboa. Durante este período, acompanhei o Professor Doutor Jorge Correia, orientador da presente tese de mestrado, nas seguintes atividades: - Corte e processamento de tumores mamários de cadela e de gata, provenientes maioritariamente do Hospital Escolar, mas também de clínicas e hospitais externos. Pude assistir à extirpação cirúrgica de vários tumores no Hospital Escolar (mastectomias), e ainda assistir e realizar o corte de amostras para futura análise histopatológica.
- Observação microscópica e classificação histológica quanto ao tipo e grau de malignidade dos tumores mamários, e realização dos relatórios.
- Acompanhamento das consultas de citologia realizadas no Hospital Escolar, observando técnicas de recolha citológica como punção aspirativa por agulha fina (PAAF) e biópsias cutâneas, tendo tido oportunidade de realizar algumas PAAF nos animais presentes às consultas.
- Análise microscópica e diagnóstico das amostras citológicas.
- Realização da técnica de imunohistoquímica indireta, com otimização do processo, relativamente à diluição do anticorpo usado e tempo de incubação.
- Acompanhamento das aulas práticas de Anatomia Patológica II, onde pude auxiliar os alunos presentes nas necrópsias realizadas, e acompanhei também o Professor Doutor Jorge Correia na realização de outras necrópsias não incluídas nas aulas de Anatomia Patológica, o que me permitiu aperfeiçoar esta técnica.
- Tive ainda a oportunidade de assistir a duas necrópsias forenses com o Professor Doutor José Ferreira da Silva, nas quais pude aprofundar conhecimentos sobre o procedimento e a importância de uma necrópsia forense.
Durante o período de estágio assisti também a várias consultas e cirurgias no Hospital Escolar da FMV, e em Agosto realizei um estágio extra-curricular no Hospital Veterinário da Arrábida, no âmbito da reabilitação animal.
2
II. INTRODUÇÃO
Os tumores mamários caninos (TMC) são das neoplasias com maior importância em medicina veterinária, sendo inclusivé a neoplasia mais comum na cadela inteira (Schneider, Dorn & Taylor, 1969; Sorenmo, Rasotto, Zapulli & Goldschmidt, 2011; Rasotto, Zappulli, Castagnaro & Goldschmidt, 2012; Goldschmidt, Peña & Zappulli, 2017). Em animais domésticos, cerca de 50% dos tumores mamários são malignos e a maioria é de origem epitelial (carcinomas) (Dyce, Sack & Wensing, 2010; Rasotto et al., 2012). Comparativamente à gata, os tumores mamários na cadela são mais frequentes, embora menos agressivos (Goldschmidt et al., 2017). São vários os fatores que levam ao seu aparecimento, como a idade, a exposição hormonal, a raça, a alimentação e a condição corporal (Sorenmo et al., 2011). A exposição hormonal é considerado o fator mais importante, sendo que a esterilização, por ovariohisterectomia (OVH) antes do primeiro cio, reduz o risco de aparecimento da neoplasia mamária a 0,5% (Goldshmidt et al., 2017; Kwon et al., 2017). O tratamento de eleição de TMC continua a ser a cirurgia e, na maioria dos casos, é suficiente para a cura do animal. Contudo, a quimioterapia torna-se necessária no tratamento coadjuvante em alguns animais. As antraciclinas são o grupo de fármacos mais utilizado em tratamentos quimioterapêuticos devido à sua eficácia, no entanto têm sérios efeitos secundários. A Topoisomerase IIα (TOPIIA) é uma enzima essencial no metabolismo do ácido desoxirribonucleico (ADN) nos processos de replicação, mitose e outros eventos moleculares, uma vez que é capaz de alterar a conformação do ADN (Burden & Osheroff, 1998). Tem importância clínica em oncologia por ser considerada o alvo terapêutico de vários fármacos utilizados em quimioterapia, tais como, as antraciclinas. Como a TOPIIA encontra-se sobreexpressa em vários tipos de tumor (Heestand, Schwaederle, Gatalica, Arguello & Kurzrock, 2017), tem sido alvo de vários estudos em medicina humana, com o objetivo de analisar a sua validade como marcador de proliferação celular ou como fator preditivo de resposta ao tratamento quimioterapêutico, embora haja vários estudos contraditórios em medicina humana. De facto, desconhece-se se níveis elevados de expressão da proteína TOPIIA permitem uma maior sensibilidade à ação dos fármacos quimioterapêuticos, ou se o aumento de expressão de TOPIIA, ao indicar uma maior atividade proliferativa, pode torná-la válida como fator de prognóstico. Em medicina veterinária, a expressão desta proteína ainda não foi estudada, pelo que tal foi o objetivo do presente trabalho, para que se possa fornecer mais informação sobre a neoplasia mamária canina, e na esperança que se venha a aprofundar também o conhecimento da medicina humana.
3
III. REVISÃO BIBLIOGRÁFICA
III.1. Cancro, do que falamos?
O termo tumor ou neoplasia refere-se a um crescimento anormal de células, a um ritmo maior que o normal, de uma forma persistente e descontrolada. Este crescimento pode ter início em qualquer célula de qualquer órgão, e o seu desenvolvimento vai levar a efeitos deletérios não só nesse local, como ao infiltrar-se em outros órgãos, designando-se neste caso por metástases (Morris & Dobson, 2001). As neoplasias primárias podem ser benignas ou malignas, em que apenas as malignas metastizam. O termo cancro, devido ao maior impacto psicológico que causa, é reservado para neoplasias malignas. O processo de carcinogénese ainda não está bem determinado, mas é aceite que resulta de um acumular de erros no ADN das células, que afetam a proliferação e diferenciação celulares. São consideradas duas classes de genes como responsáveis pelo início da carcinogénese: os proto-oncogenes, cuja ação excessiva leva à sobreprodução de fatores de crescimento de células; e os genes supressores de tumores, que normalmente deveriam impedir o crescimento anormal de células, mas que por uma mutação, não o fazem, permitindo a multiplicação de células aberrantes descontroladamente (Dobson & Lascelles, 2011).
O cancro é a causa de morte número um em cães, mas, ao contrário de outras doenças como a doença renal crónica ou cardíaca, com um diagnóstico precoce e tratamento adequado, pode levar à cura ou a um longo período de remissão, com grande qualidade de vida (Nelson & Couto, 2014). É por isso importante o desenvolvimento da medicina veterinária e uma maior atenção dos donos aos seus animais de estimação, para permitir a deteção e diagnóstico precoce destas neoplasias. A oncologia veterinária é uma área em estudo contínuo, dada a complexidade da biologia do tumor, e da variedade entre neoplasias e entre espécies. A exigência dos donos permite ao médico veterinário usar uma variedade de métodos de diagnóstico e tratamento como a cirurgia, a quimioterapia e a radioterapia.
Os tumores mais frequentes em animais domésticos são os da pele, seguidos pelos tumores da glândula mamária e tecidos hematopoiéticos (incluindo linfonodos) (Morris & Dobson, 2001). Na mulher, os tumores mamários são os mais comuns, tanto em países mais desenvolvidos como sub-desenvolvidos. Estima-se que em 2011 cerca de 508 000 mulheres tenham morrido com esta doença (Global Health Estimates, World Health Organization [WHO], 2013). A taxa de sobrevivência é muito variável, mas o fator mais importante é, sem dúvida, a deteção precoce da doença para garantir um melhor prognóstico e sucesso no tratamento (WHO, 2013).
4
III.2. Anatomia e histologia da glândula mamária
As cadelas têm normalmente cinco pares de glândulas mamárias, embora glândulas supranumerárias possam ser encontradas nas regiões torácica e abdominal (Dyce et al., 2010). Os dois primeiros pares são as glândulas mamárias torácicas (craniais e caudais), os dois pares seguintes as glândulas mamárias abdominais (craniais e caudais) e o último par corresponde às glândulas mamárias inguinais (Goldschmidt et al., 2017) (Figura 1). O desenvolvimento destas glândulas ocorre em grande parte na fêmea adulta, apenas durante a gestação (com o aumento dos níveis de progesterona), com proliferação de tecido ductal, diferenciação de ácinos e secreção de leite (Sorenmo et al., 2011).
● ● ● ● ● ● ● ● ● ●
Figura 1 - Distribuição das glândulas mamárias na cadela (adaptado de Dyce et al., 2010)
A glândula mamária é uma glândula apócrina sudorípara modificada, localizada subcutâneamente, e encontrada apenas em mamíferos (Sorenmo et al., 2011). Cada glândula mamária tem uma formação túbulo-alveolar composta, com as unidades secretoras a formarem entre 5 a 25 lóbulos separados por septos de tecido conjuntivo, e rodeada por tecido adiposo. Tem na sua constituição, os alvéolos, estroma (tecido conjuntivo), ductos, vasos e nervos (Dyce et al., 2010; Sorenmo et al., 2011; Goldschmidt et al., 2017). A partir de cada lóbulo forma-se um ducto excretor, o ducto interlobular, que drena para o ducto galactóforo. Estes vão convergir nos seios lactíferos ou lactóforos e abrem-se direta e independentemente no mamilo, em número variável (7 a 16 aberuras ou óstios externos) (Junqueira & Carneiro, 2008).
Os ductos interlobulares são revestidos por epitélio simples cilindrico ou cúbico simples, envolvido por células mioepitelais. A camada de células mais interior tem uma função secretora e protetora, e as células mioepiteliais têm função contráctil (sendo responsáveis pela descida do leite) (Goldschmidt et al., 2017). Estas duas camadas são delimitadas pela membrana basal, composta principalmente por colagénio de tipo IV, laminina e proteoglicanos (Sorenmo et al., 2011).
Os ductos galactóforos são compostos por uma camada dupla de células epiteliais cúbicas ou cilíndricas baixas. Este epitélio transforma-se em epitélio estratificado pavimentoso nas aberturas externas dos ductos galactóforos (Junqueira & Carneiro, 2008).
5
O mamilo sendo a porção terminal da glândula mamária é revestido por epiderme externamente e os seus ductos por epitélio estratificado escamoso. Os seios lactóforos por outro lado são revestidos por epitélio colunar ou cuboide (Junqueira & Carneiro, 2008; Goldschmidt et al., 2017).
III.3. Neoplasia mamária em animais domésticos
Os tumores mamários são muito comuns em cães e gatos, mas raros em outras espécies domésticas (Goldschmidt et al., 2017). De facto, esta é a neoplasia mais comum na cadela inteira (Schneider et al., 1969; Sorenmo et al., 2011; Rasotto et al., 2012), sendo rara nos machos (Goldschmidt, Penã, Rasotto & Zappulli, 2011; Goldschmidt et al., 2017). A prevalência desta neoplasia varia consoante a localização geográfica (Goldschmidt et al., 2017).
Em animais domésticos, cerca de 50% dos tumores mamários são malignos e a maioria é de origem epitelial (carcinomas) (Dyce et al., 2010; Rasotto et al., 2012; Benavente, Bianchi & Aba, 2016). Estes tumores são mais frequentes em cadelas do que em gatas, contudo têm menor agressividade (Novosad, 2013; Goldschmidt et al., 2017).
A apresentação clássica é a de uma cadela de meia idade ou mais velha, não esterilizada, ou com esterilização tardia, e que apresenta um ou mais nódulos nas cadeias mamárias (Sorenmo et al., 2011). Tumores benignos são normalmente mais pequenos (menos de 1cm de diâmetro), bem delimitados, firmes à palpação e com crescimento mais lento, enquanto que tumores malignos são localmente invasivos com infiltração em tecidos profundos ou na pele, podendo encontrar-se ulcerados, e apresentam um crescimento mais rápido (com diâmetro superior a 3cm) (Sorenmo et al., 2009; Benavente et al., 2016). Apesar de ser frequente o aparecimento de múltiplos nódulos mamários, pouco se sabe se estão relacionados entre si, ou se são independentes (Sorenmo et al., 2009).
A maioria dos animais apresenta mais de um tumor mamário, na altura do diagnóstico, podendo apresentar tamanhos e tipos histológicos diferentes (multiplicidade primária), pelo que todos os tumores devem ser retirados por cirurgia e submetidos a análise histopatológica (Misdorp, Else, Hellmén & Lipscomb, 1999; Peleteiro et al., 2011). Parece haver maior incidência desta neoplasia nas glândulas mamárias inguinais (Goldschmidt et al., 2017), talvez devido à maior quantidade de tecido mamário nesse local, comparando com as glândulas mamárias torácicas.
Além da presença de uma ou mais massas na região da cadeia mamária, a maioria dos animais não aparenta quaisquer sinais clínicos (exceção é o caso do carcinoma inflamatório), a não ser que a neoplasia já tenha metastizado. Como o primeiro local de metastização à distância é o
6
pulmão, a dificuldade respiratória é a apresentação clínica mais frequente, em animais com um estado de doença mais avançado, juntamente com um estado de caquexia (Sorenmo et al., 2011; Goldschmidt et al., 2017).
III.3.1. Circulação sanguínea e linfática da glândula mamária
Para compreender a evolução do tumor e progressão das metástases, é necessário conhecer o padrão de circulação sanguínea e linfática. As neoplasias mamárias podem metastizar por via sanguínea ou linfática. Os carcinomas metastizam frequentemente através do sistema linfático, enquanto que os sarcomas (osteossarcoma ou fibrossarcoma mamários) metastizam preferencialmente por via sanguínea (Rasotto et al., 2012; Goldschmidt et al., 2017).
III.3.1.1. Circulação sanguínea
Diferentes artérias fornecem sangue às glândulas mamárias, e paralelamente encontram-se as veias que fazem a sua drenagem. A glândulas torácicas craniais são irrigadas por ramos craniais da artéria torácica interna e artéria intercostal, enquanto que as glândulas mamárias torácicas caudais e abdominais craniais são irrigadas pela artéria epigástrica superficial cranial, que anastomosa com a artéria epigástrica superficial caudal. As glândulas mamárias abdominais caudais e as inguinais são irrigadas pela artéria epigástrica superficial caudal e artéria abdominal caudal. As glândulas mamárias abdominais caudais recebem ainda sangue das artérias pudenda externa e ramo cutâneo da artéria frénico-abdominal (Sleeckx, Rooster, Kroeze, Ginneken, Brantegem, 2011; Goldschmidt et al., 2017).
A drenagem sanguínea é feita pela veia epigástrica superficial cranial, para as glândulas torácicas (cranial e caudal) e glândulas mamárias abdominais craniais; e pela veia pudenda externa para as glândulas mamárias abdominais caudais e inguinais (Sleeckx et al., 2011; Goldschmidt et al., 2017). Quanto à linha central entre as glândulas mamárias esquerdas e direitas são poucos os vasos que existem nesta área (Sleeckx et al., 2011) (Figura 2).
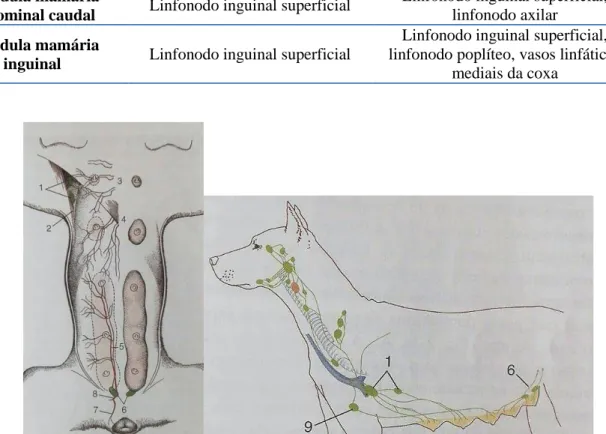
III.3.1.2. Circulação linfática
O sistema linfático é importante para a metastização das células tumorais, como já foi referido, principalmente em carcinomas. Cada glândula mamária tem uma rede de vasos linfáticos que drena para os linfonodos. Em animais saudáveis a drenagem é feita para os linfonodos ipsilaterais, por exemplo as glândulas mamárias torácicas craniais e caudais drenam apenas para o linfonodo axilar ipsilateral (Sorenmo et al., 2011). As glândulas abdominais craniais drenam para o linfonodo axilar e inguinal superficial. As glândulas abdominais caudais e inguinais drenam para o linfonodo inguinosuperficial ipsilateral. Certas neoplasias como os carcinomas mamários apresentam mais anastomoses em comparação com
7
as glândulas mamárias normais (Tabela 1). Estas novas ligações dos linfonodos podem levar a uma alteração do padrão de drenagem linfática, através da formação de novos caminhos para a propagação de células neoplásicas, aumentando a probabilidade de metastização (Sleeckx et al., 2011).
Tabela 1 – Drenagem linfática normal e neoplásica da glândula mamária na cadela (adaptado de Sorenmo et al., 2011)
Glândula mamária Drenagem linfática normal Drenagem linfática neoplásica
Glândula mamária
torácica cranial Linfonodo axilar Linfonodo axilar, linfonodo esternal Glândula mamária
torácica caudal Linfonodo axilar Linfonodo axilar, linfonodo esternal Glândula mamária
abdominal cranial
Linfonodo axilar, linfonodo inguinal superficial
Linfonodo axilar, linfonodo inguinal superficial, linfonodo iliaco medial
Glândula mamária
abdominal caudal Linfonodo inguinal superficial
Linfonodo inguinal superficial, linfonodo axilar
Glândula mamária
inguinal Linfonodo inguinal superficial
Linfonodo inguinal superficial, linfonodo poplíteo, vasos linfáticos
mediais da coxa
Figura 2a e 2b– Linfonodos e vasos sanguíneos das glândulas mamárias da cadela (adaptado de Dyce et al., 2010)
Legenda: 1-Linfonodos axilar e axilar acessório; 2-Ramo da artéria torácica lateral; 3-Ramos perfurantes dos vasos torácicos internos; 4-Ramificações dos vasos epigástricos craniais superficiais; 5-Artéria epigástrica caudal superficial; 6-Linfonodos inguinais superficiais; 7-Ramos labial ventral para a vulva; 8- Artéria pudenda externa; 9-Linfonodo esternal.
III.3.2. Fatores de risco
A idade é um dos principais fatores de risco para o aparecimento de tumores mamários, sendo que, os animais mais afetados são os de meia-idade a mais velhos, entre 7 a 13 anos. Neoplasias benignas ocorrem mais frequentemente nos animais mais jovens entre 7 a 9 anos,
8
enquanto que as malignas em animais de mais idade (Sorenmo et al., 2011; Goldschmidt et al., 2017). Neoplasias mamárias em animais com menos de 5 anos de idade são raras, a não ser que lhes tenham sido administradas hormonas exógenas (considerado o segundo maior fator de risco) (Sorenmo et al., 2011).
A exposição hormonal vai aumentar o risco de tumores mamários, e diminui a idade de incidência desta neoplasia, como é o caso de fêmeas inteiras ou com história de administração de hormonas exógenas, como anticoncecionais (Sorenmo et al., 2011; Goldschmidt et al., 2017; Kwon et al., 2017). Vários estudos indicam que a esterilização no animal jovem é a melhor forma de prevenir o aparecimento de tumores, sendo que a partir dos quatro anos de idade, este beneficio torna-se nulo. Fêmeas submetidas a OVH antes do primeiro cio, têm apenas 0,5% de probabilidade de desenvolverem tumores mamários, o que indica que seria a exposição a hormonas ováricas a responsável pelo aparecimento destes tumores (Goldschmidt et al., 2017; Kwon e al., 2017). A probabilidade aumenta para 8% e 26% se a cirurgia for realizada após o primeiro e segundo cio, respetivamente (Schneider et al., 1969; Salas, Márquez, Diaz & Romero, 2015; Goldschmidt et al., 2017). O uso de anticoncecionais está relacionado com o aparecimento de tumores mamários em cadelas, sendo que doses baixas de progesterona, estão normalmente associadas a tumores benignos, enquanto que a administração de progesterona e estrogénios, parece causar mais neoplasias malignas (Goldschmidt et al., 2017). Segundo Schneider et al. (1969) a pseudogestação não constitui um fator de risco por si só, não influenciando o aparecimento de neoplasias mamárias.
A raça é também considerada um fator de risco, pois animais de raça grande desenvolvem tumores mais cedo, embora os de raça pequena apresentem estes tumores mais frequentemente (Sorenmo et al., 2011; Goldschmidt et al., 2017). As raças mais comuns são Cocker Spaniel, Pastor Alemão, Pointer, English Setter, Chihuahua, Beagle, Dachshund, West Highland White Terrier, Yorkshire Terrier, Bichon Frisé, Labrador Retriviers, Samoyedos entre outras (Sorenmo et al., 2011; Novosad, 2013).
Também a dieta e condição corporal parecem afetar a prevalência de tumores mamários. Animais obesos ao primeiro ano de idade, ou com uma alimentação rica em carne vermelha correm maior risco desta neoplasia (o tecido adiposo é uma fonte importante de estrogénios, devido à ação da aromatase que transforma androgénios em estrogénios) (Benavente et al., 2016). Como na mulher, uma alimentação baixa em gordura é aconselhada, pensa-se que também nos animais domésticos, uma alimentação deste tipo poderá ser benéfica, ao ponto de aumentar a taxa de sobrevivência após a excisão de uma neoplasia maligna (Goldschmidt et al., 2017).
9
III.3.3. Diagnóstico e estadiamento de tumores mamários
O diagnóstico de neoplasia mamária é feito essencialmente por citologia ou histopatologia, não esquecendo a importância de um exame do estado geral e imagiológico ao animal. Dada a frequência da patologia da mama, a análise citológica da mesma para obter um diagnóstico, é das análises mais realizadas em laboratório. Pelos diversos tipos de lesões que acometem a glândula mamária, o diagnóstico citológico pode por vezes ser inconclusivo, e apresenta várias dificuldades. Não é uma análise completamente rigorosa e não fornece informações sobre o grau de infiltração e a invasão vascular. Logo o diagnóstico definitivo é sem dúvida a análise histopatológica do material enviado após a cirurgia (Peleteiro et al., 2011).
O estadiamento refere-se à extensão da doença e passa por uma classificação segundo um sistema TNM (tumor size, node infiltration, metastasis) estabelecido pela Organização Mundial de Saúde (OMS) e tem em conta o tamanho e extensão do tumor primário (considerar o maior diâmetro possível), infiltração de células neoplásicas nos linfonodos regionais e a presença ou não de metástases à distância (National Cancer Institute, 2015) (Tabela 2). Este sistema foi proposto inicialmente em 1980 pela OMS e revisto posteriormente em 2001. Permite a adequação do tratamento consoante o estadio e facilita o registo médico para acompanhar a evolução do tumor, além de que por ser um sistema universal, permite a comparação de casos. Pode também ter valor prognóstico, pois um estadio mais avançado reflete um pior prognóstico (Sorenmo et al, 2011).
Tabela 2 – Sistema de estadiamento modificado da WHO – Estadiamento TNM (adaptado de Sorenmo et al., 2011)
Sistema de estadiamento modificado de tumores mamários caninos
Estadio I T1 N0 M0
Estadio II T2 N0 M0
Estadio III T3 N0 M0
Estadio IV Qualquer T N1 M0
Estadio V Qualquer T Qualquer N M1
T- Tumor primário
T1 < 3cm de diâmetro T2 3-5cm de diâmetro T3 > 5cm de diâmetro
N- Linfonos regionais
N0 Sem sinais de metástase na histopatologia ou citologia N1 Metástase presente detetada por histopatologia ou citologia
M- Metástase à distância
M0 Sem metástase à distância detetada M1 Presença de metástase à distância
10
III.3.4. Classificação histológica
Em 1974, a OMS publicou a primeira Classificação Internacional Histológica de Tumores em Animais Domésticos, onde se encontravam incluídas as neoplasias mamárias de cão e gato (Misdorp et al., 1999). Desde então, têm sido feitas várias atualizações, em 1999 e 2010. A de 1999 é a mais utilizada em patologia veterinária para classificar tumores mamários e diferencia vários tipos de neoplasias segundo as características morfológicas (Misdorp et al., 1999) (Tabela 3). Em 2010 surgiu uma nova classificação de tumores mamários, que inclui novas entidades e alterações quanto à malignidade de tumores previamente considerados benignos (Anexo I).
Tabela 3 – Classificação histológica de tumores mamários da cadela, segundo as classificações de 1974 e 1999 (adaptado de Goldschmidt et al., 2011).
1974 1999
I. Carcinoma
A. Adenocarcinoma 1. Tubular (a) tipo simples (b) tipo complexo 2. Papilar
(a) tipo simples (b) tipo complexo 3. Papilar quístico
(a) tipo simples (b) tipo complexo
B. Carcinoma sólido (a) tipo simples (b) tipo complexo
C. Carcinoma de células fusiformes (a) tipo simples
(b) tipo complexo D. Carcinoma anaplásico
E. Carcinoma de células escamosas F. Carcinoma mucinoso
1. Tumores malignos
1.1. Carcinoma não-infiltrativo (in situ) 1.2. Carcinoma complexo
1.3. Carcinoma simples
1.3.1. Carcinoma tubulopapilar 1.3.2. Carcinoma sólido 1.3.3. Carcinoma anaplásico 1.4. Tipo especial de carcinomas
1.4.1. Carcinoma de células fusiformes 1.4.2. Carcinoma de células escamosas 1.4.3. Carcinoma mucinoso
1.4.4. Carcinoma rico em lípidos 1.5. Sarcoma
1.5.1. Fibrossarcoma 1.5.2. Osteossarcoma 1.5.3. Outros sarcomas 1.6. Carcinossarcoma
1.7. Carcinoma ou sarcoma em tumor benigno
II. Sarcoma
A. Osteossarcoma B. Fibrosarcoma
C. Osteocondrossarcoma D. Outros sarcomas
III. Carcinossarcoma (tumor misto maligno) IV. Benignos A. Adenoma B. Papiloma 1. Papiloma ductal 2. Papilomatose ductal C. Fibroadenoma 1. Pericanicular 2. Intracanicular
(a) tipo não-celular (b) tipo celular 2. Tumores benignos 2.1. Adenoma 2.1.1. Adenoma simples 2.1.2. Adenoma complexo 2.1.3. Adenoma basaloide 2.2. Fibroadenoma
2.2.1. Fibroadenoma de baixa celularidade 2.2.2. Fibroadenoma de alta celularidade 2.3. Tumor misto benigno
11 3. Tumor misto benigno
4. Hiperplasia fibroadenomatosa D. Tumor benigno de tecidos moles
V. Tumores não classificáveis 3. Tumores não classificáveis VI. Displasias A. Quistos 1. Não papilar 2. Papilar B. Adenose C. Epiteliose D. Ectasia ductal E. Fibroesclerose F. Ginecomastia
G. Outras lesões proliferativas não neoplásicas
1. Hiperplasia lobular não-inflamatória 2. Hiperplasia lobular inflamatória
4. Hiperplasia e displasia mamária 4.1. Hiperplasia ductal 4.2. Hiperplasia lobular 4.2.1. HIperplasia epitelial 4.2.2. Adenose 4.3. Quistos 4.4. Ectasia ductal
4.5. Fibrose focal (fibroesclerose) 4.6. Ginecomastia
III.3.5. Prognóstico
O conhecimento dos diferentes fatores envolvidos no prognóstico de cadelas com tumores mamários, permite ao médico veterinário estabelecer um tratamento adequado e prever eventuais metástases. É aceite que o diagnóstico tardio desta neoplasia está relacionado com um baixo tempo de sobrevivência (TS) e no geral baixa taxa de sobrevivência após mastectomia (Novosad, 2013; Benavente et al., 2016).
A mortalidade devido a neoplasias mamárias concentra-se principalmente no primeiro ano após o diagnóstico. A idade de diagnóstico parece ser um fator de prognóstico, pois quanto mais novo o animal, maior a probabilidade de sobrevivência (provavelmente pelo facto de animais mais novos terem mais frequentemente tumores benignos invés de malignos). A OVH após o diagnóstico de neoplasia mamária não tem influência na taxa de sobrevivência ou mortalidade (Schneider et al., 1969).
Uma das dificuldades ao classificar histologicamente um tumor é decidir quais os que são verdadeiramente malignos. Critérios como o tipo de tumor, pleomorfismo celular e nuclear, índice mitótico, necrose, invasão linfática e peritumoral, e presença de metástases nos linfonodos e à distância, são considerados na classificação do grau de malignidade destas neoplasias. São vários os sistemas utilizados para atribuir um grau histológico de malignidade a tumores mamários, sendo que a maioria é uma modificação do método de Elston e Ellis, usado para tumores mamários em humanos (Elston & Ellis, 1991), e recentemente aplicado em cães (Karayannopoulou, Kaldrymidou, Constantinidis & Dessiris, 2005). Este sistema inclui três critérios: formação tubular, número de mitoses e pleomorfismo nuclear, como indicado na Tabela 4.
12
Tabela 4 – Critérios de classificação do grau histológico de malignidade – método de Elston e Ellis (adaptado de Goldschmidt et al., 2017).
Diferenciação tumoral Pleomorfismo nuclear Mitoses por
campo (x10)
Formação tubular > 75% do tumor: 1 ponto
Núcleo pequeno, regular ou uniforme e
presença ocasional de nucléolo: 1 ponto 0-9: 1 ponto
Formação tubular moderada (10-75%) juntamente com áreas de crescimento tubular sólido: 2 pontos
Variação moderada no tamanho e forma nuclear, núcleo hipercromático e presença de nucléolo (proeminente ou não): 2 pontos
10-19: 2 pontos
Ausência ou mínima constituição tubular (<10%): 3 pontos
Variação marcada no tamanho nuclear, nucléo hipercromático, com um ou mais nucléolos : 3 pontos
>20: 3 pontos
A soma dos pontos associados a cada critério, indica o grau de malignidade da neoplasia, segundo Peña (Clemente et al., 2010) e Misdorp (Goldschmidt et al., 2017) respetivamente: 3 a 5 pontos - Grau I (baixo) ou bem diferenciado; 6 a 7 pontos - Grau II (intermédio) ou moderadamente diferenciado; 8 a 9 pontos - Grau III (alto) ou pouco diferenciado (Clemente et al., 2010; Sorenmo et al., 2013).
Na cadela, como na mulher, a deteção histopatológica de células neoplásicas nos linfonodos, ou vasos sanguíneos está associada a um mau prognóstico (Rasotto et al., 2012; Gundim, Araújo, Blanca, Guimarães & Medeiros, 2016). Também o grau histológico e o estadiamento podem ser fatores de prognóstico. Os sarcomas têm pior prognóstico que carcinomas, e os carcinomas simples têm pior prognóstico que outros carcinomas. Dos carcinomas simples o anaplásico é o mais agressivo, seguido do carcinoma sólido de tipo papilar e por último o carcinoma de tipo tubular ou in situ (Misdorp et al., 1999; Gundim et al., 2016). Carcinomas de grau III (menos diferenciados) têm pior prognóstico que os de grau I e II, assim como carcinomas mamários com padrão de crescimento infiltrativo, tumores de maior dimensão ou ulcerados (Goldschmidt et al., 2017).
A importância de classificar o tumor quanto ao grau histológico e grau de malignidade vem na necessidade de estabelecer um prognóstico e medidas a adotar perante o mesmo.
As duas camadas de células mioepitelias e epiteliais luminais podem ser identificadas através da técnica IHQ, por análise de proteínas que se sabem estar presentes normalmente. A identificação de células mioepiteliais num tumor mamário, é importante, pois tal como na mulher, a presença das mesmas é considerada um fator prognóstico positivo, ao terem um efeito supressor tumoral, por inibição do crescimento, invasão e angiogénese das células tumorais (Goldschmidt et al., 2017).
13
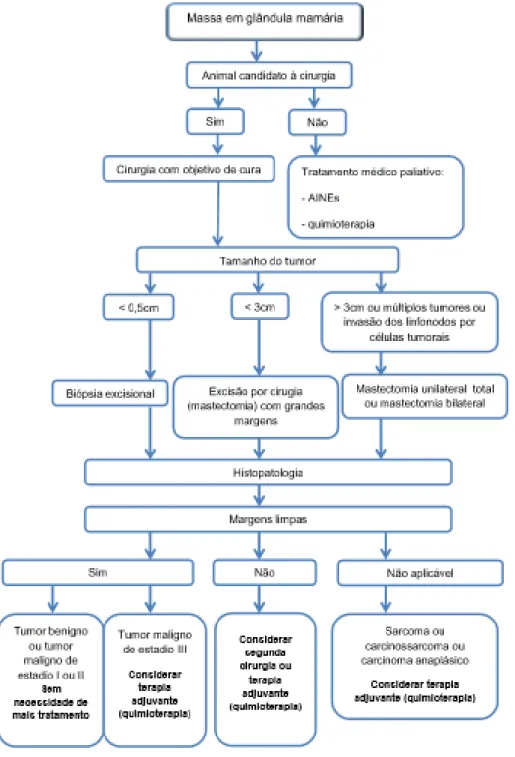
III.3.6. Tratamento
Os principais tratamentos que se podem realizar no tratamento das neoplasias mamárias em cadela são a cirurgia, a quimioterapia e a radioterapia (Dobson & Lascelles, 2011). O tratamento a aplicar depende não só do tumor, mas também dos objetivos da terapia e da decisão e capacidade financeira do responsável pelo animal. A Figura 3, apresenta um diagrama com os passos a tomar na decisão do tratamento de neoplasias mamárias.
Figura 3 - Diagrama de decisão do tratamento na neoplasia mamária canina (adaptado de Dobson & Lascelles, 2011).
14
III.3.6.1. Cirurgia
A cirurgia é sem dúvida o tratamento de eleição para TMC podendo levar à cura sem necessidade de tratamentos adjuvantes. Tem como vantagens ser um procedimento único, sem toxicidade e frequentemente sem problemas adicionais (Dobson & Lascelles, 2011). Os diferentes tipos de cirurgia encontram-se na Tabela 5.
Tabela 5 – Tipos de cirurgias recomendadas em tumores mamários de cadela (adaptado de Dobson & Lascelles, 2011).
Tipo de cirurgia Características do tumor
Lumpectomia ou mastectomia parcial Tumor com diâmetro inferior a 0,5 cm
Mastectomia simples Tumor envolve a zona central ou a maioria da glândula mamária
Mastectomia regional Múltiplos tumores em glândulas adjacentes ou um tumor entre duas glândulas mamárias
Mastectomia radical Vários tumores ao longo de uma mesma cadeia mamária
Mastectomia bilateral Vários tumores ao longo das duas cadeias mamárias A eficácia da cirurgia depende da completa excisão do tumor e obtenção de margens limpas. Após a cirugia todos os tumores devem ser enviados para análise histopatológica para confirmação do diagnóstico, confirmação de margens limpas, e existência ou não de permeação vascular com invasão de células neoplásicas. Estes dados, permitem decidir se a cirurgia terá sido curativa, ou se há necessidade de nova cirurgia e/ou realizar tratamentos adjuvantes.
III.3.6.2. Quimioterapia
Em medicina humana há uma falta de marcadores que predigam a resposta a fármacos quimioterapêuticos, sendo que vários regimes são usados sem clara indicação de que serão os mais adequados. Níveis baixos de recetores de estrogénio, sobreexpressão de HER-2, ou aumento da proliferação celular constituem marcadores de resposta geral à quimioterapia, mas não a fármacos específicos (Goldhirsch et al., 2009).
Segundo um estudo publicado pelo Early Breast Cancer Trialists’ Collaborative Group (EBCTCG, 2005) a maioria das mulheres com diagnóstico de cancro da mama recebe tratamento quimioterapêutico adjuvante, à base de antraciclinas, com combinações como FAC ou FEC, pois é o grupo de fármacos que maior eficácia e benefícios tem demonstrado quando comparado com um terapia clássica não-antraciclina (CMF) (EBCTCG, 2005; Romero, Caldés, Díaz-Rubio & Martín, 2012). As antraciclinas, embora sejam eficientes, não estão livres de efeitos secundários, que podem ser agudos ou crónicos, e potencialmente fatais (Romero et al., 2012).
15
A quimioterapia é o tratamento adjuvante mais frequentemente utilizado também em tumores mamários de cadela. Os fármacos mais comuns são a ciclofosfamida, doxorrubicina, 5-fluoracil e os taxanos (os mesmos usados na mulher) (Figura 4). O fármaco 5-fluorouracil tem como principal aplicação em oncologia humana, o tratamento de tumores sólidos como tumores mamários. Em medicina veterinária, o seu uso em tumores mamários em cadela não tem tido tanta eficácia, e em gatos não deve ser utilizado (Dobson & Gorman, 1993).
Figura 4 - Estrutura química de alguns fármacos quimioterapêuticos: 5- fluoracil e doxorrubicina (adaptado de Nitiss, 2009).
A doxorrubicina é uma antraciclina produzida pelo fungo Streptomyces peucetius var. caesius. O seu efeito citotóxico é devido à sua ação no ADN, interferindo com a síntese do ADN e ARN (ácido ribonucleico) e a transcrição do ADN. A doxorrubicina vai estabilizar o complexo da TOPIIA após a clivagem das cadeias de ADN, e impedir a religação destas cadeias, deste modo impedindo a replicação de células neoplásicas (Jarvinen, Holli, Kuukasjarvi & Isola, 1998; Damiani et al., 2016; Hajduk, 2009a).
Este é provavelmente o agente quimioterapêutico com maior espectro de ação anti-tumoral e considerado como o mais eficaz no tratamento de várias neoplasias. Em medicina veterinária é usado principalmente no tratamento de linfoma, em alguns tumores sólidos como os tumores mamários, e outros como osteossarcoma e hemangiossarcoma. Também em mulheres, este fármaco é um dos mais utilizados no tratamento das neoplasias mamárias (Dobson & Gorman, 1993). A principal desvantagem da doxorrubicina é o seu forte efeito cardiotóxico, tornando-se a causa número um para a cardiotoxicidade no tratamento quimioterapêutico. Além disso pode causar disfunção da medula óssea, com consequente leucemia aguda e mielodisplasia (Romero et al., 2011). Há duas teorias que explicam porque as antraciclinas destroem as células neoplásicas: ou porque têm como alvo as topoisomerases do ADN, ou pela produção de espécies reativas de oxigénio (ROS), através da sua interação com o ferro (Damiani et al., 2016). Dada a gravidade destes efeitos adversos, compreende-se a necessidade de identificar quais os pacientes que beneficiarão da administração destes fármacos quimioterapêuticos.
16
III. 3.6.3. Radioterapia
A radioterapia embora seja considerada eficaz, não mostra vantagens quando utilizada unicamente, em comparação com a cirurgia (Dobson & Lascelles, 2011), pelo que são necessários mais estudos para testar os benefícios da radioterapia em tumores mamários em cadela. Em Portugal esta terapia não se encontra disponível para os animais de companhia, mas é um tratamento utilizado em vários tumores malignos em humanos, incluindo tumores mamários.
III. 3.6.4. Terapia hormonal
A terapia hormonal é largamente utilizada no tratamento adjuvante de tumores mamários da mulher, sendo bem aceite e com resultados positivos no aumento da taxa de sobrevivência. Um dos fármacos mais frequente é o tamoxifeno, que é um modulador seletivo dos recetores de estrogénio, com ação anti-estrogénica, que atua por inibição competitiva da ligação dos estrogénios aos recetores, inibindo a expressão dos genes regulados pelo estrogénio (Platet, Cathiard, Gleizes & Garcia, 2004; Infarmed, 2016).
Na cadela esta terapia anti-estrogénica, tem sido testada in vitro e in vivo em cadelas com neoplasias mamárias. Contudo não têm sido obtidos resultados positivos, e a maioria dos animais teve de parar o tratamento devido aos efeitos secundários (edema vulvar, secreções vaginais, piómetra e sinais de estro), pelo que atualmente esta não é uma terapia recomendada em cadelas (Novosad, 2003; Tavares et al., 2010).
III.4. Oncologia comparada (mulher vs cadela)
Animais com neoplasias espontâneas podem ser considerados bons modelos para o estudo de neoplasias humanas, relativamente à etiologia, epidemiologia, patogénese e genética desta doença (Paolini & Khanna, 2008; Dobson & Lascelles, 2011). Em cães, existem neoplasias em que é possivel prever a metastização como o osteossarcoma, o melanoma oral maligno e o hemangiossarcoma esplénico, por se tratarem de neoplasias de metastização precoce (Dobson & Lascelles, 2011).
Em tumores mamários da mulher, o uso da IHQ com base em marcadores de diferenciação celular em conjunto com recetores de estrogénio (RE), recetores de progesterona (RP) e HER-2, permitem a classificação molecular destes tumores em vários subtipos: luminal A e B (expressam RE e/ou RP, e citoqueratinas luminais (CK7, CK8, CK18, CK19)), tipo basal ou triplo-negativo (tumores negativos para recetores hormonais como RE, RP e HER-2) mas expressam marcadores basais (CK5, CK6, CK14, CK17, SMA, calponina, vimentina e p63), e HER-2 positivos (com sobreexpressão de HER-2). Associados a estes subtipos estão diferentes prognósticos, sendo que o melhor prognóstico corresponde aos tumores luminais e
17
o pior aos tumores de tipo basal ou triplo-negativos (Sorenmo et al., 2011). Ao aplicar estes painéis de marcadores em IHQ a TMC, estes não têm se mostrado igualmente úteis, pois não distinguem a expressão de componentes epiteliais e mioepiteliais, normalmente existentes em TMC (Goldschmidt et al., 2017). No entanto, Gama e Schmitt (2008a), ao tentarem estabelecer os subtipos moleculares de TMC, utilizaram quatro biomarcadores moleculares (RE, HER-2, Ck5, p63 e P-caderinas) e identificaram os mesmos subgrupos: luminal A, luminal B, tipo basal e HER-2 positivos. Quanto ao prognóstico, também os tumores luminal A eram os que apresentavam o melhor prognóstico e as características associadas a menor malignidade. Contudo, há dados contraditórios quanto ao prognóstico de tumores HER-2 positivos na cadela (Gama & Schmitt, 2008a; Sorenmo et al., 2011).
Os TMC apresentam algumas características idênticas aos mesmos na mulher (semelhanças clínicas, patológicas, epidemiológicas...), pelo que a cadela é considerada um excelente modelo para estudos em oncologia comparada, quanto ao tratamento e prognóstico deste tipo de neoplasia (Gama & Schmitt, 2008a; Salas et al., 2015; Gundim et al., 2016).
A diversidade de tumores diagnosticados em cães é tanta como em humanos, e partilham muitas características em termos de histopatologia, comportamento biológico, dependência hormonal, fatores de risco e alterações (Paolini & Khanna, 2008; Sorenmo et al., 2009). Não só as características tumorais são semelhantes, mas também a complexidade do tratamento, e as resistências a fármacos são um obstáculo a enfrentar tanto em oncologia humana, como veterinária.
III.5. Topoisomerases
III.5.1 Biologia da topoisomerase
A topoisomerase é uma enzima ubiquitária, presente em todas as células, que permite a clivagem e o desenrolar das cadeias de ADN, necessárias à sua replicação, recombinação e transcrição do mesmo (Sandri et al., 1996; Burden & Osheroff, 1998). É um dos biomarcadores utilizados em oncologia, especialmente na escolha do tratamento a utilizar em tumores de mama. Um biomarcador pode ser definido como um indicador de um processo biológico, doença ou medida de resposta a um tratamento (Ramos‐Vara & Borst, 2017). A sua ação faz, portanto, a clivagem temporária nas cadeias de ADN (Burden & Osheroff, 1998; Wang, 2002; Damiani et al., 2016), após a qual promovem a passagem da cadeia complementar pelo espaço criado, permitindo o desenrolar da cadeia. Posteriormente, a topoisomerase que formava o complexo de clivagem com o ADN clivado, religa as extremidades livres, libertando-se (Ferreira, 2008) (Figura 5).
18
Figura 5 – Mecanismo de ação das TOPII (adaptado de Nitiss, 2009).
Legenda: A Topoisomerase II interage com as duas cadeias de ADN. A enzima faz uma quebra numa cadeia, designada por segmento G, e permite a passagem de uma segunda cadeia (segmento T), pelo espaço criado.
São conhecidas cinco topoisomerases nas células humanas, divididas em 3 grupos: grupo IA, das topoisomerases IIIα e IIIβ; grupo IB, com a topoisomerase I (nuclear e mitocondrial) e grupo IIA, com as topoisomerases IIα e IIβ. As mais estudadas são sem dúvida as topoisomerases I e IIα, pelo que serão as mais detalhadas nesta revisão (Wang, 2002).
A topoisomerase tipo I (TOPI), cliva apenas uma das cadeias de ADN, enquanto que a topoisomerase tipo II (TOPII) cliva as duas cadeias (Wang, 2002). As TOPII são também essenciais para a condensação e descondensação dos cromossomas e o seu arranjo durante a segregação cromossómica (Romero et al., 2012; Damiani et al., 2016).
III.5.2. Tipos de TOPII
Existem duas isoformas descritas de TOPII: α (170 kDa) e β (180 kDa), que diferem na sua localização celular, propriedades bioquímicas e suscetibilidade aos fármacos (Jarvinen, Kononen, Pelto-Huikko & Isola, 1996; Sandri et al., 1996; Jarvinen et al., 1998). Estas duas isoformas de TOPII são codificadas por genes diferentes localizados nos cromossomas 17q e 3p, respetivamente (Jarvinen et al., 1996; Romero et al., 2012).
19
A expressão da proteína topoisomerase IIα (TOPIIA) (produzida pelo gene TOPIIA) é muito elevada em células com crescimento exponencial (isto é, está dependente do estado de proliferação celular) e em menor grau em células quiescentes, podendo ser por isso considerada um marcador de proliferação celular como o Ki-67 (Figura 6). A expressão da TOPIIA aumenta no fim da fase S e durante a fase G2 e fase M, e diminui após a mitose. A topoisomerase IIβ (TOPIIB) por outro lado, encontra-se largamente expressa, tanto em células que se encontram em divisão como em células quiescentes (Boege, Andersen, Jensen, Zeidler & Kreipe, 1995; Sandri et al., 1996; Hajduk, 2009a; Hong, Sang, Shang, Xue & Liu, 2012; Romero et al., 2012).
Enquanto que o papel da TOPIIA é reconhecido no metabolismo do ADN, em funções como replicação e divisão de cromossomas na divisão celular, o papel da TOPIIB é pouco conhecido e pensa-se que pode não ter um papel importante na proliferação celular, mas estar principalmente envolvida na transcrição de genes (Jarvinen et al., 1998; Romero et al., 2012).
Figura 6 - Modelo da TOPIIA humana (adaptado de McCledon & Osheroff, 2007).
III.5.3. Importância clínica da TOPIIA
A TOPIIA é considerada o alvo terapêutico de vários fármacos utilizados em quimioterapia, tanto em humanos como nos animais, dada a sua função de clivagem e rearranjo das cadeias de ADN (Boege et al., 1995; Sandri et al., 1996; Jarvinen et al., 1998; Di Leo et al., 2001; Arriola et al., 2007; Hajduk, Olszewski & Smietana, 2009b; Romero et al., 2012). O gene que codifica esta enzima, funciona como alvo para variados fármacos quimioterapêuticos e várias mutações neste gene têm sido associadas ao aparecimento de resistência a fármacos (NCBI - National Center for Biotechnology Information).
20
Contudo a importância clínica da TOPIIA ainda não está bem definida. Embora seja reconhecido como benéfico o uso de antraciclinas em tumores mamários com amplificação de TOPIIA (maior sensibilidade a antraciclinas) (Di Leo et al., 2001; Arriola et al., 2007; Schindlbeck et al., 2010; Heestand et al., 2017), alguns estudos afirmam que a TOPIIA não tem valor preditivo na resposta ao tratamento com antraciclinas, limitando a sua utilização como fator de prognóstico (Jarvinen et al., 1998).
Vários autores associam a localização dos genes HER-2 e TOPIIA no mesmo cromossoma 17 (região q12-q21) (na mulher) à sua co-amplificação (Jarvinen, Tanner, Barlund, Borg & Isola, 1999; Jarvinen et al., 2000; Arriola et al., 2007). Não é claro como o HER-2 poderia influenciar a sensibilidade às antraciclinas, sendo que não é o alvo destes fármacos. Contudo, essa suposta sensibilidade seria devido à proximidade do gene TOPIIA no cromossoma 17 (na mulher) (Oakman, Moretti, Galardi, Santarpia & Di Leo, 2009). Foi demonstrado que tumores com amplificação do gene HER-2 têm igualmente amplificação do gene TOPIIA sugerindo a sobreexpressão de TOPIIA como marcador de sensibilidade às antraciclinas em conjunto com o HER-2 (Jarvinen et al., 1996), ou seja, o valor preditivo do HER-2 na resposta ao tratamento com antraciclinas, dever-se-ia sobretudo à amplificação do gene da TOPIIA, o que acontece em cerca de 40% dos casos (Jarvinen et al., 1999; Fountzilas et al., 2012). Mais ainda, que células tumorais com amplificação dos genes HER-2 e TOPIIA são sensíveis às antraciclinas, enquanto que a amplificação de HER-2 e deleção de TOPIIA mostra resistência às antraciclinas (Jarvinen et al., 2000).
No geral, os tumores mamários com sobreexpressão de TOPIIA têm sido correlacionados com elevada proliferação celular, pobre diferenciação histológica, pior prognóstico, maior agressividade, além de ausência de recetores hormonais (Jarvinen et al., 1996; Sandri et al., 1996; Fritz et al., 2005; Biesaga, Niemiec, Ziobro, Wysocka & Kruczak, 2011; Romero et al., 2011). Foi também demonstrado que a expressão da TOPIIA varia muito consoante o subtipo molecular do tumor mamário, estando mais sobreexpressa em tumores mais proliferativos como o tipo basal, luminal B e HER-2 positivo (Romero et al., 2011).
Daí a hipótese de testar a TOPIIA como forma de prever a resposta do paciente ao tratamento de quimioterapia com antraciclinas, pois a baixa expressão da TOPIIA pode determinar resistência à terapêutica. Caso seja provado não existir associação entre a expressão de TOPIIA e resposta à terapêutica com antraciclinas, isto pode levar ao desinteresse pelo estudo desta proteína como marcador em oncologia.
Embora na mulher o gene TOPIIA esteja localizado no cromossoma 17, assim como como o HER-2 (Figura 7), o mesmo não acontece na cadela. Nesta espécie o gene HER-2 encontra-se no cromossoma 1 (Escobar, Becker, Bullerdiek & Nolte, 2001; Ferreira, Bertagnolli, Gobbi &
21
Cassali, 2014) enquanto que o gene TOPIIA está presente no cromossoma 9 (NCBI Gene). Por isso, não se sabe se a amplificação da TOPIIA está relacionada com a amplificação do HER-2, ou se a sua expressão está relacionada com outro mecanismo biológico ou alteração genómica (Romero et al., 2012).
Figura 7 - Cromossoma 17 (Humano): Região 17q12 a 17q21, onde se encontram respetivamente os genes do HER-2 e TOPIIA (adaptado de Romero et al, 2012).
III.5.4. Determinação da TOPIIA
A expressão da TOPIIA pode ser determinada a nível de ARN ou a nível proteico por diversas técnicas. Tanto a avaliação da expressão do gene por microarrays e PCR são métodos fiáveis. A IHQ (método utilizado neste estudo) avalia a expressão da proteína, e é considerada uma técnica mais subjetiva, além de que ainda não foram estabelecidos parâmetros de classificação que permitam concluir se o paciente beneficiará ou não com o tratamento de antraciclinas. Outras técnicas a ter em consideração são as de hibridização in situ fluorescente (FISH - fluorescent in situ hibridization) e cromogénica (CISH - chromogenic in situ hibridization) que permitem a avalição do número de genes presentes.
A determinação da topoisomerase em tecidos tumorais pode ser feita em material incluído em parafina, tanto por IHQ como FISH, o que permite uma análise retrospetiva dos tumores (Hajduk, 2009a).
III.6. Imunohistoquímica III.6.1. Técnica IHQ
A IHQ é uma técnica laboratorial que ao combinar as áreas de imunologia, histologia e química permite o reconhecimento de antigénios (proteínas) em tecidos animais, ao localizar